La fórmula molecular es la representación más simple
de una sustancia química, que muestra el número
exacto de átomos de cada elemento presente en una molécula. En
la formulación química, utilizamos un conjunto de técnicas teóricas
y heurísticas para inferir la fórmula molecular más probable de una
sustancia desconocida. En química inorgánica, este proceso generalmente
se basa en la correcta disposición de cargas opuestas, ya que los
compuestos inorgánicos se forman cuando los iones positivos y negativos
se combinan para alcanzar un equilibrio eléctrico. Esta disposición
asegura que las moléculas sean estables y que sus propiedades sigan las reglas
de la electroquímica.
Regla de conservación de la carga
Al formular compuestos inorgánicos, asumiremos que la
entidad formada, ya sea de naturaleza iónica o covalente polar,
tiene carga neta neutra o igual a cero. Esto significa que el producto
ponderado entre la cantidad de cargas positivas y cargas
negativas debe ser el mismo, garantizando la neutralidad eléctrica
del compuesto. Esta regla básica es esencial para construir correctamente las fórmulas
químicas de sustancias inorgánicas y refleja el principio fundamental de
conservación de la carga en los sistemas químicos.
Lo que haremos básicamente es simplificar el teorema de
conservación de la carga (Enlace)
con lo que obtenemos la siguiente demostración (enlace).
Figura 1. Teorema de la Regla de Aspa. Cabe señalar que los números de
carga se consideran sin su marca cuasivectorial, lo que implica que,
en este contexto, sus direcciones no son relevantes y solo trabajamos
con sus magnitudes escalares. Demostración.
Heurístico de recíprocos
Tal como ocurre con otros teoremas, el ratio de
recíprocos es simplemente un formalismo que respalda una regla
enseñada a través de un heurístico más sencillo: el subíndice de un
ion es igual al valor absoluto de la carga de su ion
recíproco, simplificado a la proporción más pequeña entre ambos.
Figura
2. Representación
esquemática de la regla de aspa.
Figura
3. Aplicación de
la regla de aspa para el ejercicio: plantee la fórmula molecular más probable
para una sustancia formada por el ion calcio (2+) y el ion óxido (2-).
Tenga en cuenta que la simplificación de los subíndices
solo se realiza cuando existe un divisor común entre ellos. En caso de
no haberlo, la fórmula se deja intacta inmediatamente después de
aplicar la regla de aspa. Además, los valores de ±1 en las cargas
se ignoran al asignar los subíndices, debido a la regla de
formulación molecular que establece que los subíndices iguales a 1 son
implícitos y no se escriben de manera explícita.
Figura
4. Aplicación de
la regla de aspa para el ejercicio: plantee la fórmula molecular más probable
para una sustancia formada por el ion hierro (3+) y el ion óxido (2-).
Referencias
Brown, T.
L., LeMay, H. E. J., Bursten, B. E., Murphy, C. J., Woodward, P., &
Stoltzfus, M. W. (2015). Chemistry the Central Science.
Brown, T.
L., LeMay, H. E. J., Bursten, B. E., Murphy, C. J., Woodward, P., Stoltzfus, M.
W., & Lufaso, M. W. (2022). Chemistry, the central science (15th ed.).
Pearson.
Chang, R.
(2010). Chemistry (10th ed.). McGraw-Hill New York.
Chang, R.,
& Overby, J. (2021). Chemistry (14th ed.). McGraw-Hill.
Matamala, M., & González Tejerina, P. (1975). Química
(1a ed.). Ediciones Cultural.
Seager, S.
L., Slabaugh, M. M., & Hansen, M. M. (2022). Chemistry for Today (10th
ed.). Cengage Learning.
Zumdahl, S. S., Zumdahl, S. A., DeCoste, D. J., & Adams, G. (2018). Chemistry (10th ed.). Cengage Learning.


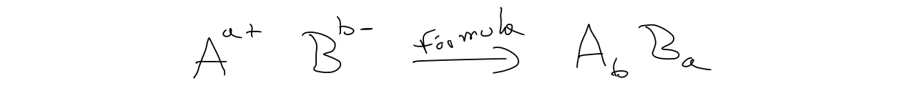


No hay comentarios:
Publicar un comentario