Índice
Portada
1. Introducción
|| Regresar al Índice ||
La respiración
celular aeróbica consta de dos procesos, el ciclo de Krebs y la cadena de
transporte de electrones fotosintética, que funcionan de manera análoga, pero
con resultados opuestos a la cadena de transporte de electrones fotosintética y
al ciclo de Calvin. Tradicionalmente esta ruta metabólica se estudia como
extensión de la glucólisis, sin embargo para la segunda versión de la presente
unidad he decidido desligarme un poco de la tradición, pues es posible
conectarlo con otro tema relevante para nosotros, la grasa y la obesidad, y es
que en el ciclo de Krebs y la cadena de transporte de electrones respiratoria
se encuentra el secreto de hacer ejercicio de manera racional con el objetivo
de quemar grasa de manera efectiva.
El ciclo de ácido
cítrico (CAC) - también conocido como el ciclo de ácido tricarboxílico (CAT) o
el ciclo de Krebs (H. A. Krebs, 1970;
THAUER, 1988; Weitzman, n.d.) es una serie de reacciones químicas
utilizadas por todos los organismos aeróbicos para liberar la energía
almacenada a través de la oxidación de acetil-CoA derivados de carbohidratos,
grasas y proteínas en dióxido de carbono y energía química en forma de trifosfato
de adenosina (ATP) y otros portadores de energía. Además, el ciclo proporciona
precursores de ciertos aminoácidos, así como el agente reductor NADH, que se
utilizan en numerosas otras reacciones bioquímicas. Su importancia central para
muchas vías bioquímicas sugiere que fue uno de los primeros componentes
establecidos del metabolismo celular y puede haber originado abióticamente (Cavalcanti et al.,
2014; Lane, 2010; Wagner, 2014).
La cadena de
transporte de electrones respiratorio por su parte es semejante a la
fotosíntética, pero la principal diferencia es que el movimiento de electrones
de alta energía no se logra con la luz, sino con electrones que ya vienen en el
nivel de energía alto, transferidos a esta por portadores de alta energía como
el NADH:H+ y al FAD. La suma de los procesos respiratorios es la
síntesis de altas concentraciones de ATP necesarios para impulsar otros
procesos celulares clave.
1.1 Sir Hans Adolf Krebs
(25 de agosto de 1900 - 22 de noviembre de
1981) Fue un biólogo, médico y bioquímico británico nacido en Alemania. Fue un
científico pionero en el estudio de la respiración
celular, un proceso bioquímico en las células vivas que extrae energía de
los alimentos y el oxígeno y la pone a disposición para impulsar los procesos
de la vida. Es más conocido por sus descubrimientos de dos secuencias
importantes de reacciones químicas que tienen lugar en las células de los seres
humanos y muchos otros organismos, a saber, el ciclo del ácido cítrico y el ciclo de la urea. El primero, a menudo epónimo conocido como el
"ciclo de Krebs", es la secuencia clave de reacciones metabólicas que
proporciona energía en las células de los seres humanos y otros organismos que
respiran oxígeno; y su descubrimiento le valió a Krebs un Premio Nobel de
Fisiología o Medicina en 1953. Con Hans Kornberg, también descubrió el ciclo
del glioxilato, que es una ligera variación del ciclo del ácido cítrico que se
encuentra en plantas, bacterias, protistas y hongos.
Krebs murió en 1981 en Oxford, donde había
pasado 13 años de su carrera desde 1954 hasta su jubilación en 1967 en la
Universidad de Oxford.
Fuentes: (Stubbs & Gibbons, 2000)
2. Generalidades
2.1 El problema del piruvato
Hay que pensar en el origen y necesidad de
la respiración celular aeróbica, no como una ganancia evolutiva para obtener
energía, sino como un mecanismo que permitió evitar el problema del piruvato,
es decir, un proceso que al igual que las fermentaciones busca en esencia
proteger a la célula, aunque claro, una vez que se estableció, le permitió a
las bacterias obtener más energía de la célula sin aumentar la acidez del
medio.
Figura 2.1. Recuerde que,
debido al equilibrio químico, los nombres piruvato y ácido pirúvico en estas
ecuaciones se tratan como sinónimos.
Todas las rutas metabólicas sufren del
problema de intermediarios metabólicos, que experimentan reacciones reversibles
o que cuyos sustratos están limitados en cantidad. En cuanto a la glucólisis
por ejemplo, la acumulación del ácido pirúvico puede conllevar fácilmente a la
parálisis de la ruta metabólica de la glucosa (Borichewski, 1967; Marı́, Bai,
& Cederbaum, 2002; Matin, 1978), lo cual priva a la célula de su fuente energética. De hecho, este
evento se da en el envenenamiento por arsénico, el cual causa una acumulación
de piruvato por inhibición de la enzima que lo integra a la respiración
aeróbica en los seres humanos (Ghosh & Sil, 2014; Jomova et
al., 2011; Petrick, Jagadish, Mash, & Aposhian, 2001; Tchounwou, Centeno,
& Patlolla, 2004).
Dado que el piruvato es toxico si se
acumula, la célula debe “hacerse cargo” de él, modificándolo a una forma
química menos toxica y expulsándolo de la célula como desecho “excreción”.
Adicionalmente existe otro dilema celular que debe ser afrontado por la célula.
Si recordamos la primera reacción de obtención de energía de la glucólisis, en
esta se reduce una molécula de NAD para producir una de NADH:H+,
esta molécula de NADH:H+ posee energía y puede ser empleada para
otros fines metabólicos. Pero si nos encontramos en un evento en el que se
acumula ácido pirúvico, también se da un evento de acumulación de NADH:H+
con un consumo de NAD, el problema es que las cantidades de NAD en la célula
son limitadas, por lo que, si no se hace nada con él, sus cantidades se agotan
y por lo tanto este paso de la glucólisis se interrumpe cortando el chorro de
energía por fosforilación de sustrato “un trancón en la “ruta” metabólica”.
Durante la respiración celular aeróbica el
problema de la secuestración del NADH se resuelve por medio de la cadena de
transporte de electrones, desligándolo del asunto del piruvato. Recordemos que
en las fermentaciones generalmente se sacrifica NADH:H+ para
convertir el piruvato en algo menos tóxico y se expulsa. Durante la respiración
celular lo que va a suceder es que el piruvato se oxida a dióxido de carbono y
agua, y la energía se transfiere a NAD y FAD, para producir NADH:H+ y
FADH, los cuales posteriormente regresan a sus formas de baja energía en la
cadena de transporte de electrones, evitando la secuestración del NAD+.
La principal ventaja es que la oxidación del piruvato y la transferencia de
toda la energía del NADH:H+ a la cadena de transporte de electrones
lo que conlleva es a un aprovechamiento neto de la energía, ya no se desaprovecha
la energía en una excreción inútil como en la fermentación, sino que se
transfiere la energía en producir ATP.
2.2 El problema de la
oxidación del piruvato
Oxidar el piruvato a su vez trae otra
cascada de consecuencias de naturaleza química. La oxidación de un compuesto
orgánico requiere un aceptor de electrones, tal como:
Todos los cuales son explotados como
oxidantes en diferentes organismos, sin embargo, tradicionalmente se distinguen
dos grupos, los organismos que respiran anaeróbicamente y los que respiran
aeróbicamente. En los organismos aerobios, los electrones producidos por el
metabolismo oxidativo son finalmente transferidos a O2 cuando han
perdido su energía, lo cual induce la síntesis de agua, siendo la reacción
opuesta a la fotólisis del agua en la fotosíntesis. La oxidación de los
combustibles metabólicos se lleva a cabo por el ciclo del ácido cítrico, una
secuencia de reacciones que surgieron en algún momento después de que los
niveles de oxígeno atmosférico se hicieron significativos, hace aproximadamente
entre 3,0-2,4 mil millones de años. A medida que los átomos de carbono
reducidos de los combustibles metabólicos se oxidan a CO2, los
electrones se transfieren a portadores de electrones que son posteriormente
reoxidados por O2 para formar agua. En esta unidad, examinamos las
reacciones de oxidación del propio ciclo del ácido cítrico y el destino de los
electrones, analizando cómo su energía se utiliza para impulsar la síntesis de
ATP.
2.3 Distinguiendo intercambio
de gases “breath” de la respiración “respiration”
Antes que nada, hablando de términos, esta
es la verdadera RESPIRACIÓN, como proceso de obtención de energía. En los
animales, por ejemplo, los sistemas respiratorio y digestivo sirven para que se
de este proceso, el sistema respiratorio “sistema de intercambio de gases”
proporciona el oxígeno que será empleado en la cadena de transporte de
electrones” mientras que el digestivo y circulatorio proporcionan los
materiales, grasas y azucares para inducir las reacciones de transferencia de
energía. Las reacciones más importantes ocurren sin duda gracias a los
mecanismos de transporte a través de membrana como el transporte activo, el
transporte pasivo facilitado y el trasporte pasivo para los gases metabólicos
oxígeno y dióxido de carbono.
La respiración celular aeróbica no es un
proceso aislado, sino que se encuentra unido a muchas rutas accesorias como la
famosa glucólisis, la oxidación de la grasa y los metabolismos de los
aminoácidos. Por tradición el ciclo de Krebs y la cadena de transporte se
estudian como continuaciones de la glucólisis, pero eso no es necesariamente
cierto. Sin embargo, estas desviaciones de la tradición las discutiremos
posteriormente, así que nos concentraremos en la ruta clásica glucólisis →
ciclo de Krebs → cadena de transporte de electrones respiratoria.
Como se vio anteriormente, la glucólisis
termina con la producción del piruvato, una molécula de alta energía, pero que
al mismo tiempo es toxica para la célula. Las rutas metabólicas fermentativas
sacrifican energía en forma de los electrones y el protón altamente energéticos
que había sodio producidos en el primer paso de la glucólisis para producir
alcohol metílico y/o el ácido láctico. La respiración celular aeróbica es la
otra solución posible para el problema del ion piruvato, sin embargo, esta
solución posee una ventaja extra, no solo transforma al piruvato en dióxido de
carbono que puede ser difundido fácilmente a través de la membrana, sino que al
mismo tiempo produce una enorme cantidad de moléculas de NADH mediante una
serie de reacciones denominadas ciclo de Krebs.
En las bacterias aeróbicas la glucólisis
ocurre en el citoplasma, y al mismo tiempo se integra al ciclo de Krebs, pero
en la relación endosimbiótica, la célula eucariota realiza la glucólisis,
mientras que la mitocondria realiza el ciclo de Krebs. De esta manera tenemos
ya un problema, el ciclo de Krebs ocurre en la matriz mitocondrial, mientras
que el ion piruvato es formado en el citoplasma celular, por lo cual se
requiere de un mecanismo de transporte que envíe al piruvato desde el
citoplasma al interior de la membrana. Inicialmente esta función es llevada a
cabo por una coenzima compleja derivada del ácido pantoténico denominada
Coenzima A. La fusión de la Coenzima A con el piruvato forma una molécula
llamada acetil-Coenzima A la cual es el combustible precursor de las reacciones
del ciclo de Krebs.
2.4 Importancia evolutiva
La habilidad de emplear oxígeno para
lograr la máxima oxidación de una molécula orgánica puede verse en términos
químicos como algo bastante obvio. De cualquier molécula con base en carbono el
dióxido de carbono es la que posee la máxima oxidación. Del mismo modo la
oxidación completa de los compuestos orgánicos involucra la degradación de la
estructura compleja a moléculas de dióxido de carbono con una importante
liberación de energía. Aun así, desde la perspectiva química lograr la máxima
oxidación no es algo universalmente distribuido a diferencia de lo que sucede
con la glucólisis. Como vimos en temas pasados, la glucólisis deja como
resultado dos moléculas de ácido pirúvico la cual en muchas ocasiones no es
oxidada en su totalidad, si no que para las rutas fermentativas es de hecho
reducida y expulsada de la célula, en otras palabras no todos los seres vivos
son capaces de lograr la máxima oxidación de las moléculas en base de carbono.
Otro ejemplo son aquellas bacterias productoras
de metano, el metano es una molécula orgánica reducida susceptible de
oxidaciones subsecuentes, pero estas bacterias parecen incapaces de lograrlo.
Las rutas respiratorias de máxima oxidación son raras y pueden deberse a una
razón que se encuentra registrada en el registro paleoquimico de la Tierra y es
la disponibilidad del oxígeno molecular. Cuando la Tierra se formó hace unos
4,5 mil millones de años, los volcanes calientes liberaron enormes cantidades
de oxigeno molecular. Este oxigeno molecular rápidamente comenzó a oxidar todo
lo que se encontraba a su paso, generando las grandes reservas de solidos
minerales de la corteza terrestre que son óxidos. Los óxidos del hierro, los
óxidos de los metales alcalinos, los óxidos de los metales de transición, pero
especialmente el óxido del hidrogeno al cual llamamos agua (Blankenship &
Hartman, 1998; Buick, 2008; De Duve & Pizano, 1995; Holland, 2006; Kump,
2008; Kump & Barley, 2007; Planavsky et al., 2014; Tarbuck, Lutgents, &
Tasa, 2014).
De esta manera al llegar la etapa de 3.8
mil millones de años el oxígeno molecular libre en la atmósfera se había
desvanecido, o en otras palabras, había sido secuestrado por todas las demás
especies químicas de la superficie del planeta formando líquidos o sólidos. Sin
oxígeno, la vida tuvo que desarrollar rutas metabólicas que no lo empleaban, y
es bueno ya que el oxígeno en sí mismo es más una amenaza para el material
genético que otra cosa. La primera fotosíntesis, que aún sigue siendo realizada
por ciertos tipos de bacterias no produce oxígeno, simplemente libera
electrones de ciertos minerales con el apoyo del Sol y a esto lo denominamos fotosistema
I. Del mismo modo el poder emplear oxigeno molecular en una ruta metabólica
tuvo que esperar a que este estuviera disponible en grandes cantidades y esto
solo sucedió hasta que evolucionó el fotosistema II en las cianobacterias.
Cuando el oxígeno molecular gaseoso se hizo común en la atmósfera muchas
bacterias empezaron a morir, otras prosperaron en ambientes donde el oxígeno
molecular nunca pudo llegar, otras desarrollaron esporas para aislarse cuando
este las alcanzaba, otras desarrollaron enzimas para neutralizarlo y
transformarlo en especies químicas menos toxicas (Blankenship &
Hartman, 1998; Buick, 2008; De Duve & Pizano, 1995; Holland, 2006; Kump,
2008; Kump & Barley, 2007; Planavsky et al., 2014; Tarbuck et al., 2014).
Sin embargo, un grupo de bacterias
desarrolló un grupo de enzimas insertadas en la membrana semejantes a aquellas
que permitían las reacciones lumínicas de la fotosíntesis que permitía dos
cosas de manera simultánea, transformar el oxígeno gaseoso toxico en una
especie inocua “agua” y al mismo tiempo usar esta reacción para extraer la
máxima energía del ácido pirúvico, de este modo estas dos reacciones se
conectaron mediante el ciclo de Krebs. Con el nacimiento de la respiración
oxidante, los seres vivos fueron capaces de extraer la máxima energía de los
nutrientes y de equilibrar el ciclo biogeoquímico del carbono. Sin embargo la
respiración oxidante es un desarrollo de procariotes, ningún eucariote puede
por sí mismo realizar esta ruta metabólica, pues estas células se encuentran
limitadas a rutas fermentativas (Blankenship &
Hartman, 1998; Buick, 2008; De Duve & Pizano, 1995; Holland, 2006; Kump,
2008; Kump & Barley, 2007; Planavsky et al., 2014; Tarbuck et al., 2014).
La única razón por la cual la mayoría de
los eucariotes puede realizar la respiración celular aeróbica es por la
presencia del organelo mitocondria, sin embargo, este organelo se diferencia
mucho del sistema de membranas internas. Más aun y como veremos en el siguiente
tema, las mitocondrias se asemejan más a las bacterias que a las membranas como
el aparato de Golgi o las vesículas digestivas de una célula eucariota (Blankenship &
Hartman, 1998; Buick, 2008; De Duve & Pizano, 1995; Holland, 2006; Kump,
2008; Kump & Barley, 2007; Planavsky et al., 2014; Tarbuck et al., 2014).
3. La betaoxidación de la grasa
|| Regresar al Índice ||
Antes de iniciar el ciclo de Krebs vale la
pena mencionar otro ciclo que va a aportar muchas mayores cantidades del
ingrediente base del ciclo de Krebs, nos referimos al ciclo de betaoxidación de
la grasa. De hecho, en el músculo lo normal es que el piruvato generado por
glucólisis siga la fermentación láctica y luegi se regenera glucosa por medio
de la gluconeogénesis. El ciclo de Krebs para lo que nos interesa entonces
dependerá casi de manera exclusiva del ciclo de la betaoxidación de la grasa.
Figura 3.1 (YouTube) β-OXIDACIÓN
3.1 Ingredientes para el ciclo
de los ácidos grasos, de cadena larga a cadena corta
La glucólisis no es la única ruta metabólica que produce acetil-Coenzima A, existen otras, y en términos humanos una de las más importantes “no solo educativa, sino estéticamente” es la que involucra a los ácidos grasos, o simplemente grasas. De cierta forma este es el mecanismo en que el cuerpo “literalmente” quema las grasas para producir energía celular, es interesante como muchas veces es pasado por alto en los textos de biología básica. En cualquier caso, se debe recordar que un ácido graso no es más que un ácido carboxílico relativamente largo, por lo cual su característica primordial es tener una punta alifática muy grande que lo hace insoluble en agua y un grupo COOH en un extremo que es bastante reactivo. Los ácidos grasos pueden ser oxidados por diversas rutas, que pueden ser la alfa, la beta y la omega.
Figura 3.2. Ruta resumida
de la betaoxidación, la cual termina en la acetilcoenzima A.
La alfa oxidación se caracteriza por
oxidar los ácidos grasos ramificados, los cuales son muy poco comunes dado que
los triglicéridos, o portadores de grasa más comunes en la sangre portan
siempre ácidos grasos no ramificados. Se puede dar tanto en el retículo
endoplasmático como en la mitocondria. La omega oxidación es otra ruta de oxidación
minoritaria de ácidos grasos es la ω-oxidación, que tiene lugar en el retículo
endoplasmático de muchos tejidos; se produce una hidroxilación sobre el carbono
metílico (–CH3) en el extremo de la molécula opuesto al grupo carboxilo
(–COOH).
Utiliza el tipo de reacción de la oxidasa
de función mixta y requiere citocromo P450, 02 y NADPH. Luego, el ácido graso
hidroxilado se oxida en el citosol a un ácido dicarboxílico (un grupo carboxilo
en cada extremo de la molécula); este proceso se da principalmente en ácidos
grasos de mediana longitud. Para los ácidos grasos de cadena más larga se
emplea la ruta de los peroxisomas, los peroxisomas, que contienen enzimas
similares, aunque no idénticas, de los de la β-oxidación mitocondrial. Así, por
ejemplo, en la deshidrogenación inicial, se forma H2O2 que es eliminado por la
catalasa. Los peroxisomas tienen especificad para ácidos grasos de cadena más
larga y a menudo no degradan totalmente la molécula, por lo que una posible
función de este proceso sea el acortamiento de ácidos grasos de cadena larga
hasta un punto en que la mitocondria pueda completar su β-oxidación.
3.2 Beta oxidación
La oxidación beta de los ácidos grasos se
denomina de este modo porque corta la cadena en el enlace beta, es decir entre
el segundo y tercer carbono de un ácido carboxílico (contando desde el carbono
del grupo carboxilo”, el proceso libera en cada vuelta del ciclo 1 molécula de
acetilcoenzima A. Para llevar a cabo el resto de las reacciones de la
respiración aeróbica en caso de que no exista suficiente azúcar disponible en
el citoplasma. El ciclo consta de cuatro reacciones cíclicas y una reacción de
ingreso. La reacción de ingreso se caracteriza por la unión de la
acetilcoenzima A al extremo carboxilo del ácido graso “lo cual es bastante
obvio dado que es el extremo carboxilo la zona más reactiva de cualquier ácido
carboxílico”. La primera reacción es una oxidación por FAD para formar FADH2
el cual puede ser empleado posteriormente para impulsar otras reacciones o
preferentemente para impulsar la cadena de transporte de electrones.
La segunda reacción es una hidratación
reversible en la que se adiciona un grupo hidroxilo "o retirando un doble
enlace en caso de que el ácido carboxílico sea insaturado" en el carbono 3
de la cadena del ácido carboxílico. Esta reacción es destacable, sin agua el
equilibrio de la reacción tendería al alargamiento de la molécula de grasa con
la producción de agua. Lo que en otras palabras indica que ¡sin agua no puede
oxidarse la grasa! La tercera reacción nuevamente es una oxidación por una
coenzima, la NAD para formar NADH la cual puede emplearse para impulsar la
cadena de transporte de electrones.
La cuarta reacción se denomina tiólisis,
lo cual traduce a rompimiento por azufre, en esta reacción un segundo
acetilcoenzima A se adiciona al tercer carbono que ahora se convierte en el
primer carbono de un nuevo ácido carboxílico con dos carbonos de menos. Dado
que ya se tiene una unión a la acetilcoenzima A la oxidación puede proseguir
hasta formar completamente acetilcoenzima A en caso de que hubiéramos tenido un
ácido carboxílico con número de carbonos par, o a la formación de un ácido
carboxílico de tres carbonos en caso de que se tuviera un ácido carboxílico de
cadena impar.
4. Introducción al ciclo de Krebs
4.1 Historia
Hans Adolf Krebs nació en Alemania en 1900 y murió en Inglaterra en 1981. Aunque su formación fue en Alemania y por lo tanto su juventud debe haber sido afectada por los horrores de la primera guerra mundial y de la crisis de la postguerra sus principales actividades académicas se realizaron en Inglaterra desde 1931. Obtuvo su premio Nobel en 1953 junto a Fritz Lipmann. La ciencia de los libros de texto, y también mucha de la que he escrito en el presente blog es marcadamente positivista, una historia de historias imparables, éxitos tras éxitos, como si cada uno de los hombres y mujeres involucrados en el mundo de las ciencias fuera un genio iluminado que o que nunca se equivoca o que nunca tiene problemas. Sin embargo la historia de la formulación del ciclo de Krebs por parte de del bioquímico inglés Hand Krebs en 1937 se caracteriza por lo opuesto (Andréasson & Jones, 1996; Campanario, 2002; Gest, 2002; Holmes, 1984; Leigh, 2009).
Figura 4.1. Hans Adolf
Krebs (Hildesheim, Alemania, 25 de agosto de 1900 - Oxford, Inglaterra, 22 de
noviembre de 1981) fue un bioquímico alemán, ganador del Premio Nobel de
Fisiología o Medicina en el año 1953.
Varios de los componentes y reacciones del ciclo del ácido cítrico se establecieron en la década de 1930 por la investigación de Albert Szent-Györgyi, que recibió el Premio Nobel de Fisiología o Medicina en 1937 específicamente por sus descubrimientos relacionados con el ácido fumárico, un componente clave de la ciclo (Akram, 2014; Kaminer, 2014). Por su parte Krebs al ser el hijo de un médico judío, fue forzado en 1933 a abandonar la Alemania Nazi para Inglaterra, donde continuó sus investigaciones en la Universidad de Cambridge (1933-35). En la Universidad de Sheffield, Yorkshire (1935-54), Krebs midió las cantidades de ciertos ácidos de cuatro carbonos y seis carbonos generados en el hígado y el músculo de la paloma, cuando los azúcares se oxidan completamente para producir dióxido de carbono, agua y energía.
Figura 4.2. Fritz Albert Lipmann (12 de junio 1899 – 24 de julio 1986) fue un bioquímico germano-estadounidense. Co-descubridor en 1945 de la coenzima A. Por esto, junto con Hans Adolf Krebs (que describió el ciclo de los ácidos tricarboxílicos, o ciclo de Krebs), fue galardonado con el Premio Nobel de Fisiología o Medicina en 1953.
Figura 4.3. Albert Szent-Györgyi de Nagyrápolt (Budapest, 16 de septiembre de 1893 – Woods Hole, Massachusetts, 22 de octubre de 1986) fue un fisiólogo húngaro, galardonado con el Premio Nobel de Fisiología o Medicina en 1937.
En 1937, Krebs demostró la existencia de
un ciclo de reacciones químicas que combina el producto final de la
descomposición del azúcar, demostrando posteriormente como una forma
"activada" del ácido acético de dos carbonos, con el ácido
oxaloacético de cuatro carbonos podían formar ácido cítrico. El ciclo regenera
el ácido oxaloacético a través de una serie de compuestos intermedios liberando
dióxido de carbono y electrones que se utilizan inmediatamente para formar
enlaces de fosfato de alta energía en forma de trifosfato de adenosina (ATP, el
reservorio químico-energético de la célula). El descubrimiento del ciclo del
ácido tricarboxílico, que es central para casi todas las reacciones metabólicas
y la fuente de dos tercios de la energía derivada de los alimentos en
organismos superiores, fue de vital importancia para una comprensión básica del
metabolismo celular y la biología molecular (Andréasson & Jones, 1996;
Campanario, 2002; Gest, 2002; Holmes, 1984; Leigh, 2009).
Cuando Krebs encontró suficiente evidencia
experimental para justificar la idea de una ruta metabólica cíclica envió sus
resultados en un artículo a la revista Nature. El artículo fue devuelto unos
cuantos días después con una carta de rechazo. Sin embargo, en lugar de pegarse
un tiro en la cabeza, Krebs decidió publicar en otra revista. Para nadie ha
sido fácil hacer ciencia, y siempre han encontrado muchos problemas, pero, al
final de cuentas lo que importan son los resultados, al final Krebs recibiría
el premio Nobel por este importante descubrimiento (Andréasson & Jones, 1996;
Campanario, 2002; Gest, 2002; Holmes, 1984; Leigh, 2009).
4.2 Definiciones generales
Primero discutiremos exactamente qué es el Ciclo de Krebs y
luego su importancia en el cuerpo. El proceso tiene lugar dentro de las
mitocondrias de las células del cuerpo. El ciclo comienza con la ruta de diez
pasos de la glucólisis, durante la cual la glucosa se convierte en dos
moléculas de piruvato: no se requiere oxígeno para este paso. El piruvato puede entonces someterse a la
respiración aeróbica o anaeróbica para generar energía. El Ciclo de Krebs es la
ruta aeróbica, y significativamente más eficiente que la fermentación
alternativa. Las dos moléculas de piruvato se oxidan luego a dos de Acetil-CoA
con la liberación de dióxido de carbono. Los dos grupos acetilo de Acetil-CoA
se donan a Oxaloacetato en presencia de agua para formar citrato. El citrato
luego experimenta una serie de reacciones químicas para llegar de nuevo a
oxaloacetato y el ciclo comienza de nuevo, reaccionando con más acetil-CoA de
piruvato y oxígeno para formar citrato de nuevo. Durante el ciclo se produce
más ATP y se envían electrones y otras especies a la cadena de transferencia de
electrones donde se genera la mayor parte de la energía.
4.3 Principales eventos del
ciclo de Krebs
Durante las diversas transformaciones de Citrato,
específicamente cuando Succinil-CoA se convierte en succinato, se genera un
Trifosfato de Guanosina (GTP), que luego dona un fosfato al difosfato de
Adenosina (ADP) para crear la molécula de energía trifosfato de adenosina
(ATP). A lo largo de todo el ciclo, tres moléculas de nicotinamida adenina
dinucleótida (NAD) se reducen a NADH que dona sus electrones a la cadena de
transporte de electrones que es responsable de la generación de grandes
cantidades de ATP. Una molécula de Flavin Adenina Dinucleotido (FAD) se reduce
a FADH2, una vez más donando sus electrones al sistema de transporte de
electrones y la generación de energía. Se genera más energía a patir de los
portadores denergía que funcionan como ácidos de brostened que a partir de la
fosforilación de sustrato de la GTP. Esto se debe a la enorme eficiencia de la
cadebna de transporte de electrones respiratoria y su proceso final, que
también es mediado por una f1f0 ATP sintetasa, tal como ocurre en la cadena de
transporte de electrones fotosíntpetica.
4.4 La coenzima A
La coenzima A es otra de estas moléculas basadas en
nucleócidos de ARN, nuevamente en este caso basada en el ATP. Es una coenzima,
notable por su papel en la síntesis y oxidación de ácidos grasos, y la
oxidación del piruvato en el ciclo del ácido cítrico. Todos los genomas
secuenciados hasta la fecha codifican enzimas que usan la coenzima A como
sustrato y alrededor del 4% de las enzimas celulares lo utilizan (o un
tioéster, como acetil-CoA) como sustrato. En los seres humanos, la biosíntesis
de CoA requiere cisteína, pantotenato y trifosfato de adenosina (ATP).
Por cierto, un tiol es el equivalente de un alcohol para el azufre, y puede llevar a cabo reacciones semejantes como los que forman los eteres y esteres. De hecho cuando la coenzima A acepta un grupo etanal “acetaldehido” la reaccion de adición se lleva a cabo por sustitución del hidrógeno del tiol para formar un tioester.
Figura 4.4. La coenzima A
(CoA, CoASH o HSCoA) es una coenzima, notable por su papel en la biosíntesis y
la oxidación de ácidos grasos, así como en la descarboxilación oxidativa del
ácido pirúvico, paso previo al ciclo de Krebs. Su molécula consta de ácido
pantoténico (vitamina B5), adenosín difosfato y cisteamina. Se señalan los dos
carbonos del grupo acetilo. Evidentemente, dibujar toda la acetil coenzima A en
los diagramas de reacción sería un dolor de cabeza, por lo que casi toda la
estructura se simbolizará como CoA.
4.5 Importancia del ciclo de
Krebs para el cuerpo
Si no fuera por
el Ciclo de Krebs no serías capaz de generar energía eficientemente de su
comida. En particular, el contenido de carbohidratos de su comida. Los
carbohidratos están disponibles en su dieta de dos fuentes: productos
alimenticios simples directos y como formas complejas almacenadas en moléculas
que no son carbohidratos, especialmente grasas y proteínas. Los carbohidratos
por definición sólo contienen moléculas de carbono, hidrógeno y oxígeno, y
pueden convertirse en glucosa dentro de tu cuerpo. Las proteínas pueden
desaminarse y luego la parte de carbohidratos se convierte de nuevo en glucosa.
De hecho, su cuerpo utilizará inicialmente los carbohidratos en su dieta como
una fuente de glucosa para su glucólisis al piruvato, luego el tejido graso en
su cuerpo, luego las proteínas serán desaminadas para que su cuerpo pueda
llegar a los carbohidratos que contienen. Sin embargo, es común en el músculo
que los ácidos grasos triglicéridos sean transformados directo a acetil-CoA
mediante la betaoxidación e ingrese de esta manera al ciclo de Krebs sin tener
que ser convertido a un carbohidrato.
A parte de poder
emplear más sustratos por medio de intermediarios clave como la acetil-CoA, el
ciclo de Krebs y la cadena de transporte de electrones pueden oxidar
completamente los esqueletos de carbono, produciendo muchas veces más ATP que
con las fermentaciones. Pero hay una trampa, si agregamos el eje del tiempo, la
fermentación produce ATP más rápido, pero gasta más energía en el proceso,
mientras que la respiración celular es más lenta, pero es más eficiente. Es
como comprara el consumo de gasolina versus la potencia de un Camaro de 67 con
un auto híbrido ultra eficiente. La eficiencia es la clave, la respiración
celular se emplea en tejidos que demandan energía constante y a largo plazo
como el cerebro y el corazón, mientras que la fermentación es empleada para
movimientos espasmódicos a muy corto plazo, como algunos tipos de ejercicio
muscular como el levantamiento de peso.
5. Reacciones del ciclo de Krebs 1, hasta GTP
|| Regresar al Índice ||
Una vez en la matriz mitocondrial la
formación de acetil-coenzima A puede lograrse por la ruta del piruvato y de la
beta oxidación de las grasas “que ya hemos visto” así como del catabolismo de
los aminoácidos “que veremos en temas futuros”. El ciclo de Krebs es
formalmente denominado como ciclo de los ácidos tricarboxilicos debido a la
presencia de ciertas moléculas que sirven de sustrato a la reacción, y que de
hecho son muy similares a otro ciclo famoso, el ciclo de Kalvin-Benson de la
fotosíntesis. Sin embargo, el nombre es gracioso, en primera no todos los
sustratos son ácidos con tres grupos carboxilo como el oxaloacetato, y el
segundo ni siquiera son ácidos (en el sentido molecular), son grupos cargados
negativamente producto de la disociación del ácido, es por esto se los designa
con la terminación de los grupos aniónicos (-ato). En las fórmulas he decidido
poner la fórmula ácida, pero el lector debe tener en cuenta que es posible
encontrar estas reacciones donde en lugar de hidrógenos se encuentre el símbolo
de carga (-). Ahora, debido a que esto es un poco largo se ha dividido la
descripción en dos etapas, la primera hasta la síntesis de la GTP y la segunda
hasta la regeneración del oxaloacetato.
5.1 Ingreso a la mitocondria
Como fue mencionado anteriormente, la mitocondria es el lugar físico donde la respiración celular aeróbica es llevada a cabo, y esta consta de dos pasos generales, el denominado ciclo de Krebs y la cadena de transporte de electrones. Sin embargo, el problema que enfrenta el proceso inicialmente es la adquisición por parte de la mitocondria del piruvato, y esto se lleva a cabo mediante la coenzima A mediante la formación del acetil Coenzima A. La formación de la acetil-CoA ya fue referenciada para el caso del ciclo de la oxidación beta de los ácidos grasos, sin embargo, en bioquímica básica es más común estudiar su formación desde la glucólisis.
Figura 5.1. Reacción
condenzada para la formación de la acetil-coenzima A, esta reacción es
exergónica y favorablemente energética como lo indica un valor de energía libre
estándar negativo. Esta energía es transferida al portador FAD y luego al
portador NAD el cual al formar NADH será parte del combustible que alimentará
la cadena de transporte de electrones.
Esto quiere decir que la reacción que hemos de describir en
este momento es uno de los mecanismos que posee la célula eucariota para
deshacerse del piruvato pues es un desecho de la glucólisis cuya toxicidad es
grande debido a que su acumulación hace que las reacciones de la glucólisis se
detengan.
Reacción condenzada para la formación de la acetil-coenzima
A, esta reacción es exergónica y favorablemente energética como lo indica un
valor de energía libre estándar negativo. Esta energía es transferida al
portador FAD y luego al portador NAD el cual al formar NADH será parte del
combustible que alimentará la cadena de transporte de electrones. La reacción
en si recibe dos nombres, oxidación del piruvato debido a que la molécula de
piruvato es cortada a la mitad, transfiriendo un grupo grade a la coenzima A y
liberándose una molécula de dióxido de carbono en el proceso, pero también es
conocida con el nombre de descarboxilación oxidativa del ácido pirúvico.
Esta primera reacción es particularmente compleja, cosa que no se ve claramente en la fórmula estequimétrica anterior. La reacción comenzará con el ingreso de las moléculas de piruvato a la mitocondria por medio de proteínas que sirven de poro específico para el piruvato llamadas piruvato translocasa, lo cual implica que las demás reacciones para la formación de la acetil-coenzima A ocurren en la matriz de la mitocondria. El proceso consta de 3 reacciones de transferencia de grupo y una de recolección de energía.
Figura 5.2. Complejo de
reacciones para el ingreso a la mitocondria, básicamente el piruvato de 3C
pierde un C que se vuelve CO2, mientras que los 2 carbonos restantes
forman el grupo acetilo.
En la primera reacción la molécula de piruvato es partida a
la mitad, una parte de transfiere a una coenzima de transporte denominada TTP y
la otra mitad es liberada en forma de dióxido de carbono. La TTP es una
coenzima derivada de la vitamina B1, se sintetiza a partir del Pirofosfato de
tiamina o TDP, y ATP a través de la enzima TDP-ATP fosforiltransferasa (la cual
se expresa en cerebro, riñón, hígado y corazón). Su función está asociada a la
función no coenzimática de la Tiamina y está relacionada con la síntesis de sustancias
que regulan el sistema nervioso. No confundir con el desoxinucleósido Timidina
trifosfato TTP. La reacción es catalizada por la enzima piruvato deshidrogenasa
La segunda reacción es una trasferencia del grupo acetil a
otra coenzima llamada lipoamida, la lipoamida posee dos átomos de azufre, por
lo que el enlace que forma el grupo acetil es muy similar al que ha de formar
en la tercera reacción. Este proceso es catalizado por la enzima dihidrolipoil
transacetilasa. Sin embargo la especie química generada en este paso es muy
inestable lo cual permite que dos
moléculas la oxiden rápidamente, la primer oxidación es una transferencia de
grupo el grupo acetil es transferido a la coenzima A, y acoplada a esta otra
coenzima esta vez el FAD se encarga de oxidar energéticamente extrayendo dos
protones con el respectivo par de electrones de alta energía para formar FADH2.
Posteriormente el FADH2 es oxidado transfiriendo un protón y un par de
electrones a una molécula de NAD para formar NADH mientras que el segundo
protón es liberado.
5.2 Acetil coenzima A y oxaolacetado a
citrato
La conversión del piruvato en acetil CoA por el complejo
piruvato deshidrogenasa es el vínculo entre la glicólisis y la respiración
celular porque el acetil CoA es el combustible para el ciclo del ácido cítrico.
De hecho, todos los combustibles son metabolizados en última instancia a acetil
CoA o componentes del ciclo del ácido cítrico, convirtiendo al ciclo de Krebs
en un metabolismo centralizante.
(Eq. 5.1)
La primer reacción
del ciclo de Krebs es una condensación de aldoles catalizada de manera
irreversible por la enzima citrato sintasa, lo cual nos da una idea del
producto de la reacción, que es citrato. Esta es una reacción de reducción
desde la perspectiva del citrato ya que su sustrato era una molécula con menor
catidad de carbonos y de menor nivel energético. Los ingredientes son agua,
acetil-coenzima A el primero indispensable para la química de la reacción, y el
segundo siendo un portador de energía gracias a una transferencia de grupo. El
otro ingrediente que sirve como sustrato es una molécula orgánica de 4 carbonos
llamada oxaloacetato. De esta manera la reacción en sí, se puede describir como
una transferencia de grupo con una condensación de agua en la que se incrementa
el número de carbonos del sustrato (4C) a (6C) con una transferencia implícita
de energía.
5.3 Citrato a isocitrato
La segunda reacción del ciclo de Krebs es
una isomerización reversible. El sustrato es
la molécula de citrato generada en la reacción anterior, esta reacción
básicamente modifica la estructura molecular para formar isocitrato. La enzima
que cataliza se denomina aconitasa, este nombre es extraño pues una isomerasa
de citrato debería llamarse isocitrasa, sin embargo, existe una razón, la aconitasa
puede catalizar la isomerización a partir de un mismo sustrato de dos productos
diferentes dependiendo de la disponibilidad de agua, dependiendo del equilibrio
con respecto al agua, si se genera una deshidratación del sustrato que
incrementa la disponibilidad de agua se genera ácido aconitico.
(Eq. 5.2)
Si la disponibilidad de agua es amplia el
equilibrio tenderá a generar una hidratación "entre comillas, porque en la
reacción no entra más agua", lo que genera la síntesis del isocitrato. Para
que el ciclo de Krebs pueda darse de manera efectiva es necesario que la enzima
catalice en la dirección del isocitrato y no del aconitico. El isocitrato es el
resultado esperado de esta reacción, y es básicamente un intercambio de grupos,
en lugar de perderse el hidrógeno y el hidroxilo como en el caso anterior,
simplemente los carbonos intercambian un hidrógeno y el grupo hidroxilo.
5.4 Isocitrato a
alfacetoglutarato
Este paso es en realidad una reacción
doble catalizada por una misma enzima llamada Deshidrogenasa de isocitrato. Decimos
que es una reacción doble porque se cataliza la reacción de isocitrato a
oxalosuccinato y posteriormente se cataliza la reacción de oxalosuccinato a
alfacetoglutarato.
(Eq. 5.3)
Este es un paso importante en esta ruta
metabólica ya que en términos básicos es una de las reacciones que llama
nuestra atención cuando vemos un diagrama del ciclo de Krebs, ¿la razón?
Produce energía y libera una molécula de dióxido de carbono “hasta el momento llevaríamos
2 NADH:H+ y 2 CO2 a partir de un piruvato” En el primer paso, donde
se produce oxalosuccinato también es producida la molécula de NADH a partir de
NAD y un protón junto con un par de electrones de alta energía que son cedidos
del isocitrato. En el segundo paso, una parte de la molécula se pierde para
formar dióxido de carbono y alfacetoglutarato.
5.5 Alfacetoglutarato a
succionil coenzima A
La reacción anterior posee varias
características importantes, es una reacción irreversible, transforma un sustrato
de 6 carbonos a un sustrato de 5 carbonos con obtención de energía.
(Eq. 5.4)
La presente reacción comparte las mismas
características, libera energía suficiente para sintetizar una molécula de NADH:H+
con el corte de un carbono para formar una molécula de dióxido de carbono. Este
corte y liberación de energía hacen que esta sea una reacción de oxidación
irreversible.
Otra característica importante de esta
reacción es que ha regenerado un sustrato de 4 carbonos, pero es una molécula
con protones extra y altamente energética que puede ser oxidada aún más. El
sustrato de la reacción es alfacetoglutarato, y a diferencia de las dos
reacciones anteriores la enzima alfacetoglutarato deshidrogenasa cataliza de
manera directa al producto que es succinil-coenzima A. Esto implica que uno de
los ingredientes de esta reacción vuelve a ser la coenzima A.
5.6 Succionil coenzima A a
Succinato
La quinta reacción del ciclo de Krebs es
una fosforilación a nivel de sustrato, pero el nucleósido empleado no es
derivado de la adenosina. De cierta manera los derivados de la adenosina son
extremadamente comunes en todas las reacciones bioquímicas, pero esto no
implica que sean los únicos, otros nucleósidos pueden polifosfatarse, es decir
su función no solo tiene que ver con el transporte de información genética a
través del ARN, sino que también están involucrados en el metabolismo.
(Eq. 5.5)
La presente
reacción es un recordatorio de cuan estrechamente ligados están la información
genética y el metabolismo, en este caso el nucleósido a fosfatar es uno
derivado de la guanina, el difosfato de guanocina GDP que formará trifosfato de
guanocina o GTP. En este caso, la guanosina trifosfato realiza rápidamente una
reacción de transferencia de grupo fostato a ADP para formar ATP, por lo que en
muchos esquemas se representa directamente el ATP sin referencias a la GTP.
Esta reacción es en esencia una fosforilación a nivel de sustrato semejante a
las de la glucólisis, donde se toma un fósforo inorgánico y se sintetiza un
grupo fosfato orgánico. El otro producto de la reacción es la rotura del enlace
de azufre con la producción de succinato y la liberación de la coenzima A. Cabe
destacar que esta es la única reacción en todo el ciclo donde se obtiene ATP de
manera directa.
6. Reacciones del ciclo de Krebs 2, regeneración del oxaloacetato
|| Regresar al Índice ||
6.1 Succinato a Fumarato
Esta es otra reacción de oxidación en la
que se desprenden dos protones con sus respectivos electrones de alta energía. La
reacción en si requiere de dos coenzimas, la primera se denomina ubiquinona
también conocida como coenzima Q10. La coenzima Q-10 “la misma que vemos en
fotosíntesis” es una molécula muy importante, se hecho su rol más preponderante
concierne a la cadena de transporte de electrones. CoQ-10 es una molécula
hidrófoba lo cual le permite atravesar con gran facilidad la membrana interna
de la célula y a adicional a esto es un aceptor de protones y electrones, es
decir es un portador de energía similar a NAD. La coenzima Q-10 se caracteriza
por un anillo de 6 carbonos unido a una cadena alifática ramificada de unos 40
carbonos de longitud, esta cadena larga de la su carácter hidrófobo y le
permite penetrar en la membrana celular con suma facilidad. Las posiciones para
aceptar protones son dos oxígenos cetona ubicados en el anillo de 6 carbonos
"en la forma oxidada". En la forma reducida en anillo de 6 carbonos
se convierte en un anillo bencénico y los oxígenos tipo cetona se convierten en
grupos hidroxilo.
(Eq. 6.1)
Como portador de electrones es el agente
que se encarga de transferir los electrones entre las proteínas integrales de
la cadena de transporte de electrones. Sin embargo, co-Q10 también es una
molécula con importantes roles como antioxidante, por ejemplo, impide la
oxidación de los lípidos y por lo tanto previene la síntesis de radicales
peróxilo. Más aun reduce radicales perferril y singletes de oxígeno, lo cual
previene la propagación de la peroxidación de los lípidos con la formación de
ubisemiquinona y peróxido de hidrógeno. Durante eventos de estrés metabólico,
coQ-10 protege la integridad del ADN especialmente el mitocondrial. Incluso
reghenera a otros antioxidantes como la vitamina E. En la reacción también
interviene un segundo portador de energía FAD quien se reduce para formar FADH2.
De los dos portadores solo FAD se emplea en los cálculos de energía para la respiración
aeróbica.
En cuanto a la enzima que cataliza la
reacción resulta interesante que, también se encuentra involucrada en la cadena
de transporte de electrones. De hecho, estamos tratando con un complejo de
proteínas integral de la membrana interna de la mitocondria llamado
deshidrogenasa de succinato o complejo II de la cadena de transporte de
electrones. Sin embargo, su naturaleza biomolecular será discutida con más
profundidad cuando se hable de los componentes de la cadena de transporte de
electrones. El sustrato oxidado de esta reacción es fumarato, un compuesto
oxidad, esta oxidación se caracteriza por la pérdida de dos protones por
molécula generando un doble enlace a la altura de los carbonos 2 y 3 de la
cadena.
6.2 Fumarato a Malato
Esta es una reacción de hidratación, es
decir una en la que una molécula de agua es adicionada, adicionalmente no se
obtiene energía en el proceso. La enzima involucrada viene en dos variedades en
los seres humanos, una involucrada en el metabolismo de los aminoácidos y la
otra que es la que nos interesa en la mitocondria.
(Eq. 6.2)
El sustrato de la reacción es el fumarato
el cual posee un enlace doble en los carbonos 2 y 3. El blanco de la reacción
es precisamente este doble enlace, donde la enzima es capaz de adicionar un
protón a uno de los carbonos y un grupo hidroxilo al otro liberando el enlace
doble. La enzima que cataliza la reacción también se encuentra involucrada en
ciertos tipos de cáncer, especialmente el cáncer renal.
6.3 Malato a oxaloacetato
Esta es la
reacción que completa el ciclo de Krebs, se trata de una oxidación en la cual
se extrae energía en forma del portador NADH. El equilibrio de la reacción
favorece en condiciones normales favorece la forma inversa de la reacción. La
reacción es catalizada por la enzima malato deshidrogenasa, la cual libera un
protón del grupo hidroxilo agregado en la reacción anterior junto con un par de
electrones de alta energía, donándolos al NAD. La reacción en si está
involucrada en otras rutas metabólicas como la gluconeogénesis.
En cada ciclo de
Krebs por lo tanto, se pierde un carbono del piruvato y un carbono del
oxaloacetato en forma de dióxido de carbono, y el oxaloacetato regenerado
poseerá un solo carbono proveniente del piruvato del ciclo anterior.
(Eq. 6.3)
7. Coenzimas y membrana celular en la respiración celular
7.1 La importancia de las
coenzimas reducidas en la síntesis de ATP
Es evidente que el mayor productor de la
oxidación de los ácidos tricarboxilicos o ciclo de Krebs a parte del desecho de
dióxido de carbono son coenzimas altamente reducidas, una de ellas ya la habíamos
trabajado en la glucólisis y es el NADH:H+, la otra molécula es la
de FADH2. Ambas coenzimas poseen tanto un protón como un par de electrones de
alta energía que enlazan al protón con la coenzima. Por lo anterior es fácil
señalar que la energía celular se encuentra en este enlace, y que el
rompimiento de este enlace es el que permitirá en pasos subsecuentes de la
respiración aeróbica la síntesis de ATP.
Aun así, hace falta una consideración adicional, si se recuerda de la glucólisis, esta ruta metabólica produce dos moléculas de NADH:H+ durante el primer paso de obtención de energía después de la isomerización de las moléculas de tres carbonos. El problema resulta del hecho de que el NADH:H+ difícilmente logra atravesar la membrana, por esta razón se establece un mecanismo alterno.
Figura 7.1. En lugar de
transportar a la coenzima completa a través de la membrana, lo que se hace es
translocar el par de electrones energético disociando su hidrogeno en el
citosol del NAD. Luego, los electrones de alta energía son empleados para la
síntesis de FADH2. Una vez se resintetiza un portador de electrones
y protones en el interior de la mitocondria, puede integrarse totalmente los
productos de la glucólisis a la respiración celular aeróbica mediante la cadena
de transporte de electrones.
7.2 La importancia de la membrana
de la mitocondria en la síntesis de ATP
Las mitocondrias generalmente son
descritas como generadores de energía en miniatura. Una analogía cercana es a
la de un motor de combustión interna, la mitocondria extrae la energía de los
materiales biológicos mediante un procedo oxidativo para generar energía
operativa. Al igual que las plantas de producción de energía en base a carbón,
la primera forma de energía que es generada después de la oxidación es energía
eléctrica. Más específicamente, la energía extraída de los sustratos orgánicos
es empleada para generar un gradiente “diferencial de cargas “es decir cargas
separadas por una membrana”” de iones separados por la membrana interna de la
mitocondria.
Y de manera similar, esta electricidad puede emplearse para realizar trabajo mecánico. Los gradientes ionicos son un mecanismo de paso de sustancias a través de membrana que es muy empleado por diferentes células de los seres vivos. En ocasiones como ocurre con la respiración celular el truco es generar una enorme presión a ambos lados de la membrana parta que luego pueda generarse transportes pasivos que liberan esa energía de forma controlada. Las mitocondrias emplean este gradiente iónico a través de sus membranas internas para realizar una serie de reacciones que conllevan a la síntesis de grandes cantidades de energía en forma de ATP. Debido a que el proceso de adición de grupo fosfato a portadores de energía en forma de ADP y GTP en base a la oxidación completa de sustratos organicos a este proceso se lo ha denominado fosforilación oxidativa “adición de fosfato en base a oxidación”.
Figura 7.2. Cadena de
transporte de electrones. La membrana actúa como el separador de los polos de
una batería, las coenzimas FADH2 y NADH:H+ mueven
protones a un solo lado de la membrana, haciéndola muy positiva y con más
presión osmótica, hasta que esa energía se libera de manera controlada en el
paso 2 para sintetizar ATP antes de que la membrana reviente (YouTube).
Personalmente la analogía que más me gusta
para describir a la fosforilación oxidativa es la de una planta eléctrica que
produce su energía por medio de agua. En este caso el sol eleva el agua hasta
una altura tal que cae sobre una montaña. Una vez que se acumula suficiente
agua esta fluye hasta el generador eléctrico que se mueve de manera mecánica
para generar energía. En la fosforilación oxidativa el papel de la represa lo
juega la membrana interna de la mitocondria, y los electrones de alta energía
que son cedidos por el FAD:H2 y el NADH:H+ hacen el papel
del Sol. Cuando los electrones fluyen a través de los citocromos o portadores
de electrones insertados en la membrana, pierden energía. Esta energía es
empleada para que los citocromos impulsen “transloquen” un protón (H+)
desde el interior de la matriz mitocondrial hacia el exterior de la membrana
interna.
Paulatinamente los protones se acumulan de
manera exagerada en la región intermembranal cargando esta sección con un
voltaje positivo. Finalmente, los protones llegan a acumularse a un nivel
crítico en el que deben regresar al otro lado de la membrana ejerciendo una
presión osmótica y eléctrica sobre esta. Esta fuerza es canalizada por la
célula a través de la proteína final, la F1F0 ATP sintetasa. Esta proteína al
igual que un generador, deja pasar los protones de regreso para equilibrar las
cargas a ambos lados de la membrana, y en el proceso se genera un movimiento en
la proteína que transfiere suficiente energía para sintetizar ATP. Algunos
estimados han llegado a la conclusión de que la fosforilación oxidativa permite
la síntesis de 160Kg de ATP al día en nuestros cuerpos. Obviamente mucha de esa
energía es consumida y regenerada constantemente a lo largo del día.
El entendimiento de los mecanismos de la
fosforilación oxidativa ha sido uno de los más grandes logros de la biología celular y de la biología
molecular, y las lagunas que aún posee el modelo sigue siendo un área de
estudio muy activa actualmente.
8. Portadores de electrones en la cadena de transporte respiratoria
|| Regresar al Índice ||
La mayoría de las enzimas que participan
en el transporte de electrones durante la fosforilación oxidativa se clasifican
como deshidrogenasas. Las deshidrogenasas son enzimas que transfieren un par de
electrones de un sustrato a un portador de energía. Las deshidrogenasas también
juegan un papel clave en el ciclo de Krebs, donde varias reacciones de este
tipo culminan con la síntesis de NADH:H+ y de FADH2. Posteriormente
estos portadores de energía se vinculan a otra deshidrogenasa, la cual los
despoja de sus electrones, dejando libres iones protio(1+) al mismo tiempo. Las
cadenas de transporte de electrones contienen cinco tipos de proteínas unidas a
las membranas que fungen como portadores de electrones: 1. Flavoproteínas 2. Citocromos 3. Complejos de cobre 4. Ubiquinonas 5. Y proteínas de hierro y azufre.
Con la excepción de la ubiquinona, todos
los centros de reacción oxido-reducción al interior de la cadena de la
respiratoria son grupos prostéticos. Un grupo prostético es una sustancia no
aminoacídica que se encuentra unida fuertemente mediante un enlace covalente al
cuerpo de la proteína. Las metaloproteínas son un ejemplo de proteínas con grupos
prostéticos, donde el componente que no es un aminoácido es un metal como el
hierro o el magnesio. El grupo prostético más común es el grupo heme cuyo
centro de reacción es un átomo de hierro.
8.1 Flavoproteínas
Consiste en un polipéptidos unido a uno o dos grupos prostéticos relacionados. Estos pueden ser la flavina de adenina dinucleótido (FAD) la flavina mononucleótido (FMN).
Figura 8.1. La
deshidrogenasa de NADH es una proteína integral de la membrana, el sitio activo
que se encarga del rompimiento de los enlaces con los hidrógenos en ambas
imágenes se ubica en la parte superior izquierda en verde. La proteína se
quedará con los electrones que empiezan a fluir a través de ella mientras que
los hidrógenos reaccionan con el agua para formar iones protio(1+) en la
solución interna de la matriz mitocondrial.
El grupo prostético de ambas proteínas es
un derivado de la riboflavina o vitamina B2, y cada uno es capaz de aceptar dos
protones con dos electrones. Resumen de la respiración celular aeróbica. Las
flavoproteínas más importantes de la mitocondria son la deshidrogenasa del
NADH:H+ que le da inicio a la cadena de transporte de electrones y la
succinato deshidrogenasa del ciclo de Krebs.
8.2 Citocromos
De cierta forma muchos aspectos de la biología se los tiende a percibir de manera aislada, lo cual da pie a las apelaciones del diseño inteligente. Un ejemplo de ello es la evolución de los sistemas sanguíneos de los animales dependientes de un centro de reacción prostético denominado grupo hemo. El grupo hemo sirve como un marco que fija en su centro un átomo de hierro que puede realizar transiciones redox reversibles entre el hierro II y el hierro III, mediante la acpación y liberación de un único electrón.
Figura 8.2. Formas: oxidada
"arriba" y reducida "abajo" del grupo hem
Si se analizara a grupo hemo como un
componente integral de la sangre sin el cual la sangre no sirve para su función
de transporte de gases estaríamos hablando ante un componente que hace a la
hemoglobina irreductiblemente compleja. Sin embargo, si se analiza con mayor
generalidad los componentes celulares encontramos otro cuerpo de proteínas altamente
dependientes del grupo prostético hemo llamadas citocromos. En términos de
antigüedad los citocromos son conclusivamente proteínas más antiguas que la
hemoglobina de la sangre. Se tienen registros de que los citocromos están en
funcionamiento como mínimo poco después de la gran crisis de oxigeno por lo que
podemos afirmar que su antigüedad es de al menos 1,5 mil millones de años,
mientras que la hemoglobina como componente de la sangre de los animales no
debe ser más antigua que hace unos 800 millones de años poco antes de generarse
la explosión cámbrica.
Existen tres tipos de citocromos nombrados
desde la a hasta la c, presentes en la cadena de transporte de electrones, los
cuales difieren unos de otros por sustituciones de grupos hemo. Dado que resulta
poco probable que el grupo hemo evolucionara dos veces de manera independiente,
se concluye que lo más probable para la hemoglobina es que esta proteína
sanguínea reclutara de manera paralela al grupo hemo por algún error en la
regulación de la síntesis de los citocromos de la cadena de transporte de
electrones, y luego sirviendo para mejorar la eficiencia del flujo de gases
entre el organismo y su medioambiente en los animales.
8.3 Complejos de cobre y
ubiquitinonas
El complejo de cobre se ubica en una sola proteína de la cadena de transporte de electrones y al igual que el hierro del grupo hemo, su función primordial es alternar entre los estados de cobre II y cobre I permitiendo un flujo continuo de electrones.
Figura 8.3. Portadores de
electrones comunes.
Las ubiquinonas "imágen siguiente" son grupos prostéticos de proteínas insertadas en la membrana con una gran porción altamente hidrofóbica. Como las flavoproteinas, cada ubiquinona es capaz de aceptar o donar dos electrones y dos protones.
Figura 8.4. Estructura
reducida y oxidada de la ubiquinona Q10.
8.4 Complejos de hierro y
azufre
Son metaloproteinas cuyo grupo prostético está determinado por un átomo de hierro, pero a diferencia de los citocromos, estos hierros no se encuentran enmarcados en el grupo hemo. El hierro en estas proteínas se encuentra vinculado a iones de azufre inorgánico como parte de un centro de hierro-sulfuro. El centro de hierro-sulfuro más común contiene dos o cuatro átomos de hierro y azufre vinculados a una proteína en los residuos de cisteína. A pesar de que un solo centro puede tener una gran cantidad de átomos de hierro, el complejo completo es capa de transferir un solo electrón por cada ronda redox. El potencial redox de un centro de hierro-sulfuro depende de la carga hidrófoba y la carga de los residuos de aminácidos que rodean al centro de hierro-sulfuro.
Figura 8.5. Los grupos
prostéticos se encuentran distribuidos a través de la superficie de los
complejos de proteínas que componen a la cadena de transporte de electrones, lo
suficientemente cerca para que se formen puentes eléctricos entre las
posiciones que aceptan y seden electrones. En la imagen se muestra la posición
de varios grupos prostéticos de tipo diferente estrechamente unidos entre sí.
8.5 El último aceptor de
electrones
La cadena de transporte de electrones se la puede visualizar casi que como un sistema de corriente eléctrica en la que se dan cambios alternos de esta reducido y oxidado. Cuando tenemos una pareja de componentes, como FMN y Q, FMN al recibir electrones cambia a un estado reducido. Una vez está cargado con electrones “reducido” debe encontrar un adecuado aceptor electrones que esté vacío “oxidado” para poder donarlos. Cuando los dona la pareja cambia a su forma alterna respectiva, FMN cambia a la forma oxidada “Vacía” mientras que Q cambia a la forma reducida “llena”.
Figura 8.6. Relación de los
componentes de la cadena de transporte de electrones con el flujo de electrones
"vínculos en negro" y la emisión de energía "líneas rojas".
Cuando se emite energía es posible realizar transporte activo.
Al interior de la cadena se genera una corriente de electrones que fluirá siempre y cuando se encuentren aceptores de electrones vacíos a los cuales se les pueda reducir. Otro aspecto de esta corriente eléctrica es que a medida que los electrones son transferidos a un aceptor, este gasta parte de la energía que ellos contienen para cambiar de forma y permitir que iones hidrogeniones fluyan en contra del gradiente de concentración “transporte activo” desde el interior de la matriz hasta el exterior. El aceptor final de la cadena de transporte de electrones debe ser un elemento fácilmente removible del sistema, si fuera otra proteína rápidamente esta se cargaría con electrones y la corriente eléctrica se detendría al no tener a nadie diferente para depositar los electrones de energía agotada. Es por esto que varios elementos gaseosos u otras sustancias que pueden captarse y excretarse con gran velocidad por las células son el aceptor final de electrones. Para muchos seres vivos incluidos los seres humanos este aceptor de electrones es el oxígeno molecular gaseoso. El oxígeno gaseoso cumple las condiciones ideales para ser el aceptor final.
Figura 8.7. Flujo de
electrones a través de dos centros de reacción a través de diversas rutas fijas
a través de la proteína, puede verse con claridad en este modelo la presencia
de un grupo hemo.
Al ser un gas diatómico no es una molécula
polar, por lo que fluye con facilidad a través de las membranas biológicas, y
cuando es cargado con los electrones, capta los protones de los iones
hidrogeniones, lo cual permite disminuir el nivel de acidez al interior de la
matriz mitocondrial “durante la cadena de transporte de electrones la acidez a
ambos lados de la membrana se incrementa debido a que los portadores NAD y FAD
liberan protones al agua con cada par de electrones”, produciendo agua en el
proceso. Aunque el oxígeno pueda tener un papel bastante pequeño en toda esta
historia es fundamental. Si no está el oxígeno, no hay ningún lugar en donde
depositar los electrones de baja energía, lo cual hace que toda la cadena de
transporte de electrones sufra un enorme “trancón o atascamiento”. Resulta
también remarcable que uno de los epítetos básicos de la respiración celular
AERÓBICA solo se hace evidente hasta una de las últimas reacciones del proceso.
9. La cadena de transporte de electrones respiratoria
|| Regresar al Índice ||
Una cadena de transporte de electrones (CTE) es una serie de
complejos que transfieren electrones de donantes de electrones a receptores de
electrones a través de reacciones redox (ambas reducciones y oxidaciones que
ocurren simultáneamente), y acopla esta transferencia de electrones con la
transferencia de iones protio(1+) a través de una membrana . Esto crea un
gradiente de protones electroquímicos que impulsa la síntesis de adenosina
trifosfato (ATP), una molécula que almacena la energía químicamente en forma de
enlaces de alta tensión. Las moléculas de la cadena incluyen péptidos, enzimas
(que son proteínas o complejos de proteínas), y otros. El aceptor final de
electrones en la cadena de transporte de electrones durante la respiración
aeróbica es el oxígeno molecular, aunque existe una variedad de aceptores
distintos del oxígeno, tales como el sulfato, en la respiración anaeróbica.
Las cadenas de transporte de electrones se
utilizan para extraer energía a través de reacciones redox de la luz solar en
la fotosíntesis o, como en el caso de la oxidación de los azúcares, la
respiración celular. En los eucariotas, una importante cadena de transporte de
electrones se encuentra en la membrana mitocondrial interna, donde sirve como
el sitio de la fosforilación oxidativa mediante el uso de la ATP sintasa.
También se encuentra en la membrana tilacoide del cloroplasto en eucariotas
fotosintéticos. En las bacterias, la cadena de transporte de electrones se
encuentra en su membrana celular.
9.1 Componentes solubles y no
solubles de la cadena de transporte de electrones
Cuando la membrana interna de la mitocondria colapsa con la ayuda de un detergente especial, es posible aislar varios de los portadores de electrones como parte de cuatro complejos transmembranales asimétricos. Los portadores de electrones van insertados en los complejos como si fueran una red eléctrica. Estos complejos se los puede identificar como estructuras cuaternarias en las que varias unidades funcionales se acoplan de manera muy estrecha. Cada uno de los cuatro complejos puede ser identificado en base a la función que cumplen en la ruta de flujo de electrones general. Dos componentes de la cadena de transporte de electrones, el citocromo c y la ubioquinona no hacen parte de los cuatro complejos proteínicos insertados en la membrana interna de la mitocondria. La ubiquinona funciona como un grupo de molecular disueltas en el interior de la bicapa lipídica de la membrana interna, mientras que el citocromo c es una proteína soluble que se encuentra en la región intermembranal disuelta. La función de estos componentes es la de servir como puentes para el flujo de electrones, como si fueran una red eléctrica móvil entre cada uno de los complejos transmembranales.
Figura 9.1. Los componentes
solubles de la cadena de transporte son II, la ubiquinona que se solubiliza en
los lípidos de la membrana y el citocromo c que se solubiliza en el citoplasma
de la mitocondria.
9.2 NADH, FADH2 y
la cadena de transporte de electrones
NADH:H+ y FADH2
poseen una relación diferente con la cadena de transporte de electrones que
depende de su comportamiento en el ciclo de Krebs. El NADH:H+ al ser
sintetizado puede difundirse de las proteínas que lo sintetizan, mientras que
el FADH2 queda unido de manera covalente a la succinato
deshidrogenasa. Es por esto que mientras el NADH:H+ puede donar sus
electrones al complejo I de la cadena de transporte de electrones, el FADH2
no tiene más opción que regresar los electrones a la enzima succinado
deshidrogenasa a la cual está unido. Dado que una de las reacciones de
transferencia de energía ocurre entre el complejo I y el complejo II, que los
electrones del FADH2 ingresen directamente en el complejo II tiene
un efecto negativo en la obtención de energía desde esta coenzima. Es por esto que la cantidad de energía que
puede sintetizarse a partir del NADH:H+ es superior a la del FADH2.
9.3 Sitios de acoplamiento
Figura 9.2. Las zonas de
acoplamiento hace referencia a complejos que poseen dominios transmembranales
capaces de ejecutar transporte activo de iones protio(1+) desde la matriz a la
región intermembranal manteniendo el pH de la matriz en contra de la tendencia
acidificante del NADH:H+ y el FADH2.
Si se examinan los potenciales redox de
cada uno de los portadores de electrones, se hace evidente que existen tres
lugares en los que la transferencia de electrones se logra junto a una
liberación de energía libre máxima. Cada uno de estos sitios de acoplamiento
ocurre entre los portadores que son parte de los complejos I, III y IV. La
energía libre es empleada por los complejos para alterar su propia estructura
de manera momentánea, lo cual permite una segunda función como bombas de
protones "transporte activo de iones protio(1+)".
9.4 Los complejos de la cadena
de electrones como bombas de protones
Aquí empleamos uno en los significados
posibles de bomba, en ingles no ocurre esto ya que están las palabras pump y
bomb para diferenciar las dos ideas. Aquí emplearemos la palabra bomba como
traducción del inglés pump. Las bombas de protones son dominios
transmembranales empleados para hacer transporte activo de iones protio(1+)
"el ion protio(1+) es un producto ácido ya sea en la teoría de Lewis o de
Bronsted, en otras palabras son los responsables del poder corrosivo de un
ácido"
Figura 9.3. (YouTube).
Bomba de Protones
Una bomba es una máquina que permite hacer
fluir algo en contra de una tendencia general. Por ejemplo, cuando un barco
sufre una fisura y empieza a hundirse, el hundimiento se produce porque el agua
ingresa a él con cierta velocidad. Una bomba es una máquina que saca el agua
desde el interior del barco al exterior con una velocidad y gastando energía.
En el caso del barco, la acción que va en favor de la segunda ley de la
termodinámica es que el agua ingrese al barco y lo hunda ya que es la ruta
espontánea que no requiere energía, sino que la libera “energía gravitacional
contenida en el agua y que se libera cuando ingresa a presión en el barco”.
La ruta que va en contra es sacar el agua,
y para lograrlo es necesario invertir grandes cantidades de energía. Una bomba
de protones es una proteína que sirve como canal iónico para iones protio(1+)
“agua enlazada débilmente a un átomo de hidrogeno iónico o protón”. El flujo de protio(1+) “para simplificar,
protones” puede darse en favor del gradiente de concentración “desde el lado
donde hay más, hacia el lado donde hay menos” o en contra del gradiente de
concentración. Como cualquier transporte activo, cuando se trabaja en contra
del gradiente de concentración se debe invertir energía para lograr la tarea.
Esta energía para el caso de la cadena de transporte de electrones es
proporcionada por los electrones de alta energía proporcionados por el NADH:H+
y el FADH2.
Los complejos I, III y IV tienen un
segundo dominio transmembranal a parte de los que sirven para que se dé una
corriente de electrones. Ambos dominios están acoplados, cuando se recibe un
electrón energético, parte de su energía se consume para que la proteína cambie
de forma y traslade a la fuerza “translocar” a un protón "ión
protio(1+)" desde una región de menor concentración a una de mayor
concentración”, es por esto que los complejos I, III y IV sirven como bombas de
protones.
La función de la cadena de transporte de
electrones es acumular enormes cantidades de protones en la zona intermembranal
de la mitocondria, lo cual genera una presión osmótica y eléctrica. Es la energía
generada por estas presiones la que será empleada en el último paso de la
respiración celular aeróbica para sintetizar ATP, transfiriendo la energía
desde la presión de protones a un enlace entre grupos fosfato. Las bombas de
protones son tipos de proteína muy general que son empleadas en otros contextos
en diferentes tipos de seres vivos.
9.5 Diferentes versiones de la
cadena de transporte de electrones
La respiración celular aeróbica es un
desarrollo evolutivo exclusive de las células procariotas. Es gracias a que
cierto grupo de bacterias procariotas que evolucionaron endosimbióticamente en
los eucariotas, los hongos, las plantas, los animales y otros eucariotas pueden
obtener beneficios energéticos de este tipo de metabolismo. Sin embargo,
existen diferencias significativas entre los linajes de vida libre y
endosimbiótico que se correlacionan a los diferentes ambientes en que han
evolucionado. En los mamíferos, por ejemplo, la cadena de transporte de
electrones es conformada con 70 polipéptidos, mientras que las bacterianas
contienen menos unidades genéticas.
Las partes adicionales de los mamíferos no
contienen centros funcionales de la cadena de transporte de electrones, es
decir centros redox, y aunque su función es poco clara es probable que estas proteínas
sirvan para regular la conformación de la cadena de transporte de electrones de
las mitocondrias. Lo anterior implica que el núcleo básico que genera la
función de la cadena de transporte de electrones ha cambiado poco desde que los
linajes de vida libre y endosimbiótico se separaron en su historia evolutiva.
9.6 Complejo I o
deshidrogenasa de NADH
El complejo I es una de las compuertas de
ingreso de los electrones a la cadena de transporte de electrones relacionada a
la NADH:H+, esta proteína cataliza la transferencia de un par de
electrones desde el NADH hasta la ubiquinona para formar ubiquinol.
La versión del complejo I de los mamíferos es un conglomerado multiprotéico en forma de L conteniendo 45 subunidades. Siete de estas subunidades son hidrófobas insertadas en la membrana se codifican por los genes de la mitocondria y son homólogos a los polipéptidos de las bacterias. El complejo I contiene flavoproteinas de FMN la cual oxida al NADH, también posee almenos 8 distintos de núcleos de hierro-sulfuro y dos moléculas unidas de ubiquinona. El paso del par de electrones a través del complejo I induce el transporte activo de cuatro protones desde la matriz de la mitocondria a la región intermembranal. Es este transporte activo el objeto de la cadena de transporte de electrones y ocurrirá otro par de veces a través de toda la cadena hasta que los electrones pierdan su energía y sean captados por el oxígeno.
Figura 9.4. El complejo I
es una estructura compleja de varias proteínas en forma de L, la región
hidrófila "superior" se encuentra en la matriz de la mitocondria
"arriba"
9.7 Complejo II o succinato
deshidrogenasa
El complejo II consiste en cuatro polipéptidos: dos unidades hidrófobas insertadas en la membrana y dos unidades hidrófilas expuestas a la matriz de la mitocondria, las cuales cumplen una función en el ciclo de Krebs como la enzima succinato deshidrogenasa. El complejo II provee una segunda compuesta de entrada para electrones de menor nivel energético proporcionados por el FADH2 el cual se sintetiza sobre la succinado deshidrogenasa “dominios hidrófilos del complejo II” y al cual queda unido después de su síntesis.
Figura 9.5. Aquí se muestra la función doble del complejo II en la cadena de transporte de electrones "arriba" y en el ciclo de Krebs "abajo". El ciclo de Krebs "abajo" en el paso de succinato a fumarato sintetiza una molécula de FADH2 que queda pegada al complejo II e ingresa inmediatamente a la cadena de transporte de electrones.
Los grupos prostéticos del complejo dos se
caracterizan por tres núcleos de hierro-sulfuro y grupos hemo. Actualmente se
piensa que el grupo hemo cumple una función de atractor de electrones que
desvían su camino de la cadena, impidiendo que estos se liberen hacia la matriz
generando radicales de oxígeno llamados superóxido que poseen el potencial de
lastimar el ADN de la célula y la mitocondria. El complejo II no posee el
dominio intermembranal que permite el transporte activo de iones protio(1+),
por lo que no hay acumulación en este paso de la cadena de transporte de
electrones.
9.8 Complejo III o citocromo
bc1
El complejo III cataliza la transferencia de electrones desde el ubiquinol al citocromo c.
Figura 9.6. Dominios del
citocromo bc1.
Determinaciones experimentales sugieren que
el complejo III posee los dominios transmembranales necesarios para la
translocación de iones protio(1+) desde la matriz hasta el espacio
intermembranal de la mitocondria al costo de energía proporcionada por
electrones. Por cada par de electrones son transferidos cuatro iones
protio(1+). El complejo III posee los siguientes tipos de grupos prostéticos que
permiten la transferencia de electrones, grupos hemo, y núcleos de
hierro-sulfuro.
9.9 Complejo IV y citocromo c
oxidasa
El paso final de la cadena de transporte
de electrones en una mitocondria es la transferencia sucesiva de electrones
desde el citocromo C al oxígeno molecular diatómico de acuerdo a la siguiente
reacción:
(Eq. 9.1)
La reducción del oxígeno es catalizada por
el complejo IV como un enorme ensamblaje de polipéptidos denominados en
conjunto como citocromo oxidase. La citocromo oxidasa fue el primer componente
de la cadena de transporte de electrones en mostrar un dominio de transporte
activo para iones protio(1+) “también llamada bomba de protones”. Debemos
recordar que la acidez de la matriz de la mitocondria sería muy alta debido al
constante aporte de protones desde el FADH2 y el NADH:H+
para formar iones protio(1+) con agua. Esta acidez no se manifiesta por dos
factores.
El primero es la cadena de transporte de electrones misma, que exporta protones al otro lado de la membrana. Por cada oxígeno en una ronda 4 iones protio(1+) son transferidos desde la matriz hacia la región intermembranal. Otros 4 iones protio(1+) restantes de la matriz son consumidos por el oxígeno mismo para la formación de una molécula de agua. Esto sirve como segundo factor que impide que la acidez del interior de la mitocondria sea muy alta. Los seres humanos producen 300ml de agua sintetizada metabólicamente al día. Vale la pena señalar que varios venenos se caracterizan por interrumpir la cadena de transporte de electrones a la altura de un grupo hemo prostético en la subunidad a3 de la citocromo oxidasa. Ejemplos de este tipo de venenos incluye al monóxido de carbono, el cianuro y la azida.
Figura 9.7. Existen dos
estructuras con nombre semejante, el citocromo c que es el portador de electrones
desde el complejo III al complejo IV y el propio complejo IV que recibe el
nombre de citocromo c oxidasa y que es muchísimo más grande que el citocromo c.
El citocromo C oxidasa es una proteína
compuesta por 13 subunidades, tres de las cuales se codifican en el genoma
mitocondrial, estas subunidades de la mitocondria poseen todas las fracciones
que poseen los 4 núcleos redox. El mecanismo de transferencia de electrones a
través del complejo IV ha sido estudiado de manera intensiva por varios grupos de
investigación alrededor del mundo. Uno de
los aspectos más desconcertantes de la parte final de la cadena de
transporte de electrones es la habilidad del complejo IV de reducir dos átomos
de oxígeno para formar dos moléculas de agua, un proceso que requiere de cuatro
electrones acoplándose de manera simultánea, siendo que su flujo de electrones
solo permite el paso de uno a la vez.
Si el sistema no estuviera acoplado de
manera eficiente podrían liberarse radicales parcialmente reducidos de oxígeno
que pueden dañar cualquier macromolécula en el interior de la célula. Este
aspecto podría inducir al pensamiento teleológico de que ambas funciones de la
cadena de transporte de electrones deben haber aparecido de manera simultánea.
Sin embargo, varios modelos evolutivos de la cadena de transporte de electrones
proponen que esta se desarrolló en primera instancia como un mecanismo de
defensa contra el oxígeno venenoso convirtiéndolo en agua. De hecho, podemos
contabilizar dos funciones de la citocromo c oxidasa en el contexto de
bacterias de vida libre.
1-Protector contra el envenenamiento por
oxígeno al convertirlo en agua.
2-Protector contra la acidificación del
interior de la célula mediante (a) la producción de agua metabólica y (b)
mediante la excreción de iones protio(1+) al exterior de la célula.
10. Fosforilación oxidativa
|| Regresar al Índice ||
La fosforilación
oxidativa es la vía metabólica en la que las células utilizan enzimas para
oxidar los nutrientes, liberando así la energía que se utiliza para reformar la
ATP. En la mayoría de los eucariotas, esto ocurre dentro de las mitocondrias.
Casi todos los organismos aerobios llevan a cabo la fosforilación oxidativa.
Esta vía es probablemente tan omnipresente porque es una forma altamente
eficiente de liberar energía, en comparación con otros procesos de fermentación
como la glicolisis anaeróbica. Durante la fosforilación oxidativa, los electrones se transfieren
de donantes de electrones a receptores de electrones como el oxígeno, en
reacciones redox. Estas reacciones redox liberan energía, que se utiliza para
formar ATP. En los eucariotas, estas reacciones redox se llevan a cabo por una
serie de complejos de proteínas dentro de la membrana interna de las
mitocondrias de la célula, mientras que en procariotas estas proteínas se
encuentran en el espacio intermembrana de las células. Estos conjuntos
vinculados de proteínas se llaman cadenas de transporte de electrones. En
eucariotas, cinco principales complejos de proteínas están involucrados,
mientras que en procariotas muchas enzimas diferentes están presentes,
utilizando una variedad de donadores de electrones y aceptores.
La energía liberada por los electrones que
fluyen a través de esta cadena de transporte de electrones se utiliza para
transportar protones a través de la membrana mitocondrial interna, en un
proceso llamado transporte de electrones. Esto genera energía potencial en
forma de un gradiente de pH y un potencial eléctrico a través de esta membrana.
Este almacén de energía es aprovechado permitiendo que los protones fluyan
hacia atrás a través de la membrana y abajo de este gradiente, a través de una
enzima grande llamada ATP sintasa; Este proceso se conoce como quimiosmosis.
Esta enzima utiliza esta energía para generar ATP a partir de difosfato de
adenosina (ADP), en una reacción de fosforilación. Esta reacción es impulsada
por el flujo de protones, que obliga a la rotación de una parte de la enzima;
La ATP sintasa es un motor mecánico rotatorio. Aunque la fosforilación
oxidativa es una parte vital del metabolismo, produce especies reactivas del
oxígeno tales como superóxido y peróxido de hidrógeno, que conducen a la
propagación de radicales libres, dañan las células y contribuyen a la
enfermedad y, posiblemente, al envejecimiento (senescencia). Las enzimas que
llevan a cabo esta vía metabólica son también el blanco de muchos fármacos y
venenos que inhiben sus actividades. Es el proceso terminal de respiración
celular en eucariotas y explica el alto rendimiento de ATP (trifosfato de
adenosina).
10.1 Maquinaria para la
síntesis de ATP
El objetivo de la cadena de transporte de
electrones es la de generar una alta concentración de iones protio(1+) en la
zona intermedia de las dos membranas mitocondriales. Esto se da independiente
al tipo de aceptor final de electrones. Dependiendo del linaje de seres vivos
han evolucionado multitud de aceptores finales, pero el que predomina es el
oxígeno. Ahora llegamos al punto de, si tenemos muchos iones protio(1+) en la
zona intermembranal, pero ¿y qué?, ¿qué se hace con esos iones protio(1+)?,
pues la respuesta obvia es sintetizar energía en forma de ATP. Por lo cual
debemos hacer la conexión, esta concentración de protones se emplea para
sintetizar ATP, la pregunta es ¿cómo? ¿Cómo se emplea un gradiente de
concentración alto de iones protio(1+) en la región intermembranal para
sintetizar ATP?
Como se mencionó anteriormente, la cadena de transporte de protones es básicamente varias bombas de protones que funcionan de manera acoplada, sin embargo existen otras bombas de protones, una que funcionan como transporte activo y otras como transporte pasivo. Originalmente una serie de proteínas llamadas proteínas tipo F1 fueron identificadas precisamente como bombas de protones de transporte activo, pero que en lugar de gasta energía de una corriente de electrones, lo lograban mediante el corte selectivo de proteínas del alta energía llamadas ATP. Ahora téngase en mente que originalmente las proteínas tipo F fueron asociadas al CONSUMO de energía por lisis de ATP formando ADP. Durante inicios de la década de los 60s, Humberto Fernández Moran del hospital general de Massachussetts se encontraba aislando mitocondrias mediante un nuevo método de tinción negativa. Fernández descubrió una serie de esferas unidas a la membrana interna de la mitocondria proyectándose especialmente hacia la matriz mitocondrial.
Figura 10.1. Se señala la
sombra de una proteína importante, la sintetizadora de energía.
Unos años después Efraim Racker de la
Universidad de Corrnell aisló estas esferas a las cuales denominó factor de
acoplamiento 1 o simplemente f1. Racker descubrió que las esferas f1 poseían un
comportamiento enzimático hidrolizando el ATP para formar ADP, es decir,
consumían energía celular. La pregunta del millón es, ¿Por qué un organelo que
se supone produce ATP a ´partir de ADP y fosforo inorgánico tendría una enzima
que cataliza la reacción opuesta? Una característica de muchas enzimas es que
pueden catalizar la reacción directa y la reacción opuesta dependiendo de las
condiciones de equilibrio químico en el sistema en el cual están presentes.
Evidencia de que las ATPasas pueden
sintetizar ATP dependiendo de las condiciones, es la ATPasa que potencia el
transporte activo de la bomba de sodio y potasio, proceso por el cual las neuronas
son capaces de generar pulsos eléctricos.
En condiciones experimentales en los que se emplea la ATPasa de sodio y
potasio en contra de los gradientes de concentración de ATP en los que opera
normalmente se ha logrado que funcione como una sintetasa de ATP. Esto prueba
que las ATPasa y las ATP sintetasa pueden exaptarse “cambiar objetivo haciendo
la misma función básica” para la función opuesta con extrema facilidad en el
contexto celular.
10.2 Estructura de la ATP
sintasa
La proteína que se encarga de la síntesis de ATP es compleja, y posee varios dominios integrados, donde el f1 es solo una parte de la historia. Las proteínas de síntesis de ATP que generalmente reciben el nombre de ATP sintetasa son proteínas con forma de sobrero de hongo, compuesto por dos componentes básicos: La cabeza esférica o componente f1 y una sección basal llamada f0 que se encuentra insertada en la membrana celular. Las dos secciones se encuentran conectadas por un conector o eje central. Una mitocondria de un hígado de un mamífero típico contiene alrededor de 15 000 copias de la proteína f1f0 ATP sintetasa. Versiones homologas de la ATP sintetasa es encontrada en la membrana plasmática de las bacterias, los tilacoides de los cloroplastos y cianobacterias.
Figura 10.2. Dos partes del
complejo se diferencian como f1 y f0. La f0 "verde" es la estructura
que rota realmente junto con el eje gama, mientras que f1 se queda estática con
respecto a f0.
Las porciones f1 de la ATP sintetasa, ya
sea de una bacteria o de una mitocondria contienen 5 diferentes tipos de
polipéptidos. Los polipéptidos se denominan de acuerdo a letras del alfabeto
griego, alfa (3 copias), beta (tres copias), delta, gamma y eta. Las
subunidades alfa y beta se organizan de manera intercalada en la cabeza F1 de
una manera semejante a los segmentos de una naranja o mandarina. Existen dos
aspectos que deben tomarse en cuenta para futuras discusiones. En primera
instancia, cada cabeza f1 posee 3 dominios catalíticos, cada uno con la
capacidad de sintetizar (o de cortar) una molécula de ATP ubicados en las
subunidades beta.
En segunda instancia, la subunidad gamma
sirve como eje central al cual se ancla la sección de f1 y se extiende hasta la
base f0. En las versiones mitocondriales, todas las subunidades se sintetizan
en el ADN del núcleo, se sintetizan en el citoplasma y luego importadas a las
mitocondrias. La sección f0 de la ATP sintetasa reside en el interior de la
membrana y consisten en tres polipéptidos diferentes. Una subunidad a; dos
subunidades b; y entre diez a catorce subunidades c. Se dice que entre diez a
catorce debido a que el análisis comparativo ha demostrado que la cantidad de
subunidades c puede cambiar dependiendo de la fuente de la que se extrae la
enzima analizada. Por ejemplo, tanto las levaduras como las bacterias E. coli
poseen una ATP sintetasa que poseen ambas 10 subunidades c, mientras que la
enzima de un cloroplasto posee 14 subunidades c. La sección f0 contiene un
canal de protones “permite el paso facilitado de iones protio(1+)” que conecta
los dos lados separados por una membrana biológica.
Figura 10.3. (YouTube)
GRADIENTE ATPsintetasa
La f1f0 ATP sintetasa puede funcionar por
lo tanto como un canal de iones protio(1+), dependiendo de las condiciones de
equilibrio osmótico funcionará alternativamente como una bomba de protones de
transporte activo consumiendo ATP, o como un canal de transporte pasivo
facilitado con la producción de ATP en el proceso.
10.3 Síntesis de ATP
Los elementos que ya conocemos a esta
altura de la discusión son los siguientes: La cadena de transporte de
electrones ha generado un enorme gradiente electro-osmótico a través de la
membrana interna de la mitocondria, en la región de intermembranas hay una gran
concentración de iones protio(1+) y una fuerte carga positiva con respecto a la
matriz de la mitocondria. La f1f0 funciona como una proteína de transporte
pasivo facilitado para los iones protio(1+) de la región intermembranal. Los
iones protio(1+) hacen girar a la f1f0 ATP sintetasa y tal proceso conlleva a
la síntesis de ATP. En los siguientes textos indagaremos en los principios
bioquímicos que permiten que (a) el ATP se sintetice; que (b) los iones
protio(1+) fluyan a través de la membrana; y (c) como ambos procesos de
conectan permitiendo la transformación de la energía.
10.4 Síntesis indirecta de ATP por
la mitocondria
La energía es liberada mediante el
movimiento de los iones protio(1+) no es empleada para realizar la reacción de
adición de fosfato inorgánico al ADP “fosforilación” de manera directa. Lo que
cambia es la afinidad de enlace de la región activa del dominio de síntesis de
ATP. Estamos acostumbrados a pensar que las reacciones celulares ocurren en un
ambiente acuoso en el que la concentración de agua es de 55 molar y que los
reactivos y productos se disuelven de manera simple en el medio acuoso polar.
Bajo estas condiciones, se requiere energía para la formación de un enlace
covalente entre ADP y un grupo fosfato inorgánico.
Ha sido demostrado experimentalmente que
una vez que el ADP y el fosfato son acoplados al dominio catalítico de la f1f0
ATP sintetasa, los dos reactantes se condensan rápidamente, formando una
molécula de ATP sin la necesidad de adicionar energía extra. En otras palabras,
aunque la formación de ATP podría requerir una considerable cantidad de energía
(cerca de 7.3 kcal/mol bajo condiciones estándar), la reacción puede ocurrir
espontáneamente sin la aplicación de energía directa. Esto no significa que la
obtención de ATP sea gratuita, sino que la energía se aplica para generar una
forma de la región activa que coloque de manera muy cerca a los reactivos para
que la reacción se dé.
10.5 Estructura de los dominios
de síntesis de ATP de la mitocondria
Se tiene evidencia de que la conformación
estructural de los tres dominios que sintetizan ATP es diferente poseyendo una
afinidad por los reactivos “ADP y fosfato inorgánico” y el producto “ATP”
totalmente diferente. Para explicar esta contradicción, se ha propuesto que
cada uno de los tres dominios catalíticos pasa secuencialmente por las tres
diferentes conformaciones, en otras palabras, cambian de forma a medida que se
da el proceso de reacción. A medida que el eje gamma gira en el centro, la
energía se transfiere alternativa entre cada uno de los dominicos de la
reacción haciéndolos pasar alternativamente por tres conformaciones diferentes.
Aunque sacar videos de un lugar
creacionista no es mi estilo, la animación es correcta y simplemente demasiado
ilustrativa para dejarla pasa. Sin embargo, la conclusión final posee un vicio
de fondo, pues asume que la única forma de fosforilar ATP es mediante la f1f0
ATP sintetasa, omitiendo la existencia de la fosforilación de sustrato que
ocurre en la glucólisis y que definitivamente es más antigua.
10.6 Síntesis rotativa de ATP
en la mitocondria
La síntesis de ATP se da mediante una
catálisis rotacional en la que una parte
de la ATP sintetasa rota de forma relativa a otra parte. Y decimos relativa
porque en verdad una se queda quieta y otra gira. La parte motil f0 transfiere
energía a través del eje de trasmisión ha f1. En este modelo, la rotación es empujada
por el flujo de iones protio(1+) “protones” a través de la membrana a través
del canal de protones en la base f0. En
este orden de ideas la energía almacenada en el gradiente de concentración y la
enorme presión electro-osmótica de la región intermembranal. La energía
electro-osmótica es transferida a energía mecánica “literalmente” en forma del
movimiento giratorio de f1, y finalmente transferida a energía química en forma
de ATP. Por consideraciones termodinámicas, cada transferencia de energía es
ineficiente y se pierde algo en forma de calor, por lo que de la energía
almacenada en la región de intermembranas, solo una fracción es convertida a
ATP. “Esto explica porque la producción de ATP está asociada a la producción de
calor”.
10.7 Mecanismo de enlace y
cambio para la síntesis de ATP de la mitocondria
Las tres conformaciones de la subunidad f1
de la ATP sintetasa se denominan alternativamente O, L y T. A medida que el eje
de transmisión gama gira dentro de f1, su energía se transfiere a los dominios
de f1 cambiando su forma de manera secuencial. La conformación O se denomina
abierta “Open”, la conformación L se denomina suelta “Loose”, y la conformación
T se denomina firme “Tight”. En la conformación abierta “O”, el domino
catalítico se encuentra abierto a la unión con los reactivos, es decir posee
una alta afinidad por el fosfato inorgánico y el ADP como especies químicas
independientes. Una vez que la conformación abierta se une a los reactivos, el
flujo de iones protio(1+) en f0 induce un cambio de conformación del dominio
catalítico a medida que f1 gira. En este punto el dominio catalítico adquiere
la conformación suelta “L” donde empieza a inducirse la reacción de enlace
entre el grupo fosfato y el ADP.
Figura 10.4. (YouTube)
Funcionamiento de la ATP sintetasa.
Nuevamente, con el flujo de más iones protio(1+) a través del domino f0, la cabeza f1 sigue girando, lo cual índice un nuevo cambio en el dominio catalítico a la conformación firme induciendo la reacción final hacia el ATP. Finalmente el paso de más iones protio(1+) causa que la cabeza f1 vuelva a girar, causando el cambio de conformación del domino catalítico hacia la conformación suelta, la cual es poco afín al ATP, lo cual permite su liberación del dominio catalítico.
Figura 10.5. (a) Secuencia
de cambio de forma de los dominios, (b) relación entre los tres dominios
catalíticos y el eje central gamma. El eje central gamma no es simétrico, lo
cual permite estimular a los dominios catalíticos a medida que va girando por
acción del dominio f0.
11. El ejercicio y la respiración aeróbica
|| Regresar al Índice ||
¿Cualquier tipo de ejercicio consume
grasa? ¿Cuánta energía consume un músculo? Estas son preguntas pertinentes para
alguien que pretende bajar de peso, o por lo menos no engordar tanto.
Figura 11.1. (YouTube) metabolismo y nutrición.
Resulta que no todo ejercicio es útil para
quemar la grasa de forma metabólica, sin embargo, mejor comenzamos por el
principio. Una sola célula muscular requiere 600 trillones de moléculas de ATP
por segundo para que todas sus fibras generen una contracción útil. Cuando consideramos
que incluso los músculos más pequeños contienen miles de células se hace claro
que la contracción muscular requiere enormes cantidades de energía almacenada.
La pregunta es ¿de dónde viene todo este ATP?
Figura 11.2. (YouTube) Ejercicio aeróbico y anaeróbico
Nuestros músculos tienen diversos mecanismos de almacenamiento de energía, los cuales se activan de forma secuencial a medida que se consume la energía. Una analogía útil es la del presto leño del doctor Brawn (Volver al futuro III), en esta analogía existen tres leños que se activan secuencialmente cuando la locomotora alcanza ciertos requerimientos de temperatura y tiempo de movimiento, el primer leño es más débil y el último es más potente.
Figura 11.3. Los
presto-leños de volver al futuro III son una analogía a la activación
secuencial de energía en el cuerpo de los seres vivos. En esta analogía: Blanco
= ATP libre; verde= Fosfato de creatinina; amarillo= glucósa y otros azúcares;
rojo "aeróbico" = grasa. El cuerpo humano posee cuatro almacenes de
energía, al igual que los presto leños del doctor Brown se activan
secuencialmente, primero el más débil y por último el más potente.
11.1 Primera velocidad
ATP disuelto en la matriz citoplasmática
de la célula muscular. Se agota en 6 segundos después de ejercicio vigoroso.
Los demás almacenes de energía tienen como objeto regenerar constantemente el
ATP ya que es la molécula encargada de activar a la miosina. Si se acaba el ATP
el músculo no responderá por más órdenes que él envíe el sistema nervioso.
11.2 Segunda velocidad
Fosfato de creatinina almacenado en las
células musculares. Se agota 10 segundos después de que el ejercicio vigoroso
provocara la crisis de ATP “llevamos 16 segundos”. Químicamente la creatinina
fosfato es un compuesto de alta energía que transfiere un grupo fosfato para
sintetizar ATP. Los ejercicios que requieren altísimos picos energéticos y
descansos prolongados como el levantamiento de pesas son alimentados casi
exclusivamente por creatinina como principal restaurador del ATP. Por esta
razón no hay quema de grasa, lo cual explica que los levantadores de pesa, a
pesar de ser los más fuertes del mundo también sean redonditos y pachoncitos.
11.3 Tercera velocidad
Glucosa y otros azúcares degradables
rápidamente a ATP de forma anaeróbica. Si el levantamiento de pesas se prolonga
más o se realiza una carrera de larga velocidad un poco más prolongada el
cuerpo hecha manos de las rutas metabólicas de alta velocidad, especialmente la
glucólisis. Cerca del 1.5% de la masa de una célula muscular consiste en un
almacén de glucosa llamada glucógeno. Una vez que los niveles de creatinina
bajan las enzimas de la célula convierten el glucógeno en glucosa que ingresa
en glucólisis.
Nuevamente esto tiene un límite, si el
ejercicio se prolonga más de unos 15 minutos los niveles de metabolitos
secundarios puede hacerse peligroso para las células, y en consecuencia se
inicia el uso de las rutas metabólicas lentas. Pero si se descansa a menos de
15 minutos el ácido láctico retornará al hígado donde se transforma de nuevo en
glucógeno y de allí es reenviado a los músculos. Esto implica que, si se
interrumpe el ejercicio, creando lapsos de ejercicio de 15 minutos o menos, se
generará una rutina anaeróbica. La diferencia entre una ruta metabólica rápida
y anaeróbica y una ruta lenta y aeróbica a parte del uso del oxígeno es
precisamente la tasa de producción de ATP. Las rutas anaeróbicas producen 2.5
veces más ATP por segundo, pero tienden a consumir las reservas de energía y a
producir metabolitos secundarios tóxicos para las células como el ácido
láctico.
El músculo esquelético humano consiste
generalmente en dos tipos de fibras. Fibras de cambio rápido que se pueden
contraer a gran velocidad (15-40 milisegundos); y fibras de cambio lento, que
se contraen de una forma más lenta (40-100 milisegundos). Las fibras de cambio
rápido cuando se lo ve al microscopio se encuentran prácticamente despojadas de
mitocondrias, lo cual implica que estas células son incapaces de producir
suficiente ATP por oxidación para ejercicios prolongados. Las fibras de cambio
rápido por el contrario contienen una alta concentración de mitocondrias, lo
cual a su vez implica que pueden generar ATP cuando se requiere a un largo
plazo.
Estos dos tipos de fibras musculares están
adaptadas para dos tipos de actividades diferentes. Por ejemplo, el
levantamiento de pesas o la carrera a corta distancia depende principalmente de
las fibras de cambio rápido. Estas fibras tienen el potencial de generar más poder,
pero por un periodo de tiempo más corto, antes de quedarse sin energía. Las
fibras de cambio rápido obtienen prácticamente todo su ATP mediante metabolismo
anaeróbico “si, los seres humanos también podemos emplear reacciones
metabólicas anaeróbicas como las fermentaciones”. Toda fermentación obtiene su
energía en su fase de glucólisis, mientras que sus reacciones finales
fermentativas consumen parte de la energía y sirven más para la excreción de
desechos que otra cosa.
Es por esto que la energía obtenida por
las fermentaciones es igual a la obtenida por la glucólisis menos la consumida
por la fermentación, generalmente es solo 2 ATP por molécula de glucosa. La
glucólisis produce solo un 5% de la energía en forma de ATP en comparación con
la respiración celular aeróbica, sin embargo, la glucólisis a pesar de producir
menos energía en términos absolutos, posee una ventaja critica, y es que puede
producir mas energía en una menor cantidad de tiempo. Las consecuencias de
producir mucha energía por fermentación en los humanos es que se consume muy
rápido la glucosa y se genera una alta producción del producto de excreta de la
fermentación, en nuestro caso, ácido láctico.
11.4 Descanso y arranque en
primera antes de 15 minutos
Recuérdese que la fermentación son unas
reacciones acopladas a la glucólisis, de modo tal que se evitan los efectos
tóxicos de este tipo de metabolismo en dos factores, agotamiento del portador
de energía NAD+ y excreción del producto tóxico piruvato cuando este
no es oxidado posteriormente por la mitocondria. Las fermentaciones lácticas
convierten el piruvato en ácido láctico para excretarlo de forma segura
empleando NADH:H+ y convirtiéndolo en NAD+. La mayoría del
ácido láctico se difunde a graves de las células musculares a los capilares y a
la sangre, donde es enviado al hígado. Una vez en el hígado el ácido láctico no
es excretado, esto es porque esta molécula aun almacena cantidades importantes
de energía, pero no puede ser oxidado desde ese punto.
En el hígado, se emplea una pequeña
cantidad de energía para reconvertir el ácido láctico en glucosa por la runa de
la gluconeogénesis, y se reenvía de nuevo a los tejidos. Sin embargo la
producción de energía a altas velocidades no viene de manera gratuita, la
liberación de ácido láctico baja el pH del músculo, con el incremento de iones
protio(1+), y el mero rose mecánico de las fibras generan efectos nocivos como
sensación de calor o quemazón en el tejido, destrucción de fibras y sensación
de dolor. La fatiga muscular se genera entonces por el efecto conjunto de la
disminución de energía en forma de glucosa, ATP y fosfato de creatina,
adicional a los efectos por intoxicación tisular ácida “suena feo, pero es la
fisiología normal, no es que alguien se pueda morir de esto… generalmente”.
El hígado es bastante efectivo en la
regeneración de la glucosa, por lo que aun descansos leves como los que hacemos
cuando “intentamos hacer aeróbicos” generan la glucosa, creatinina y ATP
muscular, por lo que jamás se ejecuta la ruta aeróbica. Hacer ejercicio intenso
con descansos esporádicos cada 10 o 15 minutos se conoce en consecuencia como
ejercicio anaeróbico ya que solo usa las rutas de glucólisis, fermentación
láctica y gluconeogénesis.
Figura 11.4. El
levantamiento de peso no es un ejercicio aeróbico que consuma grasa.
11.5 Cuarta velocidad,
aeróbico.
Grasa, esta solo puede ser degradada por
la ruta de la beta oxidación, la cual requiere oxígeno para funcionar pues se
conecta directamente al ciclo de Krebs. Dado que el ciclo de Krebs solo “gira”
si su cadena de transporte de electrones de alta energía encuentra oxígeno, la
regeneración del ATP para el movimiento depende de que el cuerpo suministre cantidades
adecuadas de oxígeno a los músculos en movimiento, de allí proviene el nombre
de los ejercicios que queman grasa, pues al requerir oxígeno contenido en el
aire son “¡Aeróbicos!”. Químicamente el oxígeno es transportado por la
hemoglobina o almacenado en los músculos en forma de mioglobina en los
mamíferos y otros vertebrados.
Figura 11.5. (YouTube)
Cómo aguantan las ballenas y focas tanto tiempo bajo el agua
La mioglobina es un banco de oxígeno que
alimenta la quema de grasa, el ejercicio continuo consume más oxígeno del que
podría alimentar la hemoglobina por si sola. Esto explica porque después de
realizar ejercicio intenso, el cuerpo sigue respirando de forma agitada por
unos minutos. Existe una deuda de oxígeno con la mioglobina, que debe restaurar
sus niveles de oxígeno antes de que el cuerpo pueda recuperar sus niveles
homeostáticos de presión sanguínea y respiración.
La pregunta mágica es ¿cuánto tiempo pasa
para empezar a consumir grasa en lugar de azúcar durante el ejercicio aeróbico?
A medida que es más largo el ejercicio, mayor será la dependencia de los ácidos
grasos. Después de 20 minutos de ejercicio vigoroso, se estima que cerca del
50% de las calorías consumidas por el musculo se derivan de la grasa, por lo
que aun después de 20 minutos el hígado aún se niega a dejarnos adelgazar. El
radio entre fibras de cambio rápido y de cambio lento varían dependiendo del
individuo, debido a variables genéticas y de entrenamiento. Ciertos individuos
y ciertos ejercicios favorecen un tipo de crecimiento de fibras sobre otro.
Figura 11.6. Dos tipos de
carrera diferente, requieren cuerpos diferentes, aunque ambos sean
profesionales. El individuo de la izquierda es un velocista con un cuerpo de
metabolismo anaeróbico muy tonificado, mientras que el de la derecha es un
maratonista con un metabolismo aeróbico más apto para resistir carreras muy
largas por mucho tiempo sin descansar.
11.6 Metabolismo humano y el
ejercicio, construir músculo o quemar grasa
Aunque existen planteamientos diferentes
para la causa de la fatiga muscular, asumiremos el que fue explicado en el
artículo anterior. La diferencia de las fibras implica una diferencia entre
catabolismo (fermentativo y oxidativo: degradación de tejido graso) y en
anabolismo (construcción de músculo). El ejercicio anaeróbico genera daños en
las fibras musculares con facilidad, pero estos con el tiempo se regenerar con
un mayor grosor, lo cual favorece el crecimiento del músculo de cambio rápido.
Esto implica que ejercicios como el
levantamiento de pesas incrementa musculo, incrementando poder instantáneo pero
generando un estasis o una pérdida de resistencia. Este tipo de ejercicio no
consume grasa, construye musculo que de manera indirecta puede consumir grasa
al incrementar el nivel de consumo metabólico pasivo del individuo. El
entrenamiento en las fibras de cambio lento posee características opuestas. Sus
fibras contienen altos niveles de mitocondria, lo cual favorece el metabolismo
oxidativo aeróbico, inicialmente de la glucosa. Sin embargo, los niveles de
glucosa y otros azucares oxidables es bajo en las células, por lo que
rápidamente la fuentea oxidar cambia a los ácidos grasos.
Este tipo de ejercicio se denomina
aeróbico debido a que hace uso del metabolismo aeróbico mediante ejercicios de
resistencia a largo plazo. Las fibras de cambio lento generan menos poder, pero
se agotan menos debido a una producción inferior de ácido láctico. Un caso
especial de fibras de cambio lento es el musculo cardíaco el cual solo puede
derivar su energía por respiración celular aeróbica. Debido a esto, unos bajos
niveles de oxígeno son tan perjudiciales para el musculo cardíaco.
11.7 Haciendo trampa
Cuando las células son tratadas con
agentes solubles en lípidos como el 2,4-dinitrofenol (DNP) las células se hacen
incapaces de sintetizar ATP aun cuando siguen oxidando los sustratos
metabólicos como los lípidos. En otras palabras, el DNP desacopla la glucólisis
de la fosforilación oxidativa en la mitocondria. Debido a esto el DNP se ha
convertido en un agente para el desacople del metabolismo en el laboratorio
desde hace poco más de 100 años. Durante la década de los 1920 algunos médicos
emplearon píldoras con DNP para el tratamiento de la obesidad. Cuando los
pacientes eran expuestos a este medicamento, sus cuerpos empezaban a oxidar sus
reservas de grasa en un intento por mantener los niveles de ATP en el mínimo
necesario para seguir viviendo. Esta práctica fue proscrita debido a la muerte
de numerosos pacientes (Colman, 2007; Durazo et al., 2004;
Grundlingh, Dargan, El-Zanfaly, & Wood, 2011; Miranda, McIntyre, Parker,
Gary, & Logan, 2006).
El mecanismo del DNP funciona uniéndose a
los iones protio(1+), debido a su solubilidad en lípidos, incrementa el
transporte pasivo de iones protio(1+) de regreso a la matriz mitocondrial. A
largo plazo esta molécula provocaba que no se generara la acumulación de iones
protio(1+) en el espacio intermembranal, por lo que se hacía imposible la
síntesis de energía. La última proteína de la respiración celular aeróbica se
denomina F1F0 ATP sintetasa, y requiere que la región intermembranal posea un
exceso de iones protio(1+), los cuales al pasar a través de ella la hacen girar
y le permiten sintetizar energía, similar a como un dinamo produce energía por
medio de una cascada en una planta hidroeléctrica.
Para que el proceso sea eficiente, la
membrana interna de la mitocondria, y también la externa deben ser ampliamente
impermeables a los iones hidrogeniones, de este modo su única salida se
convierte en la f1f0 ATP sintetasa conllevando a la síntesis de energía. Si las
membranas pierden esta impermeabilidad, la presión osmótica y quimiosmótica
provocaría un trasporte pasivo forzado a través de ambas membranas
mitocondriales, liberando la energía en forma de calor, e impidiendo a la f1f0
ATP sintetasa poder girar. “es como si alguien vaciara el embalse que le
proporciona a la planta hidroeléctrica su poder por una zona diferente al ducto
de las turbinas”. A las sustancias que incrementan la permeabilidad de las
membranas mitocondriales al transporte pasivo de iones protio(1+) se las
denomina desacopladores de la fosforilación oxidativa.
Recientemente ha resultado sorpresivo que
ciertas células poseen desacopladores de la fosforilación oxidativa de manera
natural. En los bebes humanos por ejemplo, su tejido graso posee una cantidad
importante de estos desacopladores llamados proteínas de desacoplamiento (o UCP
por sus siglas en inglés). Los bebes
emplean los UCP para generar calor a partir de los gradientes de iones
protio(1+) de la región intermembranal sin que intervenga el ATP mediante un
mecanismo similar al del DNP. A medida que las personas crecen pierden estas
proteínas, debido a que los adultos generan calor debido a la fricción e
ineficiencia metabólica de los músculos. Actualmente las proteínas de
desacoplamiento de la fosforilación oxidativa se ha convertido en el foco de
investigación de las compañías farmacéuticas con el objeto de crear medicamentos
que sean análogos a la función de estas proteínas en los bebes humanos. De esta
manera se emplearía la grasa corporal para generar calor sin necesidad de hacer
ejercicio.
12. Resumen de la respiración celular aeróbica
|| Regresar al Índice ||
12.1 Ciclo de Krebs
En resumen, el ciclo de Krebs es una serie de reacciones en la cual un grupo metil- altamente energético se une a un compuesto de cuatro carbonos que es un ácido dicarboxílico para formar un ácido tricarboxílico. Resulta interesante que a pesar de que el ciclo adquiere su nombre debido a este ácido tricarboxílico, solo hasta la reacción que forma alfacetoglutarato es que persiste esta configuración de 6 carbonos, y de hecho en la reacción subsecuente se genera un ácido dicarboxílico. Esto se debe a que a medida que se extrae energía en forma de portadores como NADH también son liberados carbonos de la cadena. La energía química se encuentra almacenada en forma de los enlaces C-C por lo que, al ser transferida, el enlace debe romperse.
Figura 12.1. Resumen del
ciclo de Krebs.
Como productos del ciclo tenemos de manera
neta dos moléculas de dióxido de carbono que son liberadas al torrente
sanguíneo “el dióxido de carbono puede atravesar las membranas mitocondriales y
celular por transporte pasivo”. En términos energéticos también son liberados
tres protones cuya importancia será revelada en la cadena de transporte de
electrones, así como 5 NADH:H+, una molécula de FADH2 un
ATP y la liberación de la coenzima A. En términos de ATP, cada molécula de NADH
puede alimentar la síntesis de 2.5 ATP posteriormente en la cadena de
transporte de electrones, mientras que una de FADH2 alimenta la
síntesis de 1,5 ATP.
Sin embargo, existen otros factores a
tener en cuenta en la síntesis final de ATP durante la cadena de transporte de
electrones que serán discutidos en próximos temas. El ciclo de Krebs es de
importancia crítica en una gran cantidad de rutas metabólicas, de hecho, alguno
de sus componentes e incluso reacciones pueden estar presentes en otras rutas
metabólicas. Este detalle nos lleva a poder realizar ciertas hipótesis.
El ciclo de Krebs puede verse desde la
perspectiva del DI como un sistema de múltiples partes integradas en la que
cada parte del ciclo sirve para un todo, y que al ser cíclico debería haberse
formado de una manera completa, sin embargo, el mero hecho de que varias partes
del ciclo puedan encontrarse en otros contextos en la misma célula nos permite
dudar sobre la irreductibilidad del ciclo, lo cual es el tema del siguiente
artículo.
12.2 Cadena de transporte de
electrones
En términos simples, una cadena de
transporte electrones consiste en cuatro complejos de proteínas que poseen
grupos prostéticos capaces de transferir electrones en línea como si se tratara
de una red eléctrica. Existen otros dos conductores de electrones que permiten
la conexión entre los complejos de proteínas llamados ubiquinonas y el
citocromo c, los cuales se disponen de manera independiente a los complejos.
Los electrones de alta energía ingresan a la cadena de transporte de electrones
por dos vías diferentes dependiendo de qué coenzima los transporta. El NADH:H+
deposita sus electrones de alta energía a la altura del complejo I, mientras
que el FADH2 lo hace a la altura del complejo II al cual había
permanecido unido desde su formación durante el ciclo de Krebs.
Figura 12.2. (YouTube) Cadena respiratoria.
Los electrones son subsecuentemente
transferidos desde un complejo a otro oxidando y reduciéndose de manera alterna
de modo que siempre existe un flujo continuo de electrones hasta su destino
final. El aceptor final de electrones que han sido despojados de su energía es
el oxígeno, el cual al adquirirlos reacciona con los iones protio(1+) de la
solución interna de la matriz mitocondrial para formar agua. Cuando el oxígeno
reacciona, la presión osmótica del interior de la mitocondria disminuye
permitiendo el ingreso de más oxígeno para las subsecuentes rondas de la
respiración. Debido a que el FADH2 deposita sus electrones en el
complejo II tiene un menor poder de síntesis de energía que el NADH:H+.
12.3 Fosforilación oxidativa
Para evitar que la membrana se rompa por
la presión osmótica y eléctrica, los iones protio(1+) deben regresar, pero lo
hacen de manera controlada por medio de un canal de protones especializado
llamado F1F0 ATP sintetasa, la cual aprovecha la fuerza electro-osmótica que
genera el regreso de los protones para sintetizar ATP a partir de ADP y fosfato
inorgánico. De esta manera se aprovechan todos los protones que fueron transferidos
de un lado a otro de la membrana durante la cadena de transporte de electrones.
12.4 Rendimiento energético
La respiración celular aeróbica ocurre en
bloques, lo cual nos da ciertas pistas de su construcción evolutiva a lo largo
del tiempo. La glucólisis su parte inicial y la más antigua, se caracteriza por
sintetizar ATP por fosforilación a partir de sustrato, así como dos moléculas
de NADH. La segunda parte es el ciclo de Krebs que se caracteriza por una
fosforilación a partir de sustrato (2 ATP) y la producción de una alta cantidad
de portadores de protones y electrones de alta energía, principalmente NADH:H+
(8 moléculas) y FADH2 (2 moléculas). Estas moléculas son empleadas
en la cadena de transporte de electrones, que se emplean para potenciar a la f1f0
ATP sintetasa. Finalmente el ATP es sintetizado por la f1f0 ATP sintetasa.
No nos molestaremos con el cálculo teórico
por una simple razón, este varía, debido a varios procesos de transferencia de
energía que aminoran el rendimiento energético. Teóricamente la respiración
celular aeróbica produce 38 ATP, pero esto es solo si todos los NADH son
capaces de impulsar la misma cantidad de síntesis de ATP sin importar en donde
se generan.
Los cálculos de rendimiento de la
respiración celular aeróbica son una franca pérdida de tiempo, ya que en la
realidad depende del organismo. Teóricamente el rendimiento debería ser de 38
ATP, pero en la realidad la cantidad varía entre 28 a 32 ATP, con otros valores
inclusive. Muchas causas aplican para estas variaciones como por ejemplo
pérdida de energía del NADH:H+ cuando atraviesa la membrana para
llegar a la cadena de transporte de electrones. Sin embargo el punto sigue
siendo el mismo, la ganancia mínima de la respiración celular aeróbica es de 28
ATP en lugar de los 2 ATP que ofrece la fermentación (Niknamian, 2016; Rich, 2003).
Por las razones anteriores consideramos
que es inútil hacer memorizar al estudiante un valor ideal, lo importante es
reconocer las características esenciales en cada una de las fases de este gran
proceso.
13. Evolución de la respiración aeróbica
13.1 Ciclo de Krebs
La evolución biológica es un proceso
conservativo a pesar de estar basado en mutaciones. En cierto sentido este
tiene sentido debido a que las mutaciones son eventos raros, así que resulta
más eficiente reclutar componentes viejos a nuevos contextos que crear
componentes completamente nuevos desde el caos del ADN no codificante contando
con que la célula en cuestión posea este tipo de genoma “muchas bacterias
carecen de él”. A medida que pasa el tiempo, las condiciones del ambiente
cambian o existen ambientes que aún no
son explotados por nadie En este contexto los organismos reclutan componentes
preexistentes para realizar nuevas funciones (Baughn & Malamy, 2002;
Meléndez-Hevia, Waddell, & Cascante, 1996).
A pesar de que uno podría pensar de que un componente vital a que genera un proceso vital A (a → A) no puede evolucionar a una función B sin sacrificar la función original y por lo tanto la existencia misma del organismo, la solución a esto se da por duplicación de genes, de esta manera el gen original genera la función basal vital mientras que el nuevo gen a´ puede realizar la nueva función (a → A; a´→ B)
Figura 13.1. Ramas de dos
rutas metabólicas que pueden generarse a partir del puruvato, en una se
regenera NAD+ a partir de NADH:H+, y en la otra se da el
proceso inverso. Si se tienen ambas rutas la célula puede ajustar de una mejor
forma su equilibrio NAD+/ NADH:H+.
Como resultado de los análisis genómicos y
bioquímicos un gran número de especies de eucariotas y de cepas de procariotas
han comenzado a mostrar las piezas del rompecabezas que dieron origen a ciclo
de Krebs como un todo. Si empleamos los conceptos de las teorías evolutivas
clásicas, se debe encontrar versiones más simples del ciclo de Krebs, pero ¿qué
versión más simple se puede pensar de un ciclo?, es como pensar en un arco sin
la piedra angular, todo se caería, ¿cierto? Esta analogía funciona para un
sistema mecánico, pero estamos hablando de reacciones aquí, y de hecho de un
proceso de reacciones muy conocido, en contraste a otras rutas metabólicas poco
conocidas, de esta manera, debemos abandonar la idea de que medio ciclo no
sirve para nada.
La idea es dejar de visualizar al ciclo
como tal, y analizar series o secciones del ciclo y ver si están involucradas
en otras rutas metabólicas. Esta es una hipótesis muy concreta extraída de la
teoría, una hipótesis empírica de hecho, en lugar de escondernos en análisis
filosóficos y abstractos simplemente se debe analizar en la literatura por la
existencia de seres vivos que empleen secciones del ciclo en otros contextos.
Más aun, en base al análisis hecho previamente de las reacciones individuales
del ciclo de Krebs, especialmente la última reacción ofrecen un detalle, son
reacciones reversibles, por lo que un fragmento del ciclo de Krebs podría estar
operando en el sentido contrario en otro contexto, la reversión de la reacción
obedece en mucho a las concentraciones de productos y reactivos, por lo que la
integración de los fragmentos de un ciclo no requeriría mayores modificaciones
en la ruta que originalmente se originó en el sentido inverso al cual la
conocimos en el ciclo de Krebs.
La hipótesis más soportada actualmente es
la que establece al origen del ciclo como dos rutas metabólicas independientes
y no dependientes de la cadena de transporte de electrones, por lo que su
evolución podría realizarse en ausencia de oxígeno, es decir en ambientes
anaeróbicos. La rama oxidativa constituye las reacciones desde la síntesis del
citrato hasta el alfacetoglutarato, esta serie de reacciones producen el
portador de energía NADH:H+ el cual puede emplearse para impulsar
las fermentaciones u otras respiraciones celulares dependientes del azufre en
lugar del oxígeno. La segunda rama es más interesante ya que opera en sentido
inverso, al ser una ruta reductora consume energía para sintetizar una molécula
de alta energía y regenerando NAD+ para que la glucólisis pueda
seguir operando, y podría vérsela como el eslabón perdido entre la fermentación
y la respiración aeróbica.
La utilidad evolutiva radica precisamente
en el problema de toxicidad del ácido pirúvico, recuérdese que en el contexto
de las fermentaciones el procesamiento del ácido pirúvico simplemente se trata
de sacrificar energía en forma de NADH:H+ para formar NAD+
y expulsarlo de la célula en forma de ácido láctico. En base a esto, cualquier
uso que se le diera al piruvato sería una ventaja para la célula portadora,
pues es darle uso a un desecho.
13.2 De la fermentación a la
cadena de transporte de electrones
Dos funciones son las que hacen que un ser
vivo sea clasificado como tal al nivel celular, la primera es la capacidad de
autoreplicación y la segunda es la capacidad de mantener un ambiente interno
mediante el uso controlado de la energía. La energía por lo tanto se convierte
en uno de los ejes primordiales que determinan las adaptaciones y necesidades
de los seres vivos, fundamentalmente todos los seres vivos están ávidos de
energía. Existen dos métodos fundamentalmente diferentes para la generación de
energía a partir de los sustratos alimenticios como la glucosa, la primera es
la fosforilación al nivel de sustrato que puede realizarse durante la
glucólisis para formar ATP o durante el ciclo de Krebs generando también ATP
mediante una ruta indirecta con GTP (Björn,
Papageorgiou, Dravins, & Govindjee, 2009; Gorbushina, 2007; Pace, 2001; J.
A. Raven, Andrews, & Quigg, 2005; J. Raven & Skene, 2003).
El segundo mecanismo para la síntesis de
ATP requiere del acoplamiento de varias proteínas que funcionan como bombas de
protones, la mayoría en el sentido del transporte activo y la última en el
sentido del transportepasivo facilitado. La pregunta del millón es, ¿cómo algo
tan complejo e integrado como la cadena de transporte de electrones pudo surgir
mediante mutaciones fortuitas y selección natural?, como siempre, cada uno de
los pasos propuestos deben ser funcionales en sí mismos, aun cuando la función
que ejecuten sea diferente a la función definitiva que pretendemos explicar (Bruce Alberts et al., 2002; De Duve
& Pizano, 1995).
Una de las características de la glucólisis
como vimos anteriormente es que siempre está acoplada a una fermentación. La
fermentación convierte al piruvato en especies químicas menos toxicas para la
célula no aeróbica y permite expulsarlo fuera de la célula. Los productos
excretados no solo consumen energía celular “muestra de la imperiosa necesidad
de la célula de deshacerse del piruvato producto de la glucólisis y todos sus
derivados metabólicos” sino también son ácidos, ácidos de Bronsted. Los ácidos
de Bronsted son especies químicas que liberan protones al medio, en un medio
acuoso como en el que viven las bacterias estos protones reaccionan con el agua
para formar iones protio(1+) que son los responsables del poder corrosivo y
denaturante de los ácidos. Entre mayor es la concentración de iones protio(1+)
más corre la célula riesgo de que sus proteínas integrales de membrana se
denaturen y su membrana pierda cohesión. Mucho antes de que eso pueda suceder,
la presión osmótica haría ingresar a los iones protio(1+) al interior de la
célula matándola (Bruce Alberts et al., 2002; De Duve
& Pizano, 1995).
Debido a la evolución de la fermentación
se generaría una presión de selección que favorecería la evolución de bombas de
protones, proteínas que impiden que los iones protio(1+) ingresen a la célula,
pues de lo contrario la matarían mucho más rápido. En la parte externa la
célula desarrollaría otras formas de protegerse de esta acidez, como el uso de
envolturas externas, pero lo importante es la presión a la evolución de las
bombas de protones mediadas por transporte activo, justo el mismo tipo de
función que realizan 3 de los complejos de la cadena de transporte de
electrones (Bruce Alberts et al., 2002; De Duve
& Pizano, 1995).
13.3 Cadena de transporte
Tanto la respiración celular aeróbica como
la fotosíntesis dependen en alguna etapa de sus procesos de la cadena de
transporte de electrones, por lo que contar con una explicación para su origen
evolutivo gradual, paso a paso es fundamental para tener un marco de referencia
naturalista de todos estos sistemas bioquímicos. La temprana evolución de la
fermentación hubiera provisto no solo la formación de ATP, sino también el
poder reductor en forma de NADH o NADPH requeridos para la biosíntesis
esencial. Sin embargo, las necesidades de no morir por su propia alimentación
hicieron que las fermentaciones excretaran grandes cantidades de ácido al
ambiente, y con el tiempo, el microambiente de estas bacterias se tornaría
tremendamente ácido. En base a lo anterior pueden postularse varias fases
evolutivas (B Alberts et al., 2015; Bruce
Alberts et al., 2002; Blankenship, 2002, 2010; Brack, 1998; Gargaud, Martin,
López-García, Montmerle, & Pascal, 2012; Hohmann-Marriott &
Blankenship, 2011; Sepúlveda, Ortiz, & Holmes, 2015; Xiong, Fischer, Inoue,
Nakahara, & Bauer, 2000).
👉 Fase 1: La excreción continua de ácidos disminuye el pH del ambiente
externo de la célula favoreciendo la evolución de bombas de protones que
mantiene el ambiente interno de la célula libre de iones protio(1+)
reingresando debido al transporte pasivo. Una de estas proteínas, es una
proteína giratoria que puede hidrolizar ATP para girar y forzar la salida de
iones protio(1+) de la célula. Esta proteína se convertiría en el ancestro del
flagelo y de la proteína que sintetiza energía en el final de la cadena de
transporte de electrones (Alberts et al., 2002).
👉 Fase 2: Con el incremento de la presión a
exportar protones, se favorecerían sistemas redundantes para la expulsión de
iones protio(1+), por lo que a parte de las bombas de protones mediadas por ATP
evolucionarían paulatinamente otras bombas de protones que emplearían
electrones de alta energía para exportar iones protio(1+) de manera individual.
De hecho algunas bacterias acidófilas sobreviven actualmente en estos ambientes
ácidos gracias a la conjunción de bombas de protones mediadas por electrones de
alta energía asi como por bombas de protones mediadas por ATP (Alberts et al.,
2002).
La fuente de energía en estos casos no es el ciclo de Krebs, sino algunos ácidos no fermentables de los que puede extraerse poder reductor en forma de NADH. Otras lo logran a partir de la extracción de electrones de alta energía de fuentes inorgánicas minerales. De manera concomitante, aquellas bombas de protones que pudieran funcionar de manera integrada mediante el flujo de un mismo par de electrones ahorrarían energía celular y por lo tanto serian seleccionadas para formar una cadena (Alberts et al., 2002).
Figura 13.2. Existe una amplia diversidad de cadenas de transporte de electrones que pueden emplear a otros portadores de protones como NADPH que a su vez obtienen sus electrones de fuentes minerales. Del mismo modo el aceptor final de la cadena de transporte de electrones puede ser otras especies químicas diferentes del oxígeno (Alberts et al., 2002).
Figura 13.3. Faces de
evolución de la cadena de transporte de electrones. (1) evolución de una bomba
de protones mediada por ATP. (2) evolución de bombas de protones mediadas por
flujo de electrones. (3) integración de las bombas mediadas por electrones y
liberación de las bombas mediadas por ATP para sintetizar energía al dejar
ingresar iones protio(1+) por transporte pasivo facilitado (Bruce Alberts et
al., 2002).
👉 Fase 3: Eventualmente algunas bacterias perfeccionarían estas cadenas de
forma tal que podrían exportar más iones protio(1+) de lo que necesitan para
mantener su ambiente interno. Esto liberaría a las bombas de protones
giratorias mediadas por ATP para hacer la reacción opuesta, es decir en lugar
de romper ATP para expulsar iones protio(1+), girarían en el sentido opuesto
sintetizando ATP a medida que dejan ingresar iones protio(1+) para mantener sus
condiciones de pH interno normales. Ahora esta nueva célula tendría una nueva
fuente de energía, lo cual la haría proliferar de manera más eficiente que sus
competidores, siempre y cuando encuentre aceptores finales para los electrones,
de modo tal que se libere toda su energía en las cadenas de transporte. Varios
minerales son empleados para esta tarea, entre ellos el oxígeno (Bruce Alberts
et al., 2002).
Otros aceptores finales de electrones son
el hierro ferroso, el manganeso IV, el cobalto III, el uranio VI, los nitratos,
el sulfato, el azufre, el fumarato entre otros. Muchas de estas sustancias son
difíciles de encontrar o son empleadas en otros procesos de importancia de la
célula, es por esto que solo hasta la producción de cantidades masivas de
oxigeno que la cadena de transporte de electrones con base en oxígeno adquirió
preponderancia “eso sin contar que al convertir al oxígeno en agua, esta cadena
de transporte de electrones funcionaria también como mecanismo de defensa
contra los efectos venenosos del oxígeno” (Alberts et al., 2002).
13.4 Máquinas rotativas, analogías
y distribución filogenética
Las
maquinas rotacionales son muy comunes en nuestra sociedad
industrializadas, más aun, podría decirse que la rueda es una de las primeras
máquinas inventadas por el hombre, ubicua, o mejor dicho, siendo la base de
muchas otras máquinas más complejas junto con la palanca. La rueda y las
maquinas rotativas son empleadas en turbinas, taladros, propelas, ruedas,
engranajes etc. A pesar de que esta estructura mecánica es casi universalmente
distribuida en el diseño de máquinas humanas, su empleo por parte de la
naturaleza es muy limitado.
No existen proteínas que ejerzan una
función mecánica rotacional en todo el linaje de los eucariotes al descontar
sus organelos endosimbióticos. De hecho, solo dos tipos de estructuras
biológicas conocidas contienen partes rotativas, las cuales las clasificaremos
por su nivel de complejidad comparativo. Los más simples canales iónicos/bombas
iónicas en las que encontramos a las ATP sintetasa y ATPasa; mientras que el
segundo grupo más complejo corresponde a los mecanismos de secreción tipo III y
el flagelo.
Ambos pueden ser descritos como
nano-máquinas rotativas de acuerdo a nuestro pensamiento analógico. Es más, uno
podría pensar en el mecanismo de secreción tipo III y en el flagelo como
versiones más complejas de la ATP sintetasa, ya que el motor que proporciona
movimiento en ambos casos es precisamente un homólogo genético, estructural y
funcional de la ATP sintetasa de tipo f. Por fuera de estos dos ejemplos,
aparentemente no existen otras proteínas análogas u homologas que empleen
sistemas de transducción de energía mecánica/química conocidos por la
microbiología moderna, aunque claro está, más del 90% de las especies de
bacterias no se pueden aislar en el laboratorio, por lo que aún queda mucho por
investigar y descubrir.
13.5 Evolución de la ATP
sintetasa
El mejor modelo para explicar el origen de
la ATP sintasa es la evolución modular.
En este modelo dos subunidades funcionalmente independientes se asociaron y
adquirieron nueva funcionalidad (Doering, Ermentrout, & Oster,
1995).
Esta asociación parece haber ocurrido temprano en la historia evolutiva, ya que
esencialmente la misma estructura y actividad de las enzimas ATP sintasa están
presentes en todos los reinos de la vida (Axelsen & Palmgren, 1998;
Koonin, 1993; Walker, 2003). La F-ATP sintasa muestra alta similitud funcional y mecánica a la
V-ATPasa (Kim et al., 2015). Sin embargo, mientras que la F-ATP sintasa genera ATP utilizando
un gradiente de protones, la V-ATPasa genera un gradiente de protones a
expensas de ATP, generando valores de pH tan bajos como 1 (Kim et al., 2015).
La región F1 también muestra una similitud
significativa con las helicasas hexánicas de ADN, y la región FO muestra cierta
similitud con los motores flagelares y redivados (Mulkidjanian, Makarova, Galperin,
& Koonin, 2007; Oster & Wang, 2003; Yinghao, Jun, Yuanbo, Jiachang,
& Xiaohong, 2005). El
hexámero α3β3 de la región F1 muestra una similitud estructural significativa
con las helicasas hexánicas de ADN; Ambos forman un anillo con una simetría
rotacional de 3 veces con un poro central. Ambos tienen papeles dependientes de
la rotación relativa de una macromolécula dentro del poro; Las helicasas de ADN
utilizan la forma helicoidal del ADN para impulsar su movimiento a lo largo de
la molécula de ADN y para detectar el superenrollamiento, mientras que el
hexámero α3β3 utiliza los cambios conformacionales a través de la rotación de
la subunidad γ para impulsar una reacción enzimática (Martinez et al., 2003).
El motor de protones de la partícula FO
muestra gran similitud funcional con los motores protones que impulsan flagelos
(Mulkidjanian et al., 2007; Oster
& Wang, 2003; Yinghao et al., 2005). Ambos cuentan con un anillo de muchas pequeñas proteínas
alfa-helicoidal que giran en relación con las proteínas estacionarias cercanas,
utilizando un protón potencial como una fuente de energía. Sin embargo, esta relación
es tenue, ya que la estructura general de los motores flagelares es mucho más
compleja que la de la partícula FO y el anillo con aproximadamente 30 proteínas
rotantes es mucho más grande que las 10, 11 o 14 proteínas helicoidales en el
complejo FO, por lo cual es fácil concluir que el motor flagelar es derivado a
la ancestral F0 (Junge, 1999; Liu & Ochman,
2007; Pallen & Matzke, 2006).
El modelo de evolución modular para el origen de la ATP
sintasa sugiere que dos subunidades con función independiente, una helicasa de
ADN con actividad ATPasa y un motor protones, fueron capaces de unirse, y la
rotación del motor impulsó la actividad ATPasa de la helicasa a la inversa (Doering et al., 1995; Martinez et al., 2003). Este complejo
luego evolucionó una mayor eficiencia y finalmente se convirtió en intrincadas
ATP sintasas de hoy. Alternativamente, el complejo de helicasa de ADN / motor
de protones puede haber tenido actividad de la bomba de protones en sentido
inverso, ambos modelos son plausibles por el hecho de que los completos tipo F
pueden funcionar como sintetizadores o como destructores de ATP.
14. ¿Y por qué engordamos?
|| Regresar al Índice ||
Cada vez más, los investigadores biomédicos están llegando a reconocer la importancia de una perspectiva evolutiva para comprender el origen y la naturaleza de los problemas de salud humana modernos. Esto es particularmente cierto cuando se examinan los trastornos "nutricionales / metabólicos" como la obesidad y las enfermedades cardiovasculares. La investigación en biología evolutiva humana en los últimos 20 años ha demostrado que muchas de las características clave que distinguen a los seres humanos de otros primates (por ejemplo, nuestra forma bípeda de locomoción y grandes tamaños cerebrales) tienen implicaciones importantes para nuestras necesidades nutricionales(Aiello & Wheeler, 1995; Leonard, 2002; Leonard & Robertson, 1997; Leonard, Snodgrass, & Robertson, 2010; Navarrete, van Schaik, & Isler, 2011). La más importante de estas características son nuestros altos niveles de encefalización (cerebro grande: masa corporal). Las demandas de energía (kcal / g / min) del cerebro y de otros tejidos neurales son extremadamente altas-aproximadamente 16 veces la del músculo esquelético (Holliday, 1986; Kety, 1957). En consecuencia, la evolución del tamaño del cerebro grande en el linaje humano llegó a un costo metabólico muy alto.
Figura 14.1. Para los
homínidos y nuestros ancestros, obtener alimento rico en azúcar y grasa
digerible era algo muy complicado.
Comparados con otros primates y mamíferos de nuestro tamaño, los humanos asignan una porción mucho mayor de su presupuesto energético diario para "alimentar sus cerebros". La asignación desproporcionadamente grande de nuestro presupuesto energético al metabolismo cerebral tiene implicaciones importantes para nuestras necesidades dietéticas. Para dar cabida a las altas demandas energéticas de nuestros grandes cerebros, los seres humanos consumen dietas que son de mayor calidad en términos de energía y grasa, que las de nuestros familiares primates (Leonard & Robertson, 1992, 1994; Leonard, Robertson, Snodgrass, & Kuzawa, 2003). En promedio, consumimos mayores niveles de grasa en la dieta que otros primates (Popovich et al., 1997) y niveles mucho más altos de ácidos grasos poliinsaturados de cadena que son críticos para el desarrollo del cerebro (Cordain, Watkins, & Mann, 2001; Crawford et al., 1999; Cunnane & Crawford, 2003). Además, los seres humanos también parecen ser distintivos en sus cambios de desarrollo en la composición corporal. Tenemos mayores niveles de grasa corporal que otras especies de primates, y estas diferencias son particularmente evidentes al principio del desarrollo.
Figura 14.2. La comida rica
en grasa peleaba por su vida.
La necesidad de una dieta rica en energía también parece
haber moldeado nuestra capacidad de detectar y metabolizar alimentos ricos en
grasa. Los seres humanos muestran fuertes preferencias por los alimentos ricos
en lípidos. Varios trabajos en neurociencia han demostrado que estas
preferencias se basan en el olor, la textura y el sabor de los alimentos grasos
(Gaillard, Passilly‐Degrace, &
Besnard, 2008; le Coutre & Schmitt, 2008; Sclafani, 2001) y que nuestros
cerebros tienen la capacidad de evaluar el contenido energético de los
alimentos con notable rapidez y precisión (Toepel, Knebel, Hudry, le Coutre, & Murray, 2009). Además, en
comparación con los grandes monos, los seres humanos tienen una mayor capacidad
para digerir y metabolizar las dietas más altas en grasa. Nuestro tracto
gastrointestinal (GI), con su intestino delgado expandido y colon reducido, es
muy diferente de los de chimpancés y gorilas, y es consistente con el consumo
de una dieta de alta calidad energética con grandes cantidades de proteína
animal (Milton, 1987). Finch y
Stanford (2004) han demostrado
que la evolución de los genes clave de la "adaptación de la carne" en
la evolución de los homínidos fue fundamental para promover el metabolismo
lipídico mejorado necesario para subsistir en las dietas con mayores niveles de
material animal.
Además, un trabajo reciente en la genética evolutiva humana sugiere que la selección de los genes clave de "adaptación de la carne" fue fundamental para permitir que nuestros antepasados homínidos para explotar más eficazmente las dietas con mayores niveles de grasa animal. Finch y Stanford (2004) argumentaron que la evolución del único alelo E3 en Homo en el locus apolipoproteína E (apoE) era importante para permitir que nuestros antepasados explotaran dietas con mayor material animal. ApoE desempeña un papel crítico en la regulación de la absorción de colesterol y lípidos en todo el cuerpo (Davignon, Gregg, & Sing, 1988; Kolovou, Daskalova, & Mikhailidis, 2003). El alelo E3 es evidente en humanos, pero no en chimpancés y gorilas, y está asociado con menores riesgos metabólicos y cardiovasculares con el consumo de dietas con alto contenido de grasa (Finch y Stanford, 2004).
Figura 14.3. Los bosquimanos
son tribus africanas que aún conservan los hábitos de supervivencia
ancestrales.
A la luz de estas importantes adaptaciones morfológicas y genéticas a una dieta más rica en grasa animal, no es sorprendente que los seres humanos también muestren preferencias por alimentos ricos en grasa y energía en el presente. Hasta hace poco, se pensaba que la preferencia humana por "alimentos grasos" se basaba principalmente en el olor y la textura (Sclafani, 2001); Sin embargo, ahora sabemos que el gusto desempeña un papel crítico (Gaillard et al., 2008). Los estudios de neuroimagen también sugieren que el cerebro humano tiene una notable capacidad para evaluar el contenido energético de los alimentos potenciales con rapidez y precisión (Toepel et al., 2009).
Figura 14.4. El fantasma de
la hambruna puede regresar en cualquier momento.
A través de las poblaciones humanas, la
variación en el grado de preferencia por los alimentos dulces y grasos ha sido
bien documentada (Johns, 1996;
Messer, 1986; Reed & McDaniel, 2006; Reed, Tanaka, & McDaniel, 2006;
Salbe, DelParigi, Pratley, Drewnowski, & Tataranni, 2004). Lussana et al. (2008) ha demostrado que el estado nutricional durante el desarrollo
puede jugar un papel importante en la formación de preferencias de sabor.
Basándose en análisis de la Cohorte de Nacimientos durante la Hambruna
Holandesa (Lumey et al., 1993), estos autores muestran que la exposición prenatal a las
condiciones de hambruna está asociada con una mayor preferencia por alimentos
grasos y un mayor riesgo de perfiles de lípidos séricos deficientes en la edad
adulta.
Además de los beneficios energéticos asociados con un mayor consumo de carne en la evolución de los homínidos, parece que este cambio en la dieta también habría proporcionado mayores niveles de ácidos grasos clave necesarios para apoyar la rápida evolución del cerebro de homínidos (Cordain et al., 2001). El crecimiento del cerebro de los mamíferos depende de cantidades suficientes de dos ácidos grasos: ácido docosahexaenoico (DHA), y el ácido araquidónico (AA) (Crawford et al., 1999; Cordain et al., 2001). Debido a que la composición de todos los tejidos cerebrales de mamíferos es similar con respecto a estos dos ácidos grasos, las especies con mayores niveles de encefalización tienen mayores requisitos para DHA y AA (Crawford et al., 1999). También parece que los mamíferos tienen una capacidad limitada para sintetizar estos ácidos grasos a partir de precursores dietéticos. En consecuencia, las fuentes dietéticas de DHA y AA eran nutrientes limitantes que frenaban la evolución de un tamaño cerebral mayor en muchos linajes de mamíferos (Crawford et al., 1999).
Figura 14.5. Nuestro cuerpo
cree que en cualquier momento se dará una hambruna, y por eso almacena tanto
como puede.
Cordain et al. (2001) han demostrado que
los alimentos vegetales silvestres disponibles en la sabana africana (por
ejemplo, tubérculos, frutos secos) contienen sólo pequeñas cantidades de AA y
DHA, mientras que el tejido muscular y la carne de órganos de rumiantes
salvajes africanos proporcionan niveles moderados a altos de estos ácidos
grasos clave. El tejido cerebral es una rica fuente de AA y DHA, mientras que
el hígado y los tejidos musculares son buenas fuentes de AA y fuentes moderadas
de DHA. Otras buenas fuentes de AA y DHA son los peces de agua dulce y los
mariscos (Broadhurst, Cunnane, &
Crawford, 1998; Crawford et al., 1999). Cunnane y Crawford (2003) han sugerido que los mayores aumentos
en la encefalización de homínidos se asociaron con el uso sistemático de
recursos acuáticos (marinos, fluviales o lacustres). Sin embargo, hay poca
evidencia arqueológica para el uso sistemático de los recursos acuáticos hasta
mucho más tarde en la evolución humana (véase Klein, 1999).
Debido a la limitación natural para
obtener ácidos grasos, el cuerpo humano evolucionó para usar toda fuente de
energía disponible menos la grasa. Como hemos apreciado, para activar el
metabolismo de las grases solo a la mitad, se debe hacer mínimo 20 minutos de
ejercicio de mediana intensidad. De esta manera los ácidos grasos pueden
mantenerse para períodos de escases y para alimentar el costoso cerebro humano.
Aun en la actualidad la hambruna hace que este tipo de reticencia a gastos
energéticos sea útil para muchas poblaciones humanas. Sin embargo en un
fragmento de la población mundial la cosa es diferente, pues tienen acceso a
grandes cantidades de alimentos ricos en calorías, pero aun poseen una biología
para sobrevivir hambrunas. Combinar una amplia disponibilidad con un cuerpo e
instintos que se generaron para sobrevivir en condiciones de escases ha
demostrado ser una bomba de tiempo (Bellisari, 2008; Chakravarthy &
Booth, 2004; J. R. Krebs, 2009; Speakman, 2013), la cual ha concluido con una epidemia de obesidad que plaga la
vida de las sociedades industriales modernas (Hu, 2008; Nguyen & El-Serag,
2010; Ogden, Yanovski, Carroll, & Flegal, 2007).
Referencias bibliográficas
|| Regresar al Índice ||
Aiello, L. C., & Wheeler,
P. (1995). The expensive-tissue hypothesis: the brain and the digestive system in
human and primate evolution. Current Anthropology, 36(2), 199–221.
Akram, M. (2014). Citric acid
cycle and role of its intermediates in metabolism. Cell Biochemistry and
Biophysics, 68(3), 475–478.
Alberts, B, Johnson, A.,
Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P. (2015). Molecular
biology of the cell (5th ed.). Garland Science.
Alberts, Bruce, Johnson, A.,
Lewis, J., Raff, M., Roberts, K., & Walter, P. (2002). The Evolution of
Electron-Transport Chains.
Andréasson, R., & Jones,
A. W. (1996). Historical anecdote related to chemical tests for intoxication. Journal
of Analytical Toxicology, 20(3), 207–208.
Axelsen, K. B., &
Palmgren, M. G. (1998). Evolution of substrate specificities in the P-type
ATPase superfamily. Journal of Molecular Evolution, 46(1),
84–101.
Baughn, A. D., & Malamy,
M. H. (2002). A mitochondrial-like aconitase in the bacterium Bacteroides
fragilis: implications for the evolution of the mitochondrial Krebs cycle. Proceedings
of the National Academy of Sciences, 99(7), 4662–4667.
Bellisari, A. (2008).
Evolutionary origins of obesity. Obesity Reviews, 9(2), 165–180.
Björn, L. O., Papageorgiou, G.
C., Dravins, D., & Govindjee, G. (2009). Detectability of life and photosynthesis
on exoplanets. INDIAN ACAD SCIENCES CV RAMAN AVENUE, SADASHIVANAGAR, PB# 8005,
BANGALORE 560 080, INDIA.
Blankenship, R. E. (2002).
Origin and evolution of photosynthesis. Molecular Mechanisms of
Photosynthesis, 220–257.
Blankenship, R. E. (2010). Early
evolution of photosynthesis. Plant Physiology, 154(2), 434–438.
Blankenship, R. E., &
Hartman, H. (1998). The origin and evolution of oxygenic photosynthesis. Trends
in Biochemical Sciences, 23(3), 94–97.
Borichewski, R. M. (1967).
Keto acids as growth-limiting factors in autotrophic growth of Thiobacillus
thiooxidans. Journal of Bacteriology, 93(2), 597–599.
Brack, A. (1998). The
molecular origins of life: assembling pieces of the puzzle. Cambridge
University Press.
Broadhurst, C. L., Cunnane, S.
C., & Crawford, M. A. (1998). Rift Valley lake fish and shellfish provided
brain-specific nutrition for early Homo. British Journal of Nutrition, 79(01),
3–21.
Buick, R. (2008). When did
oxygenic photosynthesis evolve? Philosophical Transactions of the Royal
Society B: Biological Sciences, 363(1504), 2731–2743.
Campanario, J. M. (2002). The
parallelism between scientists’ and students’ resistance to new scientific
ideas. International Journal of Science Education, 24(10),
1095–1110.
Cavalcanti, J. H. F.,
Esteves-Ferreira, A. A., Quinhones, C. G. S., Pereira-Lima, I. A., Nunes-Nesi,
A., Fernie, A. R., & Araújo, W. L. (2014). Evolution and functional
implications of the tricarboxylic acid cycle as revealed by phylogenetic
analysis. Genome Biology and Evolution, 6(10), 2830–2848.
Chakravarthy, M. V, &
Booth, F. W. (2004). Eating, exercise, and “thrifty” genotypes: connecting the
dots toward an evolutionary understanding of modern chronic diseases. Journal
of Applied Physiology, 96(1), 3–10.
Colman, E. (2007).
Dinitrophenol and obesity: an early twentieth-century regulatory dilemma. Regulatory
Toxicology and Pharmacology, 48(2), 115–117.
Cordain, L., Watkins, B. A.,
& Mann, N. J. (2001). Fatty acid composition and energy density of foods
available to African hominids. In Nutrition and fitness: Metabolic studies
in health and disease (Vol. 90, pp. 144–161). Karger Publishers.
Crawford, M. A., Bloom, M.,
Broadhurst, C. L., Schmidt, W. F., Cunnane, S. C., Galli, C., … Parkington, J.
(1999). Evidence for the unique function of docosahexaenoic acid during the
evolution of the modern hominid brain. Lipids, 34, S39–S47.
Cunnane, S. C., &
Crawford, M. A. (2003). Survival of the fattest: fat babies were the key to
evolution of the large human brain. Comparative Biochemistry and Physiology
Part A: Molecular & Integrative Physiology, 136(1), 17–26.
Davignon, J., Gregg, R. E.,
& Sing, C. F. (1988). Apolipoprotein E polymorphism and atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular
Biology, 8(1),
1–21.
De Duve, C., & Pizano, M. (1995). Polvo vital:
origen y evolución de la vida en la tierra. Norma, Bogotá.
Doering, C., Ermentrout, B.,
& Oster, G. (1995). Rotary DNA motors. Biophysical Journal, 69(6),
2256–2267.
Durazo, F. A., Lassman, C.,
Han, S. H. B., Saab, S., Lee, N. P., Kawano, M., … Yersiz, H. (2004). Fulminant
liver failure due to usnic acid for weight loss. The American Journal of
Gastroenterology, 99(5), 950–952.
Finch, C. E., & Stanford,
C. B. (2004). Meat-adaptive genes and the evolution of slower aging in humans. The
Quarterly Review of Biology, 79(1), 3–50.
Gaillard, D.,
Passilly‐Degrace, P., & Besnard, P. (2008). Molecular mechanisms of fat
preference and overeating. Annals of the New York Academy of Sciences, 1141(1),
163–175.
Gargaud, M., Martin, H.,
López-García, P., Montmerle, T., & Pascal, R. (2012). Intermezzo: The
Gestation of Life and its First Steps. In Young Sun, Early Earth and the
Origins of Life (pp. 93–154). Springer.
Gest, H. (2002). Landmark
discoveries in the trail from chemistry to cellular biochemistry, with
particular reference to mileposts in research on bioenergetics. Biochemistry
and Molecular Biology Education, 30(1), 9–13.
Ghosh, J., & Sil, P. C.
(2014). Mechanism for Arsenic-Induced Toxic Effects. Handbook of Arsenic
Toxicology, 203.
Gorbushina, A. A. (2007). Life
on the rocks. Environmental Microbiology, 9(7), 1613–1631.
Grundlingh, J., Dargan, P. I.,
El-Zanfaly, M., & Wood, D. M. (2011). 2, 4-dinitrophenol (DNP): a weight
loss agent with significant acute toxicity and risk of death. Journal of
Medical Toxicology, 7(3), 205–212.
Hohmann-Marriott, M. F., &
Blankenship, R. E. (2011). Evolution of photosynthesis. Annual Review of
Plant Biology, 62, 515–548.
Holland, H. D. (2006). The
oxygenation of the atmosphere and oceans. Philosophical Transactions of the
Royal Society B: Biological Sciences, 361(1470), 903–915.
Holliday, M. A. (1986). Body
composition and energy needs during growth. In Postnatal Growth Neurobiology
(pp. 101–117). Springer.
Holmes, F. L. (1984).
Lavoisier and Krebs: The individual scientist in the near and deeper past. Isis,
75(1), 131–142.
Hu, F. (2008). Obesity
epidemiology. Oxford University Press.
Johns, T. (1996). The
origins of human diet and medicine: chemical ecology. University of Arizona
Press.
Jomova, K., Jenisova, Z.,
Feszterova, M., Baros, S., Liska, J., Hudecova, D., … Valko, M. (2011).
Arsenic: toxicity, oxidative stress and human disease. Journal of Applied
Toxicology, 31(2), 95–107.
Junge, W. (1999). ATP synthase
and other motor proteins. Proceedings of the National Academy of Sciences,
96(9), 4735–4737.
Kaminer, B. (2014). Search
and discovery: a tribute to Albert Szent-Györgyi. Academic Press.
Kety, S. S. (1957). The
general metabolism of the brain in vivo. Metabolism of the Nervous System,
221–237.
Kim, M.-S., Jang, J., Rahman,
N. B. A. B., Pethe, K., Berry, E. A., & Huang, L.-S. (2015). Isolation and
characterization of a hybrid respiratory supercomplex consisting of
Mycobacterium tuberculosis cytochrome bcc and Mycobacterium smegmatis
cytochrome aa3. Journal of Biological Chemistry, 290(23),
14350–14360.
Kolovou, G., Daskalova, D.,
& Mikhailidis, D. P. (2003). Apolipoprotein E polymorphism and
atherosclerosis. Angiology, 54(1), 59–71.
Koonin, E. V. (1993). A
superfamily of ATPases with diverse functions containing either classical or
deviant ATP-binding motif. Journal of Molecular Biology, 229(4),
1165–1174.
Krebs, H. A. (1970). The
history of the tricarboxylic acid cycle. Perspectives in Biology and
Medicine, 14(1), 154–172.
Krebs, J. R. (2009). The
gourmet ape: evolution and human food preferences. The American Journal of
Clinical Nutrition, 90(3), 707S-711S.
Kump, L. R. (2008). The rise
of atmospheric oxygen. Nature, 451(7176), 277–278.
Kump, L. R., & Barley, M.
E. (2007). Increased subaerial volcanism and the rise of atmospheric oxygen 2.5
billion years ago. Nature, 448(7157), 1033–1036.
Lane, N. (2010). Life
ascending: the ten great inventions of evolution. Profile books.
le Coutre, J., & Schmitt,
J. A. J. (2008). Food ingredients and cognitive performance. Current Opinion
in Clinical Nutrition & Metabolic Care, 11(6), 706–710.
Leigh, F. W. (2009). Sir Hans
Adolf Krebs (1900–81), pioneer of modern medicine, architect of intermediary
metabolism. Journal of Medical Biography, 17(3), 149–154.
Leonard, W. R. (2002). Dietary
change was a driving force in human evolution. Scientific American, 287(6),
106–116.
Leonard, W. R., &
Robertson, M. L. (1992). Nutritional requirements and human evolution: a
bioenergetics model. American Journal of Human Biology, 4(2),
179–195.
Leonard, W. R., &
Robertson, M. L. (1994). Evolutionary perspectives on human nutrition: the
influence of brain and body size on diet and metabolism. American Journal of
Human Biology, 6(1), 77–88.
Leonard, W. R., &
Robertson, M. L. (1997). Comparative primate energetics and hominid evolution. American
Journal of Physical Anthropology, 102(2), 265–281.
Leonard, W. R., Robertson, M.
L., Snodgrass, J. J., & Kuzawa, C. W. (2003). Metabolic correlates of
hominid brain evolution. Comparative Biochemistry and Physiology Part A:
Molecular & Integrative Physiology, 136(1), 5–15.
Leonard, W. R., Snodgrass, J.
J., & Robertson, M. L. (2010). Evolutionary perspectives on fat ingestion
and metabolism in humans. In Fat Detection: Taste, Texture, and Post
Ingestive Effects (pp. 3–18). CRC Press, Boca Raton, FL.
Liu, R., & Ochman, H.
(2007). Stepwise formation of the bacterial flagellar system. Proceedings of
the National Academy of Sciences, 104(17), 7116–7121.
Lumey, L. H., Ravelli, A. C.
J., Wiessing, L. G., Koppe, J. G., Treffers, P. E., & Stein, Z. A. (1993).
The Dutch famine birth cohort study: design, validation of exposure, and
selected characteristics of subjects after 43 years follow‐up. Paediatric
and Perinatal Epidemiology, 7(4), 354–367.
Lussana, F., Painter, R. C.,
Ocke, M. C., Buller, H. R., Bossuyt, P. M., & Roseboom, T. J. (2008).
Prenatal exposure to the Dutch famine is associated with a preference for fatty
foods and a more atherogenic lipid profile. The American Journal of Clinical
Nutrition, 88(6), 1648–1652.
Marı́, M., Bai, J., &
Cederbaum, A. I. (2002). Toxicity by pyruvate in HepG2 cells depleted of
glutathione: role of mitochondria. Free Radical Biology and Medicine, 32(1),
73–83.
Martinez, L. O., Jacquet, S.,
Esteve, J.-P., Rolland, C., Cabezón, E., Champagne, E., … Tercé, F. (2003).
Ectopic β-chain of ATP
synthase is an apolipoprotein AI receptor in hepatic HDL endocytosis. Nature,
421(6918), 75–79.
Matin, A. (1978). Organic
nutrition of chemolithotrophic bacteria. Annual Reviews in Microbiology,
32(1), 433–468.
Meléndez-Hevia, E., Waddell, T. G., & Cascante, M.
(1996). The puzzle of the Krebs citric acid cycle: assembling the pieces of
chemically feasible reactions, and opportunism in the design of metabolic
pathways during evolution. Journal of Molecular Evolution, 43(3),
293–303.
Messer, E. (1986). Some like
it sweet: estimating sweetness preferences and sucrose intakes from
ethnographic and experimental data. American Anthropologist, 88(3),
637–647.
Milton, K. (1987). Primate
diets and gut morphology: implications for hominid evolution. Food and
Evolution: Toward a Theory of Human Food Habits, 93–115.
Miranda, E. J., McIntyre, I.
M., Parker, D. R., Gary, R. D., & Logan, B. K. (2006). Two deaths
attributed to the use of 2, 4-dinitrophenol. Journal of Analytical
Toxicology, 30(3), 219–222.
Mulkidjanian, A. Y., Makarova,
K. S., Galperin, M. Y., & Koonin, E. V. (2007). Inventing the dynamo
machine: the evolution of the F-type and V-type ATPases. Nature Reviews
Microbiology, 5(11), 892–899.
Navarrete, A., van Schaik, C.
P., & Isler, K. (2011). Energetics and the evolution of human brain size. Nature,
480(7375), 91–93.
Nguyen, D. M., & El-Serag,
H. B. (2010). The epidemiology of obesity. Gastroenterology Clinics of North
America, 39(1), 1–7.
Niknamian, S. (2016).
Nutritional Ketosis Condition and Specific Ketogenic Diet, May Benefit Cancer
Patients as an Alternative Treatment by Sudden Change in the Metabolic State of
Cancer Cells. International Science and Investigation Journal, 5(5),
28–48.
Ogden, C. L., Yanovski, S. Z.,
Carroll, M. D., & Flegal, K. M. (2007). The epidemiology of obesity. Gastroenterology,
132(6), 2087–2102.
Oster, G., & Wang, H.
(2003). Rotary protein motors. Trends in Cell Biology, 13(3),
114–121.
Pace, N. R. (2001). The
universal nature of biochemistry. Proceedings of the National Academy of
Sciences, 98(3), 805–808.
Pallen, M. J., & Matzke,
N. J. (2006). From The Origin of Species to the origin of bacterial flagella. Nature
Reviews Microbiology, 4(1), 784–790.
Petrick, J. S., Jagadish, B.,
Mash, E. A., & Aposhian, H. V. (2001). Monomethylarsonous acid (MMAIII) and
arsenite: LD50 in hamsters and in vitro inhibition of pyruvate dehydrogenase. Chemical
Research in Toxicology, 14(6), 651–656.
Planavsky, N. J., Asael, D.,
Hofmann, A., Reinhard, C. T., Lalonde, S. V, Knudsen, A., … Smith, A. J. B.
(2014). Evidence for oxygenic photosynthesis half a billion years before the
Great Oxidation Event. Nature Geoscience, 7(4), 283–286.
Popovich, D. G., Jenkins, D.
J. A., Kendall, C. W. C., Dierenfeld, E. S., Carroll, R. W., Tariq, N., &
Vidgen, E. (1997). The western lowland gorilla diet has implications for the
health of humans and other hominoids. The Journal of Nutrition, 127(10),
2000–2005.
Raven, J. A., Andrews, M.,
& Quigg, A. (2005). The evolution of oligotrophy: implications for the
breeding of crop plants for low input agricultural systems. Annals of
Applied Biology, 146(3), 261–280.
Raven, J., & Skene, K.
(2003). Chemistry of the early oceans: the environment of early life. Evolution
on Planet Earth—the Impact of the Physical Environment, 55–64.
Reed, D. R., & McDaniel,
A. H. (2006). The human sweet tooth. BMC Oral Health, 6(1), S17.
Reed, D. R., Tanaka, T., &
McDaniel, A. H. (2006). Diverse tastes: Genetics of sweet and bitter
perception. Physiology & Behavior, 88(3), 215–226.
Rich, P. R. (2003). The
molecular machinery of Keilin’s respiratory chain. Portland Press Limited.
Salbe, A. D., DelParigi, A.,
Pratley, R. E., Drewnowski, A., & Tataranni, P. A. (2004). Taste
preferences and body weight changes in an obesity-prone population. The
American Journal of Clinical Nutrition, 79(3), 372–378.
Sclafani, A. (2001).
Psychobiology of food preferences. International Journal of Obesity, 25(S5),
S13.
Sepúlveda, R., Ortiz, R., & Holmes, D. S. (2015). Evolution of
Electron Transport Chains During the Anaerobic to Aerobic Transition on Early
Earth. In AGU Fall Meeting Abstracts.
Speakman, J. R. (2013).
Evolutionary perspectives on the obesity epidemic: adaptive, maladaptive, and
neutral viewpoints. Annual Review of Nutrition, 33, 289–317.
Stubbs, M., & Gibbons, G.
(2000). Hans Adolf Krebs (1900‐1981)… His Life and Times. IUBMB Life, 50(3),
163–166.
Tarbuck, E. J., Lutgents, F.
K., & Tasa, D. (2014). Earth, an introduction to physical geology, 11ed.
Boston, Pearson.
Tchounwou, P. B., Centeno, J.
A., & Patlolla, A. K. (2004). Arsenic toxicity, mutagenesis, and
carcinogenesis–a health risk assessment and management approach. Molecular
and Cellular Biochemistry, 255(1–2), 47–55.
THAUER, R. K. (1988).
Citric‐acid cycle, 50 years on. The FEBS Journal, 176(3),
497–508.
Toepel, U., Knebel, J.-F.,
Hudry, J., le Coutre, J., & Murray, M. M. (2009). The brain tracks the
energetic value in food images. Neuroimage, 44(3), 967–974.
Wagner, A. (2014). Arrival
of the Fittest: Solving Evolution’s Greatest Puzzle. Penguin.
Walker, J. E. (2003). ATP
synthesis by rotary catalysis. Chemistry, 1996-2000, 146.
Weitzman, P. D. J. (n.d.).
Krebs citric acid cycle: half a century and still turning. In Biochem. Soc.
Symp (Vol. 54, pp. 1–198).
Xiong, J., Fischer, W. M.,
Inoue, K., Nakahara, M., & Bauer, C. E. (2000). Molecular evidence for the
early evolution of photosynthesis. Science, 289(5485), 1724–1730.
Yinghao, Z., Jun, W., Yuanbo,
C., Jiachang, Y., & Xiaohong, F. (2005). Rotary torque produced by proton
motive force in FoF 1 motor. Biochemical and Biophysical Research Communications, 331(1), 370–374.











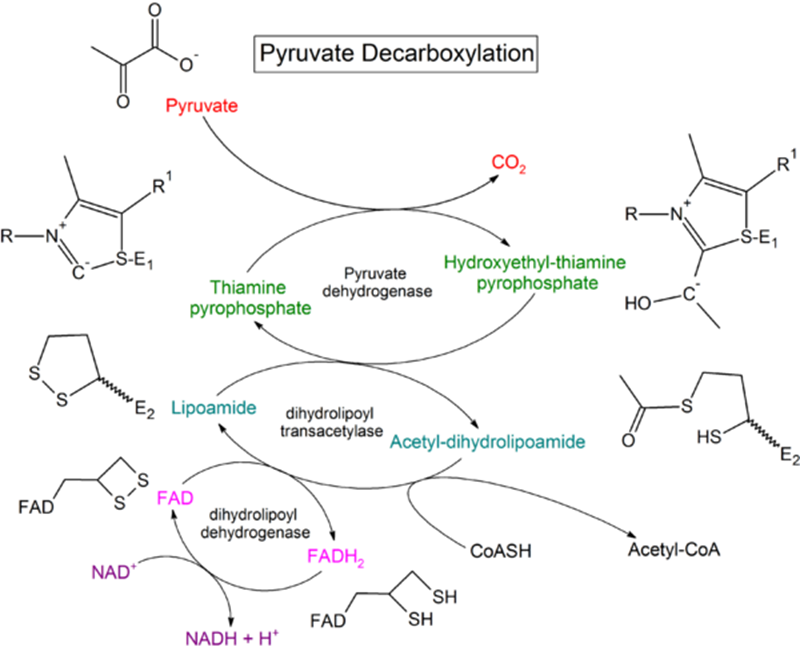



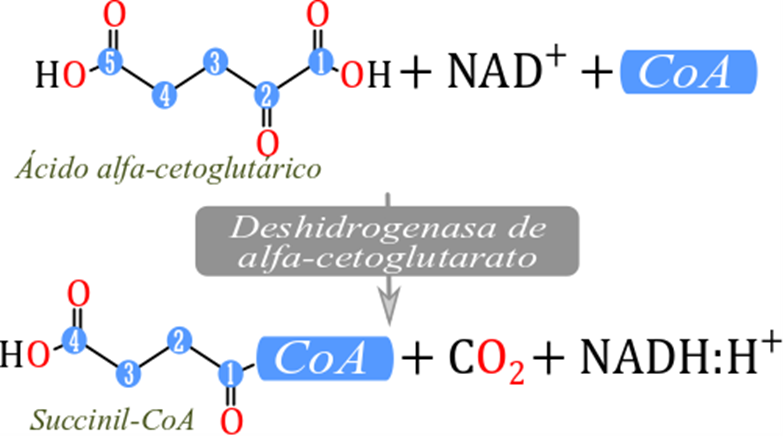



















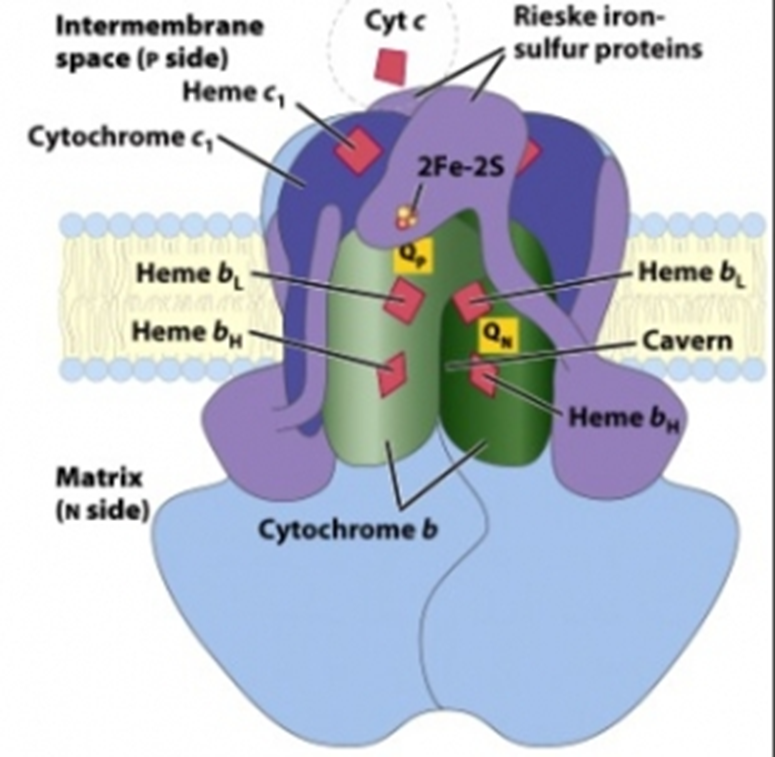















No hay comentarios:
Publicar un comentario