Índice
Portada
1. Introducción
|| Regresar al Índice ||
La fotosíntesis es un metabolismo
anabólico que se encarga de la síntesis de compuestos complejos de carbono
empleando materiales inorgánicos como agua, dióxido de carbono y la energía
solar.
(Eq. 1.1)
La fotosíntesis
es un proceso utilizado por las plantas y otros organismos para convertir la energía
luminosa en energía química que luego puede liberarse para alimentar las
actividades de los organismos. Esta energía química se almacena en moléculas de
carbohidratos, como los azúcares, que se sintetizan a partir de dióxido de
carbono y agua - de ahí el nombre de fotosíntesis que literalmente traduce como
“construir con luz”. En la mayoría de los casos, el oxígeno también se libera
como un producto de desecho. La mayoría de las plantas, la mayoría de las
algas, y las cianobacterias realizan la fotosíntesis; Tales organismos se
llaman fotoautótrofos. La fotosíntesis es en gran parte responsable de producir
y mantener el contenido de oxígeno de la atmósfera terrestre (Buick, 2008; Holland, 2006; Kump, 2008;
Kump & Barley, 2007), y suministra todos los compuestos
orgánicos y la mayor parte de la energía necesaria para la vida en la Tierra.
1.1 Melvin Ellis Calvin
(8 de abril de 1911 - 8 de enero de 1997) fue un bioquímico estadounidense conocido por descubrir el ciclo de Calvin junto con Andrew Benson y James Bassham, por lo que fue galardonado con el Premio Nobel de Química de 1961. Pasó la mayor parte de su carrera de cinco décadas en la Universidad de California, Berkeley.
Calvin nació en St. Paul, Minnesota, hijo
de Elias Calvin y Rose Herwitz, inmigrantes judíos del Imperio Ruso.
Cuando era niño, la familia de Calvin se
mudó a Detroit; se graduó de Central High School en 1928. Melvin Calvin obtuvo
su Licenciatura en Ciencias de la Facultad de Minería y Tecnología de Michigan
(ahora conocida como Universidad Tecnológica de Michigan) en 1931 y su Ph.D. en
química de la Universidad de Minnesota en 1935. Luego pasó los siguientes
cuatro años haciendo un trabajo postdoctoral en la Universidad de Manchester.
Se casó con Marie Genevieve Jemtegaard en 1942.
Calvin se unió a la facultad de la Universidad de California, Berkeley, en 1937 y fue ascendido a Profesor de Química en 1947. Usando el isótopo carbono-14 como trazador, Calvin, Andrew Benson y James Bassham mapearon la ruta completa por la que viaja el carbono a través de una planta durante la fotosíntesis, comenzando desde su absorción como dióxido de carbono atmosférico hasta su conversión en carbohidratos y otros compuestos orgánicos. Al hacerlo, Calvin, Benson y Bassham demostraron que la luz solar actúa sobre la clorofila de una planta para impulsar la fabricación de compuestos orgánicos, en lugar de sobre el dióxido de carbono, como se creía anteriormente. Calvin fue el único destinatario del Premio Nobel de Química de 1961 por lo que a veces se conoce como el ciclo Calvin-Benson-Bassham. Calvin escribió una autobiografía tres décadas más tarde titulada Siguiendo el rastro de la luz: una odisea científica. Durante la década de 1950 fue uno de los primeros miembros de la Sociedad para la Investigación de Sistemas Generales. En 1963 se le otorgó el título adicional de Profesor de Biología Molecular. Fue fundador y Director del Laboratorio de Biodinámica Química y simultáneamente Director Asociado del Laboratorio de Radiación de Berkeley, donde realizó gran parte de su investigación hasta su jubilación en 1980. En sus últimos años de investigación activa, estudió el uso de plantas productoras de aceite. como fuentes de energía renovables. También pasó muchos años probando la evolución química de la vida y escribió un libro sobre el tema que se publicó en 1969 (Govindjee, Nonomura, & Lichtenthaler, 2020).
2. Generalidades
Tradicionalmente la fotosíntesis se divide
en dos etapas, y he de admitir que sus nombres son demasiado poéticos para mis
muy sistemáticos gustos, siendo llamadas las reacciones de la luz y las
reacciones de la oscuridad. Tal como ocurre con el tradicional símbolo del ying
y el yang, una vez asociadas, estos dos grupos de reacciones no pueden
independizarse, una depende de la otra en los organismos que la poseen, aun
cuando para su evolución, la una pudo haber evolucionado independientemente a
la otra (Pessarakli,
2016).
2.1 Reacciones de la luz
Aunque la fotosíntesis se realiza de
manera diferente por diferentes especies, el proceso siempre comienza cuando la
energía de la luz es absorbida por las proteínas llamadas centros de reacción
que contienen pigmentos verdes de clorofila. En las plantas, estas proteínas se
mantienen dentro de organelos llamados cloroplastos, que son más abundantes en
las células foliares, mientras que en las bacterias están incrustados en la
membrana plasmática. En estas reacciones dependientes de la luz, se utiliza
cierta energía para despojar electrones de sustancias adecuadas, tales como
agua, produciendo dioxígeno gaseoso. El hidrógeno ionico “ion protio(1+) o
simplemente protones” liberado por la división del agua se utiliza en la
creación de otros dos compuestos que actúan como medios inmediatos de
almacenamiento de energía: nicotinamida adenina dinucleótido fosfato (NADPH) y
adenosina trifosfato (ATP), la "moneda de la energía" de las células (Pessarakli,
2016).
Las reacciones de la luz se las puede asumir como una cadena de
transporte de electrones, en otras palabras, se genera una corriente eléctrica
que permite la producción de energía de dos formas diferentes. La primer forma
es directa, y es mediante la formación de NADPH a partir de NADP. El NADPH es
una molécula de alta energía que puede catalizar numerosas reacciones de
reducción “constructoras de componentes celulares”. El segundo método es
indirecto, y es mediante la formación de un gradiente de protones. La
plastoquinona y el citocromo fotosintético trasladan 6 iones protio(1+) desde
el estroma del cloroplasto al interior del tilacoide, por lo que rápidamente el
interior del tilacoide adquiere una mayor concentración de iones protio(1+).
Esta acumulación genera un potencial electroquímico que es
aprovechada por una enzima F1F0 ATP sintetasa para generar energía de forma
similar a lo que ocurre en la respiración celular aeróbica en forma del
portador de energía llamado ATP. El sustrato de donde se extrae la corriente
eléctrica que impulsa los dos procesos anteriores es el agua, sin embargo, al
ser el agua una molécula estable de alta energía se emplea energía lumínica
para impulsar el proceso. En total al sumar los dos fotosistemas, se necesitan
en óptimas/ideales condiciones 8 fotones para producir una molécula de oxígeno
y ocho moléculas de NADPH; con el rompimiento de dos moléculas de agua.
2.2 Reacciones de la oscuridad
En plantas, algas y
cianobacterias, el almacenamiento de energía a largo plazo en forma de azúcares
es producido por una secuencia subsiguiente de reacciones independientes de la
luz llamada ciclo de Calvin; Algunas bacterias utilizan diferentes mecanismos,
como el ciclo inverso de Krebs, para lograr el mismo fin. En el ciclo de
Calvin, el dióxido de carbono atmosférico se incorpora en los compuestos de
carbono orgánico ya existentes, como el bisfosfato de ribulosa (RuBP).
Utilizando el ATP y NADPH producido por las reacciones dependientes de la luz,
los compuestos resultantes se reducen y se eliminan para formar otros
carbohidratos, tales como glucosa (Pessarakli,
2016).
En general se pueden distinguir dos fases en el esquema del ciclo
de Calvin, todos dicen que son 3, pero la tercera nunca se ve, y de hecho ha
sido omitida intencionalmente en esta sección de las reacciones de fase oscura,
debido a que la mayoría de los esquemas realmente solo muestran dos, mientras
que la tercera es solo una desviación a mitad de camino. La primera fase es una
fase de activación en la que se invierte energía proveniente de las reacciones
dependientes de la luz.
La segunda fase es la de regeneración, donde el punto principalmente
es una reorganización molecular, para transformar 6 moléculas de 3 carbonos, en
3 moléculas de 5 carbonos para regeneración y una como beneficio para la
síntesis de carbohidratos. Esta molécula de tres carbonos es equivalente a las
tres moléculas de dióxido de carbono que fueron asimiladas por los tres
arranques del ciclo de Calvin. El ciclo de Calvin para completarse de manera
completa debe avanzar en grupos de tres, tres arranques, una sola
reorganización y tres finalizaciones.
2.3 Que el Sol pague la fiesta
Ya sé que es un anime un poco antiguo, pero Full metal Alchemist (Figura 2.1) nos introduce a un concepto bastante pertinente a la hora de visualizar mentalmente el funcionamiento de la vida, el intercambio equivalente “para obtener algo debes ofrecer otra cosa de un valor equivalente”.
Figura 2.1. La vida
funciona por dos tipos de intercambios, los de materia y los de energía
acoplados.
En el mundo real, sin embargo, la cosa no
es tan “equivalente”, debido a las restricciones de la segunda ley de la
termodinámica, ningún pago energético puede hacerse sin pagar impuesto al
universo en forma de calor, por lo que el que recibe, recibirá menos de lo que
se pagó originalmente, en otras palabras, la energía no se recicla en ciclos
ilimitados, así pues, en la realidad “para
obtener algo debes sacrificar energía de un mayor mayor”.
Debido a estas pérdidas impositivas
impuestas por nuestro universo, los sistemas deberían moverse rápidamente a un
caos por falta de energía, sin embargo, nuestro universo aun es joven, y en
consecuencia aún hay mucha energía que puede moverse. Para que los seres vivos
puedan entonces crecer y multiplicarse se necesita alguien que pague este
intercambio más que equivalente, alguien que pague por nuestra fiesta. En
general hay dos pagadores en el planeta Tierra, las fuentes hidrotermales y el
Sol (Schneider & Kay, 1994, 1995;
Von Bertalanffy, 1950). Y
dado que esta unidad trata de fotosíntesis, nos interesará en consecuencia como
es que el Sol paga por nuestra fiesta.
Cada año, la
Tierra está bañada en fotones con un contenido energético total de
aproximadamente
2.4 Dos tipos de fotosíntesis
La fotosíntesis de puede clasificar como
fotosíntesis de tipo I, la cual posee únicamente el fotosistema I; y la
fotosíntesis del tipo II que posee los fotosistemas I y II de manera acoplada. La fotosíntesis que estudiaremos a
continuación se centra en las plantas terrestres, por lo que estudiaremos la
fotosíntesis del tipo II. Ambas fotosíntesis presentan diferencias notables en
su distribución biológica, sus materias primas y sus productos finales. La
fotosíntesis del tipo I se restringe especialmente a las bacterias verde
sulfurosas, sus materias primas son ácido sulfhídrico, dióxido de carbono y
luz, mientras que su producto principal es azúcar y azufre molecular. En la
actualidad muchos biólogos están de acuerdo en que la fotosíntesis del tipo I
es la más antigua, y la razón principal es que es más simple, ya que requiere
un solo complejo fotosintético, aunque claro solo funciona si hay electrones de
energía intermedia accesibles (Cardona, Murray, & Rutherford,
2015).
La fotosíntesis del tipo II es ampliamente
distribuida en varias especies de bacterias entre las que destacan las
cianobacterias. La principal ventaja de la fotosíntesis de tipo II es que
consta de dos fotosistemas, el primero llamado fotosistema II carga electrones
de bajísima energía con energía solar, estos electrones provienen del agua, por
lo que libera a las bacterias de sus nichos minerales, es decir, donde quiera
que exista agua, de aquí en adelante existiría vida, con los electrones
excitados al nivel medio, el fotosistema I o arcaico los podía retomar y
proseguir la actividad de síntesis de carbohidratos normal (Blankenship, 1992; Blankenship
& Hartman, 1998; Cardona, 2017; Pessarakli, 2016). Pero no podemos olvidar la poesía del intercambio equivalente, y
es que tanta dicha venía acompañada con un detalle, que al igual que nuestra
industria humana moderna se traduce en un gas de desecho que resulta tóxico.
Estamos hablando del dioxígeno gaseoso O2. Por
muchos milenios las cantidades de dioxígeno se acumularon en la atmósfera, pero
a medida que se producía era consumido por el hierro disuelto en los mares en
forma del ion hierro(2+) el cual capturaba el oxígeno y reaccionaba para formar
óxido de hierro(3+) o hierro férrico (Bekker et al., 2014; De Duve &
Pizano, 1995; Gaucher, Sial, & Frei, 2015; Planavsky et al., 2014). Cuando el hierro se acabó la atmósfera se saturó de repente,
generando el gran evento de oxigenación, conocido como la primera extinción en
masa (Fru et al., 2016; Johnson et al.,
2015; Planavsky et al., 2014; Schirrmeister, de Vos, Antonelli, & Bagheri,
2013; Schirrmeister, Gugger, & Donoghue, 2015; Zerkle et al., 2017).
Cierto tipo de cianobacterias se
encuentran como endosimbiotes de células eucariotas conocidas como algas o
plantas y se las llama cloroplastos (Gray & Archibald, 2012). La fotosíntesis del tipo II es la fotosíntesis que estudiamos en
primaria y que veremos con mayor profundidad en los artículos posteriores. Al
igual que la respiración celular aeróbica y en la glucólisis, la fotosíntesis
se la debe entender como reacciones de transferencia de energía, en las que,
los portadores de energía se convierten en pasos clave. Saber distinguir donde
se producen o donde se consumen los portadores de energía, permiten dar orden y
comprensión a los muchas veces confusos diagramas de reacciones.
2.5 Procesos inversos y complementarios
Tal como la suma complementa a la resta
siendo lo mismo, pero en sentido opuesto, la fotosíntesis tiene su opuesto en
la respiración celular aeróbica.
(Eq. 2.1) Reacción generalizada de la fotosíntesis.
(Eq. 2.2) Reacción generalizada de la respiración celular
aeróbica.
Las reacciones de luz de la fotosíntesis se parecen mucho a
los eventos de fosforilación oxidativa o cadena de transporte de electrones
respiratoria. La respiración celular es la oxidación de la glucosa a CO2 con
la reducción de O2 al agua, un proceso que genera ATP.
En la fotosíntesis, este proceso debe invertirse, reduciendo el CO2 y
oxidando el H2O para sintetizar la glucosa. Ahora
bien, sé que se pasaron por alto la parte crítica y casi que mágica de la
fotosíntesis, es decir, estamos hablando de oxidar el agua, una de las
moléculas más oxidadas y de menor energía que existen en la naturaleza, porque
si hubiera modo fácil de oxidar el agua, créanme que ya conducirías autos que
queman agua para movilizarnos, pero la naturaleza no funciona así, o por lo
menos no de manera sencilla.
Aunque los procesos de respiración y fotosíntesis son
químicamente opuestos entre sí, los principios bioquímicos que rigen los dos
procesos son casi idénticos, lo cual da pistas de una evolución por reclutamiento
paralelo y duplicaciones genéticas. La clave para ambos procesos es la
generación de electrones de alta energía. El ciclo del ácido cítrico oxida los
combustibles de carbono a CO2 para generar
electrones de alta energía. El flujo de estos electrones de alta energía en una
cadena de transporte electrónico genera una fuerza motriz protónica para que la
f1f0 ATP sintasa genere ATP para otros procesos celulares, sin contar con otras
moléculas portadoras de energía como NADH2. Para sintetizar glucosa
a partir de CO2, se requieren electrones de alta
energía para dos propósitos:
👉 proporcionar potencia reductora en
forma de NADPH para reducir CO2.
👉 generar ATP para alimentar la
reducción.
¿Cómo se pueden generar electrones de alta energía sin usar
un combustible químico? Inicialmente sería como pretender generar fuego a
partir de cenizas, pero recuerden que el Sol paga la fiesta. La fotosíntesis
utiliza la energía de la luz para impulsar los electrones de un estado de baja
energía a un estado de alta energía. En el estado de alta energía e
inestabilidad, las moléculas cercanas pueden fugarse con los electrones
excitados. Estos electrones se utilizan para producir energía reductora, y para
generar una fuerza motriz de protones a través de una membrana, que conduce
posteriormente a la síntesis de ATP. Las reacciones que son impulsadas por la
luz del sol se llaman las reacciones de luz.
3. Física de la fotosíntesis
3.1 La luz y la fotosíntesis
La radiación electromagnética es una cosa extraña a la cual los físicos describen como onda/partícula, es decir, expone características de onda, como la posesión de longitudes de onda y fenómenos como la reflexión y difracción de las ondas. Como partícula posee la capacidad para transmitir energía en unidades discretas llamadas cuantos. Dependiendo de la longitud de onda, la radiación electromagnética interactúa de forma diferencial con la materia, específicamente aquella radiación que está entre los 400 nm y los 700 nm estimula nuestros receptores visuales, y la llamamos luz, y a sus cuantos los llamamos fotones. Independientemente a su naturaleza final, a la luz en esta serie de escritos la manejamos como esa dualidad, en ocasiones la manejamos como una partícula "cuanto mencionamos los cuantos y fotones" y en otras como onda "longitudes de onda medidas en nanómetros nm".
Figura 3.1. de onda mayor
energía “violetas y ultravioletas”.
Una mol de fotones con una longitud de
onda de 680 nm contiene cerca de 45 kcal de energía, lo cual es equivalente a
un cambio de potencial redox de 1.8 voltios. La absorción de luz es el primer
paso en cualquier proceso fotoquímico. Cuando el fotón es absorbido por una
molécula, uno de sus electrones se estimula para pasar a un estado energético
de mayor energía.
3.2 Electrones excitados
Cada sustancia en la naturaleza puede
absorber algunas determinadas longitudes de onda, mientras que otras, las
refleja como si fuera un espejo, esto genera marcas distintivas de cada
sustancia química en forma de los espectros de absorción o de emisión en gases
o los colores de los sólidos y líquidos. En términos más físicos, lo que pasa
es que los electrones de las moléculas interactúan con fotones de determinadas
longitudes de onda, absorbiéndolos y aumentando su estado energético, proceso
llamado excitación. Los estados
excitados de los electrones son muy inestables y tienden a durar solo
nanosegundos. Numerosas cosas pueden pasar antes de ese límite de tiempo, una
es que el electrón emita el fotón reflejando la luz, pero otra muy diferente
ocurre en la clorofila. Cuando la clorofila es sometida a la luz de forma
aislada esta refleja los fotones que absorbe tornándose fluorescente, emitiendo
los fotones en una longitud de onda inferior a la que la recibió “parte de la
energía se pierde en forma de calor”. Sin embargo, si el mismo experimento es
llevado a cabo en una cantidad de cloroplastos que contienen la misma cantidad
de clorofila, apenas si se nota una muy leve fluorescencia. Es decir, en tales
casos la energía lumínica no se pierde de nuevo al ambiente, por el contrario,
es almacenada por el cloroplasto y empleada para realizar sus procesos de
síntesis de alimentos.
4. Pigmentos fotosintéticos
|| Regresar al Índice ||
En procariotas tales como cianobacterias, la fotosíntesis tiene lugar en gránulos unidos a la membrana plasmática o en un sistema de membranas internas propio llamado tilacoide. El sitio de la fotosíntesis en eucariotas como las plantas verdes y las algas verdes es el cloroplasto, una organelo que discutimos en la unidad de La Célula. Al igual que la mitocondria, el cloroplasto tiene membranas internas y externas y un espacio intermembrana.
Figura 4.1. El cloroplasto
posee una serie de membranas internas donde se sitúan complejos de proteínas
encargados de evitar que la energía de la clorofila escape de regreso al
ambiente.
Además, dentro del cloroplasto hay cuerpos
llamados grana, que consisten en pilas de membranas aplanadas como monedas
llamadas discos tilacoides, el nombre común a las membranas de las
cianobacterias no es ninguna coincidencia, pues ambas hacen lo mismo con las
mismas enzimas, lo cual es una evidencia de su relación evolutiva (De Clerck, Bogaert, & Leliaert,
2012; Gray & Archibald, 2012). Las granas están conectadas por membranas llamadas láminas
intergranales. Los discos tilacoides se forman mediante el plegado de una
tercera membrana dentro del cloroplasto. El plegamiento de la membrana
tilacoide crea dos espacios en el cloroplasto además del espacio intermembrana.
El estroma se encuentra dentro de la membrana interna y fuera de la membrana
tilacoide. Además del estroma, hay un espacio intertilacoidal. La captura de la
luz y la producción de oxígeno tienen lugar en los discos tilacoidales. Las
reacciones oscuras (también llamadas reacciones independientes de la luz), en
las que el
Está bien establecido que el evento
primario en la fotosíntesis es la absorción de luz por la clorofila. Los
estados de alta energía (estados excitados) de la clorofila son útiles en la
fotosíntesis porque la energía luminosa se puede pasar a lo largo de complejos
enzimáticos y se convierte en energía química en las reacciones de la luz. Hay
dos tipos principales de clorofila, la clorofila a y la clorofila b. Los
eucariotas tales como las plantas verdes y las algas verdes contienen clorofila
a y clorofila b. Los procariotas tales como las cianobacterias (antes llamadas
algas azules-verdes) contienen sólo clorofila a. Las bacterias fotosintéticas
distintas de las cianobacterias tienen bacterioclorofilas, siendo la
bacterioclorofila a la más común. Los organismos como las bacterias verdes y
sulfuropurpurosas, que contienen bacterioclorofilas, no utilizan el agua como
la fuente última de electrones para las reacciones redox de la fotosíntesis, ni
producen el oxígeno. En su lugar, utilizan otras fuentes de electrones como
4.1 La clorofila
Los pigmentos son compuestos que tiñen de determinado color una solución, debido a que absorben y reflejan determinadas longitudes de onda. La luz absorbida son los colores que desaparecen de nuestra vista, mientras que la luz reflejada son los colores que aparecen a nuestra vista.
Figura 4.2. En el presente espectro de
absorción se muestra en el eje (x) las longitudes de onda de la radiación
electromagnética asociada a determinados colores. En el eje (y) se encuentra el
nivel de absorción relativo de determinada longitud de onda. La clorofila a
absorbe principalmente dos colores, el azul oscuro y el rojo intenso, los demás
colores los emite.
La clorofila que significa afín o amante
del verde es por lo tanto un nombre paradójico para los pigmentos verdes. Esto
se debe a que los pigmentos verdes absorben todos los colores, menos el verde
el cual expulsan o emiten al ambiente. Las hojas y una amplia gama de
estructuras vegetales son verdes debido a que sus cloroplastos poseen grandes
cantidades de clorofila que constantemente se encuentra emitiendo luz de
longitud de onda verde que no es absorbida para realizar la fotosíntesis. Los
colores cuyas longitudes de onda son más fuertemente absorbidos por la
clorofila son el azul y el rojo.
👉 Estructura de la clorofila: Existen dos clases de clorofila, la clorofila a y la clorofila b,
ambos son pigmentos verdes que absorben longitudes de onda especialmente en el
azul y el rojo Figura 4.2. En
la Figura 4.3
podemos ver la estructura general de la clorofila, en verde el anillo de
porfirina con su centro de magnesio
Figura 4.3. Estructura general de la
clorofila.
Las diferencias mínimas en la estructura,
alteran las longitudes de onda a las que responde cada molécula de clorofila.
El resto de la estructura es similar. La clorofila a es una molécula de dos
partes.
👉 Funcionamiento de la clorofila: La primera parte es un anillo de porfirina, que funciona como la parte de absorción de luz (Figura 4.3 en verde). Este anillo se encuentra en el interior de la membrana celular. La estructura recuerda a la del grupo heme, siendo un marco orgánico que apoya la función de un metal pesado. En la hemoglobina es un átomo de hierro, mientras que en la porfirina es un átomo de magnesio. El anillo de porfirina posee una propiedad similar a la del anillo del benceno, sus enlaces dobles y simples alternantes no son más que una representación del enlace deslocalizado en donde los electrones fluyen de manera poco unida a sus respectivos núcleos. Cuando un fotón de luz impacta contra el anillo de porfirina, se causa una redistribución de la densidad de electrones, los cuales, al estar deslocalizados, se liberan del anillo confacilidad. En otras palabras, la forma en como está unido el anillo de porfirina hace que los electrones de los enlaces dobles y simples sean fáciles de arrancar, y solo basta la energía contenida en un fotón de luz para lograr ese cometido. El anillo de porfirina vibra con los fotones de algunas longitudes de onda, mientras que otras simplemente pasan sin activar el sistema de emisión de electrones, siendo rebotados y generando su color, en otras palabras, el color de la clorofila es aquel que esta no emplea para la fotosíntesis.
Figura 4.4. Espectros de absorción de las
clorofilas a y b, en ambos casos los colores verdes no son absorbidos, lo cual
hace que estas sustancias se vean de ese mismo color.
Este detalle es particularmente evidente
en un espectro de absorción de absorción de luz para la molécula de clorofila (Figura 4.2 y Figura 4.4). Al
igual que cuando se hace para la fase gaseosa de ciertos elementos purificados,
el espectro de absorción es único, y permite identificar la molécula. Sin
embargo, ciertos polipéptidos cortos unidos de manera débil a la clorofila
pueden modificar el espectro de absorción de luz. Diferencias en la absorción
de luz entre las clorofilas a y b. Aunque ambas tienen picos de absorción hacia
los mismos colores "azul y rojo" no se sobrelapan completamente,
permitiendo absorber más gamas de ambos colores. Cabe anotar que otra
diferencia entre ambas clorofilas en las plantas terrestres es que se asocian a
un fotosistema específico.
4.2 Carotenoies
A parte de la clorofila y los carotenoides existen otros pigmentos fotosintéticos que pueden absorber los verdes como la ficoeritrina y la ficocianina presente en las cianobacterias.
Figura 4.5. Espectros de
absorción de las clorofilas a y b, así como otros pigmentos como los
carotenoides, la ficoeritrina y la ficocianina, los cuales tienen absorciones
en el verde, por lo que se verán azules, anaranjados o rojos.
Muchas clases de clorofila no son
reconocidas como tales debido a una diversidad de polipéptidos accesorios que
alteran las longitudes de onda a las cuales responden. Las clorofilas sin
alterar se encuentran más ampliamente distribuidas en cianobacterias, algas y
plantas terrestres, sin embargo, las plantas terrestres tienen otras clorofilas
modificadas. Esto se debe a que el agua también es una molécula que responde a
la luz, absorbiendo longitudes de onda que se relacionan con colores que se
pierden cuando la luz ingresa al agua. En tierra esas longitudes de onda se
mantienen y portan energía. Estas clorofilas modificadas se denominan
carotenoides, las cuales se caracterizan por emitir luz no absorbida en los
colores amarillo y anaranjado.
Cuando los tejidos vegetales acumulan una
gran cantidad de carotenoides adquieren colores característicos Amarillo y
anaranjado como en la zanahoria y la naranja. Estos pigmentos son acumulables
cuando son consumidos en el tejido adiposo de los mamíferos. Una persona con
una dieta excesiva de carotenoides se pondrá amarillo o anaranjado como una
zanahoria. Los carotenoides poseen funciones múltiples, en primera instancia en
honor a su origen filogenético, actúan como pigmento fotosintético secundario.
Adicionalmente ayudan a estabilizar a las
clorofilas extrayendo exceso de energía desde las clorofilas verdes y
emitiéndola al ambiente en forma de calor. Esto se debe principalmente a que el
calor puede romper el anillo de porfirina y otros componentes claves del
sistema fotosintético. Otro efecto perjudicial, es que el oxígeno absorbería
esa energía calórica haciéndolo hiperreactivo, y el oxígeno hiperreactivo es
hipervenenoso, hipermutagénico, hipercancerigeno, e hipermortal.
4.3 Las clorofilas y carotenoides como celdas solares
En 1932, Robert Emerson y William Arnold
del Instituto Tecnológico de California llevaron a cabo una serie de
experimentos que conllevaron a una extraña conclusión (Emerson & Arnold, 1932a, 1932b). No toda la clorofila en una planta era empleada para la
conversión de energía lumínica en energía química. Empleando suspensiones del
alga verde denominada Chlorella spp., y rayos de luz de duración extremadamente corta se pudo
determinar la cantidad de energía mínima para la producción óptima de oxigeno
durante la fotosíntesis. Basados en la cantidad de clorofila presente en la
preparación, calcularon que una sola molécula de oxigeno era liberada durante
un rayo de luz muy corto por cada 2500 moléculas de clorofila presentes.
Posteriormente, Emerson demostró que se necesitaba un mínimo de 8 fotones para
poder sintetizar una sola molécula de oxigeno molecular, lo cual implica que
los cloroplastos poseen cerca de 300 veces las moléculas que deberían ser necesarias
para oxidar el agua y sintetizar el oxígeno molecular. Lo anterior nos lleva a
la pregunta ¿para qué sirve la clorofila extra?
Figura 4.6. La unidad
fotosintética actúa como una celda solar. Los carotenoides filtran la energía
que dañaría a la célula, mientras que las clorofilas transfieren la energía
restante de fotones a electrones vibratorios.
Una posible interpretación de estos resultados es que solo un pequeño porcentaje de las moléculas de clorofila están relacionadas con la fotosíntesis en sí misma, lo cual es una verdad a medias y una falsedad a medias. Las clorofilas se encuentran empaquetadas y actúan en grupos como uno solo, en una estructurada denominada unidad fotosintética. La unidad fotosintética posee clorofilas que se distribuyen las funciones, solo una parte de las clorofilas se desempeñan como el centro de reacción de la clorofila. La función del centro de reacción es transferir electrones a un aceptor. A pesar de que la mayor parte de las clorofilas no participan de manera directa en la conversión de luz en energía química, ellas son responsables de la absorción de la luz.
Figura 4.7. La unidad
fotosintética se divide en dos partes, la antena que transmite la energía y el
centro de reacción.
Las clorofilas y los carotenoides se los
pueden clasificar dos grupos diferentes, la antena y el centro de la reacción.
En la antena se encuentra la mayor densidad molecular de clorofilas, así como
los carotenoides que la protegen. La energía se transfiere desde los pigmentos
que capturan mayor energía a los que capturan menor energía. La transferencia
de la energía de excitación desde una molécula a otra es muy sensible a la
distancia entre las moléculas. Las moléculas en una antena de fotosíntesis se
mantienen a una gran proximidad unas de otras para no disipar la energía
capturada.
Una regla que opera en los pigmentos de la
antena fotosintética, es que la energía solo se puede transmitir a una molécula
que pueda capturar la misma o menor energía. En otras palabras, la energía solo
puede pasar a una molécula que absorbe luz en la misma o en una longitud de
onda más grande “corriendo hacia el rojo”. A medida que la energía pasa de una
molécula a otra parte de ella se disipa y una fracción llega al centro de
reacción, la cual procesa menor energía que cualquier otra molécula ubicada en
la antena. Una vez el centro de reacción captura energía, este emite un
electrón hacia su aceptor.
5. Destino de los átomos en la fotosíntesis
|| Regresar al Índice ||
¿Qué hay que entender en esencia de la
fotosíntesis?, diría que cual es el destino de las materias primas. Por
ejemplo, todos sabemos desde la infancia que la fotosíntesis produce oxígeno a
partir del dióxido de carbono y el agua. Una pregunta adecuada es, ¿de dónde
viene el oxígeno de respiramos? Una vez damos la respuesta, del agua
convertimos a la otra alternativa “dióxido de carbono” en una respuesta de
tontos, en un error. Sin embargo, históricamente muchos miembros de la
comunidad científica asumían precisamente esta alternativa como válida dentro
de las presunciones plausibles.
(Eq. 5.1)
Antes de la propuesta de C. B. van Niel en la década de los 30s del siglo XX (Stanier & Van Niel, 1941; C B Van Niel, 1935, 2006; C Bo van Niel, 1949), muchos miembros de la comunidad científica pensaban que el proceso de la fotosíntesis se caracterizaba por que el dióxido de carbono era “roto” de forma tal que el carbono se transmitía a la molécula de agua reorganizándola para formar la base de un carbohidrato, mientras que los dos oxígenos liberados se unían para forman el oxígeno molecular diatómico.
(Eq. 5.2)
En 1931 van Niel propuso la alternativa
que se ha convertido en nuestra explicación estándar para el proceso de la
fotosíntesis y el destino de los átomos de las moléculas precursoras de la
fotosíntesis. Su trabajo se concentró en las bacterias verdes sulfurosas.
(Eq. 5.3)
Las bacterias verde sulfurosas se
caracterizan por realizar fotosíntesis SIN AGUA, en lugar de agua, estas
bacterias emplean una molécula análoga al agua llamada ácido sulfhídrico (H2S). Los estudios de este
tipo de fotosíntesis revelaron que generaba el mismo tipo de carbohidratos que
las fotosíntesis con base en agua, sin rastros de azufre en este lugar. ¿En
dónde estaba el azufre? la respuesta está en la razón por la cual llaman a
estas bacterias “sulfurosas”, ¡produce azufre! en lugar de oxígeno.
(Eq. 5.4)
Con estos datos van Niel propuso una
reacción general para las dos fotosíntesis postulado que en ambos casos agua o
azufre, eran ellos la molécula que era “destruida” para reorganizar sus átomos,
en ambos casos los hidrógenos serian empleados para “según el equilibrio
químico de la reacción” unirse al dióxido de carbono convirtiéndolo en la base
del azúcar sintetizado, mientras que el átomo de oxígeno/azufre era liberado y
segregado, ya fuera de forma oxígeno molecular gaseoso o como azufre.
(Eq. 5.5)
Esta propuesta realizada principalmente en
base al balanceo de una reacción química, “sin asumir criterios biológicos en
estas cajas negras llamadas células fue corroborada en 1941 por Samuel Ruben y
Martin Kamen de la universidad de California, Berkeley. Los investigadores
emplearon isótopos del oxígeno para sintetizar agua marcada. De esta forma era
posible rastrear el destino final del isótopo del oxígeno y así diferenciarlo
del oxígeno normal del dióxido de carbono (Carson, Ruben, Kamen, & Foster,
1941; Foster, Carson, Ruben, & Kamen, 1941; S Ruben & Kamen, 1941; Samuel
Ruben, Randall, Kamen, & Hyde, 1941).
Si el oxígeno marcado terminaba en los azucares y tejidos de las plantas se refutaría la propuesta de van Niel, pero si el oxígeno marcado terminaba siendo liberado en forma gaseosa, la propuesta de van Niel sería confirmada. Al realizar el experimento, las algas verdes emitieron el oxígeno marcado de forma gaseosa. La propuesta de van Niel es importante en el sentido de que convierte a la fotosíntesis en el proceso opuesto a la respiración celular. Sin embargo, en los próximos artículos evaluaremos esta “caja negra” que está en medio de los reactivos y los productos, pues la complejidad de la fotosíntesis se pierde mucho cuando se la simplifica a una simple reacción química.
Figura 5.1. Complejo
multiprotéico de las reacciones lumínicas de la fotosíntesis del tipo II.
El proceso de fotosíntesis se divide en
dos etapas de reacciones muy diferentes entre sí, la primera etapa es la de
reacciones dependientes de luz, en la cual se realizan muchas de las funciones
que desde los cursos de primaria de adjudicamos a este proceso, como la
producción de oxígeno dependiente de reacciones basadas en la luz y la
clorofila. La segunda fase es el de las reacciones independientes de la luz o
también llamadas fase oscura. Este grupo de reacciones son en esencia lo
opuesto al ciclo de Krebs aunque un poco más compleja.
6. Reacciones de la luz 1, la oxidación del agua
|| Regresar al Índice ||
La evolución de los seres vivos capaces de emplear agua como una fuente de electrones acompañó una de las mayores modificaciones en los mecanismos de fotosíntesis que se han documentado hasta la fecha. El agua en esta historia no es un aceptor de electrones, de hecho, el agua es una molécula muy oxidada y es muy difícil que acepte más electrones. Uno de los puntos cruciales de la fotosíntesis del tipo II es que emplea agua como fuente de electrones. Como ya se dijo en la sección anterior, el centro de reacción del fotosistema emite electrones desde sí mismo a un aceptor, pero si no existiera una fuente de electrones externa, al poco tiempo, las moléculas de clorofila se quedarían sin electrones para enviar a su aceptor. El agua es la clave en este punto, ya que a partir de su rompimiento en el fotosistema II, permite extraer los electrones que regeneran los que ha perdido el centro de reacción del fotosistema.
Figura 6.1. ¿Qué es la
fotosíntesis?, es literalmente una cadena de transporte de electrones que
genera una corriente eléctrica con el Sol y electrones provenientes del agua. A
diferencia de la cadena de transporte de electrones de la respiración que es
una "bajada", en la fotosíntesis tenemos una montaña rusa, en esta
hay dos subidas representadas por los fotosistemas, y dos bajadas representadas
por una serie de aceptores/donantes de electrones que deben terminar en la
síntesis de NADPH. El esquema aquí presentado se denomina esquema Z
"aunque a mí me parece más una M".
Durante la fotosíntesis que emplea agua
como fuente de electrones, el sistema se distribuye de manera similar a la
cadena de transporte de electrones de la respiración celular aeróbica, con una
serie de complejos proteínicos que terminan en una f1f0 ATP sintasa. Los otros
complejos son tres, dos de ellos son fotosistemas, y el último es un citocromo
reducto de la cadena de transporte de electrones que dio origen a la
fotosíntesis de tipo II. El orden completo del proceso es fotosistema II,
citocromo, Fotosistema I y f1f0 ATP sintasa. En medio de estos sistemas se
encuentran una serie de moléculas vinculantes tal como sucede en la cadena de
transporte de electrones de la respiración celular aeróbica, los cuales
transportan electrones casi como una red eléctrica. El fotosistema II carga con
energía a los electrones extraídos del agua hasta un nivel intermedio. El
segundo fotosistema retoma estos electrones después de haber perdido una
fracción de esta energía y los vuelve a cargar a un nivel superior del que
necesita el NADP+ para reaccionar con iones protio(1+) y convertirse en NADPH.
A pesar de las diferencias, la
organización general de los fotosistemas es muy similar entre sí, lo cual
implica un origen a partir de un solo fotosistema ancestral mediante
duplicación de genes. El fotosistema ancestral es homologo al fotosistema I, el
cual, aunque no puede operar con agua sin el fotosistema II, si lo puede hacer
de manera autónoma si el donante de electrones inicial es el ácido sulfhídrico
u otras fuentes minerales de rocas especiales.
6.1 Estructura del fotosistema I y II
El centro de reacción de la molécula de
clorofila es pequeño en comparación con su respectiva antena. Recuérdese que
los cálculos originales establecían que existía 300 veces más clorofila de la
que se empleaba en la producción de electrones. El centro de reacción del
fotosistema II está compuesto por 2 moléculas de clorofila, es decir un dímero
al cual se le denomina pigmento absorbente de la longitud de onda 680
nanómetros, o para recortar P680.
El centro de reacción del fotosistema I
también es un dímero de clorofilas al cual se le denomina pigmento absorbente
de la longitud de onda 700 nanómetros, o para acortar P700. Cuando un rayo de Sol impacta en el tilacoide de un cloroplasto,
su energía es absorbida parcialmente por las secciones de la antena del
fotosistema, compuesto por cientos de moléculas de clorofila. Rápidamente la
energía es trasferida con cierto nivel de pérdida al centro de reacción que
libera electrones. Una vez que ambos fotosistemas liberan electrones, adquieren
una carga positiva que provoca que adquieran la tendencia a atraer electrones
de otras partes. Más allá de los
procesos subsecuentes, el paso antes mencionado es la clave de todo el proceso,
ya que es aquí donde, la energía de la luz en forma de fotones sin masa, se
transfiere a los electrones con masa, es decir, donde energía en términos
físicos se convierte energía en términos químicos, y más aún en términos de una
corriente de electrones.
6.2 Estructura
del fotosistema II. Parte superior
Aunque originalmente no existe un sentido de arriba o abajo, estableceremos un marco de referencia vinculado al modo en que se representa a la cadena de transporte de electrones de la fotosíntesis en todos los esquemas que he visto. Así siempre está “abajo” el lumen o interior del tilacoide y siempre está “arriba” el estroma del cloroplasto, así que esa será la dirección sobre la cual estableceremos de aquí en adelante la orientación de nuestras palabras. Es decir, para saber ubicarnos en los mapas de las representaciones de las reacciones lumínicas diremos que, el centro del fotosistema es el centro de reacción fotosintético, la parte de arriba es la mitad que da hacia el estroma y la parte de abajo es la que termina hacia el lumen. El fotosistema no es solo un grupo de moléculas de clorofila, es un complejo de proteínas con varios grupos prostéticos de importancia.
Figura 6.2. Estructura
completa del fotosistema II, "arriba" estroma, "abajo"
lumen. La región de la antena se encuentra hacia arriba, mientras que el
dominio que degrada el agua y sintetiza el oxígeno molecular está abajo., en el
centro se encuentra una serie de aceptores/donantes de electrones. El proceso
de flujo de electrones empieza en el centro de reacción que realiza un proceso
doble, al activarse empuja un electrón hacia la parte de arriba del
fotosistema, y al mismo tiempo genera un efecto de atracción hacia electrones
que provienen de la parte inferior del fotosistema.
El proceso inicia con la extracción de
electrones desde el agua “rompiéndola en el proceso”, y termina con la deposición
de estos electrones en una molécula llamada plastoquinona “PQ a PQ2-”. Los eventos comienzan con la absorción de luz por parte de los
pigmentos de la antena en el complejo de captura de luz externa (LHCII). La
energía es transferida desde LHCII a través de la antena interna que sirve
conector hacia el centro de reacción “P680” de clorofila a, donde cada una de las 4 moléculas están
cercanamente unidas. El dímero P680 y otras dos moléculas de clorofila a accesorias. Como ya se ha
mencionado anteriormente, cuando la energía impacta de P680 un electrón es emitido con alta
energía hacia un aceptor “o más bien una cadena de aceptores”. El primer
aceptor se denomina feofitina “Pheo”, la cual es una molécula de clorofila que carece del centro de
magnesio II. El segundo aceptor de electrones es la plastoquinona A (PQA) ubicado en el estroma
del tilacoide. Posteriormente avanza hacia un grupo prostético de hierro “no
insertado en un grupo hemo”. El siguiente aceptor de electrones es la molécula
móvil llamada plastoquinona B (PQB) que no hace parte integral del fotosistema II, es decir, PQB puede salir o ingresar
del fotosistema II dependiendo de si está oxidado o reducido. PQB ingresa al fotosistema
II oxidado “sin el par de electrones energéticos”, en el fotosistema II se le
transfieren los electrones uno por uno desde el hierro prostético. Una vez que
los dos electrones han sido cargados en PQB, dos protones ingresan desde el estroma formando PQBH2, en este
punto esta molécula abandona el fotosismeta II. PQB es apolar, por lo que al salir del fotosistema ingresa en la
membrana del tilacoide.
6.3 Estructura del fotosistema II. Parte inferior
A medida que los eventos en la parte media
y superior del fotosistema II ocurren (visto si ponemos al estroma del cloroplasto
arriba y el lumen del tilacoide abajo), otra serie de reacciones toman lugar
hacia la zona del lumen del cloroplasto. Una vez que el centro fotosintético
pierde un electron incrementa su afinidad hacia electrones externos, los cuales
vienen de “abajo” donados por otra serie de grupos prostéticos y finalmente
desde el agua. Viendo desde el centro de reacción fotosintético, el primer
donante de electrones es un grupo prostético llamado TyrZ. TyrZ
dona un electrón por cada uno que pierde el centro de reacción. Por debajo se
encuentra un complejo de metales, el manganeso y el calcio formando una
estructura cubica. Por cada 4 átomos de manganeso existe un átomo de calcio. El
centro metálico requiere de DOS moléculas de agua para operar la lisis y la síntesis
de oxígeno y 4 iones protio(1+). Los detalles de cada uno de estos procesos se
estudiarán en artículos posteriores.
6.4 Funcionamiento del fotosistema II
El fotosistema II emplea la luz absorbida
para realizar dos actividades interrelacionadas. La primera es la generación de
una corriente de electrones a través del fotosistema, iniciando desde el centro
de la reacción, empujando y jalando electrones de manera simultánea. Los
electrones empujados son enviados hacia una serie de portadores que terminan en
la plastoquinona. Los electrones jalados provienen a su vez de otra serie de
portadores de electrones que tienen su origen último en varias moléculas de
agua. El fotosistema II de una célula vegetal es un complejo de más de 20
polipéptidos, la mayoría de los cuales se encuentran integrados en la membrana
del tilacoide. Dos de estas proteínas se designan con los códigos D1 y D2.
D1 y D2 son particularmente
importantes ya que ellos se unen al centro de reacción P680 y a todos los cofactores
involucrados en el transporte de electrones a través de todo el fotosistema. El
primer paso en la activación del fotosistema II es la absorción de luz por
parte de los pigmentos de la antena. La
mayoría de los pigmentos de la antena que recolectan energía residen en el
interior de un complejo de pigmentos separado denominado “Complejo de
Recolección de Luz II, también llamado LHCII por sus siglas en ingles”. Las
proteínas del LHCII se unen tanto a las clorofilas como a los carotenoides y
son dispuestas de manera externa al núcleo del fotosistema. El LHCII no es un
sistema rígido, bajo ciertas circunstancias puede migrar para asociarse al
fotosistema I y servir como antena de recolección de luz para el centro de
reacción P700.
6.5 Plastoquinona
Es una molécula de la familia de las quinonas,
muy similar en su estructura a la ubiquinona “coenzima Q10”. Esto implica que es
una molécula apolar que se mueve con facilidad en el interior de la membrana
celular pero que no puede moverse hacia las regiones acuosas. La plastoquinona
es un portador de energía en el mismo sentido que el NAD y el FAD, es decir tyransporta
tanto electrones energérticos “que precisamente deben terminar en el NADP” y también protones desde el
estroma del cloroplasto a lal interior del tilacoide generando un diferencia
electroquímico de concentración de protones. Con el diferencial electroquímico
se genera un gradiente de protones que permitirá el movimiento de una F1F0 ATP
sintasa igual que en la respiración celular aeróbica. La plastoquinona al ser
cargada con dos electrones energéticos y dos protones provenientes de iones
protio(1+) del estroma del cloroplasto pasa a denominarse plastoquinol. Varias
moléculas derivadas de la plastoquinona han demostrado poseer efectos
antioxidante y antienvejecimiento.
6.6 Flujo de electrones desde el fotosistema II a la plastoquinona
La energía de excitación es transferida
desde los pigmentos de la región externa de la antena LHCII a un pequeño número
de clorofilas de la antena interna ubicadas cerca del núcleo del fotosistema
II. Desde aquí la energía termina en el centro de reacción P680. Como se ha mencionado
reiterativamente, el centro de reacción libera electrones con la absorción de
luz, pero esto ocurre del siguiente modo.
La importancia de este diferencial de
cargas se hace evidente cuando se analizan los potenciales de
oxidación-reducción de estas dos especies. P680 al poseer una carga positiva incrementa su electronegatividad y
afinidad por electrones, lo cual implica que puede aceptar electrones con suma
facilidad “con menor energía”, convirtiéndolo en un potente agente oxidante. En
contraste,
(Eq. 6.1)
Debido a que ambas especies poseen cargas
opuestas, con tendencias complementarias, el proceso de fotosíntesis sería
imposible si no existiera una salvaguarda que impidiera que ambas especies
reaccionaran entre sí, disipando la energía en forma de calor. El proceso se
logra simplemente mediante la transferencia del potencial de óxido-reducción a
las zonas opuestas del fotosistema II. En otras palabras,
La plastoquinona A es solo un portador de
electrones momentáneo, que de manera inmediata transfiere su electrón a una
segunda molécula de plastoquinona que no permanece de marea permanente en el
fotosistema II. Esta segunda molécula de plastoquinona se denomina
plastoquinona B o PQB.
La plastoquinona B permanece fuertemente ligada al dominio D1 del fotosistema II aun
cuando recibe un electrón. Solo hasta que la plastoquinona B recibe un segundo
electrón se libera del dominio D1 y reacciona como una base con un par de protones provenientes del
estroma donde se encuentran almacenados en forma de iones protio(1+). Una vez
los protones “hidrógenos” son transferidos a la plastoquinona esta se
transforma en plastoquinol. Una vez D1 pierde una plastoquinona en
forma de plastoquinol, reemplaza su perdida por una nueva molécula de
plastoquinona completamente oxidada “no electrones y no protones”, para la
siguiente ronda de reacciones.
6.7 Flujo de electrones desde el agua al fotosistema II
Producir energía a partir del agua es una
gran farsa, la cantidad de energía que almacena del agua es extremadamente baja
en términos de procesos químicos y termodinámicos. Como cualquier molécula
altamente estable, el agua necesita energía para romperse, no al revés. Toda
reacción para que sea termodinámicamente favorable requiere emitir energía al
universo, por lo cual para romper el agua se debe generar un estado o material
que al reaccionar con ella sintetice una molécula de menor energía "con la
consecuente liberación del sobrante energético al universo". Un último
detalle adicional, la UNICA reacción de carga de energía en electrones, es la
transferencia de electrones desde P680 hacia Pheo. TODAS las demás reacciones de transferencia de energía DEBEN
realizarse cuesta abajo, con transferencias energéticas en las que los productos
son siempre de menor nivel energético.
(Eq. 6.2)
(Eq. 6.3)
Las reacciones de trasferencia de electrones desde el agua hacia P680 por muchas décadas fue la parte menos conocida de las reacciones de fotosíntesis. A pesar de que la reacción general de la fotosíntesis había sido formulada desde principios del siglo XX, no fue sino hasta 1970 que gracias a los trabajos de Pierre Joliot y Bessel Kok, quienes propusieron la hipótesis del estado S “mecanismo de funcionamiento del complejo de evolución de oxígeno". A pesar de que el agua es una molécula muy estable que necesita de grandes cantidades de energía eléctrica o temperaturas superiores a los 2000°C para romperse, los cloroplastos pueden lograrlo aun en plantas que habitan en las montañas de las tundras del extremo norte y sur del mundo, solo con la energía del espectro visible. El rompimiento del agua durante la fotosíntesis se llama fotolisis. Sin embargo, la fotolisis no ocurre mediante un segundo bombardeo de fotones, todo debe lograrse mediante los productos que surgen de la primera reacción del fotosistema.
(Eq. 6.4)
La única reacción donde interviene la luz (γ) es esta, el flujo de electrones desde el centro de reacción P680 a Pheo. Una vez que P680 se torna positivo se convierte en un agente oxidante más potente que el oxígeno, lo cual le permite atraer electrones hacia sí mismo. Los electrones son jalados de forma tal que P+680 es el último aceptor de electrones en esta cadena. La formación de una sola molécula de oxígeno necesita la fotolisis de dos moléculas de agua, de manera simultánea. Pero la cadena de transporte de electrones en el fotosistema II solo permite el flujo de un electrón a la vez. Adicionalmente, los experimentos en esta fase de la fotosíntesis se realizaron con ráfagas de luz muy breves, lo cual permitió determinar que una molécula de oxigeno era producida por cada cuatro ráfagas (4 equivalentes de fotones) de luz en el fotosistema.
Figura 6.3. Abajo se
encuentran dos moléculas de agua que al ingresar en el complejo de evolución de
oxígeno reaccionan, liberando 4 electrones, 4 protones y una molécula de
oxígeno molecular. Los electrones los jalados hacia P680 gracias a una molécula
similar a la clorofila que sirve como puente llamada TyrZ.
6.8 Dos de agua y cuatro electrones
El problema se resuelve mediante un
mecanismo capaz de ahorrar electrones en grupos de 4. A medida que la cadena de
transporte de electrones los necesita, este complejo libera de uno en uno,
hasta que se queda vacío. En este punto reacciona de manera simultánea con dos
moléculas de agua, para extraer cuatro nuevos electrones y de este modo volver a
completar sus reservas para los siguientes cuatro préstamos.
(Eq. 6.5)
Este complejo de ahorro de cuatro
electrones por ciclo se le denomina complejo
de evolución de oxígeno. Está compuesto por 5 átomos metálicos, 4 de
manganeso y 1 de calcio. El complejo solo almacena la suficiente
electronegatividad para oxidar el agua una vez ha perdido sus cuatro electrones
completamente, y esto solo ocurre una vez P680 se ha tornado positivo cuatro veces consecutivas.
6.9 Fotoinhibición
Debe tenerse en cuenta que, el exceso de
luz puede acarrear problemas potenciales para el fotosistema. Recordemos que el
proceso transcurre gracias a la formación de agentes oxidantes más potentes aun
que el propio oxígeno, y de igual forma pueden ocurrir errores durante la
reacción del complejo de evolución de oxígeno con el agua dando lugar a
especies de oxígeno tóxicas. Fuera de control, estas especies pueden oxidar lo
que sea, incluyendo el ADN del cloroplasto. A este fenómeno se lo denomina
fotoinhibición. La luz ultravioleta puede formar especies de manganeso de
valencias muy altas, las cuales inducen a daños en las proteínas que sirven de
marco para la cadena de transporte de electrones del fotosistema II. Del mismo
modo, un exceso de P+680 conlleva a la oxidación de las proteínas que sirven de marco y
también de los pigmentos de la antena. En otras palabras, demasiada energía
sobrecarga el sistema y lo lleva a su propia destrucción. Los cloroplastos
poseen una gran cantidad de salvaguardas contra este fenómeno, varios
caterotenoides y derivados de la plastoquinona son antioxidantes. Mientras que,
por otra parte, el cloroplasto reemplaza constantemente su dominio D1 y a sus complejos de
evolución de oxígeno para evitar oxidarse a sí mismo. Los mecanismos de
protección son tan eficaces, que los vegetales se cuentan entre los seres vivos
más longevos del planea, existen árboles que han vivido por milenios sin
desarrollar cáncer.
7. Reacciones de la luz 2, Cadena de transporte de electrones y fosforilación
|| Regresar al Índice ||
Una vez fuera del agua los electrones, el
oxígeno y el ion protio(1+) seguirán destinos diferentes. El oxígeno formará su
gas diatómico en la mayoría de los casos O2 y será expulsado de la célula, el ion protio(1+) H+(aq) se quedará interno
aumentando la acidez, la presión osmótica y la diferencia de potencial
eléctrica, de manera semejante a lo que ocurre en la respiración aeróbica o en
la excitación de una neurona. Los electrones por otra parte fluirán a través de
la cadena de transporte hasta el aceptor final que es el NADP+. El
objetivo de este flujo será permitir el transporte de más iones protio(1+) al
interior con el consecuente aumento en acidez, osmolaridad y diferencia de
potencial eléctrico, haciendo que la membrana del tilacoide se cargue como una
batería.
7.1 Citocromo fotosintético b6f
El citocromo fotosintético recibe el nombre formal de citocromo b6f, el cual es homólogo en estructura y función al citocromo III (bc1) de la cadena de transporte de electrones de la respiración celular aeróbica. Ambos son un complejo de proteínas lleno de grupos prostéticos que permite el flujo de una corriente de electrones, en este caso del plastoquinol, y en el caso de su homólogo del ubiquinol.
Figura 7.1.
"Arriba" el estroma del cloroplasto, "abajo" el interior
del tilacoide. PQ transfiere dos protones al interior del tilacoide formando
dos iones H+(aq), mientras que el citocromo b6f
transfiere cuatro iones H+(aq) (representados
por la flecha vertical del centro de H+(aq) al interior
del tilacoide.
Ambos funcionan como una bomba de protones
que transfiere cuatro iones H+(aq) por cada par de electrones energéticos. Esto quiere decir que
existe un consumo de energía en esta fase de la fotosíntesis. El ubiquinol al
perder sus electrones transfiere dos protones a la región interna del tilacoide
formando otros dos iones H+(aq) extra. En total, por cada par de electrones son transferidos 4
iones H+(aq) desde el estroma al interior del tilacoide generando un gradiente
de protones que será empleado posteriormente por una f1f0 ATP sintasa.
Finalmente, los electrones son
transferidos a una molécula de transporte libre llamada plastocianina, que
sirve de homologo al citocromo c en el sentido de que es una molécula soluble
en agua, por lo que transmite sus electrones en el lado interno de la membrana,
transfiriendo los electrones al fotosistema I por el lado interno del
tilacoide. Se debe tener en cuenta que todas las reacciones descritas desde
7.2 Fotosistema I en la cadena de transporte de electrones fotosintética
El fotosistema I s menos complejo que el fotosistema II, en las bacterias verde sulfurosas, la fuente de electrones es una molécula de ácido sulfhídrico, y en los seres vivos equipados con el fotosistema II es una molécula de plastocianina.
Figura 7.2. Modelo que
representa la organización estructural y funcional del fotosistema I. Abajo se
encuentra el interior del tilacoide y arriba el estroma del cloroplasto. (A)
transferencia de los electrones desde la plastocianina al centro de reacción
P700. (2) (3) (4) (5) cadena de transporte de electrones al interior del
fotosistema II. (6) dos moléculas de ferredoxina que se encargan de reducir el
NADP a NADPH.
El fotosistema I funciona a su vez como
una cadena de transporte de electrones, y del mismo modo que en el fotosistema
anterior, la carga de energía solo se produce una vez en el centro de reacción
llamado P700. El proceso
inicia con la captura de un fotón por parte de la antena, la cual transfiere la
energía de forma vibracional al centro de reacción. Cuando el centro de
reacción captura energía, emite un electrón cargado hacia un aceptor de
electrones llamado
El electrón es finalmente transferido a la
ferrodoxina, una pequeña proteína de hierro-sulfuro que es externa al complejo
fotosintético I. Cuando dos moléculas independientes de ferrodoxina han
aceptado un electrón, actúan como un dímero que reduce una molécula de NADP+.
El NADP+ es entonces cargado con un par de electrones fotosintéticos
y al mismo tiempo capta un protón, de los iones protio(1+) circundantes, para
formar NADPH.
(Eq. 7.1)
El centro de reacción que ha perdido su
electrón (P+700) es restituido de manera directa por la plastocianina sin necesidad
de intermediarios como si ocurre con el fotosistema II.
7.3 El
fotosistema I de los vegetales terrestres
El fotosistema I de las plantas terrestres
consiste en un centro de reacción compuesto por entre 12 y 14 unidades de
polipéptidos y un complejo periférico de proteínas unidas a los pigmentos de la
antena. La energía lumínica es absorbida por la antena y pasada al centro de
reacción P700. El P700 es un dímero de clorofila a. El
primer aceptor de electrones es un monómero de clorofila denominado A0. El P+700 es un
agente oxidante muy potente, pero no tanto como P680, esto quiere decir que es capaz de oxidar moléculas de mayor
energía que el agua, como la plastocianina o el ácido sulfhídrico.
En resumen, los dos fotosistemas cargan
dos veces de energía a los electrones del agua, la primera vez a un nivel
suficiente para activar una bomba de protones, perdiendo parte de su energía en
el proceso. En este punto los electrones portan una energía semejante a los que
posee el ácido sulfhídrico. Esto es lo que le permite al fotosistema I operar
en ausencia de ácido sulfhídrico en las cianobacterias y las plantas. El
fotosistema II lleva los eletrones al nivel en que el fotosistema I puede
operar con normalidad. Este es un ejemplo de como la evolución opera en capas,
agregando funciones extra sobre funciones antiguas que siguen operando de un
modo muy parecido, aunque el resultado final del conjunto sea muy diferente.
👉 El fotosistema I, la reducción de nitrógeno y azúfre: Los electrones que pasan a través de la ferredoxina no siempre
terminan reduciendo el NADP+ a NADPH; los seres vivos fotosintéticos
pueden alterar la ruta de los electrones a través de la ferredoxina. Esto se
debe a que los seres vivos no solo necesitan reducir carbono a moléculas de
mayor energía, sino también otros compuestos químicos inorgánicos como el
amoníaco NH3,
el grupo nitrato NO3-, el grupo fosfato PO43- o el grupo sulfhidril SH-, los cuales son
componentes básicos de moléculas biológicas de importancia como las vitaminas,
los nucleótidos y más importante aún, las proteínas. La capacidad de reducir
compuestos inorgánicos simples y estables, a sustancias de alto peso molecular
es una de las habilidades más importantes de los seres vivos que sirven como
productores primarios. El fotosistema I es un mecanismo que sirve para esta
función de múltiples formas.
👉 Agro-tóxicos: Aunque a simple vista las plantas son
seres vivos muy diferentes de los seres humanos, es un hecho innegable que la
cadena de transporte de electrones y las reacciones de la fase luminosa
comparten procesos similares. Es por esta razón que muchos herbicidas tienen
efectos tóxicos remanentes que pueden llegar a afectar a las personas. Y el
hecho es que muchos de los herbicidas empleados industrialmente tienen su
blanco en los portadores de electrones de las reacciones lumínicas. Por ejemplo,
varios herbicidas comunes como diuron, atrazina y terbitrin actúan uniéndose a
las proteínas que sostienen el núcleo de reacción del fotosistema II,
específicamente en el punto de unión entre nueva plastoquinona B que viene a
regenerar la que se ha perdido al producir plastoquinol.
Otro herbicida llamado paraquat ha
recibido atención mediática debido a que mata selectivamente las plantas de
marihuana, pero sus residuos son altamente tóxicos para los seres humanos
también. El paraquat interfiere con la función del fotosistema I a la altura de
la ferredoxina. El proceso que trata de desviar a los electrones de alta
energía de su objetivo que es el NADP+ y llevarlos al oxígeno,
generando radicales tóxicos de oxígeno que matan a los cloroplastos y a las
células. Debido a que la ferredoxina y el complejo I de la fotosíntesis poseen
una función análoga y centros de reacción homólogos, también altera la ruta de
los electrones en la cadena de transporte de electrones de los animales,
generando igualmente radicales tóxicos de oxígeno. Los radicales tóxicos de
oxígeno matan o incrementan la tasa de mutaciones, por lo que, aunque una
persona expuesta a bajas dosis de este herbicida no muera, si incrementará su
probabilidad de desarrollar varios tipos de cáncer.
7.4 Fotofosforilación
Las reacciones dependientes de la luz discutidas en los anteriores artículos proveen la energía requerida para reducir una gran gama de sustancias inorgánicas, pero es la reducción del dióxido de carbono a azucares la que más llama la atención ya que crea las bases o esqueletos con los que otras sustancias orgánicas pueden ser construidas posteriormente. La reducción de dióxido de carbono a azucares necesita el sacrificio de energía que proviene de dos portadores diferentes, en NADPH que proviene de la primera sección de reacciones de la luz, y de ATP. Se necesitan dos NADPH y dos ATP para sintetizar un mol de carbohidrato (CH2O). Los cloroplastos no emplean ATP exógeno, ellos sintetizan su propio ATP gracias al potencial osmótico acumulado durante el segundo grupo de reacciones de la luz, las cuales ocurren en el citocromo fotosintético b6f.
Figura 7.3. Diagrama de la
fosforilación cíclica, la cual es probablemente un remanente evolutivo previo a
la evolución del fotosistema II, esto es porque este sistema solo tiene sentido
cuando hay una fuente de electrones de energía media como los del ácido
sulfhídrico.
Durante esta reacción 6 iones H+(aq) se retiran del
estroma del cloroplasto y se posicionan en el interior del tilacoide "sin
contar con los 4 iones H+(aq) que se forman cuando las dos moléculas de agua son oxidadas por el
fotosistema II", generando un potencial osmótico. A diferencia del
potencial generado en la respiración celular aeróbica que es al mismo tiempo
eléctrico y osmótico, en el cloroplasto es solo osmótico, debido a que el
tilacoide emite iones positivos al estroma durante el proceso de reacciones de
la luz para mantener las cargas estabilizadas. El punto aquí es que la proteína
empleada para sintetizar ATP a partir de este potencial osmótico es homóloga a
la f1f0 ATP sintasa de la respiración celular aeróbica.
El citocromo B6f recibe
electrones del fotosistema II, y el sistema conlleva a la formación de ATP tal
como hemos visto en las secciones anteriores. El proceso que se describe hasta
este punto se denomina fosforilación no cíclica. La fosforilación cíclica fue
descrita por primera vez por Daniel Arnon de la Universidad de California en
Berkeley durante la década de 1950. En la fosforilación cíclica, la f1f0 ATP
sintasa debe operar de manera independiente al fotosistema II. En este proceso,
el fotosistema I opera de manera alternativa, para generar NADPH, o para
generar un gradiente de iones H+(aq). Es denominada cíclica porque el electrón que sale del centro de
reacción
8. Introducción a las reacciones de la oscuridad
|| Regresar al Índice ||
Ahora, iniciemos por lo básico. Las plantas no derivan los materiales para incrementar su peso de la tierra, sino del aire. De la tierra obtienen minerales importantes, pero que solo representan fracciones insignificantes de sus propios pesos, el resto proveniente de otra fuente que no es otra que el aire. El primero en puntualizar este detalle fue Jan Baptist van Helmont (1580-1644). Van Helmont fue un hombre de contradicciones a nuestros ojos, pero definitivamente recoge el significado completo de un ilustrado del renacimiento. Donde se amalgaman el mundo moderno y el antiguo, místico, alquimista y experimentador. Independientemente de sus investigaciones en alquimia o sus creencias místicas, Van Hemont al igual que otros ilustrados es recordado únicamente por sus contribuciones experimentales.
Figura 8.1. Jan Baptista
van Helmont, (nacido el 12 de enero de 1580 [1579, estilo antiguo], Bruselas
[Bélgica] - fallecido el 30 de diciembre de 1644, Vilvoorde, Países Bajos
españoles [Bélgica]), médico, filósofo, místico y químico flamenco que
reconoció la existencia de gases discretos y dióxido de carbono identificado.
Uno de los más importantes y que nos introduce al estudio de la fijación de carbono por parte de las plantas fue el realizado al hacer crecer plantas de sauce en el interior de recipientes con cantidades de tierra medidas mediante el peso. Adicionalmente, adicionó a sus cálculos el peso del agua que debía agregar a los recipientes durante años. Después de cinco años las plantas ganaron 74 kg independientes de la masa de la tierra, sin embargo, originalmente él pensó que la ganancia de masa se debía al agua únicamente. Sin embargo, Stephen Hales (1677-1761) determinó que las hojas realizaban transpiración, perdiendo agua en el proceso. En otras palabras, ni el agua ni el suelo eran la fuente de la ganancia de peso de las plantas. El mismo Hales en su libro titulado “Vegetable Staticks” describe experimentos en los que demuestra que es el aire que ingresa a las plantas la fuente principal de nutrición, y que este podía ingresar a la planta no solo por las raíces, sino por el tallo y las hojas.
Figura 8.2. Stephen Hales
(17 de septiembre de 1677 – 4 de enero de 1761) fue un clérigo inglés que hizo
importantes contribuciones en varios campos científicos como la medicina,
fisiología, química y botánica. Hales estudió el papel del aire y el agua en el
mantenimiento de la vida animal y vegetal. Dio los primeros registros del
movimiento del agua en las plantas y demostró que las plantas absorben aire.
Hales descubrió los peligros de respirar aire viciado e inventó un ventilador
que mejoraba los índices de supervivencia de los trabajadores de barcos,
hospitales y prisiones. También se le reputa avances en los sistemas de
recolección de gases.
Sin embargo, debió pasarse por los
experimentos que diferenciaron el contenido del aire en sustancias individuales
para poder identificar qué tipo de aire ingresaba y salía de la planta. Ya para
el siglo XX era evidente que dos gases de importancia metabólica eran los
protagonistas de la historia, el oxígeno y el dióxido de carbono. En la serie
de artículos sobre las reacciones lumínicas vimos cómo es que el oxígeno es
producido mediante la oxidación de dos moléculas de agua por parte del
fotosistema II. Ahora nos enfocaremos en como el dióxido de carbono ingresa y
es convertido a moléculas orgánicas de alto peso molecular, proceso al cual se
le denomina fijación de carbono.
8.1 Estudiando la fijación de carbono
Después de la Segunda Guerra Mundial, Melvin
Calvin de la Univeridad de California, Berkeley junto con sus colegas Andrew
Benson y James Bassham, iniciaron lo que se convertiría en un estudio de una
década a cerca de reacciones enzimáticas que permiten a las células asimilar el
dióxido de carbono y convertido en biomasa.
Figura 8.3. Montaje
experimental y resultados de la cromatrografía en papel, el carbono-14 sirve
como marcador para identificar las sustancias en las cuales se va integrando
paulatinamente.
Armados con el nuevo isótopo de carbono-14
y una nueva técnica llamada cromatografía bidimensional en papel, ellos
comenzaron la tarea de identificar todas las moléculas marcadas producidas por
la célula vegetal cuando absorbía carbono atmosférico “Dióxido de carbono
catorce
Los extractos de células eran
posteriormente posicionados en el papel de cromatografía y sometidos al
procedimiento de identificación. Los resultados experimentales llevados a cabo
por años en la década de 1950 dieron como resultado lo que actualmente es
denominado el ciclo Kalvin-Benson, ciclo de Kalvin, fase oscura o reacciones de
la oscuridad de la fotosíntesis (Bassham, Benson, & Calvin,
1950; Bassham et al., 1954; A A Benson et al., 1950; Andrew A Benson et al.,
1952; Biel & Fomina, 2015; Calvin et al., 1950; Schou, Benson, Bassham,
& Calvin, 1950).
Los experimentos de Calvin y colaboradores
permitieron determinar que las plantas eran capaces de fijar carbono muy
rápido. Si el periodo de tiempo de incubación era muy corto “algunos segundos”,
se generaba una marcha radioactiva en el revelado de la cromatografía, dando un
compuesto identificado previamente como 3-fosfogliceraldehído “
Cuando el tiempo de incubación se prologó
otras manchas fueron apareciendo e identificando, esto gracias a la presencia
de los carbonos marcados de manera radioactiva. Pronto pareció evidente que el
proceso de fijación del carbono era cíclico “o cuasi cíclico” y bastante
complejo. Esta ruta metabólica ha venido a denominarse históricamente como el
ciclo de Calvin “o ciclo de Calvin Benson”, y ocurre en todos los organismos
con fotosíntesis del tipo II “fotosistema I + fotosistema II”. Las bacterias
verdes sulfurosas que hacen uso la fotosíntesis del tipo I “fotosistema I”
emplean un ciclo distinto llamado ciclo del 3-hidroxipropionato.
8.2 Fases generales del ciclo de Calvin
El ciclo de Calvin es un cuasi-ciclo, es
decir, no siempre se completará como ciclo. En esencia de una ruta metabólica
bifurcada en un punto de desviación, en el punto de desviación puede o
completar el ciclo, o sintetizar azúcares. Históricamente al ciclo de Calvin se
lo ha dividido en tres partes:
👉 La fijación de carbono: En esta etapa se emplea una molécula de 5 carbonos que actúa como fijador, se denomina Ribulosa-1,5-bifosfato, tambien llamada RuBP para acortar. RuBP captura una molécula de CO2, Para formar un intermediario de 6 carbonos, muy inestable, el cual recibe energía proveniente de las reacciones lumínicas, para formar dos moléculas de gliceraldehido-3-fosfato o GAP cada una de 3 carbonos. La sustancia GAP es el producto más importante, pues él puede emplearse ya sea para regenerar el ciclo o para fabricar azúcar. Tenga en cuenta que en dos moléculas de GAP solo se ha fijado un carbono externo, por lo que para fijar varios carbonos debemos iniciar el ciclo de Calvin varias veces.
Figura 8.4. El ciclo de
Calvin consta de tres etapas, las primeras dos, fijación y reducción son las
más representadas en los libros de texto.
👉 Regeneración del ciclo: A
partir del GAP pueden hacerse sucesivas y complejas transformaciones para
producir nuevamente la RuBP, evidentemente esto requiere fusionar varias
moléculas de GAP, así que para producir 6 moléculas de RuBP se necesitan al
menos 10 moléculas de GAP, y por ende, se requiere que el ciclo de Calvin se
inicie como mínimo 5 veces. Pero de los 15 carbonos involucrados, solo 5 son
carbonos nuevos fijados de la atmósfera, mientras que los otros 10 provienen de
la propia planta. Por ende, se puede decir que para generar una sola RuBP
completamente nueva, se requiere que el ciclo inicie 5 veces.
👉 Síntesis de azúcares: El
ciclo de Calvin no es realmente un ciclo debido a dos detalles, para producir
algo debe iniciar varias veces, y segundo, la etapa de síntesis implica
precisamente NO completar su forma cíclica. Si el GAP se emplea para hacer
azúcares, no puede usarse para regenerar RuBP. Por lo tanto, la planta debe
regular que tanto de GAP sigue la ruta para completar y expandir su ciclo de
Calvin, y que tanto se emplea para fabricar azúcares.
Solo dos de las moléculas de GAP son
empleadas para la síntesis de un azúcar de 6 carbonos como la glucosa, sin
embargo, para que esta glucosa esté compuesta solo por carbonos externos a la
planta, el ciclo debe iniciar 6 veces, para sí fijar 6 carbonos externos. La
glucosa puede alterarse en sus isómeros por reacciones posteriores, como la
fructosa. Posteriormente en el citoplasma de la célula, dos azúcares de 6
carbonos llamados glucosa y fructosa respectivamente se unen en un disacárido
llamado sacarosa. Alternativamente varias moléculas de glucosa pueden unirse en
un enorme polímero de almacenamiento llamado almidón, o sufrir alteraciones
para generar grasas y otras sustancias necesarias para la célula.
8.3 Reacciones de oscuridad, y el flujo energético
La hemos examinado porque se lo denomina
ciclo de Calvin, pero hay que analizar el segundo nombre de este tipo de
reacciones "reacciones de la oscuridad o fase oscura" antes de pasar
a describirlas con mayor detalle. Las reacciones de la luz que vimos
anteriormente solo tienen dos posiciones de entrada de energía lumínica en el
centro de cada uno de los dos fotosistemas, todas las demás reacciones se dan
“cuesta abajo” en términos de energía. Las reacciones de oscuridad se denominan
así porque a pesar de hacer parte de la fotosíntesis no tienen posiciones de
entrada para la energía del Sol. El proceso es impulsado por productos químicos
que provienen de las reacciones de la luz en forma de los portadores de energía
llamados
Estas moléculas se emplean para impulsar
la producción de glucosa y una molécula de 5 carbonos que ayuda a regenerar el
ciclo de Calvin. En total para que el ciclo se complete una vez de manera
efectiva se deben sacrificar 12 moléculas de NADPH y 18
moléculas de ATP
8.4 Alternativa al ciclo de Calvib-Benson
El ciclo del 3-hidroxipropionato es una de las pocas rutas metabólicas capaces de fijar dióxido de carbono inorgánico. Esta ruta metabólica fue descubierta en las bacterias verdes sulfurosas que emplean únicamente el fotosistema I como mecanismo para producir electrones de alta energía y ATP, específicamente en Chloroflexus aurantiacus, dado las fechas no es de extrañar que virtualmente ningún libro de texto posea referencia alguna a él, dejando la impresión de que la única ruta para la fijación de carbono es el ciclo de Calvin. De hecho, el texto que he empleado como base para los muchos artículos en este tema de fotosíntesis no tiene ninguna referencia a él. Una ruta metabólica altamente relacionadan puede encontrarse en las arcaicas acidofilas del filo Crenarqueota como Acidianus brierleyi, Sulfolobus metallicus y Metallosphaera sedula (Becerra, Rivas, García-Ferris, Lazcano, & Peretó, 2014; Caspi et al., 2014, 2016; Caspi, Dreher, & Karp, 2013; Ruvindy, White III, Neilan, & Burns, 2016).
Figura 8.5. Ciclo del
3-hidroxipropionato.
Cada giro del ciclo es capaz de fijar de
manera neta dos moléculas de dióxido de carbono que se encuentra en forma de
bicarbonato en una molécula de glicoxilato. El glicoxilato, que es una fuente
de carbono poco convencional puede ser convertido a piruvato, un precursor
universal de muchas rutas metabólicas “ejemplo, fermentaciones” mediante una
ruta metabólica acoplada denominada asimilación de glocoxilato. Esta ruta
metabólica comienza con la acetil-CoA la cual experimenta la carboxilación a
malonil-CoA gracias a la catálisis de la acetil CoA carboxilasa. Posteriormente
ocurren tres reacciones consecutivas de carga de energía. En la primera se
sacrifica NADPH produciéndose malonato semialdehido; en la segunda se sacrifica
otra molécula de NADPH produciéndose 3-hidroxipropionato y en la tercera se
sacrifican dos grupos fosfato de una molécula de ATP para formar
3-hidroxipropanoil-CoA (Becerra et al., 2014; Caspi et al.,
2014, 2016, 2013; Ruvindy et al., 2016).
En el siguiente paso ocurre una
deshidratación y nuevamente dos reacciones consecutivas de carga de energía. En
la primera se sacrifica otra molécula de NADPH para formar propanoil-CoA;
posteriormente ocurre una nueva fijación de carbono junto con el sacrificio de
un grupo fosfato de una nueva molécula de ATP para formar (s)-metilmalonil-CoA.
Las siguientes dos reacciones son de reorganización molecular, la primera
produciendo (R)-metilmalonil-CoA “ha ocurrido una isomerización” y
posteriormente produciéndose Succinil-CoA la cual es ya una molécula conocida
por otras rutas metabólicas como el ciclo de Krebs (Becerra et al., 2014; Caspi et al.,
2014, 2016, 2013; Ruvindy et al., 2016).
La siguiente reacción requiere de la
adición de (S)-Malato para dar dos productos importantes, el primero al igual
que en el ciclo de Krebs es Succinato, y el segundo que sigue haciendo parte de
la ruta se llama (S)-Malil-CoA. En el paso final la molécula de (S)-Malil-CoA
es lisada para formar glioxilato y acetil-CoA para regenerar el sustrato
inicial del ciclo. Un tema común que aparece cuando se examinan varias enzimas
y moléculas de rutas metabólicas como la glucólisis, el ciclo de Krebs, el
ciclo de Calvin, la ruta de las pentosas fosfato y el que se presenta aquí es
el del reciclaje de reacciones, moléculas y enzimas para diferentes rutas (Becerra et al., 2014; Caspi et al.,
2014, 2016, 2013; Ruvindy et al., 2016).
9. Etapa de fijación de carbono en las plantas C3
|| Regresar al Índice ||
El ciclo de Calvin
(también conocido como ciclo de Benson-Calvin) es el conjunto de reacciones
químicas que tienen lugar en los cloroplastos durante la fotosíntesis. El ciclo
es independiente de la luz porque tiene lugar después de que la energía ha sido
capturada de la luz solar. En esta sección estudiaremos la primera mitad del
ciclo, que va desde la integración de un carbono inorgánico al sistema viviente
a través de la enzima rubisco y una molécula llamada RuBP hasta la obtención de
un precursor activo de tres carbonos llamado G3P, el cual es la base para
fabricar la glucosa en reacciones independientes al ciclo de Calvin.
9.1 RuBP a intermediario de 6 carbonos
La aproximación original de Calvin y
colaboradores de que una molécula de 2 carbonos era el aceptor inicial para la
fijación del dióxido de carbono resultó ser errónea, y en su lugar propusieron
a una molécula de 5 carbonos llamada ribulosa-1,5-bifosfato (RuBP).
(Eq. 9.1) Fijación del carbono en el CO2
RuBP capta un carbono del dióxido de carbono
transformándose en una molécula de 6 carbonos. El proceso es realizado por una
enzima que también participa en el segundo paso del cíclo llamada
ribulosa-1,5-bifosfato carboxilasa, conocida coloquialmente como Rubisco. La
enzíma rubisco en este paso se encarga de adicionar una molécula de dióxido de
carbono a la RuBP para formar un intermediario de 6 carbonos inestable y de muy
corta duración, al cual denominaremos RuBP+CO2. La RuBisCO que se
observa en los plastos es una proteína oligómera formada por 16 polipéptidos,
que son de dos tipos, uno grande (subunidad L) y otro pequeño (subunidad S). La
subunidad L es el sitio catalítico de esta enzima, mientras que la subunidad S
es el sitio regulador. El sitio catalítico consta de un núcleo de Mg+2
y una lisina que tiene un CO2 unido a su extremo terminal.
9.2 Rompimiento de la molécula de 6 carbonos
El Segundo paso es el rompimiento del
intermediario de 6 carbonos en dos moléculas de PGA “fosfogliceraldehído”
isoméricas. Esto implica que desde este punto se describe el ciclo en términos
de una sola de estas moléculas de tres carbonos. El hecho de que el
intermediario de 6 carbonos sea de muy corta duración explica porque los
experimentos iniciales de Calvin y colaboradores conducían a pensar que el aceptor
inicial era de 2 carbonos y no de 5 como fue determinado más tarde. Más aún,
este intermediario de 6 carbonos no se identifica en los esquemas del ciclo de
Calvin que he analizado hasta el momento. El proceso también es catalizado por
la enzima rubisco. Cabe anotar que esta enzima es de muy baja eficiencia,
siendo capaz únicamente de fijar tres moléculas de carbono por segundo, lo cuál
puede ser reconocido como la velocidad más patética de catálisis, de cualquier
enzima biológica en el planeta.
(Eq. 9.2) Rompimiento del intermediario de 6 carbonos a dos
intermediarios de 3 carbonos.
Para compensar este defecto, prácticamente
la mitad de las proteínas que producen las células vegetales son Rubisco. De
hecho, la enzima rubisco constituye la proteína más abundante del planeta,
representando entre 5-10 kg por cada ser humano.
9.3 Fosfogliceraldehído a bifosfogliceraldehído
En este paso, se produce una primera carga
de energía en forma del sacrificio de un grupo fosfato del ATP a la molécula de PGA que ya tenía un grupo fosfato propio, es
decir, la molécula resultante tendrá dos grupos fosfato y un mayor nivel
energético. Cabe recordar que este proceso se da con cada uno de los PGA, y por
cada ciclo se producen dos PGA, por lo anterior se puede decir que para fijar
un solo carbono se debe sacrificar en este paso dos moléculas de ATP.
(Eq. 9.3) Carga de energía proveniente de las reacciones de la
luz para convertir el intermediario de 3 carbonos en un segundo intermediario
de 3 carbonos.
La enzima que cataliza esta reacción se
denomina quinasa de fosfoglicerato, cuya función primordial es realizar una
transferencia reversible de grupos fosfato.
9.4 Regeneración o síntesis
Esta es una segunda reacción de carga de
energía, en forma de transferencia de un par de electrones de alta energía y
sus correspondientes protones hacia el BPGA “reducción”. El resultado de la
reacción se denomina gliceraldehído 3-fosfáto “o GAP” justo con NADP.
Nuevamente, por cada molécula de dióxido de carbono que es fijada se deben
sacrificar dos moléculas de NADPH en este paso del ciclo. La enzima que
cataliza esta reacción se denomina deshidrogenasa de gliceraldehído 3-fosfáto.
Un aspecto que se vuelve aparente al analizar las enzimas y los intermediarios
del ciclo de Calvin es que parecen reciclajes de la glucolisis. Un ejemplo de
esto es esta enzima, ya que esta cataliza uno de los pasos de la glucolisis.
(Eq. 9.4)
La reacción es reversible y depende de las
condiciones de equilibrio, así como la presencia de NAD/NADH “glucolisis” o NADP+/
NADPH “ciclo de Calvin”. El GAP producto de esta reacción puede ser o enviado a
la ruta de síntesis de carbohidratos, en la cual puede describirse a este grupo
de reacciones como una ruta metabólica; o, por el contrario, ser enviado a la
ruta de regeneración de RuBP la molécula de 5 carbonos empleada en el primer
paso, lo cual si completa el ciclo. Como se dijo anteriormente, por cada 12
moléculas de GAP que quedan en la bifurcación, 10 son enviadas para completar
el ciclo y generar más RuBP, y dos son enviadas por la ruta de síntesis de
carbohidratos.
9.5 Control redox de ciclo de Calvin-Benson
El nombre es rimbombante, sin embargo, el
punto es la disponibilidad de electrones de alta energía provenientes del
fotosistema I. Anteriormente ya fue discutido que los electrones provenientes
del fotosistema I no siempre terminan en la NADP+ para formar NADPH.
Los electrones de alta energía pueden terminar en una amplia gama de aceptores
finales, entre los cuales para el presente artículo destaca una proteína
denominada tierodoxina. Tierodoxina puede ser un aceptor de electrones de alta
energía, y de hecho este evento es lo que activa o desactiva su función. Cuando
la tierodoxina recibe electrones, esta procede a reaccionar con enzimas clave
del ciclo de Calvin. Estas enzimas afectadas por la tierodoxina son activadas
iniciando el proceso de reacciones del ciclo de Calvin. Esto solo funciona
mientras que el Sol sostiene la producción de electrones de alta energía, pero
cuando llega la noche, la producción de electrones de alta energía se detiene,
y la activación de la tierodoxina se detiene. Poco tiempo después de que llega
la noche, el ciclo de Calvin se detiene debido a que la tierodoxina ya no
activa a las enzimas del ciclo. Este detalle implica que el nombre de
reacciones de la oscuridad o fase oscura de la fotosíntesis es un nombre
erróneo, ya que, de hecho, poco después de que cae la noche el ciclo de Calvin
también se detiene.
10. Etapa de fijación de carbono en las plantas CAM y C4
|| Regresar al Índice ||
Como hemos visto, las células fotosintéticas producen O2
(mediante la división de H2O) y el uso de CO2 para
producir 3-fosfoglicerato con un cambio neto gaseoso durante la fotosíntesis
que puede escribirse de la siguiente manera:
(Eq. 10.1)
En la oscuridad las plantas están llevando a cabo la
respiración mitocondrial por la oxidación de sustratos a CO2 y la
conversión de O2 a H2O.
Además de eso, hay otro proceso en las plantas que, al igual que la respiración
mitocondrial, consume O2 y produce CO2 y, al
igual que la fotosíntesis, es impulsado por la luz. Este proceso se llama
fotorespiración y es una costosa reacción secundaria de la fotosíntesis. En
esta sección describimos este proceso y las estrategias que usan las plantas
para minimizar sus consecuencias metabólicas.
Figura 10.1. La fotorespiración
es una ruta indeseable tanto para las plantas como para los agricultores, sin
embargo, los defectos intrínsecos de la rubisco hacen que químicamente sea
inevitable.
10.1 El
ingeniero tuvo problemas con el oxígeno, la fotorespiración
La
enzima rubisco es un dolor de cabeza, no solo es altamente ineficiente, también
posee una inespecificidad inamovible en el gas que sirve como sustrato de
reacción. Aunque en el contexto de la fotosíntesis siempre se la introduce como
la enzima que fija el dióxido de carbono, resulta que es mucho más ávida por el
oxígeno. Sin embargo, iniciaremos por el principio para entender el problema
generado por esta inespecificidad. Una de las moléculas identificadas por las
cromatografías de Calvin y colaboradores en su trabajo con células de algas fue
el compuesto glicolato, el cuál fue correctamente ignorado en la formulación
del modelo de reacciones del ciclo de Calvin. Mientras que el glicolato no hace
parte del ciclo de Calvin, si es un producto de la reactividad de la enzima
rubisco.
Aparentemente solo después de 20 años
desde que se describiera la catálisis del rubisco usando un sustrato de dióxido
de carbono fue descrita la ruta alternativa en la que el rubisco logra
catalizar al oxígeno como sustrato. Esta segunda reacción, el rubisco integra
una molécula de oxígeno molecular a la RuBP sintetizando la 2-fosfoglicolato
junto con PGA. El 2-fofoglicolato es subsecuentemente convertido a glicolato
mediante una enzima del estroma. El glicolato sintetizado en el estroma del
cloroplasto es posteriormente transportado al citoplasma, donde el peroxisoma
convierte la molécula de glicolato en moléculas de dióxido de carbono. Esto
implica que la planta empieza a perder biomasa en forma de carbonos. Este
proceso se denomina fotorespiración, debido a que el proceso involucra el
consumo de oxígeno y la producción de dióxido de carbono.
De lo anterior, se puede notar que la
fotorespiracion es un problema para que las plantas puedan adquirir biomasa,
debido a la perdida en forma de dióxido de carbono de sus moléculas RuBP del
ciclo de Calvin. De hecho, la fotorespiración puede causar la pérdida del 50%
del carbono fijado por una planta de cultivo bajo condiciones de cultivo y alta
intensidad solar. Como se podrá esperar, se ha concentrado una gran cantidad de
esfuerzo por décadas para poder impedir la pérdida de eficacia de la
fotosíntesis debido a la fotorespiración. Sin embargo, hasta el día de hoy los
esfuerzos han sido en vano. Al igual que la hemoglobina cuyo defecto hace que
acople irreversiblemente monóxido de carbono creando una asfixia química, la
rubisco en su misma naturaleza catalítica no puede evitar unirse al oxígeno. De
hecho, varios estudios han demostrado que la rubisco es mucho más afín para
reaccionar con el oxígeno que con el dióxido de carbono. Dado que la
fotorespiración es una característica inamovible de los sitos de reacciones de
la rubisco, la solución radica en regular la concentración de oxígeno. Las
plantas que crecen en ambientes cerrados con niveles elevados de dióxido de
carbono no presentan fotorespiración a niveles tan altos, por lo que pueden
crecer mucho más rápido.
10.2 Ruta del glicolato
La ruta del glicolato convierte dos moléculas de
2-fosfoglicolato en dos moléculas de glicina. Glicina es en parte convertida en
CO2 y NH3 por
el complejo de la glicina descarboxilasa, con la reducción concomitante de NAD a NADH:H y en parte convertido en serina vía hidroximetiltransferasa.
La reacción global se puede representar en la Figura 10.2.
La serina se convierte en hidroxipiruvato, en glicerato, y finalmente en 3-fosfoglicerato, que se utiliza para regenerar la ribulosa 1,5-bisfosfato, completando el ciclo largo y caro. La actividad combinada de la oxidasa de rubisco y la vía de glicolato consume O2 y produce CO2, de ahí el nombre de fotorespiración. Este camino es quizás mejor llamada el ciclo de carbono fotosintético oxidativo o ciclo C2. A diferencia de la respiración mitocondrial, la "fotorrespiración" no conserva la energía y en realidad puede reducir la formación de biomasa hasta el 50%. Esta ineficiencia ha llevado a adaptaciones evolutivas en los procesos de asimilación de carbono, particularmente en plantas que han evolucionado en climas cálidos y producen oxígeno en cantidades importantes.
Figura 10.2. Ruta del glicolato
10.3 Ruta C4
Ya hemos estudiado la primera mitad del ciclo de Calvin con lo cual se obtiene el precursor de la glucosa o G3P, uno pensaría que ya está todo dicho y hecho con respecto a la fotosíntesis, pero la verdad es que no tanto. En 1965, Hugo Kortschak (COOMB, Baldry, & Bucke, 2016; Furbank, 2016; Hibberd & Furbank, 2016) realizó un procedimiento experimental semejante al que Calvin y colaboradores habían realizado para el descubrimiento de su emblemático ciclo, pero en esta ocasión su modelo biológico no fue un alga verde, sino la caña de azúcar.
Figura 10.3. A la izquierda
tenemos el proceso de una planta C3 en la que el dióxido de carbono fluye por
difusión gaseosa desde el estoma a la célula en fotosíntesis. A la derecha
tenemos una planta C4 en la cual existe una célula de apoyo que secuestra el
dióxido de carbono a la fuerza empleando una proteína de fijado de carbono
diferente a la rubisco, y posteriormente transfiere este dióxido de carbono al
ciclo de Calvin de la célula fotosintética.
Cuando la caña de azúcar era puesta a
fijar dióxido de carbono catorce, se reportó en las cromatografías la presencia
de compuestos orgánicos de cuatro carbonos, en lugar de los típicos tres
carbonos que caracteriza a la fase de carga de energía del ciclo de Calvin.
Análisis posteriores revelaron que estos compuestos de cuatro carbonos
“principalmente malato y oxaloacetato” resultaban de la combinación del dióxido
de carbono con un compuesto llamado fosfofenolpiruvato “PEP” siendo este un
segundo mecanismo independiente al ciclo de Calvin para fijar dióxido de
carbono.
👉 Fijación de carbono en las plantas C4: El dióxido de carbono se une al fosfofenolpiruvato o PEP mediante
la acción catalítica de la enzima fosfofenolpiruvato carboxilasa, siendo este
el primer paso de la ruta metabólica de las plantas C4, análogo a la reacción
del rubisco en el ciclo de Calvin. Mientras que el producto de las dos
reacciones con rubisco son moléculas de tres carbonos, el producto de la
reacción con la PEP carboxilasa es un compuesto de cuatro carbonos, es por esta
razón que las plantas equipadas con esta ruta metabolica son denominadas
plantas C4. El fosfofenolpiruvato se cliva en el proceso, el piruvato se une al
dióxido de carbono, mientras que el fosfofenol queda anclado para recibir
piruvato que haya sido liberado cuando se completa la ruta metabólica C4.
👉 El camino del carbono en una planta C4: En una célula normal, la molécula de dióxido de carbono realiza transporte pasivo a través de membrana, es decir, su concentración en el interior de la célula dependerá mucho de la concentración en el exterior de la célula. Las plantas C4 evitan esto, una vez que el producto de cuatro carbonos se ha formado en el exterior de las células fotosintéticas, son transportados a través del plasmodesmo en la zona cercana a la pared celular. Allí unas células especializadas desacoplan el producto de cuatro carbonos transformándolo nuevamente en piruvato libre y en dióxido de carbono gaseoso, pero en concentraciones elevadas a comparación con el ambiente externo.
Figura 10.4. En las plantas C4 el dióxido de carbono se fija dos veces, una en el exterior del sistema, y la segunda en el interior del sistema. Debido a que es una fijación enzimática la cantidad de dióxido de carbono liberada en el interior del sistema es superior, potenciando la actividad de la rubisco.
Figura 10.5. En las plantas
C4 hablamos de dos ciclos de reacciones, el externo o de apoyo es de cuatro
carbonos y se encuentra en las células del mesófilo, las cuales se encuentran
en una capa externa de la hoja, mientras que las células fotosintéticas se
encuentran en el interior, recibiendo en dióxido de carbono proporcionado por el
ciclo de 4 carbonos para ingresarlo al ciclo de Calvin.
Una vez allí el dióxido de carbono se
difunde más rápido entre las células fotosintéticas para que la rubisco pueda
operar a total capacidad. La concentración de dióxido de carbono próximo a las
células fotosintéticas en las plantas C4 puede ser con facilidad 100 veces
mayor a la de una planta C3. Decimos a total capacidad debido a que los
experimentos que han intentado probar que las plantas C4 realizan la
fotorespiración han fracasado, en otras palabras, aun si las plantas C4
realizan algo de fotorespiración “ineficiencia de la enzima rubisco” sus
niveles son tan bajos que actualmente no son medibles.
👉 Utilidad evolutiva de la ruta metabólica C4 para las plantas: Cuando una planta es ubicada en una cámara cerrada y su actividad
fotosintética es monitoreada en tiempo real, se encontró que una vez que esta
reduce los niveles de dióxido de carbono a un punto crítico, esta empieza a
fotorespirar. Esto se debe a que la concentración de oxígeno empieza a ser
mayor que la de dióxido de carbono, y la enzima rubisco presenta la falla
catastrófica de generar una desviación del ciclo de Calvin cuando existen altas
concentraciones de oxígeno. Esta desviación conocida como fotorespiración
conlleva a la pérdida de 5 carbonos por oxígeno fijado, en lugar de la ganancia
de un carbono por cada dióxido de carbono fijado.
Es por esta razón que las plantas C3
requieren de ambientes relativamente pobres en luz o en su defecto de ambientes
con niveles de dióxido de carbono en niveles mínimos necesarios para llevar a
cabo su fotosíntesis normalmente. En las zonas templadas, con la llegada del
invierno y menores cantidades de luz, resulta poco probable que se produzcan
grandes cantidades de oxígeno todo el año, y de este modo las plantas no se
autoinhiben. El valor de la ruta C4 se vuelve aparente en las zonas tropicales
donde las tasas de fotosíntesis son altas y estables durante la mayoría del
año. En estos ambientes, las plantas deben afrontar tres problemas, la desecación
por evaporación, la fotoinhibición y la fotorespiración.
El segundo problema es resuelto mediante
el incremento de la cantidad de carotenoides en las antenas fotosintéticas y al
incremento en la concentración de otros compuestos químicos antioxidantes. El
primer y el tercer problema se resuelven con la ruta C4. La ruta de fijación de
carbonos C4 no es totalmente independiente al ciclo de Calvin, análisis
posteriores revelaron que el destino final del carbono fijado en PEP no era
otra que la reacción con rubisco. En otras palabras, la ruta C4 es solo una
actualización sobre la ruta C3. La PEP carboxilasa se encuentra ubicada en las
células del mesófilo mas externas de la hoja de la planta, por lo que pueden
capturar dióxido de carbono aun cuando el estoma está prácticamente cerrado,
impidiendo así la perdida de agua durante el día.
Debido a que la captura de dióxido de
carbono se realiza a nivel enzimático y no por la espera de la lenta difusión
del gas desde la atmosfera al interior de la hoja por medio del estoma, la tasa
con que la rubisco empieza a fijar carbonos es incomparablemente más alta que
la que ocurre con las plantas que únicamente tienen la ruta metabólica C3. Las
plantas que presentan la ruta C4 generalmente son pastos tropicales de crecimiento
rápido y que tienden a almacenar grandes cantidades de carbohidratos en sus
tejidos como la caña de azúcar, el maíz y el sorgo. La ruta metabólica C4 es
más eficiente que la C3 solo en ambientes secos y con grandes cantidades de
luz. Esto es porque la ruta C4 también consume más energía para poder
instaurarse, y esta energía en últimas proviene del Sol. En ambientes templados
con estaciones muy marcadas, las enzimas de la ruta C4 serían inútiles, pues no
hay luz durante una buena parte del año. Esto ha hecho que los pastos
tropicales de crecimiento rápido y de alta producción de azucares se encuentren
limitados biogeograficamente a las regiones tropicales del planeta.
👉 Síntesis de carbohidratos en las plantas C4 y otros: Dado que la ruta C4 se construye sobre la C3, es decir, las
enzimas C4 solo sirven para construir una concentración elevada de dióxido de
carbono en el microambiente fotosintético para que la rubisco opere a total
potencia, la síntesis de carbohidratos en las plantas C4 es exactamente igual
que en las plantas C3, con la diferencia de que la producción de carbohidratos
y de biomasa es en varios ordenes de magnitud, mayor. Actualmente se está
realizando investigación transgénica con el fin de transmitir la maquinaria
molecular de las plantas C4 como el maíz a plantas C3 con el arroz con el fin
de incrementar la productividad de los cultivos sin la necesidad de adicionar
más fertilizantes al suelo, con sus conocidos efectos de eutrofización.
10.4 Plantas CAM
Muchas plantas del desierto como los cactus, poseen una adaptación bioquímica que les permite sobrevivir en ambientes muy secos y calientes. Estas plantas son denominadas plantas CAM. Las plantas CAM utilizan una enzima llamada Carboxilasa de PEP para igual que en las plantas C4. A diferencia de las plantas C4, las plantas CAM SI llevan a cabo la fijación de carbono en diferentes tipos del día en lugar de diferentes partes de la planta. Mientras que en las plantas C3 y C4 el concepto de reacciones de oscuridad es imposible, ya que ambos procesos están vinculados mediante el proceso de regulación redox, las plantas CAM si llevan a cabo las reacciones de fijación de carbono en la oscuridad.
Figura 10.6. En las plantas
CAM el carbono se fija de manera reversible en la noche gracias al mismo
mecanismo de las plantas C4, pero en lugar de que el carbono se dirija
inmediatamente al ciclo de Calvin, este es almacenado en la vacuola hasta la
llegada del día, entonces si es reconvertido a dióxido de carbono en el
interior de la planta, lo cual permite su ingreso al ciclo de Calvin.
Las plantas CAM fijan carbono durante la
noche mediante la apertura de sus estomas y con el apoyo extra de la
carboxilasa de PEP. La fijación de carbono en la noche NO ingresa directamente
en el ciclo de Calvin, por el contrario, el carbono fijado es almacenado en
forma de malato y almacenado en la vacuola durante la noche. Cuando llega el
día y la disponibilidad de ATP y electrones de alta energía vuelven a estar
disponibles, el malato es liberado, se degrada para liberar el dióxido de
carbono y reingresa rápidamente al ciclo estándar de Calvin. Las plantas CAM
segregan sus procesos metabólicos, en base a las rutas C4 y C3; pero en
cualquier momento, el carbono fijado siempre es reconvertido a dióxido de
carbono y luego conducido por la rubisco al ciclo de Calvin. Por lo anterior se
puede decir que la síntesis de carbohidratos es igual a la de las plantas C3,
solo que con eficiencia en ambientes muy secos como los desiertos.
11. Etapa de regeneración de la RuBP
|| Regresar al Índice ||
La regeneración del ribulosa-1,5-bifosfato
RuBP es la ruta metabólica que le da su naturaleza cíclica al ciclo de Calvin.
Diez moléculas de GAP “cada una de tres carbonos” generan seis moléculas de
RuBP cada una de cinco carbonos, sacrificando en el camino seis moléculas de
ATP. Dado de cada molécula de dióxido de carbono genera dos moléculas de GAP,
seis moléculas de dióxido de carbono producen doce moléculas de GAP. Esto
permite emplear dos moléculas de GAP como ganancia energética y las diez reacciones
restantes, como regeneradores del ciclo. El proceso de regeneración de RuBP
puede ser dividido en varias reacciones acopladas, que son simplificadas en los
diagramas del ciclo de Calvin en la gran mayoría de los casos. Una regeneración
completa de RuBP “ribulosa-1,5-bifosfato” requiere que el ciclo de Calvin
inicie 5 veces sin enviar carbonos a generar glucosas.
11.1 Isomerización
La primera es una isomerización, una
reacción en la que se transforma a la molécula en otra con diferentes enlaces,
pero el mismo contenido de átomos. La molécula producida se denomina
dihidroxiacetona fosfato o (DHAP) en base a la molécula de GAP. La
dihidroxiacetona es una molécula que también hace parte de la glucolisis,
siendo uno de los productos del rompimiento de la fructosa 1,6-bifosfato junto
al gliceraldehído 3-fosfato.
(Eq. 11.1) Lo
admito, el nombre común del DHAP no tiene sentido, porque solo hay un grupo OH,
pero ese es el nombre tradicional.
La enzíma involucrada se denomina
isomerasa de triosas fosfato, al igual que las moléculas que involucra, la
isomerasa de triosas fosfato también es empleada en la glucolisis. La reacción
que cataliza es reversible y por lo tanto altamente dependiente de las
condiciones de equilibrio al interior del cloroplasto. En ambos contextos la
reacción es la misma.
11.2 Síntesis de Fructosa 6-fosfato
Esta es una reacción de síntesis, se
caracteriza por la unión de una molécula de GAP y DHAP para formar ya un azúcar
de 6 carbonos llamado fructosa 6 fosfato.
(Eq. 11.2)
Durante el proceso, uno de los grupos
fosfato pierde definitivamente, perdiéndose a la solución del estroma. La reacción es catalizada por dos enzimas, la
aldolasa y la frutosa-1,6-bifosfatasa. Este es tal vez uno de los pasos más
importantes ya que está involucrado en la gluconeogénesis y en la síntesis de
hexosas como la glucosa si es que se toma el camino de la síntesis de
carbohidratos. De cierta manera diría que la mayoría de esquemas del ciclo de
Calvin son mentirosos en hacernos creer que el punto de bifurcación entre la
síntesis de carbohidratos y la regeneración de la Ribulosa se da al llegar a la
triosa llamada gliceraldehído-3-fosfato, pero el verdadero punto de división de
las rutas antes mencionadas es este, la fructosa-6-fosfato. La clave está en la
cantidad de fosfatos. Cuando la fructosa tiene un solo fosfato sigue por la
regeneración, pero si la fructosa tiene dos fosfatos entonces sigue por la ruta
de la síntesis de carbohidratos.
11.3 Clivaje de F6P
La transcetolasa codificada por el gen TKT
es una enzima tanto de la ruta de la pentosa fosfato en todos los organismos
como del ciclo de fotosíntesis de Calvin. Cataliza dos reacciones importantes,
que operan en direcciones opuestas en estas dos vías. En la primera reacción de
la vía no oxidativa de la pentosa fosfato, el cofactor tiamina difosfato acepta
un fragmento de 2 carbonos de una cetosa de 5 carbonos (D-xilulosa-5-P), luego
transfiere este fragmento a una aldosa de 5 carbonos ( D-ribosa-5-P) para
formar una cetosa de 7 carbonos (sedoheptulosa-7-P). La abstracción de dos
carbonos a partir de D-xilulosa-5-P produce la aldosa de 3 carbonos
glyceraldehyde-3-P. En el ciclo de Calvin, la transcetolasa cataliza la
reacción inversa, la conversión de sedoheptulosa-7-P y gluceraldehído-3-P a
pentosas, la aldosa D-ribosa-5-P y la cetosa D-xilulosa-5-P.
(Eq. 11.3)
La segunda reacción catalizada por la
transcetolasa en la ruta de la pentosa fosfato involucra la misma transferencia
mediada por tiamina difosfato de un fragmento de 2 carbonos de D-xilulosa-5-P a
la aldosa eritrosa-4-fosfato, proporcionando fructosa 6-fosfato y
gliceraldehído. 3-P. Nuevamente, en el ciclo de Calvin ocurre exactamente la
misma reacción, pero en la dirección opuesta. Además, en el ciclo de Calvin,
esta es la primera reacción catalizada por la transcetolasa, en lugar de la
segunda.
En los mamíferos, la transcetolasa conecta
la ruta de la pentosa fosfato con la glucólisis, alimentando el exceso de
fosfatos de azúcar en las principales rutas metabólicas de los carbohidratos.
Su presencia es necesaria para la producción de NADPH, especialmente en tejidos
que participan activamente en biosíntesis, como la síntesis de ácidos grasos
por el hígado y las glándulas mamarias, y para la síntesis de esteroides por el
hígado y las glándulas suprarrenales. El difosfato de tiamina es un cofactor
esencial, junto con el calcio.
La transcetolasa se expresa abundantemente
en la córnea de los mamíferos por los queratocitos estromales y las células
epiteliales y tiene fama de ser una de las cristalinas corneales.
11.4 Síntesis de Xu5P
El ciclo de Calvin debe hacer un segundo
inicio para formar otras dos moléculas de GAP. En este punto se han fijado dos
moléculas de dióxido de carbono.
La translocasa no solo corta la F6P,
también transfiere el intermediario de 2 carbonos a una molécula de G3P nueva
sintetizando de este modo un azúcar de 5 carbonos llamado xilulosa-5-fosfáto
“Xu5P”. La Xu5P es un isómero de la fructosa 5 fosfato, con diferencias
tridimensionales, es por esto que en las representaciones planas que empleamos
en el presente documento no aparecen diferencias entre las dos.
(Eq. 11.4)
11.5 Síntesis de una heptosa
En este punto retomamos uno de los
intermediarios de 4 carbonos que fue generado por el clivaje de la primer F6P,
y se la hace reaccionar con una molécula de DHAP producto del segundo inicio
del ciclo de Calvin. Nos encontramos ante una nueva reacción de síntesis en la
que una molécula de 4 carbonos y una molécula de 3 carbonos forman una de 7
carbonos llamada sedoheptulosa-1,7-bifosfato. La enzima que cataliza esta
reacción se denomina aldolasa.
(Eq. 11.5)
11.6 Clivaje de la heptosa a R5P
Nos encontramos ante dos tipos de clivaje,
un primer clivaje es el corte de uno de los grupos fosfato por parte de la
enzima sedoheptulosa-1,7-bifosfatasa. El grupo fosfato pierde totalmente su
energía y es liberado al estroma del cloroplasto. El producto intermedio es
sedoheptulosa-7-fosfato “S7P”.
Inmediatamente debe iniciar una tercera
vez el ciclo de Calvin con la formación de dos moléculas extra de GAP. Del
mismo modo, una molécula llamada transcetolasa corta a la S7P, de modo tal que
se genera una molécula de 5 carbonos llamada ribosa 5-fosfato “R5P” y un
intermediario de dos carbonos. Este intermediario es inmediatamente transferido
a una molécula de GAP para sintetizar otra molécula de 5 carbonos “Xu5P”.
(Eq. 11.6)
Esto deja una molécula de GAP como
producto para síntesis de carbohidratos del ciclo de Calvin y tres moléculas de
5 carbonos: 2Xu5P y R5P; las cuales pueden ser transformadas a Ru5P.
11.7 Isomerización a Ru5P
En el penúltimo paso deben converger G3P,
R5P y Xu5P a Ribulosa 5-fosfato. R5P es isomerizado a Ru5P por medio de la
enzima ribulosa 5-fosfato isomerasa.
(Eq. 11.7) Ru5P
y Xu5P son estereoisómeros, por lo que tienen la misma fórmula molecular.
Xu5P es isomerizado a Ru5P por medio de la
enzima isomerasa de fosfatopentosa. Hay que tener en cuenta que la
xilulosa-5-fosfato es un estereoisómetro de la ribulosa-5-fosfato, por lo que
la isomerización solo se percibe si realizamos la notación de cuñas.
(Eq. 11.8)
(Eq. 11.9)
11.8 Síntesis final de RuBP
Finalmente, las tres moléculas de Ru5P se isomerizan
a RuBP mediante la enzima llamada fosforibuloquinasa. Finalmente, la RuBP será
empleada para completar el ciclo de Calvin. La síntesis del RuBP requiere el
sacrificio de energía en forma de ATP. Mediante la transferencia de un grupo
fosfato.
(Eq. 11.10)
En total hemos iniciado tres veces el
ciclo de Calvin, generando 6 moléculas de sustrato G3P, de las cuales se
obtienen 3 moléculas de RuBP y una molécula de tres carbonos como beneficio
energético que toma la ruta de la síntesis de carbonos. Ruta que estudiaremos
en los artículos de la síntesis de carbohidratos de las plantas C3.
12. Etapa de síntesis de carbohidratos
|| Regresar al Índice ||
Bueno, al completar el ciclo de Calvin se
da la impresión de que no ganamos nada, pero el asunto es que el ciclo de
Calvin inicia muchas veces. En cada ciclo de inicio se fija un carbono, por lo
que para sintetizar un carbohidrato de 6 carbonos se necesita que el ciclo
inicie como mínimo unas 6 veces. Como el
ciclo inicia miles de millones de veces, hay exceso de triosas fosfato y por
ende el equilibrio químico que da lugar a la fructosa monofosfatada cambia para
generar una fructosa bifosfatada, lo cual cambia la ruta que sigue. Durante la fase
lumínica, una hoja produce más carbohidratos (como triosas-fosfato) de lo que
necesita para generar energía o sintetizar precursores para regenerar el ciclo
de Calvin. El exceso se convierte en sacarosa y se transporta a otras partes de
la planta, para ser utilizado como combustible o almacenado a largo plazo. En
la mayoría de las plantas, el almidón es la forma principal de almacenamiento,
pero en algunas plantas, como la remolacha azucarera y la caña de azúcar, la
sacarosa es la forma primaria de almacenamiento. La síntesis de sacarosa y
almidón ocurre en diferentes compartimentos celulares (citosol y plastidios,
respectivamente), y estos procesos están coordinados por una variedad de
mecanismos reguladores que responden a cambios en el nivel de luz y en la tasa
fotosintética. Debo resaltar mi gran orgullo por este capítulo ya que en la
mayoría de los esquemas del ciclo de Calvin notarán que la ruta que da a la
glucosa (…) ¡No se muestra! Lo cual lo deja a uno con la sensación de que algo
falta, algo muy importante.
12.1 Síntesis de glucosa y el pozo de hexosas
El producto G3P y DHAP a mitad del ciclo de Calvin puede ser
inducido a la ruta sintética o a la regenerativa. Si sigue la ruta sintética se
convierte a continuación en fructosa-1,6-bifosfato, que se isomeriza fácilmente
en glucosa 1-fosfato y glucosa-6-fosfato. La mezcla de las tres hexosas
fosforiladas se denomina pozo de hexosa monofosfato. Los pasos de esta
conversión son similares a los de la vía gluconeógena, excepto que la
gliceraldehído 3-fosfato deshidrogenasa en los cloroplastos, que genera G3P es
específica para NADPH en lugar de NADH:H. Estas reacciones
llevan 6 moleculas
Hay que anotar que este es el proceso
opuesto a la lísis de la fructosa-1,6-bifosfato durante la glucólisis. Esto
hace de la fructosa-1,6-bifosfato un intermediario crítico en ambas rutas metabólicas.
De hecho, esto le permite en teoría ala célula vegetal regenerar los materiales
de la fotosíntesis a partir de la glucosa almacenada, así que si alguien se
pregunta de donde viene la Ribulosa original, la respuesta es de la glucosa. La siguiente reacción posible es la síntesis
de fructosa-6-fosfato que hace el parte del pozo de hexosas.
(Eq. 12.1)
De aquí es posible sintetizar glucosa fosfatada por una
isomerización.
(Eq. 12.2)
Y al retirar el último fosfato, la glucosa es finalmente
generada.
(Eq. 12.3)
¿Cuál es la razón por la cual esto no se muestra en los
diagramas básicos de las reacciones de la oscuridad? Diría que la principal
causa es que todas estas reacciones hacen parte de la gluconeogénesis, y los
libros de texto “asumen” generalmente que ya se vio ese tema.
12.2 Síntesis almidón
¿Cuáles son los destinos de los miembros del pozo de hexosas-monofosfato? Estas moléculas se utilizan en una variedad de maneras, pero hay dos funciones principales.
Figura 12.1. La síntesis de
almidón involucra activar la glucosa empleando ATP.
Las plantas contienen dos formas
importantes de almacenamiento de azúcar: el almidón y la sacarosa. El almidón,
al igual que su contrapartida animal glucógeno, es un polímero de residuos de
glucosa, pero es menos ramificado que el glucógeno porque contiene una
proporción menor de enlaces alfa-1, 6-glucosídicos. Otra diferencia es que
ADP-glucosa, no UDP-glucosa, es el precursor activado. El almidón se sintetiza
y se almacena en cloroplastos.
El almidón, un carbohidrato complejo, es
un polímero de moléculas de glucosa. Se presenta en dos formas principales:
amilosa, consistente en cadenas predominantemente lineales de monómeros de
glucosa unidos por enlaces 1,4-glicosídicos, y amilopectina, en la que las
cadenas se ramifican mediante la adición de enlaces 1,6-glicosídicos. La
amilosa comprende entre el 11 y el 37% del almidón encontrado en las plantas
(dependiendo de la especie y el sitio de almacenamiento); El resto es
amilopectina. La síntesis de almidón en células vegetales comienza con la
enzima ADP-glucosa pirofosforilasa (AGPasa), que cataliza la reacción de
glucosa-1-fosfato con ATP para formar ADP-glucosa (pirofosfato liberador). La ADP-glucosa
se utiliza entonces un sustrato por enzimas de almidón sintasa, que añaden
unidades de glucosa al extremo de una cadena polimérica en crecimiento para
formar una molécula de almidón (liberando el ADP en el proceso). Las ramas de
la cadena son introducidas por enzimas ramificadoras de almidón (SBE), que
hidrolizan enlaces 1,4-glicosídicos, y en su lugar, crean enlaces 1,6 con otras
unidades de glucosa.
Aunque la vía de síntesis del almidón
parece relativamente simple, se complica por el hecho de que las enzimas
implicadas vienen en diversas formas diferentes, que difieren en su
comportamiento y en las partes de una planta en la que están activos. La
complejidad adicional se crea por la presencia de enzimas de-ramificación
(DBEs), que hidrolizan enlaces 1,6-glicosídicos y rompen ramificaciones en las
cadenas de polímero. Aunque estos se consideran tradicionalmente como
catalizadores de la descomposición del almidón, parece que también juegan un
papel importante en la síntesis de almidón. La evidencia de esto proviene de
los mutantes 'azucarados' de maíz, arroz y sorgo, que son deficientes en una
enzima de des- ramificación particular, en la que los gránulos de almidón se
degradan a medida que se forman y se reemplazan con un polímero alternativo, el
fitoglucógeno.
12.3 Síntesis de sacarosa
Por el contrario, la sacarosa (azúcar de mesa común), un disacárido, se sintetiza en el citoplasma. Las plantas carecen de la capacidad de transportar fosfatos de hexosa a través de la membrana del cloroplasto, pero son capaces de transportar triosas-fosfato de los cloroplastos al citoplasma. Intermedios tales como gliceraldehído 3-fosfato cruzan al citoplasma a cambio de fosfato a través de la acción de transportadoras insertadas en la membrana externa de cloroplasto. Allí la triosa sigue la gluconeogénesis imperfecta hasta la etapa de fructosa-6-fosfato y se une a una unidad de glucosa de UDP-glucosa para formar sacarosa-6-fosfato. La hidrólisis del éster fosfato por la sacarosa fosfatasa produce sacarosa, un azúcar fácilmente transportable y movilizable que se almacena en muchas células vegetales, como las de remolacha azucarera y caña de azúcar. Con esto hemos completado la ruta de la fotosíntesis, con la glucosa como principal producto de la ecuación estequimétrica original.
Figura 12.2. Síntesis de
sacarosa.
13. Evolución de la fotosíntesis
|| Regresar al Índice ||
Si la creación de los seres vivos
obedeciera a la lógica del ingeniero los fotosíntetizadores serían los primeros
en aparecer, pero la cuestión no es tan fácil a la vista de los
microorganismos. La fotosíntesis como tal requiere de proteínas especializadas
y bastante complejas para poder ocurrir, un caso especial es precisamente la
ATP sintasa, complejo de proteínas que es vital en cualquier fotosíntesis, al
igual que el dilema del ojo de Darwin (Kutschera & Niklas, 2004), es decir a un tipo de problemas de la biología que se caracteriza
por tratar de encontrar una explicación naturalista y plausible para sistemas
complejos e integrados. ¿Cómo explicar algo tan complicado como la fotosíntesis
desde el punto de vista naturalista sin recurrir al facilismo de un ingeniero
supremo con poderes ilimitados?
Los microorganismos poseen dos detalles
fundamentales que nos permiten obviar el problema de la complejidad integrada
en sus inicios, estos son: la quimiolitotrofía y la fosforilación a partir de
sustrato. Los minerales inorgánicos pueden sustentar a una amplia variedad de
bacterias, y la fosforilación a partir de sustrato permite generar ATP
independientemente a una ATP sintasa.
Ahora, ¿de dónde surgían las proteínas necesarias para la fotosíntesis
en primera instancia?, nuevamente la respuesta debe ser empleadas en canales
iónicos que transportan, ya sea activamente o de manera facilitada a los iones
protio(1+) “que en los libros de texto de biología y en las animaciones recibe
el nombre de protones” de un lado hacia el otro de una membrana biológica (Blankenship, 2002, 2010;
Hohmann-Marriott & Blankenship, 2011; Xiong, Fischer, Inoue, Nakahara,
& Bauer, 2000).
13.1 Energía y biocompuestos
Los seres vivos están hechos
principalmente de carbono, hidrógeno y oxígeno, unidos por enlaces de alta
energía. Durante la era de los comedores de roca “quimiliototrofos” el carbono se
encontraba, igual que hoy en día en forma de dióxido de carbono, la especie
química de menor energía del carbono, extremadamente estable y difícil de
modificar. El hidrógeno estaba almacenado en enormes fuentes líquidas de un
oxido denominado monóxido de dihidrógeno, el cual posee propiedades de ácido y
base simultáneamente, es decir AGUA. Uno podría decir que allí estaban ya los
componentes básicos de la vida, pero la cuestión no es tan simple, pues una
cosa es tener los materiales de construcción y otra cosa tener el dinero para
financiar la construcción. Esto es válido tanto para el Origen de la Vida como
para la vida actual, aun cuando los materiales inorgánicos estén a la mano se
necesita una forma de “activarlos” a estados de energía mayores, necesitamos de
alguien que page por la fiesta y de los medios para ejecutar el pago, es decir
se requiere energía y operadores (De Duve & Pizano, 1995).
En las épocas más primitivas lo más
probable es que quien pagaba por la fiesta y suministraba muchos de los medios
de pago era la roca misma, de la cual puede extraerse electrones de alta
energía “que son precisamente uno de los medios de pago más importantes”, los
cuales alimentarían a las células para poder realizar las modificaciones de
estos óxidos de baja energía (Björn,
Papageorgiou, Dravins, & Govindjee, 2009; Gorbushina, 2007; Pace, 2001; J.
A. Raven, Andrews, & Quigg, 2005; J. Raven & Skene, 2003). Sin
embargo, todo producto de la roca es por naturaleza no renovable, lo cual implica
que las colonias de seres vivos comedores de roca llegarían a puntos de
competencia muy rápidamente. Al ser los recursos no renovables, los nutrientes
del ambiente se agotarían rápidamente, por lo que mutaciones que conllevaran a
la explotación de los óxidos básicos mediante fuentes de energía alternativas
se convertiría en algo realmente útil.
Nótese que en este escenario es la roca
misma la que cumpliría las primeras funciones de los portadores de electrones
como FAD, NADP y NAD, y que estas moléculas extraerían sus electrones de la
roca misma una vez fueran implantados, algo que debería haber sucedido incluso
antes del nacimiento de la misma célula. Una vez protonados en sus formas
ácidas como FADH2, NADPH y NADH:H, los portadores de electrones pueden
impulsar la síntesis para generar
formaldehido a partir del dióxido de carbono y otras reacciones de reducción de
manera independiente y/o paralela al ATP (De Duve & Pizano, 1995;
Gollihar, Levy, & Ellington, 2014; RicARdo & Szostak, 2009;
Wächtershäuser, 1990).
Posteriormente lo que comenzó como un
proceso “corriente arriba”, desde los minerales a los portadores de electrones,
podría haberse invertido con algunas modificaciones “corriente abajo” con el
desarrollo de la fermentación en algunas bacterias que empezaran a tener un
modo de vida heterótrofo. En un ambiente atestado de productores
quimiolitotrofos, la habilidad de consumir los desechos de un vecino muerto, o
de matarlo y consumir los materiales ya sintetizados por él, se convertiría en
una ventaja. Las modificaciones de su metabolismo harían que en lugar de
generar energía a partir de los electrones de los minerales, lo harían a partir
del material orgánico, un metabolismo de este tipo sería la glucólisis (De Duve & Pizano, 1995;
Gollihar et al., 2014; RicARdo & Szostak, 2009; Wächtershäuser, 1990).
La glucólisis presentaría una desventaja y
es el secuestro de los portadores de electrones, especialmente el
13.2 Evolución de la cadena de transporte de electrones
Tanto la respiración celular aeróbica como la fotosíntesis dependen en alguna etapa de sus procesos de la cadena de transporte de electrones, por lo que contar con una explicación para su origen evolutivo gradual, paso a paso es fundamental para tener un marco de referencia naturalista de todos estos sistemas bioquímicos. La temprana evolución de la fermentación hubiera provisto no solo la formación de ATP, sino también el poder reductor en forma de NADH o NADPH requeridos para la biosíntesis esencial. Sin embargo, las necesidades de no morir por su propia alimentación hicieron que las fermentaciones excretaran grandes cantidades de ácido al ambiente, y con el tiempo, el microambiente de estas bacterias se tornaría tremendamente ácido. En base a lo anterior pueden postularse varias fases evolutivas (B Alberts et al., 2015; Bruce Alberts et al., 2002; Blankenship, 2002, 2010; Brack, 1998; Gargaud, Martin, López-García, Montmerle, & Pascal, 2012; Hohmann-Marriott & Blankenship, 2011; Sepúlveda, Ortiz, & Holmes, 2015; Xiong et al., 2000).
Figura 13.1. Las cadenas de
transporte respiratorio y fotosintética son solo versiones refinadas de una
amplia gama de cadenas de transporte de electrones con funciones más humildes,
como la de sobrevivir en ambientes muy ácidos.
👉 Fase 1: La excreción
continua de ácidos disminuye el pH del ambiente externo de la célula
favoreciendo la evolución de bombas de protones que mantiene el ambiente
interno de la célula libre de iones protio(1+) reingresando debido al
transporte pasivo. Una de estas proteínas, es una proteína giratoria que puede
hidrolizar ATP para girar y forzar la salida de iones protio(1+) de la célula.
Esta proteína se convertiría en el ancestro del flagelo y de la proteína que
sintetiza energía en el final de la cadena de transporte de electrones (Bruce Alberts et al., 2002).
👉 Fase 2: Con el incremento de la
presión a exportar protones, se favorecerían sistemas redundantes para la
expulsión de iones protio(1+), por lo que a parte de las bombas de protones
mediadas por ATP evolucionarían paulatinamente otras bombas de protones que
emplearían electrones de alta energía para exportar iones protio(1+) de manera
individual. De hecho algunas bacterias acidófilas sobreviven actualmente en
estos ambientes ácidos gracias a la conjunción de bombas de protones mediadas
por electrones de alta energía así como por bombas de protones mediadas por ATP
(Bruce Alberts et al., 2002).
La fuente de energía en estos casos no es el ciclo de Krebs, sino algunos ácidos no fermentables de los que puede extraerse poder reductor en forma de NADH:H. Otras lo logran a partir de la extracción de electrones de alta energía de fuentes inorgánicas minerales. De manera concomitante, aquellas bombas de protones que pudieran funcionar de manera integrada mediante el flujo de un mismo par de electrones ahorrarían energía celular y por lo tanto serian seleccionadas para formar una cadena (Bruce Alberts et al., 2002).
Figura 13.2. Es un proceso
gradual en que varias bombas de protones se acoplan para obtener una nueva
función general.
Existe una amplia diversidad de cadenas de
transporte de electrones que pueden emplear a otros portadores de protones como
NADPH que a su vez obtienen sus electrones de fuentes minerales. Del mismo modo
el aceptor final de la cadena de transporte de electrones puede ser otras
especies químicas diferentes del oxígeno (Bruce Alberts et al., 2002).
👉 Fase 3: Eventualmente algunas bacterias perfeccionarían estas cadenas de
forma tal que podrían exportar más iones protio(1+) de lo que necesitan para
mantener su ambiente interno. Esto liberaría a las bombas de protones
giratorias mediadas por ATP para hacer la reacción opuesta, es decir en lugar
de romper ATP para expulsar iones protio(1+), girarían en el sentido opuesto
sintetizando ATP a medida que dejan ingresar iones protio(1+) para mantener sus
condiciones de pH interno normales. Ahora esta nueva célula tendría una nueva
fuente de energía, lo cual la haría proliferar de manera más eficiente que sus
competidores, siempre y cuando encuentre aceptores finales para los electrones,
de modo tal que se libere toda su energía en las cadenas de transporte. Varios
minerales son empleados para esta tarea, entre ellos el oxígeno (Bruce Alberts et al., 2002).
Otros aceptores finales de electrones son
el hierro ferroso, el manganeso IV, el cobalto III, el uranio VI, los nitratos,
el sulfato, el azufre, el fumarato entre otros. Muchas de estas sustancias son
difíciles de encontrar o son empleadas en otros procesos de importancia de la
célula, es por esto que solo hasta la producción de cantidades masivas de
oxigeno que la cadena de transporte de electrones con base en oxígeno adquirió
preponderancia “eso sin contar que al convertir al oxígeno en agua, esta cadena
de transporte de electrones funcionaria también como mecanismo de defensa
contra los efectos venenosos del oxígeno” (Bruce Alberts et al., 2002).
👉 Resumen: Estadios en la evolución de la cadena de transporte de electrones,
(1) evolución de una bomba de protones mediada por ATP. (2) evolución de bombas
de protones mediadas por flujo de electrones. (3) integración de las bombas
mediadas por electrones y liberación de las bombas mediadas por ATP para
sintetizar energía al dejar ingresar iones protio(1+) por transporte pasivo
facilitado (Bruce Alberts et al., 2002).
13.3 El fotosistema I
Los portadores de electrones podrían ser otros ácidos de altos niveles energéticos, como el ácido sulfhídrico “H2S”, una sustancia análoga al agua responsable del olor a huevos podridos de un pantano.
Figura 13.3. Síntesis de
NADH:H a partir de electrones de alta energía en una fotosíntesis de tipo I.
El
ácido sulfhídrico se genera de forma geoquímica, lo cual concuerda con nuestro
marco de referencia de comedores de roca luchando por la existencia. Sin
embargo, los electrones contenidos en el ácido sulfhídrico no son del nivel
energético necesario para impulsar reacciones como las generadas por NADH:H, o
para generar más NADH:H independiente a la roca o a otros compuestos orgánicos.
Sin embargo, las fermentaciones habrían conllevado rápidamente a la formación
de cadenas de transporte de electrones para defenderse de la acidez del
ambiente generada por la fermentación misma. Una vez que la eficiencia de la
cadena de transporte de electrones excede a la de la fermentación misma, puede emplearse algunas baterías de reacción
para otras funciones empleando la presión electro-osmótica externa u otras
fuentes de energía (B Alberts et al.,
2015; Bruce Alberts et al., 2002; Blankenship, 2002, 2010; Brack, 1998; Gargaud
et al., 2012; Hohmann-Marriott & Blankenship, 2011; Sepúlveda et al., 2015;
Xiong et al., 2000).
Las bacterias verde sulfurosas al igual
que los primeros seres vivos armados con fotosíntesis del tipo I emplean sus
cadenas de transporte de electrones en sentido directo o inverso dependiendo de
las condiciones de luz y disponibilidad de ácido sulfhídrico. Resulta notable
como el mismo juego de proteínas puede ejecutar dos procesos opuestos con tan
pocas modificaciones, que para este caso es el fotosistema en el cuál el rol
principal lo juega la clorofila. En la imagen de izquierda a derecha tenemos el
complejo I "NADH:H deshidrogenasa" de la cascada de transporte de
electrones, la ubiquinona, los complejos II, III de la cadena de transporte de
electrones que sirven como bombas de protones, la citocromo oxidasa "de
azufre u otros aceptores de electrones diferentes del oxígeno" y
finalmente el fotosistema que puede o no funcionar dependiendo de las
condiciones ambientales (Bruce Alberts et al., 2002).
En este contexto la cadena de transporte
de electrones es meramente un escudo anticorrosivo, nada más, pero un detalle
más debe saltarnos a la vista, los electrones sin energía siempre deben caer a
un aceptor inorgánico. En este contexto lo que se necesita es la evolución de
una proteína que reaccione ante la luz, para despojar de electrones a una
molécula inorgánica, y al mismo tiempo cargarlos con energía suficiente como
para invertir el curso de la cadena de transporte de electrones, en este flujo
inverso en lugar de consumir NADH:H se produciría. La energía final la
proporcionaría el SOL (Bruce Alberts et al., 2002).
En otras palabras, la fotosíntesis
evolucionaría generado el fotosistema, pero aprovechando a las cadenas de
transporte de electrones preexistentes. Aunque hipotético, este proceso es
empleado mediante el fotosistema I de las bacterias verde-sulfurosas. En el
fotosistema I se emplea luz para transferir un protón y un electrón desde el
ácido sulfhídrico al NAD a través de una cadena de transporte de electrones que
funciona de manera inversa a la de la respiración celular, conllevando a la
formación de NADH:H. Posteriormente NADH:H se emplea para otras reacciones que
necesite la célula en rutas metabólicas alternas. El fotosistema I necesita
menor energía para formar NADH:H debido a que los electrones almacenados en el
ácido sulfhídrico son de mayor energía que los del agua, solo se necesita un
fotón para echar a andar el proceso (Alberts et al., 2002).
13.4 El fotosistema II
A pesar de ser un poco confuso ya que en la misma bacteria tendríamos la potencia de tener cadenas de transporte de electrones que van “hacia abajo”, sirviendo como escudo contra la corrosión de iones protio(1+); y cadenas de transporte de electrones en sentido inverso mediante la fotosíntesis, el proceso dependería de las condiciones del ambiente. En ambientes de poca acidez, la bacteria puede importar protones del ambiente externo permitiendo el flujo inverso a través de su cadena de transporte de electrones generando así la primera fotosíntesis, pero cuando el ambiente es muy ácido, la misma cadena funcionaría hacia abajo sirviendo como escudo sacando a los iones protio(1+) del interior de la célula. Aunque se ve algo ineficiente, las bacterias verde sulfurosas tienen precisamente ese tipo de fotosíntesis reversa (B Alberts et al., 2015; Bruce Alberts et al., 2002; Blankenship, 2002, 2010; Brack, 1998; Gargaud et al., 2012; Hohmann-Marriott & Blankenship, 2011; Sepúlveda et al., 2015; Xiong et al., 2000).
Figura 13.4. Tres esquemas
que representan el funcionamiento de la cadena de transporte de electrones.
"Arriba" en las bacterias verdes sulfurosas la cadena se usa en doble
vía, si la flecha apunta hacia la NADH deshidrogenasa funciona como
fotosíntesis, y si la flecha apunta hacia abajo como respiración celular.
"En medio" tenemos el funcionamiento de la cadena de transporte de
electrones en la fotosíntesis tipo II de cloroplastos y cianobacterias. "A
bajo" tenemos la cadena de transporte de electrones de la respiración
celular aeróbica. Resalta el hecho de que en el fotosistema I de las bacterias
verde sulfurosas la cadena de transporte de electrones se usa a medias,
mientras que en el fotosistema del tipo II se emplea de manera completa
(Alberts et al., 2002).
Sin embargo, ni las plantas ni las
cianobacterias presentan esta fotosíntesis, en ellas tanto las cadenas de
transporte de electrones directa y reversa están separadas, y a su vez, pueden
extraer electrones de ácidos más débiles con electrones de menor energía como
el agua. ¿Cómo sucedió?, en términos probabilísticos no fue sencillo, mientras
que del fotosistema I se tiene evidencia de su evolución poco después del
surgimiento de la vida registrada en piedra hace unos 3.5 mil millones de años,
del fotosistema II solo se tienen registros de poco antes de 2.7-2.4 mil
millones de años. Un tercio de la historia de la vida fue necesario para su
evolución, lo que implica que no fue fácil. Recordemos que hasta ahora, nuestra
fotosíntesis tipo I es diferente a la actual, pues solo produce NADH:H o sus
análogos, pero no tiene los demás accesorios, como la f1f0 ATP sintetasa o el
ciclo de fijación de carbono atmosférico (Alberts et al., 2002).
Mencionamos anteriormente que el fotosistema I despoja de un protón y un electrón al ácido sulfhídrico, pero lo que no se mencionó es que, en el proceso, el otro protón se desprende del azufre, el cual se convierte el azufre molecular, y el protón liberado externamente reacciona con el agua para formar iones protio(1+), lo cual acidifica el medio externo. Del mismo modo que sucede con la cadena de transporte de electrones en sentido directo, la acumulación de protones en el medio externo puede ser útil si la bacteria es eficiente en sacarlos de sí misma (Alberts et al., 2002).
Figura 13.5. Diagrama
evolutivo de varios tipos de fotosíntesis conocidos actualmente y de sus
parientes las respiraciones celulares dependientes de cadena de transporte de
electrones (Alberts et al., 2002).
De este modo las ATPasa que sirven como
bombas de protones se pueden emplear como sintetizadores de ATP, que es otro de
los componentes típicos de la fotosíntesis. El siguiente paso importante fue la
evolución del ciclo de reacciones de fijación de carbonos, que es opuesto al
ciclo de Krebs, nos referimos al ciclo de Kalvin-Benson. Es en este punto
evolutivo donde los linajes que conllevaron a la respiración celular aeróbica
se separan del de la fotosíntesis moderna. Ambas heredan una cadena de
transporte de electrones con una f1f0 ATP sintetasa que depende de un ambiente
ácido para funcionar, así como por un
ciclo de reacciones que sirve para conectar el dióxido de carbono con moléculas
de varios carbonos más complejas (Alberts et al., 2002).
Finalmente, en el linaje de las
cianobacterias ocurre una duplicación de la proteína que sirve como
fotosistema, lo cual permite cargar con más energía a los ácidos de los cuales
se extraen electrones y protones. Este paso es fundamental ya que le permite a
la bacteria emplear ácidos con electrones de menor energía como el agua. Una
vez esto sucede, las bacterias quedan liberadas de sus cunas de minerales para
colonizar el resto del planeta, empleando al agua como fuente de electrones y
protones, y al dióxido de carbono como fuente de carbono y oxígeno (Alberts et al., 2002).
13.5 La gran crisis de oxígeno
El oxígeno es una especie química extremadamente tóxica, ya que causa reacciones aleatorias de oxidación con los compuestos orgánicos. Las bacterias anaeróbicas actuales son un ejemplo de cuan tóxico es este gas, ya que al ser expuestas a la atmósfera oxigenada se mueren al instante. De hecho, la toxicidad por oxígeno es tan fuerte que aun seres vivos con mecanismos de defensa no son inmunes a él, pues causa acumulación de mutaciones que conllevan al cáncer y al envejecimiento. Con la evolución del fotosistema II las bacterias empezarían a esparcirse por el planeta elevando poco a poco las cantidades de oxígeno en el planeta. Al inicio de manera lenta, ya que grandes yacimientos de minerales aún no se habían oxidado desde la formación del planeta, en especial grandes bandas de hierro ferroso en los océanos (Blankenship & Hartman, 1998; Buick, 2008; De Duve & Pizano, 1995; Holland, 2006; Kump, 2008; Kump & Barley, 2007; Planavsky et al., 2014; Tarbuck, Lutgents, & Tasa, 2014).
Figura 13.6. Mediciones con
intervalos superior e inferior del oxígeno molecular en la atmósfera del
planeta a lo largo de su historia.
El hierro ferroso en solución acuosa
actuaría como un filtro/esponja que poco a poco absorbería el oxígeno,
convirtiéndose en hierro férrico, el cual se deposita en el lecho oceánico,
convirtiéndose en los grandes yacimientos de hierro férrico de la actualidad.
Sin embargo, cuando la superficie del planeta se oxidó por completo, los
niveles de oxígeno del planeta debieron elevarse. Las bandas de hierro férrico
oceánico han sido datadas de hace unos 2.7 mil millones de años, lo cual ayuda
a ubicar el tiempo en que las cianobacterias se dispersaron por el planeta. El
proceso fue geológicamente lento, pues la cantidad de oxígeno se estabiliza a
los niveles cercanos a los actuales desde hace unos 1.5 mil millones de años
hasta hace unos 500 millones de años (Blankenship &
Hartman, 1998; Buick, 2008; De Duve & Pizano, 1995; Holland, 2006; Kump,
2008; Kump & Barley, 2007; Planavsky et al., 2014; Tarbuck et al., 2014).
El oxígeno en el planeta puede
clasificarse en tres períodos, el evento denominado Gran Crisis de Oxígeno
representa la primera elevación de oxígeno entre 2,7 y 2,5. Le sigue un período
de estabilidad hasta una segunda elevación hace unos 800 millones de años justo
antes de la explosión cámbrica, el tercer evento sucede hace unos 300 millones
de años cuando las plantas terrestres colonizaron el planeta. El mayor pico se
da durante la era carbonífera (Blankenship &
Hartman, 1998; Buick, 2008; De Duve & Pizano, 1995; Holland, 2006; Kump,
2008; Kump & Barley, 2007; Planavsky et al., 2014; Tarbuck et al., 2014).
Este crecimiento tan gradual les permitió
a las bacterias generar una serie de contramedidas contra el mortífero gas,
algunas se escondieron en ambientes anaeróbicos, otras desarrollaron enzimas
modificadas de la cadena de transporte de electrones, un ejemplo fue el de los
citocromos con su alto contenido de dominios heme que contienen hierro. Esta
modificación conllevó a la evolución de la citocromo oxidasa que podía emplear
al oxígeno como último aceptor de electrones, convirtiendo así al gas mortífero
en un componente más de la cadena de transporte de electrones, dando nacimiento
así a la respiración celular aeróbica (Blankenship &
Hartman, 1998; Buick, 2008; De Duve & Pizano, 1995; Holland, 2006; Kump,
2008; Kump & Barley, 2007; Planavsky et al., 2014; Tarbuck et al., 2014).
Otras bacterias que no poseían la cadena
en primera instancia, simplemente desarrollaron enzimas como la catalasa, que
inactivaban al oxígeno o a sus subproductos tóxicos. De hecho, tanto las
cianobacterias, las bacterias purpuras fotosintéticas como los mismos
cloroplastos de las plantas pueden cambiar o emplear de manera simultánea ambos
tipos de metabolismo. En las bacterias purpuras, solo existe una cadena, y por
lo tanto dependiendo de las condiciones se la emplea de manera “hacia abajo”
para la respiración celular aeróbica o “hacia arriba” para la fotosíntesis. Los
cloroplastos y cianobacterias al poseer varias membranas pueden separar sus
funciones (Blankenship &
Hartman, 1998; Buick, 2008; De Duve & Pizano, 1995; Holland, 2006; Kump,
2008; Kump & Barley, 2007; Planavsky et al., 2014; Tarbuck et al., 2014).
La evolución es un proceso conservativo,
en los que una parte puede funcionar en muchos contextos diferentes dando
funciones en conjunto muy diferentes e incluso hasta puestas. Es por esto que
cuando se hace el cambio de estudiar la respiración celular aeróbica a la
fotosíntesis se da una sensación de deja
vu, de estar repitiendo lo que ya se explicó en el pasado. Lo que es
paradójico es que las proteínas que conectan a ambos tipos de metabolismo, las
cadenas de transporte de electrones apenas si son conocidas, mientras que otras
como la clorofila reciben toda la atención, dando la apariencia de que ambos
metabolismos funcionaran de formas totalmente diferentes (Blankenship &
Hartman, 1998; Buick, 2008; De Duve & Pizano, 1995; Holland, 2006; Kump,
2008; Kump & Barley, 2007; Planavsky et al., 2014; Tarbuck et al., 2014).
Referencias bibliográficas
|| Regresar al Índice ||
Alberts, B, Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K.,
& Walter, P. (2015). Molecular biology of the cell (5th ed.).
Garland Science.
Alberts, Bruce, Johnson, A., Lewis, J., Raff, M., Roberts, K., &
Walter, P. (2002). The Evolution of Electron-Transport Chains.
Bassham, J. A., Benson, A. A., & Calvin, M. (1950). The path of carbon
in photosynthesis VIII. The role of malic acid. Lawrence Berkeley National
Laboratory.
Bassham, J. A., Benson, A. A., Kay, L. D., Harris, A. Z., Wilson, A. T.,
& Calvin, M. (1954). The path of carbon in photosynthesis. XXI. The cyclic
regeneration of carbon dioxide acceptor1. Journal of the American Chemical
Society, 76(7), 1760–1770.
Becerra, A., Rivas, M., García-Ferris, C., Lazcano, A., & Peretó, J.
(2014). A phylogenetic approach to the early evolution of autotrophy: the case
of the reverse TCA and the reductive acetyl-CoA pathways. International
Microbiology, 17(2), 91–97.
Bekker, A., Planavsky, N., Rasmussen, B., Krapez, B., Hofmann, A., Slack,
J., … Konhauser, K. (2014). Iron formations: their origins and implications for
ancient seawater chemistry. In Treatise on Geochemistry (Vol. 12, pp.
561–628). Elsevier.
Benson, A A, Bassham, J. A., Calvin, M., Goodale, T. C., Haas, V. A.,
& Stepka, W. (1950). The path of carbon in photosynthesis. V. Paper
chromatography and radioautography of the products1. Journal of the American
Chemical Society, 72(4), 1710–1718.
Benson, Andrew A, Bassham, J. A., Calvin, M., Hall, A. G., Hirsch, H.,
Kawaguchi, S., … Tolbert, N. E. (1952). The Path of Carbon in Photosynthesis,
XV. Ribulose and Sedoheptulose. Lawrence Berkeley National Laboratory.
Biel, K., & Fomina, I. (2015). Benson-Bassham-Calvin cycle
contribution to the organic life on our planet. Photosynthetica, 53(2),
161–167.
Björn, L. O., Papageorgiou, G. C., Dravins, D., & Govindjee, G.
(2009). Detectability of life and photosynthesis on exoplanets. INDIAN ACAD
SCIENCES CV RAMAN AVENUE, SADASHIVANAGAR, PB# 8005, BANGALORE 560 080, INDIA.
Blankenship, R. E. (1992). Origin and early evolution of photosynthesis. Photosynthesis
Research, 33(2), 91–111.
Blankenship, R. E. (2002). Origin and evolution of photosynthesis. Molecular
Mechanisms of Photosynthesis, 220–257.
Blankenship, R. E. (2010). Early evolution of photosynthesis. Plant
Physiology, 154(2), 434–438.
Blankenship, R. E., & Hartman, H. (1998). The origin and evolution of
oxygenic photosynthesis. Trends in Biochemical Sciences, 23(3),
94–97.
Brack, A. (1998). The molecular origins of life: assembling pieces of
the puzzle. Cambridge University Press.
Buick, R. (2008). When did oxygenic photosynthesis evolve? Philosophical
Transactions of the Royal Society B: Biological Sciences, 363(1504),
2731–2743.
Calvin, M., Bassham, J. A., Benson, A. A., Lynch, V., Ouellet, C., Schou,
L., … Tolbert, N. E. (1950). The path of carbon in photosynthesis. X. Carbon
dioxide assimilation in plants. Lawrence Berkeley National Laboratory.
Cardona, T. (2017). Photosystem II is a Chimera of Reaction Centers. Journal
of Molecular Evolution, 84(2–3), 149–151.
Cardona, T., Murray, J. W., & Rutherford, A. W. (2015). Origin and
evolution of water oxidation before the last common ancestor of the Cyanobacteria.
Molecular Biology and Evolution, msv024.
Carson, S. F., Ruben, S., Kamen, M. D., & Foster, J. W. (1941).
Radioactive Carbon as an Indicator of Carbon Dioxide Utilization VI. On the
Possibility of Carbon Dioxide Reduction via the Carboxylase System. Proceedings
of the National Academy of Sciences, 27(10), 475–480.
Caspi, R., Altman, T., Billington, R., Dreher, K., Foerster, H., Fulcher,
C. A., … Kubo, A. (2014). The MetaCyc database of metabolic pathways and
enzymes and the BioCyc collection of Pathway/Genome Databases. Nucleic Acids
Research, 42(D1), D459–D471.
Caspi, R., Billington, R., Ferrer, L., Foerster, H., Fulcher, C. A.,
Keseler, I. M., … Mueller, L. A. (2016). The MetaCyc database of metabolic
pathways and enzymes and the BioCyc collection of pathway/genome databases. Nucleic
Acids Research, 44(D1), D471–D480.
Caspi, R., Dreher, K., & Karp, P. D. (2013). The challenge of
constructing, classifying, and representing metabolic pathways. FEMS
Microbiology Letters, 345(2), 85–93.
COOMB, J., Baldry, C. W., & Bucke, C. (2016). C4 PHOTOSYNTHESIS. In Botany:
Proceedings of the Fiftieth Anniversary Meeting of the Society for Experimental
Biology (p. 177). Elsevier.
De Clerck, O., Bogaert, K. A., & Leliaert, F. (2012). Diversity and
evolution of algae: primary endosymbiosis. Adv Bot Res, 64,
55–86.
De Duve, C., &
Pizano, M. (1995). Polvo vital: origen y evolución de la vida en la tierra.
Norma, Bogotá.
Emerson, R., & Arnold, W. (1932a). A separation of the reactions in
photosynthesis by means of intermittent light. The Journal of General
Physiology, 15(4), 391.
Emerson, R., & Arnold, W. (1932b). The photochemical reaction in
photosynthesis. The Journal of General Physiology, 16(2),
191–205.
Foster, J. W., Carson, S. F., Ruben, S., & Kamen, M. D. (1941).
Radioactive Carbon as an Indicator of Carbon Dioxide Utilization VII. The
Assimilation of Carbon Dioxide by Molds. Proceedings of the National Academy
of Sciences, 27(12), 590–596.
Fru, E. C., Rodríguez, N. P., Partin, C. A., Lalonde, S. V, Andersson, P.,
Weiss, D. J., … Konhauser, K. O. (2016). Cu isotopes in marine black shales
record the Great Oxidation Event. Proceedings of the National Academy of
Sciences, 201523544.
Furbank, R. T. (2016). Walking the C4 pathway: past, present, and future. Journal
of Experimental Botany, erw161.
Gargaud, M., Martin, H., López-García, P., Montmerle, T., & Pascal, R.
(2012). Intermezzo: The Gestation of Life and its First Steps. In Young Sun,
Early Earth and the Origins of Life (pp. 93–154). Springer.
Gaucher, C., Sial, A. N., & Frei, R. (2015). Chemostratigraphy of
Neoproterozoic banded iron formation (BIF): types, age and origin. Chemostratigraphy:
Concepts, Techniques and Applications. Elsevier, Amsterdam, 43.
Gollihar, J., Levy, M., & Ellington, A. D. (2014). Many Paths to the
Origin of Life. Science, 343(6168), 259–260.
Gorbushina, A. A. (2007). Life on the rocks. Environmental Microbiology,
9(7), 1613–1631.
Govindjee, G., Nonomura, A., & Lichtenthaler, H. K. (2020).
Remembering Melvin Calvin (1911–1997), a highly versatile scientist of the 20th
century. Photosynthesis Research, 143(1), 1–11.
Gray, M. W., & Archibald, J. M. (2012). Origins of mitochondria and
plastids. In Genomics of Chloroplasts and Mitochondria (pp. 1–30).
Springer.
Hibberd, J. M., & Furbank, R. T. (2016). In retrospect: Fifty years of
C4 photosynthesis. Nature, 538(7624), 177–179.
Hohmann-Marriott, M. F., & Blankenship, R. E. (2011). Evolution of
photosynthesis. Annual Review of Plant Biology, 62, 515–548.
Holland, H. D. (2006). The oxygenation of the atmosphere and oceans. Philosophical
Transactions of the Royal Society B: Biological Sciences, 361(1470),
903–915.
Johnson, A., Romaniello, S. J., Reinhard, C., Garcia-Robledo, E.,
Revsbech, N. P., Canfield, D. E., … Anbar, A. D. (2015). Oxidative Weathering
of Archean Sulfides: Implications for the Great Oxidation Event. In AGU Fall
Meeting Abstracts.
Kump, L. R. (2008). The rise of atmospheric oxygen. Nature, 451(7176),
277–278.
Kump, L. R., & Barley, M. E. (2007). Increased subaerial volcanism and
the rise of atmospheric oxygen 2.5 billion years ago. Nature, 448(7157),
1033–1036.
Kutschera, U., & Niklas, K. J. (2004). The modern theory of biological
evolution: an expanded synthesis. Naturwissenschaften, 91(6),
255–276.
Pace, N. R. (2001). The universal nature of biochemistry. Proceedings
of the National Academy of Sciences, 98(3), 805–808.
Pessarakli, M. (2016). Handbook of photosynthesis. CRC Press.
Planavsky, N. J., Asael, D., Hofmann, A., Reinhard, C. T., Lalonde, S. V,
Knudsen, A., … Smith, A. J. B. (2014). Evidence for oxygenic photosynthesis
half a billion years before the Great Oxidation Event. Nature Geoscience,
7(4), 283–286.
Raven, J. A., Andrews, M., & Quigg, A. (2005). The evolution of
oligotrophy: implications for the breeding of crop plants for low input
agricultural systems. Annals of Applied Biology, 146(3), 261–280.
Raven, J., & Skene, K. (2003). Chemistry of the early oceans: the
environment of early life. Evolution on Planet Earth—the Impact of the
Physical Environment, 55–64.
RicARdo, A., &
Szostak, J. W. (2009). Origin of life on earth. Scientific
American, 301(3), 54–61.
Ruben, S, & Kamen, M. D. (1941). Long-lived radioactive carbon: C 14. Physical
Review, 59(4), 349.
Ruben, Samuel, Randall, M., Kamen, M., & Hyde, J. L. (1941). Heavy
oxygen (O18) as a tracer in the study of photosynthesis. Journal of the
American Chemical Society, 63(3), 877–879.
Ruvindy, R., White III, R. A., Neilan, B. A., & Burns, B. P. (2016).
Unravelling core microbial metabolisms in the hypersaline microbial mats of
Shark Bay using high-throughput metagenomics. The ISME Journal, 10(1),
183–196.
Schirrmeister, B. E., de Vos, J. M., Antonelli, A., & Bagheri, H. C.
(2013). Evolution of multicellularity coincided with increased diversification
of cyanobacteria and the Great Oxidation Event. Proceedings of the National
Academy of Sciences, 110(5), 1791–1796.
Schirrmeister, B. E., Gugger, M., & Donoghue, P. C. J. (2015).
Cyanobacteria and the Great Oxidation Event: evidence from genes and fossils. Palaeontology,
58(5), 769–785.
Schneider, E. D., & Kay, J. J. (1994). Life as a manifestation of the
second law of thermodynamics. Mathematical and Computer Modelling, 19(6–8),
25–48.
Schneider, E. D., & Kay, J. J. (1995). Order from disorder: the
thermodynamics of complexity in biology. What Is Life? The next Fifty Years:
Speculations on the Future of Biology, 161–172.
Schou, L., Benson, A. A., Bassham, J. A., & Calvin, M. (1950). The
Path of Carbon in Photosynthesis, XI The Role of Glycolic Acid. Physiologia
Plantarum, 3(4), 487–495.
Sepúlveda, R., Ortiz, R., & Holmes, D. S. (2015). Evolution of
Electron Transport Chains During the Anaerobic to Aerobic Transition on Early
Earth. In AGU Fall Meeting Abstracts.
Stanier, R. Y., & Van Niel, C. B. (1941). The main outlines of
bacterial classification. Journal of Bacteriology, 42(4), 437.
Tarbuck, E. J., Lutgents, F. K., & Tasa, D. (2014). Earth, an
introduction to physical geology, 11ed. Boston, Pearson.
Van Niel, C B. (1935). Photosynthesis of bacteria. In Cold Spring
Harbor Symposia on Quantitative Biology (Vol. 3, pp. 138–150). Cold Spring
Harbor Laboratory Press.
Van Niel, C B. (2006). The bacterial photosyntheses and their importance
for the general problem of photosynthesis. Advances in Enzymology, 1,
263–328.
van Niel, C Bo. (1949). The comparative biochemistry of photosynthesis. American
Scientist, 37(3), 371–383.
Von Bertalanffy, L. (1950). The theory of open systems in physics and
biology. Science, 111(2872), 23–29.
Wächtershäuser, G. (1990). The case for the chemoautotrophic origin of
life in an iron-sulfur world. Origins of Life and Evolution of the Biosphere,
20(2), 173–176.
Xiong, J., Fischer, W. M., Inoue, K., Nakahara, M., & Bauer, C. E.
(2000). Molecular evidence for the early evolution of photosynthesis. Science,
289(5485), 1724–1730.
Zerkle, A. L., Poulton, S. W., Newton, R. J., Mettam, C., Claire, M. W.,
Bekker, A., & Junium, C. K. (2017). Onset of the aerobic nitrogen cycle
during the Great Oxidation Event. Nature, 542(7642),
465–467.


















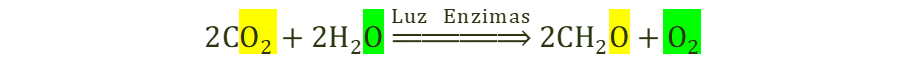



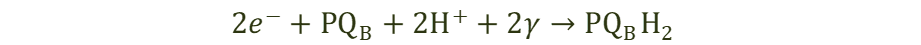












































No hay comentarios:
Publicar un comentario