1. Introducción
Los muros de una casa, los muros de una
caja fuerte o las láminas de un carro separan al frágil interior de ambientes
impredecibles y hostiles. Estas barreras son duras y rígidas, para poder
realizar esta protección. Podríamos esperar que la barrera que separa lo vivo
de lo no vivo fuera una estructura igual de poderosa, dura y rígida; y, aun
así, la membrana celular es de hecho una barrera delgada, frágil y dinámica. Es una bicapa lipídica que delimita toda la
célula. Es una estructura formada por dos láminas de fosfolípidos, glucolípidos
y proteínas que rodean, limitan la forma y contribuyen a mantener el equilibrio
entre el interior (medio intracelular) y el exterior (medio extracelular) de
las células. Regula la entrada y salida de muchas sustancias entre el
citoplasma y el medio extracelular. Es similar a las membranas que delimitan
los orgánulos de células eucariotas.
Está compuesta por dos láminas que sirven de "contenedor" para el citosol y los distintos compartimentos internos de la célula, así como también otorga protección mecánica. Está formada principalmente por fosfolípidos (fosfatidiletanolamina y fosfatidilcolina), colesterol, glúcidos y proteínas (integrales y periféricas). La principal característica de esta barrera es su permeabilidad selectiva, lo que le permite seleccionar las moléculas que deben entrar y salir de la célula. De esta forma se mantiene estable el medio intracelular, regulando el paso de agua, iones y metabolitos, a la vez que mantiene el potencial electroquímico (haciendo que el medio interno esté cargado negativamente). La membrana plasmática es capaz de recibir señales que permiten el ingreso de partículas a su interior. Cuando una molécula de gran tamaño atraviesa o es expulsada de la célula y se invagina parte de la membrana plasmática para recubrirlas cuando están en el interior ocurren respectivamente los procesos de endocitosis y exocitosis.
Figura 1.1.
La membrana celular es difícil de ver. (Izquierda) Las primeras microfotografías mostraban una
ultraestructura de tres partes, dos de ellas se podían teñir de manera muy
densa en las pares externa e interna de la membrana, y una zona que no se tiñe
en medio. (Derecha) En la microfotografía tenemos dos células coloreadas en
verde y en azul, mientras que el espacio intersticial está señalado de color
café. El par de membranas que podemos ver muestran una estructura típica en
estas microfotografias, dos líneas densamente teñidas con otra en medio más
clara como si fuera un sándwich.
Las barreras que separan a la célula verde
y la célula azul (Figura 1.1
derecha) son increíblemente delgadas en comparación con el volumen celular. El
grosor de una membrana celular pude rondar la longitud de unos 5 nm, “una
mitocondria es mil veces más larga”. Debido a este grosor tan corto, la
membrana celular no pudo ser vista sino hasta 1950 cuando las mejoras en la
preparación de las células para la microscopía electrónica permitieron
visualizar la estructura “de lo cual se desprende que es imposible para un
microscopio óptico ver la membrana dado que este amplifica solo en la escala de
los µm. Unas de las primeras microfotografías fueron realizadas por J. D.
Robertson de la universidad de Duke (Robertson, 1956). Sin importar cual
membrana, ya fuera la membrana celular externa o la membrana de los orgánulos,
si la membrana fuera de un animal, una planta, un hongo, o una bacteria,
siempre se podía ver la misma estructura (Edidin, 2003).
Actualmente se sabe que la membrana es una
bicapa de moléculas llamadas fosfolípidos, las cuales a su vez tiene dos
partes, una cabeza polar y una cola apolar. Por naturaleza muchos lípidos en
agua se organizan de modo que sus colas apolares se encierren totalmente
alejándose del agua, dejando solo las cabezas polares en contacto con ella. Es
por esto que se ve una estructura triple. Las zonas que se tiñen densamente son
las regiones polares de los fosfolípidos, mientras que la parte interna está
constituida por dos colas de lípidos independientes.
2. Historia de la membrana celular
Desde la invención del microscopio en el siglo XVII, se ha conocido que los tejidos de las plantas y animales están compuestos de células. La pared celular de las plantas fue visible con gran facilidad incluso con los primeros microscopios, pero ninguna barrera similar a esta fue vista en células animales, aunque dio lugar a que debía de existir algo parecido. A mediados del siglo XIX, esta cuestión estaba siendo constantemente investigada por lo que Moritz Traube notó que esta capa externa debía ser semipermeable para permitir el transporte de iones (CRB, 1906). Traube no tenía evidencia directa para afirmar la composición de esta capa, aunque erróneamente declaró que estaba formada por una reacción de fases diferentes “como la del agua y el aceite” del protoplasma celular con el fluido extracelular (E. A. Mason, 1991; Sourkes, 1955).
Figura 2.1.
Charles Ernest Overton (1865–1933). Considerado
como un pionero de la teoría de la membrana celular. En los últimos años del
siglo XIX, Overton realizó un trabajo experimental, permitiendo establecer la
distinción entre la pared celular de las plantas y su membrana citoplasmática.
Estudió la permeabilidad de una gama de materiales biológicos a alrededor de
500 compuestos químicos. En 1900, Overton propuso un modelo de biomembrana
"Modelo de biomembrana Overton" que afirmaba que las biomembranas
están formadas por lípidos. Dio esta declaración sobre la base de la
observación del transporte de sustancias solubles en lípidos a través de las
biomembranas.
2.1.
Un muro de grasa
La naturaleza lipídica de la membrana
celular fue primeramente intuida de manera correcta por Georg Quincke, quien
notó que una célula generalmente toma la forma de una esfera en el agua y,
cuando es partida a la mitad, forma dos esferas más pequeñas. Otro material que
mostraba este único comportamiento era el aceite. Él también notó que una
delgada capa de aceite de comporta como una membrana semipermeable,
precisamente como se predijo (Gupta & Surolia, 2010; Latorre,
1996).
Basándose en estas observaciones, Quincke afirmó que la membrana celular
formaba una capa de un fluído de grasa con un grosor menor a 100 nm. Los
primeros experimentos a cerca de la naturaleza química de la membrana
biológica, específicamente de la membrana celular externa fueron obtenidos por
Ernst Overton de la universidad de Zürich durante la década de 1890 (Kleinzeller, 1997). Charles Ernst Overton "1865-1933", biólogo y
farmacólogo inglés, sus estudios en la membrana celular estaban enfocados en la
mejora de los fármacos como las anestesias (Lipnick, 2013).
Overton sabía que los solutos no polares
se disuelven fácilmente en solventes no polares, y que los solutos polares se
disuelven fácilmente en solventes polares. Es decir, lo parecido se disuelve
con lo parecido. Un ejemplo de ello es por ejemplo una grasa, como soluto es
una sustancia no polar, la cual se disuelve en solventes no polares como el
éter líquido. La grasa no pude disolverse en agua, ya que el agua es un
solvente polar. El alcohol metanol como soluto líquido puede disolverse en agua
ya que ambos son sustancias polares. Sabiendo esto, Overton razonó que aquellas
sustancias capaces de atravesar la membrana celular primero deberían disolverse
en ella para poder ingresar. Para medir
la permeabilidad de la membrana celular, Overton colocó pelos de raíces de
plantas en cientos de diferentes soluciones, conteniendo una diversa variedad
de compuestos químicos que varían en su solubilidad. Con el desarrollo de sus
experimentos, Overton de dio cuenta de que los solutos que se diluyen en
aceites podían ingresar a las células a una mayor velocidad. Overton por lo
tanto concluyó que el poder solvente de la membrana celular era equivalente al
de los ácidos grasos.
2.2.
La bicapa lipídica
Figura 2.2.
Modelo de la bicapa de lípidos. La capa externa
pone sus cabezas polares hacia el exterior en contacto con el agua, y la
membrana interna pone sus cabezas polares hacia el interior en contacto con el
agua. Los fosfolípidos se organizan de manera estrecha de modo tal que las
colas apolares quedan fuera del contacto del agua, y lo único que podría verse
son las cabezas polares. Esto concuerda con las microfotografías, donde las
cabezas polares son la parte que más se tiñe en la microfotografía y las colas
apolares la parte intermedia que no se tiñe.
La primera propuesta de que la membrana biológica podría estar compuesta por una bicapa lipídica fue realizada por dos científicos daneses en 1925 E. Gorter y F. Grendel (Coskun & Simons, 2010; Edidin, 2003). Estos investigadores extrajeron los lípidos de las células rojas humanas o eritrocitos humanos para determinar la cantidad de moléculas de fosfolípidos por unidad de área de los glóbulos rojos. Esto lo realizaron en estas células debido a que los glóbulos rojos humanos carecen de membranas internas y núcleos, por lo que literalmente la única membrana con lípidos de membrana seria la membrana externa. Si la membrana biológica se tratara de una sola capa externa, el radio entre la superficie de agua y los lípidos extraídos debería ser de 1 a 1. Los resultados arrojaron valores de 1,8 a 1, y de 2,2 a 1. Los valores más grandes eran los de los lípidos y el valor menor la superficie de agua que cubre al glóbulo rojo. De lo anterior se dedujo que había dos membranas para una misma cantidad de agua en la superficie del glóbulo rojo. Esta conclusión era correcta, aunque Gorter y Grendel realizaron varios errores experimentales “que por casualidad se anularon el uno al otro”.
Figura 2.3.
Fosfolípidos La capa externa pone sus cabezas polares
hacia el exterior en contacto con el agua, y la membrana interna pone sus
cabezas polares hacia el interior en contacto con el agua. Los fosfolípidos se
organizan de manera estrecha de modo tal que las colas apolares quedan fuera
del contacto del agua, y lo único que podría verse son las cabezas polares.
Esto concuerda con las microfotografías, donde las cabezas polares son la parte
que más se tiñe en la microfotografía y las colas apolares la parte intermedia
que no se tiñe.
En base a esto, el modelo de la bicapa
lipídica se configuro en su estructura termodinámica más estable, la cual fue
confirmada por microfotografías de microscopios electrónicos varios años
después. Los fosfolípidos son sustancias con dos naturalezas de solubilidad,
una cabeza polar soluble en agua y una cola apolar insoluble en agua. La bicapa
lipídica, en este modelo se puede apreciar como las colas lipídicas se
encuentran en un contacto íntimo, las cuales bajo una mirada sin mucha
resolución aparecen como una sola capa en medio de dos capas con propiedades
altamente polares. Las capas polares se dan debido a que cada cola posee una
cabeza, las esferas rojas indican la presencia de átomos electronegativos que
permiten interactuar con el agua y poder disolverse.
2.3. El grosor de la membrana
A principios del siglo XX, la naturaleza
química, no la estructural, de la membrana celular era conocida. Dos
experimentos llevados a cabo en 1942 establecieron la base para llenar este
hueco. Por medio de la medición de la capacidad eléctrica de una solución de
eritrocitos, H. Fricke determinó que la membrana celular tenía un grosor de 3.3
nm (Cole, 1972; Edidin, 2003). A pesar de que los resultados de este experimento fueron
acertados, Fricke malinterpretó los datos y expresó que la membrana celular
tenía una sola capa molecular. Ya que la cabeza polar de los lípidos está
completamente hidratada, no aparecen en la medición de la capacidad eléctrica
lo que significó que este experimento midió el grosor del núcleo de
hidrocarburos, no toda la bicapa.
Gorter y Grendel atacaron el problema
desde una perspectiva diferente, utilizando un solvente hicieron una extracción
de los lípidos del eritrocito y extendieron el material resultante como una
sola capa en aparato llamado, Langmuir-Blodgett. Cuando compararon el área de
la capa única con el área superficial de las células, encontraron una
proporción de dos a uno (Gorter & Grendel, 1925). Análisis tardíos de este experimento, mostraron varios problemas
incluyendo una presión errónea de la mono capa, extracción lipídica incompleta
y un cálculo incorrecto en el área superficial de la célula (Yeagle, 1993). A pesar de esto, la conclusión fundamental que decía que la
membrana tenía una bicapa lipídica, era correcta.
2.4.
El modelo Davson-Danielli
Hacia 1920 y 1930, los fisiólogos
celulares se dieron cuenta que había muchos detalles que no concordaban bien
con el modelo básico de la bicapa lipídica. Se encontró por ejemplo que la
solubilidad de los fosfolípidos no podía explicar la solubilidad de las células
como un todo, existen elementos que incrementaban la solubilidad de las células
de manera drástica. Esta discrepancia entre el modelo teórico y los datos
empíricos podía ser resuelta si se agregaban proteínas al modelo (Danielli & Davson, 1935).
Figura 2.4. Modelo Davson Danielli
Figura 2.5. Detalles del modelo de Davson Danielli. El modelo de Davson Danielli explicaba la permeabilidad de la membrana a ciertas sustancias por poros creados por las dos capas de proteínas.
La primera propuesta sobre la presencia de
proteínas en la estructura de la membrana biológica fue realizada por Hugh
Davson y James Danielli (Davson & Danielli, 1943). En esta primera propuesta las proteínas formaban una tercer y
cuarta membrana en la parte externa e interna de la membrana bilógica como si
se tratara de una cota de mallas, que no sería distinguible de las cabezas
hidrofilias de los fosfolípidos. Davson y Danielli revisaron su propuesta para
principios de 1950, para tomar en cuenta la permeabilidad selectiva de las
membranas que habían estudiado por los últimos 20 años (Edidin, 2003). En esta
versión revisada los investigadores sugirieron además de cubrir la totalidad de
la membrana lipídica, las proteínas se encontraban insertadas a través de la
membrana tanto hacia el interior como al exterior formando canales.
Estas proteínas proveían canales de flujo
selectivo para iones y otras sustancias solubles en agua, pero que no
atravesarían una membrana celular completamente hecha de fosfolípidos. Un
detalle a tener en cuenta es que todos los modelos de la membrana la asumían
como una estructura fija, como si fuera una barrera de plástico con huecos
regulados por proteínas.
2.5.
Potenciales osmo-voltáicos
Una de las características de la membrana
es su capacidad de separar sustancias por concentración y por carga, creando
diferencias de potencial mecánicas y eléctricas que luego emplea para
sintetizar sustancias, un ejemplo de esto es el funcionamiento de la f1f0 ATP
sintetasa o del motor del flagelo. Esta idea de una membrana semipermeable, es
decir, una barrera que es permeable a los solventes, pero impermeable a las moléculas
de soluto, fueron desarrolladas también en la década de los 30 del siglo XX.
El término ósmosis se originó en 1827, y
su importancia en los fenómenos fisiológicos fue reconocida hasta 1877 cuando
el botanista Pfeffer propuso la teoría de la membrana en la fisiología celular (Jacobs, 1962; G. N. Ling, 2001). Desde esta perspectiva, se vio que la célula estaba encapsulada
por una superficie delgada, la membrana plasmática; el agua celular y los
solutos, como los iones de potasio(1+), existían en un estado físico como una
disolución. En 1889, Hamburger usó hemólisis de eritrocitos para determinar la
permeabilidad de varios solutos (Jacobs, 1962). Midiendo el tiempo requerido
para que las células se hincharan pudo estimarse al tomar en cuenta el cambio
en el volumen de la célula. Él también descubrió que había un volumen no
solvente de aparentemente 50% en los glóbulos rojos y después se mostró que
esto incluía al agua en la adición de la hidratación de la proteína y otro
componente no solvente en las células. Overton (un primo lejano de Charles
Darwin) fue el primero en proponer el concepto de una membrana plasmática
lipídica en 1899. La debilidad más grande de la membrana lipídica fue la falta
de la explicación de la alta permeabilidad al agua, así que Nathansohn (1904)
propuso la teoría de mosaico (Kleinzeller, 1997).
En este contexto, la membrana no es una
capa pura de lípidos, pero un mosaico de áreas con lípidos y áreas con un gel
semipermeable. Ruhland especificó la teoría de mosaico al incluir poros que
permitieran el paso adicional de moléculas pequeñas. Ya que las membranas son
generalmente menos permeables a los aniones (Ling, 2001), Leonor Michaelis
concluyó que los iones eran absorbidos por las paredes a través de los poros
(Ling, 2001), cambiando la permeabilidad de los poros a iones por medio de la
repulsión electrostática. Michaelis demostró el potencial de membrana (1926) y
propuso que estaba relacionado a la distribución de iones a través de la
membrana (Ling, 2001). Harvey y Danielli (1939) propusieron una membrana de una
bicapa lipídica cubierta en cada lado por una capa de proteínas para encajar
las medidas de la tensión superficial. En 1941, Boyle y Conway mostraron que la
membrana de un músculo en reposo de una rana era permeable a los iones de
potasio(1+) y cloruro(1-); sin embargo, aparentemente no lo era para los iones
sodio(1+), así que la idea de las cargas eléctricas en los poros era
innecesaria porque un solo tamaño de poro podría explicar la permeabilidad
hacia los iones de potasio(1+), protio(1+) y cloruro(1-) así como la
impermeabilidad a los iones de sodio(1+), calcio(2+) y magnesio(2+) (Ling,
2001).
2.6.
Bombas iónicas
Con el desarrollo de rastreadores
radioactivos, se mostró que las células no son impermeables al ion sodio(1+).
Esto fue difícil de explicar con la teoría de la barrera de membrana, así que
la bomba “canal activo” de sodio fue propuesta para remover sodio(1+) al
momento que pasa por la célula (YouTube).
Nuevamente tenemos un ejemplo de la historia de la ciencia en la cual un
fenómeno es predicho como una estrategia ad
hoc para salvar un modelo general que
se intuye correcto pero que está en riesgo de naufragar con un contraejemplo
que parece no encajar (Kuhn, 1970; Lakatos, 1978).
Y evidentemente no faltaron detractores, y
de hecho aún hasta nuestros días es posible encontrar una minoría al interior
de la comunidad científica que no está de acuerdo con la teoría de la membrana
celular apoyada por canales iónicos (Ling, 2007). El problema radica es que a nivel médico la teoría de la membrana
celular apoyada por canales iónicos ha sido demasiado exitosa, además de que
los condenados canales aparecieron experimentalmente, los transformó en una
hipótesis ad hoc en una predicción que confirmaba la teoría (Hamlyn et al., 1989;
Jørgensen, 1974; Quinton, Wright, & Tormey, 1973).
Esto produjo el concepto de que las
células están en un estado de equilibrio dinámico, constantemente usando
energía para mantener los gradientes iónicos estables. En 1935, Karl Lohmann
descubrió el ATP y su rol como una fuente de energía para las células, así que
el concepto de una bomba de sodio manejada por el metabolismo fue propuesta de
forma tal que no se violara la segunda ley de la termodinámica (Glynn, Hoffman, & Lew, 1971;
Repke & Schönfeld, 1984). El éxito tremendo de Hodgkin, Huxley, y Katz en el desarrollo de
la teoría de la membrana en cuanto a los potenciales de la membrana celular,
con ecuaciones diferenciales que modelaban correctamente el fenómeno,
produjeron más apoyo para la hipótesis de la bomba de sodio (Ling, 2001; Rinzel, 1990).
La
perspectiva actual de la membrana plasmática es que hay una bicapa lipídica que
tiene componentes proteicos integrados a ella. La estructura de la membrana es
conocida ahora con gran detalle, incluyendo modelos en 3D de muchas proteínas
diferentes que están vinculadas con la membrana. Estos desarrollos grandes en
la fisiología celular pusieron a la teoría de la membrana apoyada por canales
proteínicos en una posición de gran dominancia.
2.7.
El modelo de mosaico fluido
Experimentos realizados a finales de los años 60s y a inicios de los años 70s dieron como resultado una modificación importante al modelo de la membrana biológica. Por ejemplo, la bicapa dibujada permitió la investigación directa de las propiedades de una bicapa simple artificial. Al "pintar" una solución conformada por lípidos a través de una apertura, Mueller y Rudin fueron capaces de determinar que la bicapa resultante exponía fluidez lateral, alta resistencia eléctrica y una habilidad de reparación propia en respuesta a un pinchazo (Mueller, Rudin, Tien, & Wescott, 1962). Esta forma del modelo de la bicapa pronto se conoció como un "BML" aunque desde el inicio el significado de este acrónimo ha sido ambiguo. A principios de 1966, BML era usado para referirse a una "membrana lipídica negra" o a una "membrana lipídica bimolecular" (Tien, Carbone, & Dawidowicz, 1966; Tien & Diana, 1967). Esta misma fluidez lateral fue antes demostrada conclusivamente en la superficie celular por Frye y Edidin en 1970. Ellos fusionaron dos células etiquetadas con diferentes marcadores fluorescentes vinculados a la membrana, y vieron cómo las dos poblaciones entintadas se mezclaban con el tiempo de manera azarosa (Frye & Edidin, 1970).
Figura 2.6.
Modelo del mosaico fluido. El citoesqueleto
interactúa íntimamente con las proteínas integrales de la membrana biológica (YouTube). Las enzimas, sustancias vitales, solo pueden
funcionar adecuadamente cuando están ancladas a un marco como la membrana
celular.
Los resultados de este experimento fueron
clave para el desarrollo del modelo de "mosaico fluido" en la
membrana celular, por Singer y Nicolson en 1972 (Leabu, 2013; Morange, 2013; Singer
& Nicolson, 1972; Szymanski, Kierszniowska, & Schulze, 2013). El modelo propuesto por Jonathan Singer y Garth Nicolson de la
universidad de California en San Diego, denominado modelo del mosaico fluido ha
servido como el paradigma central de las membranas biológicas por más de 60
años, y es el modelo actual. El modelo de mosaico fluido es aparentemente
similar al modelo refinado de Davson Danielli pero dos detalles lo diferencian.
En primera instancia, las proteínas insertadas en la membrana son los únicos
componentes que incrementan la solubilidad de la membrana, y no existen
proteínas que sirvan de capas extra. En
segunda instancia la atención debe llevarse al estado de los lípidos en la
membrana, los cuales no se encuentran fijos, y los mismo las proteínas en
ellos, todos fluyen en una solución grasosa plana.
Las moléculas en la membrana son móviles,
las proteínas pueden agruparse en una zona de la membrana o dispersarse por
toda la superficie dependiendo de las necesidades de la célula, la membrana se
encuentra en un estado fluido que no puede compararse a un estado sólido o a un
estado líquido.
En la actualidad hay dos modificaciones
importantes que deberíamos realizar a la visión de la membrana celular. La
primera es que muchos canales iónicos no se organizan como un tubo que permita
el flujo de agua y sustancias como si se tratara de un poro, que, aunque si los
hay, son tan raros que los únicos ejemplos prácticos son los poros nucleares.
En lugar de lo los canales funcionan más como complejos de translocación y son
más angostos, es decir armazones de proteínas de transportan a las malas
sustancias de un lugar a otro con gastos energéticos. La segunda idea es la
importancia del citoesqueleto, muchas proteínas integrales de la membrana están
ancladas a un andamio de citoesqueleto. Este andamiaje es el que permite explicar
diversos comportamientos de la membrana, como su plegamiento en estructuras no
esféricas, la formación de vesículas, la fusión de vesículas y el acoplamiento
a la matriz extracelular generando un continuo entre citoesqueleto, proteínas
de anclaje en la membrana y fibras proteínas en la matriz extracelular.
3. Funciones de las membranas biológicas
La membrana celular es mucho más que una
barrera, y de hecho es la estructura que define a la vida que conocemos
actualmente. Bajo nuestro conocimiento actual, todo lo vivo posee una membrana
biológica que aísla el ambiente interno del ambiente externo y lleva a cabo una
serie de funciones. Todas las membranas poseen una serie de funciones base, y
luego dependiendo de qué célula u organelo, también posee capacidades
especiales, que dependen la mayoría de las veces de las proteínas de membrana.
Las funciones básicas de una membrana biológica son: separación de ambientes
interno y externo, andamiaje enzimático, barrera semipermeable, barrera
selectiva, barrera sensible a los estímulos y barrera que transforma la
energía.
3.1. Compartimentación celular
Figura 3.1.
Compartimentos celulares. En las células
eucariotas la compartimentalización celular permite a cada compartimento operar
especializadamente para almacenar, fabricar o procesar sustancias químicas.
Las membranas son una barrera continua sin
rompimientos, en cierto sentido son algo muy similar a la lámina de una bomba
de jabón, y de hecho comparten con las láminas de las bombas de jabón muchas
propiedades como el auto-sellamiento y la capacidad de fusionarse entre sí. Las
membranas biológicas recubren a las células o, en el caso de los eucariotas
también a muchos organelos, a los cuales los llamamos sistema de membranas
internas, para separarlos de otros organelos de estructura proteínica o
ribosomal como el ribosoma o los microtúbulos.
El sistema de membranas internas genera
una serie de compartimentos cerrados al interior de las células, lo cual
permite a esos compartimentos funcionar como zonas especializadas en la
producción y procesamiento de sustancias específicas. La beioquímica de cada
compartimento será independiente al de los demás y al del citoplasma en
general. La utilidad de la compartimentación es que permite que cada sección
opere con reacciones químicas independientes con condiciones independientes, lo
cual incrementa la diversidad bioquímica de la célula y por consiguiente la
cantidad de funciones que puede llevar a cabo.
3.2.
Andamiaje enzimático
Una característica importante de la célula
es que lleva a cabo cientos de miles de reacciones químicas que difícilmente se
dan de manera “natural” en el ambiente externo. Para que estas reacciones se
den, se debe agregar un modificador de las condiciones externas que permitan
que las reacciones químicas ocurran naturalmente, lo que de otra forma tardaría
eones en darse. Estos componentes que hacen fácil, lo que en el ambiente es
casi imposible son las enzimas.
La membrana celular posee una gran
cantidad de proteínas insertadas, estas funcionan más eficazmente de este modo
que estando libres en la solución acuosa del citosol. Algunas de estas son
receptores, otras son canales, pero muchas son enzímas. Las enzimas son
catalizadores biológicos que acelera las reacciones por niveles de magnitud
astronómicos, haciendo que una reacción que tarda miles de años se de en unos
cuantos segundos. Sin embargo, al igual de los catalizadores las enzimas deben
encontrarse fijas en un sustrato para que sean más eficientes. La membrana
biológica sirve como sustrato de enzimas que se anclan en ella, acelerando las
reacciones aún más de lo que lo realizarían si se encontraran libres en la
solución del citoplasma celular.
El andamiaje enzimático va más allá de
permitir la permanencia de las proteínas integrales, estas proteínas integrales
sirven a su vez de puertos de acoplado para el citoesqueleto al interior de la
célula y para las fibras de la matriz al exterior de la célula, lo cual le
permite a un tejido comportarse de manera unificada.
3.3.
Trasporte de solutos
La membrana es una barrera selectiva que deja pasar fácilmente unas sustancias y difícilmente otras. Las sustancias que pasan difícilmente requieren de sistemas especiales para poder cruzar la membrana. Como la mayoría de los procesos especiales en los sistemas biológicos estos son básicamente proteínas de membrana. Las proteínas sirven como canales de comunicación entre ambos lados de la membrana y permiten el ingreso específico de ciertas sustancias particulares.
Figura 3.2. La membrana es permeable a solutos grasos. Existen sustancias capaces de integrarse
a la membrana y pasar a través de ella, aunque su velocidad cinética molecular
disminuye en el proceso de atravesar la membrana. Algunas sustancias pasan más
rápido que otras y por lo tanto decimos que se difunden con facilidad. Otras
sustancias se difunden más lentamente y otras nunca lo hacen de manera normal.
La sustancia más común que se difunde por la membrana se el agua, y las
siguientes son los gases apolares y moléculas de grasa.
Dependiendo del tipo de proteína y de sustancia, se debe invertir o
no energía. Cuando la sustancia no se difunde por la membrana, puede usar
canales que permite su paso, estos canales son construidos con proteínas
insertadas en la membrana. Un ejemplo de estas proteínas de transporte es la
GLUT2, la cual sirve como mecanismo para que la glucosa pueda pasar a través de
la membrana celular en los tejidos humanos. Cuando se da una deficiencia de
esta función la célula empieza a morir por falta de energía. Si la proteína no
usa energía estamos hablando de un transportador pasivo, pero si esta emplea
energía se trata de un transportador activo.
3.4. Barrera semipermeable selectiva
Figura 3.3.
Canales iónicos. Las proteínas integrales de membrana
actúan como tarnslocadores o poros. Un ejemplo de poros son las acuaporinas que
permiten el paso selectivo y restringido de agua.
La función primordial de las membranas es la de ser una barrera que impide un flujo irrestricto de sustancias a un lado y al otro. Esto implica que la membrana permite el mantenimiento de un ambiente interno completamente diferente a un ambiente externo, y esto es también otra característica de los seres vivos. Las membranas impiden la difusión aleatoria entre dos puntos en el espacio, esto causa que existan ambientes independientes de un lado hacia el otro de la membrana, esta propiedad justifica muchas de las propiedades del mundo viviente, como la nutrición.
Figura 3.4.
Algunos canales usan energía. A diferencia de
los poros, los translocadores funcionan activamente moviendo a las malas
sustancias de un lugar a otro, pero a cambio se debe sacrificar energía en el
proceso, aunque en algunos casos pueden operar pasivamente.
El hecho de que los ambientes en el
interior y en el exterior sean diferentes implica que los seres vivos se
encuentran en un estado de desequilibrio químico y energético con el
ambiente. Al interior del ser vivo se
encuentra una mayor cantidad de sustancias químicas de alta energía, mientras
que en el exterior estas sustancias tienden a ser escasas y en el peor de los
casos “en una atmósfera oxidante” tienden a desaparecer rápidamente.
La membrana biológica permite un paso de
sustancias de manera selectiva, permite el ingreso de sustancias
energéticamente altas, pero cuando están en su interior no las deja salir; de
igual forma existen sustancias a las cuales no se les permite el ingreso hasta
que no han sido adecuadamente preparadas “por procesos de digestión”. Del mismo
modo existen sustancias que se producen al interior de las células que son
extremadamente toxicas, y que son expulsadas hacia el exterior, y que una vez
fuera, la célula tiende a mantenerlas a fuera. La selectividad de la membrana
depende de la naturaleza soluble de la sustancia y de la presencia de proteínas
de transporte o canales. Las sustancias grasas tienden a atravesar pasivamente
la membrana celular, al igual que las moléculas muy pequeñas como el agua. Todo
lo demás debe ingresar por medio de proteínas de transporte.
Hay que anotar que el flujo de sustancias
a través de los canales iónicos no es tan simple como el que se representa en
el modelo anterior, pero estos modelos son comunes para representar la idea del
proceso. En realidad, los únicos canales con un hueco en el centro son los
poros nucleares o las acuaporinas, mientras que los demás canales dependerán
más del cambio conformacional de la proteína siendo translocadores, sea a favor
o en contra del gradiente de concentración.
3.5.
Respuestas a estímulos
externos
Las membranas pueden responder a agentes
externos, una de las respuestas más elementales es la capacidad de
autosellamiento. Si la membrana es rota por un orificio lo bastante pequeño
como para no alterar los equilibrios y la integridad del sistema, esta pequeña
alteración puede sellarse de manera automática, sin la intervención de
proteínas o energía (YouTube). La
respuesta a las señales externas por parte de la membrana le permite a la
célula ejecutar la propiedad de relacionarse con su entorno y con otros seres
vivos, tanto recibiendo datos externos por medio de sus proteínas como
emitiendo respuestas, también por medio de sus proteínas.
Este evento es uno de los fenómenos más
contra-intuitivos si se piensa en términos coloquiales de la segunda ley de la
termodinámica. En términos coloquiales, la segunda ley de la termodinámica
establece que los procesos espontáneos son aquellos en que el nivel de desorden
se incrementa en el universo. El proceso de autosellamiento es aparentemente
todo lo inverso, las moléculas de fosfolípidos que componen a la membrana de organizan
de manera espontánea sin la intervención de energía externa. Este evento se
debe a que en el momento en que se organizan las moléculas de fosfolípidos
causan un desordenamiento mayor de las moléculas de agua contiguas a ellos,
incrementando el nivel de desorden del universo “tomando en cuenta al agua”.
Por lo general en los cursos básicos, las
primeras proteínas que generan cambios o respuestas celulares son las proteínas
de transporte a través de membrana para los transportes activo y pasivo facilitado.
Pero a medida que indaguen más en la biología celular se dará cuenta de que la
célula posee un amplio abanico de respuestas posibles a las señales externas y
que prácticamente siempre estará involucrada una proteína específica. La
membrana posee otros mecanismos para responder a otros tipos de señales
externas, mucho más sutiles la mayoría de las veces.
Al igual que con el transporte celular, la
respuesta a las señales externas será directamente dependiente de proteínas de
membrana, las cuales reconocen de manera específica las señales “las cuales no
son otras cosas que sustancias químicas”, cuando las proteínas reconocen las
señales, generan efectos al interior de la membrana, lo cual desencadena una
cascada de reacciones proteínicas que conlleva a una respuesta celular
determinada. Este mecanismo también sirve para las interacciones entre células.
3.6.
Transducción de información
La transducción o transporte de una señal
ocurre cuando una molécula de señalización de fluido extracelular activa un
receptor de superficie de la célula. A su vez, este receptor altera moléculas
intracelulares creando una respuesta. Hay dos etapas en este proceso: (1) Una
molécula de señalización activa un receptor específico en la membrana celular.
(2) Un segundo mensajero transmite la señal hacia la célula, provocando una
respuesta fisiológica. En cualquiera de las etapas, la señal puede ser
amplificada. Por lo tanto, una molécula de señalización puede causar muchas
respuestas. La transducción de la información es por lo tanto la otra cara de
la comunicación celular, sin embargo, para el tema de la membrana celular lo
que es relevante es el papel de las proteínas integrales de la membrana como
receptores de la señal.
Para que esto funcione se necesita una proteína integral con tres dominios. El primero al exterior que se acopla a la señal que puede ser química o física. Cuando se da el acople la proteína transmite el cambio de forma a través del dominio intermembranal hasta el dominio intracelular. Cuando el dominio intracelular cambio se genera la cascada de comunicación que puede afectar secundariamente el metabolismo o directamente al núcleo.
Figura 3.5.
Proteínas G. Los receptores acoplados a proteínas G
son diversos, y convierten diversos tipos de estímulos, como la luz, o las
vibraciones, en señales químicas que viajan al núcleo o a otras células para
generar una respuesta efectiva (YouTube).
👉 Portadores de
información: Existen muchas moléculas que pueden
funcionar como portadoras extracelulares de información. Entre ellas se
incluyen:
Aminoácidos y derivados
de aminoácidos. Los ejemplos incluyen glutamato,
glicina, acetilcolina (Ach), adrenalina, dopamina, y hormona tiroidea. Estas
moléculas actúan como neurotransmisores y hormonas.
Gases, como NO y CO.
Los esteroides, que se derivan de colesterol. Las hormonas esteroideas regulan la
diferenciación sexual, el embarazo, el metabolismo de los carbohidratos y la
excreción de iones sodio y potasio.
Eicosanoides, son moléculas no polares que contienen 20 carbonos derivados de
un ácido graso llamado ácido araquidónico. Los eicosanoides regulan diversos
procesos, como el dolor, la inflamación, la presión sanguínea y la coagulación
de la sangre. Existen varios fármacos que están disponibles sin prescripción y
son empleados para tratar cefaleas e inflamación, éstos inhiben la síntesis de
eicosanoides.
Una gran variedad de polipéptidos
y proteínas. Algunos de éstos se encuentran como proteínas transmembranales
en la superficie de una célula que interactúa. Otros son parte de la matriz
extracelular o se relacionan con ella.
Por último, una gran cantidad de proteínas se excreta hacia el
ambiente extracelular, donde participan en la regulación de procesos como la
división celular, la diferenciación, la reacción inmunitaria o la muerte y
supervivencia de las células.
Aunque no siempre, la mayoría de las veces
las moléculas de señalización extracelular se reconocen por receptores
específicos que se hallan en la superficie de la célula que responde. Los
receptores se unen con gran afinidad con sus moléculas de señalización y
traducen esta interacción en la superficie externa de la célula en cambios que
ocurren dentro de ella. A continuación, se describirán:
👉 Receptor
acoplado a proteínas G (GPCR): son
una enorme familia de receptores que contienen siete hélices alfa
transmembranales. Estos traducen la unión de moléculas extracelulares de
señalización en la activación de proteínas G (proteínas de unión con guanosín
trifosfato). Es extremadamente universal y está involucrado en fenómenos que
van desde poder ver, hasta poder sentir placer. La estructura de la GPCR
también revela uno de los trucos favoritos de la célula, ser diversa y al mismo
tiempo conservado. Los dominios intracelular, intramembranoso y parte del
extracelular son conservados, lo que cambia es el receptor extramembranoso que
varía desde aquellos que se acoplan a hormonas, hasta aquellos que responden a
la luz.
👉 Receptores de
tirosina quinasa (RTK): Representan
una segunda clase de receptores que evolucionaron para traducir la presencia de
moléculas mensajeras extracelulares en cambios dentro de la célula. La mayoría
de las quinasas de proteína transfieren grupos fosfato a residuos de serina o
treonina de sus sustratos proteicos, pero como su nombre lo sugiere, las RTK
fosforilan residuos de tirosina. Los cambios activados por un ligando
representan la tercera clase de receptores en la superficie celular que se unen
con ligandos extracelulares. La unión con el ligando regula de manera directa
la capacidad de estas proteínas de membrana, lo cual afecta la actividad de
otras proteínas de membrana, por ejemplo, los canales activados por voltaje.
Esta secuencia de fenómenos es la base para la formación de un impulso
nervioso. Además, la entrada de ciertos iones, como Calcio(2+), puede cambiar
la actividad de enzimas citoplásmicas particulares.
👉 Receptores para
hormonas esteroideas: Funcionan
como factores de transcripción regulados por un ligando. Las hormonas
esteroideas se difunden a través de la membrana plasmática y se unen con
receptores, los cuales están en el citoplasma. La unión con la hormona induce
un cambio en la conformación, esto provoca que el complejo hormona-receptor se
mueva hacia el núcleo y se una con elementos presentes en los promotores o
intensificadores de los genes de respuesta hormonal. Esta interacción da origen
a un aumento o descenso del ritmo de transcripción genética.
Por último, hay varios tipos de receptores
que actúan por mecanismos únicos. Algunos de estos receptores, como los
receptores de las células B y células T que participan en la reacción a los
antígenos extraños, se relacionan con moléculas de señalización conocidas como
quinasas citoplásmicas de proteína-tirosina. Para otros aún se desconoce el
mecanismo de transducción de señal.
3.7.
Transporte energético
Otro aspecto que fundamenta la distinción de
las membranas biológicas como una estructura fundamental para la vida se da a
nivel energético. Virtualmente todos los sistemas de obtención de grandes
cantidades de energía dependen de algún modo de la membrana. En la
fotosíntesis, por ejemplo, la membrana posee pigmentos fijos en ella, como lo
es la clorofila; la clorofila reacciona de manera eficiente cuando se encuentra
fija en un marco como la membrana, capturando la energía solar y emitiendo un
electrón altamente energético en respuesta a la luz de Sol capturada. La
membrana del cloroplasto posee una serie de proteínas que permiten transferir
la energía de la radiación solar a los enlaces químicos de ciertas sustancias.
El proceso requiere de un átomo de magnesio en un marco especial llamado clorofila,
la cual a su vez está anclada a la membrana.
La respiración celular también depende de
las membranas. Una de las proteínas que se encarga de transformar la energía
almacenada en los carbohidratos y los lípidos se denomina F1F0 ATP sintetiza,
una proteína transmembranaria que gira como un motor, mediante este giro se
transfiere la energía desde una sustancia química de transferencia de energía
hasta el ATP la sustancia de transporte energético más usada por los demás
mecanismos celulares. La membrana de la mitocondria posee una propiedad
semejante a la del cloroplasto, transferir energía, pero en este caso será
desde un tipo de compuesto químico a otro. En ambos procesos la ATP sintetiza
que es una proteína transmembranaria que gira juega un rol primordial para la
transferencia energética funcionando como un motor eléctrico/dinamo molecular.
4. La grasa de las membranas biológicas
Las membranas biológicas son ensamblajes
de lípidos y proteínas en los que los componentes se mantienen juntos en una
capa muy delgada mediante encales no covalentes, la mayoría de las veces son
interacciones moleculares débiles que individualmente débil, pero en
estructuras grandes bastante fuertes. El componente básico de la membrana es
una bicapa de lípidos especiales, la cual forma la mayor parte de la membrana.
Esta parte forma la barrera de la membrana contra el flujo arbitrario de
sustancias de uno a otro lado de la membrana. Las proteínas de la membrana por
otro lado, llevan a cabo la mayoría de las funciones biológicas específicas
relacionadas con transporte a través de membrana o reconocimiento y
señalización celular.
Figura 4.1. Los ácidos grasos son ácidos carboxílicos.
Cada tipo de célula posee un equipo único
de proteínas de membrana, que contribuye a las actividades y propiedades
específicas de cada tipo de célula. La cantidad relativa de lípidos y proteínas
varía dependiendo del tipo de célula y del tipo de membrana biológica que
estamos analizando: ya sea entre tipos de célula básicos (membrana bacteriana y
eucariótica) tipos de estructura (membrana plasmática vs membrana del aparato
de Golgi), tipos de eucariotes (plantas animales) tipos de tejido (nervioso,
epitelial) entre muchos otros. Por ejemplo, la mitocondria que posee dos
membranas biológicas, la primera membrana posee un muy alto radio de
proteínas/lípidos en comparación con las membranas de mielina alrededor de una
célula nerviosa.
Figura 4.2. El glicerol no es una grasa, es un alcohol.
En términos generales, las diferencias
entre la cantidad de proteínas, y el tipo de proteínas en la membrana se
relaciona con las funciones básicas que llevan a cabo las células que las
poseen. La mitocondria realiza una gran cantidad de procesos de transferencia
de energía, las cuales dependen de proteínas insertadas en la membrana, por lo
cual es lógico que la membrana interna que es donde estos procesos se llevan a
cabo tenga una gran cantidad de proteínas de transferencia de energía. Por otro
lado, las membranas de mielina son usadas como aislante eléctrico, las
proteínas son sustancias que transmiten la electricidad, por lo que una baja
cantidad de proteínas incrementa la capacidad aislante de la membrana de
mielina. Unidos a la membrana o a las proteínas se encuentran azucares
complejos “polisacáridos” los cuales otorgan nuevas propiedades a las proteínas
membranales.
Figura 4.3. Los triglicéridos son la unión de tres ácidos
carboxílicos con un glicerol.
4.1.
Lípidos de membrana
Las membranas biológicas poseen una amplia variedad de sustancias de tipo grasoso o aceitoso llamadas formalmente, lípidos. Por lo general los lípidos son hidrófobos, lo que implica una repulsión a la mezcla con agua, esto se debe a su naturaleza apolar o sin cargas de sus moléculas. Por otro lado, los lípidos de membrana poseen propiedades especiales, a diferencia de la mayoría de los lípidos, los lípidos de membrana son de naturaleza anfipática, es decir, pueden diluirse tanto en solventes acuosos (polares) como en solventes aceitosos (apolares).
Figura 4.4.
Fosfolípidos. (Izquierda) Estructura general de un fosfolípido de
membrana, compuesta por dos colas hechas de carbonos e hidrógenos y una cabeza
que además, contiene fósforo y oxígeno.
Figura 4.5. Fosfolípido de tipo fosfatidiletanolamina
saturada.
El fosfolípido sacrifica un ácido
carboxílico por un grupo fosfato modificado, la alta densidad de oxígenos
provoca que sea región sea soluble. Estas moléculas anfipáticas al mezclare son
el agua, se organizan de manera espontánea sin la intervención de información
biológica “sin intervención de proteínas”, debido a la naturaleza misma de las
leyes químicas que gobiernan las sustancias nivel molecular. De este modo la
porción polar de los lípidos se une al agua por puentes de hidrógeno, mientras
que la sección apolar busca la unión con otras moléculas de lípidos. Al poco
tiempo se generan burbujas de aceite, las cuales logran diluirse con el agua
debido a la sección polar, la cual queda en contacto con el agua. Existen tres tipos
generales de lípidos de membrana: los fosfodigliceridos, los esfingolipidos y
el colesterol.
👉 Fosfodiglicéridos
o fosfolípidos: La mayoría de los lípidos de
membrana contienen un grupo fosfato, lo cual los vuelve fosfolípidos. Debido a
que la mayoría de los lípidos de membrana son construidos en base a un
esqueleto de glicerol son denominados fosfodiglicéridos. Los triglicéridos son
moléculas relativamente complejas, que se componen por tres grupos R alifáticos
o cadenas apolares, y tres grupos ester. Los grupos ester poseen dos oxígenos
cada uno, los cuales le permiten a la molécula de triglicérido diluirse en
agua. La molécula de triglicérido también se la puede entender como el
reemplazo de un hidrógeno de tres grupos hidroxilos de un poli alcohol llamado
1, 2, 3-propatriol, también llamado glicerol. Cada uno de los hidrógenos se
reemplaza por un ácido carboxílico.
Figura 4.4. Fosfolípido insaturado. Una insaturación es
un doble enlace entre carbonos que provoca que la cadena cambie de dirección.
A diferencia de los triglicéridos, las
cuales poseen tres cadenas de ácidos grasos y no anfipáticos, los glicéridos de
membrana son diglicéridos. Esto se debe a que, de las tres cadenas del
triglicérido, una es empleada para su modificación, insertándose el grupo
fosfato que lo hace la región polar del fosfodiglicérido. Sin ninguna
sustitución adicional, la molécula recibe el nombre de ácido fosfatídico, el
cual está virtualmente ausente en todas las membranas. Los fosfodiglicéridos de
membrana poseen otras sustancias asociadas al grupo fosfato, generalmente
colina “formando fosfatidilcolina”, etanolamina “formando
fosfatidiletanolamina”, serina “formando fosfatidilserina” inositol “formando
fosfatidilinositol”.
Cada uno de los oxígenos junto con el
fosfato están negativamente cargados, por lo que generan un polo altamente
soluble en agua en la punta de la molécula, también denominado “grupo cabeza” o
simplemente “cabeza del fosfolípido”. En contraste, las cadenas de ácidos
grasos son altamente hidrófobas, una cadena de hidrocarburos lineales de
aproximadamente 16 a 22 carbonos de longitud. Esta cadena puede ser
completamente saturada “todos los carbonos se unen por enlaces simples”,
monosaturados “posee un doble enlace” o polisaturados “poseen más de un doble
enlace”. Los fosfodiglicéridos pueden contener también una cadena saturada y la
otra insaturada. La cabeza polar puede presentar modificaciones extra conocidas
como grupos diglicéridos.
Figura 4.7. Fosfatidilserina
Figura 4.8. fosfatidiletanolamina
Figura 4.9. Fosfatidilcolina
Figura 4.10. Fosfatidilinositol
Recientemente ha despertado mucho interés
los beneficios aparentes de fosfodiglicéridos cuyas dos cadenas “o colas” se
encuentran altamente insaturadas, las cuales se encuentran en altas
concentraciones en el aceite de pescado. Estos ácidos grasos poseen entre 5 y 6
dobles enlaces en su cadena cada uno. Estos ácidos grasos se denominan Omega-3
debido a que su último doble enlace se encuentra en la posición del tercer
carbono final. Se tiene evidencia de que los ácidos grasos Omega-3 puede
mejorar la función del cerebro y la retina.
En resumen, todos los fosfodiglicéridos
poseen una cabeza soluble en agua y dos colas insolubles en agua, las colas se
alejan del agua y las cabezas se ponen de frente a ella. Esta doble naturaleza
de atracción/repulsión se denomina anfipática.
👉 Esfingolipidos: Una clase de lípido de membrana menos abundante se denomina
esfingolípido, y son derivados de la esfingosina, un aminoalcohol que contiene
una larga cadena de hidrocarburos. Los esfingolípidos consisten de esfigosina
unida a un ácido graso mediante un grupo amino. Esta molécula se denomina
ceramida. Existe una amplia variedad de esfingilípidos que se diferencian por
grupos esterificados adicionales del alcohol terminal.
La esfingocina es un amino alcohol, posee
dos grupos hidroxilo y un grupo amino. Debido a que los oxígenos se encuentran
en un extremo de la molécula se genera una región polar, mientras que el resto
del esqueleto de carbonos e hidrógenos es completamente apolar. Si la
sustitución es por fosforilcolina, la molécula resultante se denomina
esfingomielina, el cual es el único fosfolípido de membrana que no es
construido en base a un esqueleto de glicerol.
Figura 4.11. Esfingolípido
Si la sustitución es por un carbohidrato,
la molécula se denomina glicolípido. Si el carbohidrato es un azúcar simple, la
molécula recibe el nombre de cerebrosida. Si es un grupo pequeño de anillos de
azucares encadenados, el glicolípido es denominado gangliosida. Debido a que
todos los esfingolípidos poseen dos regiones largas, una hidrófoba y otra
hidrófila, también poseen la capacidad de ser anfipáticos, y por lo tanto
similares en sus propiedades con el agua a los fosfodigliceridos. Los
glicolípidos son componentes de membrana muy interesantes, aunque se conoce
relativamente poco a cerca de ellos, aunque algunos reporten tentativos han
sugerido que juegan funciones importantes en las labores
celulares. El sistema nervioso es
particularmente rico en glicolípidos. La capa de mielina que rodea a un axón
contiene altas concentraciones de un glicolípido en particular llamado
galactocerebrosida, el cual se forma cuando la galactosa es adherida a la
ceramida.
Los ratones que carecen de la enzima que
lleva a cabo la reacción que une la ceramida a la galactosa exhiben temblores
musculares severos y eventualmente deben afrontar parálisis muscular. De manera
similar, los seres humanos que son incapaces de sintetizar una gangliosida
particular sufren de una enfermedad neurológica severa caracterizada por
ataques y por ceguera. Los glicolípidos también juegan roles importantes en las
enfermedades infecciosas; las toxinas que causan el cólera y el botulismo
ingresan a la célula mediante su unión a gangliosidas de superficie de
membrana, así como el virus de la influenza.
👉 Colesterol: Otro componente de naturaleza lipídica de las membranas
biológicas es un esterol llamado colesterol.
Figura 4.12. Colesterol
En algunas células animales, el colesterol
puede llegar a representar hasta el 50% de los lípidos de membrana. El
colesterol está ausente de las membranas de la mayoría de las plantas y de
todas las bacterias. Lo que en verdad sorprende de la molécula de colesterol,
es que a pesar de que su único grupo que le da una propiedad polar es
extremadamente pequeño, aun pueda ser considerado anfipático.
El
colesterol tiene una estructura diferente de otros lípidos, pero sigue siendo
una molécula compuesta principalmente por carbono e hidrógenos, que en la
figura anterior se representan implícitamente en cada vértice y arista.
El colesterol posee un grupo hidrófilo pequeño, pero aun así lo bastante grande como para orientar a la molécula en su organización, es un grupo hidroxilo. Este grupo hidroxilo se encuentra orientado hacia la superficie membranal como los fosfodigliceridos, mientras que el resto de la molécula se encuentra embebida dentro de la membrana.
Figura 4.13.
El colesterol en la membrana. La molécula de
colesterol se inserta en la membrana, exponiendo su grupo hidroxilo al exterior
de cada lado de la membrana, mientras que su grueso cuerpo hidófobo permanece
oculto con el resto de cadenas hidrófobas. Su característica principal es la de
incrementar la rigidez de la membrana, ya que sus anillos hidrófobos son planos
y rígidos, e interfieren con los movimientos de las colas de gliceroles de los
fosfodigliceridos.
4.2.
Naturaleza diversa de la
bicapa lipídica
Cada tipo de membrana biológica posee su
propia composición de lípidos característica, diferente unas de otras, en los
tipos de lípidos empleados y en la proporción de estos a través de la
membrana. Esta diversidad se traduce
tanto en las cabezas que pueden tener una variedad de sustituyentes como la
colina o la serina; o en las colas que pueden poseer una diversa cantidad de
dobles enlaces o no tenerlos en absoluto.
Dada la diversidad estructural antes
mencionada, se ha estimado que algunas membranas biológicas pueden llegar a ser
compuestas por cientos de especies químicas diferentes de lípidos de membrana.
La función de esta diversidad remarcable aún sigue siendo sujeto de interés e
investigación. Los lípidos de membrana son más que simples elementos
estructurales regulados por proteínas de membrana, ellos pueden regular su
propia función mediante cambios en el estado de fluidez de la membrana y por lo
tanto influir en la función de algunas proteínas de membrana. Los lípidos de
membrana también pueden ser usados como precursores que mensajeros químicos
altamente activos que regulan la función celular.
4.3.
Propiedades emergentes de la
bicapa lipídica
Varios tipos de medidas indican que las
dos cadenas de ácidos grasos que componen una sola línea en la membrana celular
miden alrededor de 30 Armstrong, mientras que las cabezas polares añaden otros
15 Armstrong cada una. Esto quiere decir que el grosor total de la membrana
celular es de uno 60 Armstrong, lo que equivale a unos 6 nm de grosor. La
presencia en la membrana de estas moléculas de tipo anfipático posee
consecuencias remarcables en la estructura celular y en la función celular.
La membrana biológica es una estructura hecha de moléculas anfipáticas, que se autoensambla, sin embargo, esta propiedad de auto-organización solo es posible cuando hay muchas moléculas anfipáticas en un medio polar. Debido a consideraciones termodinámicas, las cadenas de hidrocarburos de la bipaca de lípidos, nunca expone fisuras que conecten el interior de la célula al ambiente acuoso externo. Las membranas biológicas activas nunca son presentan puntas abiertas, siempre son capas continuas, estructuras sin fisuras.
Figura 4.14.
Efecto de la insaturación en la membrana.
Cambios en la estructura como una instauración afectan la estabilidad de la
membrana como un todo, aumentando o disminuyendo las temperaturas de tolerancia
de la membrana.
Esto implica que, las membranas biológicas
poseen la propiedad de autosellamiento y autoorganización a expensas del medio
externo. Mientras que, como subsistema, la membrana incrementa su complejidad,
cuando se la ve como parte del sistema agua membrana, el nivel de caos se
incrementa de manera neta gracias al agua. Las interacciones moleculares
débiles, y la energía presente en el agua en estado líquido son las que en
últimas provocan la posibilidad de que la membrana se autoorganice. Como
resultado, las moléculas de la membrana forman una red interconectada y
extensa, de bolsas autosellantes, alrededor de la célula y en ocasiones en el
interior de la célula. Debido a la flexibilidad de la bicapa lipídica, las
membranas son deformables en su apariencia general, y pueden cambiar con suma
facilidad, tal como ocurre durante el desplazamiento de ciertas células
eucariotas, o cuando la célula procede a la división celular. La endocitosis y
exocitosis son dos ejemplos de propiedades de la membrana para unirse a una
membrana más grande o generar una burbuja que se separa de una membrana grande.
Las membranas también son estructuras
motiles que pueden transportar sustancias entre ellas, a través de ellas
mismas. Por ejemplo, los orgánulos celulares como el Aparato de Golgi procesas
las sustancias en su interior, pero para transportar los productos terminados
no los segregan al citoplasma, en lugar de ello se almacenan en una esquina del
aparato de Golgi, el cual se separa del resto del aparato formando una burbuja,
esta burbuja hecha con la membrana del aparato de Golgi viaja hasta otra
membrana y allí depositando su contenido, ya sea en el interior de otro
orgánulo, o en el exterior de la célula, sin que las sustancias nunca sean liberadas
en el citoplasma. Este mecanismo es particularmente útil en el caso de enzimas
digestivas que, si son liberadas en el citoplasma, podrían causar el suicidio
celular.
👉 Autoensamblaje
de la bicapa lipídica: Las
membranas biológicas pueden autoformarse de una manera sorprendentemente
abiótica, esto se debe a que su formación depende exclusivamente de las leyes
fisicoquímicas de lípidos anfipáticos en solución. Esta capacidad se puede
demostrar fácilmente en los tubos de ensayo. Diluyendo una pequeña cantidad de
fosfatidilcolina en agua, los fosfolípidos se ensamblan de manera espontánea,
hasta formar las paredes fluidas de vesículas esféricas llamadas liposomas. Las
paredes de los liposomas consisten en una capa doble de fosfolípidos, que se
organizan de manera igual a la de una membrana biológica. Los liposomas han
demostrado ser invaluables en la investigación acerca de las membranas
biológicas.
Las proteínas pueden ser insertadas en la
membrana del liposoma, y por lo tanto, sus funciones estudiadas de una manera
mucho más simple de lo que sería intentar realizarlo en una célula viva con
miles de proteínas diferentes insertadas en la membrana. De manera interesante,
aunque el desarrolló esta técnica con objetivos puramente científicos, como por
el ejemplo el estudio del origen de la vida, los liposomas han demostrado ser
una técnica muy útil para poder administrar medicamentos al interior de las
células de manera mucho más efectiva.
👉 Asimetría de
los lípidos de membrana: La
bicapa posee una composición diferenciada de lípidos de membrana y otros
componentes dependiendo del lado, si es la capa que mira al interior de la
célula o si es la capa que mira al medio externo.
Aunque, se tiene la tendencia a pensar en
las capas de la bicapa lipídica como estructuras homogéneas que se organizan al
azar, la realidad es diferente, cada una de las capas de la bicapa posee una
composición específica de diferentes lípidos de membrana. Una línea
experimental que ha conllevado al descubrimiento de esta propiedad de las membranas
es el hecho de que las enzimas de digestión de lípidos no pueden penetrar en la
membrana interna de la bicapa lipídica. Solo son capaces de digerir los lípidos
que residen en la capa externa de la bicapa lipídica. De hecho, los glóbulos
rojos humanos son tratados con una fosfolipasa que puede digerir en promedio el
80% de los fosfatidilcolina (PC), pero solo el 20% de la fosfatidiletanolamida
(PE) y menos del 10% de la fosfatidilserina (PS).
Estos datos sugieren que, comparada a la
capa interna, la capa externa posee una concentración relativamente alta de PC
“y esfingomielina” y una baja concentración de PE y PS. De lo anterior se sigue
que la bicapa lipídica puede ser entendida como una estructura más o menos estable,
de monocapas independientes en sus propiedades físicas y químicas que se
mantienen unidas de manera intima por sus regiones hidrófobas.
👉 Variedad
funcional de los lípidos de membrana: Las diferentes clases de lípidos de membrana poseen propiedades
químicas variables. Todos los glicolipidos de la membrana plasmática se
encuentran en la capa externa, donde pueden servir como receptores de ligandos
extracelulares. La fosfatidiletanolamida, la cual se encuentra concentrada en
la capa interna tiende a promover la curvatura de la membrana, lo cual es
importante en la fusión de membranas, así como en la división de secciones
membranales. La fosfatidilserina, que se
encuentra concentrada en la capa externa posee una carga neta negativa a pH de
7, lo cual la hace un blanco para ligarse con aminoácidos de carga positiva
como la lisina y la arginina. Esta señalización hace que la fosfatidilserina
sea un marcado de membrana muy bueno, su aparición en la membrana externa de un
linfocito implica que ya está viejo y debe ser removido por los macrófagos del
sistema inmune; mientras que su aparición en la membrana de las plaquetas es un
indicador de inicio para la coagulación. El fosfatidilinositol que se encuentra
en la capa interna juega un rol vital en la transferencia de los estímulos de
la membrana celular al citoplasma.
5. Azúcares y proteínas de las membranas
5.1.
Carbohidratos de membranas
biológicas
La membrana plasmática de las células eucarióticas también posee carbohidratos. Dependiendo de la especie y el tipo de célula, el contenido de carbohidratos en la membrana plasmática puede variar entre el 2 y el 10% de su peso. Más del 20% de los carbohidratos de membrana se encuentran unidos de manera covalente a proteínas, convirtiéndolos en parte de una molécula única con la proteína; por lo cual a estas moléculas las denominamos glicoproteínas. Los carbohidratos remanentes se encuentran ligados de manera covalente a lípidos de membrana “glicolípidos”, como el fosfatidilinositol.
Figura 5.1.
Carbohidratos de membrana y tipos de sangre. Los
tipos de sangre se determinan debido a poilisacaridos en anillo complejos que
se unen a proteínas de la membrana, como si fueran banderines identificadores.
Todos los carbohidratos de membrana se
encuentran ubicados hacia el exterior de la célula anclado en la capa externa
de la membrana celular. La adición de un carbohidrato a una molécula de tipo
diferente se denomina glicosilación, y representa la modificación más compleja
que puede sufrir una proteína después de que asume su conformación
tridimensional. Los carbohidratos de las glicoporteinas se presentan como
cadenas cortas, ramificadas de oligosacáridos hidrófilos, típicamente poseyendo
menos de 15 unidades de azucares.
En contraste, la mayoría de los
polisacáridos se almacenan en polímeros muy largos como el glicógeno, la
celulosa o el almidón, los cuales son polímeros de un solo azúcar; mientras que
los oligosacáridos unidos a las proteínas y los lípidos pueden poseer una
variedad en su composición estructural. Los oligosacáridos se pueden unir a una
amplia variedad de aminoácidos mediante dos tipos diferentes de enlaces. Estas
protecciones de carbohidratos juegan un rol central en las interacciones de las
células con su medio ambiente y pueden guiar a las proteínas de membrana a
diferentes compartimentos celulares.
Los carbohidratos de los glicolípidos de
los glóbulos rojos determinan los tipos de sangre que puede llegar a tener una
persona. Una persona de tipo de sangre A posee una enzima que adiciona
N-acetilgalactosamina al final de la cadena, mientras que una persona de tipo
de sangre B posee una enzima que adiciona galactosa al final de la cadena. Las
dos enzimas se codifican como alelos alternativos en un mismo locus, aunque
ambas reconocen diferentes sustratos. Personas con tipo de sangre AB poseen
ambas enzimas, mientras que las personas con tipo de sangre 0 carece de ambas.
La función de estos marcadores de membrana sigue siendo un misterio.
5.2.
Proteínas de membrana
Dependiendo del tipo de célula o de
orgánulo, la membrana contiene cientos de diferentes tipos de proteínas. Cada
capa de la membrana posee un contenido de diferentes de proteínas, unas
atravesando ambas capas, otras ancladas solo a una capa. Esta concentración
diferenciada hace que cada capa de la membrana posea una serie de propiedades
diferentes. Las proteínas de membrana, aunque en conjunto representan una parte
más bien pequeña del total de moléculas de membrana cuando se las cuenta junto
con los lípidos de membrana, son sustancias muy importantes, ya que le confiere
a la membrana una serie de propiedades especializadas y específicas que los
lípidos por si mismos son incapaces de realizar por sí mismos. Una gran
cantidad de funciones biologías completas dependen exclusivamente de que las
proteínas se encuentren insertadas en la membrana.
👉 Proteínas
integrales de membrana: Las
proteínas integrales de membrana son aquellas que penetran en la bicapa
“AMBAS”, en otras palabras, las proteínas integrales son transmembranales.
Figura 5.2.
Proteínas integrales de membrana. Las proteínas
integrales de la membrana tienen tres partes generales, una externa, una
interna y una inserta en la membrana. Los dominios externos e internos son
solubles en agua y el inserto en la membrana soluble en lípidos. El tamaño de
cada dominio y su organización son muy variables y dependen del modo en que las
proteínas han evolucionado.
Algunas proteínas de membrana solo tienen un segmento que atraviesa ambas membranas “dominio transmembranal”, mientras que otras proteínas pueden tener múltiples dominios que atraviesan varias veces la membrana biológica. Los dominios terminales son activos y están conectados estructural y fisiológicamente.
Figura 5.3.
Proteínas integrales y periféricas. Existen
diferentes tipos de anclaje de una proteína a la membrana, de izquierda a
derecha: proteínas integrales (morado y verde) proteína periférica anclada a un
polisacárido de membrana (amarillo), anclada a la membrana (café), anclada a
otra proteína (café y verde; café y azul) anclada a la membrana median
interacciones (azul).
Por lo general hay un dominio receptor y
un dominio efector. El dominio receptor es estimulado por la recepción de una
señal, como acoplarse a una sustancia química, ser estimulado por la luz o las
vibraciones. Una vez estimulado la señal se transfiere al dominio efector que
causa otras reacciones en cadena al otro lado de la membrana. Este principio de
comunicación transmembranal es importante en muchos sistemas como el nervioso o
para la absorción de nutrientes como la glucosa. Las proteínas de membrana son
muy importantes, y representan entre el 20-30% de las proteínas codificadas en
el genoma de diferentes células.
👉 Proteínas
periféricas de membrana: Las
proteínas periféricas se encuentras localizadas de manera completa en la parte
externa de la bicapa, en cualquiera de las dos caras, ya sea en el citoplasma o
en el medio externo, aunque asociadas a la superficie de la membrana mediante
una interacción no covalente “si fuera covalente diríamos que es un dominio
externo de una proteína integral de la membrana”. Los enlaces empleados en este
caso son interacciones electrostáticas débiles. Debido a que estas proteínas se
encuentran fuera de la bicapa, no requieren tener una naturaleza anfipática,
esto implica que en su mayoría pueden ser obtenidas en solución acuosa, y se
las puede aislar en altas concentraciones mediante soluciones salinas que
debilitan las interacciones electrostáticas.
Sin embargo, la distinción entre proteínas
integrales y periféricas en ocasiones el altamente problemático, ya que muchas
proteínas poseen dominios que se insertan en la membrana y otros dominios que
emergen de ella extendiéndose de manera amplia hacia la periferia. En resumen,
el problema es que as proteínas periféricas de membrana son difíciles de
diferenciar de los dominios extramembranales de una proteína integral de la
membrana.
Las proteínas periféricas asociadas a la
membrana más estudiadas se encuentran en la cara interna “citosólica”, estas
proteínas forman un polímero fuerte pero flexible que puede alterar su forma y
su constitución, estas proteínas se denominan citoesqueleto. Estas proteínas
proveen un soporte mecánico para la función de la membrana como un punto de
anclaje de las proteínas de membrana. Otras proteínas periféricas de membrana
funcionan como enzimas, cubiertas especializadas, o factores para la
transducción de señales de un lado a otro de la membrana. Las proteínas
periféricas de la membrana poseen una relación dinámica de la membrana, siendo
reclutadas a la membrana o siendo liberadas de la membrana dependiendo de las
condiciones.
👉 Lipoproteínas
de membrana: Son proteínas
que se anclan directamente a los lípidos de membrana. Se pueden identificar
cientos tipos de lípidos que pueden anclar proteínas. Numerosas proteínas que
se presentan en la cara externa de la membrana biológica se encuentran unidas a
la membrana mediante un pequeño puente de oligosacáridos unidos a una molécula
del fosfolípido fosfatidilinositol. Las proteínas periféricas de membrana que
contienen este tipo de puente son llamadas proteínas GPI. Las proteínas de este
tipo fueron descubiertas cuando, las células eran tratadas con una sustancia
que corta de maneta especifica el fosfatidilinositol, lo que provocaba la
liberación de una gran gama de proteínas dependiendo del número de células.
6. Fluidez de la membrana biológica
En base al modelo del mosaico fluido de la estructura de la membrana biológica podemos resumir su estructura en términos de una base de fosfodigliceridos con otras moléculas asociadas como el colesterol, las proteínas se encuentran dispersas de manera irregular, ya sea atravesando la membrana “proteínas integrales” o pegadas de manera leve a la membrana “proteínas periféricas”. La membrana debe mantenerse normalmente una temperatura relativamente elevada (37°C) donde los lípidos existen en un estado de fluidez relativa, es decir, no es un estado sólido, pero tampoco es un estado líquido, es más bien un sólido fluido flexible, de allí viene el nombre de mosaico “referente a la disposición irregular de las proteínas” fluido “referente al estado físico de los lípidos de la membrana”. De cierta forma el mejor modo de describir este estado es como el de un fluido de dos dimensiones cristalino. Como en un cristal, las moléculas mantienen una organización molecular distinguible, pero como es fluido, cada molécula tiene la posibilidad de vibrar.
Figura 6.1. Membrana con fosfolípidos saturados. Las membranas hechas con ácidos grasos saturados se empacan fácilmente por lo que tienden a mantenerse sólidas.
Figura 6.2.
Título Membrana con fosfolípidos insaturados. Las
membranas hechas con ácidos grasos insaturados son más inestables por lo que
tienden a ser fluidas o líquidas.
En esta simulación observamos la formación
de tres bicapas lipídicas, uno de los fenómenos de debemos resaltar es que,
termodinámicamente las colas de los fosfodigliceridos se encuentran vibrando en
todo momento, lo cual le otorga a la membrana su fluidez característica. Si la
temperatura disminuye lo suficiente, la fase del líquido cristalino cambia, con
la reducción energética las moléculas disminuyen su vibración, por lo que los
fosfolípidos adquieren una conformación más ordenada y restringida. La
temperatura en la que esto sucede se denomina temperatura de transición. Empaquetamiento
cercano de la membrana biológica cuando la temperatura disminuye demasiado, en
este estado la membrana pierde muchas de sus cualidades, como flexibilidad,
crecimiento, motilidad entre muchas otras. Las colas de los lípidos tienden a
ser rectas "cadenas de carbonos saturadas".
La temperatura de transición especifica de
una bicapa lipidia depende de la habilidad de los lípidos de membrana para
empacarse de manera unitaria, lo cual a su vez depende del tipo de lípidos de
membrana que la componen. Algunos de los factores que afectan la temperatura de
transición son la saturación de los ácidos grasos, por ejemplo, los
fosfolípidos saturados se empacan más fácilmente, mientras que los insaturados,
al tener una cola “torcida” no pueden agruparse tan fácilmente de manera
compacta.
Otro factor que afecta la fluidez de la
membrana es la longitud del ácido graso “las colas”. Mientras las colas sean
más cortas, la temperatura de fusión será más baja “esto se debe a que cadenas
más cortas tienen menos interacciones moleculares, por lo que es más fácil
romper sus uniones usando energía calorífica”. Las moléculas de colesterol
debido a su estructura y organización impiden que las moléculas de fosfolípidos
se empaquen de manera organizada a medida que la temperatura desciende,
haciendo que el cambio de fase no se genere de manera abrupta.
6.1. La Importancia de la fluidez de la membrana
Figura 6.3.
Efecto de la insaturación en la cola de los fosfolípidos. Las
colas de los fosfolípidos pueden ser saturadas en cuyo caso son rectas y
fáciles de empaquetar, mientras que las colas insaturadas presentan enlaces
dobles que tuercen la cadena, lo cual hace que sean difíciles de empaquetar.
De las tres opciones de estado físico, la del solido fluido cristalino es realmente útil. Un sólido en gel más rígido posee una estructura más ordenada pero más inmóvil, impidiendo los procesos de asociación de proteínas y de ensamblaje de estructuras multiprotéicas. Tampoco permite la asociación de proteínas específicas en lugares necesarios de la célula. Una estructura fluida completamente en estado líquido no proporcionaría un soporte estructural, ni tampoco la tan necesaria separación entre un ambiente interno y un ambiente externo, característica que define a cualquier estructura biológica que se precie de estar viva.
Figura 6.4.
Alternancia estructural de la membrana. La membrana
puede alternar entre una estructura rígida "izquierda" cuando la
temperatura sube, o una estructura flexible "derecha" cuando la
temperatura baja.
6.2.
Mantenimiento de la fluidez de
la membrana
La temperatura interna de la mayoría de
los organismos (diferentes de las aves y los mamíferos) fluctúa con la temperatura
externa del ambiente. Dado que para muchas de las actividades de la membrana la
célula debe mantener en su estado de fluido cristalino, las células responden a
las condiciones cambiantes del ambiento, alterando los tipos de lípidos que
componen la membrana en relación a la temperatura.
La modificación de los lípidos de membrana
puede ejecutarse de diversas maneras; por ejemplo, si una célula detecta
disminución de la temperatura, de inmediato una serie de enzimas empieza a
desaturar los carbonos creando enlaces dobles. Esto hace que las colas de los
fosfolípidos se tuerzan y sea más difícil para la estructura general
empaquetarse de manera ordenada, manteniendo temporalmente el estado de fluido
cristalino. Y a la inversa, cuando la temperatura se incrementa se favorece la
síntesis de fosfolípidos con colas saturadas que se organizan fácilmente, y
otras enzimas se encargan de retirar los enlaces dobles para formar más
fosfolípidos saturados.
6.3.
Balsas de lípidos de membranas
biológicas “Lipid raft”
Un caso interesante de orden y caos. Por
lo general las membranas biológicas poseen una mezcla relativamente aleatoria
de varios tipos de lípidos; sin embargo, cuando se construye una membrana de
lípidos de manera sintética, los lípidos se segregan de manera ordenada, los
fosfodigliceridos se convierten en su estructura cristalina fluida, mientras
que los esfingolípidos y el colesterol se agrupan en islotes o balsas mucho más
densos y solidos que flotan en el océano fluido de los fosfilípidos.
Las balsas de lípidos ocurren en membranas
artificiales, que no están provistas de ciertos componentes enzimáticos. Sin
embargo, su capacidad para organizar proteínas podria resultar una propiedad
interesante en los estudios sobre química prebiótica. Este caso resulta interesante
en el sentido de que estamos acostumbrados de que lo vivo presente un mayor
orden y simetría que lo no vivo. En todo caso estos islotes o balsas de lípidos
presentan otra propiedad interesante, y es que sirven como puntos de anclaje
para aminoácidos y proteínas de manera mucho más prevalente de lo que lo son
los fosfodigliceridos.
6.4.
Naturaleza dinámica de las
membranas biológicas
Es bastante evidente dadas las discusiones de artículos anteriores y del mismo nombre del modelo moderno de membrana, que la membrana biológica se encuentra en un estado de fluidez relativa, pero con moléculas ordenadas aunque en constante vibración. Como resultado, los fosfolípidos, los esfingolípidos y el colesterol pueden experimentar movimientos bastante bruscos. La movilidad de las moléculas lipídicas individuales al interior de la bicapa lipídica de la membrana plasmática puede observarse de manera directa al microscopio mediante la unión a las cabezas polares de átomos de oro o compuestos fluorescentes.
Figura 6.5.
Transporte de lípidos de membrana. Para que una
célula crezca debe fabricar membrana desde el interior, pero para que la
membrana crezca, también debe crecer en el exterior, por lo que los
fosfolípidos fabricados internamente deben ser reorientados hacia el exterior,
permitiendo un crecimiento homogéneo de las dos capas de la membrana celular.
Se ha estimado que los fosfolípidos pueden
realizar el proceso de difusión a través de la superficie de la membrana desde
un lado de la membrana a otro en un segundo o dos. Esto se ha demostrado usando
dos células una humana y otra de ratón, cada una con diferentes marcadores para
microscopia, donde los fosfolípidos se difuminan unos con otros mezclándose. En
contraste, le puede tomar a una sola molécula de fosfolípidos horas o días
moverse a través de las dos capas de la membrana celular. De todos los posibles
movimientos de un fosfolípido, este cambio de orientación es el más
restringido, ya que implica que la cabeza polar atraviese la capa intermedia
apolar, lo cual se ve poco favorecido desde el punto de vista termodinámico.
Sin embargo, como en cualquier fenómeno
poco favorecido termodinámicamente, las células encuentran la solución en las
proteínas de tipo catalítico o enzimas, las cuales pueden mover de manera
activa a los fosfolípidos desde una cara de la membrana a la otra. Estas
enzimas juegan un papel importante en el establecimiento de la asimetría.
Debido a que los lípidos proveen la matriz sobre la cual las proteínas
integrales se anclan a la membrana, el estado físico de los lípidos de membrana
es un factor determinante en la movilidad de las proteínas integrales. La
demostración de que las proteínas, así como los lípidos pueden difuminarse a
través de la superficie de la membrana de manera constante es uno de los
pilares fundamentales del modelo del mosaico de fluido.
6.5.
Difusión de las proteínas de
membrana y la fusión celular
La fusión celular es una técnica en la que
dos tipos diferentes de células con un citoplasma similar de dos especies
diferentes pueden fusionarse para producir una célula con un citoplasma común y
una sola membrana continua. Las células son inducidas a fusionarse mediante el
uso de proteínas de fusión, las cuales pueden ser insertadas en la membrana
mediante el empleo de virus modificados, de modo tal que el producto de su
infección no son virus, si no las proteínas de adhesión-fusión. Posteriormente
adicionando un compuesto químico como polietilenglicol o una descarga eléctrica
leve las dos células son inducidas a fusionarse.
La fusión celular ha jugado un papel
fundamental en la biología celular, y actualmente se emplea como una
herramienta indispensable para preparar anticuerpos específicos. Los primeros
experimentos en demostrar que las proteínas de membrana se podían mover en el
plano “como flotadores en la superficie del fluido de las membranas” emplearon
precisamente la técnica de la fusión celular, y fueron reportados en 1979 por
Larry Frye y Michael Edidin de la universidad de John Hopkins. En sus
experimentos, las células de los humanos y los ratones fueron fusionadas,
mientras que las localizaciones de proteínas específicas de la membrana fueron
seguidas una vez que las dos membranas se fusionaron convirtiéndose en una
sola.
Las distribuciones subsecuentes de las
proteínas de membrana, tanto de los ratones como de los humanos fueron
determinadas en varios puntos de tiempo después de la fusión mediante
anticuerpos marcados para cada tipo de proteína. Es la señal atada a los anticuerpos
“de tipo fluorescente” lo que podemos detectar con el microscopio. Los
anticuerpos contra las proteínas de ratón fueron marcados con verde
fluorescente, mientras que los anticuerpos para las proteínas de los humanos
fueron marcados con rojo fluorescente. Cuando los anticuerpos fueron
adicionados a las células fusionadas, el movimiento de las proteínas podía
rastrearse mediante microscopia de luz fluorescente.
Durante el momento de la fusión, la
membrana celular parecía una mitad de ratón y una mitad de humano, es decir,
dos polos de colores altamente conspicuos y diferenciables. A medida que el
tiempo después de la fusión se incrementó, los diferentes colores comenzaron a
moverse de modo cal que ocurría una mezcla. Después de unos 40 minutos cada uno
de los colores se había distribuido de manera uniforme a través de toda la
membrana hibrida. Cuando se repitió el experimento a menor temperatura, la
viscosidad de la membrana se incrementó, y la movilidad de las proteínas
disminuyo.
Estos primeros experimentos de movilidad
proteínica demostraron los principios básicos del modelo del mosaico fluido, en
la cual las proteínas se encuentran “flotando” insertadas en un más de lípidos
móviles. Otro aspecto importante es que, estas primeras técnicas daban la idea
de que las proteínas tenían una capacidad prácticamente irrestricta de
movimiento a través de toda la membrana, sin embargo, estudios subsecuentes han
demostrado que la dinámica de la superficie de la membrana es algo más
complejo. Mientras que la mayoría de las proteínas presentan una movilización
aleatoria, otras están fijas y las ultimas poseen movimientos altamente
deterministas.
7. Transporte de sustancias a través de membrana
Fácilmente podemos decir que este es uno de los temas más fundamentales para el entendimiento de la fisiología de los seres vivos. Las reglas que controlan el movimiento de sustancias a través de la membrana condicionan la anatomía y la fisiología de los seres vivos, y le otorga una razón, un porque para el que las cosas son como son. Subsecuentes discusiones sobre el sistema digestivo, el sistema respiratorio, el sistema circulatorio, el sistema excretor, el sistema endocrino, el sistema nervioso poseen de manera invariable una referencia a los temas que estudiaremos en las siguientes discusiones.
Figura 7.1.
Difusión a través de membrana. El flujo de
sustancias por una membrana se asemeja a una reacción reversible, en el sentido
de que en la realidad las partículas pueden fluir hacia cualquier lado. Sin
embargo, si existe una diferencia de concentraciones, el flujo desde el lado de
mayor concentración es superior al del que proviene del lado de menor
concentración. Si restamos ambos flujos sigue existiendo un flujo neto. En un
ambiente donde no hay gradiente de concentración, los flujos hacia ambos lados
son iguales, lo que al restarse genera un flujo neto de 0, lo que puede
interpretarse como un estado de equilibrio.
Debido a que el contenido de una célula
está completamente rodeado por una membrana biológica, toda comunicación entre
el interior de la célula y el medio externo debe encontrarse mediado por la
membrana biológica. En cierta forma, la membrana biológica posee una función
dual. Por un lado, debe mantener los materiales disueltos de la célula de modo
tal que estos no se escapen al medio externo “nutrientes” o al interno
“desechos”. Por otro lado, debe permitir un adecuado intercambio de sustancias
para mantener los equilibrios químicos internos “homeostasis”.
La membrana biológica por su naturaleza lipídica tiende a dejar pasar con mayor facilidad sustancias apolares y muy pequeñas, como el oxígeno molecular, aunque también puede dejar pasar sustancias levemente polares como el agua y el dióxido de carbono. Sin embargo, representa una berrera realmente poderosa para cualquier sustancia polar, así como para moléculas apolares demasiado grandes. En consecuencia, la membrana biológica debe poseer mecanismos que permiten el manejo y flujo de sustancias que no se difunden a través de ella con facilidad, aunque esto generalmente requiere de una inversión energética por parte de la célula.
Figura 7.2.
Difusión simple. Las sustancias ordenadas tienden a
desordenarse si se les aplica calor. La
segunda ley de la termodinámica nos dice que los sistemas tienden a hacia
conjuntos de microestados más probables a medida que el tiempo transcurre, o
como hubiera dicho Lord Kelvin, “desorden madame, las cosas tienden al
desorden”. La difusión es un proceso entrópicamente (S) favorable, donde el
sistema avanza a un microestado más probable, más aleatorio y menos ordenado.
Si la medida del desorden lo simbolizamos como S, siendo S inicial más
ordenado, la tendencia natural es obtener un S final menos ordenado. S mide el
desorde de forma cuantitativa, así que a mayor caos mayor será el valor de S.
Dado que, la membrana biológica puede ser
permeable “a sustancias como el oxígeno molecular” o impermeable “a sustancias
como los carbohidratos” decimos que existen básicamente dos tipos de movimiento
de sustancias a través de la membrana. Un movimiento pasivo, o un movimiento
activo. Ambos tipos de movimiento generan un flujo neto de sustancias a través
de la membrana o el mecanismo que esté implicado.
Usamos el termino flujo neto debido a que
el flujo de sustancias siempre se da en ambas direcciones, sin embargo,
generalmente el flujo en una dirección es mucho más marcado que el flujo en otra
dirección, por lo que cuando se restan la cantidad de productos que han fluido
hacia un lado de los que han fluido hacia el otro lado tenemos un resultado de
flujo neto. Se conocen muchos tipos de procesos en los cuales las sustancias se
mueven a través de la membrana, la difusión simple; difusión facilitada a
través de un canal iónico; difusión facilitada a través de un transportador;
transporte activo a través de un transportador que requiere energía “bomba”.
Todo transporte a través de membrana depende indudablemente de ciertas fuerzas de la física, las cuales a su vez se relacionan con los principios de la termodinámica. Aún más que desorden, diríamos que las cosas tienen a igualarse, por ejemplo, el Sol emite energía de modo tal que la temperatura del universo pueda igualarse con su propia temperatura, sin embargo, el Sol posee tanta energía que el tiempo que se tarda en1 alcanzar un estado de equilibrio térmico con su ambiente es muy largo. La materia es un tipo especial de energía, que al estar en un estado fluido “sólido o líquido” también experimenta la tendencia a ir hacia microestados moleculares más probables, es decir tienden al equilibrio. El mecanismo por medio del cual un grupo de moléculas de una especie química alcanza un equilibrio con otro grupo de moléculas de una especie química diferente lo denominaremos difusión.
Figura 7.3.
La superficie de la membrana afecta la difusión. Una
membrana con pliegues, arrugas y barbas tiene más área de superficie para el
flujo de sustancias que una membrana tersa y lisa. Entre más arrugas, más
sustancias pasan en menos tiempo.
De este modo, definiremos el proceso de
difusión como el mecanismo en que una sustancia se mueve de una región de alta
concentración a una región de baja concentración, y eventualmente eliminando la
diferencia de concentraciones entre las dos regiones. Al igual que la teoría
cinética de los gases, la difusión se modela como una serie de partículas duras
y elásticas que vibran y chocan entre sí, la vibración es la medición molecular
del calor. Las partículas se mueven cuasi-aleatoriamente debido a la vibración
calórica, pero sus movimientos estarán limitados por las interacciones
moleculares propias del estado líquido o gaseoso, y dependerán de si la
molécula puede generar dipolos, puentes de hidrógeno y/o fuerzas de Van der
Waals. Un último aspecto de importancia es que la velocidad de transito de
sustancias depende del área de superficie, a mayor superficie más fácilmente
una sustancia puede pasar a un lado o a otro de la membrana.
8. Transporte pasivo
La regla principal para que una sustancia no electrolítica pueda atravesar la membrana es que exista un gradiente de concentración fuerte, de modo que el sistema tenga una enorme tendencia al equilibrio, lo cual a su vez genera una gran energía potencial que mueve a las sustancias. La segunda regla es que la membrana debe ser permeable “penetrable” por la sustancia en cuestión. Uno de los factores que afecta esa penetrabilidad es, por ejemplo, la polaridad de la molécula. Con los primeros experimentos hechos para determinar la naturaleza química de la membrana, nos dimos cuenta que en su mayoría tratamos con una membrana apolar, por lo que es más fácil que pasen sustancias apolares. El oxígeno molecular es un ejemplo de una molécula perfectamente apolar que puede atravesar la membrana celular con relativa facilidad.
Figura 8.1.
Transporte pasivo. Las sustancias fluyen desde la región
de mayor concentración a la de menor concentración sin gasto de energía (YouTube)
Otra característica es el tamaño, resulta
evidente que, en una estructura apretujada y vibrante como la membrana, las
moléculas más grandes no podrán encontrar fisuras por donde insertarse ya que
estas van y vienen con extremada rapidez. Las moléculas pequeñas pueden
insertarse con suma facilidad en dichas fisuras y por lo tanto atravesar la
membrana. En otras palabras, las moléculas pequeñas atravesaran con más
facilidad la membrana desde que no posean cargas.
De esta manera podemos resumir que, para
moléculas apolares o con polaridades leves el paso a través de la membrana es
simple, desde que la molécula sea pequeña, por ejemplo, el dioxígeno, dióxido
de carbono, monóxido de nitrógeno y agua. En contraste, moléculas grandes y
polares como los azucares, los aminoácidos, los intermediarios fosforilados
exhiben una penetración en membrana muy baja. De esta manera decimos que las
membranas biológicas son semipermeables, siendo penetradas por ciertas
sustancias con suma facilidad, pero a otras sustancias siendo una barrera muy
efectiva. Es cierto que la membrana necesita dar paso a moléculas de
importancia como los carbohidratos o los aminoácidos, pero para esto emplea
mecanismos diferentes que no tienen que ver con los lípidos de la membrana. A
este tipo de movimiento a través de la membrana lo denominamos transporte
pasivo, en el sentido de que no requiere la intervención de sustancias de apoyo
o de energía por parte de la célula.
8.1.
Filtración
Filtración es el movimiento de agua y
moléculas de soluto a través de la membrana de la célula debido a la presión
hidrostática generada por el sistema cardiovascular. Dependiendo del tamaño de
los poros de membrana, solamente los solutos de cierta medida pueden pasar a
través de ellos. Por ejemplo, los poros de membrana de la cápsula de Bowman en
los riñones son muy pequeños, y solamente las albúminas las proteínas más
pequeñas, tienen la posibilidad de ser filtradas a través de ellos. Por otro
lado, los poros de membrana de las células del hígado son extremadamente
grandes, permitiendo a toda una variedad de solutos pasar a través de ellos y
ser metabolizados.
Si la célula es puesta en un ambiente con
solutos en menor cantidad que su ambiente interno, el agua del ambiente empieza
a ingresar a la célula intentando igualar las concentraciones de la célula, lo
que hace que esta se hinche como un globo hasta explotar. Este tipo de
ambientes se denomina hipotónico o hipo-osmótico, y al mecanismo por medio del
cual la célula se hincha y explota se le denomina lisis. Un ambiente en
equilibrio con la célula se denomina isotónico o iso-osmótico. En ambientes
levemente hipertónicos o isotónicos, la célula puede recuperarse al hacer que
los solutos se muevan a través de la membrana, pero hacer esto regularmente
requiere un esfuerzo de la célula, es decir, invertir energía.
8.2.
Importancia de la ósmosis
El proceso de ósmosis es muy importante en una amplia variedad de funciones del cuerpo. Por ejemplo, en los seres humanos, el tracto digestivo segrega varios litros de fluidos al día, los cuales son reabsorbidos por el intestino grueso “y si no tendrás diarrea” en cuyo caso deberás enfrentar el prospecto de una deshidratación rápida. Las células de los animales se encuentran sumergidas en un líquido denominado linfa, matriz extracelular o sangre, cualquiera de los cuales es isotónico con respecto al interior de la célula, de modo tal que estas no alteran sus volúmenes, aunque el flujo de sustancias entre el interior y el exterior es bastante activo. Las plantas usan la ósmosis en formas diferentes, a diferencia de las células animales, las células de las plantas son hipertónicas con respecto a sus fluidos internos. Como resultado existe la tendencia a que el agua de los fluidos ingrese a las células, causando la aparición de una presión constante contra la pared celular vegetal denominada presión de turgencia (YouTube).
9. Transporte pasivo facilitado
El transporte pasivo facilitado se requiere cuando la sustancia en cuestión no pasa con facilidad a través de la membrana, o la célula en cuestión necesita una cantidad superior de dicha sustancia de la que puede atravesar de manera espontánea por la membrana. Sea cual sea el caso, si se debe obedecer la regla, y es la del gradiente o diferencial de concentraciones a través de la membrana, es decir, las sustancias fluyen a través de los facilitadores en favor del gradiente de modo tal que las concentraciones a ambos lados intentan igualarse de manera paulatina.
Figura 9.1.
Transporte pasivo facilitado. Las sustancias
fluyen desde la región de mayor concentración a la de menor concentración sin
gasto de energía gracias a una proteína (YouTube).
El aspecto más destacado del transporte
pasivo es el empleo de proteínas que permiten el flujo de sustancias a través
de la membrana sin la necesidad de que la célula invierta energía en el
proceso. De este modo podemos clasificar dos modos de funcionamiento general,
las proteínas que sirven de canal iónico, y las proteínas de translocación.
En las primeras, las proteínas atraviesan
por un canal acuoso como si fuera un pasillo abierto a través de la pared
membranal, mientras que en las segundas la sustancia debe encajar de manera
“especifica” en la superficie de la proteína para que esta cambie de forma y
haga pasar a la sustancia a través de la membrana.
9.1.
Acuaporinas
Muchas células poseen una permeabilidad de
agua a través de la membrana superior a lo que puede ser explicado mediante la
difusión simple a través de la membrana. A inicios de la década de los 90s del
siglo pasado, Peter Agre y sus colegas de la universidad de Johns Hopkins
intentaron aislar proteínas de membrana responsables para el antígeno Rh de los
glóbulos rojos. Durante esta búsqueda, ellos identificaron una proteína que
podría ser el tan esperado canal de agua de la membrana celular de glóbulo
rojo. El equipo llamo a estas proteínas acuaporinas, lo que significa canales
de agua, una familia de proteínas integrales que permitían un flujo acelerado
de agua a través de la membrana.
Las acuaporinas (YouTube) son en esencia filtradores
moleculares que no requieren energía, por lo cual la industria del tratamiento
de agua se ha volcado a la investigación de membranas artificiales con
acuaporinas que permitirían el filtrado del agua a nivel molecular. El
potencial de esta tecnología es enorme, tan solo imaginen, industrias que ahora
desechan agua contaminada podrían convertirse en fuente de agua purificada, y
al mismo tiempo, todos los compuestos filtrados podrían re-emplearse en otras
aplicaciones industriales.
La proteína en si posee cuatro
subunidades, donde cada una de ellas contiene un canal central alineado a
aminoácidos hidrofóbicos y es altamente específico para las moléculas de agua.
Cerca de mil millones de moléculas de agua pueden atravesar por uno solo de
estos canales cada segundo, y al mismo tiempo iones protio(1+) son excluidos de
estos canales impidiendo su entrada. Las acuaporinas juegan un rol
imprescindible en células de filtrado de agua como las células de los riñones o
de las raíces de las plantas.
9.2.
Canales iónicos
La membrana lipídica constituye la base en
la cual se insertan una serie de proteínas que permiten el paso de sustancias
que de otro modo quedarían excluidas de manera permanente, y que son cruciales
para muchas reacciones metabólicas de importancia como los iones de sodio(1+),
potasio(1+), calcio(2+) o cloruro(1-). A pesar de esto, la existencia de estas
proteínas fue simplemente una asunción teórica hasta la década de 60-70 del
siglo pasado. Actualmente los biólogos han encontrado una inmensa diversidad en
este tipo de proteínas, las cuales rodean a un poro acuoso por donde los iones
pueden pasar con relativa facilidad. Las variaciones en estos poros alteran su
selectividad, y de manera común pueden resultar en variación neutral
isoenzimática o en enfermedades muy serias.
La mayoría de los canales iónicos son
altamente selectivos para los tipos de iones que permiten pasar por el poro. La
mayoría de los poros que se han estudiado pueden cambiar entre dos formas
posibles, una abierta y otra cerrada. Podemos distinguir entre tres tipos de
canales iónicos. Canales de apertura voltaica, los cuales se abren y cierran
dependiendo de la diferencia de cargas a los lados de la membrana. Canales de
apertura dependiente de cofactores, estos canales dependen de moléculas
secundarias que al unirse de manera específica con el canal lo abren para que
las sustancias de interés puedan pasar a través del poro. Canales de apertura
mecánica, estos canales pueden abrirse o cerrarse dependiendo de las tensiones
que sufre la membrana en el punto en que se encuentra el poro.
9.3.
Canales iónicos en los
eucariotas
Como ya lo hemos mencionado anteriormente,
las proteínas poseen un nivel de complejidad que podemos denominar como bloque.
En las proteínas de canal iónico podemos identificar dos bloques, que a su vez
están formados por 6 hélices de aminoácidos en los eucariotes. El dominio se
relación es aquel que se encarga de percibir una señal, como por ejemplo un
cambio en el equilibrio voltaico y ejecuta un cambio en la forma de la
proteína. El dominio del poro es el canal acuoso por donde los iones pueden
pasar, y al mismo tiempo es restrictivo, en otras palabras, selecciona unos
pocos o inclusive un solo tipo de ion para pasar a través de él.
9.4.
Proteínas de translocación y
transporte facilitado
Al igual de las proteínas de transporte
iónico las proteínas de translocación (YouTube)
no requieren de energía para operar. A diferencia de ellas, estas proteínas no
generan un poro, si no que el cambio conformacional transloca a la sustancia
desde un lado al otro de la membrana. Estas proteínas operan mediante el
mecanismo de reacción de las enzimas, es decir, mediante el reconocimiento
especifico de la superficie del compuesto químico su unión a él, y su
translocación al otro lado de la membrana.
Algunos de las proteínas de translocación
más importantes en los seres humanos son las proteínas de translocación de
glucosa. La glucosa es un carbohidrato simple de importancia vital en la
obtención de energía instantánea por parte de la célula. En los humanos existen
al menos 5 isoformas de un translocador de glucosa, pero el más importante es
la forma 4 (GLUT-4). En condiciones normales estos translocadores se encuentran
aislados de la membrana celular, en el interior del citoplasma anclados a la
membrana de vesículas.
Cuando la hormona insulina es liberada,
estas vesículas sufren estímulos para fusionarse a la membrana celular
integrándose a ella, lo cual incluye a los canales GLUT de modo tal que estos
empiezan translocar glucosa desde el exterior de la célula al interior.
10. Transporte activo
Mi profesora, Barbara Zimmerman una vez nos preguntó, ¿Están los seres vivos en equilibrio con su ambiente externo?, y de entre alrededor de 20 estudiantes, solo dos no contestamos de manera afirmativa. Por lo general el discurso ecológico nos lleva a pesar en esto, sin embargo, el equilibrio ecológico es completamente diferente al equilibrio químico. Piense por ejemplo en su piel, hacia el interior se encuentra una gran cantidad de fluidos, está líquido, mientras que hacia el exterior de su piel solo existe aire seco, tal fue mi razonamiento, y estaba en lo correcto.
Figura 10.1.
Transporte activo. Las sustancias fluyen desde la región de
menor concentración a la de mayor concentración con gasto de energía gracias a
una proteína, la energía generalmente se da por hidrólisis de ATP aunque
existen otras opciones (YouTube).
Los seres vivos se encuentran
fundamentalmente en desequilibrio con sus ambientes externos en términos
químicos, ellos almacenan cantidades masivas de compuestos químicos complejos
al interior de sus barreras, mientras que se mueven en un ambiente
relativamente pobre en nutrientes. Es decir, almacenan sustancias en contra de
los gradientes de concentración. A nivel molecular sería algo así como ir en
contra de la corriente, o aparentemente en contra de la segunda ley de la
termodinámica. En este caso una proteína haría fluir sustancias de la zona de
menor concentración a la de mayor concentración.
Sin embargo, este milagro entrópico no es
tal ya que viene a un costo, la disipación energética, mientras que una zona
del sistema se hace menos probable “el incremento de la diferencia de
concentraciones” otra región del sistema se hace más probable “la dispersión
energética”. Esto se debe a que las proteínas de este tipo de transporte gastan
energía para cambiar de forma. Pero su eficiencia no es absoluta, y la mayor
parte de la energía empleada se disipa al universo en forma de calor inútil. En
otras palabras, el transporte pasivo es el flujo de sustancias en contra del
gradiente de concentración con un costo de energía. Y sin él, la vida misma
seria teóricamente inviable.
10.1.
Transporte activo primario
El transporte activo primario, también llamado transporte activo directo, utiliza energía metabólica en forma directa para transportar moléculas a través de la membrana. La mayor parte de las enzimas que llevan a cabo este tipo de transporte son ATPasas transmembrana. Una ATPasa primaria y universal para todas las formas de vida animales es la bomba de sodio y potasio, la cual ayuda a mantener el potencial de membrana celular. Otras fuentes de energía para el transporte activo primario son las reacciones redox y la energía entregada por fotones de la luz. Un ejemplo de transporte activo primario que hace uso de energía proveniente de reacciones redox es la cadena de transporte electrónico mitocondrial, la cual utiliza la energía proveniente del NADH para mover protones a través de la membrana mitocondrial interna en contra de su gradiente de concentración. Un ejemplo de transporte activo primario que hace uso de la energía de la luz son las proteínas involucradas en la fotosíntesis las cuales utilizan la energía de los fotones para crear un gradiente de protones a través de la membrana tilacoide y poder reductor en la forma de NADPH.
👉 Bomba de sodio y
potasio: Uno de
los principales mecanismos empleados por la célula neuronal para crear una
diferencia de cargas a ambos lados de la membrana es mediante la bomba de sodio
y potasio. Junto con otras proteínas de transporte transmembranal, la bomba de
sodio y potasio contribuye a que la célula se encuentre en un estado de
desequilibrio eléctrico y de concentraciones con respecto al medio circundante,
esto genera fuerzas que pueden ser empleadas para diversos propósitos.
Un ejemplo relacionado es el uso que hace la célula de gradientes electroquímicos en base al ion protio(1+) con el cual es capaz de mover mecánicamente proteínas tipo F para la síntesis de energía. En este caso, sin embargo, la célula mantiene un estado de desequilibrio estable, o lo que llamaríamos en física clásica, un estado de equilibrio muy inestable, el sistema en apariencia se encuentra en un estado inactivo, pero a cualquier estímulo la inestabilidad se manifiesta con una energía mucho mayor de la empleada para haber realizado el estímulo. A esto lo denominaremos estado de estabilidad.
Figura 10.2. Ciclo de acción de la bomba de sodio y
potasio. Se trata de una proteína de translocación que saca a
las malas 3 iones sodio(1+), permitiendo el ingreso de 2 iones potasio(1+), el
flujo neto permite extraer una carga positiva por cada ciclo (YouTube).
Normalmente las concentraciones
intracelulares del ion sodio(1+) “10 milimol por litro en una célula muscular”
es mucho más baja que la concentración extracelular “140 milimol por litro”, en
consecuencia hay una presión osmótica sobre la célula para que ingrese el ion
sodio(1+) pero existe un mecanismo que lo extrae con mayor eficacia. La entrada
del ion sodio(1+) es permitida por canales iónicos sin cisternas, lo cual
implica que siempre se encuentran abiertos. La salida se encuentra mediada por
una proteína de transporte transmembranario conocida comúnmente como la bomba
de sodio y potasio.
La bomba de sodio y potasio tiene tres
dominios de acople principal: El primer dominio acopla tres unidades del ion
sodio (1+) en el interior de la célula, el segundo dominio acopla dos unidades
del ion potasio(1+) en el exterior de la célula, y el tercer dominio acopla
ATP, la unidad portadora de energía de la célula. La bomba de sodio y potasio
se emplea para transportar sodio al exterior y potasio al interior de forma
selectiva creando un gradiente de concentraciones químico y eléctrico. Químico
porque cada ion genera una presión osmótica contra la membrana para intentar
igualar sus concentraciones individuales. El funcionamiento de la bomba de
sodio y potasio es cíclico.
El ciclo inicia con el acople de 3 iones
sodio(1+) en el interior de la célula. Posteriormente se acopla una unidad de
ATP. En este punto la proteína hidroliza el ATP transfiriendo la energía a su
estructura, lo cual genera un cambio en la estructura de la bomba de sodio y
potasio. Al cambiar de forma los iones
sodio (1+) se transfieren al exterior de la célula y expone los dominios de
acople para dos iones potasio(1+). Cuando la energía se libera por calor, la
bomba regresa a su estado de descanso cambiando de forma y liberando los iones
potasio(1+) al interior de la célula. Cada ciclo aumenta en una carga positiva
el exterior de la célula y disminuye una carga positiva el interior, creando
una corriente eléctrica neta.
Aunque la carga de ambos iones es la
misma, la cantidad de iones que se mueve es desigual, hacia un lado de la
membrana se transportan más cargas positivas, lo cual con el tiempo contribuye
a una diferencia de cargas. Como mencionamos antes, la generación de un
diferencial de cargas “potencial eléctrico” puede definirse como una corriente
eléctrica a través de la membrana, y el aumento del diferencial de cargas
incrementa el voltaje o potencial eléctrico de la membrana.
👉 Motor del flagelo: El motor del flagelo bacteriano consiste en solo dos proteínas
(MotA y MotB) lo cuales son homólogos a energizadores de los receptores de la
membrana externa que concentran grandes moléculas como la vitamina B12 o
complejos de hierro en el espacio periplasmático de las bacterias gram
negativas o a la f1f0 ATP sintetaza (YouTube). Estas proteínas comprimen canales
transmembranales de iones protio(1+), lo que implica que el conjunto Mot AB emergió
como un simple canal iónico, permitiendo un paso a través de la membrana de
protones a través de un canal, disipando la concentración de los protones y
estabilizando el pH del citoplasma con un evidente gasto energético en forma de
ATP. Una vez que estos canales existen, estos pueden ser reclutados para otras
funciones más complejas como la motilidad o la energización del transporte a la
membrana externa. Sin embargo, este es solo un motor de muchos el cual permite
un movimiento giratorio de derecha o de izquierda. Otros motores permiten otros
tipos de movimiento, así como un ajuste de velocidades.
Básicamente funciona como una f1f0 ATP
sintetaza inversa, La hidrólisis de ATP se utiliza para transportar iones
hidrógeno contra su gradiente electroquímico (de una zona de baja concentración
a una de alta concentración del ion). La fosforilación de la proteína
transportadora y la unión de un ion hidrógeno induce un cambio conformacional
que impulsa el transporte de iones hidrógeno en contra de su gradiente electroquímico.
La hidrólisis del grupo fosfato unido y la liberación del hidrógeno restablece
al transportador a su conformación original.
👉 Transporte activo secundario: En el transporte activo secundario, también llamado transporte
acoplado o cotransporte, se utiliza energía para transportar moléculas a través
de una membrana, sin embargo, en contraste con el transporte activo primario,
no existe un acoplamiento directo con el proceso generador de energía, ya sea
la hidrólisis de ATP una reacción redox o una reacción impulsada por luz. En
cambio, el proceso extrae la energía necesaria de un potencial electroquímico
creado por bombas de iones que bombean iones hacia el interior o exterior de la
célula. Estos transportadores permiten que un ion o molécula se mueva
"cayendo" a favor de su potencial electroquímico, pero arrastrando
consigo a otra sustancia contra su gradiente de concentración. El movimiento de
un ion desde donde se encuentra más concentrado hacia donde se encuentra menos
concentrado aumenta la entropía y puede ser utilizado como fuente de energía
para el metabolismo (por ejemplo, la ATP sintasa).
En agosto de 1960, en Praga, Robert K.
Crane presentó por primera vez su descubrimiento del cotransporte de
sodio-glucosa como mecanismo para la absorción intestinal de glucosa. El
descubrimiento del cotransporte de Crane fue la primera propuesta jamás hecha
para un flujo acoplado en biología. Los cotransportadores pueden ser
clasificados en simportadores o antiportadores dependiendo de si las sustancias
se mueven en la misma o en diferentes direcciones.
👉 Antiporte o cambalache: En un mecanismo de antiporte dos especies de iones u otras clases de soluto son bombeados en direcciones opuestas a través de la membrana. A una de estas especies se le permite fluir desde una zona de alta concentración a una de baja concentración lo cual provee la energía entrópica necesaria para impulsar el transporte de otros solutos desde una región de baja concentración a otra de alta. Un ejemplo de este tipo de transportadores es el intercambiador o antiportador de sodio-calcio, que permite el ingreso de tres iones sodio al interior de la célula, bombeando simultáneamente un ion calcio hacia afuera.
Muchas células además poseen una calcio
ATPasa (YouTube), la cual puede
operar a bajas concentraciones intracelulares de calcio y restablece las
concentraciones normales en reposo de este importante segundo mensajero. Sin
embargo, la ATPasa exporta iones calcio mucho más lentamente: solo 30 por
segundo contra 2000 por segundo que es capaz de movilizar el intercambiador. El
intercambiador entra en funcionamiento cuando las concentraciones de calcio
aumentan bruscamente y permite una rápida recuperación. Esto muestra que un
único tipo de ion puede ser transportado por varias enzimas, las cuales no
necesariamente tienen que estar activas todo el tiempo (constitutivamente);
sino que pueden actuar para suplir necesidades intermitentes específicas.
👉 Simporte o cotransporte: El mecanismo de simporte hace uso del movimiento a favor de
gradiente de un soluto, desde una zona de alta concentración hacia una zona de
baja concentración, para mover otra molécula desde una zona de baja
concentración hacia una de alta concentración (contra su gradiente de
concentración). Ambas moléculas son transportadas en la misma dirección.
Figura 10.3.
Acople de transporte activo. El transporte
activo simple implica la entrada o salida de una sola sustancia, el simporte
implica que dos moléculas ingresa, y el antiporte o cambalache implica que una sustancia
ingresa y otra sale.
Un ejemplo de este tipo de mecanismo es el
simportador de glucosa, las proteínas de transporte de sodio y glucosa SGLT1,
las cuales cotransportan una molécula de glucosa (o galactosa) hacia el
interior de la célula mientras que simultáneamente transporta dos iones sodio
hacia el interior de la célula. Este simportador se encuentra localizado en el
intestino delgado, tráquea, corazón, cerebro, testículos y próstata. También se
encuentran localizados en el segmento S3 del túbulo proximal de cada nefrona en
el riñón. Su mecanismo se explota en la terapia de rehidratación con glucosa y
los defectos en el SGLT1 previenen la reabsorción efectiva de glucosa, causando
la glucosuria familiar renal.
11. Transporte vesicular
Aunque este es un subtema del sistema de membranas internas de la célula, la aplicación es bastante alta al interior de muchos sistemas, en especial del sistema nervioso y de cualquier tejido con función glandular. El transporte de sustancias a través de una membrana permite a la célula realizar procesos de selección, poro no soluciona el asunto del transporte. ¿Cómo transportar una enzima peligrosa desde el punto A hasta el punto B sin autodestruirse? Las células eucariotas dependen de bolsas de transporte que se mueven entre los organelos y la membrana celular para transportar sustancias importantes y/o peligrosas para estar en el citoplasma. A estas estructuras las denominamos vesículas o somas.
Figura 11.1.
Las vesículas son segmentos de membrana que transportan sustancias.
Las vesículas de transporte membranario son bolsas creadas por membranas biológicas empleadas para transportar sustancias o para realizar procesos bioquímicos en su interior. En la siguiente serie de artículos analizaremos algunos detalles de este sistema de transporte intermembranario.
Figura 11.2.
Transporte vesicular. Las vesículas transportan
sustancias desde un organelo, como el retículo endoplásmico a otro organelo
como el aparato de Golgi.
11.1.
Las vesículas celulares
La imagen clásica de una vesícula es la de
una burbuja formada por una membrana biológica, sin embargo, esto es
incompleto. Las membranas de las vesículas poseen todo tipo de proteínas
integrales de membrana, así como un andamio formado por proteínas periféricas.
Las rutas biosintéticas de las células eucarióticas se encuentran altamente
dependientes de una serie de organelos rodeados por membranas, son las
membranas mismas las responsables de muchas de las reacciones bioquímicas al
anclar la mayor parte de la batería bioquímica, por ejemplo, en la cadena de
transporte de electrones de la respiración celular aeróbica. Adicionalmente,
las sustancias formadas deben poder ser enviadas entre los diferentes organelos
o hacia la membrana externa y de regreso en concentraciones relevantes y en
periodos de tiempo eficaces.
La mayoría de los materiales son
transportados entre los organelos y las membranas externas por secciones más
pequeñas de los organelos que las producen, es decir por membranas biológicas
internas, al ser más pequeñas sus formas tienden a ser esféricas y en
consecuencia reciben el nombre genérico de vesículas de transporte o “somas”
que significa cuerpos. Dependiendo de la función cada soma recibe un prefijo
específico, por ejemplo, si el soma transporta peróxidos oxidantes se lo llama
peroxisoma, si el soma se produjo para digerir un material se llama fagosoma.
A pesar de lo anterior emplearemos de aquí
en adelante el término de vesícula, ya que la expresión soma no solo se aplica
a estas, también es un nombre genérico recurrente para otras estructuras
biológicas como la parte central de una neurona, lo cual genera confusiones. El
sistema membranario del cual nace una vesícula se denomina membrana donante, y
el sistema que lo recibe se llama membrana receptora. El interior de la
vesícula se denomina lumen al igual que el interior de los organelos como los
retículos endoplasmáticos o el aparato de Golgi, mientras que la parte externa
de la vesícula da al citoplasma celular. Finalmente, las vesículas no solo
transportan sustancias, también transportan superficie de membrana, por lo que
los organelos y la membrana externa se encuentran en un equilibrio dinámico de
brotes de vesículas y fusión con vesículas para mantener sus superficies de
membrana constantes.
11.2. Proteínas vesiculares y los brotes
Figura 11.3.
Formación de una vesícula La formación de
una vesícula no es algo arbitrario, existen lugares prefijados de la membrana,
marcados con proteínas receptoras de la sustancia, que al conectarse con esta
inician la formación de la vesícula por medio de interacciones con el
citoesqueleto.
Cuando la vesícula esta por formarse un polímero de homólogo de dinamina se forma estrangulando el puente entre la vesícula y la membrana donante. Estos procesos son dependientes de GTP y por lo tanto agotan energéticamente a la célula.
Figura 11.4.
Importancia de las vesículas. Las úlceras
pancreáticas se generan por la mala señalización de las vesículas de transporte
de las proteínas líticas encargadas de finalizar la digestión de los
nutrientes, liberadas cuando no hay alimento en el duodeno dichas enzimas
digieren el duodeno rompiendo su pared.
Las vesículas no se forman espontáneamente
como las bombas de jabón, por el contrario, su formación se encuentra altamente
regulada por proteínas integrales de membrana y por proteínas periféricas de
membrana que forman andamios, las proteínas individuales se encuentran
disueltas en el citoplasma, y por la acción de algunas señales de proteínas
integrales de la membrana “proteínas de tipo G” se polimeriza el andamio
externo o cota. Las proteínas tipo G generalmente requieren energía en forma de
GTP para activarse.
La cota de proteínas extrae el fragmento
de membrana vesicular brotándola a partir de la membrana donante, a medida que
la esfera va tomando forma más cota proteínica se forma creando una estructura
con forma esférica, es decir la vesícula madura. Las proteínas de la cota de
una vesícula poseen dos funciones básicas: (1) actúan mecánicamente para que la
membrana se curve y forme el brote,, básicamente son un molde; (2) actúan como
un mecanismo para elegir cual es la sección de la membrana donante que será
extraída, sería un problema extraer una vesícula sin contenido de importancia.
Los componentes que se encuentran al interior de las vesículas pueden ser: (1)
proteínas líticas, ácidos, mucosas, hormonas, biomoléculas de diverso orden,
iones inorgánicos entre otras sustancias, las cuales se emplean para descargar
en otros organelos o en el exterior de las células (2) las proteínas integrales
de la membrana con dos dominios, el dominio receptor y el dominio efector.
El dominio receptor atrapa los materiales
a ser transportados como si fueran cinturones de seguridad, cuando se forma el
par sustancia-receptor el domino efector se activa formando la cota al otro
lado de la membrana.
11.3.
Los blancos de las vesículas
celulares
Dejando de lado la discusión sobre el
transporte y formación de un soma o vesícula al interior de la célula, hay que
examinar algunos detalles sobre el modo en que las proteínas sintetizadas en un
sistema de membranas internas hacia su destino particular. Muchas de las sustancias
producidas por las células son dependientes de su blanco, es decir solo actúan
bien si llegan al blanco concreto donde son requeridas, de lo contrario hay dos
opciones generales:
👉 No
funcionan, perdiendo por lo tanto toda su actividad, así como la energía que
empleó la célula para formarlas, sin embargo, esto es el menor de los problemas
si se compara con la otra posibilidad.
👉
Alteración funcional, las sustancias actúan en otro lugar causando una
consecuencia diferente de la original, esto generalmente es muy malo, por
ejemplo, en las enzimas pancreáticas que van al duodeno, si su blanco es
equivocado ya sea en lugar o en ritmo provoca serias úlceras. En algunas
ocasiones estos errores pueden acusar algunas novedades evolutivas, por
ejemplo, las hipótesis para la formación de la cascada de coagulación dependen
de este tipo de errores. La correcta señalización y envío a un blanco de
vesícula se logra mediante una serie de proteínas cuyas estructuras básicas se
encuentran relacionadas con el músculo, sin embargo, eso lo veremos en el
siguiente artículo.
11.4.
Transportando una vesícula en
el citoplasma
Una vez liberada la vesícula su movimiento
hacia el blanco no es estocástico “al azar”, sin embargo, para entender esto
debemos alterar fundamentalmente el modo en que imaginamos el citoplasma de la
célula. Normalmente lo visualizamos como un gel acuoso con materiales disueltos
y flotando. Esto no es del todo cierto, el citoesqueleto no solo se encuentra
dándole forma a la membrana, también se extiende hacia el interior de la
célula, formando autopistas de transporte. Dichas autopistas están
formadas por carriles de actina, la misma proteína del sarcómero. Al ser actina
posee dominios para insertarse a una proteína con dos cabezas móviles como
manos, en el transporte esta proteína es la familia dineina o quinesina,
homólogas a la miosina del sarcómero.
La dineina y sus homólogas operan bajo el
mismo principio de la miosina "por eso son homólogas", es una
proteína dependiente de la energía suministrada por el ATP. La dineina posee un
dominio que se ancla a la cota o lo que quede de la cota alrededor de la
vesícula y como si fuera una grúa o un globo la mueve de un organelo a otro.
Las células que presentan la mejor de estas autopistas y sistemas de transporte
son las neuronas, en estas células los organelos de síntesis como el aparato de
Golgi se encuentra a centímetros de distancia de las puntas de sus citoplasma
llamados dendritas, distancias que para una célula son enormes.
Cuando la vesícula se acerca a la membrana
receptora las proteínas de la superficie de ambas membranas deben acoplarse
entre sí, una vez hecho esto se genera una fuerza de acercamiento entre las
superficies de lípidos, al ser estos fluidos y vibrantes se fusionan sin mayor
esfuerzo, permitiendo la fusión de membranas y la descarga de materiales.
11.5.
Grúas moleculares
Son moléculas que anclan las vesículas al
citoesqueleto, son típicas en el sentido de que el dominio que genera el movimiento
es semejante a dos piernas que caminan.
👉 Dineina: La dineína es, junto con la kinesina, la proteína motora más
importante asociada a los microtúbulos. Proteína enorme, 9 a 10 cabezas
grandes, globulares, generadoras de fuerza. La dineína se mueve hacia el
"extremo menos" (Minus End) del microtúbulo (movimiento
retrógrado). La dineína es clave en el transporte retrógrado de sustancias en
la célula. Este hecho reviste gran importancia en el axón neuronal, y en el
movimiento de cilios y flagelos. Generador de fuerza para el movimiento del
cromosoma durante la mitosis.
Típicamente ha sido estudiado en
fragmentos celulares ricos en microtúbulos y con un transporte vesicular
altamente ordenado y frecuente: esto es, en los axónes de neuronas, más frecuentemente
en el calamar gigante. Las técnicas más empleadas para su estudio han sido: las
puramente morfológicas, como la microscopía electrónica de barrido o de
transmisión; las bioquímicas, como la electroforesis; las biofísicas, como la
trampa óptica; las de inmunomarcaje por fluorescencia o enzimas; y las
genéticas, por deleción de dominios proteicos o mediante animales knockout.
La dineína es una molécula de estructura
similar a la kinesina: consta de dos cadenas pesadas idénticas que conforman
dos cabezas globulares y de un número variable de cadenas intermedias y de
cadenas ligeras. Se sugiere que la actividad de hidrólisis de ATP, fuente de
energía de la célula, se encuentra en las cabezas globulares. La dineína
transporta vesículas y orgánulos, por lo que debe interaccionar con sus
membranas, y, para interactuar con ellas, requiere de un complejo proteico, de
cuyos elementos cabe destacar la dinactina. Además de las dineínas
citoplasmáticas antes descritas, las dineínas axonémicas son cruciales en
el mantenimiento de la estructura y funcionalidad de los flagelos.
Estructuralmente, las dineínas del axonema son más complejas que las
citoplasmáticas.
La importancia de la dineína radica en su
relación directa con el movimiento de los cilios y los flagelos. Encontramos la
parte basal de la dineína unida a un microtúbulo, y la cabeza unida a otro
microtúbulo que conforma el par adyacente. En este caso el movimiento de la
dineína axonémica se ve frustrado pues los pares de microtúbulos que conforman
el axonema están anclados mediante una proteína denominada nexina. De este modo
un par de microtúbulos se desliza sobre el otro provocando que toda la
estructura del axonema se doble. La regulación del movimiento coordinado de
cilios y flagelos es todavía un terreno desconocido.
👉 Quinesina: Las kinesinas, quinesinas o cinesinas (YouTube) son una familia de proteínas
motoras que median el transporte intracelular anterógrado sobre los microtúbulos,
que son componentes del citoesqueleto. La palabra kinesina etimológicamente
proviene del griego kinetos que significa móvil. Típicamente ha sido estudiado
en fragmentos celulares ricos en microtúbulos y con un transporte vesicular
altamente ordenado y frecuente: esto es, en los axones de neuronas, más
frecuentemente en el calamar gigante. Las técnicas más empleadas para su
estudio han sido: las puramente morfológicas, como la microscopía electrónica
de barrido o de transmisión; las bioquímicas, como la electroforesis; las
biofísicas, como la trampa óptica; las de inmunomarcaje por fluorescencia o
enzimas; y las genéticas, por deleción de dominios proteicos o mediante
animales knockout.
La kinesina I es un dímero de dos cadenas
pesadas, cada una de las cuales está asociada a una cadena liviana, con un peso
molecular total de 380.000 Da. Consta de dos dominios cabeza, globulares, un
tallo central y un par de dominios cola, también globulares pero más pequeños.
El dominio cabeza posee la actividad ATPasa y une los microtúbulos, y el
dominio cola reconoce a la membrana lipídica de las vesículas a transportar,
probablemente por mediación de las cadenas ligeras.
La mayoría de las kinesinas intervienen en
el transporte anterógrado de vesículas, es decir, que implican un movimiento
hacia la parte más distal de la célula o la neurita, hacia el extremo (+) de
los microtúbulos, sobre los que se desplazan. Por el contrario, otra familia de
proteínas motoras, las dineínas, emplean los mismos rieles, pero dirigen las
vesículas a la parte más proximal de la célula, por lo que su transporte es
retrógrado. En neuronas los extremos positivos de los microtúbulos se dirigen
hacia las terminales sinápticas.
11.6.
Endocitosis
La endocitosis es el proceso por el cual
una célula cuya membrana externa es flexible rodea a otra partícula, puede ser
otra célula u sustancia química, cuando termina de rodearla genera una vesícula
interna llamada endosoma. La endocitosis puede dividirse en dos categorías
principales, la endocitosis no específica y la endocitosis específica. La
endocitosis no específica también denominada pinocitosis engloba fluidos y todo
material que se encuentre diluido en este.
La endocitosis específica también se denomina endocitosis mediada por receptores. En este caso la célula o partícula debe tener una serie de proteínas en si membrana que sirven como marcadores de reconocimiento. La célula que va a realizar la endocitosis también tiene otras proteínas que sirven como reconocedores. Cuando ambos marcadores entran en contacto íntimo activan a la célula que realiza la endocitosis para iniciar el proceso.
Figura 11.5.
Endocitocis. Izquierda, endocitocisis no específica o
pinocitosis; derecha, endocitosis específica mediada por receptores que
interactúan con el citoesqueleto.
Independientemente del tipo de
endocitosis, el resultado final es un endosoma, es decir una vesícula del sistema
de membranas internas de la célula eucariota. Esta vesícula y su contenido
pueden sufrir diferentes destinos dependiendo del contexto, ya sea en el
sistema inmune, en la digestión celular o como una manipulación de
endoparásitos para atacar a la célula.
11.7. Fagocitosis
Figura 11.6.
Fagocitosis. La fagocitosis involucra la endocitosis
de sustancias en una vesícula o endosoma que luego se fusiona con otras
vesículas portadoras de enzimas digestivas, la absorción de los componentes de
interés y la exocitosis de los desechos.
La fagocitosis se puede definir
literalmente como un tipo de digestión interna por parte de una célula, y
probablemente sea la primera digestión interna que existió. La fagocitosis es
un proceso más complejo que la endocitosis, aunque muchas veces empleamos estos
dos términos de manera indiferenciada. Sin embargo, la diferencia está en el
tratamiento que recibe el material endocitado, en la fagocitosis en endosoma
“llamado en este caso fagosoma” recibe un tratamiento más complejo, poco
después de que el fagosoma ingresa a la célula este se fusiona con otra
vesícula llamada lisosoma. Los lisosomas son vesículas que contienen las
enzimas digestivas y otras sustancias químicas que degradan a la víctima.
Cuando el fagosoma se fusiona con el
lisosoma se forma un fagolisosoma, las enzimas digestivas y las otras
sustancias químicas oxidantes empiezan a degradar a la víctima transformándola
en sus componentes básicos. Una vez se han degradado, los componentes básicos
que se extraen de allí serán absorbidos por los mecanismos de transporte a
través de membrana dependiendo de la naturaleza del nutriente liberado. Este
modo de alimentación es muy común en los eucariortes de vida libre unicelulares
como las amebas. En los eucariotes multicelulares, especialmente en los
animales la fagocitosis cumple una función inmune más que de nutrición.
Muchas células del sistema inmune como los
monocitos activados pueden fagocitar activamente a otras células para mantener
seguro al organismo. Sin embargo, a pesar de esta pequeña escala, la
fagocitosis nos muestra todos los pasos que intervienen en una digestión
interna: (1) captura de la presa en un compartimiento especializado; (2)
digestión de la presa por parte de enzimas líticas y otras sustancias químicas
oxidantes; (3) absorción de los nutrientes y procesamiento de estos
integradolos a alguna ruta metabólica o bioquímica; (4) eliminación de los
desechos que no fueron absorbidos. Aunque ya hemos hablado fuertemente de los
puntos (2) enzimas líticas, (3) absorción y someramente del (1) captura “del
cual se hablará más específicamente en ecología”. Aún no hemos hablado del (4)
eliminación.
La eliminación es el proceso en el cual se
desechan compuestos que no fueron absorbidos y que nunca fueron parte de las
rutas metabólicas del ser vivo. Otro proceso parecido es el de excreción en el
cual se desechan compuestos químicos que hicieron parte de las redes
metabólicas y que potencialmente podrían detenerlas de mantenerse en el cuerpo.
11.8.
Exocitosis
La fusión de una vesícula de transporte
con la membrana externa y la subsecuente descarga de su contenido se denomina
exocitosis. La exocitosis probablemente ocurre de forma continua en la mayoría
de las células, especialmente las que poseen una función glandular. Sin
embargo, el caso que más se ha estudiado de la exocitosis ha sido la descarga
de los neurotransmisores en la sinápsis neuronal, la cual de hecho puede ser
señalada como una función glandular paracrina. En las neuronas la grúa
molecular compuesta por dineina o quinesina se para antes de llegar a la
membrana plasmática en la punta de la dendrita, justo en la sinapsis neuronal.
Esto permite acumular muchas vesículas a la espera de una señal que les permita
reiniciar su recorrido hasta la fusión de membranas.
La señal por lo general es la liberación
de iones calcio(2+), estos iones permiten que miosina cambie a su posición
activa, como si fuera un semáforo o una bandera de arranque los iones
calcio(2+) permiten que la grúa molecular continúe avanzando hacia la membrana.
Es probable que la exocitosis en otras glándulas ocurra por mecanismos
análogos, sinembargo la neurona simplemente es el caso más estudiado. Una vez
allí las proteínas restantes de la cota se acoplan con los receptores internos
de la membrana plasmática fusionando las membranas. En algunos casos cuando la
vesícula abre hacia el medio externo retrocede después de descargar sus
materiales, pero n la mayoría de los casos la vesícula se fusiona totalmente
con la membrana externa.
12. Referencias bibliográficas
Alberts, B.,
Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P.
(2015). Molecular biology of the cell (5a ed.). Garland Science.
Belk, C., & Maier, V. B.
(2013). Biology Science for Life with physiology. (Pearson, Ed.) (4a
ed.).
Campbell, M. K., &
Farrell, S. O. (2009). Biochemistry (6a ed.). USA: Thomsom Brooks/Cole.
Cole, K. S. (1972). Membranes,
ions and impulses: a chapter of classical biophysics (Vol. 5). Univ of
California Press.
Coskun, Ü., & Simons, K.
(2010). Membrane rafting: from apical sorting to phase segregation. Febs
Letters, 584(9), 1685–1693.
Cox, M. M., Doudna, J. A.,
& O’Donnell, M. (2012). Molecular biology (1a ed.). Freeman.
CRB. (1906). The Dynamics of
Living Matter. Botanical Gazette, 41(6), 449–450.
Danielli, J. F., & Davson,
H. (1935). A contribution to the theory of permeability of thin films. Journal
of Cellular Physiology, 5(4), 495–508.
Davson, H., & Danielli, J.
F. (1943). The permeability of natural membranes. The permeability of
natural membranes.
Edidin, M. (2003). Lipids on
the frontier: a century of cell-membrane bilayers. Nature Reviews Molecular
Cell Biology, 4(5), 414–418.
Frye, L. D., & Edidin, M.
(1970). The rapid intermixing of cell surface antigens after formation of
mouse-human heterokaryons. Journal of cell science, 7(2),
319–335.
Glynn, I. M., Hoffman, J. F.,
& Lew, V. L. (1971). Some’partial reactions’ of the sodium pump. Philosophical
Transactions of the Royal Society of London B: Biological Sciences, 262(842),
91–102.
Gorter, E., & Grendel, F.
(1925). On bimolecular layers of lipoids on the chromocytes of the blood. The
Journal of experimental medicine, 41(4), 439.
Gupta, G., & Surolia, A.
(2010). Glycosphingolipids in microdomain formation and their spatial
organization. FEBS letters, 584(9), 1634–1641.
Hamlyn, J. M., Harris, D. W.,
Clark, M. A., Rogowski, A. C., White, R. J., & Ludens, J. H. (1989).
Isolation and characterization of a sodium pump inhibitor from human plasma. Hypertension,
13(6 Pt 2), 681–689.
Hoefnagels, M. (2015). Biology:
concepts and investigations (3a ed.). McGraw-Hill New York.
Jacobs, M. H. (1962). Early
osmotic history of the plasma membrane. Circulation, 26(5),
1013–1021.
Jørgensen, P. L. (1974).
Isolation and characterization of the components of the sodium pump. Quarterly
reviews of biophysics, 7(2), 239–274.
Karp, G. C. (2013). Cell
and Molecular Biology, Concepts and Experiments (7a ed.). USA: Wiley Online
Library.
Kleinzeller, A. (1997). Ernest
Overton’s contribution to the cell membrane concept: a centennial appreciation.
Physiology, 12(1), 49–53.
Kuhn, T. S. (1970). The
structure of scientific revolutions, 2nd. Chicago: Univ. of Chicago Pr.
Lakatos, I. (1978). The
methodology of scientific research programmes. Cambridge University Press.
Latorre, R. (1996). Biofísica y fisiología celular.
Universidad de Sevilla.
Leabu, M. (2013). The still
valid fluid mosaic model for molecular organization of biomembranes:
accumulating data confirm it. Discoveries, 1(1), e7.
Ling, G. (2007). History of
the membrane (pump) theory of the living cell from its beginning in mid-19th
century to its disproof 45 years ago--though still taught worldwide today as
established truth. Physiological chemistry and physics and medical NMR, 39(1),
1.
Ling, G. N. (2001). Life at
the cell and below-cell level: The hidden history of a fundamental revolution
in biology. Pacific Press New York, NY, USA:
Lipnick, R. L. (2013). Studies
of narcosis: charles ernest overton. Springer Science & Business Media.
Mackean, D. G., & Hayward,
D. (2014). Biology (3a ed.). IGCSE Cambridge.
Mader, S. S. (2010). Biology
(10a ed.). McGraw-Hill Education.
Mader, S. S., &
Windelspecht, M. (2015). Biology (12a ed.). McGraw-Hill Education.
Mason, E. A. (1991). From pig
bladders and cracked jars to polysulfones: an historical perspective on
membrane transport. Journal of membrane science, 60(2–3),
125–145.
Mason, K. A., Losos, J. B.,
Singer, S. R., & Raven, P. H. (2014). Biology (7a ed.). McGraw-Hill
New York.
Morange, M. (2013). What
history tells us XXX. The emergence of the fluid mosaic model of membranes. Journal
of biosciences, 38(1), 3–7.
Mueller, P., Rudin, D. O.,
Tien, H. T., & Wescott, W. C. (1962). Reconstitution of excitable cell
membrane structure in vitro. Circulation, 26(5), 1167–1171.
Murray, R. K., Bender, D. A.,
Botham, K. M., Kennelly, P. J., Rodwell, V., & Weil, A. (2012). Harpers
Illustrated Biochemistry (29a ed.). McGraw-Hill Medical.
Pollard, T. D., Earnshaw, W.
C., Lippincott-Schwartz, J., & Johnson, G. T. (2017). Cell Biology (3a
ed.). Elsevier.
Quinton, P. M., Wright, E. M.,
& Tormey, J. M. (1973). Localization of sodium pumps in the choroid plexus
epithelium. The Journal of cell biology, 58(3), 724.
Reece, J. B., Urry, L. A.,
Wasserman, S. A., Cain, M. L., Minorsky, P. V, & Jackson, R. B. (2014). Campbell
Biology (10a ed.). Pearson Higher Ed.
Repke, K. R. H., &
Schönfeld, W. (1984). Na+/K+-ATPase as the digitalis receptor. Trends in
Pharmacological Sciences, 5, 393–397.
Rinzel, J. (1990). Discussion:
Electrical excitability of cells, theory and experiment: Review of the
Hodgkin-Huxley foundation and an update. Bulletin of Mathematical Biology,
52(1–2), 5–23.
Sadava, D., Berenbaum, M.,
& Hillis, D. (2014). Life the Science of Biology (10a ed.). Sinauer
& MacMillian.
Simon, E. J., Dickey, J. L.,
& Reece, J. B. (2013). Essential biology (Pearson).
Singer, S. J., & Nicolson,
G. L. (1972). The fluid mosaic model of the structure of cell membranes. Membranes
and Viruses in Immunopathology; Day, SB, Good, RA, Eds, 7–47.
Solomon, E., Martin, C.,
Martin, D. W., & Berg, L. R. (2014). Biology (10a ed.). Cengage
Learning.
Sourkes, T. L. (1955). Moritz
Traube, 1826-1894: His Contribution to Biochemistry. Journal of the history
of medicine and allied sciences, 379–391.
Starr, C., Evers, C., & Starr,
L. (2013). Biology: Today and Tomorrow With Physiology (4a ed.).
Brooks/Cole.
Szymanski, W. G.,
Kierszniowska, S., & Schulze, W. X. (2013). Metabolic labeling and membrane
fractionation for comparative proteomic analysis of Arabidopsis thaliana suspension
cell cultures. JoVE (Journal of Visualized Experiments), (79),
e50535–e50535.
Tien, H. T., Carbone, S.,
& Dawidowicz, E. A. (1966). Formation of “black” lipid membranes by
oxidation products of cholesterol. Nature, 212(5063), 718–719.
Tien, H. T., & Diana, A.
L. (1967). Some physical properties of bimolecular lipid membranes produced
from new lipid solutions. Nature, 215(5106), 1199–1200.
Weaver, R. F. (2012). Molecular
biology (5a ed.). McGraw-Hill Education.
Yeagle, P. L. (1993). The membranes of cells. 2nd. San Diego: Academic
Press.













































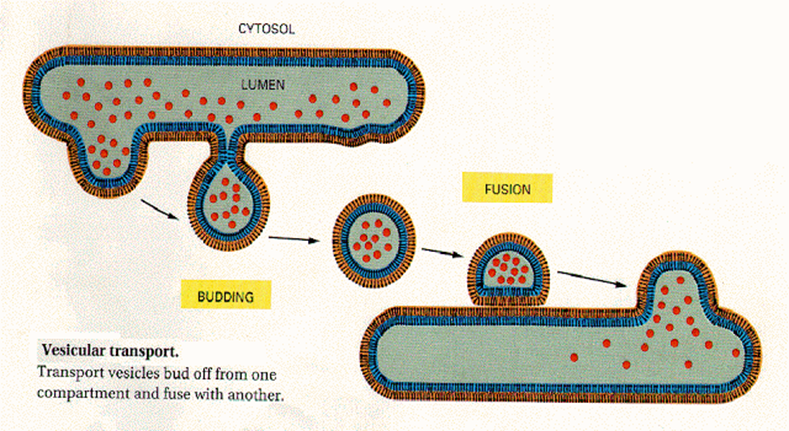




No hay comentarios:
Publicar un comentario