Indice
Portada
1. Introducción
|| Regresar al Índice ||
Debo iniciar este capítulo rememorando un
poco la historia de este blog, básicamente esto debería ser un anexo de la
discusión sobre el sistema circulatorio bajo el título, “el sistema
circulatorio como tejido” sin embargo la información relevante sobre la sangre
y otros fluidos vitales es demasiado extensa, por lo que decidí asumirlo más
bien como un sistema aparte, digno de su propio capitulo. El objeto primordial
de este capítulo es evidentemente la sangre de los vertebrados en general y de
los seres humanos en particular, sin embargo, para entender el funcionamiento
de la sangre es conveniente hacer un contraste con otros fluidos vitales, no
solo de los propios mamíferos, sino de todos los seres vivos. La sangre en ese
punto de vista es solo uno de muchos fluidos internos vitales, o lo que
Christian de Duve llamaba el mileau interior (De Duve & Pizano, 1995), fluidos sin los cuales es imposible entender el funcionamiento de
la vida misma, y de los cuales el primero que conocemos es la sangre, nuestro
propio fluido. Pero antes de eso, la presente sección estará dedicada
primordialmente a la historia del estudio de la sangre, después de todo al ser
nuestro propio fluido vital, fue el primero en ser estudiado.
Max Ferdinand Perutz
(19 de mayo de 1914 - 6 de febrero de
2002) fue un biólogo molecular británico nacido en Austria, que compartió el
Premio Nobel de Química de 1962 con John Kendrew, por sus estudios de las estructuras de la hemoglobina y la
mioglobina.
Luego ganó la Medalla Real de la Royal
Society en 1971 y la Medalla Copley en 1979. En Cambridge, fundó y presidió
(1962-1979) el Laboratorio de Biología Molecular (LMB) del Consejo de
Investigación Médica (MRC), catorce de los cuales los científicos han ganado
premios Nobel. Las contribuciones de Perutz a la biología molecular en
Cambridge están documentadas en The
History of the University of Cambridge: Volume 4 (1870 a 1990) publicado
por Cambridge University Press en 1992.
2. Historia del estudio de la sangre
|| Regresar al Índice ||
Debido a su importancia para la vida
humana la sangre ha sido asociada a una enorme cantidad de creencias rituales.
Una de las más básicas es emplear la sangre como un símbolo de relaciones de
parentesco; estar relacionado sanguíneamente implica que los miembros comparten
ancestros comunes en oposición a los parentescos maritales por matrimonio. Las
referencias míticas de la sangre se encuentran relacionadas con sus propiedades
vitales como en el nacimiento, en la cacería o en la batalla, tres eventos de importancia
vital para nuestros ancestros. Por lo que no es de extrañar que a lo largo de
los milenios de las culturas que han dejado legado en la nuestra, se hubieran
entretejido muchos mitos y leyendas alrededor de la sangre, entre las cuales,
tal vez la más relevante al interior de la cultura popular es el mito del
vampiro (Prewitt, 1992).
2.1 Las sangrías como fenómeno
más arcaico
En el mundo antiguo era razonable suponer que, si la sangre era el alma y por lo tanto la parte más importante de nuestro organismo, debía ser asiento favorito de los espíritus malignos. Y una forma apropiada de echarlos para afuera y hacer sanar al enfermo, era extrayéndole una buena cantidad de sangre. Todas las civilizaciones, desde los tiempos más antiguos, utilizaban la sangría; los babilonios y los egipcios, al igual que los hindúes, los chinos y los aztecas, así como otros amerindios, con frecuencia la practicaban y practican hasta la fecha en algunas regiones “Norte América, Amazonas, Perú”.
Figura 2.1. Las
sanguijuelas han sido un método común de extracción de sangre por miles de
años.
Los mayas precolombinos realizaban
sangrías como un mecanismo de “perdón” a los dioses para que estos le
restituyeran la salud. Ciertas tribus norteamericanas “los Dakotas, por
ejemplo”, realizan procedimientos curativos a base de aplicación de ventosas,
la sangría, el uso del humo y los baños de vapor. Los hechiceros americanos
combinaron tratamientos “mágicos” con medicina “natural”, asociando el uso de
hierbas, sustancias minerales, productos animales y sangrías, enemas y
emplastos, con actos mágico-religiosos del tipo de las danzas rituales y las
ofrendas (Adams, 1989; Newquist, 2012).
2.2 Los
cuatro humores griegos
En la época de
Hipócrates, los griegos habían desarrollado un sistema interpretativo del
mecanismo de producción de las enfermedades, basado en la teoría de los cuatro
humores orgánicos. Puede reconstruirse claramente el camino que llevó al
pensamiento griego a este sistema médico: la idea de que el universo está
formado por cuatro elementos básicos (agua, aire, fuego y tierra), cada uno de
ellos caracterizado por una cualidad específica (humedad, sequedad, calor,
frío); la teoría de los contrarios (con especial hincapié en el número cuatro),
que sostenía que entre los elementos opuestos debe conservarse un equilibrio
para mantener la armonía de los cosmos y la salud en el microcosmos que es el
hombre; los efectos producidos por las estaciones del año, que inicialmente
eran tres y no cuatro, sobre el cuerpo y la mente; las secreciones orgánicas,
que eran al principio tres (sangre, flema y bilis) y luego se transformaron en
cuatro, al diferenciarse entre bilis negra y bilis amarilla (Góngora-Biachi, 2005).
¿Y de dónde
sacaron eso de los cuatro humores si cuando nos cortamos lo que sale es sangre?
Cuando la sangre se la coloca en un contenedor de vidrio y se la deja
inalterada por al menos una hora, esta se separa en cuatro capas debido a que
sus componentes internos se separan por densidad, es básicamente lo que hacemos
con la centrifugadora, y cuyos detalles discutiremos a fondo en secciones
futuras. Por el momento solo nos enfocaremos en una descripción desde el punto de
vista de un filósofo natural antiguo, que observaría la formación de cuatro
capas. La capa más densa de plaquetas coaguladas que se depositaria en el fondo
se denominó como la bilis negra, posteriormente tenemos los glóbulos rojos
suspendidos en agua formando la capa que fue denominada como “la sangre”,
encima de ella una muy delgada y hasta tenue capa blanca y lechosa de glóbulos
blancos que fue denominada “flema” y por encima, una capa amarilla de suero que
fue denominada “bilis amarilla” (Hart, 2001). Por último, hacía falta alguna hipótesis
general que integrara todos estos conceptos, porque, como dice el premio Nóbel
Peter Medawar, “La ciencia, sin el apoyo de las hipótesis, es sólo arte
culinario” (Góngora-Biachi, 2005).
Si estos “humores” se encuentran en equilibrio, el cuerpo goza de salud; en cambio, el exceso o defecto de alguno de ellos produce la enfermedad. Las teorías humorales de los primeros filósofos griegos fueron utilizadas por Galeno (129 a.C.-200 a.C.) para explicar las enfermedades crónicas. Aunque tal perspectiva nos puede parecer risible en la actualidad, hay que recordar que Galeno fue un médico de batalla, por lo que sus aportes prácticos se dieron más en el tratamiento de heridas y problemas muy agudos, mientras que las enfermedades crónicas obedecen a causas completamente diferentes, Galeno debió ser quien iniciara una edad de raciocinio, pero en lugar de ello fue elevado a un pedestal en el cual, lo que el propuso permaneció con pocas alteraciones por poco menos de un milenio. Los cuatro humores fundamentales (sangre, flema, bilis amarilla y bilis negra), responsables de la salud y de la enfermedad, le sirvieron de base para clasificar los temperamentos en cuatro tipos: flemáticos, sanguíneos, coléricos y melancólicos. Estos términos se utilizan todavía hoy para designar el carácter de una persona. Galeno ha sido probablemente el autor que más ha influido en el desarrollo de la Medicina.
Figura 2.2. Relación entre
los elementos clásicos y los humores.
Para la
fisiología galénica, la sangre se forma continuamente en el hígado a partir de
los alimentos ingeridos, después de haber sufrido una primera elaboración en
los intestinos. A través de la vena porta, los alimentos en forma de quilo van
al hígado. Aquí, mediante una segunda elaboración, el quilo se transforma en
sangre nutricia y continúa siendo transformada por los demás órganos, que la
purifican y preparan a cumplir sus funciones nutricias. El bazo retira los
residuos terrosos y el riñón retira los residuos acuosos. Una vez preparada, la
sangre venosa discurre por las venas a la periferia, donde termina su recorrido
al transformarse directamente en parénquima. La sangre venosa, que desde el
hígado pasa al corazón, ingresa por el ventrículo derecho e inmediatamente pasa
al izquierdo, a través de comunicaciones interventriculares, para mezclarse con
el aire que ingresa por la traquearteria hasta este punto, donde ocurre la
neumatosis. Desde el ventrículo izquierdo, una vez transformada en sangre vital,
corre a través de las arterias llevando el calor innato. En la periferia se
enfría y se coagula para transformarse en cada uno de los tejidos a los que
llegó, con lo que termina su recorrido. Este concepto sobre la composición y
movimiento de la sangre permaneció prácticamente sin cambios por más de
diecisiete siglos (Izaguirre-Ávila & de
Micheli, 2005). Durante cerca de 15 siglos sus trabajos
fueron la autoridad indiscutible (Góngora-Biachi, 2005).
Hipócrates
recomendaba la sangría terapéutica cerca del órgano enfermo para eliminar los
humores excesivos localizados ahí (efecto derivativo) y también lejos del
órgano enfermo para evitar que continuasen llegando a él dichos humores
(efectos revulsivos) (Mory, Mindell,
& Bloom, 2000). La sangría derivativa no debía ser
necesariamente copiosa y se acostumbraba practicarla con sanguijuelas o
ventosas. La del tipo revulsivo era más abundante y se efectuaba por medio del
cuchillo (flebotomía). Galeno utilizó con frecuencia las sangrías, basándose en
la teoría de los cuatro humores, pero fue el primero en advertir acerca de las
precauciones que había que considerar en cuanto a la cantidad de sangre
extraída (Góngora-Biachi, 2005), después de todo era un médico de
batalla, no un filósofo, por lo que con prudencia decidía anteponer la
experiencia al mero razonamiento filosófico.
2.3 El
renacimiento y más desangramiento
En el Renacimiento las sangrías fueron utilizadas sin discriminación, sobre todo en las enfermedades infecciosas y de ahí en adelante se mantuvo el criterio de sangrar en forma copiosa cerca del sitio de la enfermedad y aún se estipuló la sangría total para las fiebres, por medio de la aplicación de sanguijuelas en todo el cuerpo (10 a 50 para los casos comunes). Como hasta el siglo XIX no se tuvo una idea precisa de la relación directamente la pérdida de sangre y la disminución del volumen sanguíneo, no era raro que ocurriesen accidentes con el abuso de la sangría, generalmente atribuidos a la misma enfermedad (Góngora-Biachi, 2005).
Figura 2.3. Louis XV desangrado por sus médicos.
Así, no se sabe
bien si la viruela hubiese matado por si sola a Louis XV de Francia. Sus
médicos (parece que eran seis, auxiliados por cinco cirujanos y tres boticarios)
le propusieron tres sangrías, pero el rey aceptó solamente dos porque temía
debilitarse demasiado. Y para no violar los preceptos terapéuticos y al mismo
tiempo exceder a la petición real, sólo se le practicaron dos, aunque la
segunda fue de doble cantidad. La actividad sangradora de los médicos franceses
en la primera mitad del siglo XIX, capitaneados por Broussais, un cirujano
militar agresivo, llegó a extremos pocos creíbles. En el año 1830, tuvieron que
ser importadas a Francia 41 millones de sanguijuelas, mientras que diez años
antes bastaban dos o tres millones para satisfacer todas las demandas (Góngora-Biachi, 2005).
2.4 El
consumo de la sangre
El consumo de la sangre como fuente de alimento ha sido un aspecto de suma importancia en muchas religiones. Por un lado, era común sacrificar a los dioses animales de granja, donde se asumía que la sangre derramada y/o quemada servía de alimento para los dioses que se fortalecían con los holocaustos, o simplemente servían para apaciguar su divina ira. El consumo humano de la sangre es posible, de hecho algunas tribus africanas como los Masai Mara viven de la sangre de su ganado cuando las condiciones duras de las estaciones secas no dejan más opciones, y no pueden permitirse matar al ganado (Suárez, Rojas, & Miranda, 2009).
Figura 2.4. En áfrica, la
sangre es una fuente común de hierro y proteína.
Plinio el viejo,
relata que el circo romano, alrededor del año 100 de nuestra era, la gente se
lanzaba a la arena a beber la sangre de los gladiadores moribundos y adquirir
así su fuerza y su valor. Entre grupos étnicos de Asia y Meseoamérica de hace
2,000 años, es frecuente encontrar la descripción de la ingesta de sangre
humana de los enemigos y también de algunos animales para adquirir fortaleza y,
en su caso, las buenas cualidades de los animales. Esta costumbre de ingerir
sangre de animales, hasta hace unos pocos años -y quizá hasta estas fechas del
año 2005- era practicada en el rastro de la ciudad de Mérida, Yucatán y en las
corridas de toros de las poblaciones del interior de este estado mexicano. Por
supuesto una manera más sutil de ingerir sangre es a través de un buen taco de
“morcilla” (sangre cocida y condimentada, alimento popular en México, Colombia
y algunos otros países latinoamericanos) (Góngora-Biachi, 2005).
Sin embargo, la
tradición judeocristiana con respecto a la sangre es la de un tabú. En el
judaísmo, en el Islam y en ciertas denominaciones cristianas como los testigos
de Jehová y los adventistas, se considera tabú el consumo de sangre, carne
sangrienta o alimentos que contengan sangre como ingrediente. En la Biblia, en
el libro V de Moisés (Deuteronomio 12:23), se rechaza el consumo de sangre
debido a que es fuente de vitalidad. Esta prohibición se repite en la Torá y en
el (Levítico 7:26-27). Al igual que el caso del tabú de la carne de cerdo, el
hecho de que el tabú de comer sangre aparezca en la Biblia no ha bastado para
extenderlo entre los cristianos (aunque habitualmente sí existe un tabú
cultural). Sin embargo, existen indicios de que esta prohibición era respetada
por los primeros cristianos (Hechos 15:19-21).
En el Corán la
prohibición se puede leer en la (Sura 5.4). Para respetar este tabú, en los
faenamientos existen métodos especiales y personas especializadas (judaísmo:
Shojet, ‘matarife’) encargadas de «purificar» la carne eliminando todo rastro
de sangre para que pueda ser ingerida de acuerdo con las reglas de cada
religión (Latzer, Witztum, & Stein,
2008). En el Corán existen prohibiciones explícitas
acerca de la ingesta de sangre (Razi, Bd.): se menciona repetidamente que el
sacrificio de los animales debe ir acompañado de un degüello, que elimina los
rastros de sangre en sus venas.23 No obstante, la prohibición del Corán se
refiere directamente sólo a la “sangre derramada”, lo que se puede entender
como la sangre que brota.
Por razones diferentes a la religión, en algunos países de la Unión Europea está prohibido vender sangre líquida, alegando razones de salud pública. Este fenómeno ha hecho que algunos platos tradicionales como el sanguinaccio dolce (extraña mezcla de chocolate con sangre de cerdo) de la cocina de Nápoles quedara relegado casi al olvido (Dalla Bona, 2004) (Figura 2.5). Sin embargo, el consumo de sus subproductos procesados en forma de embutido (morcillas, black pudding, etcétera) está muy extendido y es altamente popular. En Galicia es tradicional comer durante la matanza del cerdo, filloas hechas con su sangre. En la región sur de México es muy consumida la moronga, un embutido hecho con sangre de cerdo y especias mientras que en Colombia la rellena es infaltable en platos típicos como la fritanga.
Figura 2.5. Sanguinaccio dolce.
Figura 2.6. La rellena.
2.5 William Harvey y la edad de
la razón
El renacimiento es un tiempo de múltiples contrastes, por un lado, muchos cultos religiosos “o partes importantes de ellos” mantenían creencias medievales junto con los pobladores poco entendidos, pero, por otra parte, los filósofos naturales irrumpen tratando de llevarse para sí y para el estudio naturalista cosas que habían sido vistas como parte del misticismo, lo cual generó evidentes tensiones entre la luz de la razón y la oscuridad de las creencias locales en todo el mundo.
Figura 2.7. William Harvey
(1 de abril de 1578 - 3 de junio de 1657) fue un médico inglés a quien se le
atribuye describir correctamente, por primera vez, la circulación y las
propiedades de la sangre al ser distribuida por todo el cuerpo a través del
bombeo del corazón. Este descubrimiento confirmó las ideas de René Descartes,
que en su libro Descripción del cuerpo humano había dicho que las arterias y
las venas eran tubos que transportan nutrientes alrededor del cuerpo. Así
mismo, en 1651 mencionó por primera vez el concepto de ovocito mediante la
sentencia latina «ex ovo omnia» (Todo procede de un huevo). No lo
observó como tal, pero fue el primero en sugerir que los seres humanos y otros
mamíferos albergan una especie de “huevo” que contiene al individuo sucesor;
teoría criticada por la comunidad científica del momento.
Con la obra de
William Harvey (1578-1657) cambia el concepto, no sólo sobre el movimiento de
la sangre, sino también sobre su composición. De Motu Cordis (Harvey, 1959), además de ser el primer tratado sobre la
circulación sistémica, es también el primer tratado sobre la composición y
funciones del líquido hemático. La función del corazón existe sólo para un fin:
enviar la sangre a los tejidos para llevar el pneuma, tanto nutricio como vital. Así, se requiere de la mecánica para que pueda
cumplirse el vitalismo. La función del corazón sólo se entiende a través del
servicio que presta a la sangre para impulsarla. La sangre líquida es quien
lleva la vida, pero el corazón es necesario para moverla. En el capítulo VII
del De Motu
Cordis, Harvey explica la
razón de la circulación sanguínea (Izaguirre-Ávila & de
Micheli, 2005):
"El movimiento de la sangre
nutre, da calor y vigoriza todas las partes, al llevarles sangre más caliente,
más perfecta, más vaporosa y espirituosa y aún diría yo, más aumentativa. En
las partes (órganos) sucede lo contrario: la sangre se enfría, se espesa, y por
decirlo así, tiene que volver al principio, o sea el corazón, al cual regresa
como a la fuente u hogar del cuerpo, para recuperarse. Allí, por el calor
natural, potente cuanto impetuoso tesoro de vida, vuelve a licuarse y a
preñarse de espíritus (que es como si dijésemos de un bálsamo), para volver a
ser distribuida."
En estas palabras
queda implícito que la sangre debe mantenerse líquida para cumplir su función,
que esta fluidez se debe al calor innato originado en el corazón, que debe
volver a este punto para transformarse nuevamente en vital, gracias a la
neumatosis, y que en la periferia tiene una tendencia natural a coagularse. El
corazón adquiere relevancia porque se considera el sitio en que ocurre la
mezcla de la sangre con el aire. Fue el descubrimiento de la circulación
pulmonar lo que ubicó realmente a esta función en los pulmones, con lo que el
corazón pasa a ser sólo el órgano que impulsa la sangre. El líquido hemático
sigue considerándose indispensable para la vida, al grado de identificarlo como
la sede y el conductor del alma, problema que atrajo la atención de numerosos
filósofos, científicos y médicos del Renacimiento, como Miguel Servet (Whitteridge,
Pagel, & Keynes, 1972). El interés por descubrir cómo ocurre
este prodigio motivó no sólo investigar cómo la sangre se mueve, sino saber de
qué está hecha y qué servicios prestan sus componentes al resto del organismo (Izaguirre-Ávila & de
Micheli, 2005).
2.6 El
principio de los marcadores
En el siglo XVII
se inició la práctica de inyectar sustancias en el interior del torrente
sanguíneo. Era uso frecuente instilar vino en los perros de caza para el
tratamiento de algunas enfermedades. Johann Sigismund Elsholtz (1623-1688),
médico de cabecera de Federico Guillermo de Bradeburgo, en 1665 publica
Clysmatica nova (Elsholtz, 1966), que contiene la primera referencia de
una inyección intravenosa en un ser humano. Daniel Major, de Papua (1634-1693),
administró medicación intravenosa mediante finos cilindros de plata. Sugirió,
cómo habían hecho otros autores, que era posible inyectar sangre en las venas,
pero no hay pruebas de que lo realizará en hombres (Góngora-Biachi, 2005).
2.7 Las
primeras transfusiones
Richard Lower (1631-1691) fue el primero en realizar una transfusión directa de sangre (Learoyd, 2012), demostrando que la diferencia de color entre la sangre arterial y venosa se debía al contacto con el aire en los pulmones. John Mayow (1640-1679) afirmó que el enrojecimiento de la sangre venosa se debía a la extracción de alguna sustancia del aire. Llegó a la conclusión de que el proceso respiratorio no era más que un intercambio de gases entre el aire y la sangre; éste cedía el espíritu nitro aéreo y cogía los vapores producidos por la sangre (Góngora-Biachi, 2005). Richard Lower, en el siglo XVII, fue quizá el primero en realizar una transfusión mediante tubos e un animal a otro, y, según Samuel Pepys, administró sangre de oveja a un joven con la intención de cambiar su carácter (P. Moore, 2003). Se desconocen los resultados de este experimento. Otro investigador de este siglo XVII. Bartholinius, seguramente poco serio, informó el caso de una señorita epiléptica que recibió una transfusión de sangre de gato y luego, en las noches subía al tejado a maullar (Góngora-Biachi, 2005).
Figura 2.8. La
transferencia de la sangre entre especies no es viable debido a que el sistema
inmune reconoce los marcadores de los glóbulos rojos extraños y causa su
eliminación, proceso llamado hemólisis. La excepción conocida son los
chimpancés, que poseen nuestros mismos tipos de sangre.
Se considera a
Jean-Baptiste Denis como el primero en acometer con éxito una transfusión
humana (Izaguirre & de
Micheli, 2001; Jaulin & Lefrère, 2010). En 1667 administró tres pintas de sangre
de carnero a una persona, sin efectos nocivos aparentes, pero después intento
dar sangre de ternera a un muchacho de vida agitada con el fin de suavizar su
carácter violento y le produjo una grave reacción que desembocó en la muerte.
En el juicio que siguió a este hecho, Denis fue exonerado de toda culpa, pero
la facultad de París prohibió futuras transfusiones. Diez años más tarde, el
parlamento las declaró ilegales. El gobierno italiano también declaró fuera de
la ley las transfusiones de persona a persona, pero no así la Real Sociedad de
Londres, que mantuvo su conformidad (Góngora-Biachi, 2005).
2.8 De
la filosofía a la biología, los eritrocitos
Una vez que Marcello Malpighi (1628–1694) encontró la comunicación microscópica entre los vasos arteriales y venosos a través de los capilares, quedó claro que la sangre no se regeneraba constantemente a partir del hígado como pensaba Galeno dieciséis siglos antes, sino que el contenido del sistema vascular se mantenía constante en volumen gracias al movimiento del corazón (Izaguirre-Ávila & de Micheli, 2005).
Figura 2.9. Marcello
Martillion Malpighi (Crevalcore, Bolonia, Italia, 10 de marzo de 1628-Roma,
Lacio, 30 de noviembre de 1694) fue un anatomista y biólogo, considerado el
fundador de la histología.
Ya conocido el
aspecto iatromecánico de la circulación, el interés se orientó a descifrar la
composición del líquido hemático y durante los años que siguieron a la
invención del microscopio, varios observadores encontraron partículas diminutas
en la sangre. El propio Malpighi abordó su análisis lavando algunos coágulos
encontrados en el corazón. En el líquido rojo que obtiene, observa una miríada
de átomos rojos. Sin duda, es una de las primeras descripciones de los
eritrocitos (Angelini,
Villason, Chan Jr, & Diez, 1999; Azizi, Nayernouri, & Azizi, 2008;
Khan, Daya, & Gowda, 2005). En una carta a Giovanni Alfonso Borelli
(1608–1679) escrita en 1661 y publicada en 1687, Malpighi menciona:
"... por sangre, yo no entiendo el agregado de los cuatro humores comunes:
las dos bilis, sangre y flema, sino todo lo que fluye continuamente a través de
las venas y arterias, que consiste de un infinito número de partículas. Todas
parecen estar comprendidas en dos partes, la parte blanquecina, llamada suero,
y la parte roja" (Izaguirre-Ávila & de
Micheli, 2005).
Malpighi también
observó los eritrocitos en los vasos del erizo, valiéndose de excelentes
microscopios construidos por el astrónomo y óptico Eustachio Divini. En Holanda,
tanto Antonio van Leeuwenhoek (1632–1723) como Jan Swammerdam (1637–1680),
describieron partículas al estudiar gotas de sangre y las llamaron glóbulos
rubiscentes, aunque este último dudó que realmente estuvieran en el interior de
los vasos (T. Moore, 2013). Leeuwenhoek dio a conocer sus
observaciones sobre las partículas de la sangre en 1674 en la publicación de la
Real Sociedad de Londres Transacciones Filosóficas. En Suiza, Albrecht von
Haller (1708–1777) describió su forma lenticular, y Lázaro Spallanzani
(1729–1799), en Italia, diferenció a los vertebrados de los invertebrados por
la presencia de los glóbulos rojos. El propio von Haller observó otros glóbulos
más grandes, incoloros, que pudieron haber sido los leucocitos.6 El estudio de
los átomos rojos llevó a Domenico Gusmano Maria Galeazzi (1686–1775) al
descubrimiento del hierro en la sangre, al demostrar la abundancia de
partículas metálicas extraídas por un imán desde las cenizas de sangre. La
ubicación del hierro en los eritrocitos y no en el suero o en los coágulos
lavados se debe a Vincenzo Menghini (1704–1759). Así, dentro de la escuela de
Malpighi establecida en Bolonia, la sangre deja de ser un humor para
convertirse en una mezcla de suero, fibrina y partículas rojas que contienen
hierro (Izaguirre-Ávila & de
Micheli, 2005).
2.9 El
descubrimiento de los leucocitos
En el siglo XVIII
varios autores mencionaron partículas diferentes a los glóbulos rojos, que
pudieron haber sido leucocitos. En 1749 Jean Baptiste Senac (1693–1770), nacido
en Lombez, Francia, mencionó los corpúsculos pálidos en su Tratado de la
Estructura del Corazón, de su Acción y de sus Enfermedades, pero no dio
interpretación a sus observaciones (Rolleston, 1934). En Inglaterra, William Hewson
(1739–1774) también encontró los vasos lácteos linfáticos descritos por Aselli (Pearson, 2002). Los observó en pájaros, reptiles y peces
y mencionó que no contenían glóbulos rojos, sino corpúsculos pálidos.
Seguramente eran leucocitos. Como en la sangre éstos eran menos numerosos que
los glóbulos rojos, se olvidaron prácticamente durante más de un siglo (Izaguirre-Ávila & de
Micheli, 2005)
Los microscopios
del siglo XVIII y principios del siglo XIX tenían el problema de la aberración
cromática, que distorsionaba la imagen e impedía observar partículas más
pequeñas. A partir de 1820 se resolvieron los obstáculos que impedían tener el
máximo provecho del microscopio compuesto. Los ingleses habían obtenido la
técnica de elaborar lentes objetivos acromáticos y que guardaron celosamente el
secreto durante muchos años. En 1830, Joseph Jackson Lister, padre del que
sería el gran cirujano que desarrolló la antisepsia, logró reducir la
distorsión esférica y la orla de color que rodeaba a las imágenes (Schultheiss &
Denil, 2002). También en Francia, Alemania e Italia se
fabricaron numerosos microscopios compuestos de tipo acromático. El resultado
fue una explosión en la investigación microscópica entre 1830 y 1848, con lo
que se desarrolló y confirmó el conocimiento sobre la estructura del organismo
animal (Izaguirre-Ávila & de
Micheli, 2005).
Durante la
primera mitad del siglo XIX aparecieron en París dos obras dedicadas a las
células de la sangre: Ensayos de Hematología Patológica, de Gabriel Andral
(1797–1876) en
1843 (Doyle, 1989); y el Curso de Microscopía, de Alfred Doné (1801–1878),
en 1844 (Kampen, 2012). La obra de Andral es la primera monografía escrita
sobre hematología y en ella se pone especial atención a los procedimientos
microscópicos y al contenido de glóbulos en la sangre. A mediados del siglo XIX,
William Addison (1802–1881), médico de la Duquesa de Kent (Rolleston, 1934), así como otros observadores, encontraron células
incoloras o blancas también en el pus y se pensaba que venían desde la sangre.
Un hecho que acrecentó el interés por estas células fue la descripción de la
leucemia, hecha en forma casi simultánea por D. Craigie y John Bennett
(1812–1875), en Edimburgo y Rudolf Virchow (1821–1902), en Berlín (Rolleston, 1934). Cada uno de ellos describió un caso de autopsia, que
reunían sorprendentes similitudes. Ambos investigadores reportaron
esplenomegalia y cambios en el color y consistencia de la sangre. Bennett pensó
que se trataba de pus en la sangre, condición conocida en esa época como
piohemia. Su publicación apareció en octubre de 1847 y precedió a la de Virchow
por seis semanas. Sin embargo, Virchow dio otra interpretación a los mismos
cambios. Recordó que la sangre normal contenía los mismos corpúsculos pálidos
observados en el pus de individuos con infección, y eran iguales a los
encontrados en la sangre de su paciente. La única diferencia era que la
proporción de corpúsculos pigmentados (eritrocitos) y corpúsculos pálidos
(leucocitos) estaba invertida en este caso, en el que no encontró infección.
Por ello, rehusó llamarle piohemia y le llamó simplemente sangre blanca. Dos
años después, el término se acuñó con etimología griega y surgió como leucemia.
Virchow publicó una serie de reportes en 1847, 1849, 1853 y 1864, donde
comunicaba la relación entre los corpúsculos blancos y la nueva enfermedad; en
algunos casos encontró una asociación con el crecimiento de los ganglios
linfáticos, por lo que propuso dos tipos de patología: la leucemia esplénica y
la leucemia linfática (Izaguirre-Ávila & de
Micheli, 2005).
2.10 El
descubrimiento de las plaquetas
El reconocimiento de las plaquetas como una
tercera partícula en la sangre se debe a los trabajos de Giulio Bizzozero
(1846–1901), de Várese, Italia, y George Hayem (1841–1935) (Brewer, 2006). Este último, nacido en París, comunicó que "en la sangre de
todos los vertebrados existen unos pequeños elementos que no son ni los
glóbulos rojos ni los glóbulos blancos" y los llamó hematoblastos, porque
pensó que eran precursores de los eritrocitos. Describió cómo se agregan y
cambian de forma y su interacción con la fibrina cuando la sangre es removida.
Reconoció que detienen la hemorragia y les atribuyó una doble función:
"acelerar la coagulación y jugar un papel en la regeneración de la
sangre" (Izaguirre-Ávila & de Micheli,
2005).
2.11 La
fabricación de la sangre
El órgano donde
se sintetiza la sangre permaneció como un problema por siglos, originalmente
todos aceptaron la palabra de Galeno, pero cuando se dieron cuenta de que la
anatomía griega no concordaba con las nuevas observaciones anatómicas,
comenzaron a aparecer otros postulantes como el corazón o las propias venas. En
1868 Ernest Neumann (1823–1918), nacido en Kónigsberg, Prusia Oriental, publicó
un comunicado donde sugería que la sangre tenía su origen en la médula ósea y
que éste era un proceso continuo (Rolleston, 1934). Además, reconoció a la leucemia como una
enfermedad de la médula, por lo que la llamó Leucemia mielógena. Julio
Bizzozero hizo el mismo descubrimiento en forma independiente, que dio a
conocer el mismo año de 1868 en la publicación Sobre la función hematopoyética
de la médula de los huesos (Izaguirre-Ávila & de
Micheli, 2005).
Durante los
siglos XVII y XIX se demostró, mediante transfusiones experimentales en
animales e incluso en hombres, que podía restituirse la sangre de animales
desangrados, que la sangre transportaba el oxígeno y que, si se hacía
incoagulable mediante extracción de su contenido de fibrina, podía
administrarse a animales. Finalmente quedó demostrado que las transfusiones de
animales al hombre eran muy peligrosas, pero poco a poco se iniciaron las
transfusiones de hombre a hombre. Blundell, Ponfick, Landis, Arthur y Pager
expusieron los efectos fisiológicos y químicos de las transfusiones, pero
fueron los trabajos inmunológicos de Ehrlich, Bordet y Gengou, entre otros, los
que permitieron a Karl Landsteiner clarificar la existencia de los grupos
sanguíneos, lo que supuso la incorporación sin ningún riesgo de la transfusión
sanguínea a la práctica médica (Rolleston, 1934). En 1910 Landsteiner describió los tipos
A, B, 0 de los hematíes, y posteriormente al tipo AB y así, la medicina
transfusional inició su verdadera etapa científica (Giangrande, 2000;
Starr, 2012).
Aunque las
fuentes principales que he empleado para este texto abundan en más detalles, me
parece que en este punto podemos dejar el relato, en el interior de la sangre
como un tejido biológico con propiedades físicas, despojada de sus antiguas
vinculaciones a las leyendas y la religión.
3. Componentes del citosol
|| Regresar al Índice ||
Dado que el
concepto de sangre que estamos tomando es en el sentido más laxo posible como
el mileau interior de los seres
vivos, debemos analizar todos los fluidos vitales de los seres vivos, lo cual
implica iniciar por los fluidos internos de la unidad estructuran y funcional
de cualquier ser vivo, es decir, la célula. Todo ser vivo está definido como
mínimo por un fluido interno y una membrana que lo separa del ambiente externo (De Duve &
Pizano, 1995). El citosol es el fluido interno de las
células definidas por medio de una membrana biológica. El término citosol fue
acuñado por primera vez de forma bastante tardía en la historia de la biología
celular, recién hasta 1965 fue acuñado por H. A. Lardy para referirse al
líquido que era producido por el rompimiento celular una vez que fuera separado
de todos sus componentes no solubles (Ureta, 1985).
En la actualidad
el término citosol de emplea para definir la parte líquida del citoplasma en
una célula intacta, lo cual incluye cualquier parte del citoplasma que sea
contenido por orgánulos (Ito, Parsons,
& Heazlewood, 2014). Sin embargo, para evitar las confusiones
generalmente se designa como citosol a la parte liquida entre la membrana
externa y las membranas de los organelos, mientras que el líquido contenido al
interior de cualquier organelo se lo denomina generalmente como matriz. Existen
grandes diferencias en el contenido del citosol y la matriz citosólica de los
organelos, pues ese es precisamente el propósito de muchos de ellos, almacenar
sustancias de forma tal que puedan ser transportadas o procesadas sin que se
disuelvan en todo el volumen de la célula. De hecho, citosol también puede ser
conocido como matriz citoplasmática.
El citosol es
importante, ya que muchas reacciones químicas del metabolismo deben ocurrir en
fase acusa en su interior, las cuales pueden estar relacionadas con reacciones
vinculadas a las membranas (De Duve &
Pizano, 1995; Karp, 2013). El citosol es una compleja mezcla de
sustancias disueltas en el agua. Aunque el agua conforma la mayor parte del
citosol, su estructura y propiedades al interior de la célula no se encuentran
comprendidas del todo. A diferencia de lo que cabe esperar en una solución
química normal, donde las concentraciones se homogenizan con el tiempo debido
al fenómeno de difusión, en el citosol se pueden encontrar gradientes de
concentración sin la necesidad de la separación por membranas (Aw, 1999; Jaffe,
1993; Weiss & Korge, 2001). Estas diferencias en las concentraciones
de iones son importantes en procesos como la osmoregulación, la señalización
celular y la generación de potenciales de acción en células excitables como las
endocrinas, nerviosas y musculares. El citosol también contiene grandes cantidades
de proteínas, las cuales alteran las propiedades del citosol a su alrededor
mediante un sistema de pastoreo molecular (Ellis, 2001a).
Lo anterior
implica que la vieja visión del citosol como una solución química debe ser
evaluada a la luz de las propiedades biológicas ejercidas por las proteínas,
generando múltiples niveles de organización interna que habían pasado por de
ser percibidas por siglos. Estas incluyen, pero posiblemente no se limitan a,
gradientes de concentración sin separación membranosa, complejos proteínicos en
las cuales una proteína puede agrupar cual pastor de ovejas a otras moléculas
por medio de interacciones moleculares débiles (Ellis, 2001a), e incluso, la generación de estructuras
proteínicas de almacenamiento (Yeates, Crowley,
& Tanaka, 2010).
La proporción del volumen celular que es
citosol varía, por ejemplo, en las bacterias casi toda la célula es citosol y
lo demás es membrana externa, pero en las células vegetales el líquido más
voluminoso es la matriz de la vacuola que regula a su vez el volumen del
citosol.
3.1 El
agua
El componente más
importante del citosol es el agua, la cual abarca el 70% del volumen de una
célula típica (Luby-Phelps, 1999). La acidez medida como pH de este fluido
se encuentra cercana a la neutralidad, con la leve basicidad de 7,4, aunque
puede haber variaciones. En el ser humano por ejemplo, el pH puede variar entre
7,0 y 7,4 siendo más alto si la célula se encuentra en crecimiento (Bright, Fisher,
Rogowska, & Taylor, 1987; Roos & Boron, 1981). La viscosidad del citosol es casi la
misma que la del agua pura, aunque la capacidad de difusión de moléculas es
casi 4 veces más baja que en el agua debido a las colisiones moleculares con
tantas moléculas disueltas (Verkman, 2002).
Las células
poseen cuenta tolerancia a la desecación hasta un 56% del volumen celular, sin
embargo el metabolismo se inhibe paulatinamente hasta que se llega a un 21% del
volumen celular, momento en el cual el metabolismo se detiene y la célula muere
por crenación (Clegg, 1984). ¡La organización de las moléculas de
agua en el citosol sigue siendo materia de debate, incluso la organización del
agua ultra pura sigue siendo materia de debate! Debido a que el agua al formar
puentes de hidrógeno puede formar agrupaciones supramoleculares con sigo misma
y con las sustancias con las cuales ella se puede disolver (Wiggins, 1990). Por tal razón solo expondremos la imagen
clásica, en la cual el 5% de esta se encuentra unida a los solutos como las
proteínas por medio del proceso de solvatación, mientras que la mayoría de las
moléculas restantes poseen una estructura semejante a la del agua pura líquida.
El agua solvatada actúa como si sus propiedades moleculares fueran diferentes a
la del agua molecular y por lo tanto no afecta las propiedades osmóticas de la
célula (Wiggins, 1990).
3.2 Iones
Las
concentraciones de iones en el citosol son muy diferentes de las que podemos
encontrar tanto en las matrices de los diferentes orgánulos o de la que puede
presentar la matriz extracelular, pero los tipos de iones son en esencia los
mismos, con la única excepción de las proteínas citosólicas como el
citoesquelético que poseen una carga neta negativa. Por lo general el citosol
posee muchas más moléculas con carga negativa que el medio externo, eso también
lo hace un poco más ácido. Por lo general el citosol posee concentraciones más
altas de sodio y más bajas de potasio que la matriz extracelular. Esta
diferencia en las concentraciones iónicas es crítica para la osmoregulación,
debido a que los niveles iónicos determinan la posibilidad que tiene la célula
de transportar otras sustancias cargadas de un lado al otro de la membrana. Las
diferencias en las cantidades de iones también crean diferencias en la carga
eléctrica a un lado y al otro de la membrana, conocido como diferencia de
potencial eléctrico. Esta propiedad es crítica para las células excitables como
las endocrinas, nerviosas y musculares (Karp, 2013;
Rhoades & Bell, 2013).
El citosol puede
experimentar cambios de fase fuertes sin destruir el sistema de membranas,
proceso denominado criptobiosis (Sussich, Skopec,
Brady, & Cesàro, 2001). En ese estado el citosol y sustancias
denominadas osmoprotectantes como las betainas y la trehalosa adquieren una
estructura semejante al vidrio estabilizando las proteínas y componentes
celulares y aislándolas del daño que puede efectuar la desecación.
Algunos iones se
encuentran en bajas concentraciones en el citosol bajo condiciones de
normalidad funcional, tal es el caso del ion calcio(2+), que generalmente se
encuentra resguardado en la matriz de los retículos endoplasmáticos. Sin
embargo alteraciones en el estado de normalidad permiten emplear al calcio(2+)
como mensajero interno, tal como ocurre durante el proceso de excitación de la
célula muscular, donde este ion es empleado como activador del sarcómero, que
permite que la célula se contraiga (Karp, 2013;
Rhoades & Bell, 2013). Otros iones como el ion cloruro(1-) y el
ion potasio(1+) también podrían tener funciones como señalizadores
intracelulares, aunque dichas funciones aún son materia de estudio y debate (Orlov & Hamet,
2006).
3.3 Macromoléculas
Las proteínas no
vinculadas a la membrana celular o al citoesqueleto se encuentran disueltas en
el citosol (Ellis, 2001b). La cantidad de proteínas en el citosol
es extremadamente alta, y sorprende que no altere las propiedades viscosas
hacia un gel. Ahora bien, tal como ocurre con los iones, al parecer las
proteínas no se encuentran disueltas uniformemente al interior del citosol. De
hecho, son las proteínas quienes causan los gradientes de concentración al
actual cómo pastores moleculares, sustancias que agrupan a otras moléculas en
regiones específicas del citosol, impidiendo o retrasando la difusión.
En los procariotas
el citosol contiene los ácidos nucleicos al interior de una estructura
denominada nucleoide (Thanbichler, Wang,
& Shapiro, 2005). El nucleoide es una masa irregular de
ADN circular asociado a proteínas que controlan su transcripción y replicación,
así como la de los plásmidos (Peters, 2006). Por el contrario, en los eucariotas los
ácidos nucleicos como su nombre indica se encuentran almacenados en la matriz
nuclear al interior de las membranas que definen el núcleo de la célula. Como
último detalle, el pastoreo molecular altera gravemente las propiedades
químicas del citosol, y de hecho las constantes de disociación molecular, que
definen tan fuertemente a los seres vivos varían debido al efecto de la
altísima concentración molecular.
3.4 Malla citoesquelética
Aunque el citoesqueleto no hace parte del
citosol en nuestros modelos, es bastante evidente que el citosol baña al
citoesqueleto, por lo que hay una interacción directa. El citoesqueleto forma
una red o entramado molecular que puede efectivamente aislar moléculas muy
grandes, o disminuir su difusión por aumento de colisiones e interacciones
moleculares, esto se debe simplemente al tamaño. Algunos estudios han mostrado
que el citoesqueleto puede aislar estructuras de 25 nanómetros (Luby-Phelps, Castle, Taylor, &
Lanni, 1987; Provance, McDowall, Marko, & Luby-Phelps, 1993), lo cual es el tamaño efectivo de un ribosoma (Cate, 2001). Aparentemente la densidad del citoesqueleto no es la misma en
todas partes, po lo que es capaz de generar enmallados de actina que actúan
como rejas que separan compartimentos del citosol sin necesidad de membranas
biológicas. Estos microdominios podrían influenciar la distribución de
estructuras grandes como los ribosomas y organelos evitando mezclas aleatorias.
4. Fisiología del citosol
|| Regresar al Índice ||
El citosol no posee una función única, y
se trata más de un lugar donde todo se encuentra ocurriendo de manera caótica,
es decir, incluso los organelos deben moverse en el citosol. Sin embargo,
podemos señalar algunos procesos generales vinculados al citosol:
4.1 El transporte de señales
Cuando una hormona o mensajero químico
alcanza las proteínas receptoras de la membrana, estas inmediatamente cambian
su forma al interior de la membrana, activando una serie de reacciones en
cascada. La idea es bastante similar a los juegos cinéticos en los que una
pequeña fuerza activa en sucesión una serie de máquinas simples. Sin embargo en
la célula las acciones no son llevadas a cabo por objetos físicos, sino por
reacciones químicas que transmiten una serie de mensajeros químicos internos
como el ion calcio(2+) o el AMPc. La señalización le permite a la célula
responder dependiendo de las señales del ambiente (Kholodenko, 2003).
4.2 Reproducción celular
Cuando la membrana nuclear desaparece y los organelos empiezan a distribuirse, también lo hace el citosol hacia los polos opuestos de la célula, esto es el proceso de la citocinesis celular justo antes de completar la mitosis, la meiosis I y la meiosis II (Winey et al., 1995).
4.3 Matriz de difusión
A pesar de su capacidad disminuida para la
difusión molecular y al pastoreo que ejercen algunas proteínas, la matriz del
citosol aún sigue siendo una sustancia que permite que las moléculas se
difundan aleatoriamente. Sin embargo debido a la gran cantidad de sustancias,
solo las moléculas pequeñas se difundirán eficientemente debido a que
afrontarán menos colisiones e interacciones moleculares débiles (Verkman, 2002).
4.4 Transporte de grasas
Las grasas y otras sustancias hidrofobias
grandes son un problema para la posibilidad de difusión, de hecho a menos que
se encuentren vinculadas a proteínas fuertemente hidrófilas, o que se
encuentren al interior de una vesícula, estas sustancias no se difundirán, el
lugar más común de su almacenamiento son las membranas, ya sean la externa o de
los organelos celulares (Maxfield & Mondal, 2006;
Weisiger, 2002).
4.5 Metabolismo
Las moléculas que se encuentran en el
citosol al interactuar generan reacciones químicas, lo cual implica que en el
citosol se llevan muchos de los procesos del metabolismo de los seres vivos.
Por ejemplo, en los mamíferos casi la mitad de sus proteínas se encuentran en
el citosol, y se encuentran involucradas en mayor o menor medida a la
regulación de las reacciones químicas del metabolismo. Algunas de las rutas
metabólicas más viejas y comunes ocurren en el citosol como la glucólisis, la
gluconeogénesis y el ciclo de las pentosas fosfato (Berg, Tymoczko, & Stryer, 2002;
Campbell & Farrell, 2012; Murray et al., 2012).
5. Otros fluidos semejantes al citosol
|| Regresar al Índice ||
El interior de
los organelos no se define como parte del citosol, y esto implica que debemos
asignarle un nombre al líquido que estos encierran, después de todo, cualquier
membrana biológica debe contener algún tipo de fluido vital. Por lo general los
fluidos internos de los organelos se los denomina matriz, y su contenido de
sustancias, aunque es el mismo del citosol, varía mucho en concentraciones, por
ejemplo la matriz del sarcoplasma en las célula muscular se encuentra saturada
del ion calcio(2+) un mensajero intracelular típico (Rhoades &
Bell, 2013).
5.1 Matriz
mitocondrial
El interior de la
mitocondria posee dos fluidos, ya que es como si se tratara de una bacteria
envuelta en un fagosoma. El fluido que se encuentra entre la membrana externa
de la mitocondria y la membrana interna o real de la mitocondria es conocido
como fluido intermembranal mitocondrial o intersticial mitocondrial, el cual a
su vez de divide en dos. El primero es el fluido que rodea a la mitocondria
como tal, y el segundo es el fluido intercrestal, que se encuentra embebido en
las crestas mitocondriales donde ocurren los cambios electroosmóticos que
permiten la síntesis de energía por medio del metabolismo aeróbico. Al interior
de la membrana interna de la mitocondria se encuentra el fluido denominado como
la matriz mitocondrial, el cual es quien interactua con los fluidos de las
crestas mitocondriales. La cadena de transporte de electrones manipula el
potencial electro osmótico mediante el flujo de iones protio(1+), así como
iones calcio(2+). Debido a que el proceso requiere gases disueltos es común
encontrar dioxígeno gaseoso disuelto y dióxido de carbono disuelto, así como
sus correspondientes ácidos y iones de su equilibrio triple (Karp, 2013;
Scalettar, Abney, & Hackenbrock, 1991).
5.2 Matriz
del cloroplasto
El cloroplasto al
poseer tres membranas es un poco más complicado. También posee un fluido
intermembranario entre la membrana externa y la primer mebrana del cloroplasto.
En este caso no hay crestas, por lo que es un fluido regular. Al interior de la
segunda membrana del cloroplasto tenemos la cavidad denominada estroma, y su
fluido será el fluido o matriz del estroma. Sin embargo hay una tercera
membrana del cloroplasto que forma figuras semejantes a monedas llamadas
tilacoides, y en consecuencia hay una cavidad rellena de fluido que denominamos
como la matriz del tilacoide (Karp, 2013).
5.3 Otros organelos
Los demás organelos por lo general no
poseen una estructura complicada interna, y en consecuencia su contenido se
referencia simplemente como la matriz del organelo en cuestión, aunque sus
propiedades difieren dependiendo de la función concreta que desempeña cada
organelo (Karp, 2013).
6. Diferentes tipos de sangre
|| Regresar al Índice ||
Por fuera de los tejidos se forma generalmente una cutícula o
epitelio que aísla al tejido u órgano del medio circundante. Nuevamente, si el
organismo es pequeño el medio es agua, pero si no, entontes el órgano debe ser
bañado a su vez por otro fluido vital (De Duve & Pizano, 1995). Existen cuatro
fluidos vitales que alimentan a los órganos y tejidos en seres vivos grandes,
la hemolinfa, la savia, la linfa y la sangre.
6.1 La hemolinfa
La hemolinfa es un fluido análogo a la sangre y circula por
cualquier sistema circulatorio abierto. Por lo general la diferencia se da debido
a que en los sistemas circulatorios cerrados el fluido vital se encuentra
encerrado en una tubería perfectamente sellada que mantiene el ambiente interno
en el que se encuentran los órganos relativamente secos, este estadio se
denomina celoma. Por el contrario, en un sistema circulatorio abierto el fluido
vital se desparrama bañando los órganos por fuera por todo el celoma, de allí
que el fluido vital recibe el nombre de hemolinfa y la cavidad el de
hemoceloma.
Figura 6.1. La hemolinfa
carece de pigmentos y por ende es transparente. Al gunos tipos de hemolinfa si
portan pigmentos, como la clorocruorina (pigmento verde) o la hemocianina
(pigmento azul).
La hemolinfa se encuentra compuesta por un fluido o plasma y
una serie de componentes celulares suspendidos llamados hemocitos. En adición a
los hemocitos, el plasma contiene nutrientes disueltos y pigmentos
respiratorios encargados del transporte de gases de importancia metabólica. Algunas especies emplean la hemolinfa para otras cosas a parte de
transportar sustancias de un lugar a otro. Algunas especies de insectos son
capaces de generar autohemorragias cuando son atacados por depredadores.
La hemolinfa contiene una serie de agentes
nucleantes de naturaleza inorgánica que le confiere protección contra el
congelamiento, especialmente en especies que habitan ecosistemas que
experimentan fuertes fluctuaciones de temperatura. Adicionalmente también
transporta iones como cualquier fluido vital, proteínas, lípidos y pigmentos
respiratorios, que pueden ser cualquiera, aunque uno de os más comunes es la
hemocianina de color azul. La sangre de los artrópodos posee altos niveles de
aminoácidos libres. La mayoría de los aminoácidos se encuentran presentes, aunque
sus concentraciones varían de una especie a otra, así como a su estado de
desarrollo en sus respectivos ciclos de vida. Por ejemplo, el gusano de seda
requiere enormes cantidades de glicina para sintetizar la seda.
Las proteínas presentes en la hemolinfa
varían en cantidad durante el desarrollo. Estas proteínas se encuentran
clasificadas por sus funciones en proteínas de pigmento, inhibidores de
proteasas, transportadores de grasa, enzimas, vitelogeninas y aquellas
involucradas en la respuesta inmune. Al
igual que la sangre, la hemolinfa transpoirta los desechos del metabolismo
celular como el dióxido de carbono, el amonio, la alantoina, el ácido úrico y
la úrea. Algunas hormonas son transportadas por la hemolinfa.
6.2 La
savia
La savia “sap en inglés” es el
fluido o líquido transportado por los tejidos de conducción de las plantas
(xilema o floema). Otros líquidos exudados por las plantas, tales como látex,
cerumen, resinas o mucílago, muchas veces son incorrectamente denominados
savia. La savia transportada por el xilema (denominada «savia bruta») consiste
principalmente en agua, elementos minerales, reguladores de crecimiento y otras
sustancias que se hallan en disolución. El transporte de esta savia se produce
desde las raíces de la planta hasta las hojas por los tubos leñosos. En el
siglo XX ha existido una gran controversia acerca del mecanismo de transporte
de la savia bruta en la planta. Actualmente, se considera que toda la evidencia
sustenta la teoría de la cohesión-tensión. La savia elaborada es transportada
por el floema de forma basípeta (desde su lugar de formación, hojas y tallos
verdes, hacia la raíz) y está compuesta principalmente por agua, azúcares,
fitorreguladores y minerales disueltos. El transporte de la savia en el floema
se produce desde las fuentes (el lugar donde los carbohidratos se producen y
almacenan) hacia los destinos (lugares de la planta donde los carbohidratos se
utilizan). La hipótesis de flujo de presión es el mecanismo generalmente
aceptado para explicar el transporte floemático.
Las plantas representan claramente la hipótesis evolutiva
planteada anteriormente. Las algas unicelulares no requieren matriz
extracelular, mientras que las pluricelulares poseen una matriz extracelular
simple y un tegumento externo que mantiene unido al conjunto celular. A medida
que estas fueron evolucionando se requirió de un fluido conector y esa fue la
savia para los musgos. Sin embargo, sin un sistema circulatorio la eficiencia
de la savia se vio limitada a permitir el crecimiento de la planta a unos
cuantos milímetros. Solo cuando el fluido conector se encuentra con un sistema
de circulación, las propiedades menos viscosas de dicho fluido les permiten a
los nutrientes moverse con mayor eficacia y en consecuencia el individuo puede
crecer mucho.
Figura 6.2. La savia
tampoco transporta pigmentos y por ende es transparente.
El fluido de transporte de las plantas es vascular, conecta
las zonas de nutrición con los tejidos que no pueden nutrirse por sí mismos,
sin embargo, las células propias del tejido reciben los nutrientes por
intermedio de la MEC que si entra en contacto con la savia, ya sea bruta o
elaborada. La vascularización es tan especializada que hay conductos diferentes
para la savia con componentes inorgánicos básicos y otros para la savia que
transporta el alimento.
6.3 La
linfa
En los animales vertebrados la vascularización es análoga a
la de las plantas, tanto así que se generan dos tipos de conductos para dos
tipos de fluidos, aunque evidentemente no los llamamos savia bruta o elaborada,
pues la composición de dichos fluidos es diferente. Los dos sistemas de
conductos vasculares se denominan el sistema circulatorio linfático y el
sistema circulatorio general. La linfa es el fluido que recorre el sistema
circulatorio linfático, siendo principalmente un sistema para regular la
concentración del MEC, al no recibir eritrocitos no posee coloración roja. Se
produce tras el exceso de líquido que sale de los capilares sanguíneos al
espacio intersticial o intercelular, siendo recogida por los capilares
linfáticos que drenan a vasos linfáticos más gruesos hasta converger en
conductos que se vacían en las venas subclavias.
La linfa recorre el sistema linfático gracias a débiles contracciones de los músculos, de la pulsación de las arterias cercanas y del movimiento de las extremidades. Ahora bien, dijimos que su función es la de regular la concentración del MEC, pero que pasa si por alguna razón, como una obstrucción, ¿el sistema linfático no puede cumplir su objetivo? La consecuencia es que del sistema circulatorio general ingresará agua al MEC y el linfático no la drena, por lo que el MEC se empezará llenar de agua alterando los delicados equilibrios osmóticos y eléctricos, lo cual impide que la célula se alimente, excrete o que simplemente muera, esto a nivel celular produce muerte del tejido por acumulación de líquido, proceso denominado edema.
Figura 6.3. La linfa es
blanca debido a que porta una alta concentración de glóbulos blancos.
Este fluido está compuesto por un líquido claro pobre en
proteínas y rico en lípidos, parecido a la sangre, pero con la diferencia de
que las únicas células que contiene son los glóbulos blancos, que migran de los
capilares y proceden de los ganglios linfáticos, sin contener glóbulos rojos.
También puede contener microorganismos que, al pasar por el filtro de los
ganglios linfáticos, son eliminados. La linfa es menos abundante que la sangre:
se considera que hay aproximadamente 2 litros de linfa, mientras que el volumen
de sangre es de unos 5 litros.
6.4 La sangre
Es el segundo líquido altamente fluido de los vertebrados, y
como sus demás contrapartes transportará nutrientes y desechos. La
característica más importante de la sangre y que comparte con la hemolinfa es
la posesión de pigmentos que incrementan la eficiencia en el transporte de
gases metabólicamente importantes como el oxígeno y el dióxido de carbono. En los
vertebrados esta sustancia fluye a través del sistema circulatorio general. A
parte del pigmento de transporte de gases metabólicos que llamamos hemoglobina
y que es de colores rojizos, la sangre también transporta otras sustancias que
mejoran la eficacia del transporte de nutrientes.
Un ejemplo de eso son las lipoproteínas de alta y baja densidad encargadas de distribuir y recolectar las grasas desde y hacia el hígado según requiera el metabolismo del organismo. Adicionalmente también trasporta nutrientes que se disuelven fácilmente en agua y pueden ser transportado sin necesidad de proteínas de transporte, así como componentes auxiliares, como células del sistema inmune y materiales para reparar los vasos sanguíneos en caso de roturas. La mayor parte del presente capítulo de anatomía comparada se dedicará al estudio de los vasos conductores por donde fluye la sangre, más que a la sangre misma.
Figura 6.4. La sangre de
los vertebrados porta un pigmento de hierro, y por ende es roja.
7. La hemoglobina
|| Regresar al Índice ||
La coloración de la sangre se debe a sustancias denominadas
pigmentos, los cuales por lo general están allí para el transporte de los gases
de importancia metabólica como el oxígeno y el dióxido de carbono. Diferentes
linajes de seres vivos pueden presentar diferentes tipos de pigmentos, aunque
algunos linajes como en ciertos grupos de anélidos se puede presentar sangre
con mezcla de pigmentos. A pesar de lo anterior, los dos pigmentos más famosos
son la hemoglobina de los vertebrados y la hemocianina en los invertebrados.
Algunos invertebrados pueden presentar hemoglobina, pero los vertebrados nunca
presentan hemocianina.
A pesar de ser
denominados rojos, los eritrocitos no poseen este color por una proteína propia
de sus membranas, si no por el contrario por una proteína soluble que se
encuentra disuelta en el plasma o en una mayor medida en el interior en sus
citoplasmas. Esta proteína se denomina hemoglobina y su función primordial es
la de transportar gases metabólicamente importantes como el oxígeno y el
dióxido de carbono. En los mamíferos como lo seres humanos, la hemoglobina es una proteína
altamente compleja, de estructura cuaternaria, es decir está compuesta por
varias unidades proteínas independientes, en este caso cuatro, las cuales
rodean a un marco denominado grupo heme donde se encuentra el hierro
responsable del transporte de gases.
7.1 Forma cuaternaria
Al ser una
proteína compleja de nivel organizativo cuaternario en los mamíferos, es
relativamente pesada, con 64 500 daltons, las cuatro proteínas o unidades que
la componente se denominan globinas, las cuales pueden ser de muchos tipos
diferentes, codificadas por genes diferentes (β, γ, δ, ε). Cada eritrocito
contiene cientos de moléculas de hemoglobina Se pueden encontrar cuatro tipos
de hemoglobina en los eritrocitos de los seres humanos, designados por la
composición de sus cadenas de globina.
La más prevalente
en los adultos es la Hgb-HgA la cual consiste en dos globinas de tipo β y dos
globinas de tipo α (α2β2). El otro tipo de hemoglobina presente en los
eritrocitos de los adultos se denomina HgA2, con una representación que puede
variar entre el 1,5% y el 3%, en esta, se presentan dos globinas tipo α y dos
globinas de tipo δ. La hemoglobina fetal (α2γ2), es la hemoglobina más
frecuente durante la vida intrauterina. Sus niveles en la sangre circulante
disminuyen rápidamente durante la infancia, hasta llegar a una concentración
del 0.5% en los adultos. La hemoglobina embrionaria se encuentra mucho antes
durante el desarrollo. Su fórmula es la siguiente (α2ε2), aunque la producción
de las globinas tipo épsilon cesan al llegar al tercer mes de embarazo.
La producción de
cada tipo de globina es controlada por una estructura genética individual con 5
loci diferentes. Las cuatro proteínas resultantes se unen en los eritrocitos en
desarrollo, y permanecen juntas durante su periodo funcional. Las mutaciones
pueden ocurrir en cualquier momento y en muchas formas diferentes. Cuando estas
mutaciones disminuyen la eficiencia de la función, hablaremos de una enfermedad
relacionada a la hemoglobina (hemoglobinopatía), y se conocen cerca de 550
casos.
Sin embargo, la
mayoría de las mutaciones no poseen una significancia clínica conocida
(neutrales), sin embargo, algunas de ellas pueden causar problemas serios. La más conocida se
denomina anemia de hemoglobina en forma de hoz o falciforme, la cual difiere de
la hemoglobina normal HbA debido a una sustitución de un solo aminoácido en la
cadena de globina. Cuando la hemoglobina se oxide con oxígeno hasta el punto de
la saturación se denomina oxihemoglobina (HgO2), se forma en los pulmones
gracias a la gran concentración de oxígeno en los capilares de los alveolos de
los bronquiolos en los pulmones. Cuando la hemoglobina libera al oxígeno en los
capilares sistémicos se dice que se está reduciendo.
Al contrario de
lo que se creería, la hemoglobina no está diseñada para ser más afín al
oxígeno, otros gases presentan una mayor afinidad con la hemoglobina, el caso
más conocido es el monóxido de carbono, fruto de la oxidación incompleta de
compuestos orgánicos durante un incendio. Debido a que el monóxido de carbono
es más afín a la hemoglobina, este puede desplazar al oxigeno rápidamente, y es
TAN afín, que después de unido, ya no se liberará, a este compuesto
virtualmente permanente se lo denomina carboxihemoglobina (HbCO).
Figura 7.1. Piel cianótica.
Este pequeño
fenómeno químico explica la tremenda toxicidad del monóxido de carbono, pues al
ser respirado permanece unido a la hemoglobina, por lo que, aun cuando la
persona es extraída del lugar, seguirá asfixiándose al estar su hemoglobina
inhabilitada de manera permanente. Los nitratos y ciertos compuestos químicos
que oxidan el hierro de la hemoglobina a su estado férrico resultan en la
formación de methemoglobina (meHb). La methemoglobina contiene oxigeno tan
fuertemente unido al hierro férrico, que no será liberado a los tejidos durante
su viaje a los capilares, haciendo a esta hemoglobina completamente inútil para
la respiración interna.
La cianosis (Figura 7.1), la coloración azul oscura que adquiere la piel asociada a estados de hipoxia o anoxia se vuelve evidente cuando la concentración de hemoglobina reducida (sin oxígeno) excede los 5g/dL. Es un estado reversible si la condición es causada únicamente por una disminución en la obtención de oxígeno, pero es irreversible si es causada por la acumulación de methemoglobina, y ni siquiera la administración concentrada de oxigeno solucionará la asfixia.
Figura 7.2. La estructura
de la hemoglobina, es una proteína tetradimencional, en realidad se trata de la
unión de cuatro proteínas "globinas" que rodean a cuatro moléculas
orgánicas relativamente complejas llamadas grupos heme, es el grupo heme el que
se encarga de la función de transporte de oxígeno. En la imagen tenemos 4
globinas, en rojo tenemos alfa globinas y en azul beta globinas. Debemos
recordar que, las hemoglobinas humanas son más complejas que las presentadas
por otros animales.
7.2 El
grupo Heme
Estructura del grupo heme o hemo también es conocido como grupo Fe(2+) protoporfirina IX, y es la región activa de la hemoglobina humana.
Figura 7.3. es un grupo
prostético que forma parte de diversas proteínas, entre las que destaca la
hemoglobina, consiste en un ion Fe(2+) (ferroso) contenido en el centro de un
gran heterociclo orgánico llamado porfirina, hecho de cuatro grupos pirrólicos
unidos entre sí por medio de puentes metino (YouTube).
Es un grupo
prostético que forma parte de diversas proteínas, entre las que destaca la
hemoglobina, consiste en un ion hierro(2+) “antiguamente llamado ferroso, pero
ya no debería” contenido en el centro de un gran heterociclo orgánico llamado
porfirina, hecho de cuatro grupos pirrólicos unidos entre sí por medio de
puentes metino. No todas las porfirinas contienen hierro, pero una fracción
sustancial de las metaloproteínas que contienen el núcleo porfirina, poseen el
grupo hemo como grupo prostético; estas proteínas se conocen como
hemoproteínas. El grupo hemo es principalmente conocido por formar parte de la
hemoglobina, el pigmento rojo de la sangre, pero también se encuentra en un gran
número de otras hemoproteínas biológicamente importantes tales como la
mioglobina, citocromos, catalasa, y la óxido nítrico sintasa endotelial.
Las hemoproteínas poseen diversas
funciones biológicas, incluyendo el transporte de gases diatómicos, catálisis
química, y detección de gases diatómicos y transferencia de electrones. El ion
hemo sirve como fuente o sumidero de electrones durante transferencias
electrónicas o reacciones redox, como ocurre en las cadenas de transporte de
electrones. En las reacciones de las peroxidasas, la molécula de porfirina
sirve además como fuente de electrones. En el transporte o detección de gases
diatómicos, el gas se une al ion hemo. Durante la detección de gases
diatómicos, la unión del gas ligando al grupo hemo induce cambios
conformacionales en la proteína que lo rodea. Se ha especulado que la función
evolutiva original de las hemoproteínas fue la transferencia de electrones en
la fotosíntesis primitiva basada en los compuestos de azufre que realizaban los
organismos similares a cianobacterias ancestrales, antes de que apareciera el
oxígeno molecular.
Las hemoproteínas han alcanzado su
remarcable diversidad funcional modificando el ambiente inmediato del
macrociclo hemo dentro de la matriz proteica. Por ejemplo, la capacidad de la
hemoglobina para entregar en forma efectiva el oxígeno a los tejidos se debe a
unos residuos aminoacídicos específicos localizados cerca del grupo hemo de la
molécula. La hemoglobina une oxígeno en la vasculatura pulmonar, donde el pH es
alto y la pCO2 es baja, y lo libera en los tejidos, donde la situación se
invierte. Este fenómeno se conoce como efecto Bohr. El mecanismo molecular
detrás de este efecto es la organización estérica de la cadena globina; un
residuo de histidina localizado en una posición adyacente al grupo hemo,
deviene en positivamente cargado cuando el pH se acidifica (lo cual es causado
por la disolución del dióxido de carbono en tejidos con alta tasa metabólica),
liberando estéricamente al oxígeno del grupo hemo.
A diferencia de
lo que podría esperarse, no existe un único grupo hemo, hay varios tipos de
grupos hemo biológicamente importantes.
El tipo de Hemo más común en la naturaleza es el Hemo B; otros tipos
importantes son el Hemo A y el Hemo C. Los grupos heme aislados comúnmente se
designan con letras mayúscula, mientras que los grupos heme unidos a las
proteínas se designan con las letras en minúscula. El citocromo a se refiere al
grupo hemo A en una combinación específica con una proteína de membrana para formar
una porción del citocromo c oxidasa.
Bajo condiciones
de homeostasis, la reactividad del grupo heme se encuentra bajo control, ya que
se encuentra insertado dentro de los "bolsillos hemo" de las
hemoproteínas. Sin embargo, bajo condiciones de estrés oxidativo, algunas
hemoproteínas, tales como por ejemplo la hemoglobina, pueden liberar sus grupos
prostéticos. El hemo no proteico (libre) que se produce de esta manera es
altamente tóxico, más probablemente debido al átomo de hierro contenido dentro
del anillo protoporfirina IX, el cual actúa como un reactivo de Fenton para
catalizar la producción de radicales libres.[cita requerida] Esta propiedad del
hemo libre puede sensibilizar a una variedad de células para entrar en muerte
celular programada en respuesta a agonistas proinflamatorios, un efecto
deletéreo que juega un importante rol en la patogénesis de ciertas enfermedades
inflamatorias tales como la malaria y sepsis.
7.3 Las
globinas
La globina es una proteína de predominio
globular (estructura terciaria) que forma parte de la hemoglobina
(heteroproteína) siendo la globina la parte proteica. Existen varios tipos de
cadenas de globina o monómeros, que se designan mediante letras griegas (alfa,
beta, gamma, etc.). La globina es la parte proteica de la hemoglobina
(apoproteína). El hemo es el grupo prostético de la hemoglobina. Está compuesto
por cuatro cadenas polipeptídicas, estas son semejantes dos a dos. Los
aminoácidos varían según la especie y dentro de la especie humana varían con el
desarrollo del organismo, de forma que cambian según se trate de la vida
embrionaria, fetal o adulta. La familia de las globinas alfa, se encuentra en
el cromosoma 16 y forma un cluster que está compuesto por dos copias de la
globina alfa, dos pseudogenes y a continuación la globina zeta. La familia beta
ubicada en el cromosoma 11 está compuesta por: beta, seguida por delta (formará
junto con la globina alfa la Hb A2), dos gamma (que varían en 1 aminoácido) y
épsilon.
8. La evolución de la hemoglobina
|| Regresar al Índice ||
Alguna vez tuve
una discusión con un creacionista sobre la hemoglobina, el planteaba lo
siguiente:
“La hemoglobina (proteína de los
glóbulos rojos de la sangre), por ejemplo, planteó, de entrada no más, un
enigmático problema. Es cierto que está presente en el hombre y en los monos, lo
cual provocó un júbilo rayano en el trance místico (parece que algunos llegaron
a la "visión unitiva” con Darwin). El problema es que también está
presente en todos los vertebrados. Aquí los aplausos comenzaron a ralear, y
hasta hubo algunas voces que aconsejaron prudencia. Pero no faltaron los imprudentes, ya sea por
un exceso de fervor y falta de una adecuada dirección espiritual, o quizá por
algún resto de espíritu científico que los impulsó a tratar de ser coherentes;
no faltaron, digo, quienes prosiguieron las investigaciones y encontraron que
la susodicha hemoglobina -exactamente la misma clase de molécula- aparecía en
las lombrices de tierra, en las almejas, en algunos insectos e, incluso, en
algunas bacterias (!). ¡Qué horror! Y no era para menos: la hemoglobina no
aparecía en forma gradual y progresiva, perfeccionándose cada vez más a medida
que ascendía en la escala zoológica -como sería de esperar si la hipótesis
evolucionista fuera cierta- sino que aparecía ya perfecta en algunas bacterias,
luego desaparecía y volvía a aparecer en las almejas, luego en las lombrices,
etc., sin experimentar ningún cambio evolutivo.”
http://www.foros.catholic.net/viewtopic.php?p=425883&sid=e6c0b43b7e9a11d1dca2aee45068b96e
Este argumento
destaca el modo en que explicamos el funcionamiento y la estructura de la
hemoglobina, por lo general la mayoría de cosas que escribimos sobre la
anatomía se basan en el modelo humano, o de los mamíferos si introducimos la
información de ratones de laboratorio. Pero para tener una imagen más general
de los procesos evolutivos es indispensable tener a nuestra disposición
información comparativa de varios linajes.
8.1 Mas allá de los mamíferos
Si bien la
mayoría de los artrópodos emplean una hemoglobina de cuatro cadenas, ese no es
siempre el caso. En las lampreas por ejemplo se presenta una hemoglobina
compuesta por dos fragmentos (le falta el 50%) y siguen como si nada , de hecho
si seguimos alejándonos del parentesco en los artrópodos es un monómero una
proteína única con tercer nivel estructural (Doolittle, 1984;
Love et al., 1972; Ratner et al., 1996). De hecho, la misma proteína de la
hemoglobina se relacionan con ciertas proteínas de la cadena de transporte de
electrones en la respiración no solo en su secuencia sino también en su
interacción con el oxígeno (Wittenberg &
Wittenberg, 1990). Lo anterior se debe a que la cadena de
transporte de electrones emplea grupos hemo para que los electrones fluyan (Karp, 2013;
Pelletier & Kraut, 1992).
8.2 Genes duplicaods
y retrotrasposones
Los estudios
comparativos también se han conducido sobre los genes que sintetizan las
cadenas individuales de globinas, que a su vez forman el dímero y luego el
tetrámero, la cual ha revelado una rica historia de duplicaciones, loci
perdidos por mutaciones deletéreas y campos de posicionamiento del locus (Tejero &
Gladwin, 2014; Wajcman, Kiger, & Marden, 2009). Uno de los propósitos de los estudios de
evolución mediante genética comparativa es la de lograr un mejor entendimiento
de la aparición de los sistemas que regulan la expresión de los genes de
globinas de manera correcta, así como poder entender o plantear hipótesis
acerca de posibles intervenciones que pudieran realizarse para reparar los
sitios en caso de presentarse enfermedades. Muchas enfermedades humanas
vinculadas a las globinas resultan de una expresión genética inadecuada.
Ahora, uniendo
las dos líneas de investigación, la anatómica y la genética se encontró un
detalle impresionante, cuando se analizaron los genes para los dímeros
globinicos de las lampreas y mixinos se reveló que la secuencia de dichos
dímeros era diferente del dímero de los demás vertebrados, asemejándose más a
una proteína denominada CYGB o citoglobina. Lo cual sugiere que la función para
el transporte de oxígeno de las globinas que contienen el grupo hemo apareció
de manera independiente mediante evolución convergente (Storz, Opazo,
& Hoffmann, 2011).
8.3 Componentes de
un circuito eléctrico
Incluso de manera
mucho más arcaica, el grupo hemo y las globinas se encuentran fuertemente
vinculadas a los metabolismos basales como la respiración celular aeróbica y la
fotosíntesis, en ambos casos la función no es el transporte de electrones, sino
el transporte de electrones, constituyendo el propio circuito de las cadenas de
transporte de electrones. La coopción de los grupos heme y las globinas para el
transporte de oxígeno es un fenómeno secundario que deriva probablemente del
hecho de que en ambos cadenas de transporte de electrones, el oxígeno es un
componente importante, ya sea como desecho o como reactivo (Karp, 2013;
Pelletier & Kraut, 1992).
Lo anterior nos
lleva a una respuesta común basada en el naturalismo metodológico. Las
hipótesis evolutivas planteadas deben seguir algunas leyes de la física
preexistentes, la más básica es la ley de causalidad, todo efecto debe tener
una causa, o lo que es lo mismo, las cosas no aparecen de la nada, la evolución
no puede ser vista como un ente teleológico semejante a un mago que con un puff
hace aparecer un gen de la nada. Las estructuras biológicas solo aparentan
aparecer de la nada completamente formadas si se las analiza de manera aislada.
8.4 Otras
globinas
Aunque como pigmento circulatorio la
hemoglobina es púnica, como estructura evolutiva en los vertebrados mamíferos
como el ser humano, no lo es, existen otras globinas con funciones diversas.
Durante mucho tiempo se asumió que la hemoglobina y la mioglobina eran las
únicas globinas de los vertebrados. En el año 2000 se descubrió un tercer tipo
de globina, que sobre la base de su ubicación preferencial en el sistema
nervioso fue denominada neuroglobina(Burmester, Weich, Reinhardt, &
Hankeln, 2000).
Aunque aún se desconoce su función específica, se han planteado varias
hipótesis entre las que se destaca la que sugiere que puede descodificar las
especies reactivas del oxígeno y el nitrógeno. Otros estudios proponen que es
parte de una cadena de transducción de señales que transmite el estado redox de
la célula o que inhibe la apoptosis. Aunque algunas funciones son más probables
que otras, aún no se ha establecido definitivamente cuál es la función
fisiológica de la neuroglobina en los vertebrados. No obstante, no hay dudas de
que esta globina tiene una función esencial, conservada y que es beneficiosa
para las neuronas.
8.5 Mioglobina
La mioglobina es una hemoproteína
muscular, estructuralmente y funcionalmente muy parecida a la hemoglobina. Es
una proteína relativamente pequeña constituida por una cadena polipeptídica de
153 residuos aminoácidos y por un grupo hemo que contiene un átomo de hierro.
La función de la mioglobina es almacenar oxígeno. Menos comúnmente se la ha
denominado también miohemoglobina o hemoglobina muscular. Las mayores
concentraciones de mioglobina se encuentran en el músculo esquelético y en el
músculo cardíaco, donde se requieren grandes cantidades de O2 para satisfacer
la demanda energética de las contracciones.
Figura 8.1. Todas las
hemoproteínas se encuentran relacionadas filogenéticamente, aunque la más
antigua parece ser la neuroglobina.
La mioglobina fue la primera proteína cuya
estructura tridimensional se determinó experimentalmente. En 1958, John Kendrew
y sus colegas determinaron la estructura de la mioglobina empleando
cristalografía de rayos X de alta resolución. Por este descubrimiento, John
Kendrew obtuvo en 1962 el Premio Nobel de Química, compartido con Max Perutz.
Es una proteína extremadamente compacta y globular, en la que la mayoría de los
aminoácidos hidrófobos se encuentran en el interior y muchos de los residuos
polares están expuestos en la superficie. Alrededor del 78% de la estructura
secundaria tiene una conformación de hélice alfa; de hecho, existen ocho
segmentos de hélice alfa en la mioglobina, designados con las letras A a H.
Figura 8.2. Comparación
entre hemoglobina (Hb) y la mioglobina (Mb).
Dentro de una cavidad hidrófoba de la
proteína se encuentra el grupo prostético hemo. Esta unidad no polipeptídica se
encuentra unida de manera no covalente a la mioglobina y es esencial para la
actividad biológica de unión de O2 de la proteína. La mioglobina y el citocromo
B562 forman parte de las proteínas hémicas, que intervienen en el transporte y
fijación de oxígeno, el transporte de electrones y la fotosíntesis. Estas
proteínas poseen como grupo prostético un tetrapirrol cíclico o grupo hem, o
hemo, formado por cuatro anillos de pirrol planares enlazados por puentes de
alfa metileno. En el centro de este anillo existe un hierro(2+). En el caso del
citocromo la oxidación y reducción del átomo de hierro son esenciales para la
actividad biológica. Por el contrario, la actividad biológica de mioglobina y
hemoglobina se pierde si se oxida el Fe(2+).
En la mioglobina no oxigenada, el hierro
del hemo se encuentra aproximadamente a 0,03 nm fuera del plano del grupo en
dirección al residuo de histidina HisF8. La oxigenación de la mioglobina
produce el movimiento del átomo de hierro, ya que el oxígeno ocupa la sexta
posición de coordinación del hierro y desplaza el residuo HisF8 0,01nm fuera
del plano del hemo. Este movimiento de HisF8 produce el cambio conformacional
de algunas regiones de la proteína, lo que favorece la liberación de oxígeno en
las células deficientes de oxígeno, donde éste se requiere para la generación
de energía metabólica dependiente de ATP.
La capacidad de la mioglobina y la
hemoglobina para enlazar oxígeno depende del grupo hemo, que además confiere a
la hemoglobina y a la mioglobina su característico color rojo. El grupo hemo
consta de una parte orgánica y un átomo de hierro. La parte orgánica es la
protoporfirina IX, formada por cuatro grupos pirrólicos. Los cuatro pirroles
están unidos por medio de puentes meteno1 para formar un anillo tetrapirrólico.
A este anillo están enlazados cuatro grupos metilo, dos grupos vinilo y dos
cadenas de propionato. El átomo de hierro del hemo está ligado a los cuatro
nitrógenos en el centro del anillo de la protoporfirina. El hierro puede formar
dos enlaces covalentes con dos nitrógenos y dos enlaces los cuales son enlaces
no covalentes o coordinados con los otros dos nitrógenos y también con las
hisitidinas presentes en la posición 63 y 94 las cuáles sostienen al anillo
pirrólico, uno a cada lado del plano del hemo. Estos lugares se denominan la
quinta y sexta posiciones de coordinación. La quinta posición se coordina con
un residuo de histidina en la hélice F de la hemoglobina (histidina proximal),
mientras que la sexta posición es ocupada por el oxígeno. Cerca de donde se une
el oxígeno al grupo hemo existe otra histidina (histidina distal). El átomo de
hierro del hemo puede estar en estado de oxidación (+2) o (+3). Las formas
correspondientes de la hemoglobina se denominan ferrohemoglobina y
ferrihemoglobina (o metahemoglobina), respectivamente. Solamente la
ferrohemoglobina (+2) puede captar oxígeno.
8.6 Neuroglobina
La Ngb fue descubierta en 2000 y recibió
su nombre por su localización preferencial en el sistema nervioso, en especial
en áreas del cerebro que se han adaptado al estrés fisiológico, como son las
neuronas de la corteza cerebral, el hipocampo, el tálamo, el hipotálamo, el
cerebelo y la retina. También se encuentra en el sistema nervioso periférico y
en el páncreas, en los islotes de Langerhans (Burmester et al., 2000). Desde entonces, se han identificado Ngb en diferentes mamíferos,
aves, reptiles anfibios y especies de peces.
Su estructura es muy semejante a la Mb: es
un monómero de 150 aminoácidos con una masa molecular de 17 kDa y rasgos
típicos del plegamiento de las globinas. Esta proteína une varios ligandos
gaseosos como O2, monóxido de carbono y óxido nítrico. Sin embargo, en ausencia
de un ligando externo hay diferencias estructurales significativas de la Hb y
la Mb con la Ngb. Las 2 primeras son conocidas como globinas pentacoordinadas
pues el hierro(2+) es unido por los 4 átomos de nitrógeno del anillo porfirina
y la histidina proximal de la hélice F (HisF8). Mientras la Ngb es una globina
hexacoordinada, o sea, en el estado desoxi, la histidina distal de la hélice E
(HisE7) está unida a la sexta posición de coordinación del hierro(2+). Luego,
cualquier ligando externo tiene que competir con la HisE7 para la unión del
hierro(2+). La hexacoordinación es un rasgo de varias globinas de plantas,
bacterias, invertebrados vertebrados, pero su significado funcional aún no es
bien conocido (Burmester & Hankeln, 2004;
Pesce et al., 2003; Vallone, Nienhaus, Brunori, & Nienhaus, 2004).
En el sistema nervioso central (SNC) todas
o casi todas las neuronas expresan Ngb; sin embargo existen diferencias
cuantitativas entre las diferentes poblaciones neuronales. Mientras que en
ratones la concentración total de la proteína en el cerebro es baja (menos de 1
µmol/L) el nivel en las neuronas de la retina, que requieren grandes cantidades
de O2, es entre 50 y 100 veces mayor.4 La presencia de esta globina como
proteína respiratoria en el SNC y otros tejidos nerviosos puede tener
importantes implicaciones médicas y fisiológicas.
8.7 Citoglobina
La citoglobina es una molécula globular ubicuamente expresada
en todos los tejidos y usada más notablemente en mamíferos marinos. Fue
descubierta en el 2001 y
llamada citoglobina en 2002. Se cree que protege contra la hipoxia.
La función predicha de la citoglobina es transferir el oxígeno de la sangre
arterial al cerebro (Pesce et al., 2002).
9. Reciclado de la hemoglobina
|| Regresar al Índice ||
Los eritrocitos son transportados por el
sistema circulatorio. La vida media de un glóbulo rojo en la sangre circulante
es de aproximadamente 120 días, iniciando su vida en el núcleo de los huesos,
especialmente de los huesos largos, hasta que se vuelven viejos.
Aproximadamente 200 mil millones de eritrocitos nuevos son producidos cada día
para reemplazar a los que se pierden por envejecimiento. La muerte de los
eritrocitos poseen diversas formas de morir, algunos simplemente se revienta en
el plasma de la sangre.
9.1 La suerte de los glóbulos rojos
La mayoría simplemente son fagocitados por
células del sistema inmune llamados macrófagos.
Otros al ser ya muy rígidos por ser viejos explotan al pasar por los
capilares, los capilares son vasos sanguíneos
tan delgados que requiere que los eritrocitos se deformen para pasar por ellos.
De cualquier forma, la hemoglobina generada debe ser reciclada debido a su alto
contenido de aminoácidos y de hierro, y eso no debe desperdiciarse. La
hemoglobina liberada puede tomar dos rutas, en la primera esta es capturada por
una proteína de transporte denominada haptoglobina; mientras que en la segunda,
las cuatro globinas y los cuatro grupos heme se rompen y separan.
El grupo heme se une a una segunda proteína transportadora soluble en plasma llamada hemopexina, que al igual que la haptoglobina es removida del sistema circulatorio por los macrófagos del hígado. En el caso de la hemoglobina capturada de manera completa por la haptoglobina, cuando esta es absorbida por los macrófagos sufre el rompimiento, liberando globinas y los grupos hemo. Mientras que las globinas son reingresadas al metabolismo como fuente de aminoácidos y reusados para la construcción de nuevas proteínas. El grupo hemo por su parte es roto de forma tal que libera hierro soluble iónico y una molécula denominada biliverdina, una sustancia verde que posteriormente es reducida a bilirrubina
Figura 9.1. La bilirrubina.
9.2 La bilirrubina
La bilirrubina se une a otra proteína de
transporte denominada albumina y es enviada al hígado donde de conjuga de
manera química a otra sustancia denominada glucoronida, y finalmente ser
segregada en la bilis. Una vez en la bilis se segrega en el duodeno donde sigue
la ruta hasta salir por el ano. Básicamente la eliminación de bilirrubina es la
única función excretora del sistema intestinal. La bilirrubina conjugada y
no-conjugada se mide de forma clínica para monitorear la función del hígado y
de la vesícula biliar.
Cuando la bilirrubina no se segrega en el
duodeno, empieza a circular por la sangre. Uno de sus síntomas principales, es
que la bilirrubina es un pigmento amarillo-anaranjado, lo cual con el tiempo se
acumula en los tejidos tinturándolos de amarillo/anaranjado, lo cual a su vez
genera un cuadro clínico denominado ictericia (Figura 9.3).
Otro cuadro clínico que puede diagnosticarse con la medición de la bilirrubina es la anemia hemolítica, que es cuando los eritrocitos aun jóvenes explotan de manera espontánea, liberando grandes cantidades de hemoglobina en la sangre, lo cual a su vez provoca una alta producción de bilirrubina por parte del hígado. Una de las causas de la hemolisis temprana puede ser por alteraciones en la forma de los eritrocitos como en la anemia falciforme.
Figura 9.2. La forma de los
glóbulos rojos, están condicionados por la forma de la hemoglobina que
contienen.
9.3 Reciclado del hierro
El hierro permanece en tres formas,
ferritina (almacenamiento) transferrina (transporte); enzimas (como la
hemoglobina o la mioglobina). El hierro de dieta es capturado por la
transferrina e integrado al ciclo; mientras que la perdida de hierro se da
generalmente en forma de ferritina.
Figura 9.3. Ictericia.
La mayor parte de hierro liberado de la destrucción
del grupo hemo es reciclado para la síntesis de nueva hemoglobina. La historia
del reciclaje del hierro comienza cuando este es segregado al plasma desde el
interior de los macrófagos gracias a una proteína de transporte insertada en la
membrana del macrófago llamada ferroportina. Una vez en el plasma el hierro se
oxida a su máximo generando el ion hierro(3+), el cual es capturado por una
proteína de transporte llamada transferrina. Las células encargadas de la
síntesis de grupo hemo o de otras proteínas dependientes del hierro poseen receptores
en sus membranas que se unen a la transferrina y la internalizan. Una vez en el
interior de la célula, el hierro férrico es liberado de la transferrina y
reducido al estado hierro(2+), y luego de ello utilizado para sintetizar grupo
hemo o para almacenarlo en un complejo proteínico llamado ferritina.
Cuando el hierro es requerido la ferritina
es catabolizada a hemosiderina, un compuesto insoluble que consiste en
elementos cristalinos de ferritina. Normalmente la hemosiderina puede ser usada
para otras cosas, como la síntesis de grupo hemo, pero si se acumula mucha en
poco tiempo puede generar daños a las células y alterar órganos vitales. A
pesar de que el reciclaje del hierro es muy eficiente, pequeñas cantidades de
hierro se pierden de manera continua y debe ser recuperado mediante el consumo
de hierro por el sistema digestivo. La pérdida y hierro es especialmente grave
en las mujeres debido al sangrado menstrual. La mayoría del hierro se deriva de
grupo hemo en la carne de consumo (generada por la mioglobina), aunque algunos
vegetales como los frijoles también lo proveen. El hierro también se puede
absorber de manera inorgánica (hierro(3+) o hierro(2+))
10. Hemocianina
|| Regresar al Índice ||
La hemocianina es un pigmento de transporte de oxígeno, generalmente se la abrevia con el símbolo Hc, siendo común en los invertebrados como análogo de la hemoglobina. Es el segundo pigmento de transporte de gases de importancia metabólica más frecuente. La Hc no se vincula a células, sino que se encuentra diluida directamente en la hemolinfa.
Figura 10.1. La hemocianina es de color azul.
Al igual que la hemoglobina, la hemocianina es una
metaloproteína con un grupo prostpético que sirve como el marco para el ion que
oscila en estados oxidado y reducido a medida que se une o se desprende del
oxígeno. A diferencia de la hemoglobina, en la hemocianina los átomos del metal
no están unidos a un grupo de porfirina sino a grupos prostéticos proteínicos
con contenido de histidina. La oscilación de color va desde el transparente
cobre(1+) cuando se encuentra desoxigenada a un azul intenso debido a la
oxidación a cobre(2+) cuando se une al oxígeno. Los dos centros metálicos no
están en contacto directo, pero sí muy próximos entre ellos. La molécula de
oxígeno se inserta entre los dos átomos de cobre, los cuales cambian su estado
de oxidación, de 1+ a 2+, cediendo un electrón cada uno a la molécula de
oxígeno. Como consecuencia, ésta se reduce pasando a peróxido (peróxido de
hidrógeno desprotonado). La transferencia de los electrones a pares evita la
formación del ion superóxido (Coates & Nairn, 2014)
10.1 Distribución
taxonómica
La hemocianina se
encuentra más localizada que la hemoglobina, encontrándose únicamente en los
moluscos y los artrópodos, y al igual que en la hemoglobina, la palabra
hemocianina es más una sombrilla para una amplia gama de moléculas relacionadas
funcional y evolutivamente como las fenoloxidasas, las hexamerinas, las pseudohemocianinas/criptocianinas
y los receptores hexamerinicos.
La fenoloxidasa
es un derivado de la hemocianina que contiene tirosinasas entre los cobres.
Estas proteínas están involucradas en la esclerotización de la cutícula de los
artrópodos, el sellamiento de las heridas, y el sistema inmune humoral. Las hexamerinas son proteínas de almacenamiento
encontradas en los insectos. Estas proteínas se generan en los cuerpos
larvarios para almacenar grasa y están asociadas a los ciclos de metamorfosis
y/o cambio de pieles. La criptocianina corresponde a un homólogo de la
hemocianina, pero sin el grupo prostético (Coates &
Nairn, 2014; Jaenicke, Pairet, Hartmann, & Decker, 2012; MARKL, 1986; Pick
et al., 2014; Terwilliger, 2015; Voit, Feldmaier-Fuchs, Schweikardt, Decker,
& Burmester, 2000).
10.2 Anticancerígeno
La hemocianina
encontrada en los cangrejos de herradura posee efectos inmunoterapeuticos
contra el cáncer de vejiga, así como un potente antibacteriano e inductor de la
respuesta inmune. La biotecnología ha
aprovechado esta capacidad de la hemocianina para diseñar las "vacunas del
futuro", que no inocularán virus o bacterias atenuados, sino pequeños
trozos de proteínas que inducen y potencian la producción de anticuerpos
específicos. También para desarrollar alternativas más eficientes en el
tratamiento de algunos cánceres humanos (Guncheva et al.,
2016; Lee, Collins-Hall, Hendrick, & Brabetz, 2016).
Las hemocianinas
están entre las proteínas más grandes y complejas que se conocen en la
naturaleza. Cuando son inyectadas en los mamíferos en muy pequeñas cantidades,
el sistema inmune, que vela por la salud, las reconoce como extrañas (antígeno)
desarrollándose una reacción en cadena de alerta y activación de un conjunto de
células, como células fagocíticas y linfocitos, quienes realizan la vigilancia
y destrucción permanente de los antígenos que ingresan al cuerpo, ya sean
microorganismos como bacterias, virus y hongos o también células tumorales (McFadden, Riggs,
Jackson, & Vona-Davis, 2003; Orlova et al., 1997; Riggs, Jackson,
Vona-Davis, & McFadden, 2002). Por esta razón, se dice que las Hemocianinas son
un poderoso inmunoestimulante, propiedad que las hace un material invaluable en
biotecnología para desarrollar una variada gama de productos ya sea para la
salud humana y animal, o para desarrollar investigaciones en Biomedicina y
también, productos aplicables en empresas productivas.
10.3 Base para
vacunas
También, se
utiliza Hemocianina en el diseño de las “vacunas del futuro” en las cuales ya
no se ocupan los virus ni las bacterias atenuadas, sino que se identifican en
dichos patógenos trocitos de proteínas (péptidos) que inducen la respuesta
inmune, luego se sintetizan artificialmente y se pegan químicamente a
Hemocianina (Swartz, Batich,
Fecci, & Sampson, 2015; Tam, 1988; Tam & Lu, 1989). De esta forma, la Hemocianina transporta
los péptidos de los patógenos de interés y además, por sus propiedades de
inmunoestimulante, potencia y hace más vigorosa y efectiva la respuesta que nos
mantiene protegidos contra ellos. Por esto mismo también, actualmente se
utiliza Hemocianina como alternativa terapéutica frente a la quimioterapia y
radioterapia en el tratamiento de algunos tipos de cáncer que afectan a
humanos, como es el cáncer superficial de vejiga, con la ventaja que ella no
produce efectos secundarios (Antonova et al.,
2015; Boyanova, Dolashka, Toncheva, Rammensee, & Stevanović, 2013; Stenzl
et al., 2016). Estos auspiciosos resultados han llevado
a que hoy se realizan estudios para evaluar su efectividad en otros tipos de
tumores, como melanoma maligno y cáncer de mama y ovario, aumentando aún más
las potencialidades de uso de esta notable proteína.
11. Otros pigmentos sanguíneos
|| Regresar al Índice ||
11.1 Clorocruorina
La clorocruorina
es una hemoproteína portadora del oxígeno de muchos anélidos, y destaca porque
presenta una coloración verde cuando está desoxigenada (en contraste con el
rojo intenso de la hemoglobina), aunque es de color rojo claro cuando contiene
oxígeno.
Figura 11.1. La clorocruorina es de color verde.
Contrario a lo
que se esperaría de su nombre, el grupo prostético no es a base de cloro, sino
de hierro, de hecho al ser una hemoproteína eso significa que su grupo
prostético es el grupo hemo, como en las hemoglobinas. La diferencia radical es
simplemente que se torna verde cuando no porta oxígeno. Su estructura es muy
similar a la de la eritrocruorina (que también es muy similar a múltiples
subunidades del VIH y mioglobina) y contiene muchas subunidades parecidas a la
mioglobina de 16-17kDa ensambladas en un complejo gigante de más de cien
subunidades con proteínas entrelazadas, de un peso total de más de 3.600kDa.
Debido a su estructura de macromolécula gigante, la clorocruorina flota
libremente en la sangre. La única diferencia significativa entre la clorocruorina
y la eritrocruorina es que la primera tiene una estructura de los grupos hemo
anormal (Linzen, 2013).
11.2 Hemeritrina
La hemeritrina es
una proteína oligomérica responsable del transporte de oxígeno en invertebrados
marítimos y el gusano anélido, magelona. No contiene el grupo hemo. La
hemeritrina es transparente cuando se encuentra desoxigenada, pero cambiando
aun tono violeta-rosado cuando se encuentra en estado oxigenado. Estudios
recientes sugieren que se trata de una proteína multifuncional relacionada
también con la respuesta inmune y la regeneración tisular de los gusanos (Linzen, 2013).
11.3 Hemovanadina
Basada en el
vanadio, no es un pigmento respiratorio y su color base es el verde, pero al
mezclarse con la hemocianina hace que la sangre adquiera un tono anaranjado
marrón (Linzen, 2013).
12. Las funciones de la sangre
|| Regresar al Índice ||
Habiendo trabajado los preconceptos, es hora de lo bueno, y
la razón por la cual muchos de ustedes abran llegado aquí, la sangre. La sangre
es un fluido corporal vital especializado en el transporte de sustancias. Por
lo general la sangre está compuesta por una matriz líquida o plasma y células
del tejido sanguíneo circulante, siendo las más importantes las que se encargan
del transporte de gases de importancia metabólica llamadas eritrocitos, las
células de defensa o inmunes llamadas leucocitos y las células se sellamiento
para cortes en los vasos sanguíneos. Hay que destacar que en la última
categoría los mamíferos no usan células para tapar sus heridas, sino fragmentos
de células que llamamos plaquetas. Las células producidas por
los tejidos hematopoyéticos que forman los eritrocitos, leucocitos y plaquetas
usualmente ingresan al sistema circulatorio para convertirse en sangre
circulante o periférica.
La sangre
circulante está formada por el plasma y los componentes celulares. El plasma es
un fluido, que puede imaginarse como en componente básico de la sangre y es una
especie de tejido conectivo. Los elementos celulares son células disueltas en
el torrente sanguíneo y que cumplen una gran variedad de funciones. El
componente más famoso es el eritrocito o glóbulo rojo. Todos los eritrocitos
poseen núcleo a excepción de los que pertenecen a los mamíferos “lo que implica
que los humanos tenemos eritrocitos sin núcleo”. La hemoglobina es el pigmento
de transporte de oxigeno es segregado por los riñones y disuelto en el plasma,
luego, los eritrocitos lo capturan, actuando como contenedores de este evitando
que sea eliminado del cuerpo por un periodo de tiempo determinado.
El tamaño de los
eritrocitos varía dependiendo del animal, desde 8 micrómetros en los humanos, a
9 micrómetros en los elefantes, a incluso 80 micrómetros en algunas
salamandras. La mayoría de los eritrocitos poseen una vida media de 3 a 4 meses
dependiendo de la especie, antes de ser eliminados. Los glóbulos blancos o
leucocitos son células relacionadas con la función inmune del cuerpo al igual
que el resto de células relacionadas con el cómo las células asesinas
naturales, los fagocitos y los linfocitos.
Las plaquetas son el tercer elemento celular disuelto en la sangre.
Ellas segregan factores que producen una cascada de eventos químicos que
conllevan a la generación de coágulos o trombos en los sitios donde los vasos
sanguíneos se dañan. El plasma está formado por elementos que le otorgan a la
sangre una gran variedad de funciones en los procesos vitales. Bueno, para
hablar en serio, la sangre toma parte en prácticamente todas las funciones del
cuerpo que no ocurren en el interior de una célula.
Las células
sanguíneas interactúan con las células de los tejidos por medio del sistema de
capilares manteniendo un ambiente en condiciones constantes que incluyen un pH,
concentración salina, temperatura y azucares. Por lo anterior, las pruebas de
sangre son métodos usuales para el diagnóstico de irregularidades en la
homeostasis del cuerpo. La sangre también juego un rol vital como órgano
inmune. La sangre es por lo tanto un tejido complejo y dinámico que lleva a
cabo 4 principales funciones: transporte de sustancias, detención del sangrado,
mantenimiento del balance interno y protección contra las infecciones. El plasma y los
componentes celulares deben actuar al unísono para llevar a cabo estas
funciones.
12.1 Transporte
La sangre es el medio principal para el transporte a larga distancia entre los tejidos del cuerpo de los animales. Transporta una abundante cantidad de sustancias indispensables desde un área del cuerpo a otra donde es requerida, incluyendo anticuerpos, ácidos y bases, iones salinos, vitaminas, cofactores, hormonas, nutrientes, lípidos, pigmentos, metabolitos “desechos” y minerales. Estas sustancias pueden encontrarse disueltas de manera libre en el plasma o atadas a proteínas que les permiten disolverse. Por ejemplo, la mitad de los iones de calcio II se encuentran disueltos de manera libre, mientras que la otra mitad se encuentran vinculados a la proteína albumina y otros iones solubles.
Figura 12.1. El transporte de
sustancias en la sangre se logra gracias a la parte acuosa del plasma que
disuelve algunas sustancias, a las proteínas del plasma que permiten disolver
las demás sustancias que no son solubles y a las células de transporte como los
glóbulos rojos.
Algunas otras
sustancias son transportadas en el interior de elementos celulares
(eritrocitos) como los gases de importancia metabólica (el oxígeno molecular y
el dióxido de carbono) atados a proteínas específicas (hemoglobinas).
Adicionalmente al transporte de sustancias, la sangre también transporta calor,
siendo el responsable de la manutención de niveles constantes de calor en todo
el cuerpo, así como de la termorregulación con respecto al ambiente externo por
medio de los capilares que se encuentran en la piel.
12.2 Hemostasis
La homeostasis es
un estado dinámico que provee un ambiente interno óptimo para desempeñar todas
las funciones vitales de una célula, un tejido o un organismo. La manutención
de la homeostasis se logra por dos rutas, detención del sangrado, mantenimiento
del balance interno.
Detención del sangrado: Si un vaso sanguíneo se rompe y la sangre empieza escapar, se corre el
riesgo de perder las condiciones internas del cuerpo, así como una falla
catastrófica de los tejidos alimentados por el vaso sanguíneo en cuestión. Por
esta razón la detención del sangrado es uno de los mecanismos en los que se
mantiene la homeostasis. Por lo general esta función es llevada a cabo por
las plaquetas.
Mantenimiento del balance interno: El sistema sanguíneo se encuentra integrado a y controlado por los
sistemas nervioso y endocrino, posee válvulas especializadas para permitir el
paso de sangre a unos tejidos y a otros no, de acuerdo a las necesidades
oportunas, por lo general en condiciones de necesidad, la sangre será enviada a
los órganos vitales sin importar nada más. Un ejemplo de esto puede generar
condiciones patológicas, por ejemplo, un alpinista expuesto a una tormenta muy
fría llevara su sangre a los órganos internos para mantenerlo vivo, pero esto
puede causar la muerte celular de los tejidos de sus extremidades generando
gangrena. La homeostasis es un proceso delicado, pero dinámico, fluye y cambia
todo el tiempo para (aunque sea paradójico) mantener las condiciones de los
tejidos lo más estables posibles para que puedan realizar sus funciones. Por lo
general, las células más sensibles a las alteraciones de la homeostasis son
aquellas que poseen un nivel metabólico muy alto, específicamente las células
neuronales y nerviosas.
12.3 Inmune
La función inmune
de la sangre es llevada a cabo por los leucocitos, los cuales afrontan la
batalla contra las infecciones. Aunque la piel y las mucosas se encargan de ser
barreras de primera línea, los microorganismos constantemente logra
sobrepasarlas y pueden amenazar con generar una infección. Los leucocitos
actúan en conjunto con proteínas generadas por ellos mismos patrullan el
torrente sanguíneo para detectar agentes extraños. En la mayoría de los casos,
el sistema inmune es tan eficiente en su función, que ni siquiera se generan
síntomas de enfermedad.
13. La sangre como un tipo de tejido conectivo
|| Regresar al Índice ||
Un adulto
promedio posee cerca de 5 litros de sangre total, con rangos que varían entre 5
y 6 litros para los hombres; y 4.5 y 5.5 litros en las mujeres. Alrededor del
55% corresponde a la porción líquida. El resto corresponde a la porción soluble
que se agrupa entre las proteínas y las células. La sangre representa entre el
6 al 8 por ciento del peso total de un adulto saludable.
A pesar de que, a
simple vista, definir a la sangre suena relativamente extraño, cuando
examinamos la definición del tejido conectivo la cosa cobra más sentido. El tejido conectivo se define como un
conjunto de células rodeadas por una matriz extracelular, y en el caso de la
sangre la matriz extracelular es el plasma, la parte liquida de la sangre. Los
elementos celulares se los puede distinguir en tres categorías celulares
generales, los glóbulos rojos que se relacionan con la respiración celular, la
respiración organísmica y las respiraciones externa e interna.
También están los
glóbulos blancos, los cuales son un grupo de células especializadas en la
defensa del cuerpo, existen muchos tipos de glóbulos blancos, y sus efectos
para la defensa varían mucho, algunos rodean a los elementos invasores y se los
comen (fagocitosis) otros segregan proteínas especializadas las cuales marcan a
los elementos extracelulares haciéndolos más fáciles de reconocer, comer o
eliminándolos directamente. Por último, se encuentran las plaquetas que se
encargan de sellar las lesiones que puedan afectar la integridad de los vasos
sanguíneos.
13.1 Sangre roja
En los esquemas
de estudio del sistema circulatorio siempre se utiliza un código de colores,
los cuales representan fenómenos reales macroscópicos y moleculares. En este
caso dos son los colores a los que generalmente nos referiremos. La sangre que
porta oxigeno es de un color rojo intenso, el rojo se debe al color que
adquiere un ion de hierro presente en una proteína especializada que sirve de
marco para este ion, la hemoglobina.
Figura 13.1. Los colores reales de la sangre desoxigenada "izquierda" portadora de dióxido de carbono disuelto; y de la sangre oxigenada "derecha" portadora de oxígeno molecular disuelto.
13.2 Sangre azul
La sangre desoxigenada
se representa en los esquemas como azul, aunque su visualización anatómica real
es de un rojo oscuro esta diferencia se explica debido a que estas sangres
rojas oscuras al pasar por las venas las pigmentan de un color azul cianótico,
debido a un fenómeno visual llamado deflexión, cuando un rayo de luz atraviesa
un medio diferente este cambia de dirección y por lo tanto de color. Los
términos científicos/médicos relacionados con sangre total siempre comienzan
con los prefijos hemo o hemato de la palabra griega haima que significa
literalmente, sangre. Por ejemplo, hemólisis significaría rompimiento de la
sangre, lo que generalmente se entiende más como la destrucción de los glóbulos
rojos cuando estos estallas como su fueran una bomba de aire atravesadas por un
alfiler. Otro ejemplo es el de hematología, que significa el estudio de la
sangre y hematólogo que es el especialista que se encarga de estudiar la
sangre.
Figura 13.2. El color de la
sangre venosa sistémica en los esquemas no obedece a su color real, si no al
color con que vemos las venas a través de la piel en individuos con pieles
claras en los que se pueden ver las venas.
Para poder
estudiar la sangre total en el laboratorio, se debe adicionar a la mezcla un
anticoagulante para evitar la generación de trombos al activarse las plaquetas
disueltas en el plasma. Cuando las plaquetas generan un trombo, la apariencia
fluida de la sangre total desaparece, para convertirse en una masa gelatinosa
en la cual los reactivos que se utilizan para los análisis no podrían mezclarse
y mucho menos diluirse, fenómeno necesario para poder realizar las pruebas.
13.3 La
sangre venosa y la sangre arterial
La extracción de sangre es necesaria para las pruebas hematológicas. La muestra de sangre es generalmente obtenida de una vena del brazo (venipunctura). En los recién nacidos, la sangre es recolectada mediante una punción en el talón “imagen siguiente”.
Figura 13.3. Punción de talón.
La sangre de una arteria es generalmente
obtenida para medir la presión de gases sanguíneos como el oxígeno, el dióxido
de carbono y el ácido carbónico molecular. Para determinar los cambios de sus
niveles antes de ingresar al sistema de capilares y así realizar un contraste
entre la sangre venosa sistémica y la sangre arterial sistémica. Por lo
general, para muchas sustancias en la sangre, sus concentraciones varían muy
pocos en el lado arterial y en el lado venoso.
13.4 La sangre venosa como reservorio de sustancias
Para muchas drogas y sustancias
metabólicamente importantes como los azucares o las grasas, la concentración en
el lado arterial es mayor que en el lado venoso, debido al consumo que se da en
los capilares por parte de los tejidos celulares. Y del mismo modo, algunos
metabolitos de desecho serán más comunes en el lado venoso, debido a que estos
son segregados a la sangre en los capilares. Sin embargo, la toma de sangre de
una arteria suele evitarse debido a que mucho más dolorosa que la que se
obtiene en una vena.
La sangre se recolecta en tubos de ensayo especializados que generalmente tienen una capacidad de 7 ml. Las tapas de los tubos poseen una coloración estandarizada dependiendo del aditivo y de los propósitos.
Figura 13.4. Tubos de ensayo
especializados para diferentes pruebas de sangre.
Por ejemplo, tubos con tapa purpura contienen EDTA para extraer el calcio, un componente crítico para que la sangre se pueda coagular. Estas muestras generalmente se utilizan para análisis de sangre total y para análisis en bancos de sangre. Tubos de ensayo con tapas azules contienen citrato de sodio, el cual también sirve para extraer el calcio y de esta forma producir plasma. En tubos verdes el anticoagulante es la heparina el cual es otra forma de obtener plasma para una variedad de pruebas químicas. Los tubos rojos no tienen anticoagulantes como aditivos, si no, lo opuesto, es decir compuestos que inducen una coagulación acelerada de la sangre, para poder obtener suero.
14. El plasma
|| Regresar al Índice ||
Químicamente, la
parte liquida de la sangre puede entenderse como una solución química, como es
muy acuosa, es un medio se solución relativamente polar. Este solvente
participa en muchas reacciones químicas generalmente relacionadas con la
disociación en un medio líquido polar de muchas sustancias iónicas. Por
ejemplo, los ácidos tienden a desprotonarse en el plasma, generando iones
hidronio y el ion inorgánico en cuestión, un ejemplo es el ácido carbónico
“ahora llamado dihidrogeno(trioxidocarbonato)”, el cual en la sangre se disocia
de acuerdo a su equilibrio químico para formar iones bicarbonato “ahora llamado
hidrogeno(trioxidocarbonato)(1-)” carbónico “ahora llamado
trioxidocarbonato(2-), un ion protio(1+) y moléculas de ácido molecular en
estado de equilibrio químico.
Muchas de las sustancias en la sangre son
de naturaleza orgánica que experimentan disociaciones incompletas, es decir son
electrolitos débiles que se disuelven mediante un equilibrio químico, tal es el
caso del dihidrogeno(trioxidocarbonato) “H2CO3” o ácido carbónico, el cual es
producido cuando el dióxido de carbono producido por el metabolismo celular
reacciona con el agua del plasma, a su vez y de manera instantánea el
dihidrogeno(trioxidocarbonato) experimenta dos reacciones de equilibrio,
generando el ion hidrogeno(trioxidocarbonato)(1-) “HCO3(1-)” y el ion
trioxidocarbonato(2-) “CO3(2-)”. Todas las especies de esta reacción conviven
de manera mutua en un estado de equilibrio dinámico en la sangre. La alteración
en la cantidad de una especie afecta al resto, por ejemplo, un incremento de
gas carbónico genera un incremento de todas las especies hasta llegar a un
nuevo equilibrio y viceversa.
Otras moléculas
polares que experimentan la disociación al estar en el medio acuoso del plasma
son los iones de diferentes sales, por ejemplo, la sal de cocina al estar en la
sangre nunca se encuentra de forma molecular, si no en forma iónica disociada,
como iones cloruro(1-) y iones sodio(1+). Los constituyentes más comunes del
plasma sanguíneo son las proteínas. Otros constituyentes incluyen nutrientes
como azúcares, aminoácidos, lípidos solubles o contenidos en estructuras
solubles como los quilomicrones, los cuales deben ser transportados hacia los
tejidos.
El plasma es la parte liquida de la sangre. Está compuesta en su mayoría por agua (93%) la cual es responsable de las propiedades como solvente y el restante 7% es una combinación de solutos (6% sustancias orgánicas y el restante 1% sustancias inorgánicas). El plasma puede obtenerse al recolectar sangre total con un anticoagulante como el ácido etilenadiaminatetracetico (EDTA), citrato o heparina. Luego, una centrifugación por unos 5 minutos separara la sangre. La forma en que aparece el resultado es bastante clásico, una capa de plasma amarillo en la parte superior, una pequeña capa intersticial de células blancas y una parte inferior de células rojas.
Figura 14.1. Al centrifugar una muestra de sangre tratada de manera apropiada
con un anticoagulante se obtienen tres fracciones que corresponden a varios
tipos de componentes celulares. En el fondo se encuentra la fracción de los
glóbulos rojos, en medio hay una capa muy fina y en ocasiones difícil de ver
compuesta por los glóbulos blancos y en la parte superior quedan el plasma con
sus componentes inorgánicos.
Los colores del
plasma pueden variar dependiendo de la interpretación, pero en general la
podemos visualizar como una sustancia turbia de un color amarillo grisáceo
pálido. Cuando este aparece lechoso significa que existe una gran cantidad de
lípidos disueltos, lo cual puede deberse a una enfermedad, o a que simplemente
les sacaron sangre poco tiempo después de comer. Las muestras más rojas pueden
deberse a hemolisis, lo que quiere decir que los glóbulos rojos explotaron
liberando la hemoglobina en la solución. Cuando a la sangre se le permite
coagular, usualmente en un periodo de tiempo de 15 a 30 minutos, el líquido
remanente, después de centrifugarlo adquiere la denominación de suero. El suero
es un líquido claro bastante similar al agua, pero con una concentración de
sales muy específica.
Para muchas
pruebas bioquímicas, el plasma y el suero pueden usarse de manera indistinta.
Para algunas pruebas solo puede usarse el suero, debido a que los factores de
coagulación interfieren con los ensayos. Para pruebas de coagulación solo el
plasma puede ser usado, porque se requieren los factores de coagulación para
ver cómo se están comportando. El plasma puede ser almacenado a una temperatura
de – 20 °C para análisis futuros, pero este debe ser congelado entre 6 a 8
horas después de la donación para preservar los factores de coagulación.
El plasma
congelado puede ser almacenado en bancos de sangre por 1 a 7 años y puede ser
usado para terapias de plasma. El suero también es usado como un suplemento de
sales para medios de cultivo en biología de tejidos, biología
celular, bacteriología y virología. La enorme cantidad de proteínas,
nutrientes, hormonas, iones salinos y factores unidos convierten al suero como
un excelente medio de cultivo para el crecimiento de células in vivo.
Figura 14.2. Los
quilomicrones son un mecanismo para el transporte de lípidos en su interior. La
membrana externa está hecha por fosfolípidos los cuales son lípidos especiales
capaces de diluirse en agua gracias a sus grupos fosfato (cabezas azules)
15. Iones del plasma
|| Regresar al Índice ||
Cerca del 55% de la sangre total está
hecha de plasma, la parte liquida de la sangre. El plasma contiene electrolitos
(sustancias generadas por la electrolisis, es decir el rompimiento de una
molécula en un solvente polar), los cuales pueden ser iones cargados
negativamente (aniones) o positivamente (cationes), sustancias que le confieren
conductividad eléctrica a los líquidos como el agua o el plasma.
La sangre es electroneutra, lo que quiere
decir que las cargas positivas se anulan con las negativas, básicamente la
única evidencia de la presencia de los electrolitos es la tremenda
conductividad de nuestros cuerpos a la electricidad. El catión sodio I es el
ion positivo más abundante en la sangre, mientras que los aniones más comunes
son el ion cloro I o el grupo bicarbonato. Estos tres solutos son los
componentes que generan la mayoría de la presión osmótica en la sangre. Es
decir, pérdidas o ganancias de sodio I por ejemplo provocaran disminución o
incremento en el volumen de agua, respectivamente. Algunos electrolitos son
proteínas, las cuales tienen carga negativa al pH fisiológico. Existen cerca de
1400 tipos de proteínas disueltas en el plasma que han sido identificadas.
Las proteínas son necesarias para
prácticamente todo en las células y los tejidos: ellas funcionan como enzimas
que aceleran las reacciones químicas, hormonas que controlan el orden de las
reacciones químicas del cuerpo, anticuerpos que protegen al cuerpo de
invasiones, transportadores que se unen a sustancias no solubles y les permiten
solubilizarse en el plasma. Las proteínas también contribuyen al balance
osmótico y al balance acido base o pH. Inclusive, debido a sus esqueletos de
carbono y a que son moléculas grandes de estado reducido, pueden ser usadas
como fuentes de energía durante condiciones de necesidad.
Se los clasifica en microelementos y traza
según las cantidades en mg que se necesitan: los microelementos se necesitan
más de 100 mg por día. Se hallan en el organismo como partículas cargadas
eléctricamente (iones, electrolitos), sirven para conservar la polaridad de
eléctrica de la membrana celular, para mantenerla presión osmótica y para
producir las señales nerviosas. Contrarrestan tanto las sustancias ácidas como
las alcalinas, preservando la neutralidad del medio interno. Actúan asimismo
como coenzimas, activando o inhibiendo la acción de muchas enzimas. También son
componentes de los tejidos duros, como huesos y dientes. La carencia de micro
elementos se presenta en le caso de consumo insuficiente o de excesiva
eliminación a través de sudor, vómitos y diarrea. De las trazas se sabe que se
emplean en proteínas como grupos prostéticos, es decir en el centro funcional
de la proteína, lo cual hace que se necesiten en pocas cantidades, pero sus
funciones son muy impactantes como en el caso del hierro(2+) y el hierro(3+).
15.1 Cationes:
El ion sodio(1+) se emplea en la regulación de la presión osmótica celular, es una
moneda de intercambio para que otras sustancias con carga puedan pasar o
permanezcan e algún lado de la membrana. También es empleado en los potenciales
de acción para los impulsos nerviosos y como cofactor enzimático. El ion
potasio(1+) se encuentra vinculado en los potenciales de acción a través de la
bomba de sodio y potasio, la contracción muscular, la activación enzimática
(cofactor enzimático), la presión osmótica intracelular, como compone el tejido
óseo y en la formación de la sangre.
El ion calcio(2+) actúa como mediador intracelular
cumpliendo una función de segundo mensajero; por ejemplo, el ion Ca(2+)
interviene en la contracción de los músculos y es imprescindible para la
coagulación de la sangre y la apoptosis. El principal almacén de calcio dentro
de las células es el retículo endoplasmático. También está implicado en la
regulación de algunas enzimas quinasas que realizan funciones de fosforilación,
por ejemplo, la proteína quinasa C (PKC), y realiza unas funciones enzimáticas
similares a las del magnesio en procesos de transferencia de fosfato (por
ejemplo, la enzima fosfolipasa A2). Además, diversos estudios apuntan a que el
calcio también podría ser una señal de apoptosis, a través de la excesiva
recaptación del ión en la mitocondria y, por tanto, donde lugar a una
generación de estrés oxidativo. Algunas de sus sales son bastante insolubles,
por ejemplo, el sulfato (CaSO4), carbonato (CaCO3),
oxalato, etc. y forma parte de distintos biominerales. Así, en el ser humano,
está presente en los huesos como hidroxiapatito cálcico, Ca10(OH)2(PO4)6.
El calcio interviene en la formación de las placas de algunas
arterioesclerosis.
El ion magnesio(2+) es un oligoelemento, es decir, un
elemento químico esencial para todas las formas de vida. Se ha comprobado que
el manganeso tiene un papel tanto estructural como enzimático. Está presente en
distintas enzimas, destacando la superóxido dismutasa de manganeso (Mn-SOD),
que cataliza la dismutación de superóxidos, O(2-); la Mn-catalasa, que cataliza
la dismutación de peróxido de hidrógeno, H2O2; así como
en la concavanila A (de la familia de las lectinas), en donde el manganeso
tiene un papel estructural. El cuerpo humano logra absorber el manganeso en el
intestino delgado, acabando la mayor parte en el hígado, de donde se reparte a
diferentes partes del organismo. Alrededor de 10 mg de manganeso son
almacenados principalmente en el hígado y los riñones. En el cerebro humano el
manganeso es unido a metaloproteínas de manganeso, siendo la más relevante la
glutamina sintetasa en los astrocitos. El manganeso es también importante en
fotosíntesis oxigénica en las plantas. El complejo oxigénico es parte del fotosistema
II contenido en las membranas de los cloroplastos; es responsable de la
fotoxidación final del agua durante la fase luminosa de la fotosíntesis y tiene
una metaloenzima con cuatro átomos de manganeso. Por esta razón, la mayoría de
los fertilizantes contienen manganeso.
Los iones hierro(2+)
y hierro(3+), Aunque solo existe en pequeñas
cantidades en los seres vivos, el hierro ha asumido un papel vital en el
crecimiento y en la supervivencia de los mismos y es necesario no solo para
lograr una adecuada oxigenación tisular sino también para el metabolismo de la
mayor parte de las células. La proteína más importante vinculada al hierro es
la hemoglobina, un pigmento que se encarga del transporte de los gases de
importancia metabólica por medio de la vinculación del gas al hierro en el
centro del grupo prostético que vira entre sus formas oxidada (3+) y reducida
(2+) para unirse, ya sea al oxígeno o al dióxido de carbono.
15.2 Aniones
Los iones
cloruro(1-), representan las dos terceras partes
de la carga negativa de todos los aniones en la sangre. Juegan un papel
esencial en el mantenimiento de la estabilidad de los fluidos corporales y en
el correcto pH de los jugos gástricos. Ingerir iones cloruro, principalmente en
forma de cloruro de sodio es indispensable para nuestra salud, principalmente
si sudamos mucho y en los casos de diarreas. El cloro se almacena en el
organismo en los tejidos subcutáneos y en el esqueleto. Los jugos gástricos
contienen una disolución de cloruros y en el estómago mantenemos una concentración
en cloruro de hidrógeno ácido, HCl indispensable para que se realice la
digestión. El sudor, la orina y la excreción en el proceso digestivo son las
tres maneras que tiene nuestro organismo de eliminar iones cloruro. Puesto que
el organismo mantiene un perfecto, aunque delicado equilibrio entre el cloro
que entra y el que expulsa, en el caso de que se elimine más cloro del que
entra, es indispensable compensar esta pérdida. La mejor manera, sin embargo de
proporcionar el cloro indispensable al organismo es la sal común, aunque no
debe abusarse de ella, puesto que al mismo tiempo que tomamos iones cloruro
también entran iones sodio(1+), y un exceso de estos iones favorece la
retención de agua en las células y puede crear problemas en el riñón. La carne,
la leche y los huevos contienen también iones cloruro y son una fuente adecuada
de éstos.
Los iones del fosfato en equilibrio.
El grupo fosfato es uno de los grupos
funcionales más importantes para la vida. Se halla en los nucleótidos, tanto en
los que forman parte de los ácidos nucleicos (ADN y ARN), como los que
intervienen en el transporte de energía química (ATP). También está presente en
los fosfolípidos, moléculas que forman el esqueleto de las bicapas lipídicas de
todas las membranas celulares. Tanto en los ácidos grasos como en los
fosfolípidos. El grupo fosfato forma enlaces fosfodiéster.
Los iones del carbonato en equilibrio son
importantes en el mantenimiento de la acidez en la sangre y demás fluidos
vitales, y también de las presiones osmóticas. Se forma espontáneamente cuando
del dióxido de carbono gaseoso se diluye lo bastante como para reaccionar con
el agua, lo cual forma el ácido, y de allí se generan las dos disociaciones del
hidrógeno para formar los dos carbonatos. Algunos seres vivos emplean los
carbonatos para crear conchas carbonatadas. A demás de ser un estabilizador
osmótico, el equilibrio triple de los carbonatos también funciona como solución
reguladora de acidez o buffer, la cual mantiene la acidez de la sangre dentro
de rangos tolerables por los tejidos que ella circundante y por sus elementos
celulares.
Estos son solo algunos de los iones más
comunes, pues el cuerpo emplea comúnmente trazas de otros cationes y aniones
para funciones muy importantes. El hecho de que el cuerpo necesito poco de algo
no quiere decir que no sea importante, al contrario, significa que esa
sustancia es tan poderosa que se necesita muy poco de ella, y su carencia
conlleva a severos desordenes nutricionales.
16. Proteínas del plasma
|| Regresar al Índice ||
A diferencia de lo que ocurre en el MEC o
en citosol, en la sangre se espera que las proteínas se encuentren en
suspensión. Aquí mencionaremos solo las proteínas más importantes:
16.1 Albúmina
Una de las proteínas más importantes es la
albumina, la cual es una proteína de pequeño tamaño, pero que suma el 60% del total
de las proteínas disueltas en el plasma. Una de las funciones principales de la
albumina es la de mantener la presión oncónica, la cual representa el 0,5% del
total de la presión osmótica. La presión osmótica juega roles importantes en el
intercambio de fluidos a través de los capilares, debido a que la albumina no
puede atravesar las membranas de los epitelios capilares fácilmente.
Una segunda función de la albumina es la
de transportar ácidos grasos (al ser grasas apolares, no se disuelven en un solvente
polar, por lo que requieren de una sustancia que se una a ellas y las vuelva
solubles, similar a lo que hace un jabón). La albumina también puede
transportar hormonas, drogas y otras sustancias no solubles en un solvente
polar como el plasma de la sangre. La albumina es producida en el hígado, y una
baja de concentración en el suero puede indicar enfermedad del hígado o
desnutrición.
16.2 Globulina
Constituyen cerca del 36% del total de las
proteínas disueltas en el plasma. Las globulinas a y b son producidas en el
hígado y realizan una diversidad de funciones, como transportadores o sustratos
de reacción.
Por ejemplo, el transportador para la
tiroxina es una globulina de tipo a2; y el transportador para el plasminógeno,
una forma inactiva de la proteína plasmina es una globulina tipo b. Las
globulinas tipo gamma producidas por el tejido linfático son anticuerpos
necesarios para la activación de la parte humoral del sistema inmune.
16.3 Fibrinógeno
Son moléculas de alto peso molecular que
son sintetizadas en el hígado, las cuales representan cerca del 4% de las
proteínas disueltas en plasma. Cuando se convierten en su forma insoluble
llamada fibrina, se agrupan en una masa llamada coagulo. En los tubos de
ensayo, el plasma que es liberado del fibrinógeno es incapaz de coagular
correctamente.
Figura 16.1. El fibrinógeno
es reclutado de la fibrina en el plasma por parte de las plaquetas para formar
los coágulos.
Altos niveles de fibrinógeno en la sangre
son un indicador de alto riesgo para una obstrucción arterial, lo que puede
generar incremento en la presión, taponamiento, infarto o derrame.
17. Lípidos y carbohidratos del plasma
|| Regresar al Índice ||
Los principales lípidos del plasma son el
colesterol, los fosfolípidos y los triglicéridos. El colesterol es un
componente importante de las membranas celulares y también es la base para la
síntesis de ciertas hormonas. Los fosfolípidos se forman en el hígado y son
usados principalmente como bloques de construcción para las membranas
celulares, debido a que tienen la capacidad de formar bicapas lipídicas. Los
triglicéridos son importantes para la transferencia de la energía derivada de
los alimentos a las células. Debido a la naturaleza apolar y por lo tanto
hidrofóbica de los lípidos, estos no se disuelven en medios acuosos como el
plasma de la sangre, lo que implica la necesidad de la unión a proteínas de
transporte, que conviertan a los lípidos en sustancias solubles.
Los triglicéridos y el colesterol
obtenidos del intestino delgado son ensamblados en la mucosa del intestino en
forma de quilomicrones, para luego ser liberados a través del sistema linfático
a la circulación. Sin embargo, estos no son la mayoría de los triglicéridos o
el colesterol circulante en la sangre, y para ser más sinceros “feamente”, la
mayoría del colesterol y los triglicéridos circulantes en la sangre son
sintetizados por el hígado a partir de otras sustancias.
Los triglicéridos y el colesterol
sintetizados por el hígado son empaquetados en lipoproteínas de muy baja
densidad (VLDL) y luego liberados en el plasma para distribuir los lípidos en
los tejidos. Los VLDL pueden ser convertidos a lipoproteínas de baja densidad
(LDL). El hígado y el intestino delgado también forman y segregan proteínas de
alta densidad (HDL). Los quilomricrones y las proteínas de transporte de
lípidos como el LDL y el HDL poseen una estructura similar entre sí, variando
en el tipo de proteína que llevan insertadas en sus bicapas lipídicas y en sus
funciones. El quilomicrón será el más grande, mientras que el HDL será el más
denso y pequeño.
Figura 17.1. Transportadores
de grasa, el LDL se encuentra relacionado con la arteriosclerosis (YouTube).
Las HDL inicialmente no tienen colesterol
unidas a ellas, y su misión es recorrer el cuerpo ubicando y uniéndose al
colesterol unido a los tejidos, a algunas células plantas o incluso a las
arterias ateroscleróticas, luego lo transportan al hígado, donde son liberadas
del cuerpo al ser segregadas por la bilis.
En el video anterior podemos apreciar el
colesterol bueno (HDL) es un nombre algo impreciso al igual que con los
quilomricrones, las lipoproteinas de transporte son burbujas compuestas por una
bicapa de fosfolípidos y proteínas asociadas, y son estas proteínas quienes
le confieren sus propiedades. El HDL o (bueno) es un recolector de colesterol,
mientras que el LDL (malo) es un distribuidor.
17.1 Carbohidratos del plasma
Los principales carbohidratos del plasma
son la glucosa. Existe muy pocas trazas de otros azucares presentes en la
sangre. La glucosa es la principal fuente de energía para el cuerpo, incluyendo
a los glóbulos rojos. Los niveles de glucosa en la sangre son fuertemente
regulados a concentraciones que varían entre 70 a 110 mg/dL.
A pesar de que la glucosa es el principal
componente en terminos de carbohidratos disueltos en la sangre, asociados a
esta se encuentran otros. Por ejemplo, las proteínas asociadas a los tipos de
sangre, que son proteínas unidas a las membranas de los glóbulos rojos poseen varios
tipos de carbohidratos complejos.
18. Perfiles sanguíneos y análisis de sangre
|| Regresar al Índice ||
El perfil de lípidos sanguíneos ayuda a
determinar el riesgo de un paciente para presentar enfermedades de tipo
cardiovascular. Un perfil de lípidos sanguíneos normal incluye valores para
colesterol total, colesterol unido a LDL, colesterol unido a HDL y
triglicéridos totales. El colesterol malo es una estructura similar al
quilomicrón más pequeña y de baja densidad "con un volumen mayor al de su
hermano el bueno" su función no es ser maligno, tan solo distribuir
colesterol a las células que lo necesitan, y se designa LDL "lipoproteina
de baja densidad por sus siglas en inglés". El colesterol bueno es más
pequeños que el malo, se denomina HDL “lipoproteina de alta densidad por sus
siglas en inglés”, en la imagen siguiente se presentan modelos de ambas
lipoproteínas.
Esto de la al médico una herramienta
importante a cerca del riesgo que tiene el paciente de desarrollar condiciones
de riesgo cardiovasculares. Por lo general los indicadores de riesgo son altos
niveles de triglicéridos y LDL y bajos niveles de HDL. Altos niveles de LDL, el
riesgo de comenzar a generar taponamiento arterial (arteriosclerosis) se
incrementa, ya que los LDL son los principales transportadores de lípidos a hacia
los tejidos. Bajos niveles de LDL indican un incremento en la habilidad del
cuerpo para remover el colesterol.
Al igual que todos los tejidos, el corazón
funciona con dioxígeno y nutrientes que son proporcionados por una arteria, la
arteria cardíaca, cuando esta arteria se obstruye genera un infarto localizado
que genera la muerte del sistema nervioso del corazón lo que a su vez provoca
el infarto general que concluye con la muerte del individuo. Muchas personas
con obesidad, enfermedad cardíaca y/o diabetes también presentan altos valores
de triglicéridos. Varios radios (divisiones entre valores de concentración)
como el radio LDL/HDL o el radio triglicéridos/HDL son empleados como valores
de predicción de riesgo de enfermedad cardiovascular.
18.1 Paneles metabólicos de
sangre y análisis de sangre
El panel metabólico básico o BMP por sus
siglas en inglés, es un grupo de pruebas químicas que incluye análisis de
glucosa, catión calcio II, catión sodio I, catión potasio I, dióxido de carbono
diluido, anión bicarbonato, anión cloro I, nitrógeno contenido en urea
sanguínea y creatinina. Los dos últimos son metabolitos de desecho celular que
son extraídos por filtración de la sangre por los riñones, por lo que su
incremento en el plasma sanguíneo es un buen indicador del mal funcionamiento
de los riñones.
Dependiendo de los problemas clínicos, se
puede hacer un panel solo de electrolitos o monitorear el cambio en e tiempo de
uno solo. El panel metabólico completo incluye los análisis de panel básico
además de análisis para albumina, proteínas totales, fosfato alcalino,
transaminasa alanina, transaminasa de aspartato y bilirrubina, donde los
últimos cuatro componentes se reaccionan con la función del hígado.
18.2 Electroforesis de
proteínas de suero
Como lo discutiremos más a fondo en la
sección de biología molecular, la electroforesis es una metodología diseñada
para la separación de sustancias de acuerdo a su tamaño y polaridad. Las proteínas más grandes se mueven poco y
las más pequeñas se desplazan a una mayor velocidad y distancia. La
electroforesis es un método muy utilizado para análisis de sangre y sirve para
separar las proteínas totales en diferentes grupos más fáciles de analizar.
Cuando las proteínas totales migran,
después de un tiempo suelen agruparse en 5 zonas o picos, donde el 59%
corresponde a la albumina, y las demás zonas reciben los nombres respecticos a1
con un 4%, a2 con un 7,5%, b con un 12% y g con un 17,5% Estas zonas pueden
variar entre los diferentes individuos y depender de sus condiciones de salud.
Por ejemplo, un incremento en la concentración de la región b1 es típica de
deficiencia de hierro debido al incremento de una proteína de transporte de
hierro llamada transferrina.
19. Propiedades de la sangre total y su análisis
|| Regresar al Índice ||
La sangre posee una serie de parámetros
físicos y químicos que permiten establecer intervalos de normalidad y
patología. Mediante estudios poblacionales es posible establecer tablas de
normalidad, así como estados anormales que sirven como criterios de diagnóstico
para una amplia variedad de patologías humanas. Es evidente por lo tanto que
esta sección está enfocada a la sangre humana.
19.1 Densidad de la sangre
La densidad se define como unidades de
masa total dividida entre unidades de volumen. Sin embargo, existe otro
concepto de densidad relacionado con el agua llamado gravedad especifica. Por
ejemplo, la gravedad específica del agua pura es de 1g/ml, mientras que la de
la sangre total es de 1,050g/ml. El valor exacto depende de la cantidad de
células sanguíneas que se encuentran diluidas en la solución del plasma
sanguíneo. En la sangre venosa, la densidad se hace mayor cuando la persona
está de pie que cuando está sentada. En estos casos, la densidad puede
incrementarse a niveles de 1,025g/ml.
La densidad de las células sanguíneas
individuales varía de acuerdo al tipo de células, en un intervalo que varía
entre 1.115g/ml para los eritrocitos a 1.070 g/ml para ciertos leucocitos. La
gravedad especifica se mide clínicamente en muestras de orina o de sangre mediante
difracción de luz mediante un refractómetro. Incrementos en la densidad
sanguínea pueden indicar deshidratación, o un incremento en los componentes
celulares de la sangre.
19.2 Viscosidad de la sangr
A pesar de que la sangre es levemente más
pesada que el agua, es muchísimo más gruesa/viscosa. La viscosidad de la sangre
es una medida de la resistencia al flujo es entre 3.5 a 5.5 veces la del agua.
La viscosidad del plasma es ceca de 1.5 a 1 ml veces la del agua. La viscosidad
de la sangre se incrementa a medida de la cantidad de células disueltas en ella
aumenta, así como cuando aumenta la cantidad de proteínas.
Una sangre más viscosa es más resistente
al movimiento, lo cual implica que se requiere una mayor presión sanguínea para
que esta se mueva a través de los vasos sanguíneos. Adicionalmente, una alta
viscosidad sanguínea es un factor que predispone a coagulaciones no
controladas. En las personas sanas, un incremento en la viscosidad sanguínea
causada por una producción de células sanguíneas de tipo defensivo y a la
deshidratación causada por la fiebre por enfermedades leves como la gripe es
fácilmente tolerable.
Sin embargo, en pacientes con sangre de
por sí muy viscosa, como aquellos con enfermedades pulmonares, in incremento
adicional puede conllevar a la coagulación sanguina, al taponamiento de las
arterias y por lo tanto a infartos obstructores o a derrames internos. Incluso,
la resistencia al movimiento de la sangre puede llegar a ser tan alto que el
musculo cardíaco o miocardio puede llegar a ser insuficiente para empujar la
sangre, lo que conlleva a un infarto del miocardio.
19.3 Respuesta inflamatoria y
los eritrocitos
Los eritrocitos tienen una densidad levemente mayor que la del plasma en la que se encuentran disueltos. Lo anterior genera cierta tensión en la solución, los eritrocitos tienden a caer y a sedimentarse.
Figura 19.1. La respuesta inflamatoria desencadena accidentes vasculares mortales muy
rápido (YouTube).
La tasa de sedimentación de los
eritrocitos es una herramienta de diagnóstico útil y poco costoso, ya que sus
alteraciones se encuentran relacionadas con ciertos estados patológicos de
índole autoinmune, infecciosos, y procesos inflamatorios. Cuando se incrementa
la concentración de las proteínas disueltas en plasma, los eritrocitos tienden
a sedimentarse más rápido.
19.4 Hematocrito
El hematocrito (HCT) es una fracción del volumen total de la sangre, el cual está hecho por las células rojas.El hematocrito puede ser determinado por centrifugación de sangre tratada con anticoagulante contenida en tubos pequeños de tipo capilar, los cuales permiten separar las células sanguíneas del fluido en suspensión. El volumen de hematocrito y del plasma puede usarse para calcular el volumen total de la sangre.
(Eq 19.1)
En la fórmula anterior tenemos la
definición de hematocrito, y representa un valor porcentual o en el caso de la
ecuación anterior en frecuencia (un valor entre 0 y 1 que puede convertirse a
porcentaje multiplicando por cien), las variables se denominan como Vs o sangre
total y Vp o plasma. El hematocrito es el porcentaje del volumen de la sangre
que es ocupado por glóbulos rojos, es una unidad adimensional. La determinación
del hematocrito es una herramienta de diagnóstico básico para la evaluación de
enfermedades de la sangre. Los valores normales de hematocrito para los hombres
es aproximadamente el 48% y en mujeres del 38%.
Tabla 19.1. En la siguiente
tabla presentamos los valores promedio de hematocrito. Dado que es un valor
fraccionario el hematocrito puede ser representado como fracción, frecuencia o
porcentual, esta última fue la elegida para construir la tabla.
Los descensos de los valores del
hematocrito indican la presencia de anemia (causada por perdida d sangre, o
deficiencias en la producción se eritrocitos). Valores aumentados del
hematocrito pueden indicar poli-isquemia y pueden resultar del incremento en la
producción de los eritrocitos y/o una disminución en la tasa de eliminación. La
deshidratación, la cual disminuye el contenido de agua y por lo tanto del
volumen de plasma, también genera un incremento en las lecturas del
hematocrito.
19.5 Conteo de sangre total y
conteo de glóbulos rojos
El conteo de sangre total o CBC por sus
siglas en inglés, es parte de los exámenes de rutina. Incluye los análisis
listados en la siguiente tabla. El conteo de sangre total se realiza usualmente
de manera automática, y una gran variedad de instrumentos son capaces de
realizarlo. Los valores arrojados son inmediatamente marcados y comparados con
los valores promedio estándar, los cuales se expresan en unidades del SI de
unidades tal como se muestra en la siguiente tabla. Los datos varían
dependiendo con la edad, el sexo, la condición fisiológica (embarazo, altitud)
y también pueden variar levemente dependiendo a las condiciones de un
laboratorio a otro. Cuando se evalúan pacientes para enfermedades hematológicas
“enfermedades de la sangre”, es importante determinar la cantidad total de
eritrocitos circulantes en la sangre y la concentración de hemoglobina disuelta
en la sangre.
Tabla 19.2. Valores de referencia para conteo de glóbulos rojos.
Valores promedio para el conteo de
glóbulos rojos por unidad de volumen, ya sea en valores de referencia estándar
o en valores de referencia con unidades del sistema internacional, tanto para
varones como para mujeres. Cada cuadro muestra un intervalo inferior y superior
de variación en los promedios registrados. Esta información es empleada para
determinar cuando un paciente se encuentra anémico. Debido a que no existe un
órgano de almacenamiento de los eritrocitos, virtualmente todas las células
rojas se encuentran en la sangre en cualquier momento. El hematocrito solo
puede ser empleado para determinar la anemia cuando se toma en cuenta el estado
del plasma y de hidratación. El conteo de sangre total, hemoglobina y el
hematocrito muchos otros indicios pueden ser derivados para un diagnóstico.
19.6 Volumen corpuscular medio
Representa el índice del volumen promedio
de cada eritrocito. Se calcula de la siguiente manera.
(Eq 19.2)
Las células de tamaño normal son descritas
como normocíticas, las células con un volumen menor se denominan microcíticas,
y las que tienen volúmenes más grandes serán macrocíticas.
Tabla 19.3. Valores de referencia para volumen corpuscular medio.
Estos tamaños celulares se utilizan para
clasificar diferentes tipos de anemia, aunque puede ser útil cuando tenemos una
población de eritrocitos de volúmenes muy variables.
19.7 Hemoglobina corpuscular
media
Es el estimado promedio del contenido de
hemoglobina de cada glóbulo rojo. Se obtiene de la siguiente manera.
(Eq 19.3)
Donde Ht es la hemoglobina la
concentración de la hemoglobina expresada en gramos sobre litro. La hemoglobina
corpuscular media usualmente sube o baja, dependiendo de si el volumen
corpuscular medio sube o baja. Por esta razón, a la hemoglobina corpuscular
media se la conoce como promedio corpuscular de concentración de hemoglobina,
debido a que el conteo de sangre total se encuentra usualmente relacionado al
hematocrito.
Tabla 19.4. Valores de
referencia para la hemoglobina corpuscular media.
Excepciones a esta regla generan
importantes pistas de diagnóstico. El promedio corpuscular de concentración de
hemoglobina es un índice del promedio de hemoglobina en una masa determinada de
glóbulos rojos circulantes. Se puede calcular del siguiente modo:
(Eq 19.4)
Bajos niveles de concentración corpuscular
de concentración de hemoglobina indica deficiencias en la síntesis de hemoglobina,
y las células se denominan hipocrómicas (poco coloreadas, refiriéndose a que la
hemoglobina es quien da el color rojo a los eritrocitos). Altos valores para la
concentración corpuscular promedio de hemoglobina son raros, debido a que
normalmente la concentración de hemoglobina posee un límite de saturación en
los glóbulos rojos.
Tabla 19.5. Valores de
referencia para porcentaje de concentración corpuscular media.
Los valores altos solo se producen cuando los eritrocitos tienen forma esférica y no en forma de dona como es lo normal.
19.8 Distribución de los
eritrocitos y capacidad de transporte de oxígeno
La distribución de eritrocitos mide el
grado de dispersión promedio de los eritrocitos y de manera indirecta el tamaño
de los eritrocitos también denominada anisocitosis “literalmente diferencia en
forma celular”. Este valor ayuda a clasificar anemias, especialmente las de
tipo microcistico y macrocistico. La capacidad de transporte de oxígeno no hace
parte de los procedimientos normales del conteo de sangre total, pero es un
indicador clínico muy importante, debido a que la anomia puede conllevar a
hipoxia tisular. La capacidad de transporte de oxigeno representa la máxima
cantidad de oxigeno que puede ser transportada en un decilitro (100 mL) de
sangre, incluyendo tanto el oxígeno unido a la hemoglobina como el oxígeno
disuelto en el plasma. Cada gramo de hemoglobina se puede combinar con y
transportar 1,34 mL de oxígeno gaseoso. Por cada milímetro de mercurio de
presión de sangre arterial oxigenada (Pa O2) existe 0,003 mL de oxígeno
disuelto en 1dL de sangre.
19.9 Conteo de glóbulos blancos
Mide la concentración de leucocitos en la
sangre, como un indicador del estado inmunológico del cuerpo. Una alta
concentración de células blancas se denomina leucocitosis y ocurre cuando una
infección, una alergia, una enfermedad sistémica, una inflamación, una herida
tisular o cuando se produce leucemia. Un bajo conteo de células blancas es
denominado leucopenia, y puede presentarse bajo ciertas enfermedades virales
están presentes, cuando el paciente sufre un estado de inmunodeficiencia o con
defectos en núcleo de los huesos largos “tuétano”.
Tabla 19.6. Valores de referencia para conteo de glóbulos blancos (YouTube).
En la tabla anterior podemos ver los v
alores de referencia para el conteo de glóbulos blancos. Este factor es
sumamente importante para el diagnóstico de ciertos picos de cáncer del sistema
linfático y de enfermedades de tipo inmunodeficiencia como el SIDA. El conteo
de células blancas también se usa para monitorear la recuperación de un
paciente después de una enfermedad. Para propósitos diagnósticos se utiliza un
indicador extra denominada conteo diferencial de células blancas (se abrevia
diff en inglés) el cual diferencia los diferentes tipos de células blancas en
la solución. Existen algunos factores que dificultan el análisis de los datos
del conteo de células blancas. A diferencia de las células rojas, donde la
totalidad de la población funcional se encuentra vertida en la sangre, en los
glóbulos blancos si existe una multitud de órganos de almacenamiento como el
vaso o los nódulos linfáticos.
En la tabla anterior podemos ver los v
alores de referencia para el conteo de glóbulos blancos. Este factor es
sumamente importante para el diagnóstico de ciertos picos de cáncer del sistema
linfático y de enfermedades de tipo inmunodeficiencia como el SIDA. El conteo
de células blancas también se usa para monitorear la recuperación de un
paciente después de una enfermedad. Para propósitos diagnósticos se utiliza un
indicador extra denominada conteo diferencial de células blancas (se abrevia
diff en inglés) el cual diferencia los diferentes tipos de células blancas en
la solución. Existen algunos factores que dificultan el análisis de los datos
del conteo de células blancas. A diferencia de las células rojas, donde la
totalidad de la población funcional se encuentra vertida en la sangre, en los
glóbulos blancos si existe una multitud de órganos de almacenamiento como el
vaso o los nódulos linfáticos.
También se tiene que el porcentaje de los
leucocitos varía con la edad. Los recién nacidos poseen valores muy altos de
neutrófilos, en la niñez los linfocitos son predominantes, mientras que en la
vejez el conteo total disminuye. Por último, algunos medicamentos pueden
afectar grandemente los resultados del conteo de células blancas como aquellos
empleados contra el cáncer.
19.10 Conteo de plaquetas
Niveles bajos de plaquetas puede ser el
resultado de defectos en el núcleo de los huesos largos “tuétano”, o de
destrucción periférica de las plaquetas. El volumen promedio de las plaquetas
ayuda a determinar el tamaño de las plaquetas. Altos valores indican plaquetas
jóvenes, mientras que valores bajos pueden indicar fallas en el núcleo de los
huesos largos.
Tabla 19.7. Valores de
referencia para conteo de plaquetas.
20. Detección de parásitos y otros desordenes clínicos
|| Regresar al Índice ||
Si existen anormalidades e una o más de las poblaciones celulares de la sangre, se requiere un análisis visual o frotis de sangre para validar los resultados automatizados. En este tipo de análisis, una gota de sangre es depositada en una lámina de portaobjetos para microscopia, luego esparcida hasta formar una capa muy delgada y finalmente se le permite secarse. Luego (y muy importante) se las entintan con un colorante especial.
Figura 20.1. Frotis de sangre (YouTube).
Procedimiento para realizar un frotis de
sangre, esto se debe realizar para que la capa de sangre sea muy delgada y de
este modo la luz del microscopio pase de una mejor forma, permitiendo ver de
una manera más cómoda y estandarizada la cantidad y calidad de las células de
la sangre.
El análisis microscópico permite la
diferenciación de los leucocitos de acuerdo con su apariencia morfológica y
características de tinturado. La inspección visual también permite la
identificación se células inmaduras, también denominadas células de banda. Con
respecto a los eritrocitos, también se puede identificar sus diferentes
morfologías, las cuales pueden traer consecuencias patológicas, como en el caso
de la anemia falciforme. También permite encontrar células rojas infectadas con
paracitos intracelulares como la malaria.
Por último, este análisis permite corregir
algunos errores metodológicos de los conteos automatizados de plaquetas ya que
están tienden a agruparse o a que los glóbulos rojos microciticos pueden pasar
ante el lector automático como plaquetas. Los frotis de sangre también son
comúnmente coloreados con pigmentos policrómicos como Wrigth-Giemsa después de
fijar las células con metanol. El naranja de eosina tintura los componentes
básicos de las células como los gránulos de los eosinofilos o la hemoglobina de
los eritrocitos.
El azul de metileno colorea los componentes ácidos de las células como el ADN y el ARN, Existen muchos otros colorantes para análisis de sangre más específicos. El análisis visual de un frotis de sangre se basa en el conteo y análisis de 100 células, desde la cual, el porcentaje de cada célula blanca es calculado. Estos conteos relativos muestran cual tipo de célula posee una mayor frecuencia con respecto a las demás de manera relativa.
Figura 20.2. En las
microfotografías anteriores tenemos que los recuadros A y B poseen una tinsión
Wrigth-Giemsa, mientras que los C y D están coloreados con azul de metileno
El hemocitometro es un método empleado para el conteo manual de células. Actualmente se emplea en raras ocasiones cuando la concentración de células a analizar en una muestra es demasiado pequeña para ser detectado por los métodos automatizados. Ejemplos de un caso así es en pacientes inmunocomprometidos, en los cuales, ciertas poblaciones de leucocitos disminuyen dramáticamente.
Figura 20.3. El
hemocitómetro es una regla estandarizada de medida, básicamente es un
cubreobjetos especializado con líneas para poder determinar el área de lo que
se observa al microscopio (YouTube).
21. Sistema de grupos de sanguíneos humanos
|| Regresar al Índice ||
Los sistemas de tipo sanguíneo fueron
desarrollados para disminuir los riesgos de la transfusión de sangre de humano
a humano, aunque de hecho los chimpancés son los suficientemente compatibles
evolutivamente para entrar en la posibilidad de transfusiones. En ambos casos
el problema es la compatibilidad inmunológica establecida por receptores de
membrana de los eritrocitos. Si el sistema inmune los detecta como extraños
mata a los eritrocitos impidiendo su función de transporte de oxígeno,
condenando al paciente a muerte por hipoxia. Para evitar eso se debe transferir
sangre con el mismo tipo de receptor y en consecuencia el sistema inmune no la
ataca. Existen receptores que generan una respuesta inmune fuerte y otros que
generan una respuesta inmune débil. Los
receptores que generan una respuesta inmune fuerte son los que deben ser
rastreados de forma preponderante, y corresponden a los dos sistemas más
comunes: el HB0 y el factor Rhesus. Se los denomina como de respuesta fuerte ya
que pueden matar en una sola transfusión. Existen otros tipos de receptor que
solo se hacen importantes cuando el paciente debe ser sometido a constantes
transfusiones de sangre, debido a su efecto débil en individuos en los que se
transfiere sangre una vez, se los denomina como de respuesta inmune débil.
21.1 El sistema HB0
Los tipos de sangre A, B, AB y O se basan en la presencia o ausencia de diferentes antígenos presentes en los glóbulos rojos. Para ser más claros, los antígenos son proteínas ancladas a la membrana de los glóbulos rojos, que sirven como banderas de identificación para el sistema inmune del cuerpo, y de esa manera identificar las células propias de células extrañas. Las personas que poseen glóbulos rojos cubiertos con proteínas de tipo A o de tipo B se dice que tienen un tipo de sangre A o tipo B respectivamente. Si la persona expresa las dos proteínas al mismo tiempo, se dice que su tipo de sangre es AB. Si la persona no expresa ninguno se dice entonces que es de tipo O (que se lee cero).
Figura 21.1. En el sistema
AB0 debemos distinguir entre dos tipos de proteínas, primero está el antígeno
de superficie que se encuentra insertado en la membrana del glóbulo rojo. La
segunda es la inmunoglobulina anticuerpo. Para el tipo de sangre A se tiene en
antígeno A y el anticuerpo B, para el tipo de sangre B se tiene en antígeno B y
el anticuerpo A, para el tipo de sangre AB se tiene ambos antígenos pero ningún
anticuerpo "o se autoaglutinaria su propia sangre", mientras que para
el tipo de sangre 0 no se presentan antígenos de membrana, pero si ambos
anticuerpos.
El conocimiento de los tipos de sangre es
importante para las transfusiones de sangre, una combinación inapropiada entre
sangres de diferentes grupos puede conllevar a una aglutinación de la sangre
masiva y fatal, debido a que el sistema inmune reconoce a la sangre
transfundida como un cuerpo extraño y potencialmente peligroso. La aglutinación
de los glóbulos rojos puede conllevar a una circulación sanguínea inapropiada,
cristalización de la hemoglobina liberada y eventualmente falla renal.
Una persona con tipo de sangre A puede
recibir sangre de otra persona con su mismo tipo de sangre, o de una persona
cuyos glóbulos rojos no posean antígenos de marca, es decir tipo 0. Una persona
tipo B sigue el mismo patrón. Esto se debe a que una persona con sangre A posee
anticuerpos en su sangre que reconocen y aglutinan al marcador B, por lo que se
denomina inmunoglobulina M anti B. Una persona con ambos tipos de marcadores en
la sangre no posee inmunoglobulinas anti y por lo tanto puede recibir sangre de
cualquiera. Una persona de tipo 0 posee ambas inmunoglobulinas anti, y por lo
tanto solo puede recibir sangre de una persona de tipo 0.
Debido a que las personas tipo AB pueden
recibir sangre de cualquiera se los denomina receptor universal; y del modo
inverso, debido a que una persona tipo 0 puede donarle a cualquiera se la
denomina donante universal. Los tipos de sangre pueden ser una herramienta de
identificación humana de tipo forense o de parentesco genético. Esto se debe a
que el sistema AB0 es un sistema de genes mendeliano clásico con un gen y tres
alelos. La frecuencia de los alelos A, B y 0 varía dependiendo del origen
poblacional, algunos alelos son más frecuentes en unas poblaciones y menos
frecuentes en otras. En los Estados Unidos y en América Latina los tipos de
sangre más comunes son el 0, es decir, el genotipo de la mayoría de la
población será 00. Es más, los grupos de sangre pueden generar agrupaciones
dentro de un mismo país debido a diferencias de clase y de parentesco. Sin
embargo, este tipo de segregación fenotípica está decayendo poco a poco, con el
incremento de la movilidad geográfica, social y cultural. El tipo de sangre de
una persona no se relaciona con el tipo de hemoglobina que posee, esto se debe
a que son dos tipos de proteínas diferentes que se encuentran en lugares
diferentes, la hemoglobina es una proteína soluble que se encuentra flotando en
el plasma o el citoplasma, mientras que las proteínas AB se encuentran ancladas
a la membrana de los eritrocitos.
21.2 Factor Rhesus
Otro de los tipos de sangre muy utilizados
es el factor Rhesus (Rh), el cual también es una proteína de membrana. El Rh es
un sistema complejo el cual aborda tres genes que producen los antígenos C, D y
E. El Rh D es el más importante y puede
encontrarse en el 85% de la población que se clasifican como Rh+, el restante
15% es denominado Rh- El conocimiento del factor Rh es importante en mujeres
embarazadas debido a que la vida él bebe puede estar en peligro, y por lo
tanto, generase un aborto espontáneo si el bebé hereda Rh+ del padre, siendo la
madre Rh-.
Tabla 21.1. Tabla de donante receptor en el sistema dígeno HB0/rhesus.
Durante el primer embarazo no se corren
problemas serios ya que en ese solo se forman los anticuerpos anti Rh, sin embargo,
en un segundo embarazo en el que la disparidad fenotípica se dé, el sistema
inmune de la madre formará una reacción inmune en contra de la sangre del bebé
que ingresa a su sistema. Para prevenir eso, la madre recibe inmunoglobulinas
anti Rh D alrededor del día 28 de embarazo y justo antes del parto. La
inmunoglobulina se une a las células Rh+ del bebe en el sistema sanguíneo de la
madre y evita que ella produzca sus propias inmunoglobulinas anti D.
¿Y cuál es el sentido de esto?, es simple,
el sistema inmune posee memoria, administrando la inmunoglobulina de manera
externa se evita que la madre genere una memoria y por lo tanto que monte una
respuesta inmune en futuros embarazos. No existen problemas de incompatibilidad
tan serios en el sistema AB0 entre madres y bebes, debido a que las
inmunoglobulinas que son específicas para estas proteínas son de tipo M y/o
puede cruzar la placenta. Sin embargo, en casos raros cuando la madre es tipo 0
y él bebe es cualquier otro tipo, este puede nacer con síntomas leves de anemia
con niveles levemente altos de bilirrubina.
Debido a estas complicaciones, siempre se
recomienda a las mujeres embarazadas determinar su tipo de sangre durante su primera
visita prenatal. Existen más de 600 tipos de antígenos de sangre que han sido
descritos desde el descubrimiento de los AB0 y Rh, pero son considerados
antígenos menores. Sin embargo, pueden ser incluidos en los análisis de
pacientes que requieren transfusiones de sangre muy frecuentes.
21.3 Sistema secretor
En el año 1926 se observa por primera vez
que los antígenos A, B, O (H), no solamente se encontraban en eritrocitos, sino
que también se venía observando especificidades antigénicas ABH en los líquidos
y secreciones corporales: lágrimas, saliva, semen, sudor, líquido amniótico.
Donde mayor cantidad de antígenos se manifestaba era en la saliva. Más tarde se
vio la existencia de esas sustancias antigénicas con especificidad grupal en
líquidos y secreciones estaba regulado por un locus autosómico dialélico:
Secretor (Se/se). Aparecían tres genotipos posibles! Se/Se, Se/se y se/se.
Se es dominante con expresividad completa
sobre s. Los dos primeros genotipos (Se/Se y Se/se) son los responsables del
fenotipo secretor de antígenos ABH. Mientras que el tercer genotipo
correspondería a las personas no secretoras ABH. Este fue el segundo avance en
el descubrimiento de este locus. El interés empezó a incrementar cuando la
genética bioquímica interrelacionó el locus secretor, el Hh y el ABO. Se llegó
a demostrar que el locus secretor regula la actividad del locus Hh cuando se
intenta explicar la presencia o ausencia de antígenos ABH fuera de los glóbulos
rojos. El locus secretor regula la función del locus Hh, mientras que este a su
vez regula la actividad del ABO, la expresión de toda esta relación puede
escribirse La ausencia de Se inhibe la actividad del alelo H sobre la sustancia
precursora, y por tanto no se puede desarrollar la actividad del sistema ABO.
Hoy en día a este locus se le está confiriendo importancia debido a la relación
de la no presencia de Se con enfermedades crónicas. También existe una relación
entre poseer el alelo Se y un mayor riesgo de tener un aborto (Daniels, 2008; Friedman, West,
& Bizargity, 2016; Race, Sanger, & Fisher, 1962).
21.4 Sistema Lewis
Es conocido corrientemente como otro de
los sistemas eritrocitarios inmunológicamente débiles. Tiene una doble
importancia por: El locus Lewis interrelaciona su genética bioquímicamente con
el locus ABO, por tanto, es imprescindible tener en cuenta este sistema cuando
se estudia el ABO y los sistemas asociados. Este sistema Lewis es inicialmente
plasmático, y una vez que se forman bioquímicamente son adsorbidos por la
membrana del eritrocito. Los antígenos Lewis, por tanto, se generan en el
plasma, que es un líquido corporal. Existen dos antígenos diferentes para este
sistema: Lea y Leb. El primero es un antígeno simple, mientras que es segundo
es compuesto, y además el antígeno Lea, sólo se produce por la actividad de uno
de los alelos que se segregan del locus Lewis.
Podemos señalar que el locus Lewis está
controlado por dos alelos: Le/le, y por tanto aparecen 3 genotipos posibles !
Le/Le, Le/le y le/le. Le es dominante sobre le, y además también se ha
constatado que el Le es un gen activo, mientras que le es un gen amorfo del que
no se le conoce producto alguno. Los dos primeros genotipos son los que generan
el antígeno Lewis simple, y por tanto, esas personas son siempre portadoras del
antígeno con especificidad Lewis, que genotípicamente se denota Lea+. El tipo
le/le, es el que corresponde al genotipo Lea-, nunca Leb+ La inferencia
inmediata es que los alelos ABO necesitan de manera obligatoria, para provocar
la síntesis de antígenos ABO es el sustrato conocido como Ag H, mientras que le
alelo Lewis no requiere el alelo H, pero si la sustancia sustrato inicial de la
que parten todas la rutas bioquímicas (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.5 Sistema MNS
Históricamente fue el segundo que se
descubrió después del ABO. Unos años después se detectan otros dos anticuerpos
de origen humano, denominados haloanticuerpos (pertenecientes a la misma
especie), fueron el Anti S y el Anti s, estos dos alelos tenían la propiedad de
ser antitéticos, pero su mayor propiedad es la de que el locus Ss aparece
estrechamente ligado al MN, esto se detectó a través de análisis de segregación
familiar. Aparecen en el cromosoma número cuatro del genoma humano. Se puede
señalar que estamos ante un sistema sanguíneo con dos loci estrechamente ligados,
esto hace que la recombinación sea posible, pero altamente improbable. Los
genes del sistema MNSs se transmiten en bloque en la meiosis para dar lugar a
asociaciones o haplotipos (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.6 Sistema Duffy
Es el primer grupo sanguíneo que se
localiza en el genoma humano, más exactamente en el cromosoma uno, cerca del
centrómero y por tanto es sinténico con el locus Rh. Otra razón de su
importancia es porque se conoce con bastante detalle a nivel de genética
molecular. Los antígenos más frecuentes son Fya y Fyb, que se distinguen
únicamente en un aminoácido de la secuencia proteica. Hoy también se conoce que
existe un cuarto alelo, el Fyx, y también se sabe que este es una variante del
Fyb. La tercera razón de su importancia es que se sabe que los individuos Duffy
activos y frecuentes (Fya y Fyb) son receptores de los agentes parasitarios que
inducen la malaria (Plasmodium vivax). Cuando la sangre humana del
fenotipo Duffy nulo se enfrentan a la sangre del parásito P. knowlesi, este
encuentra resistencia a infectar la sangre (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.7 Sistema Xg
Fue el último grupo sanguíneo que se
descubre dentro del genoma humano. En 1962 se descubre el sistema Xg, y se
detecta un nuevo anticuerpo en el suero de una mujer que había tenido un hijo
con incompatibilidad feto-materna. Se le denominó Anti Xga (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.8 Sistema Chido/Rodgers
(Ch/Rg)
El primer ejemplo de anti-chido, fue
estudiado en 1962. Posteriormente se identificaron seis ejemplos más en
1964-1965. inicialmente fue considerado como célula blanca o anticuerpo del HLA
(Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.9 Sistema Cartwrigth (Yt)
Fue descubierto en 1956 por Eaton. Este
antígeno se probó que era un carácter hereditario dominante e independiente de
otros sistemas conocidos en ese momento (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.10 Sistema Cromer
Fue descubierto en 1965 en el suero de un
americano africano prenatal. Se comprobó tras diversos análisis que el
anticuerpo no era del sistema Rh y fue nombrado como Cromer (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.11 Sistema Colton (Co)
En 1967 Heisto informo de tres ejemplos de
un anticuerpo semejante, contra un antígeno de elevada frecuencia que nombraron
como Co. Posteriormente en 1970 se identificó el Anti- Cob y el grupo
sanguíneos quedó establecido (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.12 Sistema Kidd
El primer caso hallado fue en 1951 en el
cual, el citado anticuerpo porvocó una enfermedad hemolítica en el recién
nacido. Se le dio el nombre de Jk, posteriormente apareció el Jkb (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.13 Sistema JMH
Normalmente son anticuerpos hallados en
personas de avanzada edad. Casi siempre es una supresión adquirida del antígeno
y hasta la fecha solo se ha sabido la existencia de una familia con JMH-
heredado (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.14 Sistema Diego
Los primeros casos de Dia se recogieron en
1956 mientras que el Anti-Dib en 1967. En 1990 el sistema Diego (Diª y Dib) y
los antígenos Wright (Wra y Wrb) quedaron consolidados (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.15 Sistema Knops (Kn)
Fue hallado por primera vez en el suero de
un paciente con 0- tras una transfusión con dicho antígeno. Su sangre era
incompatible con todos los tipos de 0. El anticuerpo fue llamado Anti-Kn
21.16 Sistema Ok
El primer caso fue estudiado en una mujer
con una previa transfusión sanguínea. El genotipo Okª- está limitado a la zona
del Japón (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.17 Sistema Raph
Consiste en un único antígeno. El
anticuerpo Raph es hallado en el 92% de la población inglesa y es un producto
de un gen situad en el brazo corto del cromosoma 11 (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
21.18 Sistema Knops (Kn)
Fue hallado por primera vez en el suero de
un paciente con 0- tras una transfusión con dicho antígeno. Su sangre era
incompatible con todos los tipos de 0. El anticuerpo fue llamado Anti-Knª (Daniels, 2008; Friedman et al.,
2016; Race et al., 1962).
22. Los glóbulos rojos o eritrocitos
|| Regresar al Índice ||
También denominadas células rojas o
eritrocitos, son el tipo de células más comunes en el torrente sanguíneo y son
el principal mecanismo para la distribución de oxígeno a los tejidos, desde el
sistema de capilares respiratorios (anclados a las branquias, los alveolos, la
piel o cualquier órgano encargado de la respiración externa) hasta los tejidos
internos del cuerpo. Los eritrocitos actúan básicamente como bolsas para
contener una proteína soluble denominada hemoglobina, esta proteína es
básicamente un marco que optimiza la función natural del hierro de oxidarse o
reducirse dependiendo de las concentraciones de oxígeno y dióxido de carbono
presentes en un medio, es decir, tratamos con una biomolécula cuyo centro
activo se basa en una función netamente inorgánica.
Cuando el hierro pasa del estado ferroso
al estado férrico adquiere una coloración marrón-rojiza, lo que, al ser
optimizado por la proteína alrededor de él, genera una coloración roja más
intensa, en otras palabras, es el hierro presente en el centro activo de la
hemoglobina quien es responsable del color rojo de la sangre. Los eritrocitos
morfológicamente se distinguen de otras células al poseer una forma de disco
aplanado bicóncavo, al microscopio se asemejan a una dona o a un roscón. Los eritrocitos de los mamíferos carecen de
núcleos, lo cual es una característica más bien única, ya que los eritrocitos
de los demás vertebrados si poseen núcleo.
En los seres humanos, la vida media de un
eritrocito funcional dura alrededor de 100 a 120 días y son reciclados por una
combinación del sistema de capilares y los leucocitos macrófagos.
Figura 22.1. Forma de un
glóbulo rojo, "arriba" tenemos una vista lateral que revela la forma
aplanada en forma de moneda con una región centran deprimida en forma de dona.
"Abajo" tenemos la vista al microscópio con un borde mucho más
marcado y un centro claro (YouTube)(YouTube).
22.1 Contenido interno de un
glóbulo rojo
Como lo dijimos en la introducción, los
eritrocitos son células aplanadas bicóncavas, similar a una dona, su diámetro
es de 7 µm con un grosor máximo de 2,5 µm. ¿Por qué no son esféricos?,
recordemos que la esfera es la forma que posee un mayor volumen posible, por lo
que los eritrocitos esféricos podrían teóricamente cargar una mayor cantidad de
hemoglobina y por lo tanto más oxígeno, ¿cierto? La respuesta a este asunto
radica en la velocidad, al incrementar el volumen, el área disminuye y por
consiguiente la velocidad de intercambio de gases, un eritrocito esférico se
tardaría más tiempo en intercambiar gases metabólicos y en suma, haría de la
respiración un proceso más lento e incómodo. Al aplanar los eritrocitos, la
superficie o área de estos aumenta, incrementando la velocidad de intercambio
de gases, cada eritrocito carga menos oxígeno, pero intercambia gases a una
mayor velocidad.
Los eritrocitos también juegan un papel
importante en mantener el equilibrio de acidez del cuerpo. Cuando el dióxido de
carbono se mezcla con el agua del plasma reacciona de manera típica produciendo
ácido carbónico molecular, el cual subsecuentemente reacciona con más agua para
disociarse, generando un equilibrio químico entre la forma molecular, el ion
acetato y el ion hidronio. Cuando se libera ion hidronio a una solución esta
aumenta su pH (potencian de iones hidronio) y por lo tanto se hace más acida.
La acidez es un factor de vital cuidado para los sistemas bilógicos, ya que las
proteínas se ven afectadas en sus funciones si la acidez de su medio cambia. La
hemoglobina funciona como una solución buffer cuando está disuelta en el
plasma, manteniendo una concentración constante de iones hidrogeniones.
22.2 Variación morfológica de
los eritrocitos
La alteración en la forma de los eritrocitos, ya sea en composición o en la membrana puede conllevar a alteraciones en su forma microscópica, los cuales proveen información importante para el diagnóstico de patologías. La membrana de los eritrocitos está unida a un esqueleto fibroso de proteínas intracelulares. La organización estructural le otorga a la célula estabilidad así como flexibilidad. Los eritrocitos normales poseen una forma de disco aplanado con el centro hundido de forma tal que al microscopio parecen anillos gruesos, roscones o donas rosadas.
Figura 22.2. Glóbulos rojos.
La alteración morfológica de los
eritrocitos puede diferenciarse en las siguientes categorías: Cambios de tamaño
y forma; Cambios de pigmentación; Inmadurez; Inclusiones y cuerpos extraños.
22.3 Cambios de tamaño y forma
de los eritrocitos
La variación notable en el tamaño o la forma de las células se denomina anisocitosis (forma diferente). Los eritrocitos más grandes de lo normal son designados con el termino macrocitos; mientras que los más pequeños microcitos.
Figura 22.3. En las anisocitocis los eritrocitos presentan tamaños diversos.
Figura 22.4. La poiquilocitosis se caracteriza por una irregularidad en las formas, los equinocitos o células de Burr, son eritrocitos con forma espinosa generados por la alteración del plasma alrededor de los eritrocitos debido a la pérdida de agua.
Figura 22.5. Existe otra
manera en que los eritrocitos pueden experimentar cambios de forma, cuando
pasan a través de vasos sanguíneos capilares anormales (muy delgados) los
eritrocitos alteran su forma al pasar de manera permanente, quedando deformes,
a estos se los denomina esquistocitos.
22.4 Cambios de color de los eritrocitos
El contenido anormal de hemoglobina en los eritrocitos puede conllevar a una coloración anormal cuando se fijan con tinciones durante los frotis al microscopio .
Figura 22.6. Eritrocitos
normocrómicos "color normal" a la izquierda y eritrocitos
hipocrómicos "bajos de color" a la derecha.
Los eritrocitos normales aparecen como roscones rojos-anaranjados-morados-rosados dependiendo del colorante utilizado, la zona central pareciera inexistente debido a la forma bicóncava, a esta coloración se la denomina normocrómica. Los eritrocitos hipocrómicos se manifiestan casi decoloreados, solo con un anillo muy tenue de coloración en la periferia. Los dianocitos son otra alteración en forma y color, ocurre cuando el centro del eritrocito que normalmente debe aparecer decoloreado aparece con un circulo como si fuera una diana de tiro al blanco.
Figura 22.7. Dianocitos.
Otra variación patológica en la coloración de una célula roja es en realidad una alteración en su forma. Los eritrocitos con forma esférica se presentan totalmente coloreados al microscopio por lo cual se los denomina esferocitos.
Figura 22.8. Esferocitos.
Como dijimos antes, los eritrocitos
normales parecen roscones/donas/anillos al microscopio, con la zona central
aparentemente vacía, sin embargo, en algunas ocasiones los eritrocitos aparecen
“aparentemente llenos” esto se debe a que presentan una forma esférica y por lo
tanto se los denomina esferocitos.
22.5 Inmadurez de los
eritrocitos
Los eritrocitos normales y maduros en los
mamíferos como los seres humanos carecen de núcleos, y por lo tanto la
presencia de glóbulos rojos con núcleos en la sangre circulante posee un
significado diagnóstico.
Figura 22.9. Normoblasto.
Un tipo específico de glóbulo rojo nucleado se puede encontrar en ciertos tipos de anemias llamado normoblasto “Figura 22.9. Normoblasto.”, se presenta cuando hay una gran pérdida de sangre y la persona empieza a producir tanto que no da abasto, la aparición de los normoblastos es una mala señal que antecede a la muerte en varias horas. Otro tipo de eritrocito nucleado es el megaloblasto “Figura 22.10” puede detectarse en la sangre circulante cuando hay presencia de anemia por deficiencia de ácido fólico.
Figura 22.10. Megaloblasto, es una célula con
un enorme núcleo púrpura.
Los retioculocitos “Figura 22.11” son células inmaduras que han perdido sus núcleos, pero que aún conservan algo del material nuclear el cual puede ser visible mediante una coloración especial. El porcentaje de reticulocitos es un indicador del nivel de eritropoyesis (formación de eritrocitos) en el tuétano. Por ejemplo, si el paciente esta anémico y el tuétano esta funcionando adecuadamente el nivel de reticulocitos (globulos rojos muy jóvenes) debe ser alto.
Figura 22.11. Reticulocitos.
22.6 Otros cambios morfológicos
de los eritrocitos
Existe una gran abundancia de otras anormalidades en los eritrocitos que pueden ser resultado de hemoglobinopatías (drepanocitos, falciformes como en la imagen siguiente) enfermedades hepáticas (estomatocitos), hematopoyesis fuera del tuétano (dacriocitos).
Figura 22.12. Eritrocitos falciformes.
Las células también pueden presentar “artefactos” que son inclusiones de proteínas resultados de la anormalidad en la hemoglobina, envenenamiento por plomo o por una eritropoyesis anormal. Los glóbulos rojos también pueden presentar inclusiones anormales debido al ingreso de cuerpos extraños, como la infección por parásitos intracelulares, tales como la malaria o la babesia.
Figura 22.13. Alteraciones morfológicas de un eritrocito
infectado por el parásito causante de la malaria.
23. Los glóbulos blancos o leucocitos
|| Regresar al Índice ||
Los glóbulos blancos o leucocitos son enviados a través de la sangre a los sitios de la infección, donde defienden el cuerpo contra microorganismos invasores y agentes extraños en conjunción con los anticuerpos y agentes proteínicos de la sangre. A pesar de su nombre genera, los glóbulos blancos comprenden 5 líneas celulares independientes denominados: neutrófilos, eosinófilos, basófilos, linfocitos y monocitos. Estas 5 líneas se derivan de tres líneas de desarrollo, la línea mieloide la línea linfoide y la línea monocítica.
Figura 23.1. El color de los
leucocitos es de hecho blanco, pues es el color con el que pigmentan a la linfa
o en el centrifugado de sangre total, al microscopio los vemos morados debido a
que usamos pigmentos para poderlos ver, y valla que es difícil.
Las células maduras de la línea mieloide
(neutrófilos, eosinófilos y basófilos) son denominados granulocitos basados en
su apariencia después de ser coloreados con colorantes policrómicos como el
Wright. Los núcleos de los granulocitos más maduros poseen núcleos que se han
dividido parcialmente en dos o más hasta cinco lóbulos interconectados por
líneas de cromatina. Esta disposición del núcleo les otorga una apariencia
multinucleada, por lo que también son conocidos por leucocitos
polimorfonucleados.
Los linfocitos y los monocitos se conocen
como leucocitos agranulados, y sus núcleos generalmente mantienen una morfología
normal, por lo que también de los denomina leucocitos mononucleados. Encontrar
a los cinco guardianes del cuerpo de forma simultánea es un evento raro, tan
raro que solo se conoce una microfotografía de tal evento. Esto se debe a que
algunosleucocitos como los monocitos son muy poco comunes y es raro
encontrarlos solos, menos aun con los demás leucocitos.
23.1 Leucocitos neutrófilos
Los leucocitos neutrófilos son el tipo de
leucocito con mayor prevalencia en la sangre periférica la mayoría del tiempo
(40-75% de todos los leucocitos). Los neutrófilos fagocitos “en la imagen
siguiente se lo muestra fagocitando a una bacteria de antrax” con apariencia de
amebas y representan la primera línea de defensa celular del organismo, en una
respuesta inflamatoria son los primeros en llegar al sitio de la alarma. Los
neutrófilos son una piedra angular del sistema inmune, ya que ellos son los de
dan la alarma a las siguientes líneas celulares de leucocitos, defectos en el
funcionamiento de estas células conlleva con rapidez a una infección masiva y
de manera casi inevitable a la muerte.
La misión primaria de los neutrófilos es
encontrar bacterias u hongos y neutralizarlos mediante un proceso de
fagocitosis (una célula engloba a otra y luego la mata). El proceso puede
dividirse en cuatro pasos:
En el primer paso la célula intrusa es marcada por
anticuerpos circulantes en sangre que se unen a ella. Esto la marca como un
agente extraño. En otras ocasiones la bacteria simplemente libera factores
quimiotácticos que atraen a los neutrófilos. Los neutrófilos reconocen a la
célula intrusa como tal gracias a las marcas de los anticuerpos. Sin embargo,
el sistema inmune es altamente redundante, la célula intrusa también puede
interactuar con proteínas de membrana de los linfocitos o de las plaquetas, lo
cual puede activar señales de alarma que atraen a los neutrófilos.
En el segundo paso, los neutrófilos activan sus característica más amebiana,
fagocitando a la célula intrusa por medio de una deformación de su membrana
celular, la cual rodea al intruso hasta embolsarlo en un organelo en el
interior. La fagocitosis es facilitada cuando la célula intrusa está cubierta
con proteínas defensivas denominadas opsoninas.
En el tercer paso tenemos una bolsa interna en el
neutrófilo que contiene la célula extraña, a esta bolsa la denominaremos
fagosoma. Activación de la fagocitosis, generalmente se da por la adhesión de
proteínas Ig (anticuerpos también llamadas inmunoglobulinas) al cuerpo extraño,
cuando el neutrófilo entra en contacto con las Ig se activa la respuesta de
fagocitosis.
Figura 23.2. Neutrófilo tal
como se ve al microscopio de una muestra de frotis de sangre periférica.
En el paso cuatro, las proteínas de la
membrana del fagosoma son activadas, y además otras vesículas del neutrófilo
producidas en los gránulos se unen al fagosoma, descargando enzimas
proteolíticas y también la generación de iones superoxido. La mezcla final se
denomina Descarga oxidativa o Descarga respiratoria. Esta Descarga mata la
célula intrusa.
Fagocitosis de una bacteria por parte de
un leucocito neutrófilo. El video se encuentra acelerado para poder notar el movimiento.
23.2 Leucocitos eosinófilos
Los leucocitos basófilos son células del sistema inmune especializadas en la defensa contra parásitos de tipo eucariótico. Su conteo en sangre es muy bajo y encontrarlos en un frotis normalmente es más un asunto de suerte que otra cosa. Junto con los basófilos representan entre el 1% y el 6% del total de leucocitos en condiciones normales. Aunque los eosinófilos son raros, cuando se los encuentra son fáciles de identificar debido a su apariencia característica. Como su nombre implica, los eosinófilos capturan con fortaleza la colorante eosina tornándose anaranjados/rojos.
Figura 23.3. En la
microfotografía siguiente tenemos un frotis de sangre con dos leucocitos (E)
eosinófilo y (N) neutrófilo.
Como los neutrófilos, los eosinófilos
migran a los sitios de inflamación, y al llegar su arma principal es la
descarga metabólica (mezcla de enzimas proteolíticas con radicales libres
superóxido). Los eosinófilos participan en la defensa contra infecciones de
parásitos eucarióticos multicelulares como las de gusanos planos, aunque
también se los relaciona con el cierre de heridas y con las respuestas
alérgicas, contribuyendo a inflamaciones crónicas.
23.3 Leucocitos basófilos
Una de las funciones principales de los
basófilos es la de incrementar la señal de alarma, favoreciendo las señales
para la migración de los neutrófilos y los eosinófilos. Como los anteriores,
los basófilos son leucocitos granulares polimorfonucleados, aunque su conteo en
sangre normal es muy bajo, su porcentaje es entre el 0% y el 2%. Los gránulos
de los basófilos poseen proteínas anticoagulantes y vasodilatadores como la
heparina y la histamina, esto le permite a la sangre fluir con mayor libertad
al sitio de la inflamación “lo cual favorece la hinchazón, incrementa la
temperatura en la zona y la pone muy roja”. Esta hinchazón o mejor dicho, este
incremento en el flujo de sangre en los vasos sanguíneos le permiten a los
leucocitos neutrófilos y eosinófilos llegar con mayor velocidad y probabilidad
a la zona de la inflamación.
Los leucocitos basófilos se caracterizan
por una densa concentración de gránulos, los cuales producen las proteínas se
alarma (inflamatorias, anticoagulantes y basodilatadoras). Adicionalmente,
también segregan otras proteínas de alarma como las prostaglandinas y las
leucotrienas. Los basófilos segregan casi las mismas proteínas inflamatorias
que los mastocitos, y son activados por el reconocimiento de la inmunoglobulina
E, de señales de heridas externas o por algunas drogas. El polen y otras
sustancias pueden activarlos también, generando una señal de alarma innecesaria
inflamando las zonas en contacto, lo cual genera una reacción alérgica.
Figura 23.4. Basófilo.
23.4 Los leucocitos linfocitos
Cerca del 16% al 45% de los leucocitos son linfocitos. Los linfocitos se subdividen en dos grupos principales, los linfocitos B generadores de anticuerpo y diversas clases de linfocitos T, de entre los cuales los más famosos son los citotóxicos. Morfológicamente un linfocito B es indistinguible de un linfocito T en un frotis de sangre.
Figura 23.5. Varios glóbulos blancos.
La identificación por lo tanto debe
realizarse por métodos de inmunofluoresencia, donde se utilizan anticuerpos
marcados para las proteínas específicas de cada linfocito. Al microscopio, los
linfocitos aparecen con un núcleo muy denso y purpura que es bastante grande en
comparación con el resto de la célula que parece un mero borde muy delgado.
Existe otra línea de linfocitos generalmente no relacionados como tales,
denominados células asesinas naturales, las cuales poseen un citoplasma más
amplio, y prácticamente se asemejan a los monocitos. La mayoría de los
linfocitos circulantes son del tipo T (linfocitos timo-dependientes), y se los
clasifica como linfocitos T efectores, linfocitos T citotóxicos y células
asesinas naturales.
Entre el 20% y el 30% de los linfocitos
circulantes son del tipo B, las cuales se encargan de la síntesis de
anticuerpos. Los linfocitos B son dependientes del tuétano, el núcleo de los
huesos (en inglés hueso es Bone, por lo que al denominarlos linfocitos
dependientes del hueso sería Bone lymphocytes, de allí la gran B de los
linfocitos B)
Cuando los receptores de membrana de un
linfocito B detectan su activador (antígeno) especifico inducen dos respuestas,
la primera es una reproducción clonal del linfocito, y la segunda, hacen que
este empiece a segregar anticuerpos que se unen de la misma manera al mismo
antígeno exacto, lo cual dispara otras respuestas y líneas celulares en el
sistema inmune. Existe otra línea celular de linfocitos llamada células nulas
(null cell) cuyas funciones no han sido elucidadas de manera precisa, aunque se
ha hipotetizado que están relacionadas junto con los linfocitos T citotóxicos
en la respuesta contra virus y tumores cancerígenos.
23.5 Los leucocitos monocitos
Al igual de los linfocitos, los monocitos son leucocitos carecen de gránulos con un núcleo simple “a veces”. Los monocitos representan entre el 4% y el 10% del total de leucocitos. Los monocitos son células fagocíticas que se distinguen de los linfocitos debido a su color más grisáceo de citoplasma cuando se los colorea con Wright. En ocasiones, el núcleo de los monocitos puede asemejarse a una herradura o a un frijol o ser ovoide.
Figura 23.6. El núcleo del monocito parece un frijol.
Al activarse los monocitos migran al
tejido infectado, una vez en el lugar se transforman de los macrófagos, las
cuales son células grandes de apariencia amebiana. Los macrófagos contienen
gránulos, las cuales son vesículas cargadas de enzimas proteolíticas que se
utiliza para matar y digerir a las bacterias y demás células extrañas.
Los monocitos al activarse generan varias líneas
celulares, en general hablamos de dos tipos generales que varían mucho en
muchos subtipos independientes. Uno de los grandes grupos de monocitos maduros
son los macrófagos encargados de devorar células extrañas y de activar al a los
linfocitos T. El otro grupo es el de las células dendríticas, las cuales son
fagocitos, aunque estas últimas permanecen en el nódulo linfático.
24. Las plaquetas o trombocitos
|| Regresar al Índice ||
El daño vascular conlleva rápidamente al
flujo de sangre, lo que, si no se repara con rapidez conllevaría a una pérdida
de sangre peligrosamente masiva, lo que conllevaría a la falla de los órganos
debido a la muerte celular. El procedimiento que sigue el organismo una vez se
da un daño vascular consiste en una vasoconstricción de los capilares y demás
vasos sanguíneos involucrados, lo cual disminuye el flujo de sangre.
Posteriormente, se forma un trombo de plaquetas temporal (también denominado
hemostasis primaria), para luego darse la formación de un coagulo de fibrina
mucho más estable (también denominada hemostasis secundaria). Finalmente, una
vez que el epitelio dañado se ha reparado se debe dar una retracción del
coagulo hasta su disolución definitiva.
24.1 Daño endotelial
Inmediatamente después de una herida, el flujo de sangre a través del vaso sanguíneo disminuye debido a una serie de factores. Entre los factores físicos incluimos una dilatación del tejido adyacente que ejerce presión para cerrar el vaso sanguíneo, además que este por sí mismo genera una vasoconstricción que cierra lo más posible el volumen por donde puede circular y perderse la sangre. El nivel de compresión varía entre los diferentes tejidos, por ejemplo, el sangrado detrás del ojo no es detenido rápidamente debido a que la piel en esta área es fácilmente distensible (no ejerce presión con fortaleza). El ojo negro (una hemorragia interna debajo de la piel) es una consecuencia de no poder cerrar los capilares con eficiencia. Sin embargo, en muchas ocasiones el tejido adyacente a una herida, como el musculo, se tensa con fortaleza cerrando el corte para minimizar la pérdida de sangre, esta es una de las respuestas fisiológicas del útero después de que una mujer da a luz. En muchos casos, las células dañadas en el lugar de la herida liberan poderosas sustancias de vasoconstricción como la serotonina, el trombonxan A2, la epinefrina y el fibrinopeptido B.
Figura 24.1. Las plaquetas
(trombocitos) en frotis de sangre periférica se observan de un tamaño muy
reducido.
24.2 Activación de las
plaquetas
El objetivo primordial de la hemostasis es
la producción rápida de una barrera que cubra la abertura en el vaso sanguíneo.
Esta barrera no es única como se piensa comúnmente, es más una sucesión de
componentes. La primera barrera es una barrera celular generada por plaquetas
(trombocitos) las cuales se unen unas con otras por cadenas de fibrinógeno.
Figura 24.2. El megacariocito.
Esta primera barrera, aunque útil, es
relativamente frágil, lo que conlleva a una regla médica, nunca quitar de
manera brusca la sangre de una herida, so pena de volverla a abrir y generar
nuevamente una hemorragia, en su lugar se la debe limpiar con mucho cuidado
para que esta barrera primaria no se rompa. Las plaquetas son fragmentos
celulares irregulares con forma de disco generadas a través de la división de
una célula precursora denominada megacariocito. Poseen un cuarto del tamaño de
un glóbulo rojo (1.5-3 um). A medida que el megacariocito madura, atraviesa por
un proceso de fragmentación que resulta en la liberación de cerca de 1 000
plaquetas.
Existe una gran cantidad de factores que
estimulan a los megatcariocitos a liberar plaquetas en las sinuosidades del
tuétano. Entre otras incluimos a la hormona trombopoyetina la cual es generada
principalmente en el hígado y los riñones y es liberada en respuesta a bajos
niveles de plaquetas circulantes. Las plaquetas no poseen un núcleo definido,
pero poseen proteínas importantes, las cuales son almacenadas en gránulos
intracelulares, los cuales son segregados en el momento en que la plaqueta es
activada durante la primera parte de la coagulación.
24.3 Conteo de plaquetas y
tiempo de sangrado
La baja cantidad de plaquetas en la sangre
se denomina trombocitopenia, y puede ser causada por una baja producción de
plaquetas (pacientes que tienen enfermedad del núcleo de los huesos largos),
secuestro de plaquetas en un vaso agrandado (esplenomegalia) o a una
destrucción acelerada (formación de coágulos primarios con inmunoglobulina G
“modelo siguiente” y remoción por fagocitos).
La trombocitopenia inmune es un desorden
autoinmune común en el cual los anticuerpos erróneamente reconocen las
proteínas de membrana de las plaquetas como agentes extraños, lo cual activa al
sistema inmune destruyéndolas. Adicionalmente a las plaquetas del suero, se
deben realizar conteos mediante punción del núcleo de los huesos largos que
luego es analizada como una biopsia.
También se ha estandarizado un examen que mide
el tiempo de sangrado. El tiempo que le toma a una herida formar la barrera
primera de plaquetas es medido mediante una incisión de un mm en la piel del
brazo a la cual se somete a un corte de presión de 40 mm Hg. Bajo este método,
el sangrado debe detenerse entre 1 y 9 minutos.
24.4 Conversión de fibrinógeno
En el siguiente paso, la barrera
relativamente débil y soluble de plaquetas y fibrinógeno madura hasta formar
una barrera mucho más estable de un polímero de fibrina completamente
insoluble. La proteína clave en este caso se denomina trombina. La trombina
corta cuatro péptidos de la molécula de fibrinógeno, una vez cortado, la parte
expuesta puede ensamblarse con otras del mismo tipo, generando una reacción de
polimerización espontánea hasta formar una larga cadena llamada fibrina.
(YouTube)
Formación de trombina (minuto 0:19)
corte del fribrinógeno para formar el monómero de fibrina (minuto 0:26)
polimerización espontánea de fibrina (minuto 0:27). Nota, ya sé que el video
está en alemán, ¡pero la animación es muy buena!
Cuando crecen, las cadenas de fibrina
forman una red que atrapa más plaquetas, eritrocitos y leucocitos formando un
coagulo estable y muy duro. Una segunda proteína denominada factor de
estabilización de fibrina (Factor XIII) cataliza la formación de enlaces
covalentes entre las uniones de los monómeros de la fibrina haciendo al coagulo
aún más duro y estable.
24.5 Cascada de coagulación
La formación de un coagulo de fibrina es el objetivo final, es generado por un sistema complejo de múltiples componentes integrados, que regulan y amplifican su formación “por lo menos para los seres humanos”. Ruta extrínseca de coagulación. El factor VII circula en la sangre en su forma activa, pero para operar requiere como cofactor al factor III "factor tisular" el cual solo es liberado en el momento de una hemorragia. Esto es el desencadenante primordial de todos los demás eventos. A esta serie de eventos se lo denomina cascada de coagulación la cual es mediada por varias proteínas que actúan en sucesión, y que reciben el nombre colectivo de factores de coagulación. Estas proteínas son sintetizadas en el hígado y que circulan en el plasma en estados inactivos.
Figura 24.3. Ruta extrínseca de la coagulación hasta llegar al factor Xa.
Figura 24.4. Ruta intrínseca
de la coagulación hasta llegar al factor Xa.
La ruta intrínseca de coagulación, por mucho es la más compleja, la que contiene la mayoría, si no, todos los bucles de aceleración, y además, para que funcione, ya debe estar andando la ruta extrínseca, especialmente porque sin eso no se activaría el factor VIII. Estas proteínas son nombradas con numerales romanos, basado en la sucesión cronológica en que fueron descubiertos.
Figura 24.5. Ruta común de la coagulación.
La parte final de la cascada es
convergente y se denomina ruta común, es interesante resaltar que, en esta
parte es donde inician todos los bucles de aceleración y el de estabilización,
todos junto con la reacción que genera la fibrina son catalizados por la misma
proteína, el factor IIa o trombina. SE puede notar como la ruta intrínseca
requiere para empezar a funcionar de la conversión del factor VIII a VIIIa por
parte de la trombina en la figura CC-02.
24.6 Rutas extrínsecas e
intrínsecas de coagulación
La coagulación de la sangre depende de dos
rutas de cascada de coagulación, lo cual le permite a la sangre coagularse en
momentos diferentes. Sin embargo, ambas cascadas se unen en los pasos finales
en los que la fibrina se forma. El nombre de las rutas es la ruta intrínseca y
la ruta extrínseca. La ruta intrínseca se inicia cuando la sangre entra en
contacto con superficies cargadas negativamente y por la activación del factor
XII a través del contacto con una superficie expuesta en la matriz endotelial
del epitelio como el colágeno.
La ruta intrínseca también es conocida
como ruta activada por contacto. La activación del factor XII requiere de
numerosos cofactores calicreina y quinonogeno. Para el inicio de la ruta
extrínseca, se requiere un factor extrínseco a la sangre que es liberado en el
momento de una herida, llamado factor III (tromboplastina). Desde el punto de
vista de la complejidad, la cascada es muy interesante, nuevamente “para los
humanos” ambas cascadas estaban integradas, y numerosos pasos se unen entre
ellas; de hecho, cualquier intento de estudiarlas por separado conlleva a
sobresimplificaciones.
24.7 Ruta común de coagulación
Los eventos finales (y que de hecho son de
los más importantes para estudiar el origen evolutivo de la cascada de
coagulación, al ser con mucha probabilidad los más antiguos) conllevan a la
formación de la red de fibrina en ambas rutas. La ruta comienza con la
activación de un factor de coagulación inactivo llamado protrombina “factor X”
a su forma activa llamada factor Xa. En la ruta de coagulación extrínseca, el
factor X es activado por un complejo que consiste del factor VII, ion calcio y
factor III. La activación de este complejo omite el requerimiento de activar
los factores VIII, IX, XI y XII usado en la ruta intrínseca. En la ruta
intrínseca el factor X es activado por un complejo que consiste en factor VIII,
factor IXa, factor 3 plaquetario y ion calcio.
Siendo el calcio un factor necesario para
la activación de ambas rutas, el uso de agentes quelantes como el EDTA inhibe
mucho la coagulación de la sangre. En cualquier caso, la activación del factor
X conlleva a la activación de la protrombina en trombina, la cual a su vez
convierte el fibrinógeno en monómeros de fibrina que se polimerizaran de manera
espontánea. La trombina también optimiza la función de los factores V y VIII
acelerando los eventos de la cascada de coagulación. Adicionalmente, la trombina
también actúa como un señalizador, que atrae a las plaquetas para que ayuden en
el proceso de coagulación.
La tabla anterior muestra las proteinas
involucradas en la coagulación, junto con sus nombres comunes y la ruta en las
que se presentan. En resumen, mucho de la historia de la cascada de coagulación
ocurre cerca de la superficie de las plaquetas y células del endotelio. Aunque
el plasma puede coagular en ausencia de superficies, el uso de superficies
simplifica el proceso y acelera la tasa de reacción en varios ordenes de
magnitud.
24.8 Las plasmina y la fibrinólisis
La fibrinólisis es el proceso por el cual
la red de fibrina se rompe, retrayendo el coagulo. La principal enzima
involucrada en el proceso se conoce como plasmina. La plasmina corta la fibra de
fibrina en varias partes, haciendo que el sistema pierda estabilidad, los
fragmentos resultantes son solubles, y por lo tanto la corriente de plasma se
los puede llevar como si fueran la eran de un rio embravecido.
El proceso puede ser acelerado por otras proteasas circulantes producidas por el hígado o los riñones. La plasmina es una proteinasa de serina igual a la mayoría de los cofactores involucrados en la coagulación. Por lo general se encuentra de manera circulante en sangre en un estado inactivo (¡que sorpresa!, “si fue un sarcasmo”) denominado plasminógeno. El plasminógeno es activado mediante una proteína denominada, activador tisular de plasminógeno, el cual es liberado por las células endoteliales que ya han sido reparadas del daño.
(YouTube)La
retracción del coagulo es un fenómeno que puede ocurrir entre minutos a horas.
24.9 Factores de crecimiento
Mientras que el coagulo resuelve muchos
problemas de la cura de una herida, el proceso de regeneración del tejido
dañado requiere una mayor cantidad de factores. La regeneración óptima requiere
el reclutamiento y proliferación de nuevas células de tejido, así como nuevo
epitelio vascular, musculo liso y nervioso. El proceso requiere de proteínas
como quemoatractores, las cuales atraen el musculo liso, células infamatorias y
fibroblastos a la herida. Los mitógenos inducen la proliferación de las
proteínas antes mencionadas.
Otros factores de crecimiento del tipo de
las citoquinas inducen la proliferación y especialización de células no
diferenciadas. Todas controlan la contracción y la remodelación continua del
tejido y del colágeno sobre el por un periodo extenso de tiempo hasta lograr la
reparación completa. Un evento importante durante la reparación de una herida
es la angiogénesis, que es la formación de nuevos vasos sanguíneos. Las
plaquetas juegan un rol primordial debido a que segregan factores que inducen a
la proliferación, migración y diferenciación de los dos mayores componentes de
los vasos sanguíneos, células endoteliales y musculo liso.
Existen cerca de 20 factores angiogénicos
y 30 inhibidores de la angiogénesis encontrados naturalmente en el cuerpo.
Cuando se produce una herida, el equilibrio entre ese grupo de proteínas
favorece a la angiogénesis, produciendo una red de capilares nuevo alrededor de
la herida, los cuales transportan nutrientes y factores de crecimiento a los
tejidos en reparación.
25. Hematopoyesis, el nacimiento de la sangre
|| Regresar al Índice ||
La hematopoyesis es un proceso general de formación de elementos que componen la sangre e incluye la eritropoyesis, la granulopoyesis y la trombopoyesis. Todos los elementos sanguíneos tienen un tiempo de vida útil, por lo que se van degradando paulatinamente. El objetivo de la hematopoyesis es el de mantener estables los niveles de los diferentes tipos celulares encontrados en la sangre periférica. Los glóbulos rojos por ejemplo tienen una vida útil de 120 días, las plaquetas por su parte tienen una garantía de 10 días, los leucocitos por otro lado tienen expectativas de vida variables, algunos pueden durar décadas o casi toda la vida como en el caso de los linfocitos B de memoria. En el ser humano adulto los eritrocitos, granulocitos, monocitos y plaquetas se forman al interior del tuétano rojo. Los linfocitos se pueden formar tanto en el tuétano como en los nódulos linfáticos.
Figura 25.1. El modelo
anterior representa los principales procesos relacionados con la hematopoyesis.
Muestra las células sanguíneas desarrollarse a partir de las células madre
hematopoyéticas en el tuétano hasta convertirse en células funcionales maduras,
así como su distribución en la sangre y el tejido conectivo. En todos los
linajes cada flecha de progresión oculta el hecho de que se da una
proliferación mitótica, o lo que es lo mismo, se producen muchos individuos.
25.1 Inicio en el desarrollo
embrionario
Durante la vida fetal tanto los
eritrocitos como los leucocitos se forman en muchos órganos antes de la
diferenciación del tuétano. La primera
etapa es conocida como etapa vitelina, la cual da inicio en la tercera semana
de gestación, caracterizada por la formación de las islas de sangre en la pared
del saco vitelino. La segunda etapa se denomina hepática, pues el hígado temprano
funciona como órgano hematopoyético. La línea celular más producida en estas
etapas es la eritroide, aunque se ha reportado el desarrollo limitado de la
leucopoyesis en el hígado. El hígado es el principal órgano de formación
sanguínea fetal durante el segundo trimestre de embarazo. El bazo “Spleen” es
el órgano gemelo del hígado, por lo que ambos comparten en esta etapa temprana
la capacidad hematopoyética, aunque en este caso es mucho más limitada.
La tercera etapa o definitiva es la etapa del tuétano rojo, iniciando en el segundo trimestre de embarazo. Después del nacimiento el hígado deja de producir eritrocitos, por lo que el tuétano se convierte en el único sitio para la formación de la sangre humana.
Figura 25.2. El modelo
anterior muestra el desarrollo de las etapas hematopoyéticas por meses. La
etapa vitelina llega hasta el tercer mes de embarazo. La etapa heática inicia
en el primer mes y continua hasta el nacimiento, en medio de esta el bazo
produce eritrocitos entre el tercer y el sexto mes. La etapa definitiva o del
tuétano rojo da inicio en el cuarto mes de embarazo y continua por el resto de
la vida del individuo.
25.2 La teoría monofilética del
nacimiento de la sangre
De acuerdo a la teoría monofilética del
nacimiento de la sangre, todos los elementos celulares de la sangre, incluyendo
las plaquetas se derivan filogenéticamente de un solo ancestro común, una
célula madre pluripotencial que se encuentra en el tuétano y en los tejidos de
los órganos hematopoyéticos embrionarios. Por muchos años se acumuló evidencia
circunstancias de que las células de la sangre derivaban de un único progenitor
directo, pero no fue aceptada como teoría científica hasta que se logró aislar
la célula madre hematopoyética o HSC por sus siglas en ingles. La célula madre
hematopoyética se clasifica como célula madre pluripotente dado que solo es
capaz de diferenciarse en algunos tipos de células de un mismo tipo de tejido o
de tejidos muy semejantes entre sí, aunque también es capaz de la auto-regeneración.
Estudios recientes ha dado evidencia de
las HSC son multipotentes, es decir, que poseen potencialmente la capacidad de
generar otros tejidos no relacionados con la sangre, contribuyendo a la
regeneración celular de varios tipos de tejidos y órganos. Durante el
desarrollo embrionario las HSC se encuentran distribuidas por el torrente
sanguíneo, y experimentan una diferenciación tisular en diferentes órganos.
Las HSC humanas han sido aisladas en el
cordón umbilical, el hígado fetal, así como en el tuétano rojo fetal y del
adulto. En el adulto poseen el potencial de reparar tejidos bajo condiciones
patológicas como las isquemias y el fallo de un órgano. Las HSC poseen
receptores de membrana específicos como los CD34 y CD90 que permite
identificarlas y aislarlas de otras células hematopoyéticas.
25.3 Las células progenitoras
La HSC hacen dos cosas, la primera se
regeneran a sí mismas, y la segunda, generan múltiples colonias de células
madre progenitoras pluripotenciales más limitadas. Dos son las colonias más
importantes: la línea mieloide común o CMP por sus siglas en inglés y la línea
común linfoide o CLP por sus siglas en inglés. ¿Qué significa esto? Básicamente
que hay dos linajes, el primero es el de los linfocitos verdaderos, mientras
que el otro linaje son todas las demás células. Hay que destacar que los
progenitores son todos semejantes morfológicamente, por lo que no vale la pena
moscrar sus microfotografías, estos se distinguen por marcadores inmunológicos
de membrana de tipo CD.
El linaje linfoide: El progenitor
linfoide común o CLP es capaz de diferenciarse en los linfocitos más comunes
que llamamos B y T, pero también genera un tercer tipo de linfocito menos
famoso denominada célula asesina natural o NK por sus siglas en inglés. Progenitor mieloide: Este se divide a su vez en dos
linajes: Progenitor granuloide: El primer
grupo es el leucocitario que da lugar a la mayoría de leucocitos que vismoa
anteriormente como los basófilos, eosinófilos, neutrófilos y monocitos, pero
también da lugar a otras células involucvradas en el sistema inmune menos
famosas llamadas mastocitos. Progenitor eritroide:
El segundo sublinaje es el que da lugar a los elementos comunes de la sangre,
los eritrocitos y las plaquetas.
Ya hemos mencionado las propiedades de cada uno de los productos maduros, excepto de los mastocitos, que por alguna razón son omitidos en algunos textos de fisiología médica, aunque prometo trabajarlos cuando veamos en sistema inmune en pleno. El enfoque de las siguientes secciones es lo que sucede entre los progenitores hasta las versiones casi maduras de cada uno de los elementos celulares de la sangre. De este modo analizaremos la línea linfoide, la línea granuloide y la línea eritroide.
Figura 25.3. Las células progenitoras.
26. Células del linaje eritroide
26.1 Progenitores de megacariocitos/eritrocitos
(MEP)
Es el progenitor de los eritrocitos y de las plaquetas. Los eritrocitos de desarrollan a partir de células CMP que, bajo la influencia de la eritropoyetina, se diferencian en células MEP. Para la diferenciación terminal de las células MEP en el linaje eritroide definitivo es necesaria la expresión del factor de transcripción GATA-1. Bajo la acción de este factor las células MEP se transforman en progenitores sensibles de a la eritropoyetina predestinadosa convertirse en eritrocitos que dan origen al proeritroblasto.
Figura 26.1. El linaje eritroide.
26.2 Precursores
Hay dos precursores indistinguibles al
microscopio, el eritroide que da lugar a los glóbulos rojos y el megacarioide
que da lugar a las plaquetas.
26.3 Megacarioblasto
Primer precursor distinguible de los
megacariocitos. Son células redondeadas u ovales de un diámetro aproximado de
entre 15 y 25 micras. Frecuentemente son binucleadas, poseyendo el núcleo
varias invaginaciones y varios nucleolos. Las masas de cromatina son más densas
que las del mieloblasto. Tiene citoplasma basófido agranular con pequeñas
mitocondrias, un aparato de Golgi relativamente bien desarrollado, algunas
cisternas de retículo rugoso y moderado número de ribosomas libres. El
megacarioblasto se diferencia durante la trombopoyesis hacia promegacariocito.
Figura 26.2. Megacarioblasto.
26.4 Megacariocito
Son unas células muy grandes y conspicuas que forman parte del tejido hematopoyético de la médula ósea y de otros tejidos hematopoyéticos. Se trata de una célula muy grande (mide unos 30 μm de diámetro), poliploide y polinucleada, con numerosas ramificaciones. La participación del megacariocito en la hematopoyesis (formación de los elementos formes de la sangre) se limita a la producción de las plaquetas o trombocitos. Para formar las plaquetas, los megacariocitos liberan fragmentos de su citoplasma directamente a un vaso sinusoide (vaso poroso), pasando así a la circulación sanguínea. El proceso madurativo desde la célula madre hasta megacariocito, posteriormente a trombocitos se denomina trombopoyesis.
Figura 26.3. Megacariocito.
26.5 Proeritroblasto
En condiciones normales se encuentra en la médula ósea de 1 a 4%. Es una célula ovoide, su núcleo es el doble de un hematíe normal con un diámetro de 14-19 μm. Esta célula capta el hierro circulante en el plasma y lo almacena para su uso posterior. Da origen por divisiones mitóticas al eritroblasto basófilo. Núcleo: Grande, redondo, de color púrpura claro con cromatina laxa uniforme dispuesta en forma filamentosa, puede tener de 2 a 3 nucleolos rodeados de cromatina intensa y la relación nucleo – citoplasma se encuentra aumentada. Citoplasma: Escaso, basófilo por la gran cantidad de ácidos nucleicos presentes y que son útiles para la producción de proteínas que se emplearán en la síntesis de hemoglobina.
Figura 26.4. Proeritroblasto.
26.6 Eritroblasto
Los eritroblastos son células eritropoyéticas. El proceso de producción de eritrocitos o glóbulos rojos pasa por varios estados eritroblásticos. En la línea de eritropoyesis, el primer eritroblasto presente en humanos (que proviene del proeritroblasto) se denomina eritroblasto basófilo. Este eritroblasto es pequeño, de unas 12 micras, y posee un citoplasma basófilo debido a la presencia de abundantes ribosomas encargados de sintetizar la hemoglobina (la proteína que transporta el oxígeno). El eritroblasto basófilo capta ferritina de la sangre por pinocitosis para aumentar su contenido en hierro.
Figura 26.5. Eritroblastos.
26.7 Policromatófilo
Del eritroblasto basófilo se diferencia el
eritroblasto policromatófilo cuando su contenido de hemoglobina pasa a ser muy
alto. Esto sucede porque esta proteína es ácidófila y enmascara la afinidad por
tintes básicos de los ribosomas. Su cromatina está más condensada que en
estados anteriores.
26.8 Ortocromático o
normoblasto
El siguiente estado en la transformación
es el eritroblasto ortocromático, eritroblasto ortocromatófilo o normoblasto.
Puesto que los eritrocitos son acidófilos por definición, el prefijo de estos
eritroblastos incide en que ya poseen esta característica acidofilia. Esta
modificación se debe a una menor presencia de ribosomas, porque ya no se
requiere una síntesis de hemoglobina activa. El normoblasto sufre la pérdida
del núcleo (que es fagocitado por macrófagos) dando lugar al reticulocito o
eritrocito inmaduro. Tras unos días de maduración en la médula ósea finalmente
la abandona entrando en el torrente sanguíneo y pasando a ser un eritrocito
maduro. En vertebrados no mamíferos la pérdida del núcleo no siempre sucede,
manteniéndose por tanto eritrocitos nucleados en el torrente sanguíneo.
26.9 Reticulocito
Son glóbulos rojos que no han alcanzado su
total madurez. Se encuentran en niveles elevados en el plasma sanguíneo por
causa de algunas anemias, cuando el organismo incrementa la producción de
glóbulos rojos y los envía al torrente sanguíneo antes de que sean maduros.1
Los reticulocitos se caracterizan por presentar una red de filamentos y
gránulos que hacen que se tiñen en el frotis de sangre, distinguiéndose así de
los glóbulos rojos maduros. Normalmente representan el 0,5-1,5% del conteo de
glóbulos rojos, pero pueden exceder el 4% cuando compensan la anemia.
Los reticulocitos son células anucleadas
predecesoras de los eritrocitos con la diferencia de que poseen gránulos de
ribosomas y algunas mitocondrias que les son útiles para sintetizar el 35 % de
la hemoglobina restante. Este tipo de células está en la circulación periférica
aproximadamente un día para convertirse posteriormente en un hematíe maduro que
cumplirá con todas las funciones biológicas de estas células. A diferencia de
los hematíes o glóbulos rojos maduros, los reticulocitos aún poseen ARN. El
reticulocito es la célula roja que antecede en maduración al eritrocito, es el
resultado de la pérdida del núcleo que sufre el eritroblasto ortocromático. Su
tamaño varía de 10 - 15 micras de diámetro.
Figura 26.6. Reticulocito.
El reticulocito tiene una vida media de
dos días en médula ósea, de allí sale a la circulación donde requiere un día
para convertirse en célula roja madura. Durante este período sintetiza el 20%
de la hemoglobina contenida en la célula roja. Se han propuesto varios
mecanismos mediante los cuales el reticulocito finaliza su maduración: autofagia
y eyección de orgánulos no necesarias, acción "pitting" del bazo y
degradación bioquímica por medio de la 5 pirimidín nucleotidasa.
26.10 Eritropoyesis
La eritropoyesis (del griego 'eritro', que
significa "rojo", y "poiesis", que significa
"hacer") es el proceso de producción de glóbulos rojos (eritrocitos).
Se estimula mediante la disminución de O2 en la circulación,
detectada por los riñones, que entonces secretan la hormona eritropoyetina.
Esta hormona estimula la proliferación y diferenciación de los precursores de
los glóbulos rojos, lo que activa el aumento de la eritropoyesis en los tejidos
hematopoyéticos y, en última instancia, en la producción de glóbulos rojos. Por
lo general, en las aves y los mamíferos (seres humanos incluidos) recién
nacidos, esta se produce dentro de la médula ósea roja. En los fetos en
desarrollo inicial, la eritropoyesis tiene lugar en las células mesodermales
del saco vitelino. Al tercer o cuarto mes, la eritropoyesis se traslada al
hígado. Transcurridos siete meses, la eritropoyesis tiene lugar en la médula
ósea. El aumento de la actividad física puede producir un aumento de la
eritropoyesis. Sin embargo, en humanos
con ciertas enfermedades y en algunos animales, la eritropoyesis también puede
tener lugar fuera de la médula ósea, en el bazo o en el hígado. Esta recibe el
nombre de eritropoyesis extramedular. La
médula ósea de prácticamente todos los huesos produce glóbulos rojos hasta que
una persona alcanza aproximadamente los cinco años de edad. La tibia y el fémur
dejan de ser centros de hematopoyesis alrededor de los 25 años de edad; las
vértebras, el esternón, la pelvis, las costillas y los huesos del cráneo siguen
produciendo glóbulos rojos durante el resto de la vida.
Figura 26.7. Eritropoyesis.
En el proceso de maduración del corpúsculo
rojo, una célula sufre una serie de diferenciaciones. Las siguientes etapas de
desarrollo se producen dentro de la médula ósea: (1) un hemocitoblasto, una
célula madre hematopoyética multipotente, se convierte en (2) un progenitor
mieloide común o en una célula madre multipotente, y luego (3) en una célula
madre unipotente, después (4) en un pronormoblasto, también comúnmente llamado
proeritroblasto o rubriblasto, después, (5) este se convierte en un normoblasmo
basófilo o temprano, también comúnmente llamado eritroblasto, después, (6) en
un normoblasto policromófilo o intermedio, luego (7) en un normoblasto
ortocromático o tardío. En esta etapa, el núcleo es expulsado antes de que la
célula se convierta en un reticulocito. La célula se libera de la médula ósea
después de la séptima etapa y, por lo tanto, en los glóbulos rojos de reciente
circulación hay aproximadamente un 1 % de reticulocitos. Tras uno o dos días,
estos últimos se convierten en "eritrocitos" o glóbulos rojos
maduros.
Estas etapas se corresponden con aspectos
específicos de la célula cuando se tiñen con la tinción de Wright y se examinan
mediante microscopía óptica, y también se corresponden con otros cambios
bioquímicos. En el proceso de maduración,
un pronormoblasto basofílico se convierte de una célula con un núcleo grande y
un volumen de 900 fL a un disco enucleado con un volumen de 95 fL. En la etapa
de reticulocitos, la célula ha extrudido su núcleo, pero todavía es capaz de
producir hemoglobina. Esenciales para la
maduración de los glóbulos rojos son la vitamina B12 (cobalamina) y la vitamina
B9 (ácido fólico). La carencia de cualquiera de las dos hace que la maduración
fracase en el proceso de eritropoyesis, que se manifiesta clínicamente como
reticulocitopenia, una cantidad anormalmente baja de reticulocitos.
A medida que maduran, cambian algunas
características de los eritrocitos: El tamaño de la célula se reduce y la
matriz citoplásmica aumenta en cantidad y la reacción de tinción del citoplasma
cambia de azul a rojo rosado debido a la disminución de la cantidad de ARN y
ADN. Inicialmente, el núcleo es de gran tamaño y contiene cromatina abierta.
Pero a medida que los glóbulos rojos maduran el tamaño del núcleo disminuye y
finalmente desaparecen con la condensación del material de la cromatina
26.11 Cinética de la
eritropoyesis
En cada una de las etapas de desarrollo de
la eritropoyesis desde el proeritroblasto al eritroblasto al normoblasto al
reticulocito implica muchas divisiones mitóticas. Toma alrededor de una semana
para que los reticulocitos inmaduros inicien su migración al torrente
sanguíneo. Prácticamente todos los eritrocitosmaduran justo en los espacios
intersticiales de la matriz extracelular de la médula ósea y llegan al torrente
sanguíneo maduros. La médula ósea no es capaz de almacenar eritrocitos.
La eritropoyesis es un proceso regulado
por la hormona eritropoyetina, una glicoproteína con función hormonal, y
segregada por el riñón en respuesta a la detección de cantidades bajas de
oxígeno en la sangre circulante. La eritropoyetina como toda hormona se acopla
a receptores específicos de los precursores estimulando su proliferación y
diferenciación. Cuando los eritrocitos llegan al torrente sanguíneo elevan la
cantidad de oxígeno circulante, y al eritropoyetina deja de segregarse. De allí
en adelante la cohorte de eritrocitos funcionará por 120 días, hasta que
pierden elasticidad en sus membranas para pasar por los capilares del bazo,
momento en el cual los macrófagos los devoran. Los macrófagos lisan los
eritrocitos, y procesas su contenido que es casi que exclusivamente
hemoglobina. Las globinas se separan del grupo heme, siendo reprocesadas para
hacer parte de las reservas de aminoácidos en espera de una síntesis de más
proteínas, mientras que el grupo heme es liberado de su hierro para formar
hemosiderina o ferritina, y es almacenada para sintetizar nueva hemoglobina.
Parte del entramado del grupo heme no puede reciclarse, y es convertido en
bilirrubina, la cual se enlaza a la albumina y es liberada al torrente
sanguíneo donde el hígado la captura y la excreta por medio de la bilis.
Las cohortes de producción y destrucción
son procesos continuos, generándose un estado cíclico homeostático de
retroalimentación en el que interviene la eritropoyetina que ayuda a regular el
proceso de eritropoyesis de modo que, en fases que no pertenecen a una
enfermedad, la producción de glóbulos rojos se equipara a la destrucción de
glóbulos rojos y el número de glóbulos rojos es suficiente para mantener los
niveles de oxígeno necesarios en los tejidos pero no tan altos como para causar
lodo, trombosis o accidente cerebrovascular. La eritropoyetina se produce en el
riñón y el hígado en respuesta a bajos niveles de oxígeno. Además, la
eritropoyetina está unida por los glóbulos rojos en circulación: a un número
bajo de eritrocitos en circulación se corresponde un nivel relativamente alto
de eritropoyetina liberada, que estimula su producción en la médula ósea.
Algunos estudios recientes también han demostrado
que la hormona peptídica hepcidina puede desempeñar un papel importante en la
regulación de la producción de hemoglobina y, por lo tanto, influir en la
eritropoyesis. El hígado produce hepcidina. La hepcidina controla la absorción
de hierro en el tracto gastrointestinal y la liberación de hierro del tejido
reticuloendotelial. El hierro debe ser liberado de los macrófagos en la médula
ósea para ser incorporado en el grupo hemo de la hemoglobina en los
eritrocitos. Hay unidades que forman colonias y que las células siguen durante
su formación. Estas células se denominan células comprometidas incluyendo las
unidades formadoras de colonias de monocitos formadas por granulocitos.
La secreción de hepcidina es inhibida por
otra hormona, eritroferrona, producida por eritroblastos en respuesta a
eritropoyetina, e identificada en 2014. Parece que esta vincula la
eritropoyesis impulsada por la eritropoyetina con la movilización de hierro
necesaria para la síntesis de la hemoglobina.
La pérdida de función del receptor de la eritropoyetina o JAK2 en las
células de los ratones causa falla en la eritropoyesis, por lo que la
producción de glóbulos rojos en los embriones y el crecimiento se interrumpen.
Si no existiese una inhibición de la retroalimentación, como por ejemplo, la
realizada por los supresores de proteínas de señalización (citoquinas) en el
sistema, se produciría gigantismo en los ratones.
27. Origen de otros componentes de la sangre
|| Regresar al Índice ||
27.1 Trombopoyesis
La trombopoyesis es el proceso que permite la formación de plaquetas para la normal coagulación de la sangre. Cada día un adulto sano normal es capaz de procesar (1,0E+11) plaquetas, un número que puede aumentar cies veces en caso de que exista demanda debido a alguna hemorragia. La trombopoyesis es un proceso que requiere una compleja red de hormonas como las interleuquinas, factores de crecimiento colonial y otras hormonas.
Figura 27.1. Trombopoyesis.
Se distinguen cuatro estadios evolutivos:
megacarioblasto, elemento más inmaduro, promegacariocito, megacariocito
granular y el más maduro el megacariocito liberador de plaquetas. El
megacariocito, al desprender parcelas citoplasmáticas delimitadas por las
membranas de demarcación, como se ha demostrado a nivel estructural, origina
las plaquetas de la sangre periférica. En la serie megacariocítica, a
diferencia de lo que ocurre en el resto de las células hematopoyéticas, las
divisiones nucleares no van seguidas de las correspondientes divisiones
citoplasmáticas, lo que determina la formación de células poliploides de gran
tamaño con numerosos núcleos. En el estadio de megacarioblasto se suceden en
número variable las mitosis nucleares, apareciendo las sucesivas ploidías
nucleares. Ello se acompaña, gracias a una elevada síntesis de DNA, de un
aumento de la talla nuclear. Finalizada esta etapa de síntesis de DNA y
duplicación nuclear, se inicia en el citoplasma la granulogénesis que dará
origen a las futuras plaquetas sanguíneas.
El promegacarioblasto no tiene
identificación morfológica. Es un elemento mononucleado de aspecto a veces
pseudolinfoide que precisa para su filiación demostrar la presencia de
peroxidasa plaquetaria a nivel estructural o del empleo de anticuerpos
monoclonales específicos de esta línea (CD 41). El megacarioblasto es el
elemento de menor tamaño de esta serie con un núcleo es único, grande, ovalado
o bilobulado, con cromatina laxa y numerosos nucleolos. El citoplasma es
intensamente basófilo, agranular y puede presentar algunas prolongaciones a
modo de pseudópodos. El promegacariocito inicia ya la granulogénesis en
distintas áreas de su citoplasma. Es una célula fácilmente identificable por su
gran tamaño y por el aspecto característico de su citoplasma, que posee bordes
mal limitados y emite numerosas prolongaciones. El núcleo es multilobulado, con
cromatina densa y sin nucleolos. En el citoplasma persiste una tonalidad
basófila, cubierta zonalmente por numerosas granulaciones azurófilas. El
megacariocito posee como características más destacables su gran tamaño (80 o
más um) y su elevada ploidía. Se distinguen dos tipos de megacariocitos: el
megacariocito granular y el maduro. El granular tiene un núcleo multilobulado,
de citoplasma de tonalidad rosada y es de gran tamaño. Los maduros, liberadores
de plaquetas, poseen un extenso citoplasma que ha perdido todo resto de
basofilia y está cubierto totalmente por granulación azurófila. El núcleo,
también multilobulado o segmentado, posee una cromatina condensada sin
nucleolos. Los gránulos azurófilos se disponen especialmente en la periferia en
cúmulos que irán delimitando las futuras plaquetas. Las plaquetas pasan a la
sangre periférica donde ejercen sus funciones en los mecanismos de coagulación.
Los trombocitos son elementos formes de la sangre de menor tamaño (de 2 a 3 um)
y están desprovistos de núcleo, por lo que no se trata de verdaderas células,
sino de fragmentos celulares. Su forma fisiológica es discoide, aspecto que se
modifica con facilidad por las maniobras de extensión o centrifugación,
adquiriendo un aspecto redondeado y emitiendo finas prolongaciones.
La identificación de los elementos
megacariocíticos maduros o semimaduros es muy sencilla por simples criterios
morfológicos; sin embargo; los precursores megacariocíticos
(promegacarioblastos) precisan de la reacción de la peroxidasa plaquetar a
nivel ultraestructural y de la detección de glicoproteinas de superficie
mediante los anticuerpos monoclonales CD 41, CD 42 o de anticuerpos dirigidos
contra el factor VIII o plaquetar 4. En la mayoría de los casos el primer
marcador que aparece es la peroxidasa plaquetar que se anticipa a la
presentación de las membranas de demarcación o los gránulos en ojo de buey,
orgánulos sólo detectables a nivel ultraestructural. A ésta, le sigue la
glicoproteina IIIa (CD 61), la IIb/IIIa (CD 41) y la Ib (CD 42 ). Todos estos
marcadores persisten a lo largo del eje madurativo megacariocítico.
27.2 Granulopoyesis
La granulopoyesis se encarga de producir a los leucocitos de primera línea de batalla, encargados de contener las infecciones hasta que los linfocitos entran en acción para eliminar las infecciones.
Figura 27.2. Granulopoyesis.
Los granulocitos maduran morfológicamente
de manera semejante; se originan en la célula madre mieloide multipotencial,
que es inducida por citocinas a diferenciarse en CFU-Eo para convertirse en
eosinófilo, en CFU-Ba para convertirse en basófilo o en CFU- GM (célula madre
bipotencial) para convertirse en neutrófilo (proceso cuyo primer paso es
diferente al de los demás granulocitos y comprende la transformación de CFU-GM
en CFU-G). • El mieloblasto es la primera célula precursora reconocible de la
granulopoyesis. Mide de 14 a 20 µm de diámetro y posee un núcleo esferoidal
eucromático grande con 3 a 5 nucléolos. Su pequeña cantidad de citoplasma
agranular es bien basófilo. El mieloblasto se convierte en promielocito, con un
núcleo casi igual pero con gránulos azurófilos (primarios) en su citoplasma,
que sólo se producen en estas células.
El reconocimiento de los linajes neutrófilo,
basófilo y eosinófilo sólo es posible en la siguiente etapa, en la que se
origina el mielocito, cuyo núcleo se va tornando cada vez más hipercromático y
va adquieriendo una escotadura. Aquí empiezan a surgir los gránulos
específicos. Las divisiones del mielocito originan al metamielocito, etapa en
la que los linajes son ya bien distinguibles gracias a que los gránulos
específicos superan en número a los azurófilos.
En las series basófila y eosinófila, la siguiente fase es la de basófilo
y eosinófilo maduros; pero en la serie neutrófila, el paso siguiente origina
una célula con núcleo “en cayado”, cuyos lóbulos están en formación. Al
distinguirse bien los lóbulos nucleares, se habla de neutrófilo maduro.
Los mielocitos continúan diferenciándose
para dar lugar a los metamielocitos, siendo la primera etapa en la que los
neutrófilos, basófilos y eosinófelos pueden comenzar a diferenciarese, los
metamielocitos son algo más pequeños que sus versiones maduras. El
metamielocito neutrófilo tiene un núcleo con una escotadura evidente, con
cromatina más condensada, tiene un citoplasma un poco más eosinofilo, en este,
el 80% de los gránulos son secundarios, el metamielocito neutrófilo madura y da
lugar al cayado o banda. El metamielocito eosinófilo tiene un núcleo con una
escotadura evidente con cromatina más condensad, su citoplasma un poco más
eosinofilo, En este el 80% de los gránulos son secundarios, son más abundantes
que los inespecíficos. El metamielocito basófilo tiene un núcleo con una
escotadura evidente, con cromatina más condensada, pero menos que los meta
mielocitos anteriores, su citoplasma un poco más basófilo. Una vez en la etapa
de metamielocito cada uno de los tres puede diferenciarse en sus versiones
maduras.
27.3 Cinética de la
granulopoyesis
La granulopoyesis toma alrededor de dos
semanas, en la primera semana se dan todas las tapas hasta llegar al
metamielocito, mientras que la maduración del metamielocito a la versión madura
toma alrededor de otra semana. El tiempo que tarda la mitad de los neutrófuilos
maduros para abandonar la sangre circulante es de unas 6 a 8 horas. El tiempo
en la sangre circulante es aleatorio variando desde unos cuantos minutos hasta
unas 16 horas, con un promedio de entre 8 a 12 horas.
En el tejido conectivo los neutróifilos
tienen una vida adicional de 1 a 2 dias antes de autodestruirse por apoptosis y
sus restos ser devorados por los macrófagos. Muchos neutrófilos migran al
epitelio gastrointestinal, donde son liberados en las heces. La médula ósea
mantiene una reserva de neutrófilos funcionales listos para reemplazar a los
que se encuentran en sangre, ya sea en estado de normalidad o de respuesta a
una infección aguda. En condiciones normales la sangre posee cerca de 1,0E+11.
El tamaño de las reservas depende de la velocidad con que se ejecuta la
granulopoyesis, el periodo de vida de los neutrófilos y las tasas de migración
al sistema circulatorio y tejido conectivo.
27.4 Desarrollo de los
monocitos
Por monopoyesis se conoce la formación de
monocitos a partir de las UFC-M (Unidad Formadora de colonias Monocíticas o
monocitos). Su formación está caracterizada por dos fases de maduración que se
consideran las más importantes: (1) Monoblastos: Células de 18 a 22uM de
diámetro similares a los mieloblastos, con la diferencia del que el núcleo es
más claro y la cromatina nuclear mucho menos diferenciada. (2) Promonocitos:
Células de 20uM de citoplasma azulado grisáceo, donde no es posible distinguir
a los nucleolos. Es posible distinguir granulaciones azurófilas. Los monocitos
se pueden localizar como células fijas en órganos como el bazo, los alveolos
pulmonares, y las células de Kupffer del hígado. Su función principal consiste
en fagocitar bacterias, micobacterias, hongos, protozoos, o virus.
28. Linfopoyesis
|| Regresar al Índice ||
Es Formación de linfocitos y células plasmáticas a partir de las células madre linfoide que se desarrollan de las células madre hematopoyeticas de la médula ósea. Estas células madre linfoide se diferencian en linfocitos t, linfocitos b, células plasmáticas o células NK (células asesinas naturales), dependiendo de los órganos o tejidos (tejido linfoide) los que emigran.
Figura 28.1. Linfopoyesis.
28.1 Linfocitos B
En la ontogenia, el desarrollo de las
células B puede ocurrir en el epiplon y el hígado fetal, mientras que después
del nacimiento se confina primordialmente a la médula ósea. Aun cuando la
información acerca de los eventos de transición a partir de los potenciales
CLPs a los precursores de células B es muy limitada, se han identificado poblaciones
funcionales que definen la vía de diferenciación río abajo, iniciando con las
células B tempranas CD34+CD19-CD10+ y continuando con pro-B CD34+CD19+CD10+,
pre-BI grandes CD34+CD19+CD10+, pre-BII grandes CD34-CD19+CD10+, pre-BII
pequeñas CD34-CD19+CD10+, B inmaduras CD34-CD19+CD10+sIgM+ hasta la producción
de B maduras CD34-CD19+CD10-sIgM+sIgD+, que eventualmente serán exportadas a
los tejidos linfoides periféricos para cumplir su función de reconocimiento de
antígeno, activación y producción de anticuerpos específicos. El proceso
completo en la médula ósea requiere de la acción concertada de múltiples
factores de transcripción, incluyendo Ikaros, PU.1, E2A, EBF y Pax-5. Los dos
primeros actúan paralelamente en el control de la transición de las células
troncales a progenitores, mientras que E2A, EBF y Pax-5 regulan secuencialmente
el desarrollo de las células B tempranas (34). La linfopoyesis de B en el
humano parece cumplirse sin el requerimiento de algunas citocinas documentadas
como esenciales para el proceso en el ratón, como la interleucina 7, y hasta el
momento se desconocen los factores de crecimiento y/o citocinas que la dirigen.
28.2 Linfocitos T
Debido a que el timo no produce
progenitores de renovación autóloga, la linfopoyesis de los linfocitos T es
mantenida por la importación periódica de progenitores hematopoyéticos a través
de la corriente sanguínea, y aunque a múltiples progenitores se les reconoce
cierto potencial para generar células T, no todos ellos tienen la propiedad de
establecerse en este órgano. Las bases moleculares de su entrada no han sido
totalmente elucidadas, pero se predice que pudiera ser un proceso secuencial
análogo al ‘homing’ de leucocitos, esto es: adhesión débil al endotelio
vascular mediado por selectinas, señalización vía quimiocinas, adhesión fuerte
a través de integrinas, y transmigración. Al respecto, los modelos
experimentales han mostrado la importancia que CD44, P-selectina y CCR9 tienen
en la colonización tímica (36).
Los precursores tímicos más tempranos
(ETP) residen en la población CD34+CD1a- CD38loCD44+IL-7R+ y a partir de ellos
se inicia el proceso de compromiso de estadios intermedios de diferenciación
desde células pre-T, células inmaduras CD4 uni-positivas pequeñas, células CD4
uni-positivas grandes, células tempranas doble-positivas (EDP), hasta los
timocitos DP CD4+CD8+TCR+, los cuales darán origen a la diversidad de
linfocitos T maduros CD4 y CD8 con capacidad de reconocimiento de antígeno y
activación. La participación de algunos factores de transcripción en éste
proceso ha sido blanco de gran investigación, y actualmente es claro que las
interacciones de los receptores Notch con sus ligandos juegan un papel crucial
en el control de la diferenciación y proliferación de los precursores
tempranos, dirigiendo así las decisiones de linaje de T en el timo (35),
concomitante con la supresión del linaje de B. Así mismo, el balance de la
expresión de las proteínas E y sus antagonistas naturales Id está implicado en
la diversificación tímica T/NK , y el factor GATA3 es esencial para el
re-arreglo apropiado de genes del receptor de células T.
28.3 Asesinas naturales
Las células asesinas naturales (NK) pueden
producirse en múltiples sitios. En el feto se han encontrado precursores en
médula ósea, hígado, timo, bazo y ganglios linfáticos, mientras que en niños y
adultos la médula ósea es el sitio predominante de su desarrollo a partir de
progenitores linfoides. Los factores de transcripción Id2 y Id3 controlan el
desarrollo temprano de las células NK, mientras que los tres estadios que
definen el proceso completo -el compromiso de linaje, la selección del
repertorio de receptores NK y la maduración funcional- son críticamente
dependientes de interleucina 15, que mantiene la viabilidad y sostiene la
proliferación de las células en desarrollo.
29. La sangre y el tuétano
|| Regresar al Índice ||
En el lenguaje coloquial, se le llama tuétano; pero generalmente se refiere más a la médula ósea de los animales empleados en la gastronomía; por ejemplo, el corte de carne conocido como "chambarete", "caracú" u "osobuco" tiene una porción de tuétano o médula ósea, que es apreciada por aficionados y se consume después de ser cocinada. En otros casos, dependiendo del corte del hueso, después que el tuétano ha sido retirado, el hueso puede ser empleado en el escultismo, para hacer el nudo de la pañoleta.
Figura 29.1. Relación entre
el tuétano y las células sanguíneas.
La médula ósea es un tipo de tejido
biológico flexible que se encuentra en el interior de los huesos largos,
vértebras, costillas, esternón, huesos del cráneo, cintura escapular y pelvis.
Todas las células sanguíneas derivan de una célula madre hematopoyética
pluripotencial ubicada en la médula ósea. En promedio, la médula ósea
constituye el 4% del total de la masa corporal del ser humano; por ejemplo, en
un adulto que pesa unos 65 kilos, su médula ósea pesa unos 2.6 kg. El
componente hematopoyético de la médula ósea produce unos 500 000 millones de
glóbulos rojos por día, que utilizan la vasculatura de la médula ósea como
conducto de la circulación sistémica del cuerpo. La médula ósea también es un
componente clave del sistema linfático, produciendo los linfocitos que forman
parte del sistema inmune del cuerpo. No debe confundirse con la médula espinal
localizada en la columna vertebral y encargada de la transmisión de los
impulsos nerviosos hacia todo el cuerpo.
Hay dos tipos de médula ósea: (1) La
médula ósea roja, que ocupa el tejido esponjoso de los huesos planos, como el
esternón, las vértebras, la pelvis y las costillas; es la que tiene la función
hematopoyética. (2) La médula ósea amarilla, que es tejido adiposo y se
localiza en los canales medulares de los huesos largos. La médula ósea roja, a
la que se refiere habitualmente el término médula ósea, es el lugar donde se
produce la sangre (hematopoyesis), porque contiene las células madre que
originan los tres tipos de células sanguíneas que son los leucocitos, hematíes
y plaquetas.
La médula ósea puede trasplantarse, ya que
puede extraerse de un hueso de donante vivo, generalmente del esternón o de la
cadera, mediante una punción y aspiración y transfundirse al sistema
circulatorio del receptor si existe compatibilidad del sistema HLA
(compatibilidad de órganos entre donante y receptor). Las células madre
transfundidas anidarán en la médula ósea de los huesos del receptor. Es lo que
se llama trasplante de médula ósea. Los trasplantes de médula ósea están siendo
muy útiles en la investigación y en las terapias de regeneración del sistema
nervioso central, debido al tipo de células (pluripotenciales) que la componen;
siendo de las líneas celulares más utilizadas en estos campos.
Referencias
|| Regresar al Índice ||
Abedin, M.,
& King, N. (2010). Diverse evolutionary paths to cell adhesion. Trends
in Cell Biology, 20(12), 734–742.
Adams, S. L. (1989). The
medicinal leech: historical perspectives. In Seminars in thrombosis and
hemostasis (Vol. 15, pp. 261–264). Copyright© 1989 by Thieme Medical
Publishers, Inc.
Alberts, B., Bray, D., Hopkin,
K., Johnson, A., Lewis, J., & Raff, M. (2004). Tissues and cancer. Essential
Cell Biology. New York, 698–706.
Angelini, P., Villason, S.,
Chan Jr, A. V, & Diez, J. (1999). Normal and Anomalous Coronary Arteries in
Humans. Part 1: Historical Background.
Antonova, O., Yossifova, L.,
Staneva, R., Stevanovic, S., Dolashka, P., & Toncheva, D. (2015). Changes
in the gene expression profile of the bladder cancer cell lines after treatment
with Helix lucorum and Rapana venosa hemocyanin. J. BUON, 20(1),
180–187.
Aw, T. Y. (1999).
Intracellular compartmentation of organelles and gradients of low molecular
weight species. International Review of Cytology, 192, 223–253.
Azizi, M.-H., Nayernouri, T.,
& Azizi, F. (2008). A brief history of the discovery of the circulation of
blood in the human body. Arch Iran Med, 11(3), 345–350.
Bashkin, P., Doctrow, S.,
Klagsbrun, M., Svahn, C. M., Folkman, J., & Vlodavsky, I. (1989). Basic
fibroblast growth factor binds to subendothelial extracellular matrix and is
released by heparitinase and heparin-like molecules. Biochemistry, 28(4),
1737–1743.
Berg, J. M., Tymoczko, J. L.,
& Stryer, L. (2002). Biochemical evolution. In Biochemistry (5th
ed., pp. 56–82). Freeman. Retrieved from
https://docs.google.com/file/d/0B0HRqdV3D7xIZGNlNmRmY2YtZGY3NS00YmJiLTkyYzQtNWFkOWYwMWVlNjA1/edit
Boyanova, O., Dolashka, P.,
Toncheva, D., Rammensee, H., & Stevanović, S. (2013). In vitro effect of
molluscan hemocyanins on CAL‑29 and T‑24 bladder cancer cell lines. Biomedical
Reports, 1(2), 235–238.
Bremer, P., Flint, S., Brooks,
J., & Palmer, J. (2015). Introduction to Biofilms. Biofilms in the Dairy
Industry, 1–16.
Brewer, D. B. (2006). Max
Schultze (1865), G. Bizzozero (1882) and the discovery of the platelet. British
Journal of Haematology, 133(3), 251–258.
Bright, G. R., Fisher, G. W.,
Rogowska, J., & Taylor, D. L. (1987). Fluorescence ratio imaging
microscopy: temporal and spatial measurements of cytoplasmic pH. The Journal
of Cell Biology, 104(4), 1019–1033.
Brownlee, C. (2002). Role of
the extracellular matrix in cell–cell signalling: paracrine paradigms. Current
Opinion in Plant Biology, 5(5), 396–401.
Brusca, R., Brusca, G. J.,
& Haver, N. J. (2003). Invertebrates (2nd ed.). Sinauer Associates.
Burmester, T., & Hankeln,
T. (2004). Neuroglobin: a respiratory protein of the nervous system. Physiology,
19(3), 110–113.
Burmester, T., Weich, B.,
Reinhardt, S., & Hankeln, T. (2000). A vertebrate globin expressed in the
brain. Nature, 407(6803), 520–523.
Campbell, M. K., &
Farrell, S. O. (2012). Biochemistry (7th ed.). Canadá: Brooks/Cole.
Cate, J. H. D. (2001).
Construction of low-resolution x-ray crystallographic electron density maps of
the ribosome. Elsevier.
Clegg, J. S. (1984).
Properties and metabolism of the aqueous cytoplasm and its boundaries. American
Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 246(2),
R133–R151.
Coates, C. J., & Nairn, J.
(2014). Diverse immune functions of hemocyanins. Developmental & Comparative Immunology, 45(1), 43–55.
Dalla Bona, F. (2004). Dolci pagine: la pasticceria
napoletana nell´ opera di Matilde Serao. Revista de Italianística, (9),
149–154.
Daniels, G. (2008). Human
blood groups. John Wiley
& Sons.
De Duve, C., & Pizano, M. (1995). Polvo vital:
origen y evolución de la vida en la tierra. Norma, Bogotá.
Donlan, R. M. (2016).
Microbial biofilms. Centers for Disease Control and Prevention.
Doolittle, R. F. (1984). The
plasma proteins.
Doyle, L. (1989). Gabriel
Andral (1797-1876) and the first reports of lymphangitis carcinomatosa. Journal
of the Royal Society of Medicine, 82(8), 491.
Ellis, R. J. (2001a).
Macromolecular crowding: an important but neglected aspect of the intracellular
environment. Current Opinion in Structural Biology, 11(1),
114–119.
Ellis, R. J. (2001b).
Macromolecular crowding: obvious but underappreciated. Trends in Biochemical
Sciences, 26(10), 597–604.
Elsholtz, J.-S. (1966). Clysmatica
nova: sive ratio, qua in venam sectam medicamenta immitti possunt... ex
Officina G. Schultzi.
Friedman, M. T., West, K. A.,
& Bizargity, P. (2016). Immunohematology and Transfusion Medicine.
Springer.
Fröls, S. (2013). Archaeal
biofilms: widespread and complex. Portland Press Limited.
Gallagher, J. T., & Lyon,
M. (2000). Molecular structure of heparan sulfate and interactions with growth
factors and morphogens. Proteoglycans: Structure, Biology and Molecular
Interactions, 27–59.
Giangrande, P. L. F. (2000).
The history of blood transfusion. British Journal of Haematology, 110(4),
758–767.
Góngora-Biachi, R. A. (2005). La sangre en la historia de la humanidad. Rev Biomed, 16(4),
281–288.
Goodenough, J., & McGuire,
B. (2012). Biology of Humans, Concepts, Applications and Issues (4th
ed.). San Francisco: Pearson, Benjamin Cummings.
Guncheva, M., Paunova, K.,
Ossowicz, P., Rozwadowski, Z., Janus, E., Idakieva, K., … Apostolova, S.
(2016). Rapana thomasiana hemocyanin modified with ionic liquids with enhanced
anti breast cancer activity. International Journal of Biological
Macromolecules, 82, 798–805.
Hart, G. D. (2001).
Descriptions of blood and blood disorders before the advent of laboratory
studies. British Journal of Haematology, 115(4), 719–728.
Harvey, W. (1959). De motu
cordis. The American Journal of the Medical Sciences, 237(4),
543.
Hay, E. D. (2013). Cell
biology of extracellular matrix. Springer Science & Business Media.
Hensch, T. K. (2005). Critical
period mechanisms in developing visual cortex. Current Topics in
Developmental Biology, 69, 215–237.
Huleihel, L., Hussey, G. S.,
Naranjo, J. D., Zhang, L., Dziki, J. L., Turner, N. J., … Badylak, S. F.
(2016). Matrix-bound nanovesicles within ECM bioscaffolds. Science Advances,
2(6), e1600502.
Iozzo, R. V. (1998). Matrix
proteoglycans: from molecular design to cellular function. Annual Review of
Biochemistry, 67(1), 609–652.
Ito, J., Parsons, H. T., &
Heazlewood, J. L. (2014). The Arabidopsis cytosolic proteome: the metabolic
heart of the cell.
Izaguirre-Ávila, R., & de Micheli, A. (2005).
Evolución del conocimiento sobre la sangre y su movimiento: Parte II. El saber
sobre su composición. Iatroquímica de la sangre. Revista de Investigación
Clínica, 57(1), 85–97.
Izaguirre, A. R., & de Micheli, A. (2001). History
of blood transfusion. Revista de Investigacion Clinica; Organo Del Hospital
de Enfermedades de La Nutricion, 54(6), 552–558.
Jaenicke, E., Pairet, B.,
Hartmann, H., & Decker, H. (2012). Crystallization and preliminary analysis
of crystals of the 24-meric hemocyanin of the emperor scorpion (Pandinus
imperator). PloS One, 7(3), e32548.
Jaffe, L. F. (1993). Classes
and mechanisms of calcium waves. Cell Calcium, 14(10), 736–745.
Jaulin, P., & Lefrère, J.
J. (2010). First French transfusions (1667-1668). Transfusion Clinique et
Biologique: Journal de La Societe Francaise de Transfusion Sanguine, 17(4),
205–217.
Kampen, K. R. (2012). The
discovery and early understanding of leukemia. Leukemia Research, 36(1),
6–13.
Kardong, K. V. (2011). Vertebrates,
comparative anatomy, function, evolution (6th ed.). McGraw-Hill New York.
Kardong, K. V. (2014). Vertebrates:
Comparative Anatomy, Function, Evolution (7th ed.). McGraw-Hill Education.
Karp, G. C. (2013). Cell
and Molecular Biology, Concepts and Experiments (7th ed.). USA: Wiley
Online Library.
Khan, I. A., Daya, S. K.,
& Gowda, R. M. (2005). Evolution of the theory of circulation. International
Journal of Cardiology, 98(3), 519–521.
Kholodenko, B. N. (2003).
Four-dimensional organization of protein kinase signaling cascades: the roles
of diffusion, endocytosis and molecular motors. Journal of Experimental
Biology, 206(12), 2073–2082.
Kostakioti, M.,
Hadjifrangiskou, M., & Hultgren, S. J. (2013). Bacterial biofilms:
development, dispersal, and therapeutic strategies in the dawn of the
postantibiotic era. Cold Spring Harbor Perspectives in Medicine, 3(4),
a010306.
Kumar, V., Abbas, A. K.,
Fausto, N., & Aster, J. C. (2014). Robbins and Cotran pathologic basis
of disease. Elsevier Health Sciences.
Landau, M., & Fagien, S.
(2015). Science of hyaluronic acid beyond filling: Fibroblasts and their
response to the extracellular matrix. Plastic and Reconstructive Surgery,
136(5S), 188S-195S.
Latzer, Y., Witztum, E., &
Stein, D. (2008). Eating disorders and disordered eating in Israel: An updated
review. European Eating Disorders Review, 16(5), 361–374.
Learoyd, P. (2012). The
history of blood transfusion prior to the 20th century–part 2. Transfusion
Medicine, 22(6), 372–376.
Lee, C., Collins-Hall, J.,
Hendrick, D., & Brabetz, B. (2016). Hemocyanin; Don’t Get in the Way of
Blue Bloods.
Linzen, B. (2013). Invertebrate
oxygen carriers. Springer Science & Business Media.
Love, W. E., Klock, P. A.,
Lattman, E. E., Padlan, E. A., Ward, K. B., & Hendrickson, W. A. (1972).
The structures of lamprey and bloodworm hemoglobins in relation to their
evolution and function. In Cold Spring Harbor symposia on quantitative
biology (Vol. 36, pp. 349–357). Cold Spring Harbor Laboratory Press.
Luby-Phelps, K. (1999).
Cytoarchitecture and physical properties of cytoplasm: volume, viscosity,
diffusion, intracellular surface area. International Review of Cytology,
192, 189–221.
Luby-Phelps, K., Castle, P.
E., Taylor, D. L., & Lanni, F. (1987). Hindered diffusion of inert tracer
particles in the cytoplasm of mouse 3T3 cells. Proceedings of the National
Academy of Sciences, 84(14), 4910–4913.
MARKL, J. (1986). Evolution
and function of structurally diverse subunits in the respiratory protein
hemocyanin from arthropods. The Biological Bulletin, 171(1),
90–115.
Mauseth, J, D. (2012). Botany:
An Introduction to Plant Biology (5th ed.). Jones & Bartlett Learning.
Maxfield, F. R., & Mondal,
M. (2006). Sterol and lipid trafficking in mammalian cells. Portland Press
Limited.
McFadden, D. W., Riggs, D. R.,
Jackson, B. J., & Vona-Davis, L. (2003). Keyhole limpet hemocyanin, a novel
immune stimulant with promising anticancer activity in Barrett’s esophageal
adenocarcinoma. The American Journal of Surgery, 186(5), 552–555.
Michel, G., Tonon, T.,
Scornet, D., Cock, J. M., & Kloareg, B. (2010). The cell wall
polysaccharide metabolism of the brown alga Ectocarpus siliculosus. Insights
into the evolution of extracellular matrix polysaccharides in Eukaryotes. New
Phytologist, 188(1), 82–97.
Moore, P. (2003). Blood and
Justice: The 17 Century Parisian Doctor Who Made Blood Transfusion History.
John Wiley & Sons.
Moore, T. (2013). Novel
Approach for Assessment and Mitigation of Heat-Stress Adverse Effects. Auburn
University.
Mory, R. N., Mindell, D.,
& Bloom, D. A. (2000). The leech and the physician: biology, etymology, and
medical practice with Hirudinea medicinalis. World Journal of Surgery, 24(7),
878–883.
Murray, R. K., Bender, D. A.,
Botham, K. M., Kennelly, P. J., Rodwell, V., & Weil, A. (2012). Harpers
Illustrated Biochemistry (29th ed.). McGraw-Hill Medical.
Newquist, H. P. (2012). The
Book of Blood: From Legends and Leeches to Vampires and Veins. Houghton
Mifflin Harcourt.
Orell, A., Fröls, S., &
Albers, S.-V. (2013). Archaeal biofilms: the great unexplored. Annual Review
of Microbiology, 67, 337–354.
Orlov, S. N., & Hamet, P.
(2006). Intracellular monovalent ions as second messengers. The Journal of
Membrane Biology, 210(3), 161–172.
Orlova, E. V, Dube, P.,
Harris, J. R., Beckman, E., Zemlin, F., Markl, J., & van Heel, M. (1997).
Structure of keyhole limpet hemocyanin type 1 (KLH1) at 15 Å resolution by electron
cryomicroscopy and angular reconstitution. Journal of Molecular Biology,
271(3), 417–437.
Paliwal, S., Fagien, S., Sun,
X., Holt, T., Kim, T., Hee, C. K., … Messina, D. J. (2014). Skin extracellular
matrix stimulation following injection of a hyaluronic acid–based dermal filler
in a rat model. Plastic and Reconstructive Surgery, 134(6),
1224–1233.
Pearson, H. A. (2002). History
of pediatric hematology oncology. Pediatric Research, 52(6),
979–992.
Pelletier, H., & Kraut, J.
(1992). Crystal Structure of a Complex Between Electron Transfer. Science,
258, 1.
Pesce, A., Bolognesi, M.,
Bocedi, A., Ascenzi, P., Dewilde, S., Moens, L., … Burmester, T. (2002).
Neuroglobin and cytoglobin. EMBO Reports, 3(12), 1146–1151.
Pesce, A., Dewilde, S.,
Nardini, M., Moens, L., Ascenzi, P., Hankeln, T., … Bolognesi, M. (2003). Human
brain neuroglobin structure reveals a distinct mode of controlling oxygen
affinity. Structure, 11(9), 1087–1095.
Peters, R. (2006).
Introduction to nucleocytoplasmic transport: molecules and mechanisms. Xenopus
Protocols: Cell Biology and Signal Transduction, 235–258.
Pick, C., Scherbaum, S.,
Hegedüs, E., Meyer, A., Saur, M., Neumann, R., … Burmester, T. (2014).
Structure, diversity and evolution of myriapod hemocyanins. FEBS Journal,
281(7), 1818–1833.
Plopper, G. (2007). The
extracellular matrix and cell adhesion. Cells.
Prewitt, T. (1992). Unholy
Anorexia: Blood Myth and the Signs of the Flesh. Semiotics, 300–319.
Provance, D. W., McDowall, A.,
Marko, M., & Luby-Phelps, K. (1993). Cytoarchitecture of size-excluding
compartments in living cells. Journal of Cell Science, 106(2),
565–577.
Race, R. R., Sanger, R., &
Fisher, R. (1962). Blood groups in man (Vol. 142). Blackwell scientific
publications Oxford.
Ratner, V. A., Zharkikh, A.
A., Kolchanov, N., Rodin, S. N., Solovyov, V. V, & Antonov, A. S. (1996).
Theoretical Analysis of the Evolution of Genes and Proteins. In Molecular
Evolution (pp. 93–145). Springer.
Rhoades, R. A., & Bell, D.
R. (2013). Medical Physiology, Principles for Clinical Medicine (4th
ed.). Baltimore: Lippincott Williams & Wilkins.
Riggs, D. R., Jackson, B.,
Vona-Davis, L., & McFadden, D. (2002). In vitro anticancer effects of a
novel immunostimulant: keyhole limpet hemocyanin. Journal of Surgical
Research, 108(2), 279–284.
Rolleston, H. (1934). The
history of haematology. SAGE Publications.
Roos, A., & Boron, W. F.
(1981). Intracellular pH. Physiological Reviews, 61(2), 296–434.
Ross, M. H., & Pawlina, W.
(2011). Histology a text and atlas (6th ed.). Baltimore: Lippincott
Williams & Wilkins.
Ruoslahti, E. (1996). Brain
extracellular matrix. Glycobiology, 6(5), 489–492.
Scalettar, B. A., Abney, J.
R., & Hackenbrock, C. R. (1991). Dynamics, structure, and function are
coupled in the mitochondrial matrix. Proceedings of the National Academy of
Sciences, 88(18), 8057–8061.
Schultheiss, D., & Denil,
J. (2002). History of the microscope and development of microsurgery: a
revolution for reproductive tract surgery. Andrologia, 34(4),
234–241.
Silverthorn, D. U., Bruce, B.
R., Ober, W. C., Garrison, C. W., & Silverthorn, A. C. (2010). Human
physiology an integrative aproach (5th ed.). San Francisco: Pearson,
Benjamin Cummings.
Starr, D. (2012). Blood: an
epic history of medicine and commerce. Knopf.
Stenzl, A., Dolashki, A.,
Stevanovic, S., Voelter, W., Aicher, W., & Dolashka, P. (2016). Cytotoxic
Effects of Rapana venosa Hemocyanin on Bladder Cancer Permanent Cell Lines. Journal
of US-China Medical Science, 13, 179–188.
Stern, K. R., Bidlack, J. E.,
& Jansky, S. H. (2008). Introductory Plant Biology (11th ed.).
McGraw-Hill New York.
Storz, J. F., Opazo, J. C.,
& Hoffmann, F. G. (2011). Phylogenetic diversification of the globin gene
superfamily in chordates. IUBMB
Life, 63(5),
313–322.
Suárez, P. D., Rojas, D. V., & Miranda, R. P.
(2009). Análisis histórico–epistemológico de nomenclatura Química Inorgánica. TED: Tecné,
Episteme y Didaxis.
Sussich, F., Skopec, C.,
Brady, J., & Cesàro, A. (2001). Reversible dehydration of trehalose and anhydrobiosis:
from solution state to an exotic crystal? Carbohydrate Research, 334(3),
165–176.
Swartz, A. M., Batich, K. A.,
Fecci, P. E., & Sampson, J. H. (2015). Peptide vaccines for the treatment
of glioblastoma. Journal of Neuro-Oncology, 123(3), 433–440.
Tam, J. P. (1988). Synthetic
peptide vaccine design: synthesis and properties of a high-density multiple
antigenic peptide system. Proceedings of the National Academy of Sciences,
85(15), 5409–5413.
Tam, J. P., & Lu, Y.-A.
(1989). Vaccine engineering: enhancement of immunogenicity of synthetic peptide
vaccines related to hepatitis in chemically defined models consisting of T-and
B-cell epitopes. Proceedings of the National Academy of Sciences, 86(23),
9084–9088.
Tejero, J., & Gladwin, M.
T. (2014). The globin superfamily: functions in nitric oxide formation and
decay. Biological Chemistry, 395(6), 631–639.
Terwilliger, N. B. (2015).
Oxygen transport proteins in Crustacea: hemocyanin and hemoglobin. Physiology,
4, 359–390.
Thanbichler, M., Wang, S. C.,
& Shapiro, L. (2005). The bacterial nucleoid: a highly organized and
dynamic structure. Journal
of Cellular Biochemistry,
96(3), 506–521.
Ureta, T. (1985). Organización del metabolismo:
Localización subcelular de enzimas glicolíticas. Arch. Biol. Med. Exp, 18(9).
Vallone, B., Nienhaus, K.,
Brunori, M., & Nienhaus, G. U. (2004). The structure of murine neuroglobin:
novel pathways for ligand migration and binding. Proteins: Structure,
Function, and Bioinformatics, 56(1), 85–92.
Verkman, A. S. (2002). Solute
and macromolecule diffusion in cellular aqueous compartments. Trends in
Biochemical Sciences, 27(1), 27–33.
Voit, R., Feldmaier-Fuchs, G.,
Schweikardt, T., Decker, H., & Burmester, T. (2000). Complete Sequence of
the 24-mer Hemocyanin of the TarantulaEurypelma californicum STRUCTURE AND
INTRAMOLECULAR EVOLUTION OF THE SUBUNITS. Journal of Biological Chemistry,
275(50), 39339–39344.
Wajcman, H., Kiger, L., &
Marden, M. C. (2009). Structure and function evolution in the superfamily of
globins. Comptes Rendus Biologies, 332(2), 273–282.
Wang, Y., Meng, H., Yuan, X.,
Peng, J., Guo, Q., Lu, S., & Wang, A. (2014). Fabrication and in vitro
evaluation of an articular cartilage extracellular matrix-hydroxyapatite
bilayered scaffold with low permeability for interface tissue engineering. Biomedical
Engineering Online, 13(1), 80.
Wayne, R. (2009). Plant
Cell Biology (1st ed.). San
Diego: Elsevier.
Weisiger, R. A. (2002). Cytosolic fatty acid binding
proteins catalyze two distinct steps in intracellular transport of their
ligands. In Cellular Lipid Binding Proteins (pp. 35–43). Springer.
Weiss, J. N., & Korge, P.
(2001). The Cytoplasm No Longer a Well-Mixed Bag. Circulation Research, 89,
108–110. Retrieved from
http://circres.ahajournals.org/content/89/2/108.full#R1-094537
Whitteridge, G., Pagel, W.,
& Keynes, G. (1972). William Harvey and the Circulation of the Blood.
Wiggins, P. M. (1990). Role of
water in some biological processes. Microbiological Reviews, 54(4),
432–449.
Wikipedia, S. (2013). Hemoproteins:
Arc System, Catalase, Chlorocruorin, Chromoprotein, Cytochrome B6f Complex.
University-Press Org.
Winey, M., Mamay, C. L.,
O’toole, E. T., Mastronarde, D. N., Giddings Jr, T. H., McDonald, K. L., &
McIntosh, J. R. (1995). Three-dimensional ultrastructural analysis of the
Saccharomyces cerevisiae mitotic spindle. Journal of Cell Biology, 129(6),
1601–1616.
Wittenberg, J. B., &
Wittenberg, B. A. (1990). Mechanisms of cytoplasmic hemoglobin and myoglobin
function. Annual Review of Biophysics and Biophysical Chemistry, 19(1),
217–241.
Yeates, T. O., Crowley, C. S.,
& Tanaka, S. (2010). Bacterial microcompartment organelles: protein shell
structure and evolution. Annual
Review of Biophysics, 39,
185–205.


































































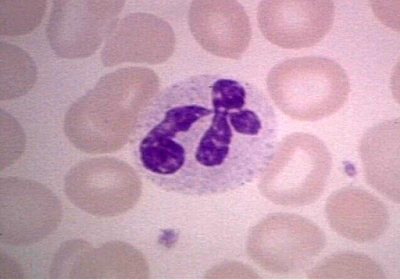














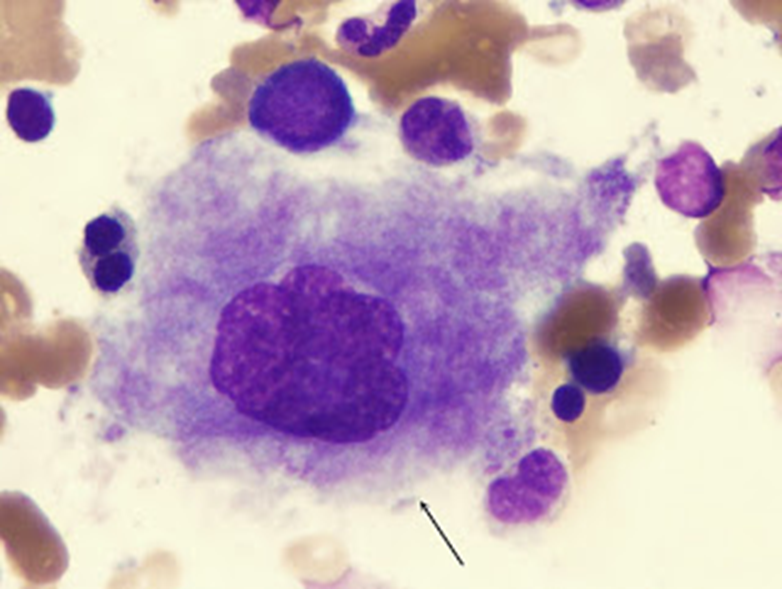









No hay comentarios:
Publicar un comentario