|Cursos
2022| |Química de
11| Periodo 1
(Lección 01)
(Lección 02)
(Lección 03)
(Lección 04)
(Lección 05)
(Tarea 01)
(Tarea 02)
(Tarea 03)
(Tarea 04)
(Tarea 05)
(Encuesta
nota extra) (Tarea 06)
(Tarea 07)
(Tarea 08)
(Ave 1)
(Ave 2)
Periodo 2 (Lección 06)
(Tareas del
periodo 2) (Ave3)
(Lección 07)
(Lección 08)
Periodo 3 (Tareas del
periodo 03) (Lección 09)
(Ave 04)
(abeja)
(Ave
05)
El análisis de combustión es un método utilizado tanto en química orgánica
como en química analítica para determinar la composición elemental (más
precisamente, la fórmula empírica) de un compuesto orgánico puro mediante la
combustión de la muestra en condiciones en las que los productos de combustión
resultantes pueden analizarse cuantitativamente. Una vez que se ha determinado
el número de moles de cada producto de combustión, se puede calcular la fórmula
empírica o una fórmula empírica parcial del compuesto original.
El procedimiento se basa en quemar un compuesto en presencia de oxígeno,
medir las masas de los productos generados, y emplear algoritmos
estequiométricos para calcular los subíndices de la fórmula empírica.
Técnica algorítmica
Calcular la masa del elemento como si fuera monoatómico.
Masa del producto de combustión → convertir a moles → relacionar moles de
producto con moles del elemento asumido como monoatómico → (Anotar este
resultado) → convertir a gramos del elemento asumido como monoatómico → (Anotar
este resultado).
Realizar lo anterior para todos los elementos donde tengamos un dato. Si no
tenemos dato para un elemento (normalmente es oxígeno), este se deja de último
y su masa se calcula como una resta asumiendo la ley de la conservación de la
masa y convertir a moles del elemento como si fuera monoatómico.
El agua normalmente es reservorio del hidrógeno, pero el oxígeno debe
calcularse por eluy de la conservación de la masa.
Hacer una lista con los resultados en moles y dividir entre el valor más
pequeño, los resultados se expresan a sin decimales asumiendo que son muy
cercanos a un entero, estos se asumen como los subíndices de una fórmula
empírica.
Suponga que en un experimento la combustión de 11.5 g de
etanol produjo 22.0 g de CO2 y 13.5 g de H2O. Podemos
calcular la masa de carbono e hidrógeno en la muestra original de 11.5 g de
etanol como sigue:
Técnica algebraica
Fórmula 1, Nota, siempre y cuando las masas dadas tengan las mismas
unidades, los valores pueden reemplazarse sin unidades.
si(I,r) = Subíndice de la
fórmula empírica de un elemento I cualquiera en el reactivo.
si(I,p) = Subíndice de la
fórmula molecular de un elemento I cualquiera en el producto (enunciado) para
el hidrógeno en H2O es 2, para el carbono en CO2 es 1,
para el hidrógeno en NH3 es 3.
m(p) = masa del producto
(enunciado).
m(r) = masa del reactivo
problema (enunciado).
M(p) = masa molar del
producto (con pesos de la tabla periódica).
M(r) = masa molar del
reactivo problema (si no aparece en el enunciado, asuma 100 g/mol).
Fórmula 2, ley de la conservación de la masa para el oxígeno o elemento del
cual no nos dan un producto. Nota, esta ecuación puede reemplazarse sin
unidades ya que las unidades de masa molar se cancelan analíticamente.
M(O) = masa molar del elemento cuyo producto del cual no
tenemos datos, normalmente es el oxígeno ya que se distribuye en muchos
productos, asuma 16.00 g/mol.
En caso de que algún subíndice o todos sean decimales muy lejanos de un
entero, se hace una lista de los subíndices calculados, y se dividen todos
entre el subíndice más pequeño.
Suponga que en un experimento la combustión de 11.5 g de
etanol produjo 22.0 g de CO2 y 13.5 g de H2O. Podemos
calcular la masa de carbono e hidrógeno en la muestra original de 11.5 g de
etanol como sigue:
El enunciado NO ofrece la masa molar del reactivo, por lo que se asume una hipótesis
de 100 g/mol.
Calculamos el subíndice el hidrógeno en el reactivo, tenga en cuenta que el
valor de si(I,p) en el H2O es 2, porque el subíndice del hidrógeno es 2.
Ejemplo.
El ácido valproico, que se usa para tratar las convulsiones
y el trastorno bipolar, está compuesto de C, H y O. Se quema una muestra de
0.165 g. La ganancia de masa del absorbente de H2O es de 0.166 g, mientras que
la del absorbente de CO2 es de 0.403 g. ¿Cuál es la fórmula empírica
del ácido valproico? Si la masa molar es 144 g/mol, ¿cuál es la fórmula
molecular?
Factores de conversión
La fórmula empírica es C4H8O. La masa molar de la
fórmula empírica es 72.104 g/mol. Si comparamos con la masa molar real 144 g/mol
nos damos cuenta de que necesitamos el doble de átomos para obtener la fórmula
molecular C8H16O2.
Algebraico
En este caso el enunciado ya nos da la masa molar del reactivo M(r) = 144
g/mol, por lo que solo aplicamos la fórmula 1 y luego la 3.
El subíndice de C en CO2 es 1, y el subíndice de H en H2O es 2.
Como usamos la masa molar, lo que obtuvimos fue la fórmula molecular C8H16O2, la cual convertimos a fórmula empírica al dividir todos los subíndices entre el factor común que es C6H8O.
¿Cuáles son las leyes de la química necesarias parea realizar la demostración matemática?
¿Qué conceptos secundarios se deben tener en cuenta al invocar las leyes de la química en esta demostración?
¿Qué operaciones matemáticas y/o propiedades de las operaciones básicas fueron aplicadas en esta demostración?
Normalmente los procesos de enseñanza de la historia y la filosofía de la química se interpretan como en oposición o perdida de tiempo con respecto al entrenamiento para resolver situaciones numéricas, ¿Cómo relaciona el proceso de demostración estas dos áreas de la enseñanza de la química?
El método científico nos enseña a pensar por nosotros mismos, y cuestionar lo que han dicho nuestros predecesores de manera argumentada y ofreciendo una alternativa mas completa, ¿Qué relación tiene este ideal con el hecho de que mientras los algoritmos de factor de conversión dados en los libros de texto no ofrecen demostración a su existencia, las ecuaciones algebraicas si ofrecen una explicación de su procedencia?
Se quemaron 12.915 g de una sustancia bioquímica que contiene solo carbono, hidrógeno y oxígeno en una atmósfera con exceso de oxígeno. El análisis posterior del resultado gaseoso arrojó 18.942 g de dióxido de carbono y 7.749 g de agua. Determine la fórmula molecular de la sustancia asumiendo que su masa molar verdadera es de 180.16 g/mol.
Se quemaron 3.450 g de omeprazol produciéndose 1.709 g de H2O (18.02 g/mol), 7.473 g de CO2 (44.01 g/mol), 1.858 g de NO3 (62.00 g/mol), y 0.800 g de SO3 (80.06 g/mol). En un experimento independiente se determinó que la masa molar del omeprazol es de 345.4 g/mol. Calcule la fórmula molecular. Asuma que el compuesto contiene C H N S y O.
Se quemaron 1.500 g de aspirina “ácido acetilsalicílico” produciéndose
3.300 g de CO2 y 0.600 g de agua. Asumiendo que la aspirina contiene carbono,
hidrógeno y oxígeno y que su masa molar es 180.16 g/mol calcular la fórmula
molecular.
Se quemaron 2.000 g de testosterona produciéndose 5.798 g de CO2 y 1.749
g de agua. Asumiendo que la testosterona contiene carbono, hidrógeno y oxígeno
y que su masa molar es 288.42 g/mol calcular la fórmula molecular de la
testosterona.






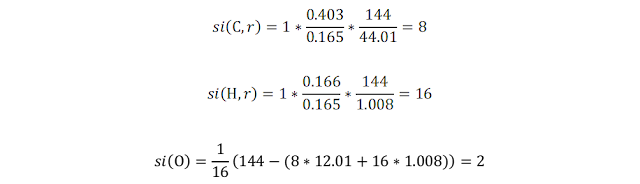
No hay comentarios:
Publicar un comentario