Este fenómeno, también denominado depresión del volumen
de un solvente puro o aumento en el volumen de un solvente impuro,
se alinea más directamente con los nombres de otras propiedades coligativas y
describe de forma más precisa su funcionamiento mecánico. En los modelos, en
lugar de presiones, observamos cambios de volumen. Se refiere a la
tendencia de flujo de agua (o solvente) a través de una membrana
semipermeable que permite el paso del solvente, pero no del soluto, hacia
el lado con mayor cantidad de impurezas. Al igual que sucede con el cambio en
la temperatura crítica, las impurezas son indiferentes a la identidad del
soluto o incluso a su tamaño; todas cuentan por igual, ya que se comportan como
entidades ideales en este contexto.
Figura
1. La presión osmótica en un tubo en U se define por la diferencia de
alturas causada por concentraciones iniciales de soluto. El flujo de
solvente va al lado de mayor concentración. Modelamos esto con fuerzas
opuestas, donde el lado con más soluto ejerce una presión osmótica neta
positiva, atrayendo agua hasta el equilibrio.
La noción de presión osmótica surge debido a que este
cambio de volumen puede generar una diferencia de alturas en un manómetro de
doble salida abierta, donde normalmente se esperaría una alineación de los
niveles de líquido. Esta diferencia indica un cambio en la presión interna
que altera el equilibrio hidrostático. El lado con más impurezas, al absorber
líquido, aumenta su presión interna, elevándose en contra de la presión de la
atmósfera hasta alcanzar el equilibrio. Así, la presión osmótica es la presión
que se debe aplicar para evitar el flujo neto de solvente a través de la
membrana semipermeable, lo que demuestra la resistencia de la disolución impura
a diluirse más allá de cierto punto.
El tono y las células
En una mezcla
isotónica, las concentraciones de soluto en ambos lados de la membrana son
iguales, y no hay flujo neto de solvente entre las dos soluciones, ya que las
concentraciones de soluto son las mismas. Esto es lo que ocurre, por ejemplo,
en los fluidos corporales, como la solución salina fisiológica, que
tiene la misma concentración de soluto que el plasma sanguíneo, por lo que no
provoca movimiento de agua hacia dentro o fuera de las células.
Por otro lado, la ósmosis
inversa es el proceso en el que el flujo de solvente ocurre en dirección
contraria, desde la región más concentrada (hipertónica) hacia la menos
concentrada (hipotónica), pero solo cuando se aplica una presión externa mayor
a la presión osmótica. Este proceso es utilizado en sistemas de filtración
de agua, como en el purificador de agua doméstico, donde se obliga al agua
a pasar a través de una membrana semipermeable, eliminando impurezas y
contaminantes. Por ejemplo, si se aplica presión a un lado de un sistema de
ósmosis inversa, el agua pasará a través de la membrana dejando atrás las
impurezas que no pueden atravesarla.
Cuando se tiene una
mezcla hipertónica, el punto analizado (el interior de una célula, por
ejemplo) está más concentrado en soluto que el punto externo. En este caso, el
agua del entorno fluye hacia el interior de la célula para equilibrar las
concentraciones, lo que provoca que la célula se hinche y aumente su
volumen. Este proceso puede ser dañino si el volumen celular se incrementa
demasiado, lo que puede llevar a la ruptura celular. Un ejemplo claro de
esto es el caso de la deshidratación celular cuando una célula se
encuentra en un medio hipertónico, como una disolución salina muy concentrada.
Figura 2. Las células mantienen su volumen en soluciones isotónicas.
En hipotónicas, el agua entra y pueden estallar; en hipertónicas,
sale y se arrugan. Han desarrollado mecanismos como paredes celulares,
osmorregulación activa o vacuolas contráctiles para resistir estas tensiones
tónicas. Células especializadas en ambientes extremos acumulan solutos
compatibles para sobrevivir.
En una mezcla
hipotónica, el punto analizado está menos concentrado que el punto externo,
lo que provoca que el agua fluya desde el exterior de la célula hacia su
interior. Este flujo de agua puede hacer que la célula aumente de volumen
hasta el punto de romperse, en un proceso conocido como lisis celular.
Un ejemplo de esto sería una célula animal colocada en agua pura (hipotónica),
donde el agua ingresará a la célula debido a la diferencia de concentración y
presión, lo que podría resultar en la ruptura de la célula si no se regula
adecuadamente.
Escenarios comparativos
Como con todas las propiedades
coligativas, los escenarios comparativos no se resuelven utilizando su
fórmula específica, sino a través del teorema de cantidad de sustancia
efectiva. Esto se debe a que es la cantidad de sustancia efectiva
—ya sea expresada en moles (Forma 1) o en gramos (Forma 2)— la que realmente impulsa y modifica estas
propiedades. Esta cantidad representa la suma real de todas las entidades
(partículas) presentes en el equilibrio de la disolución.
Oposición de fuerzas
Normalmente,
modelamos la presión osmótica en un tubo en U, lo que nos genera
un escenario de oposición de fuerzas semejante al de una máquina de
Atwood con una polea. Es decir, tendremos dos fuerzas opuestas. Esto se
debe a que a ambos lados de la membrana semipermeable podemos tener
solvente con soluto, por ende, dos presiones osmóticas en oposición que
generarán una presión osmótica neta.
Figura 3. La presión osmótica neta es la
diferencia entre la presión osmótica interna (positiva, lado concentrado, sin
marcar) y la externa. Esta dirección es crucial para marcos de
referencia. La ósmosis inversa implica una presión mecánica externa que,
aunque conceptualmente opuesta (negativa, reversa), tiene un valor absoluto
igual a la presión osmótica directa, permitiendo la purificación.
Este escenario de
oposición no se observa en otras situaciones semejantes, como la depresión
de la presión de vapor. En el caso de la presión de vapor, el solvente en
la fase gaseosa actúa como si siempre fuera puro por definición, simplificando
el análisis a una única presión de vapor ejercida por la disolución. Sin
embargo, en la ósmosis, esta suposición de pureza en uno de los lados bien
puede no ser cierta. La presencia de solutos en ambos compartimentos del
tubo en U crea una competencia por el flujo de solvente, resultando en una diferencia
de presiones osmóticas que impulsa el movimiento neto hasta alcanzar el
equilibrio.
Simplificación estándar
A pesar de la
complejidad que la presencia de solutos en ambos compartimentos introduce, en
la mayoría de los ejercicios de lápiz y papel, se ejecuta una simplificación
estándar: asumiremos que uno de los lados, usualmente el externo o
izquierdo, está puro. Esta convención, aunque arbitraria en cuanto a qué
lado es "puro" (podría ser el derecho o izquierdo, da igual),
simplifica drásticamente el cálculo. El punto clave es que siempre tendremos un
lado puro y otro impuro.
El lado impuro
siempre será nuestro marco de referencia positivo. Esto significa que,
al calcular la presión osmótica, siempre esperaremos y buscaremos valores
positivos. Esto se debe a que el flujo neto de solvente ocurrirá siempre hacia
el lado con mayor concentración de soluto (el lado impuro), generando una presión
que se considera positiva en este contexto. Por ende, siempre calcularemos
presiones osmóticas positivas, a menos que el enunciado del problema presente
variantes complejas que explícitamente sugieran una situación de equilibrio o
flujos netos en la dirección opuesta, lo cual es raro en ejercicios
introductorios. Esta simplificación permite a los estudiantes centrarse en el
concepto fundamental de la ósmosis sin sobrecargar los cálculos iniciales.
En la mayoría de
los casos donde se incluye la ósmosis inversa, esta siempre está
ajustada para recuperar los niveles y concentraciones originales de la
disolución pura o deseada. Por esta razón, su valor absoluto es igual al de
la presión osmótica directa. Esto significa que, aunque conceptualmente la
ósmosis inversa se opone al flujo osmótico natural (requiriendo una presión
externa para forzar el solvente hacia el lado de menor concentración), en la
práctica podremos resolverla utilizando la misma magnitud que la presión
osmótica interna del lado de referencia positivo. Es decir, calculamos la
presión osmótica como si fuera el proceso directo, y simplemente interpretamos
ese valor como la presión que necesitamos aplicar (o que se opone al flujo)
para revertir la ósmosis, aunque su sentido físico sea opuesto
Dirección del flujo osmótico a R y
T constantes
En condiciones
constantes de temperatura (T) y considerando la constante universal de
los gases (R), como ocurre en la interfaz de una membrana semipermeable, la
dirección del flujo osmótico está determinada exclusivamente por la diferencia
de concentración efectiva neta entre ambos lados. Específicamente, el lado
con la mayor cantidad de partículas de soluto total (o mayor
concentración efectiva) es el que genera una presión osmótica a su favor,
atrayendo el solvente y, por ende, impulsando el flujo osmótico hacia sí mismo.
Esto significa que para determinar la dirección del flujo, solo es necesario calcular
y comparar las concentraciones efectivas netas de cada lado. Ni siquiera
necesitas realizar una resta explícita; la mera inspección de cuál lado
posee la mayor concentración efectiva ya te indicará la dirección del flujo.
Concentración molar efectiva
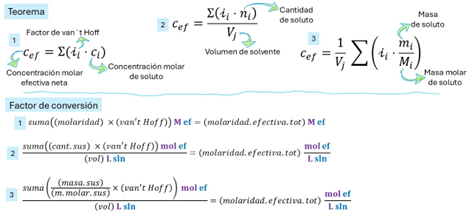
Figura 4. La molaridad efectiva total para la presión osmótica se calcula de tres formas: sumando concentraciones parciales por factor de Van't Hoff (i); sumando moles parciales por i y dividiendo por volumen; o sumando masas parciales convertidas a moles efectivos y dividiendo por volumen. Estos teoremas resaltan que las propiedades coligativas solo dependen de la cantidad total de partículas, no de su identidad. Demostración.
Teorema base
Figura 5. La presión osmótica se calcula con
la molaridad efectiva total, que suma las contribuciones de solutos
ionizables o no ionizables. Este teorema, aunque poco popular, demuestra la
indiferencia de las propiedades coligativas a la identidad química del
soluto, importando únicamente su cantidad total de partículas para
generar la presión osmótica neta. Demostración.
Figura 6. La presión osmótica se simplifica a menudo con un teorema para un único soluto en un lado positivo de una membrana. El subíndice en (i) denota la presión generada por ese soluto. Esta forma clásica, aunque una idealización, es pedagógicamente útil para entender cómo la cantidad de un soluto (y su factor de Van't Hoff) genera presión osmótica, sentando bases para casos más complejos. Demostración.
Figura 7. El teorema de la presión osmótica se calcula desde la masa del soluto y el volumen de la disolución. Esto es práctico para sustancias pesadas como hidróxidos y sales solubles. La fórmula relaciona la presión osmótica con la masa del soluto, su masa molar, el volumen, la temperatura y el factor de Van't Hoff, permitiendo un cálculo directo de la presión generada por esa sustancia única. Demostración.
Referencias
Baeza Baeza, J. J., & García Álvarez-Coque, M. C.
(2014). Extent of reaction
balances. A convenient tool to study chemical equilibria.
Brown, T.
L., LeMay, H. E. Jr., Bursten, B. E., Murphy, C. J., & Woodward, P. M.
(2022). Chemistry: The Central Science (15th ed., AP Edition). Pearson
Savvas Higher Education.
Chang, R.,
& Overby, J. (2022). Chemistry (14th ed., AP Edition). McGraw Hill.
da Silva,
D. J. (2017). The basis of the limiting reagent concept, its identification and
applications. World Journal of Chemical Education, 5(1),
1-8.
DeToma, R.
P. (1994). Symbolic algebra and stoichiometry. Journal of chemical
education, 71(7), 568.
García
García, J. L. (2020). El álgebra de la estequiometría. Educación
química, 31(1), 138-150.
García García, J. L. (2021). Deduciendo las relaciones entre
las unidades de concentración en disoluciones líquidas. Educación
química, 32(3), 38-51.
García García, J. L. (2021b). Hacia un equilibrio químico
verdaderamente analítico. Educación química, 32(1), 133-146.
García, J.
L. G. (2025). Dimensional Analysis in Chemistry Textbooks 1900-2020 and an
Algebraic Alternative. Educación Química, 36(1),
82-108.
Garst, J.
F. (1974). The extent of reaction as a unifying basis for stoichiometry in
elementary chemistry. Journal of Chemical Education, 51(3),
194.
IUPAC.
(2019). Compendium of chemical terminology (2nd ed.). IUPAC.
https://doi.org/10.1351/goldbook
Moretti, G.
(2015). The “extent of reaction”: a powerful concept to study chemical
transformations at the first-year general chemistry courses. Foundations
of Chemistry, 17(2), 107-115.
Mousavi, A.
(2019). Stoichiometry of equations through the Inverse de Donder
relation. Chemistry Teacher International, 1(1),
20180006.
Schmitz, G.
(2005). What is a reaction rate?. Journal of chemical education, 82(7),
1091.
Smith, W.
R., & Missen, R. W. (1979). What is chemical stoichiometry?. Chemical
Engineering Education, 13(1), 26-32.
SOLAZ, J. J., & Quilez, J. (2001). Changes of extent of reaction in open chemical equilibria. Chemistry
Education Research and Practice, 2(3), 303-312.
Timberlake,
K. C. (2024). An Introduction to General, Organic, and Biological Chemistry
(14th ed.). Pearson.
Vandezande, J. E., Vander Griend, D. A., & DeKock, R. L.
(2013). Reaction extrema:
Extent of reaction in general chemistry. Journal of Chemical Education, 90(9),
1177-1179.
Zumdahl, S. S., & Zumdahl, S. A. (2018). Chemistry (10th ed.). Cengage Learning.







No hay comentarios:
Publicar un comentario