La estequiometría de gases es la parte de la
estequiometría química que estudia las relaciones cuantitativas entre
sustancias en una reacción química cuando al menos uno de los componentes
del cálculo —ya sea un dato o una incógnita— corresponde a un gas.
Este tipo de análisis permite determinar cantidades como el volumen, la masa o
el número de moles de un gas involucrado en una reacción, a partir de
relaciones molares y leyes físicas que rigen el comportamiento gaseoso.
Existen tres enfoques principales para abordar la
estequiometría de gases, dependiendo de las condiciones en las que se encuentra
el gas:
- Estequiometría
en condiciones estándar de un gas ideal: Se basa en el supuesto de que
el gas se comporta idealmente y se encuentra a condiciones estándar de
presión y temperatura (0 °C o 273,15 K
y 1 atm). En este caso, se usa el volumen molar estándar
de un gas ideal: 1 mol = 22.41 L. Esta aproximación permite
simplificar los cálculos, ya que la proporción molar entre gases se puede
interpretar directamente como proporción de volúmenes.
- Estequiometría
en condiciones no estándar de un gas ideal: Aquí también se asume que
el gas se comporta idealmente, pero se encuentra a condiciones
distintas a las estándar. En este caso, se utiliza la ecuación del
gas ideal: PV = nRT, donde P es la presión, V el
volumen, n el número de moles, R la constante de los gases
ideales, y T la temperatura en kelvin. Este enfoque es más general
y permite calcular la cantidad de sustancia o volumen bajo cualquier
condición.
- Estequiometría
de gases reales: Considera las desviaciones del comportamiento ideal
que presentan los gases en condiciones extremas (altas presiones o bajas
temperaturas). Se utilizan ecuaciones más complejas como la ecuación de
van der Waals. Sin embargo, omitiremos en esta discusión el caso de los
gases reales, ya que nuestro enfoque estará centrado únicamente en gases
ideales, tanto en condiciones estándar como en condiciones variables.
Así, el estudio de la estequiometría de gases en este
contexto se limita a analizar cómo los gases ideales se relacionan con otras
sustancias en una reacción química, aprovechando las leyes de los gases y las
proporciones molares para resolver problemas cuantitativos con precisión.
Cantidad de reacción y gas en exceso
Observa que, para este punto, ya hemos definido la cantidad
de sustancia de múltiples formas: a partir de la masa (moles = masa /
masa molar), de la concentración molar (moles = M·V), del volumen
molar en condiciones normales (CN) y de la ley de los gases ideales en
condiciones generales. Todas estas expresiones pueden integrarse en el teorema
mol a mol, permitiendo convertir una cantidad química en otra según
convenga.
Figura
1. Cantidad de reacción en condiciones normales. Demostración.
Figura
2. Cantidad de reacción para cualquier condición. Demostración.
Sin embargo, esta versatilidad tiene un costo: nos
enfrentamos a una proliferación de rutas, fórmulas y teoremas posibles.
A este fenómeno lo llamamos el problema de la proliferación estequiométrica.
Lo mismo ocurre con los factores de conversión: surgen tantos caminos
posibles para resolver un mismo problema que el sistema se vuelve una red
intrincada. Aunque todos los caminos convergen en el ratio estequiométrico
—la relación entre moles en la ecuación balanceada—, el exceso de opciones
puede confundir al estudiante y fragmentar el aprendizaje.
Figura
3. Volumen remanente del gas reactante en exceso. Demostración.
Figura
4. Volumen remanente del gas reactante en exceso en cualquier condición. Demostración
Figura
5. Presión remanente del gas reactante en exceso en cualquier condición. Demostración
Por esta razón, proponemos una estrategia más simple y
unificadora: calcular siempre la cantidad de reacción, es decir, los
moles de la propia reacción “la cantidad de veces que ocurre la reacción en
moles”, y desde ahí usar únicamente las expresiones específicas según el tipo
de dato. En el caso de los gases, esto nos deja solo dos expresiones clave,
ambas basadas en la ley de los gases ideales:
Estas dos ecuaciones son suficientes y pueden despejarse
según sea necesario. Así, reducimos la complejidad del sistema sin perder
capacidad de análisis.
Estequiometría de masas y gases
Plantearemos la estequiometría gas-masa
exclusivamente porque resulta especialmente relevante en el contexto de un
diseño experimental clásico: el desplazamiento de gases. Este
procedimiento permite medir indirectamente la cantidad de sustancia generada o
consumida en una reacción química mediante el volumen de gas desplazado, lo que
lo convierte en una técnica fundamental en laboratorios educativos y
profesionales.
Figura
6. Estequiometría gas a masa. Demostración.
Figura
7. Estequiometría gas a masa. Demostración.
Además, esta ruta es la más comúnmente utilizada en los libros
de texto al abordar ejercicios de estequiometría de gases, ya que
conecta de forma clara y directa conceptos como masa, moles y volumen
gaseoso, facilitando así el aprendizaje y la resolución de problemas
prácticos. Su uso sistemático responde tanto a su utilidad experimental como a
su valor pedagógico.
Desplazamiento de gases
El experimento de desplazamiento de gases es un
diseño experimental clásico en química que permite recolectar un gas producido
durante una reacción mediante su desplazamiento de un líquido, generalmente
agua. Este gas se acumula en un recipiente invertido, como una probeta o
bureta, sumergido en agua. El volumen desplazado proporciona una medida
indirecta de la cantidad de gas generado.
La diferencia clave entre este experimento y un ejercicio
típico de estequiometría masa-gas radica en la naturaleza del gas
recolectado. En los problemas teóricos, se asume que el gas es puro y
corresponde únicamente al producto gaseoso de la reacción. Sin embargo,
en el experimento real, la burbuja de gas recogida no está compuesta
exclusivamente por el gas de interés, sino que también contiene vapor de
agua, debido a la evaporación del líquido desplazado. Esta contribución del
vapor de agua se manifiesta como una presión parcial adicional, conocida
como la presión de vapor del agua.
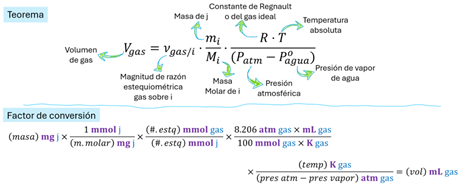
Figura
8. Estequiometría de desplazamiento de gases para la masa. Demostración.
Figura
9. Estequiometría de desplazamiento de gases para la burbuja. Demostración.
Por esta razón, el gas recolectado en este experimento
representa una mezcla de gases, lo que exige aplicar tanto el principio
de Dalton de presiones parciales como las ecuaciones del gas ideal
para aislar la cantidad real del gas deseado. Así, el análisis experimental del
desplazamiento de gases se convierte en una intersección entre la
estequiometría, la física de gases y las propiedades del agua, exigiendo
una mayor atención a las condiciones del sistema, como la temperatura y la
presión ambiental.
Figura
10. Diseño experimental del desplazamiento de gases.
Referencias
Baeza Baeza, J. J., & García Álvarez-Coque, M. C.
(2014). Extent of reaction
balances. A convenient tool to study chemical equilibria.
da Silva,
D. J. (2017). The basis of the limiting reagent concept, its identification and
applications. World Journal of Chemical Education, 5(1),
1-8.
García García, J. L. (2020). El álgebra de la
estequiometría. Educación química, 31(1), 138-150.
García García, J. L. (2021). Deduciendo las relaciones entre
las unidades de concentración en disoluciones líquidas. Educación
química, 32(3), 38-51.
García García, J. L. (2021b). Hacia un equilibrio químico
verdaderamente analítico. Educación química, 32(1), 133-146.
Garst, J.
F. (1974). The extent of reaction as a unifying basis for stoichiometry in
elementary chemistry. Journal of Chemical Education, 51(3),
194.
IUPAC.
(2019). Compendium of chemical terminology (2nd ed.). IUPAC.
https://doi.org/10.1351/goldbook
Moretti, G.
(2015). The “extent of reaction”: a powerful concept to study chemical
transformations at the first-year general chemistry courses. Foundations
of Chemistry, 17(2), 107-115.
Mousavi, A.
(2019). Stoichiometry of equations through the Inverse de Donder
relation. Chemistry Teacher International, 1(1),
20180006.
Schmitz, G.
(2005). What is a reaction rate?. Journal of chemical education, 82(7),
1091.
Smith, W.
R., & Missen, R. W. (1979). What is chemical stoichiometry?. Chemical
Engineering Education, 13(1), 26-32.
SOLAZ, J. J., & Quilez, J. (2001). Changes of extent of reaction in open chemical
equilibria. Chemistry Education Research and Practice, 2(3),
303-312.
Vandezande, J. E., Vander Griend, D. A., & DeKock, R. L. (2013). Reaction extrema: Extent of reaction in general chemistry. Journal of Chemical Education, 90(9), 1177-1179.










No hay comentarios:
Publicar un comentario