La calorimetría es la rama de la termodinámica que se
encarga de la medición del calor transferido durante un proceso físico,
químico o biológico. Su objetivo principal es determinar los cambios de energía
que acompañan a estas transformaciones, cuantificando el calor absorbido o
liberado. Para ello, utiliza un instrumento especializado conocido como calorímetro,
diseñado para aislar el sistema y permitir una medición precisa de los
intercambios de calor.
La calorimetría a presión constante es un tipo
específico de calorimetría donde las mediciones se realizan manteniendo la presión
del sistema constante durante todo el proceso. Esto es particularmente
relevante porque en muchos procesos químicos y biológicos, las reacciones
ocurren a presión atmosférica constante. Las mediciones de calor bajo estas
condiciones se relacionan directamente con el cambio de entalpía (ΔH)
del sistema. Un ejemplo común de calorímetro a presión constante es el calorímetro
de taza de café, utilizado para reacciones en solución acuosa.
Figura 1. El calorímetro de taza de café mide cambios de temperatura en reacciones a presión constante, usando vasos de icopor, tapa de corcho, termómetro y agitador. Para resultados precisos, la tapa debe ajustarse bien. No se recomienda usar aluminio, ya que aumenta la conductividad térmica, lo que compromete el aislamiento y la exactitud del experimento.
En calorimetría, abordaremos dos escenarios principales: la calorimetría
de cuerpo inerte y la calorimetría de cuerpo reactivo. Cada uno de
estos tipos de calorimetría posee su propia serie de fórmulas y metodologías
específicas para cuantificar los intercambios de calor involucrados.
Calorimetría de cuerpo inerte
En la calorimetría de cuerpo inerte, interactúan dos
cuerpos o sustancias con temperaturas iniciales diferentes. Estos intercambian
calor hasta alcanzar una temperatura de equilibrio común. Dentro del
calorímetro, que actúa como un sistema aislado, se busca que este punto de
equilibrio sea independiente del entorno externo. Por ello, la capacidad
calorífica del propio calorímetro debe ser nula o significativamente
despreciable, lo que implica que el instrumento no absorbe ni emite calor
de forma apreciable.
La calorimetría para un cuerpo inerte se basa en el flujo
de calor entre dos sustancias: una de propiedades incógnita o variable,
y otra, generalmente agua, cuyas propiedades son conocidas. El
principio fundamental es que el cuerpo inerte NO reacciona químicamente
con el agua; su interacción se limita a un intercambio puramente físico de
calor.
Dado que el teorema general puede ser complejo de despejar
en casos triviales, propondremos fórmulas concretas. Estas se adaptarán
a dos situaciones principales: (a) donde sea sencillo despejar parámetros como
el calor específico, la masa o la diferencia de temperaturas
de la sustancia incógnita y (b) el cálculo de las temperaturas inicial o
final de la sustancia incógnita.
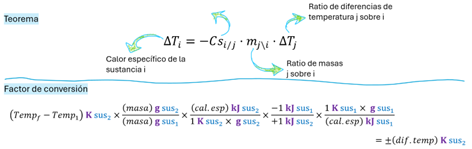
Figura
2. Calor específico de un cuerpo incógnita (i) típicamente un metal, usando
el calor específico de un solvente (j), típicamente agua, por factores
de conversión y teoremas algebraicos. Se expresa con ratios inversos de
masas y diferencias de temperatura (parámetros de j en el numerador, i en el
denominador).
Figura
3. Masa de un cuerpo incógnita (i), como un metal, se usa un solvente
conocido (j), usualmente agua. El cálculo se logra con factores de
conversión o teoremas algebraicos, empleando ratios inversos
de calores específicos y diferencias de temperatura (j en numerador, i en
denominador). Ambas herramientas facilitan la precisa caracterización térmica.
Figura 4. Diferencia de temperatura de la sustancia incógnita (i), como un metal, usando propiedades de i y un solvente (j). Permite, además, hallar trivialmente la temperatura inicial de i si se conoce la temperatura de equilibrio. Su versatilidad facilita diversas resoluciones en calorimetría.
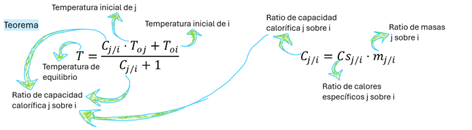
Figura
5. Calcular la temperatura de equilibrio en calorimetría inerte es
complejo. Su demostración, con factores comunes y repetición de cuatro
términos, es tediosa. Se simplifica usando una razón de calores
específicos. No se ofrece factor de conversión porque sumas/restas
dificultan el seguimiento dimensional, revelando una debilidad en este
método para leyes de conservación.
Con estos teoremas podremos resolver ejercicios de [calorimetría de cuerpo inerte a presión constante].
Calorimetría de cuerpo reactivo
Por otro lado, en la calorimetría de cuerpo reactivo,
se estudia una reacción química que libera o absorbe energía. A
medida que la reacción avanza, esta energía calórica provoca un cambio en la
temperatura del sistema. Normalmente, estas son reacciones sencillas en las
que un metal muy reactivo o alguna otra sustancia se expone a un solvente
reactante, como agua o algún ácido. A este respecto, es muy importante
saber elegir el material del calorímetro, ya que algunos materiales pueden
verse atacados por ciertos reactivos. Por lo tanto, es conveniente
seleccionar materiales inertes y resistentes a la corrosión o disolución
por parte de los reactivos empleados, como el vidrio de borosilicato o
plásticos específicos.
Por ejemplo, el ácido clorhídrico permite reacciones
rápidas y exotérmicas, pero su alta reactividad puede atacar y disolver
ciertos materiales del calorímetro, comprometiendo la integridad del
experimento y la precisión de las mediciones. Es por esto que la mayoría de las
experiencias con este fenómeno se realizan con calorímetros con recubrimientos
internos resistentes para reacciones en solución que generen calor,
asegurando que el calorímetro no participe en la reacción ni altere los
resultados.
Un problema adicional en este escenario surge al trabajar
con disoluciones molares, donde el parámetro de concentración molar
(denotado con 'c' "minúscula" según la IUPAC) puede coincidir visualmente con los símbolos
utilizados para la capacidad calorífica (C "mayúscula") y los calores específicos
(Cs). Esta similitud en la notación es una fuente potencial de confusión. Por
lo tanto, es imperativo que, al aplicar los teoremas pertinentes, se
preste una atención rigurosa al contexto de cada símbolo y a las unidades
asociadas para asegurar una correcta interpretación y evitar errores en los
cálculos.
Continuando, la mayoría de los ejercicios que hemos abordado
sobre este escenario versan precisamente sobre disoluciones reactivas en
agua. Por ello, vale la pena tener en cuenta las siguientes
consideraciones: normalmente, las temperaturas iniciales de las
disoluciones son las mismas, y el calor específico de las disoluciones
es semejante al del agua. Esto es una extensión de los presupuestos que vimos
en las propiedades coligativas concernientes a la disolución ideal.
Si bien la disolución ideal tiene impurezas que marcan su
identidad reactiva, para el calor específico, y para todas las
consideraciones significativas, asumiremos que este será igual al del agua,
sin importar si la disolución es ácida o básica. Por ende, a priori,
para los ejercicios de lápiz y papel, supondremos que el calor específico de
las disoluciones es el mismo que el del agua. Lo mismo sucede con las densidades,
a menos que el ejercicio las proporcione explícitamente. Esto nos permitiría
convertir de un plumazo los volúmenes en masas, utilizando la densidad del agua
de 1 g/mL o 1 kg/L.
Figura 6. El teorema del calorímetro de taza de café aplica a reacciones en disoluciones líquidas ideales, donde una es limitante y el agua actúa como solvente. Se iguala el calor absorbido por el solvente con la entalpía de reacción. Asumiendo densidades y calores específicos iguales, se puede calcular la entalpía estándar a partir de temperaturas y volúmenes medidos.
Con estos teoremas podremos resolver ejercicios sobre [calorimetría de cuerpo reactivo a presión constante].
Referencias
Baeza Baeza, J. J., & García Álvarez-Coque, M. C.
(2014). Extent of
reaction balances. A convenient tool to study chemical equilibria.
Brown, T.
L., LeMay, H. E. Jr., Bursten, B. E., Murphy, C. J., & Woodward, P. M.
(2022). Chemistry: The Central Science (15th ed., AP Edition).
Pearson Savvas Higher Education.
Chang, R.,
& Overby, J. (2022). Chemistry (14th ed., AP Edition).
McGraw Hill.
da Silva,
D. J. (2017). The basis of the limiting reagent concept, its identification and
applications. World Journal of Chemical Education, 5(1),
1-8.
DeToma, R.
P. (1994). Symbolic algebra and stoichiometry. Journal of chemical
education, 71(7), 568.
García
García, J. L. (2020). El álgebra de la estequiometría. Educación
química, 31(1), 138-150.
García García, J. L. (2021). Deduciendo las relaciones entre
las unidades de concentración en disoluciones líquidas. Educación
química, 32(3), 38-51.
García García, J. L. (2021b). Hacia un equilibrio químico
verdaderamente analítico. Educación química, 32(1), 133-146.
García, J.
L. G. (2025). Dimensional Analysis in Chemistry Textbooks 1900-2020 and an
Algebraic Alternative. Educación Química, 36(1),
82-108.
Garst, J.
F. (1974). The extent of reaction as a unifying basis for stoichiometry in
elementary chemistry. Journal of Chemical Education, 51(3),
194.
IUPAC.
(2019). Compendium of chemical terminology (2nd ed.). IUPAC.
https://doi.org/10.1351/goldbook
Moretti, G.
(2015). The “extent of reaction”: a powerful concept to study chemical
transformations at the first-year general chemistry courses. Foundations
of Chemistry, 17(2), 107-115.
Mousavi, A.
(2019). Stoichiometry of equations through the Inverse de Donder
relation. Chemistry Teacher International, 1(1),
20180006.
Schmitz, G.
(2005). What is a reaction rate?. Journal of chemical education, 82(7),
1091.
Seager, S.
L., Slabaugh, M. M., & Hansen, M. M. (2022). Chemistry for Today (10th
ed.). Cengage Learning.
Serway, R.
A., & Jewett, J. W. J. (2014). Physics for Scientists and Engineers with
Modern Physics, Ninth Edition (9th ed.). Boston: Brooks/Cole.
Smith, W.
R., & Missen, R. W. (1979). What is chemical stoichiometry?. Chemical
Engineering Education, 13(1), 26-32.
SOLAZ, J.
J., & Quilez, J. (2001). Changes of extent of reaction in open chemical
equilibria. Chemistry Education Research and Practice, 2(3),
303-312.
Timberlake,
K. C. (2024). An Introduction to General, Organic, and Biological
Chemistry (14th ed.). Pearson.
Tipler, P.
A., & Llewellyn, R. A. (2012). Modern Physics (6th ed.). New York: Freeman.
Vandezande,
J. E., Vander Griend, D. A., & DeKock, R. L. (2013). Reaction extrema:
Extent of reaction in general chemistry. Journal of Chemical Education, 90(9),
1177-1179.
Zumdahl, S. S., & Zumdahl, S. A. (2018). Chemistry (10th ed.). Cengage Learning.





No hay comentarios:
Publicar un comentario