[Regresar
a ejercicios de ley de Hess]
El acetileno (C₂H₂(g)) se usa para soldar porque el
oxiacetileno es el combustible gaseoso común que quema a mayor temperatura.
Usando entalpías estándar de formación, calcula la cantidad de calor producido
cuando 10 g de acetileno se queman completamente en aire bajo condiciones
estándar.
Etapa analítica
Plantemos la combustión. ?C₂H₂(g) + ?O₂(g)
→ ?CO₂(g) + ?H₂O (g)
Balanceamos carbonos. 1C₂H₂(g) + ?O₂(g)
→ 2CO₂(g) + ?H₂O (g)
Balanceamos hidrógenos. 1C₂H₂(g) + ?O₂(g)
→ 2CO₂(g) + 1H₂O (g)
La suma de oxígenos del lado de productos es 4+1, por lo que
debemos multiplicar por 2.
Multiplicamos por 2. 2C₂H₂(g) + ?O₂(g)
→ 4CO₂(g) + 2H₂O (g)
Balanceamos oxígenos. 2C₂H₂(g) + 5O₂(g)
→ 4CO₂(g) + 2H₂O (g)
Buscamos en la tabla
las entalpías de formación: C₂H₂(g) = +226.8; O₂(g) = 0; CO₂(g) = -393.509; H₂O (g) = -241.818. Con esta aplicaremos
primero la ley
de Hess para una reacción, y luego el teorema
de entalpia de reacción en función de la masa.
Etapa numérica
La entalpía de la reacción estándar con ley
de Hess para una reacción.
Masa molar de la sustancia con teorema
de masa molar de una molécula.
Entalpía de 10
g de acetileno por teorema
de entalpia de reacción en función de la masa.
Y por factor
de conversión.
Referencias
Brown, T. L., LeMay, H. E., Bursten, B. E., Murphy, C. J., Woodward, P. M., Stoltzfus, M. W., & Lufaso, M. W. (2022). Chemistry: The central science (15th ed.). Pearson




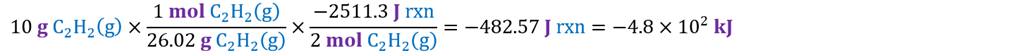
No hay comentarios:
Publicar un comentario