[Regresar a ejercicios de ley de Hess]
El etanol (C₂H₅OH) se mezcla con gasolina como combustible para vehículos. (a) Escribe una ecuación balanceada para la combustión de etanol líquido en el aire. (b) Calcula el cambio de entalpía estándar para la reacción, asumiendo H₂O(g) como producto. (c) Calcula el calor producido por litro de etanol por combustión de etanol a presión constante. El etanol tiene una densidad de 0.789 g/mL. (d) Calcula la masa de CO₂ producida por kJ de calor emitido.
Etapa analítica
(a) Escribe una ecuación balanceada para la combustión de etanol líquido en el aire.
Plantear la ecuación.
1C₂H₅OH(l)+ 1O₂(g) → 1H₂O(g)+ 1CO₂(g)
Balancear los carbonos.
1C₂H₅OH(l)+ 1O₂(g) → 1H₂O(g)+ 2CO₂(g)
Hidrógenos.
1C₂H₅OH(l)+ 1O₂(g) → 3H₂O(g)+ 2CO₂(g)
La suma de oxígenos es impar, por ende se multiplica por 2.
2C₂H₅OH(l)+ 1O₂(g) → 6H₂O(g)+ 4CO₂(g)
La cantidad de oxígenos es de 14, por ende.
2C₂H₅OH(l)+ 7O₂(g) → 6H₂O(g)+ 4CO₂(g)
Usaremos la ley de Hess para una reacción., por ende debemos buscar las entalpías de formación en la tabla de entalpías de formación estándar: C₂H₅OH(l) = -277, O₂(g) = 0, H₂O(g) = -241.818, CO₂(g) = -393.509.
Etapa numérica
(b) Calcula el cambio de entalpía estándar para la reacción, asumiendo H₂O(g) como producto.
La entalpía estándar de reacción (ΔH°rxn) y la entalpía de combustión (ΔHc) suelen confundirse, aunque no son idénticas. ΔH°rxn se refiere al cambio de entalpía según el balance estequiométrico completo con coeficientes enteros, mientras que ΔHc se define como el calor liberado por la combustión de 1 mol del combustible. En muchos casos, ambos valores coinciden numéricamente, pero esto no siempre ocurre. Si el combustible tiene un coeficiente diferente de uno en la ecuación balanceada, la diferencia es relevante. Por eso, conviene tener claridad conceptual al usar o consultar datos termodinámicos.
(c) Calcula el calor producido por litro de etanol por combustión de etanol a presión constante. El etanol tiene una densidad de 0.789 g/mL.
Usaremos el teorema de calor de combustión definido para la masa, y lo combinaremos con el axioma de la densidad.
Calculamos la masa molar del etanol.
Resolvemos la entalpía para 1 litro. Convertimos g/mL a g/L moviendo el separador decimal tres posiciones a la derecha, teniendo en cuenta que el cociente de mili/mili se cancela.
Por factor de conversión sería.
(d) Calcula la masa de CO₂ producida por kJ de calor emitido.
Calculamos la masa molar del CO2
Despejamos la masa del teorema de calor de combustión definido para la masa.
Referencias
Brown, T. L., LeMay, H. E., Bursten, B. E., Murphy, C., Woodward, P., Stoltzfus, M., & Lufaso, M. (2022)






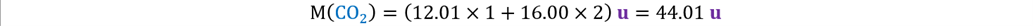


No hay comentarios:
Publicar un comentario