[Química orgánica] Sección 2. [Alquenos y alquinos] [Nomenclatura de alquenos y alquinos] [Terpenos] [Propiedades químicas de alquenos y alquinos] [Metabolitos secundarios] [Plasticos]
Un alqueno es un hidrocarburo insaturado con al menos un doble enlace carbono-carbono, formado por un enlace sigma y un enlace pi. Un alquino es un hidrocarburo insaturado con al menos un triple enlace carbono-carbono, compuesto por un enlace sigma y dos enlaces pi.
La saturación en química orgánica se refiere a la condición en la que los átomos de carbono de una molécula están unidos entre sí exclusivamente por enlaces simples (sigma) y están enlazados al máximo número posible de átomos de hidrógeno. En otras palabras, un compuesto está saturado si no tiene enlaces dobles ni triples entre los carbonos. Ejemplo: alcanos.
Enlace pi. A diferencia del enlace sigma, que permite la rotación libre de los átomos sobre su eje, como si fueran un tornillo ajustándose para alcanzar la máxima estabilidad y mínima energía, los enlaces dobles contienen un enlace pi que forma una región en forma de "rosquilla" o "nube" de densidad electrónica por encima y por debajo del plano del enlace sigma. Esta estructura restringe la rotación alrededor del doble enlace, haciéndolos rígidos y definiendo una geometría plana en torno a los átomos involucrados.
Figura 1. Los enlaces sigma se forman ya sea entre orbitales hibridados (representados como "verde en la imagen") o entre un orbital hibridado y un orbital s. Por otro lado, los enlaces pi se generan entre orbitales p no hibridados, que conservan su característica forma bilobular. Al unirse, los orbitales p no hibridados crean una región de densidad electrónica que forma un "puente doble" alrededor de los núcleos enlazados, representado como una rosca ("amarillo en la imagen"). Aunque visualmente puede parecer que son dos enlaces separados, en realidad el enlace pi es único, conectando los dos núcleos de manera continua por encima y por debajo del plano del enlace sigma.
Isomerismo cis/trans. Debido a la rotación restringida alrededor de un doble enlace carbono-carbono, cualquier alqueno en el que cada carbono del doble enlace tiene dos grupos diferentes unidos a él, muestra isomería cis, trans.
Aunque parece una diferencia superficial cuando realizamos los modelos con las estructuras de Lewis, con las fórmulas de esqueleto que representan de manera más aproximada a la geometría molecular nos damos cuenta de un aspecto importante, el doble enlace en posición trans genera una molécula lineal, mientras que el doble enlace en posición cis hace que la molécula gire hacia un lado, y una molécula torcida posee propiedades físicas y químicas diferentes de su versión lineal. Ala isomería de posición cis y trans se la denomina como isomería de diastereoisómeros; en la cual tenemos la misma composición atómica, el mismo poder de enlace entre átomos, pero una diferente configuración espacial tridimensional.
Los alquenos cis con enlaces dobles en cadenas abiertas son menos estables que sus isómeros trans debido a la tensión estérica entre los sustituyentes alquilo en el mismo lado del enlace doble, lo anterior significa que si dos grupos exactamente igual se encuentran muy cerca se repelen mutuamente, lo cual aumenta la inestabilidad de la molécula como un todo.
Figura 2. El isomerismo cis-trans ocurre en compuestos con enlaces dobles, diferenciando grupos en lados iguales (cis) o opuestos (trans).
La isomería cis-trans no es solo una complicación de nomenclatura, sino que también influye en las propiedades físicas de una molécula. Una molécula larga con isomería trans tiende a ser lineal, adoptando una geometría similar a la de una molécula saturada. En cambio, una molécula con isomería cis se tuerce, lo que dificulta su organización.
En general, las moléculas largas con geometrías retorcidas o difíciles de empaquetar suelen formar líquidos viscosos, mientras que las moléculas lineales y fáciles de empaquetar tienden a formar ceras.
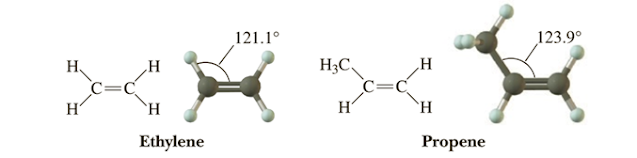
Ángulos y geometría. Debido a que el doble enlace actúa como un único lóbulo de repulsión electrónica, la molécula se comporta como si tuviera tres lóbulos de repulsión en total. Por esta razón, su geometría es trigonal planar, con ángulos de enlace de aproximadamente 120°.
Figura 3. Los ángulos de enlace en torno a un doble enlace se ajustan debido a que este se comporta como un único lóbulo de repulsión de pares de electrones de valencia. Como resultado, la geometría molecular cambia de tetraédrica a trigonal planar. En otras palabras, los dobles enlaces generan una disposición plana entre los átomos directamente vinculados.
Por otro lado, el triple enlace también actúa como un único lóbulo de repulsión. Por esta razón, un átomo de carbono con un triple enlace adopta una geometría lineal.
Energía de enlace. La energía de enlace aumenta a medida que el número de enlaces entre los átomos crece. Un enlace simple tiene la menor energía de enlace, ya que solo involucra un enlace sigma (alrededor de \(350 \ \color{purple}{\textbf{kJ/mol}}\)). Un enlace doble es más fuerte debido a la presencia de un enlace sigma y un enlace pi (aproximadamente \(600 \ \color{purple}{\textbf{kJ/mol}}\)). El enlace triple tiene la mayor energía de enlace, ya que consta de un enlace sigma y dos enlaces pi (alrededor de \(800 \ \color{purple}{\textbf{kJ/mol}}\)), resultando en una interacción aún más fuerte entre los átomos.



No hay comentarios:
Publicar un comentario