[Mitosis y meiosis] [Microorganismos] [Plantas] [Invertebrados] [Peces] [Anfibios y reptiles] [Aves] [Humanos] [Enfermedades humanas]
0. Índice
0. Índice
1. Introducción
1. Introducción
La forma más fundamental de describir los modos reproductivos en los tetrápodos existentes, si no es la mayoría de los animales, es identificando el producto reproductivo (huevo frente a crías vivas) y fuentes de nutrientes para el desarrollo (yema versus madre), modos de cópula y fertilización (interna frente a externa), modos de desarrollo (metamorfosis versus directa) entre otras.
Aunque esta clasificación bipartita de modos reproductivos puede ser fácilmente aplicado en amplios grupos taxonómicos, el "modo reproductivo" se usa de manera diferente al describir cómo se reproducen los anfibios y los reptiles, los grupos que tradicionalmente fueron denominados herpetos, "animal reptante, que se arrastra" aunque tal agrupación está desaconsejada, pues ignora de manera no natural a las aves, dinosaurios, mamíferos y todo lo que está en medio. A pesar de esto, en este capítulo nos enfocaremos en la reproducción de los anfibios y reptiles.
Con pocas excepciones, los embriones de anfibios ovíparos y reptiles reciben todos sus nutrición fetal de la yema dentro del huevo, un proceso conocido como lecitotrofia (lecitho = yema; trophos = comida). Las excepciones incluyen varias especies de cecilias en las que los embriones se pelan y comen la piel rica en lípidos de la madre, un proceso denominado dermatofagia.
Los embriones de especies vivíparas pueden recibir nutrición completamente de la yema, por las secreciones oviductales, alimentándose de óvulos o hermanos embrionarios en el útero, o por una placenta simple o compleja. Cuando la madre proporciona al menos algunos nutrientes, ya sea a través de secreciones o una placenta, el proceso se llama matrotrofia (matro = madre), y se han identificado muchos tipos diferentes de matrotrofia. La patrotrofia (patro = padre) es la provisión de algunos nutrientes por el padre. Estos términos se utilizan en este capítulo y otros relacionados.
En general podemos decir que los anfibios se reproducen de manera externa, son ovíparos, y de desarrollo indirecto atravesando una metamorfosis, mientras que los reptiles se reproducen internamente, son ovíparos, y de desarrollo directo, siendo ambos grupos de reproducción sexual en un ciclo de vida que alterna un soma diploide y gametos haploides que no forman cuerpos propios, por lo que no existe alternancia de generaciones. En las siguientes secciones analizaremos los detalles de estas caracteristicas.
1.1 Georges Cuvier
Georges Cuvier fue un destacado naturalista y paleontólogo francés del siglo XIX. Reconocido como el padre de la anatomía comparada y la paleontología, Cuvier revolucionó el campo al establecer la importancia de los fósiles en la reconstrucción de especies extintas. Sus estudios pioneros sentaron las bases para el desarrollo de la teoría de la extinción y contribuyeron significativamente al avance de la paleontología moderna.
Contexto social
Georges Cuvier vivió en un período de importantes cambios políticos, económicos, sociales, religiosos y culturales. A continuación, se describe brevemente el contexto en el que se desarrolló:
Cuvier vivió durante la época de la Revolución Francesa y los subsiguientes cambios políticos en Francia. También fue testigo del ascenso y caída de Napoleón Bonaparte y los posteriores cambios en la estructura política de Europa.
Durante el tiempo de Cuvier, Francia experimentó una transformación económica significativa. La Revolución Industrial comenzaba a tener efectos en la sociedad y la economía, con el surgimiento de nuevas industrias y el aumento de la urbanización.
La sociedad francesa de la época estaba marcada por profundas divisiones sociales y desigualdades. Cuvier pertenecía a una clase social acomodada y tenía acceso a recursos y oportunidades educativas.
Cuvier vivió en una época en la que la influencia de la Iglesia Católica en la sociedad francesa estaba en declive debido a los cambios políticos y a la influencia creciente de la Ilustración y el pensamiento científico.
El período en el que Cuvier vivió estuvo marcado por el auge de la Ilustración y el surgimiento de nuevas ideas y corrientes de pensamiento. El estudio científico y la investigación sistemática estaban ganando reconocimiento y Cuvier fue una figura destacada en la comunidad científica de su tiempo.
Infancia
La infancia de Georges Cuvier estuvo marcada por su temprano interés por la historia natural y su amor por los animales. Nació el 23 de agosto de 1769 en Montbéliard, Francia, en una familia de clase media. Desde joven, mostró una curiosidad inusual por la naturaleza y pasaba horas explorando y recolectando especímenes de la región.
Aunque su familia no era rica, sus padres apoyaron su interés y le proporcionaron libros y oportunidades para aprender. Durante su infancia, Cuvier mostró una habilidad excepcional para el estudio de los animales y se dedicó a la observación meticulosa y el dibujo de las especies que encontraba.
A pesar de algunos obstáculos económicos y sociales, Cuvier pudo continuar su educación y asistir al Collège de Stuttgart, donde amplió sus conocimientos en anatomía y paleontología. Estos primeros años de su vida sentaron las bases para su futura carrera como científico y su pasión por el estudio de los animales, lo que eventualmente lo llevaría a convertirse en uno de los naturalistas más influyentes de su tiempo.
Logros
Georges Cuvier recibió una educación sólida y diversa que le permitió convertirse en uno de los científicos más destacados de su tiempo. Estudió en el Collège de Stuttgart y luego en la Universidad de Tubinga, donde se enfocó en medicina y anatomía. Su formación le proporcionó una base sólida en anatomía comparada y paleontología. Entre sus principales logros científicos se encuentran:
(a) Ley de correlación de partes: Cuvier estableció la ley de correlación de partes, que sostiene que las partes de un organismo están íntimamente relacionadas entre sí y no pueden ser cambiadas sin afectar a otras partes.
(b) Fundador de la paleontología: Cuvier sentó las bases de la paleontología moderna al reconocer y describir numerosas especies fósiles. Su trabajo en la anatomía comparada y la reconstrucción de especies extintas fue fundamental para el desarrollo de la paleontología como disciplina científica.
(c) Descripción de especies: Cuvier describió y clasificó una amplia gama de especies, tanto fósiles como vivas. Sus detalladas descripciones y su enfoque meticuloso sentaron las bases para la taxonomía moderna.
(e) Desarrollo de la anatomía comparada: Cuvier fue pionero en la anatomía comparada, comparando las estructuras anatómicas de diferentes especies para comprender sus relaciones evolutivas y funcionales.
(f) Controversia con Jean-Baptiste Lamarck: Cuvier y Lamarck tuvieron diferencias científicas y filosóficas significativas, especialmente en relación con la evolución y la transmisión de características adquiridas.
Aunque Cuvier hizo importantes contribuciones a la ciencia, también cometió errores y se mostró reacio a aceptar la idea de la evolución. Su enfoque basado en la anatomía comparada y su énfasis en la extinción como fuerza impulsora en la historia de la vida también generaron controversia y debate en su época.
A pesar de las controversias y errores, el legado de Cuvier en la paleontología y la anatomía comparada es innegable. Su trabajo sentó las bases para futuros avances en la comprensión de la diversidad y la historia de la vida en la Tierra.
Comunidad científica
La comunidad científica en la que Georges Cuvier desarrolló su trabajo estaba compuesta por diversos investigadores, colaboradores, amigos, opositores y también algunos enemigos. A continuación, se mencionan algunas de las figuras más destacadas en relación a su relación con Cuvier. Colaboradores y amigos:
(a) Étienne Geoffroy Saint-Hilaire: Fue un colaborador cercano de Cuvier. Ambos trabajaron juntos en el Museo de Historia Natural de París y compartieron ideas sobre anatomía comparada y la clasificación de especies.
(b) Alexander von Humboldt: Cuvier y Humboldt tuvieron una relación de amistad y colaboración. Humboldt realizó expediciones científicas y recopiló una gran cantidad de datos sobre la biodiversidad, que compartió con Cuvier para su análisis y estudio.
(c) François Arago: Fue un matemático y físico francés que tuvo una amistad cercana con Cuvier. Juntos, colaboraron en la creación de la Société Philomathique de Paris, una sociedad científica que promovió la investigación y el intercambio de conocimientos.
Opositores y enemigos:
(a) Jean-Baptiste Lamarck: Cuvier y Lamarck mantuvieron una relación de oposición científica y filosófica. Lamarck defendía la idea de la evolución y la transmisión de características adquiridas, conceptos que Cuvier rechazaba. Sus diferencias llevaron a debates y disputas científicas.
(b) Étienne Geoffroy Saint-Hilaire (posteriormente): A pesar de su colaboración inicial, Cuvier y Geoffroy Saint-Hilaire se separaron debido a diferencias teóricas y metodológicas en relación con la anatomía comparada. Esto condujo a una rivalidad científica y debates públicos entre ellos.
Es importante destacar que, si bien Cuvier tuvo opositores y enemigos, también fue respetado y reconocido por muchos de sus contemporáneos. Su enfoque meticuloso y su contribución a la paleontología y la anatomía comparada dejaron un legado duradero en la comunidad científica de su época y más allá.
Reconocimientos
Durante su vida, Georges Cuvier recibió numerosos reconocimientos y honores por su destacada contribución a la ciencia. A continuación, se mencionan algunos de los principales reconocimientos que recibió:
(a) Medalla Copley: En 1818, Cuvier fue galardonado con la Medalla Copley, el premio científico más antiguo del Reino Unido, otorgado por la Royal Society. Este prestigioso premio se le concedió por su trabajo en anatomía comparada y paleontología.
(b) Miembro de la Academia de Ciencias de Francia: Cuvier fue elegido miembro de la Academia de Ciencias de Francia en 1795 y se convirtió en una figura destacada en esta institución científica.
(c) Títulos de nobleza: En reconocimiento a su contribución científica, Cuvier recibió títulos de nobleza. En 1819, fue nombrado barón por el rey Luis XVIII de Francia, y posteriormente en 1828, recibió el título de vizconde.
(d) Fundación de cátedras: Cuvier fue responsable de establecer varias cátedras y academias científicas en Francia. En 1799, fundó la cátedra de zoología en el Museo Nacional de Historia Natural de París, donde impartió conferencias y promovió la investigación científica.
Después de su muerte, el legado de Cuvier continuó siendo reconocido y honrado:
(a) Medalla Cuvier: En su honor, se estableció la Medalla Cuvier, que se otorga por contribuciones destacadas en paleontología y zoología comparada. Esta medalla es otorgada por la Academia de Ciencias de Francia.
(b) Estatuas y monumentos: Se erigieron estatuas y monumentos en diferentes partes del mundo para honrar la memoria y el legado de Georges Cuvier. Algunos de estos monumentos se encuentran en París, Montbéliard y Stuttgart.
(c) Nomenclatura científica: Varias especies de animales y fósiles han sido nombradas en honor a Cuvier como reconocimiento a sus contribuciones a la zoología y paleontología. Ejemplos incluyen el género Cuvieria y la especie Cuvierichthys.
El reconocimiento y la influencia de Cuvier en la comunidad científica y en la comprensión de la anatomía comparada, la paleontología y la taxonomía continúan hasta el día de hoy.
¿Por qué él es importante?
El trabajo de Georges Cuvier, un destacado naturalista y paleontólogo del siglo XIX, ha tenido un impacto significativo en nuestra comprensión de la historia de la vida en la Tierra y en varios aspectos de nuestra vida cotidiana. Sus contribuciones han influido en la biología, la paleontología, la geología y otras disciplinas científicas, lo que ha dado lugar a importantes avances en diferentes campos. A continuación, se describen algunas formas en las que el trabajo de Cuvier nos afecta en nuestra vida diaria:
(a) Comprender la biodiversidad: Cuvier es conocido por ser uno de los padres fundadores de la paleontología y por su trabajo en anatomía comparada. Sus estudios de fósiles y su teoría de la correlación de partes permitieron reconstruir la apariencia y los hábitos de animales extintos. Esta comprensión de la diversidad de formas de vida pasadas es fundamental para nuestro conocimiento de la biodiversidad actual y su conservación. Nos ayuda a entender cómo las especies evolucionan y cómo se adaptan a diferentes entornos.
(b) Clasificación y taxonomía: Cuvier propuso el concepto de especie y desarrolló un sistema de clasificación basado en la anatomía comparada. Su enfoque en la estructura anatómica permitió identificar patrones y diferencias entre los organismos, sentando las bases para la taxonomía moderna. Este sistema de clasificación nos ayuda a organizar y comprender la diversidad de seres vivos en la actualidad y a establecer relaciones entre ellos.
(c) Interpretación de fósiles: Cuvier fue pionero en la interpretación de fósiles y en la reconstrucción de los seres vivos extintos. Sus investigaciones permitieron determinar la existencia de especies extinguidas y comprender mejor la historia evolutiva de la Tierra. El estudio de los fósiles sigue siendo una parte fundamental de la paleontología y ha contribuido a nuestra comprensión de la historia de la vida y de eventos como la extinción de los dinosaurios.
(d) Bases para la geología moderna: Cuvier también hizo contribuciones significativas al campo de la geología. Sus estudios de los estratos de la corteza terrestre y de los fósiles en ellos ayudaron a establecer la cronología de los eventos geológicos y a desarrollar la idea de la extinción masiva. Estos conceptos son fundamentales para nuestra comprensión de la historia geológica de la Tierra y tienen implicaciones en la prospección de recursos naturales, la exploración de yacimientos de petróleo, la comprensión de los riesgos naturales y otros aspectos relacionados con la geología aplicada.
¿Qué debemos aprender de el?
La vida y el legado de Georges Cuvier nos ofrecen varias lecciones valiosas que podemos aplicar en nuestra vida diaria. Aquí hay algunas formas en las que podemos inspirarnos en su vida, limitaciones, obstáculos, logros e impacto.
Cuvier era conocido por su inmenso interés y pasión por la ciencia. Estudió con dedicación y se sumergió en el mundo natural, lo que le permitió hacer descubrimientos significativos. Podemos aprender de él al adoptar una actitud curiosa y un deseo de aprender y explorar constantemente. Cultivar una pasión por el conocimiento nos ayuda a crecer intelectualmente y a encontrar satisfacción en el aprendizaje continuo.
Cuvier enfrentó numerosos desafíos y limitaciones en su vida. A pesar de su modesto origen y de las barreras sociales y económicas de la época, perseveró en su búsqueda científica. Su determinación y capacidad para superar obstáculos nos enseñan la importancia de no permitir que las dificultades nos detengan. Enfrentar los desafíos con valentía y persistencia puede llevarnos más allá de nuestras limitaciones y abrir nuevas oportunidades.
Cuvier se destacó por su habilidad para observar y analizar las características anatómicas de los organismos. Su enfoque en las diferencias y peculiaridades de cada especie le permitió hacer descubrimientos significativos en paleontología y anatomía comparada. Podemos aplicar esta lección en nuestras vidas al reconocer y desarrollar nuestras propias fortalezas individuales. En lugar de compararnos constantemente con los demás, podemos concentrarnos en nuestras habilidades únicas y utilizarlas para lograr nuestros objetivos.
El trabajo de Cuvier tuvo un impacto duradero en el campo de la ciencia. Sus teorías, clasificaciones y métodos sentaron las bases para futuras investigaciones en paleontología, biología y geología. Nos inspira a contribuir al conocimiento colectivo y compartir nuestros descubrimientos y logros con la sociedad en general. Ya sea en el ámbito científico o en cualquier otro campo, cada uno de nosotros tiene la capacidad de hacer aportes significativos que puedan beneficiar a otros.
Cuvier fue un científico versátil y se adaptó a los cambios en su campo de estudio. A lo largo de su carrera, abordó diferentes áreas de investigación y se enfrentó a nuevas teorías y enfoques. Podemos aprender de él al ser flexibles y adaptarnos a las circunstancias cambiantes. Mantener una mente abierta y estar dispuestos a explorar nuevas ideas y enfoques nos permite crecer y evolucionar en nuestra vida personal y profesional.
2. Historia de la herpetología
2. Historia de la herpetología
La herpetología, una rama de la biología dedicada al estudio de los reptiles y anfibios, ha desempeñado un papel fundamental en nuestra comprensión de la diversidad y el funcionamiento de estos fascinantes grupos de animales. A lo largo de la historia, numerosos científicos apasionados han dejado huella en esta disciplina, desvelando los secretos de las serpientes, lagartos, tortugas, ranas y salamandras. La historia de la herpetología se remonta a siglos atrás, cuando los primeros naturalistas comenzaron a explorar y describir las diferentes especies que encontraban en sus expediciones. Sin embargo, fue durante el siglo XIX cuando la herpetología experimentó un gran avance, impulsada por el trabajo de destacados biólogos y naturalistas. Durante esta época, la comunidad científica se vio influenciada por los descubrimientos de Charles Darwin y su teoría de la evolución. Los estudios de Darwin sobre la diversidad de las especies y la adaptación dieron un impulso significativo a la investigación herpetológica, generando un interés renovado en el estudio de reptiles y anfibios.
En este artículo, exploraremos la historia de la herpetología, desde sus inicios hasta la actualidad, y nos sumergiremos en el apasionante mundo de estos seres que habitan nuestros ecosistemas. Desde los primeros naturalistas hasta los biólogos contemporáneos, descubriremos cómo se ha desarrollado esta disciplina a lo largo del tiempo y cómo ha contribuido al avance de nuestro conocimiento sobre los reptiles y anfibios. Acompáñanos en este viaje por la historia de la herpetología y descubre los grandes descubrimientos y las figuras destacadas que han moldeado esta fascinante área de estudio.
2.1 Definición
La herpetología es una rama de la zoología que se especializa en el estudio de los reptiles y anfibios. Los herpetólogos investigan la anatomía, fisiología, comportamiento, ecología, evolución y conservación de estas criaturas. El término "herpetología" proviene del griego "herpeton", que significa "animal que se arrastra" y se refiere a la naturaleza reptante o arrastrante de muchos reptiles y anfibios.
A lo largo del tiempo, la definición de herpetología no ha experimentado variaciones significativas. Sin embargo, los enfoques y métodos de estudio han evolucionado y se han refinado con el avance de la tecnología y el conocimiento científico. En el pasado, la herpetología se centraba principalmente en la taxonomía y descripción de especies, pero con el tiempo ha ampliado su alcance para incluir aspectos más amplios de la biología y la conservación de reptiles y anfibios. Algunas de las razones para estos cambios y evoluciones en la herpetología incluyen:
(a) Avances tecnológicos: Las nuevas tecnologías, como la secuenciación del ADN, los estudios de telemetría, la fotografía de alta resolución y las técnicas de muestreo no invasivas, han permitido a los herpetólogos obtener información más detallada sobre la genética, la ecología y el comportamiento de las especies.
(b) Intereses de investigación: A medida que se descubren nuevas preguntas y desafíos en el campo de la herpetología, los investigadores han ampliado sus áreas de estudio para abordar aspectos como la conservación de especies amenazadas, los efectos del cambio climático, la interacción entre especies y la respuesta de los reptiles y anfibios a los cambios en su entorno.
(c) Conservación y conciencia ambiental: Con el creciente reconocimiento de la importancia de la conservación de la biodiversidad, la herpetología ha asumido un papel más activo en la protección y gestión de los reptiles y anfibios. Esto ha llevado a un mayor énfasis en la comprensión de las amenazas a las especies y la implementación de estrategias de conservación efectivas.
El término "Herpetología" agrupa tanto a los reptiles como a los anfibios, que son clados polifiléticos, lo que significa que no comparten un ancestro común exclusivo. Los reptiles y los anfibios son dos grupos evolutivamente distintos con características y adaptaciones diferentes. Entonces, ¿por qué no se han subdividido en dos campos separados? Existen varias razones para esto:
(a) Tradición histórica: La herpetología como disciplina se originó en el siglo XIX, cuando se estableció la unión de los estudios de reptiles y anfibios bajo un mismo término. Desde entonces, la comunidad científica ha mantenido esta tradición y ha trabajado conjuntamente en la investigación de ambos grupos. en ocasiones la tradición histórica puede influir en la forma en que se estructuran los campos de estudio científico, y algunos filósofos de la ciencia han reflexionado sobre este tema. Uno de los filósofos más influyentes en este campo es Thomas Kuhn, autor de "La estructura de las revoluciones científicas". Kuhn argumenta que la ciencia no avanza de manera lineal y progresiva, sino que pasa por períodos de "ciencia normal" en los que se establece un paradigma dominante que guía la investigación y la práctica científica. En el contexto de la herpetología, podríamos considerar que la inclusión de reptiles y anfibios en una misma disciplina se debe a una tradición arraigada en un paradigma establecido en los primeros días de su desarrollo.
(b) Superposición de características: A pesar de que reptiles y anfibios son clados distintos, comparten algunas características y problemas comunes en términos de fisiología, ecología, comportamiento y conservación. Por ejemplo, ambos grupos son ectotérmicos, lo que significa que dependen del entorno para regular su temperatura corporal. Además, enfrentan desafíos similares relacionados con la pérdida de hábitat, el cambio climático y la contaminación. Estudiarlos de manera conjunta puede brindar una perspectiva más completa y facilitar la colaboración entre expertos.
(c) Recursos limitados: La subdivisión de la herpetología en dos campos separados podría requerir recursos adicionales, como financiamiento, personal y publicaciones científicas. En muchos casos, las comunidades científicas de reptiles y anfibios son relativamente pequeñas en comparación con otros campos de estudio, y dividir aún más estos recursos podría resultar en una menor capacidad para llevar a cabo investigaciones y proyectos de conservación de manera efectiva.
Aunque es cierto que los reptiles y los anfibios no forman un grupo monofilético, la herpetología como disciplina ha logrado integrar estos grupos y ha contribuido al avance del conocimiento sobre ambos. Sin embargo, esto no significa que no haya especialización dentro de la herpetología. Muchos herpetólogos se especializan en reptiles o anfibios en particular y pueden centrar su investigación en aspectos específicos de estos grupos.
2.2 Sumeria
El conocimiento específico de los antiguos sumerios sobre la herpetología es limitado debido a la falta de registros detallados. Sin embargo, se ha encontrado evidencia que sugiere que los sumerios estaban familiarizados con algunos reptiles y anfibios.
En la antigua civilización sumeria, se han descubierto representaciones artísticas y escrituras que hacen referencia a serpientes. Estas representaciones pueden encontrarse en sellos cilíndricos, estatuillas y relieves en los templos sumerios. Además, algunas de las deidades sumerias tenían asociaciones con serpientes, lo que indica una conexión simbólica o religiosa.
Figura 2.1. Cerastes cerastes, comúnmente conocida como víbora cornuda, es una serpiente venenosa que habita en las regiones desérticas del norte de África y Oriente Medio, incluyendo partes de Mesopotamia. Su nombre se debe a los cuernos aplanados y triangulares que se encuentran sobre sus ojos, los cuales le brindan una apariencia distintiva. Con un cuerpo delgado y una longitud promedio de 50 a 70 centímetros, esta serpiente está adaptada para vivir en ambientes desérticos, donde se camufla con su coloración arenosa y sus escamas que se asemejan a la arena. Cerastes cerastes tiene un comportamiento principalmente nocturno y se alimenta de pequeños mamíferos y aves que se acercan a su hábitat. Posee un veneno potente que utiliza para someter a sus presas y defenderse de los depredadores. Su estilo de caza se basa en su habilidad para permanecer inmóvil y confiar en su camuflaje antes de lanzarse rápidamente para atrapar a su presa. Esta serpiente representa un desafío para los habitantes de las regiones donde habita debido a su veneno y su capacidad de ocultarse en la arena, lo que la convierte en un depredador formidable en su entorno natural.
Aunque no tenemos información detallada sobre estudios científicos específicos en herpetología realizados por los sumerios, estas representaciones y referencias sugieren que los sumerios estaban conscientes de la existencia de serpientes y podrían haber tenido cierta comprensión de su comportamiento y características físicas.
Es importante tener en cuenta que el conocimiento sumerio en general estaba vinculado a su cosmología, religión y mitología. Por lo tanto, el enfoque en los animales, incluyendo las serpientes, estaba más relacionado con su simbolismo y significado cultural que con una investigación científica rigurosa.
2.3 Egipto
Los antiguos egipcios tenían un conocimiento limitado pero significativo sobre los reptiles y anfibios en el contexto de su civilización faraónica. Si bien su conocimiento no era científico en el sentido moderno, los egipcios tenían una comprensión práctica y simbólica de ciertas especies de herpetología.
En el antiguo Egipto, los reptiles y anfibios más prominentes y conocidos eran las serpientes y los cocodrilos. Estos animales desempeñaron un papel importante en la mitología y la religión egipcias. Por ejemplo, la serpiente Uraeus se utilizaba como un símbolo de realeza y protección, y se representaba en las coronas de los faraones. La especie de cobra más temida y asociada con el símbolo protector de los faraones en el antiguo Egipto es la cobra egipcia (Naja haje), también conocida como cobra del desierto o uraeus. Esta serpiente venenosa es nativa de las regiones desérticas y semiáridas del norte de África, incluido Egipto.
Figura 2.2. La Naja haje, también conocida como cobra egipcia o cobra del desierto, es una serpiente venenosa que habita en las regiones desérticas de África del Norte, incluyendo Egipto. Es reconocida por su apariencia amenazadora y su veneno altamente tóxico. Alcanza una longitud de hasta 2 metros y tiene un cuerpo delgado y ágil. Su coloración varía, pero generalmente es de tonos pardos u oliva, con marcas oscuras en forma de capucha en el cuello. Cuando se siente amenazada, puede erguirse y expandir su capucha para intimidar a sus depredadores. Su mordedura puede ser fatal, ya que libera un veneno neurotóxico que afecta el sistema nervioso de sus presas. La Naja haje fue temida y respetada en la cultura egipcia antigua, y su imagen se convirtió en un símbolo de protección en la iconografía faraónica.
La cobra egipcia se convirtió en un símbolo icónico en la cultura egipcia debido a su peligrosidad y su aparición amenazadora. Su veneno es altamente tóxico y puede ser mortal para los seres humanos. Los antiguos egipcios tenían un profundo respeto y temor hacia esta serpiente. El uraeus, el adorno en forma de cobra que se encuentra en las coronas y tocados de los faraones, se inspiró en la cobra egipcia. Este símbolo representaba el poder y la protección del faraón, y se creía que tenía la capacidad de escupir veneno a los enemigos del faraón. La cobra egipcia y el uraeus son elementos distintivos de la iconografía egipcia y están estrechamente asociados con la realeza y la divinidad del faraón. Estos símbolos se utilizaron como amuletos y en representaciones artísticas para representar la autoridad y la protección del faraón y su conexión con los dioses egipcios.
Además, los cocodrilos del Nilo, especialmente el cocodrilo sagrado Sobek, eran considerados como manifestaciones divinas y eran objeto de adoración en algunos templos. Los egipcios también estaban familiarizados con otras especies de reptiles y anfibios presentes en su entorno, como tortugas, lagartijas y ranas. Aunque no se dispone de registros detallados sobre estudios científicos o taxonómicos, estos animales eran reconocidos y representados en el arte y la escritura egipcia.
Figura 2.3. El Crocodylus niloticus, comúnmente conocido como cocodrilo del Nilo, es una especie de cocodrilo que habita en las regiones de África subsahariana. Es uno de los reptiles más grandes del mundo, con los machos alcanzando longitudes de hasta 6 metros. Su cuerpo está cubierto de escamas duras “en los más grandes llegando a ser a prueba de balas” y cuenta con un hocico alargado y dientes afilados. Estos cocodrilos son conocidos por su adaptación al agua, pasando gran parte de su tiempo en ríos, lagos y estuarios. Son depredadores formidables, acechando a su presa desde el agua y utilizando su poderosa mandíbula para atraparla y arrastrarla bajo el agua. En la antigua cultura egipcia, el cocodrilo del Nilo era venerado y considerado sagrado. Estaba asociado con la deidad Sobek, que era adorado como el dios del agua, la fertilidad y la protección. Los egipcios creían que el cocodrilo del Nilo era una manifestación de Sobek y lo honraban en templos y ceremonias religiosas.
Además de su importancia religiosa y cultural, los egipcios también tenían un conocimiento práctico sobre algunos reptiles y anfibios. Por ejemplo, sabían cómo manejar serpientes venenosas y utilizaban técnicas específicas para evitar mordeduras peligrosas. También eran conscientes de las propiedades curativas de ciertos animales, como la sangre de cocodrilo, que creían que tenía poderes medicinales.
En la antigua cultura egipcia, se tenía un conocimiento significativo sobre los venenos de serpientes y su uso en diferentes contextos. Los egipcios utilizaban venenos de serpientes con propósitos medicinales, rituales y también en prácticas relacionadas con la magia y la protección.
En el ámbito medicinal, los egipcios creían en las propiedades curativas de ciertos venenos de serpientes. Utilizaban técnicas como la extracción de veneno de serpientes venenosas y lo combinaban con otros ingredientes para crear remedios y elixires para tratar diversas enfermedades y dolencias.
Además, los venenos de serpientes eran utilizados en rituales religiosos y mágicos. Se creía que tenían propiedades protectoras y podían repeler a los espíritus malignos y a las fuerzas negativas. Los sacerdotes egipcios eran los encargados de manejar y utilizar los venenos de serpientes en estos contextos sagrados.
En cuanto a las toxinas de los anfibios, hay menos evidencia concreta sobre el conocimiento de los egipcios en este aspecto. Si bien los egipcios tenían familiaridad con algunas especies de anfibios, como las ranas, no hay registros específicos que indiquen que tenían un conocimiento detallado sobre las toxinas de estos animales.
Es importante tener en cuenta que, aunque los antiguos egipcios tenían un conocimiento y uso de venenos de serpientes, su enfoque no era científico en el sentido moderno. Sus prácticas y creencias se basaban en su comprensión cultural y religiosa, y no se pueden equiparar con los estudios científicos y la investigación en herpetología y toxicología moderna.
2.4 Grecia
Los antiguos griegos, tanto en la época clásica como helenística, tenían un conocimiento notable sobre herpetología, incluyendo el estudio de serpientes y otros reptiles. Estos conocimientos estaban influenciados por su interés en la naturaleza, la filosofía, la medicina y la mitología.
Figura 2.4. Lacerta viridis, también conocido como lagarto verde o lagarto esmeralda, es una especie de lagarto que se encuentra principalmente en Europa y partes de Asia. Es de tamaño mediano, alcanzando una longitud total de aproximadamente 30 centímetros. Su cuerpo está cubierto de escamas de color verde brillante, lo que le da su nombre característico. Este lagarto tiene extremidades bien desarrolladas y una cola larga y delgada. Es conocido por su capacidad de regenerar la cola en caso de pérdida. Posee una cabeza triangular con ojos prominentes y una lengua bífida que utiliza para detectar su entorno. El lagarto verde es diurno y se encuentra en una variedad de hábitats, incluyendo praderas, bosques y áreas de matorral. Se alimenta principalmente de insectos y otros pequeños invertebrados. Durante la época de reproducción, los machos exhiben colores más intensos y compiten entre sí por las hembras. Este lagarto es apreciado por su belleza y es objeto de interés en la observación de la naturaleza. Su coloración verde vibrante y su comportamiento activo lo convierten en una especie llamativa en el mundo de los reptiles. El lagarto verde fue descrito y estudiado por varios escritores y filósofos griegos antiguos. Aristóteles, en su obra "Historia de los animales", realizó observaciones detalladas sobre la anatomía y el comportamiento de los lagartos verdes. Describió sus características físicas, como su color verde brillante y su capacidad para regenerar la cola. También observó su hábitat, su reproducción y su comportamiento en la naturaleza. Otro autor griego, llamado Teofrasto, también mencionó al lagarto verde en su obra "Historia de las plantas". Aunque se centró principalmente en las plantas, hizo referencias a los animales que se encontraban en su entorno, incluyendo el lagarto verde. Estas descripciones y observaciones proporcionadas por los antiguos griegos brindaron información valiosa sobre la biología y el comportamiento de los lagartos verdes, lo que contribuyó al conocimiento temprano de la herpetología.
En cuanto a los venenos, los griegos clásicos y helenísticos desarrollaron un conocimiento considerable sobre las propiedades tóxicas de ciertas especies de serpientes y otros animales venenosos. Hipócrates, considerado el padre de la medicina occidental, y otros médicos griegos estudiaron y documentaron los efectos de los venenos en el cuerpo humano. Utilizaban sus conocimientos para tratar enfermedades y dolencias, así como para desarrollar antídotos y remedios.
Además de su estudio científico, los griegos también tenían una fascinación mitológica por los reptiles y los consideraban símbolos de fuerza, sabiduría y transformación. La serpiente, en particular, estaba asociada con la sabiduría y la curación, siendo el símbolo de Asclepio, el dios de la medicina.
El ciclo de vida de las ranas y sapos fue descrito por primera vez en la antigua Grecia. El filósofo y científico griego Aristóteles (384-322 a.C.) fue uno de los primeros en estudiar y describir detalladamente el desarrollo de los anfibios. En su obra "Historia Animalium" (Historia de los animales), Aristóteles proporcionó observaciones y descripciones del desarrollo de los renacuajos y su transformación en ranas y sapos.
Figura 2.5. Aristóteles estudió el ciclo de vida de la rana común europea (Rana temporaria) en su obra "Historia Animalium". La Rana temporaria, también conocida como rana común europea, es una especie de anfibio que se encuentra ampliamente distribuida en Europa. Tienen un tamaño promedio de 5-9 centímetros de longitud y su coloración varía, pero generalmente son de tonos marrones, grises o verdosos. Tienen una piel suave y húmeda, con una textura verrugosa. Sus ojos son prominentes y poseen pupilas horizontales. Durante la época de reproducción, los machos desarrollan almohadillas oscuras en sus pulgares, utilizadas para agarrar a las hembras durante el amplexo. La Rana temporaria habita en diversos hábitats, incluyendo bosques, praderas y zonas húmedas. Son principalmente nocturnas y se alimentan de insectos y otros invertebrados. Durante el invierno, las Ranas temporaria hibernan en lugares protegidos, como madrigueras o bajo la vegetación. Son conocidas por su capacidad de cambiar de color para camuflarse y adaptarse a su entorno.
Aristóteles describió cómo los huevos de los anfibios se convertían en larvas acuáticas, conocidas como renacuajos, que luego pasaban por una serie de etapas de desarrollo antes de su metamorfosis en ranas o sapos. También observó que los renacuajos tenían branquias para respirar en el agua, pero que las perdían a medida que se desarrollaban las patas y los pulmones.
El trabajo de Aristóteles sentó las bases para el estudio posterior de los ciclos de vida de los anfibios y tuvo una gran influencia en la biología y la zoología de la época. Sus observaciones y descripciones sentaron las bases para el entendimiento moderno del desarrollo de las ranas y sapos.
2.5 China
Los antiguos chinos imperiales tenían un conocimiento amplio sobre los herpetos y su uso medicinal. En la medicina tradicional china, se considera que los herpetos tienen propiedades terapéuticas y se utilizan para tratar una variedad de enfermedades y dolencias.
Los herpetos, incluyendo serpientes y ciertos anfibios, eran apreciados por su potencial curativo. Se creía que poseían propiedades energéticas específicas y eran utilizados tanto en forma de ingredientes crudos como en preparados farmacéuticos elaborados. Sus partes, como la piel, la carne, las escamas y las secreciones, eran utilizadas en la formulación de medicamentos y tónicos.
Figura 2.6. La Mauremys reevesii, también conocida como tortuga china de caparazón blando de Reeves, es una especie de tortuga nativa de China. Posee un caparazón liso y flexible, que le otorga su nombre distintivo. Su tamaño varía, alcanzando una longitud de unos 20 centímetros en promedio. Esta tortuga se caracteriza por su coloración variable, que puede ir desde tonos marrones y oliva hasta verdes y amarillos brillantes. Tiene patas y cuello robustos, con membranas entre los dedos que le permiten nadar ágilmente. La Mauremys reevesii es una especie semiacuática, pasando tiempo tanto en el agua como en tierra firme. Se alimenta principalmente de una variedad de plantas acuáticas, insectos, crustáceos y pequeños vertebrados. Además de su importancia ecológica, esta tortuga tiene un valor cultural en China. Se la considera un símbolo de longevidad y fortuna, y a menudo se la mantiene como mascota. Su belleza y su naturaleza tranquila la convierten en una especie apreciada tanto en su hábitat natural como en cautiverio.
Se cree que los herpetos tienen una influencia en los meridianos y en el equilibrio del yin y el yang en el cuerpo, según los principios de la medicina tradicional china. Por lo tanto, se utilizaban para tratar una variedad de afecciones, como problemas respiratorios, enfermedades de la piel, problemas renales, artritis y más.
Además de sus usos medicinales, los herpetos también tenían un lugar en la mitología y la cultura china. Se creía que algunas serpientes poseían poderes místicos y eran consideradas símbolos de buena suerte y protección.
El conocimiento sobre los herpetos y sus usos medicinales en la antigua China se transmitía a través de tratados médicos, textos clásicos y la tradición oral. Los herpetos ocupaban un lugar destacado en el arsenal terapéutico de la medicina tradicional china, y su uso continuó hasta la actualidad en algunas prácticas médicas tradicionales.
2.6 Roma
Durante el Imperio Romano, el conocimiento sobre los herpetos se basó en gran medida en la herencia de los reinos helenísticos, que a su vez habían adquirido el conocimiento de los antiguos griegos. Los romanos tuvieron acceso a las obras de autores como Aristóteles, Plinio el Viejo y Galeno, cuyos escritos trataban sobre la fauna y los herpetos en particular.
El naturalista romano Plinio el Viejo fue una figura destacada en la recopilación y descripción de la fauna, incluyendo los herpetos, en su famosa obra "Historia Natural". Su trabajo recopilaba información de diversas fuentes y describía las características, hábitats y usos medicinales de varios herpetos.
Además de heredar el conocimiento de los griegos, los romanos también hicieron sus propias observaciones y clasificaciones de los herpetos presentes en sus territorios, especialmente en las regiones mediterráneas. Si bien el enfoque romano no fue tan científico como el de los griegos, se interesaron en las propiedades curativas y venenosas de ciertos herpetos, así como en su uso en rituales religiosos y prácticas mágicas.
Aunque el conocimiento romano sobre los herpetos se basaba en gran medida en la recopilación y sistematización de información de los griegos, también realizaron contribuciones propias. Sus obras, aunque menos rigurosas desde el punto de vista científico, sentaron las bases para el posterior desarrollo de la zoología y la herpetología.
No se tiene evidencia concreta de que los romanos hayan descrito especies de herpetos específicamente para propósitos militares. Sin embargo, se sabe que los romanos eran conscientes de ciertos aspectos de los herpetos y podían hacer uso de ellos en situaciones militares de una manera más general.
Por ejemplo, los romanos eran conocedores de la capacidad de algunas serpientes venenosas para infligir daño y utilizaron esta información en el campo de batalla. Hay registros de tácticas en las que los soldados romanos arrojaban serpientes venenosas a las trincheras enemigas para sembrar el caos y el miedo. Sin embargo, estas acciones no necesariamente implicaban un conocimiento detallado sobre las especies específicas de serpientes.
Figura 2.7. La Vipera berus, conocida como víbora común o víbora europea, es una serpiente venenosa que se encuentra en Europa y algunas partes de Asia. Tiene una longitud promedio de 50 a 70 centímetros y su cuerpo es robusto. Su coloración varía, pero generalmente presenta una combinación de tonos marrones, grises y negros, con manchas o bandas en zigzag en su espalda. La víbora común es reconocida por su cabeza triangular y sus ojos distintivos con pupilas verticales. Su veneno es neurotóxico y puede causar síntomas como dolor, inflamación y en casos graves, daño tisular e incluso la muerte. Habita en una variedad de hábitats, incluyendo bosques, praderas y áreas pantanosas. Es una especie principalmente terrestre y se alimenta de pequeños mamíferos, aves y anfibios. Debido a su veneno y su comportamiento defensivo, la víbora común es respetada y temida. Es importante mantener una distancia segura y evitar el contacto con esta especie en su hábitat natural. Esta fue una de las especies más comúnmente descrita por los antiguos romanos.
Además, en la antigua Roma, se utilizaban técnicas de veneno y se conocían ciertos venenos de origen animal, incluidos algunos de herpetos, para diferentes fines. Estos venenos se usaban tanto en el contexto militar como en el civil, por ejemplo, en asesinatos selectivos o envenenamientos.
En general, aunque los romanos no se enfocaron en describir especies de herpetos con fines militares, estaban conscientes de algunas de sus características y propiedades, y pudieron utilizar ese conocimiento en su beneficio en el contexto militar y táctico.
2.7 Edad media
Durante la Edad Media, tanto en Europa como en el mundo islámico, el conocimiento sobre los herpetos, que incluye a los reptiles y anfibios, fue en gran medida influenciado por la tradición greco-romana y las obras de los antiguos filósofos y naturalistas.
En Europa, el conocimiento sobre los herpetos fue en gran medida preservado y desarrollado por los monjes y académicos en los monasterios. Las obras de autores clásicos como Aristóteles, Plinio el Viejo y Galeno se estudiaban y traducían al latín, lo que permitía la difusión y el aprendizaje de las características y propiedades de los herpetos. Aunque el enfoque de la época era más teórico y filosófico que científico, se logró una mayor comprensión de estas criaturas.
Figura 2.8. El camaleón (género Chamaeleonidae) fue objeto de estudio y descripción detallada por parte de filósofos y científicos musulmanes como Al-Jahiz, Ibn Sina (Avicena) y Al-Damiri. Estos estudiosos observaron y describieron las características únicas del camaleón, como su capacidad para cambiar de color, sus ojos móviles y su lengua proyectable. Además de su estudio científico, el camaleón también fue utilizado en la medicina tradicional y en algunas prácticas mágicas. Por ejemplo, se creía que ciertas partes del camaleón tenían propiedades medicinales y se utilizaban para tratar diversas enfermedades.
En el mundo islámico, el conocimiento sobre los herpetos se desarrolló a través de la traducción y el estudio de los textos griegos clásicos. Los sabios islámicos, como Al-Jahiz y Al-Dinawari, realizaron observaciones y recopilaciones de datos sobre la fauna, incluyendo los herpetos. Estos conocimientos se difundieron a través de las traducciones y comentarios árabes, y se incorporaron a los tratados de medicina y zoología.
Las interacciones entre Europa y el mundo islámico también contribuyeron al intercambio de conocimientos sobre los herpetos. Las traducciones árabes de obras griegas y romanas se transmitieron a Europa a través de la influencia de los sabios y traductores árabes en la Península Ibérica y Sicilia. Estas traducciones fueron cruciales para la transmisión y preservación del conocimiento clásico.
Aunque el conocimiento sobre los herpetos en la Edad Media se basaba en gran medida en textos antiguos y observaciones limitadas, sentó las bases para futuros desarrollos científicos en el campo de la herpetología. Fue en el Renacimiento, posterior a la Edad Media, cuando se produjo un resurgimiento del estudio científico de los herpetos y se sentaron las bases para la herpetología moderna.
2.8 Civilizaciones americanas
Las civilizaciones americanas, como los mayas, aztecas e incas, tenían un conocimiento notable en herpetología y reconocían la importancia de los herpetos en sus culturas y sociedades. Estas civilizaciones desarrollaron observaciones detalladas de las especies locales y sus comportamientos, y utilizaron su conocimiento para diversos propósitos.
Por ejemplo, los mayas consideraban a los serpientes, como la serpiente de cascabel (Crotalus spp.), como seres sagrados y los asociaban con la fertilidad y el poder divino. Los aztecas también veneraban a los herpetos, y se sabe que criaban y utilizaban diversas especies, incluyendo ranas y ajolotes, en rituales religiosos y prácticas medicinales.
Figura 2.9. La especie de Crotalus (serpiente de cascabel) mejor descrita por las antiguas civilizaciones americanas es el Crotalus atrox. Esta serpiente de cascabel, también conocida como cascabel occidental, es nativa de América del Norte y ha sido venerada y estudiada por diversas culturas indígenas. Los antiguos americanos reconocieron las características distintivas del Crotalus atrox, como su cuerpo robusto, su cabeza triangular y su característico cascabel en la punta de la cola. Estas serpientes son conocidas por su veneno potente y su capacidad para advertir a los depredadores y a los seres humanos de su presencia a través de un sonido característico cuando agitan su cola. Las civilizaciones americanas valoraban y respetaban al Crotalus atrox, atribuyéndole cualidades sagradas y divinas. Estas serpientes eran consideradas guardianas y protectoras, pero también se les temía debido a la potencia de su veneno. La descripción y el conocimiento del Crotalus atrox por parte de las antiguas civilizaciones americanas sentaron las bases para futuros estudios científicos de las serpientes de cascabel. Su importancia cultural y su presencia en las tradiciones indígenas continúan hasta el día de hoy, mientras que la investigación científica moderna ha profundizado nuestro conocimiento sobre su biología, comportamiento y veneno.
La influencia de los conocimientos herpetológicos de las civilizaciones americanas en las expediciones botánicas posteriores fue significativa. Cuando los exploradores europeos llegaron al continente americano, se encontraron con una diversidad asombrosa de especies de herpetos desconocidas para ellos. A través del contacto con las culturas indígenas y la recopilación de especímenes, los naturalistas europeos comenzaron a documentar y estudiar estas nuevas especies.
Las expediciones botánicas que exploraron América, como la expedición de Alexander von Humboldt en el siglo XIX, llevaron a cabo estudios rigurosos de la flora y fauna, incluyendo herpetos. Los naturalistas recopilaron muestras, describieron nuevas especies y llevaron a cabo investigaciones científicas sobre su anatomía, comportamiento y hábitats. Estas expediciones sentaron las bases para el conocimiento moderno en herpetología y contribuyeron al desarrollo de la disciplina.
2.9 Renacimiento
Durante el Renacimiento, hubo un gran avance en el conocimiento en el campo de la herpetología debido a varios factores, como el descubrimiento de América, la apertura de nuevas rutas a Asia, el establecimiento de colonias de imperios y las expediciones botánicas y científicas alrededor del mundo.
El descubrimiento de América y la exploración de nuevas tierras permitieron a los científicos europeos entrar en contacto con una gran diversidad de especies de herpetos desconocidas hasta entonces. Las expediciones lideradas por exploradores como Cristóbal Colón y Hernán Cortés llevaron a Europa descripciones y ejemplares de serpientes, ranas y lagartos que eran completamente desconocidos en el Viejo Mundo.
Además, el establecimiento de colonias y el comercio marítimo a través de nuevas rutas permitieron el intercambio de conocimientos y especímenes entre diferentes regiones. Los naturalistas y científicos pudieron estudiar y describir especies de herpetos de distintas partes del mundo, ampliando así su comprensión de la diversidad de estos animales.
Figura 2.10. Durante el Renacimiento, una de las especies de herpetos que se consideraba más extraña por parte de los naturalistas fue el ajolote (Ambystoma mexicanum). Este peculiar anfibio acuático, nativo de México, capturó la atención y la curiosidad de los científicos europeos. El ajolote posee una apariencia única, con una cabeza ancha y plana, branquias externas y extremidades en forma de paletas. Lo que lo hacía particularmente extraño para los naturalistas del Renacimiento era su capacidad de regeneración extraordinaria. El ajolote tiene la capacidad de regenerar partes de su cuerpo, incluyendo extremidades, órganos internos e incluso el cerebro. Además de su capacidad de regeneración, el ajolote también presentaba una forma de desarrollo conocida como neotenia, en la cual retiene características juveniles incluso en su etapa adulta. Esto significaba que el ajolote mantenía sus branquias y permanecía en un estado acuático, a diferencia de otros anfibios que experimentan metamorfosis y se convierten en formas terrestres.
Las expediciones botánicas y científicas también jugaron un papel crucial en el avance de la herpetología durante el Renacimiento. Científicos y naturalistas, como Alexander von Humboldt, realizaron viajes de exploración y recolectaron numerosos especímenes de herpetos. Estas expediciones proporcionaron una gran cantidad de información sobre la distribución geográfica, la anatomía y el comportamiento de las especies de herpetos.
2.10 Modernidad
Desde el siglo XIX hasta la actualidad, la herpetología ha experimentado un notable desarrollo y crecimiento como disciplina científica. Durante este período, se han realizado avances significativos en el estudio de reptiles y anfibios, tanto en términos de taxonomía y sistemática, como en la comprensión de su biología, ecología y conservación.
En el siglo XIX, científicos como Charles Darwin, y Alfred Russel Wallace realizaron expediciones y estudios que contribuyeron al conocimiento de los herpetos. Sus investigaciones sentaron las bases para el desarrollo de la teoría de la evolución y proporcionaron valiosa información sobre la distribución geográfica y la diversidad de las especies de reptiles y anfibios.
A lo largo del siglo XX, se produjeron avances importantes en la herpetología. Destacados científicos como Raymond Ditmars, Karl P. Schmidt, Edward O. Wilson y Albert Günther realizaron investigaciones pioneras sobre reptiles y anfibios, publicando estudios detallados sobre su clasificación, anatomía, comportamiento y ecología.
En el campo de la herpetología moderna, los científicos han desarrollado técnicas avanzadas para el estudio de los herpetos. Esto incluye el uso de la genética molecular para investigar las relaciones evolutivas entre especies y la aplicación de tecnología de vanguardia, como el seguimiento por satélite, para estudiar los patrones de movimiento y migración de reptiles y anfibios.
Algunos de los científicos más destacados en la herpetología contemporánea incluyen a James R. Dixon, David B. Wake, Harry W. Greene, Laurie J. Vitt, Martha Crump y Bryan G. Fry, entre otros. Estos investigadores han realizado contribuciones significativas al conocimiento de la diversidad, biología, comportamiento y conservación de los herpetos.
2.11 Influencia
La herpetología ha influido de manera significativa en el desarrollo de grandes teorías biológicas, como la evolución, la genética, la biogeografía, la etología y otras ramas de la biología teórica. Estas contribuciones se deben a los estudios detallados realizados en reptiles y anfibios, que han proporcionado valiosa información para comprender los procesos biológicos y los patrones observados en la naturaleza.
En relación a la teoría de la evolución, los estudios en herpetología han proporcionado evidencia crucial para apoyar esta teoría. Los reptiles y anfibios han sido utilizados como modelos para estudiar la adaptación, la especiación y los procesos de selección natural. Además, la diversidad y distribución de las especies de herpetos han ayudado a los científicos a comprender los patrones evolutivos y la historia de la vida en la Tierra.
La genética también ha sido una rama de la biología que se ha beneficiado de los estudios en herpetología. Las investigaciones sobre la variabilidad genética, los patrones de herencia y la genética de poblaciones en reptiles y anfibios han proporcionado información valiosa sobre la evolución molecular y la diversidad genética de estas especies.
En términos de biogeografía, los estudios en herpetología han contribuido a comprender los patrones de distribución de los reptiles y anfibios en diferentes regiones del mundo. Estos patrones de distribución han ayudado a los científicos a inferir procesos históricos, como la colonización de áreas geográficas y la formación de barreras que limitan la dispersión de especies.
La etología, el estudio del comportamiento animal, también se ha beneficiado de la investigación en herpetología. Los estudios sobre el comportamiento de los reptiles y anfibios han revelado aspectos interesantes de la comunicación, la reproducción, el cuidado parental y la interacción con el entorno. Estos hallazgos han contribuido a la comprensión general de los mecanismos del comportamiento animal y han proporcionado información relevante para el estudio comparativo del comportamiento en otras especies.
2.12 Importancia
El adecuado conocimiento de la biodiversidad de herpetos puede tener varios beneficios económicos. Aquí hay algunos ejemplos:
Muchas regiones del mundo albergan una gran diversidad de herpetos, algunos de los cuales son endémicos y raros. Estos sitios se convierten en destinos atractivos para el ecoturismo y el turismo de observación de la vida silvestre. Los turistas interesados en la herpetología pueden visitar estas áreas para ver y aprender sobre las especies de reptiles y anfibios, lo que genera ingresos para las comunidades locales a través de servicios turísticos, alojamiento y actividades relacionadas.
Figura 2.11. El dragón barbudo (Pogona vitticeps) es un lagarto fascinante y popular originario de Australia. Su cuerpo está cubierto de escamas de colores vivos y patrones llamativos. Su cabeza triangular cuenta con pequeñas espinas en forma de púas, y posee una barba que puede expandir y oscurecer para mostrar agresión o emoción. Su tamaño varía entre 30 y 60 centímetros de longitud, con una cola larga y afilada. Una de las características distintivas del dragón barbudo son sus colores vibrantes, que pueden incluir tonos de naranja, marrón, amarillo y verde. Estos colores pueden variar y mezclarse en patrones únicos en cada individuo. Además, tienen una expresión facial encantadora y ojos redondos y brillantes. Estos lagartos son conocidos por su comportamiento tranquilo y su capacidad para interactuar con sus dueños. Son omnívoros, se alimentan de una variedad de alimentos, como insectos, vegetales y frutas. El dragón barbudo es una especie cautivadora, tanto por su apariencia impresionante como por su personalidad dócil, lo que lo convierte en una mascota popular entre los entusiastas de los reptiles.
Algunas especies de herpetos son populares como mascotas exóticas en el comercio de animales. Un adecuado conocimiento de la biodiversidad de herpetos permite una gestión sostenible del comercio de estas especies, evitando la sobreexplotación y el tráfico ilegal. Esto puede generar ingresos legales y regulados para criadores, tiendas de mascotas y exportadores.
Los herpetos, como reptiles y anfibios, han sido fuente de importantes descubrimientos científicos y médicos. El estudio de sus venenos, secreciones cutáneas y propiedades bioquímicas ha llevado al desarrollo de medicamentos y productos farmacéuticos. Un adecuado conocimiento de la biodiversidad de herpetos permite identificar especies prometedoras para la investigación y el desarrollo de nuevos fármacos, lo que puede tener beneficios económicos considerables en la industria farmacéutica.
Algunas especies de reptiles y anfibios tienen dietas que incluyen insectos y roedores, que son considerados plagas en la agricultura y en entornos urbanos. El conocimiento de estas especies y su papel en el control de plagas puede ser utilizado para implementar estrategias de manejo integrado de plagas, reduciendo así el uso de pesticidas químicos y generando ahorros económicos en el control de plagas.
Estos son solo algunos ejemplos de los beneficios económicos que se pueden obtener del adecuado conocimiento de la biodiversidad de herpetos. Es importante destacar que estos beneficios están ligados a una gestión responsable y sostenible de las especies, asegurando su conservación y evitando prácticas que puedan ser perjudiciales para su supervivencia y el equilibrio de los ecosistemas.
El conocimiento sobre herpetología es de gran importancia para Colombia debido a su rica biodiversidad y alta concentración de especies de reptiles y anfibios. Colombia es considerada una potencia en el estudio de herpetología por varias razones:
(a) Diversidad de especies: Colombia alberga una de las mayores diversidades de herpetos en el mundo, con más de 800 especies registradas. Esto incluye una gran variedad de serpientes, lagartos, tortugas y anfibios. El estudio de estas especies permite comprender su ecología, comportamiento, distribución y conservación.
(b) Endemismo: Colombia es reconocida por tener numerosas especies endémicas, es decir, especies que se encuentran exclusivamente en su territorio. Estas especies son únicas y representan un valor científico y de conservación significativo. El estudio de la herpetofauna colombiana contribuye a la identificación y protección de estas especies endémicas.
(c) Ecosistemas diversos: Colombia posee una amplia gama de ecosistemas, desde selvas tropicales y páramos hasta manglares y bosques secos. Cada uno de estos ecosistemas alberga una comunidad única de herpetos adaptados a condiciones específicas. El estudio de estos ecosistemas y su herpetofauna brinda información clave para la conservación y el manejo de estos hábitats.
(d) Investigación científica y conservación: El conocimiento en herpetología es esencial para desarrollar estrategias efectivas de conservación de especies y ecosistemas. La investigación en esta área proporciona información valiosa sobre la distribución geográfica de especies, su estado de conservación, amenazas que enfrentan y medidas de manejo adecuadas. Esto contribuye a la protección de la biodiversidad y el desarrollo sostenible del país.
En resumen, el conocimiento sobre herpetología en Colombia es de gran importancia debido a su rica biodiversidad, la presencia de especies endémicas y la diversidad de ecosistemas. Esto ha llevado a que Colombia sea reconocida como una potencia en el estudio de los herpetos, lo que implica una responsabilidad y oportunidad para la conservación de su invaluable patrimonio natural.
3. El ciclo de vida de los anfibios
3. El ciclo de vida de los anfibios
Las historias de vida de la mayoría de los anfibios consisten en estadios de huevo, larva, juvenil y adulto. Debido a los distintos cambios morfológicos, fisiológicos y de comportamiento que ocurren durante la metamorfosis y el cambio en el hábitat entre las etapas larvales y juveniles, los ciclos de vida de los anfibios son complejos. En especies con desarrollo directo, la etapa larvaria está ausente. En algunas especies, los individuos con morfología larvaria se vuelven sexualmente maduros y se reproducen, y la morfología adulta "típica" nunca se logra. Otras variaciones interesantes en las historias de vida de los anfibios también ocurren. Los estudios de historia de vida de los anfibios se han concentrado ya sea en la dinámica de las larvas, que son relativamente sedentarias y constituyen una etapa de crecimiento primario, o en adultos, que son relativamente móviles y son la etapa de dispersión y reproducción. Además, numerosos estudios experimentales se han centrado en las larvas porque el período larvario probablemente regula el tamaño de la población de anfibios.
3.1 Cecilias
No existen estudios de historia de vida a largo plazo sobre las cecilias. En comparación con otros anfibios, producen garras relativamente pequeñas de huevos grandes o pequeñas crías de crías grandes. No sorprendería que la mayoría de las especies tengan una latematización y una vida prolongada, pero se necesitan estudios a largo plazo para determinar esto, y los hábitos secretos de los cecilianos han impedido tales estudios. Sin embargo, un estudios sobre Ichthyophis kohtaoensis en el valle del Mekong, en el noreste de Tailandia, demuestra que incluso las especies más cyptozoicas pueden estudiarse si se desarrollan las técnicas adecuadas (Kupfer, Nabhitabhata, & Himstedt, 2005).
Figura 3.1. El gimnofionte (Ichthyophis kohtaoensis) es una cecilia típica, que en general parecen culebritas. Ichthyophis kohtaoensis es una especie de anfibio caeciliado que se encuentra en Tailandia. Tiene un cuerpo alargado y cilíndrico, sin patas y con una piel lisa y brillante. Su coloración varía entre tonos de marrón oscuro o negro. Alcanza una longitud de aproximadamente 50 centímetros. Esta especie habita en bosques tropicales y se encuentra principalmente en áreas montañosas. Se alimenta principalmente de pequeños invertebrados que captura utilizando su lengua pegajosa. La reproducción en Ichthyophis kohtaoensis es vivípara, lo que significa que da a luz crías vivas en lugar de poner huevos. Esta especie juega un papel importante en el ecosistema al contribuir a la regulación de las poblaciones de invertebrados y actuar como indicador de la salud del hábitat acuático.
Estas cecilias se aparean y depositan huevos al comienzo de la temporada de monzones. Los nidos se depositan en forma terrestre y las hembras permanecen con los huevos hasta que nacen durante el pico o cerca del final de la temporada de lluvias. Las larvas son acuáticas y se convierten en terrestres cuando se transforman en juveniles al final de la estación seca. Los juveniles y adultos terrestres viven en una variedad de hábitats donde pasan la mayor parte del tiempo en el suelo (estación seca) o debajo de la hojarasca y la vegetación en descomposición (estación húmeda). Según las distribuciones de tamaño, parecen alcanzar la madurez sexual en 3 años. Sus densidades son bajas, con solo alrededor de 0.08 individuos por metro cuadrado. Los cecilianos en general tienen historias de vida potencialmente diversas e interesantes, y debido a que viven ya sea en el suelo o en el agua, es necesario un mayor entendimiento de sus historias de vida para determinar los impactos de la actividad humana en estos anfibios esquivos.
3.2 Salamandras
Las características de la historia de vida varían enormemente entre las especies de salamandras.
Figura 3.2. Etapas de la vida de la salamandra manchada, Ambystoma maculatum: (a) embrionaria, (b) larva/renacuajo; (c) metamorfosis; (d) adulto. La longitud total es desde la punta del hocico hasta la punta de la cola.
Figura 3.3. Ambystoma maculatum, comúnmente conocido como salamandra manchada o salamandra moteada, es una especie de anfibio que se encuentra en América del Norte. Tiene un cuerpo alargado y una cola larga, y puede alcanzar una longitud de hasta 23 centímetros. Su coloración varía, pero generalmente presenta un fondo negro o marrón oscuro con manchas amarillas, naranjas o rojas en su cuerpo y cola. Estas manchas pueden ser irregulares y variadas en tamaño. La salamandra manchada es semiacuática y se encuentra en una variedad de hábitats acuáticos y terrestres, como bosques, pantanos y estanques. Se alimenta de una dieta variada que incluye insectos, lombrices y pequeños invertebrados acuáticos. Esta especie es conocida por su capacidad de regenerar partes de su cuerpo, como extremidades y cola, si se dañan o amputan.
Entre las especies con larvas acuáticas, las salamandras difieren de las ranas en que la morfología de las larvas es similar a la de los adultos, excepto que las branquias están presentes y las extremidades pueden estar menos desarrolladas que en los adultos.
3.3 Las ranas y sapos
Las ranas exhiben la mayor diversidad en las historias de vida entre los vertebrados tetrápodos. Entre las especies con larvas acuáticas, la morfología larvaria es completamente diferente de la del adulto. La morfología de la larva cambia a la morfología del adulto como consecuencia de una metamorfosis importante durante la cual la cola se reabsorbe, las piezas bucales de la larva son reemplazadas por partes bucales adultas, las extremidades delanteras y posteriores emergen del cuerpo, y los cambios más importantes se producen en la fisiología y morfología del sistema digestivo. En especies con desarrollo directo, las crías son casi idénticas morfológicamente a las de los adultos, pero mucho más pequeñas en tamaño corporal.
Figura 3.4. Rana toro Lithobates catesbeianus y su renacuajo. Lithobates catesbeianus, comúnmente conocida como rana toro o rana de patas de sapo, es una especie de anfibio que se originó en América del Norte y se ha introducido en muchas partes del mundo. Es una de las ranas más grandes, con hembras que pueden alcanzar una longitud de hasta 20 centímetros. Su cuerpo es robusto y su piel es lisa, generalmente de color verde oliva o marrón, con manchas oscuras. Posee patas traseras musculosas adaptadas para saltar y nadar. Las ranas toro son conocidas por su distintivo llamado enérgico y profundo. Son carnívoras y se alimentan de una variedad de presas, como insectos, peces, anfibios más pequeños y pequeños roedores. Debido a su habilidad para adaptarse a diferentes ambientes acuáticos y terrestres, las ranas toro han logrado establecerse en muchas regiones, a menudo causando impactos negativos en las especies nativas.
La complejidad de las historias de vida de los anfibios es evidente a través de los factores que influyen en la supervivencia en cada etapa. Los huevos de anfibios experimentan mortalidad por desecación debido al secado de los sitios de deposición de huevos y la depredación por insectos, peces, reptiles, aves e incluso otros anfibios. Los anfibios de reproducción terrestre y aquellos que colocan sus huevos en la vegetación sobre el agua han eliminado las fuentes de mortalidad de huevos asociadas con el hábitat acuático. La supervivencia de los huevos de rana toro (Lithobates catesbeianus), por ejemplo, varía de 10 a 100%; la depredación por las sanguijuelas y las anomalías del desarrollo son las principales fuentes de mortalidad. La calidad del territorio masculino parece ser el principal determinante de la supervivencia del huevo en estas ranas. En ranas leñosas (Lithobates sylvaticus), la supervivencia de los huevos es extremadamente alta (96.6%).
Las larvas de anfibios experimentan algunas de las mismas fuentes de mortalidad, pero debido a su movilidad, altas tasas de crecimiento y, en algunos casos, la producción de sustancias químicas nocivas para la defensa, son capaces de compensar alguna mortalidad. Las larvas de anfibios de muchas especies son capaces de un rápido crecimiento como resultado de su capacidad para responder a los rápidos aumentos en la disponibilidad de alimentos que típicamente ocurren en los sitios de reproducción. Para las larvas, el ambiente cambia rápidamente de uno en el que los recursos son abundantes y los depredadores escasean justo después del llenado de los estanques, a entornos ricos en depredadores (en su mayoría insectos acuáticos) y relativamente bajos en recursos a medida que aumenta la densidad de las larvas. Las larvas más grandes son menos susceptibles a la depredación y la metamorfosis en un tamaño corporal mayor. Las tasas de supervivencia de las larvas varían considerablemente. Los renacuajos de la rana toro (Lithobates catesbeianus) en Kentucky tienen una tasa de supervivencia que varía entre el 11.8 y el 17.6% entre los estanques.
Figura 3.5. Ambystoma talpoideum, conocida como la salamandra topo, es una especie de anfibio que se encuentra en el sureste de los Estados Unidos. Tiene un cuerpo robusto y alargado, con una longitud promedio de 13 centímetros. Su piel es lisa y de color gris oscuro o negro, con algunas manchas pálidas dispersas. La salamandra topo tiene patas fuertes y adaptadas para excavar, lo que le permite vivir en hábitats subterráneos, como su nombre sugiere. Esta especie es principalmente terrestre y rara vez se encuentra en el agua. Se alimenta de pequeños invertebrados subterráneos, como lombrices y larvas de insectos. La reproducción ocurre en el agua, donde las hembras depositan sus huevos. La salamandra topo desempeña un papel importante en el equilibrio ecológico, controlando las poblaciones de invertebrados subterráneos y sirviendo como presa para otros animales.
En la salamandra Ambystoma talpoideum, la supervivencia a la metamorfosis varía entre los estanques y entre los años dentro de los estanques en particular. En un estanque en Carolina del Sur, ninguna larva se metamorfoseó en un período de 4 años. En otro estanque, la supervivencia varió de 0.01% a 4.09% durante un período de 6 años. La cantidad de tiempo que los estanques retuvieron el agua (hidroperíodo) representó gran parte de la variación en la supervivencia larvaria.
La etapa juvenil también es una etapa de rápido crecimiento, y debido a que los anfibios recientemente metamorfoseados carecen de experiencia en su nuevo entorno, la mortalidad por depredación es probablemente alta. Los adultos experimentados probablemente enfrentan su mayor amenaza de mortalidad durante los eventos de reproducción. Las densidades altas y localizadas de anfibios durante la reproducción brindan oportunidades que no existen durante gran parte del año para los depredadores. En algunas especies de ranas, las vocalizaciones masculinas en realidad atraen a los depredadores.
4. Sistema reproductor de los anfibios
4. Sistema reproductor de los anfibios
Los anfibios se reproducen sexualmente con fertilización externa o interna. Atraen a los compañeros en una variedad de formas. Por ejemplo, el croar fuerte de las ranas es su llamada de apareamiento. Cada especie de rana tiene su propio llamado distintivo que otros miembros de la especie reconocen como propio. La mayoría de las salamandras usan su sentido del olfato para encontrar pareja. Los machos producen un olor químico que atrae a las hembras de la especie.
Para el propósito de la reproducción, la mayoría de los anfibios requieren agua fresca, aunque algunos ponen sus huevos en la tierra y han desarrollado varios medios para mantenerlos húmedos. Algunos (por ejemplo, Fejervarya raja) pueden habitar aguas salobres, pero no hay verdaderos anfibios marinos (Hopkins & Brodie Jr, 2015). Hay informes, sin embargo, de poblaciones de anfibios particulares que invaden inesperadamente las aguas marinas. Tal fue el caso de la invasión del híbrido natural Pelophylax esculentus en el Mar Negro reportada en 2010 (Natchev, Tzankov, & Gemel, 2011).
Figura 4.1. Pelophylax esculentus, conocida como la rana comestible o rana verde común, es una especie de anfibio que se encuentra en diversas regiones de Europa. Es una especie híbrida resultante del cruce entre la rana verde (Pelophylax ridibundus) y la rana bermeja (Pelophylax lessonae). Tiene un cuerpo robusto y alargado, con una longitud promedio de 7 a 9 centímetros. Su coloración varía, pero generalmente es de tonos verdes o marrones, con manchas oscuras y barras en las patas traseras. Esta rana es semiacuática y se encuentra en una variedad de hábitats acuáticos y terrestres, como estanques, ríos y humedales. Se alimenta principalmente de insectos, lombrices y otros invertebrados acuáticos. La rana comestible es apreciada por su carne en algunas culturas, aunque su consumo está regulado en muchos países debido a preocupaciones de conservación.
4.1 Comportamientos copulatorios
Sin embargo, varios cientos de especies de ranas en las radiaciones adaptativas no necesitan agua para reproducirse en la naturaleza. Se reproducen a través del desarrollo directo, una adaptación ecológica y evolutiva que les ha permitido ser completamente independientes del agua. Casi todas estas ranas viven en bosques húmedos tropicales y sus huevos se incuban directamente en versiones en miniatura del adulto, pasando a través de la etapa de renacuajo dentro del huevo (Callery, Fang, & Elinson, 2001).
En los trópicos, muchos anfibios se reproducen continuamente o en cualquier época del año. En las regiones templadas, la reproducción es mayormente estacional, generalmente en la primavera, y se desencadena al aumentar la duración del día, el aumento de la temperatura o la precipitación. Los experimentos han demostrado la importancia de la temperatura, pero el evento desencadenante, especialmente en regiones áridas, suele ser una tormenta. En los anuros, los machos suelen llegar a los sitios de reproducción antes que las hembras y el coro vocal que producen puede estimular la ovulación en las hembras y la actividad endocrina de los machos que aún no son reproductivamente activos (Callery et al., 2001).
En las cecilias, la fecundación es interna, el macho extruye un órgano intromitente, el falodo, y lo inserta en la cloaca hembra. Las glándulas müllerianas emparejadas dentro de la cloaca masculina secretan un fluido que se asemeja al producido por las glándulas prostáticas de los mamíferos y que puede transportar y nutrir el esperma. La fertilización probablemente tenga lugar en el oviducto (Duellman & Trueb, 1994).
La mayoría de las salamandras también participan en la fertilización interna. En la mayoría de estos, el macho deposita un espermatóforo, un pequeño paquete de esperma sobre un cono gelatinoso, sobre el sustrato, ya sea en tierra o en el agua. La hembra toma el paquete de esperma sujetándolo con los labios de la cloaca y empujándolo hacia el respiradero. Los espermatozoides se mueven a la espermateca en el techo de la cloaca, donde permanecen hasta la ovulación, lo que puede ocurrir muchos meses después. Los rituales de cortejo y los métodos de transferencia del espermatóforo varían entre las especies. En algunos, el espermatóforo puede colocarse directamente en la cloaca femenina, mientras que, en otros, la hembra puede guiarse hacia el espermatóforo o restringirse con un abrazo llamado amplexus. Ciertas salamandras primitivas en las familias Sirenidae spp., Hynobiidae spp., y Cryptobranchidae spp., practican la fertilización externa de manera similar a las ranas, con la hembra poniendo los huevos en agua y el macho liberando esperma sobre la masa del huevo (Duellman & Trueb, 1994).
Figura 4.2. Epipedobates tricolor, también conocida como rana venenosa tricolor o rana dardo tricolor, es una especie de rana venenosa que se encuentra en América del Sur, específicamente en la región amazónica de Ecuador, Colombia y Perú. Esta pequeña rana alcanza una longitud de aproximadamente 2 a 3 centímetros. Su coloración distintiva varía, pero generalmente presenta un fondo negro o marrón oscuro con manchas y bandas de colores brillantes, como el amarillo, el naranja y el azul claro. Estas vibrantes marcas funcionan como advertencia de su toxicidad para posibles depredadores. La rana venenosa tricolor es terrestre y se encuentra en bosques tropicales y húmedos. Su dieta se compone principalmente de pequeños invertebrados. Esta especie es conocida por su potente veneno, utilizado como mecanismo de defensa. Su belleza y toxicidad la convierten en una especie fascinante para los amantes de los anfibios.
Con algunas excepciones, las ranas usan la fertilización externa. El macho agarra a la hembra con sus extremidades anteriores, ya sea detrás de los brazos o delante de las patas traseras, o en el caso de Epipedobates tricolor, alrededor del cuello. Permanecen en amplexus con sus cloacas colocadas juntas mientras que la hembra pone los huevos y el macho los cubre con esperma. Las almohadillas nupciales rugosas en las manos del macho ayudan a retener el agarre. A menudo, el macho recoge y retiene la masa del huevo, formando una especie de cesta con las patas traseras. Una excepción es la rana venenosa granular (Oophaga granulifera) donde el macho y la hembra colocan sus cloacas muy cerca mientras se enfrentan en direcciones opuestas y luego liberan huevos y esperma simultáneamente. La rana de cola (Ascaphus truei) exhibe fertilización interna. La "cola" solo es poseída por el macho y es una extensión de la cloaca y se usa para inseminar a la hembra. Esta rana vive en arroyos de flujo rápido y la fertilización interna evita que el esperma se elimine antes de que ocurra la fertilización (Duellman & Trueb, 1994). Los espermatozoides se pueden retener en tubos de almacenamiento unidos al oviducto hasta la primavera siguiente (Daugherty & Sheldon, 1982).
Figura 4.3. Ascaphus truei, conocida como la rana de vientre de fuego o rana acuática con cola, es una especie de rana que se encuentra en la región del Pacífico noroeste de América del Norte, específicamente en áreas montañosas de Columbia Británica, Canadá, y los estados de Washington y Oregón en Estados Unidos. Es una rana de tamaño mediano, con los machos alcanzando una longitud de alrededor de 6 centímetros y las hembras siendo un poco más grandes. Lo que distingue a esta especie es su cola, que es única entre las ranas y está adaptada para la reproducción. La rana de vientre de fuego vive en arroyos de agua fría y rápida, donde se alimenta principalmente de pequeños invertebrados acuáticos. Es conocida por su canto distintivo, que suena como un chasquido rápido. Su nombre se debe a la coloración roja o naranja brillante que presenta en su vientre. Esta especie es considerada un indicador de la calidad del agua y juega un papel importante en los ecosistemas acuáticos en los que habita.
La mayoría de las ranas se pueden clasificar como criadores prolongados o explosivos. Por lo general, los criadores prolongados se congregan en un sitio de reproducción, los machos suelen llegar primero, llamando y estableciendo territorios. Otros machos satélites permanecen en silencio cerca, esperando su oportunidad de apoderarse de un territorio. Las hembras llegan esporádicamente, se realiza la selección de pareja y se ponen los huevos. Las hembras parten y los territorios pueden cambiar de manos. Aparecen más hembras y, a su debido tiempo, la temporada de cría llega a su fin. Por otro lado, los criadores de explosivos se encuentran donde aparecen piscinas temporales en regiones secas después de la lluvia. Estas ranas son típicamente especies fosforiales que emergen después de fuertes lluvias y se congregan en un sitio de reproducción. Se sienten atraídos por el llamado del primer macho a encontrar un lugar adecuado, tal vez una piscina que se forme en el mismo lugar cada temporada de lluvias. Las ranas reunidas pueden llamar al unísono y se produce una actividad frenética, los machos luchan para aparearse con el número generalmente más pequeño de hembras.
Figura 4.4. Vista ventral de los tractos reproductivos de una hembra (izquierda) y macho (derecha) de un anfibio idealizado.
4.2 Sistema reproductor
En los anfibios y reptiles, las gónadas femeninas y masculinas (ovarios y testículos, respectivamente) se desarrollan a partir de los mismos órganos embrionarios. Los órganos indiferenciados surgen en la pared del cuerpo entre la mitad de los riñones. Las células germinales o gametos migran hacia cada órgano e inician la reorganización y consolidación del tejido pregonadal en una corteza externa y una médula interna. Más tarde, cuando se produce la diferenciación sexual, la corteza se transforma en un ovario en las hembras y la médula en un testículo en los machos.
Estructuralmente, las gónadas masculinas y femeninas son bastante diferentes. El ovario es un saco de pared delgada con células germinales intercaladas entre las paredes ovárica interna y externa. Las células germinales se dividen, se duplican y producen óvulos. Una sola capa de células foliculares en el epitelio de la pared ovárica encierra cada óvulo, proporcionando apoyo y nutrición. Esta unidad, el folículo, que consiste en las células del óvulo y el folículo, crece hacia la luz del ovario. Numerosos folículos en desarrollo forman la porción visible de los ovarios en hembras grávidas. El testículo es una masa de túbulos seminíferos enroscados y encerrados en un saco de pared delgada. Pequeñas cantidades de tejido intersticial llenan los espacios entre los túbulos.
Figura 4.5. Sistemas reproductores de sapos y ranas.
4.3 Sistema reproductor femenino
Los oviductos (conductos de Müller) son tubos pareados, uno a cada lado de la pared dorsal del cuerpo, lateral a cada ovario. Cada una de ellas surge de novo como un pliegue del peritoneo o, en salamandras, por una división del conducto arquínefrico. El extremo anterior del oviducto permanece abierto como un ostium; los óvulos se depositan en la cavidad del cuerpo y se mueven hacia y a través del ostium hacia el oviducto. La parte posterior del oviducto se expande en un ovisaco, que se vacía en la cloaca. Después de la ovulación, los huevos permanecen brevemente en el ovisaco antes del amplexus y la puesta de huevos. Los oviductos se forman tanto en machos como en hembras, degenerando, aunque no desaparecen en muchos anfibios machos, donde este conducto no funcional se llama ducto de Bidder. De manera similar, algunos machos retienen una parte de la corteza gonadal unida al extremo anterior del testículo. Esta estructura, común en los bufónidos, es el órgano de Bidder.
4.4 Sistema reproductor masculino
En los anfibios machos, pueden ocurrir varias configuraciones de conductos genitales. En Necturus y otras especies, los conductos arquinéfricos transportan esperma de los testículos y orina de los riñones uriníferos. Sin embargo, esta es probablemente una condición especializada de Necturus paedomorfo. En general, esta condición se produce solo en salamandras larvales. En algunas familias de salamandras, los nuevos conductos urinarios accesorios sirven a los riñones caudales, y los espermatozoides son transportados desde los testículos a través de pequeños conductos en los riñones craneales a los conductos arquinéfricos (conducto deferente) para ser almacenado.
Figura 4.6. Necturus paedomorphus, conocido como el tritón acuático paedomorfo, es una especie de salamandra acuática que se encuentra en América del Norte. Es especialmente notable por su forma paedomórfica, lo que significa que retiene características juveniles en su estado adulto. Tiene un cuerpo alargado, con una longitud promedio de 20 a 30 centímetros, y una piel lisa y viscosa de color marrón oscuro. Sus patas son pequeñas y están adaptadas para nadar en lugar de caminar en tierra. Los tritones acuáticos paedomorfos conservan características juveniles como branquias externas, lo que les permite respirar bajo el agua. Estos tritones se encuentran en arroyos, lagos y pantanos de agua dulce, donde se alimentan de insectos acuáticos, crustáceos y pequeños peces. Su estado paedomórfico les brinda una estrategia única para sobrevivir y reproducirse en el medio acuático.
En todas las ranas y algunas especies de salamandras, los conductos diminutos que llegan directamente desde los testículos hasta los conductos arquinétricos evitan la parte anterior de los riñones. La eliminación de los riñones uriníferos se produce exclusivamente a través de los conductos urinarios accesorios. Así, en algún adulto anfibio, los conductos arquinéfricos pueden tener papeles reproductivos y excretores, mientras que, en otras especies, estos conductos pueden estar involucrados exclusivamente en el transporte de esperma y los nuevos conductos urinarios accesorios pueden drenar los opistonefros.
En los anfibios, los espermatozoides se acumulan en el lumen de los túbulos seminíferos y luego se mueven secuencialmente a través de conductos colectores progresivamente más grandes hacia los conductos colectores del riñón antes de vaciarse en el conducto arquinéfrico. Debido a su doble función en el transporte de orina y espermatozoides, el conducto arquinéfrico se denomina conducto urogenital o wolffiano.
5. Metamorfosis de los anfibios modernos
5. Metamorfosis de los anfibios modernos
La metamorfosis no se produce en reptiles. La metamorfosis en los anfibios es la transformación de la larva “renacuajo” en una réplica en miniatura de un adulto, y generalmente de un estilo de vida acuático a uno terrestre o semi-terrestre. La metamorfosis marca el comienzo del fin de la vida larvaria. Una vez iniciada, la metamorfosis generalmente avanza rápidamente, lo que reduce la exposición de los anfibios en metamorfosis a la depredación u otras tensiones potenciales cuando no es totalmente acuático ni totalmente terrestre.
Figura 5.1. La metamorfosis en los vertebrados. La metamorfosis está muy extendida en el mundo animal. (A) Un árbol filogenético simplificado de cordados en relación con otros animales, destacando los grupos de cordados que se sabe que sufren metamorfosis y para los cuales se ha establecido un vínculo con las hormonas tiroideas (en un recuadro en amarillo). Tenga en cuenta que todos los otros filos de metazoos representados en el árbol contienen muchas especies en metamorfosis. (B) Algunas larvas y adultos de metamorfosis de vertebrados. Los números se refieren a los paneles de larvas, los números romanos a los paneles de adultos. 1 / i: El renacuajo y un adulto del modelo principal para el estudio de la metamorfosis de vertebrados, el anurano Xenopus laevis. 2 / ii: El renacuajo y el adulto de Ciona intestinalis, un urocordado. 3 / iii: Larvas y adultos de amphioxus; Las larvas son asimétricas y la boca, en el lado izquierdo del cuerpo, no es visible en la foto. 4 / iv: Larvas y adulto de la lamprea; La larva, también llamada ammocete, es un P. marimus, el adulto es un L. fluviatilis. 5 / v: ambistomátides salamandras (el pedomorfo A. mexicanum en 5, y A. californiense en v). 6 / vi: larvas simétricas y adulto asimétrico de un pez plano, la suela (Solea sp.); 7 / vii: Un juvenil de ocho días posterior a la fecundación y un adulto de pez cebra (D. rerio).
5.1 Control hormonal
La metamorfosis se inicia internamente y es mantenida por la hormona tiroxina (TH), y el proceso es obligatorio. La TH provoca que se produzcan cambios celulares, bioquímicos y morfológicos extensos durante la metamorfosis (Figura 7). Los eventos que ocurren durante la metamorfosis, como la alteración de la expresión génica, la morfogénesis, la reestructuración tisular y la muerte celular extensa, resultan de la respuesta diferencial de los tejidos a la TH. El programa de desarrollo determinado genéticamente está en marcha antes del lanzamiento de TH. El elemento clave que determina la respuesta a la hormona está determinado por el receptor de hormona tiroidea nuclear (TR).
Como en la mayoría de los vertebrados, dos receptores de hormona tiroidea, TRα y TRβ, reprimen la transcripción en ausencia de la TH, y cuya concentración de TR en los tejidos está directamente modulada por la TH. Sin embargo, los factores ambientales pueden iniciar la liberación temprana de tiroxina si una larva ha completado ciertos eventos morfogénicos. Por ejemplo, el hacinamiento, la reducción de alimentos u oxígeno, el secado de cuerpos de agua o el aumento de la depredación pueden provocar la liberación de TH como respuesta al estrés. Aunque la TH y sus derivados promueven la metamorfosis, no operan solos. La tiroides está presente temprano en la vida larvaria, pero su actividad secretora es aparentemente inhibida por las hormonas corticoides, como la corticosterona. Además, la prolactina es abundante en los estadios larvales tempranos y hace que los tejidos corporales sean insensibles a la TH. Cuando se eliminan estas inhibiciones, la tiroides secreta TH, lo que efectúa la transformación.
La metamorfosis señala la finalización de la embriogénesis. Algunos procesos de desarrollo, como la maduración de las gónadas, continúan a través de la etapa juvenil, pero las principales características estructurales y fisiológicas se encuentran al final de la metamorfosis. La metamorfosis es casi imperceptible en cecilias y salamandras, pero dramática en ranas. Las larvas de anuro requieren una importante reorganización estructural y fisiológica debido a las sorprendentes diferencias entre las etapas larvaria y juvenil-adulta. El cambio no se produce de una sola vez, sino de manera gradual, y cada paso conduce al siguiente nivel de transformación. A diferencia de las pupas de insectos, los renacuajos en metamorfosis permanecen activos, capaces de evitar depredadores y tensiones ambientales.
5.2 Taxonomía y metamorfosis
Incluso en vertebrados, la metamorfosis es frecuente: además de los anfibios, la mayoría de los peces teleósteos, que representan la mitad de todas las especies de vertebrados, sufren metamorfosis. Esta transición post-embrionaria también ocurre en vertebrados basales, como la lamprea. En las diversas clases de vertebrados, estas metamorfosis son morfológicamente muy diversas; sin embargo, hay algunos principios comunes en todas estas transformaciones (Laudet, 2011).
Figura 5.2. Control hormonal de la metamorfosis. Eventos clave durante el desarrollo de un renacuajo de la rana (Xenopus laevis). Sobre la línea están las transferencias de "renacuajo" de animales incubados durante 24 h con NaI “yodo radioactivo 125 para ver la actividad de la tiroides”, fijados con formaldehído y lavados a un fondo inferior. Los renacuajos se secaron sobre papel de filtro y se filmaron. X. laevis tiene dos glándulas tiroideas ubicadas a ambos lados de la línea media (flecha sólida). La primera incorporación de yodo en la glándula tiroides ocurre 10 días después de la fertilización en la etapa de desarrollo 46 de Nieuwkoop y Faber (NF). La línea continua representa concentraciones de TH y TRβ durante el desarrollo. TRβ es un gen de respuesta directa de TH (YouTube) (YouTube) (YouTube).
Primero, la metamorfosis es siempre una transformación ecológica: las larvas y el adulto no viven en los mismos ambientes, o al menos no comparten los mismos recursos. Por ejemplo, el renacuajo es acuático y la mayoría de las veces es herbívoro, mientras que la rana es un carnívoro terrestre. En el océano, la mayoría de las larvas de peces son planctónicas, pero como adultos son bentónicas o, si aún son pelágicas, pueden nadar de manera activa. Este es el caso de los peces coralinos, donde el reclutamiento de las larvas al arrecife, tan importante para la biología de la conservación marina, ocurre en paralelo a su metamorfosis (Laudet, 2011).
En segundo lugar, la metamorfosis es una transformación extensa del animal, a veces un cambio radical en la organización del plan corporal. Hay muchos ejemplos de animales que se consideraron históricamente como parte de diferentes especies y para los cuales se demostró una transformación de larva a juvenil. Existe un continuo desde las especies que muestran una reorganización radical del plan corporal, como los tunicados, hasta aquellas que experimentan cambios menores, como las salamandras. Esta transformación nunca es solo un cambio morfológico: siempre incluye remodelación fisiológica, bioquímica e histológica que afecta varios tejidos a diferentes niveles (Laudet, 2011).
En tercer lugar, la metamorfosis se desencadena en estrecha relación con el medio ambiente: en la mayoría de las especies, las señales ambientales desempeñan un papel importante en el impulso de las larvas para que se transformen en un adulto. Tanto en insectos como en anfibios, los sistemas hormonales desempeñan un papel muy importante en estos procesos, y en ambos casos los receptores de hormonas nucleares y la señalización neuroendocrina se utilizan para traducir las señales ambientales en un programa coordinado que remodela el organismo. Es importante destacar que la metamorfosis no debe confundirse con la pubertad, otro evento importante de la historia de vida controlado por las hormonas, cuando la competencia reproductiva se adquiere a través de la maduración de los órganos sexuales (Laudet, 2011).
5.3 La metamorfosis en los anfibios modernos
La metamorfosis es un fenómeno fascinante que ocurre en muchos seres vivos, y los anfibios modernos son uno de los grupos más destacados en este proceso. En este artículo, exploraremos en detalle la metamorfosis en los anfibios y cómo ha sido moldeada a lo largo de millones de años de evolución.
Los anfibios, como las ranas, los sapos y las salamandras, son criaturas únicas que experimentan una transformación extraordinaria durante su ciclo de vida. Comienzan su existencia en forma de larvas acuáticas, adaptadas para vivir en el agua, y luego pasan por una serie de cambios radicales para convertirse en adultos terrestres o semiacuáticos.
A lo largo del artículo, examinaremos los diferentes estadios de la metamorfosis, desde los huevos hasta las larvas y finalmente los adultos. Exploraremos cómo ocurren las modificaciones morfológicas y fisiológicas en cada etapa, y cómo los anfibios se adaptan a su entorno cambiante.
Además, analizaremos la importancia de la metamorfosis en la supervivencia y reproducción de los anfibios. Discutiremos cómo esta transformación les permite aprovechar tanto los recursos acuáticos como terrestres, ampliando sus nichos ecológicos y aumentando sus posibilidades de reproducción.
Ranas y sapos
Con ranas y sapos, las branquias externas del renacuajo recién salido se cubren con un saco branquial después de unos días. Tomemos como ejemplo la rana común (Rana temporaria) y el sapo común (Bufo bufo) para ilustrar estos procesos. En estos anfibios, los pulmones se forman rápidamente, permitiéndoles respirar aire. Las patas delanteras se desarrollan debajo del saco branquial, mientras que las patas traseras se hacen visibles unos días más tarde. Este es un momento crucial en el desarrollo, ya que indica la transición de una vida acuática a una vida terrestre.
Figura 5.3. Bufo bufo, comúnmente conocido como sapo común, es un anfibio fascinante que se encuentra en diversas regiones de Europa. El renacuajo de Bufo bufo es una etapa clave en su ciclo de vida. Estos renacuajos son de color oscuro y tienen una forma alargada y robusta. Presentan branquias externas que les permiten respirar bajo el agua. A medida que se desarrollan, las patas delanteras emergen debajo de su saco branquial, seguidas de las patas traseras. Los renacuajos de Bufo bufo son conocidos por su dieta omnívora, alimentándose de una variedad de materia orgánica, incluyendo pequeños invertebrados acuáticos y detritos. Durante su fase de renacuajo, estos individuos muestran una alta actividad y exploran su entorno acuático en busca de alimento y refugio. A medida que los renacuajos de Bufo bufo continúan su metamorfosis, experimentan una serie de cambios físicos y fisiológicos. Sus branquias se reabsorben y los pulmones se desarrollan, preparándolos para una vida terrestre. También adquieren una coloración más oscura y desarrollan glándulas parótidas en sus cuerpos, que secretan toxinas defensivas para protegerse de posibles depredadores.
Después de este período, generalmente hay una etapa más larga durante la cual el renacuajo se alimenta principalmente de una dieta vegetariana. Un ejemplo interesante es la rana toro (Lithobates catesbeianus), cuyos renacuajos se alimentan de algas y materia vegetal en el agua. Durante esta etapa, los renacuajos utilizan un intestino relativamente largo en forma de espiral para digerir eficientemente su dieta.
A medida que el renacuajo continúa su metamorfosis, ocurren cambios rápidos en su cuerpo a medida que su estilo de vida se transforma por completo. Observemos el caso del sapo corredor (Epidalea calamita), que experimenta cambios notables. La boca en forma de espiral con aristas de dientes calientes se reabsorbe junto con el intestino en espiral. El animal desarrolla una mandíbula grande y poderosa, adaptada para una nueva dieta carnívora. Al mismo tiempo, las branquias desaparecen junto con su saco branquial.
Figura 5.4. Epidalea calamita, conocida como rana común o ranita de San Antonio, es una especie de anfibio ampliamente distribuida en Europa. Su renacuajo es una etapa destacada en su ciclo de vida. Los renacuajos de Epidalea calamita son de forma alargada y tienen un color verde pálido, lo que les permite camuflarse en su entorno acuático. Se alimentan de una dieta omnívora, consumiendo algas, detritos y pequeños invertebrados acuáticos. A medida que se desarrollan, sus patas traseras emergen, seguidas de las patas delanteras, y experimentan cambios en su sistema respiratorio, desarrollando pulmones y perdiendo sus branquias. Esta metamorfosis les prepara para abandonar el agua y adaptarse a la vida terrestre.
Durante este proceso de metamorfosis, los ojos y las piernas de la rana o el sapo crecen rápidamente. Además, se forma una lengua especializada para la captura de presas. Estos cambios se acompañan de modificaciones en las redes neuronales, como el desarrollo de la visión estereoscópica y la pérdida del sistema de la línea lateral, que se encarga de detectar movimientos y cambios en el agua.
Todo este proceso de transformación puede ocurrir en aproximadamente un día, lo que lo convierte en una verdadera metamorfosis. Sin embargo, la cola del renacuajo no se reabsorbe hasta unos días más tarde, debido a las altas concentraciones de tiroxina requeridas para este proceso de reabsorción.
Salamandras
El desarrollo de las salamandras es extraordinariamente diverso y fascinante. Cada especie presenta particularidades únicas en su proceso de desarrollo, adaptándose de manera sorprendente a su entorno y estilo de vida. Uno de los ejemplos más destacados es el Axolote (Ambystoma mexicanum), que exhibe un fenómeno conocido como paedomorfosis, en el cual las larvas retienen características juveniles y nunca completan su transformación en adultos terrestres.
Figura 5.5. El Axolote (Ambystoma mexicanum) es una especie de salamandra que habita en los lagos de México. Destaca por su fenotipo neoténico, ya que mantiene características juveniles incluso en su etapa adulta. Presenta branquias externas y no completa su metamorfosis, conservando una forma acuática durante toda su vida. Su capacidad regenerativa es impresionante, pudiendo regenerar extremidades, órganos e incluso partes del sistema nervioso central. Es objeto de estudio en la investigación científica debido a su capacidad para regenerar tejidos. Además, su singular aspecto y su importancia en la cultura y la conservación hacen del Axolote una especie fascinante y emblemática de México.
En el género Ambystoma, se ha observado la evolución de múltiples especies pedomorfas, es decir, especies que mantienen su estado larval incluso en la edad adulta. Por otro lado, algunas especies dentro del mismo género experimentan tanto la paedomorfosis como la metamorfosis completa durante su desarrollo (Laudet, 2011).
En el caso de los tritones, su proceso de desarrollo difiere de las salamandras. A diferencia de los renacuajos, las larvas de los tritones ya son depredadoras y continúan siéndolo en su etapa adulta. Sus branquias nunca están cubiertas por un saco branquial y se reabsorben antes de abandonar el agua. Aunque los tritones también desarrollan pulmones tempranamente, no los utilizan con tanta frecuencia como los renacuajos.
Además, los tritones experimentan una alternancia entre fases acuáticas y terrestres. Por ejemplo, durante la primavera y el verano, prefieren habitar en el agua, mientras que en invierno, adoptan una fase terrestre. Para adaptarse a estas distintas etapas, los tritones requieren diferentes hormonas. La prolactina desempeña un papel importante en la adaptación a la fase acuática, mientras que la tiroxina es crucial para la fase terrestre.
Figura 5.6. Bolitoglossa capitana, conocida como el Tritón de Costa, es una especie de tritón endémica de Colombia. Habita en los bosques húmedos de las regiones montañosas del país. Este tritón se caracteriza por su aspecto alargado y delgado, con una longitud que oscila entre 8 y 12 centímetros. Su coloración varía desde tonos marrones hasta grises y negros, lo que le permite camuflarse entre la vegetación. Es un anfibio terrestre que se activa durante la noche, alimentándose principalmente de pequeños invertebrados. Su hábitat natural se ve amenazado por la deforestación y la pérdida de los bosques, lo que pone en riesgo su supervivencia.
Es importante destacar que una vez que los tritones abandonan el agua por primera vez, sus branquias externas no vuelven a desarrollarse en las fases acuáticas posteriores, ya que se reabsorben por completo. Esta asombrosa plasticidad y adaptabilidad en los procesos de desarrollo de las salamandras y tritones demuestran la complejidad y diversidad de estos animales y su capacidad para sobrevivir en una amplia gama de ambientes acuáticos y terrestres.
Cecilias
Las cecilias, un grupo de anfibios fascinante y poco conocido, presentan una diversidad de patrones de metamorfosis que han capturado el interés de los científicos. Una de las especies más estudiadas es Ichthyophis, perteneciente al grupo de las cecilias basales. Investigaciones realizadas por Dünker, Wake y Olson (2000) han revelado que Ichthyophis experimenta una metamorfosis en la que la larva acuática se transforma en un adulto fosorial. Durante este proceso, la larva pierde la línea lateral, una característica sensorial presente en las larvas acuáticas de muchos anfibios.
Figura 5.7. Ichthyophis kohtaoensis es una especie de cecilia que se encuentra en el sureste asiático y ha sido introducida en algunas áreas de Colombia. Esta especie posee un cuerpo alargado y sin patas, adaptado para la vida subterránea. Su piel es lisa y de color marrón oscuro. Se alimenta de pequeños invertebrados y se reproduce mediante la puesta de huevos. Aunque su presencia en Colombia es considerada como una especie invasora, aún se requiere de investigaciones adicionales para comprender mejor su distribución, ecología y posibles impactos en los ecosistemas locales. Es importante gestionar adecuadamente su introducción para evitar alteraciones en la biodiversidad nativa.
En contraste, las cecilianas más recientes, como las del clado Teresomata, no experimentan un cambio de nicho ontogenético tan drástico. Estas especies están adaptadas para vivir y excavar en ambientes terrestres durante toda su vida. A diferencia de los anuros, como las ranas y los sapos, las cecilianas del clado Teresomata mantienen una forma corporal similar desde su etapa larval hasta la adultez.
Investigaciones más recientes, como los estudios realizados por San Mauro, Gower, Oommen, Wilkinson y Zardoya (2004), han aportado nuevos conocimientos sobre la metamorfosis en las cecilias. Estos estudios han ayudado a comprender mejor los procesos evolutivos y las adaptaciones relacionadas con la metamorfosis en estos anfibios singulares. A medida que se continúa investigando, se espera que se descubran más detalles y se obtenga una comprensión más completa de la metamorfosis en las cecilias, revelando aún más la asombrosa diversidad y complejidad de estos animales.
5.4 La pedomorfosis
La pedomorfosis es un fenómeno fascinante que ocurre en diversas especies y que ha capturado el interés de los científicos durante décadas. Este proceso biológico se caracteriza por el mantenimiento de características juveniles en los individuos adultos, lo que resulta en una apariencia y comportamiento similares a las etapas tempranas de desarrollo. En este artículo exploraremos en profundidad el concepto de pedomorfosis, sus mecanismos subyacentes y su relevancia en la evolución y adaptación de diferentes organismos.
Analizaremos ejemplos de especies que exhiben pedomorfosis en distintos grupos taxonómicos, como anfibios, insectos y peces, destacando casos concretos y descubrimientos recientes. Examinaremos cómo la pedomorfosis puede ser una estrategia ventajosa en determinados entornos y cómo influye en la biología y ecología de estas especies.
Además, exploraremos las implicaciones de la pedomorfosis en términos de genética, desarrollo y evolución, y discutiremos las teorías propuestas para explicar este fenómeno. También examinaremos las posibles aplicaciones de la pedomorfosis en campos como la regeneración de tejidos y la biomedicina.
Facultativa
Otro caso extremo de una variación del ciclo de vida en los anfibios es un tipo de pedomorfosis en la cual el adulto sexualmente maduro de una especie tiene la morfología de la etapa larvaria de su ancestro. Esto da lugar a especies que pueden reproducirse mientras siguen teniendo una morfología larvaria. Todos los ejemplos conocidos de esto son miembros del clado Urodeles: no se sabe que ninguna especie de anuro muestre tal adaptación. El signo más obvio de la paedomorfosis es la capacidad de reproducirse mientras se conservan las branquias externas (de ahí el término perennibranchiates), con aletas de cola típicas de las larvas (Laudet, 2011).
Figura 5.8. Historia de vida paedomórfica de la salamandra topo (Ambystoma talpoideum) en relación con las probabilidades de transición estimadas en nuestro modelo de ocupación multiestado. Las líneas discontinuas se refieren a transiciones observadas únicamente en individuos que presentan paedomorfosis.
Dos tipos de paedomorfo se han descrito en anfibios: el tipo facultativo ejemplificado por el axolote, las larvas y los adultos de los cuales fueron considerados como especies diferentes hasta 1865 cuando Dumeril descubrió su relación ontogenética; y el tipo obligatorio ejemplificado por el género Proteus, que está adaptado a cuevas en los Alpes Adriáticos, o por el Necturus maculosus, bien conocido en América del Norte. En los paedomorfos facultativos, la metamorfosis puede observarse ocasionalmente en la naturaleza o ser inducida experimentalmente en el laboratorio, mientras que los pedomorfos obligatorios nunca sufren metamorfosis y a menudo se describen como refractarios a las hormonas tiroideas, tratamientos con los cuales no se desencadena la metamorfosis en dichas especies, probablemente por pérdida de los receptores para esta (Laudet, 2011).
Figura 5.9. Necturus maculosus, comúnmente conocido como salamandra acuática moteada, es una especie de tritón acuático que se encuentra en América del Norte, incluyendo partes de los Estados Unidos y Canadá. Es conocido por su apariencia distintiva, con un cuerpo largo y delgado, y una piel moteada de color marrón oscuro o negra con manchas amarillas o naranjas. A diferencia de otras especies de tritones, Necturus maculosus es exclusivamente acuático y pasa toda su vida en cuerpos de agua dulce, como ríos, lagos y pantanos. Son expertos nadadores y se alimentan de una variedad de presas acuáticas, como crustáceos, insectos y pequeños peces. Esta especie desempeña un papel importante en los ecosistemas acuáticos como indicador de la calidad del agua.
Obligada
Los pedomorfos obligados nunca sufren metamorfosis y permanecen en un hábitat acuático durante toda su vida. Esta estrategia de historia de vida se ha descrito en familias de Urodeles relacionadas de forma distante y en particular en Proteidea, entre las que se encuentran la especie de cueva Proteus anguinus y Necturus maculosus. Se ha propuesto la paedomorfosis de estas especies es un cambio neoténico: es decir, a través de la desaceleración del desarrollo somático en relación con el desarrollo gonadal. En contraste con los neotenes facultativos, la estrategia de los pedomorfos obligados no puede explicarse por las ventajas que confiere la plasticidad fenotípica: puede resultar de la selección que actúa sobre la metamorfosis en sí misma o, indirectamente, de la selección de características morfológicas o fisiológicas que son beneficiosas para la aptitud física, o bien pueden ser casos de deriva genética sobre especies con tendencia a perder ciertos receptores de membrana por mutaciones genéticas muy probables (Laudet, 2011).
Figura 5.10. Proteus anguinus, conocido comúnmente como olm o pez humano, es una especie de anfibio caudado que se encuentra en las cuevas subterráneas de Europa Central y del Sur. Es famoso por su apariencia única y adaptaciones al ambiente cavernícola. El olm tiene un cuerpo largo y serpentiforme, una piel rosada y translúcida, y carece de pigmentación en los ojos, lo que le otorga un aspecto pálido y ciego. Debido a su hábitat oscuro y la falta de luz, ha desarrollado sentidos altamente desarrollados, como un sentido del tacto y del olfato muy agudos. Además, es capaz de sobrevivir largos periodos sin alimento y puede llegar a vivir hasta 100 años. El olm es considerado un organismo extremófilo y es objeto de estudios científicos debido a su interesante biología y adaptaciones al medio subterráneo.
6. Metamorfosis en anfibios primitivos
6. Metamorfosis en anfibios primitivos
Entre los aspectos más fascinantes de la biología de los anfibios modernos se encuentra la transición de una larva acuática a un adulto terrestre o semestrestre (metamorfosis), especialmente en las ranas, en las que el cambio es drástico. La mayoría de los primeros tetrápodos “trasicionales entre pez-anfibio” eran acuáticos o, en el mejor de los casos, anfibios en sentido general. Los cambios ontogenéticos que ocurrieron fueron menores en comparación con la metamorfosis de la rana, y deberían ser más semejantes a los que ocurren en salamandras y ceciliuas. La evidencia más obvia de al menos algún cambio ontogenético en la morfología es la presencia de larvas (acuáticas) y de adultos terrestres o semestrestres son conocidos en discosauriscidos (Seymouriamorpha) y una diversidad de temnospondilos (anfibaemidos, micromelerpetontidps, branchiosauridos, zatraqueidos, eriopidos, esclerocefalidos, arquegosauridos, y estereospondilos).
Figura 6.1. Cráneos de adulto y renacuajo de Micromelerpeton. La forma larvaria del temnospondilo Micromelerpeton; tiene surcos de línea lateral, que carece la forma adulta, y carece de los huesos del cerebro que se producen en la forma adulta. La ornamentación en los huesos del cráneo también es diferente.
Los Seimouriidos, anfibamidos, branquiosauridos, zatraqueidos y eriopidos tenían adultos terrestres con centros bien desarrollados en las vértebras y una cintura escapular. Todos estos excepto zatraqueidos tenían carpelos y tarsales. Los esclerocefálidos tenían centros vertebrales, una cintura escapular, carpelos, tarsales y una pelvis completa, pero no se sabe si los adultos eran terrestres. Algunas series inusualmente bien conservadas de fósiles de temnospondilos presentan una imagen razonablemente buena de los cambios morfológicos que ocurrieron cuando se transformaron de una larva acuática a un adulto. Los disorofoides del Permo-carbonífero se sometieron a una serie de cambios ontogenéticos que acortaron la transición de renacuajo a adulto, lo que originó una metamorfosis de fase corta.
Figura 6.2. Micromelerpeton, un género extinto de anfibios, pertenecía al grupo de los lepospóndilos y habitaba durante el período Carbonífero. Estos pequeños anfibios se caracterizaban por su cuerpo alargado y su apariencia similar a la de las salamandras actuales. Micromelerpeton era especialmente notable por su adaptación a los ambientes acuáticos. Poseía patas cortas y robustas, ideales para moverse en el agua, y una cola fuerte que le permitía nadar con facilidad. Aunque sus fósiles se han encontrado en diversas partes del mundo, como Europa y Norteamérica, se cree que Micromelerpeton estaba estrechamente relacionado con las especies modernas de salamandras y contribuyó al desarrollo de los anfibios terrestres que conocemos hoy en día.
En los zatraqueidos, ocurrió una transformación de fase relativamente corta, en la cual una larva acuática típica se transformó en un adulto con un cuerpo corto y una cabeza muy grande, muy parecido al que se encuentra en las ranas con cuernos actuales (Ceratophrys). En algunos, los cambios ontogenéticos en la morfología fueron mucho menos pronunciados, y el cuerpo larvario siguió siendo acuático, produciendo adultos neoténicos (pedomorfosis).
Las formas larvales de los temnospondilos Micromelerpeton tienen distintos surcos de línea lateral en la parte frontal de la superficie dorsal del cráneo, lo que indica que tenían sistemas sensoriales paralelos, presentes solo en los tetrápodos acuáticos (Figura 6.1). Las formas adultas tenían un cráneo más osificado que carecía de los surcos de la línea lateral, pero con huesos que rodeaban la base del cerebro. Además, el cráneo de los adultos terrestres contiene una ornamentación de tipo polígono indicativa de un cráneo más fuertemente osificado. La forma larvaria también tenía un aparato hiobranquial bien desarrollado que formaba una cesta debajo y detrás del cráneo.
Figura 6.3. Modelo del renacuajo de Micromelerpeton. La forma larvaria de Micromelerpeton tenía branquias externas. y un aparato hiobranquial (esqueleto branquial) con dientes branquiales (dentición branquial) que indica que era acuático.
Este tipo de aparato hiobranquial soporta branquias externas en los anfibios acuáticos modernos (Figura 6.3). El aparato hiobranquial forma el suelo de la lengua cuando se retiene en adultos. Los taxones acuáticos y las larvas de taxones con adultos semi-terrestres o terrestres eran alargados con colas largas, mientras que los adultos que se desplazaban por tierra tenían cuerpos robustos, colas cortas y un grado mucho mayor de osificación en el cuerpo, el cráneo y las extremidades (Figura 6.1 y Figura 6.3). Entre los temnospondilos, algunos experimentaron una lenta transformación de las larvas acuáticas a adultos terrestres (por ejemplo, Eryops), algunos fueron altamente plásticos en términos de desarrollo en respuesta a condiciones ecológicas inmediatas (por ejemplo, Sclerocephalus), y otros fueron de gran tamaño acuático y evolucionaron en grandes tamaños corporales que les permitieron ser los principales depredadores (por ejemplo, Trematolestes, Gerrothorax, y Mastodontosaurus).
Figura 6.4. Trematolestes es un género extinto de anfibios que vivió durante el período Pérmico. Estos animales pertenecían al grupo de los temnospóndilos y se caracterizaban por su apariencia reptiliana. Trematolestes tenía un cuerpo alargado y robusto, con una cabeza grande y fuertes mandíbulas equipadas con dientes afilados. Se cree que eran depredadores acuáticos, adaptados para cazar presas en ríos y lagos. Sus fósiles se han encontrado en diferentes partes del mundo, como Europa y América del Norte. Estos hallazgos han proporcionado importantes evidencias sobre la diversidad y evolución de los anfibios durante el pasado geológico y han contribuido a nuestra comprensión de la historia de la vida en la Tierra.
Aunque parezca intuitivamente obvio que la transición de una existencia acuática a una parcialmente terrestre sería la fuerza impulsora detrás de la evolución de la transformación de larvas a adultos, este no parece ser el caso en los antiguos anfibios. Más bien, un cambio ontogenético en la alimentación, que resultó en modificaciones de la mandíbula y otros rasgos morfológicos, probablemente condujo a la evolución de una morfología que permitió el acceso a ambientes terrestres. El truncamiento de los eventos que se producen durante la transformación, de modo que la mayoría de los cambios se produjeron de forma relativamente simultánea, como se ve en los disorofoides ramiosaurósidos, representa el origen de la metamorfosis tal como la conocemos en lisanfibios “cecilias, tritones, salamandras, sapos y ranas”.
7. Meiosis y fecundación
7. Meiosis y fecundación
En la mayoría de los anfibios y reptiles, una hembra y un macho son necesarios para la reproducción, aunque existen algunas excepciones notables. Dentro de las especies, la actividad reproductiva entre los sexos suele ser sincrónica, aunque se conocen algunas excepciones interesantes. Los controles internos (hormonales) median el tiempo reproductivo, pero en última instancia, la reproducción se desencadena directa o indirectamente por señales ambientales, como la temperatura, la lluvia o el fotoperíodo. Los cambios hormonales causan la gametogénesis, la producción de células sexuales o gametos (óvulos en las hembras, espermatozoides en los machos), un proceso que es similar en todos los vertebrados. Además de la producción de gametos, las gónadas producen hormonas que se alimentan del cerebro, la pituitaria y otros órganos y, en última instancia, influyen en la fisiología y el comportamiento de la reproducción.
Figura 7.1. Gametogénesis de los anfibios. El proceso de maduración de ovocitos y espermatozoides. Dibujos esquematizados. Se muestra la división post-reduccional. En muchas formas, la primera división es reduccional y la segunda es ecuacional. El resultado final es el gameto haploide, en cualquier caso.
7.1 Espermatogénesis
Los gametos masculinos (espermatozoides) son producidos por células (espermatogonias) en los túbulos seminíferos de los testículos durante la espermatogénesis. La espermatogonia se somete a divisiones mitóticas para producir espermatogonias adicionales, que se diferencian en espermatocitos primarios. Como los espermatocitos primarios se diferencian en espermatocitos secundarios, el número de cromosomas se reduce a la mitad por dos eventos meióticos, que en última instancia producen cuatro espermátidas (n). Por el proceso de la espermiogénesis, cada espermátida produce un espermatozoide haploide. Los espermatozoides reciben nutrición de las células de Sertoli. Cada espermatozoide es una célula altamente modificada con tres secciones: una cabeza, una pieza central llena de mitocondrias para las necesidades de energía de la célula y una cola filamentosa para la locomoción. La cabeza contiene el núcleo celular cubierto por un acrosoma. El acrosoma produce enzimas proteolíticas que digieren la cápsula del huevo y permiten que el espermatozoide penetre en un huevo. Entre los anfibios y reptiles, la morfología de los espermatozoides es muy variable. La morfología de los espermatozoides demostrará ser un carácter útil en los análisis filogenéticos.
La espermatogénesis en la rana es estacional y se completa dentro de los testículos. Las paredes de los túbulos seminíferos producen espermatogonías que atraviesa las divisiones mitóticas y luego la serie de cambios nucleares sin mitosis. Esto da lugar a la aparición, hacia la luz de cada túbulo, de grupos de espermatozoides maduros. En el momento de la hibernación (en las especies que hibernan), todos los espermatozoides que estarán disponibles para la próxima temporada de reproducción de la primavera habrán madurado. En este momento, los testículos exhibirán solo estos espermatozoides y relativamente pocos espermatogonios, sin las etapas intermedias de maduración. La espermatogonia se encuentra cerca de la membrana basal del túbulo seminífero. Estos esperan su turno para experimentar los cambios de maduración necesarios para la producción de espermatozoides que estarán listos para la temporada de reproducción un año y medio después. Las colas alargadas y filamentosas de los espermatozoides maduros agrupados se proyectan en la luz de cada túbulo seminífero.
Los espermatozoides maduros promedian alrededor de 0.03 mm. en longitud. Tiene una cabeza alargada, teñida de sólidos (núcleo) con un acrosoma anterior, que apunta hacia el exterior hacia la periferia del túbulo seminífero. La pieza media corta generalmente no es visible, pero la cola aparece como una extensión filamentosa gris en el lumen, aproximadamente cuatro o más veces la longitud de la cabeza del esperma.
7.2 Fisiología de la eyaculación
Se ha demostrado definitivamente que la hormona pituitaria anterior causa la liberación de los espermatozoides maduros del testículo. Pero esta hormona también libera otras etapas de maduración. Por lo tanto, es probable que haya fibras musculares lisas, ya sea entre las células intersticiales o en la túnica albugínea de los testículos, fibras que se contraen para forzar a los espermatozoides desde los túbulos seminíferos. Sería tan difícil demostrar fisiológicamente la presencia de estas fibras en el testículo como es simple demostrarlas en la pared del quiste que se contrae del ovario.
En respuesta a la estimulación sexual, los espermatozoides se liberan de sus células de Sertoli y son forzados desde la luz del túbulo seminífero hacia el túbulo colector relacionado. Estos túbulos colectores son pequeños y están revestidos con células cuboidales muy compactas. Se unen a la vasa eferenteia que deja que los testículos pasen entre los pliegues del mesorquio y de allí a los corpúsculos malpighianos del riñón.
Figura 7.2. Anatomía del sistema reproductor de una rana macho.
Desde este punto, los espermatozoides pasan a través de los conductos excretores, los túbulos uriníferos y hacia el conducto mesonéfrico (uréter) que se puede encontrar unido al margen lateral del riñón. Dentro del sistema excretor, los espermatozoides son inmóviles, debido al ambiente ligeramente ácido. Se llevan pasivamente por el uréter hasta la ligera dilatación cerca de la cloaca, conocida como la vesícula seminal. Dentro de la vesícula, los espermatozoides se almacenan brevemente en grupos hasta que se producen el amplexus “abrazo copulatorio” y la ovoposición. En la ovoposición, el macho eyacula a los espermatozoides en el agua neutral o ligeramente alcalina donde se activan y luego son capaces de fertilizar los huevos a medida que emergen de la cloaca de la hembra.
Figura 7.3. Amplexus de Xenopus laevis. La postura reproductiva de las ranas y sapos se llama amplexo (YouTube). Xenopus laevis, conocida como rana africana de garras, es una especie de anfibio acuático originaria de África subsahariana. Son reconocidas por su aspecto único, con cuerpos robustos y ojos saltones. Tienen una piel lisa y de color marrón o verde oliva, adaptada para la vida acuática. Son excelentes nadadoras y pueden respirar tanto por sus pulmones como a través de su piel. Se alimentan principalmente de insectos, pequeños peces y crustáceos. Son utilizadas en investigaciones científicas debido a su capacidad de regenerar tejidos y su valor en el estudio del desarrollo embrionario. Además, son populares como mascotas en acuarios. Sin embargo, la introducción de esta especie en alguno
Durante la temporada de reproducción normal, el amplexus se logra cuando las hembras alcanzan los estanques donde los machos emiten sus llamadas sexuales. Durante el amplexus hay movimientos musculares definidos de la rana masculina, coincidiendo con la ovoposición de la hembra. El amplexus puede ser mantenido por el macho durante muchos días, incluso con hembras muertas. Tan pronto como los huevos se ponen y el macho arroja su esperma, realiza un breve movimiento de tejido del cuerpo y luego suelta su agarre para alejarse. Las ranas descuidan completamente los huevos recién puestos, aunque existen excepciones interesantes.
7.3 Ovogénesis
En las hembras, los gametos u óvulos se producen en el ovario. Los gonocitos primordiales se producen en cápsulas de células no sexuales conocidas como folículos, que se encuentran en la pared del ovario. Los gonocitos primordiales se dividen por mitosis para producir oogonia (células que producirán huevos). Oogonia experimenta divisiones mitóticas y se agrandan para producir ovocitos primarios, que luego sufren dos divisiones meióticas. La primera división meiótica produce un ovocito secundario y el primer cuerpo polar, una célula no funcional; La segunda división meiótica produce el óvulo y un cuerpo polar secundario. Por lo tanto, cada oogonio produce solo un óvulo, cada uno de los cuales es (n).
Figura 7.4. Anatomía del sistema reproductor de una rana hembra.
Los nutrientes se acumulan en el citoplasma del óvulo mediante un proceso conocido como vitelogénesis. La vitelogenina es un precursor de las proteínas de la yema y se sintetiza en el hígado en los anfibios. Se transporta en el torrente sanguíneo al ovario, donde es secuestrado por ovocitos en crecimiento. En los ovocitos, se escinde en las proteínas de la yema de huevo lipovitelina y fosvitina. Estos compuestos se almacenan como yema en el óvulo hasta que se necesitan durante la embriogénesis.
En la metamorfosis, el número de ovocitos no celulogénicos en el ovario de una hembra de anfibios aumenta rápidamente. La evidencia de los estudios sobre el sapo Bufo bufo indica que el número total de ovocitos que se utilizarán durante la vida de la hembra se alcanza temprano en la etapa juvenil. Bufo bufo puede producir de 30,000 a 40,000 ovocitos durante este tiempo. Las especies que producen masas de huevos más pequeños tienen menos ovocitos no celulíticos.
La hormona gonadotropina inicia el crecimiento y el mantenimiento vitelogénico de los pequeños ovocitos, lo que indica el comienzo de un ciclo ovárico. En los anfibios maduros, los ovarios contienen una serie de ovocitos pequeños no celulogénicos que no responden a la gonadotropina y una serie de ovocitos más grandes que responden a la gonadotropina. Aparentemente, una vez que comienza la vitelogénesis para un grupo de ovocitos, los mecanismos reguladores intraováricos evitan que ovocitos pequeños adicionales respondan a la gonadotropina.
Los cuerpos grasos son estructuras discretas en todos los anfibios, ubicados adyacentes a las gónadas. La compleja relación entre las gónadas y los cuerpos grasos ha sido debatida durante muchos años. La evidencia experimental sobre el papel de los cuerpos grasos es contradictoria. En muchas especies, los cuerpos grasos son grandes en las hembras juveniles y en aquellas hembras con ovarios que sufren vitelogénesis. Sin embargo, otras especies no muestran correlación entre el tamaño corporal de la grasa y el ciclo ovárico. Los lípidos se almacenan en otros órganos, como el hígado y las gónadas, así como los cuerpos grasos. Por ejemplo, en Ambystoma opacum recién metamorfoseado, el 36% de los lípidos se almacenan en cuerpos grasos, en comparación con el 17% en Ambystoma talpoideum. El aumento de los niveles de lípidos puede aumentar la supervivencia de estas salamandras cuando entran en el entorno terrestre después de la metamorfosis.
Figura 7.5. Ambystoma opacum, comúnmente conocida como salamandra marmolada, es una especie de salamandra que se encuentra en varias regiones del este de los Estados Unidos y México. Estas salamandras tienen un aspecto distintivo con un patrón de coloración marmolado en su cuerpo, que varía en tonos de gris y negro. Son de tamaño mediano, alcanzando una longitud de aproximadamente 12 a 15 centímetros. A diferencia de otras especies de salamandras, Ambystoma opacum no pasa por una metamorfosis completa y mantiene rasgos larvales durante toda su vida. Son especies semiacuáticas que se encuentran en cuerpos de agua dulce y también pueden encontrarse en tierra durante condiciones húmedas. Estas salamandras juegan un papel importante en los ecosistemas acuáticos al alimentarse de invertebrados acuáticos y ser presas para otros animales.
Los patrones de almacenamiento de grasa también pueden variar con los correlatos ambientales de latitud y altitud. La energía almacenada en la grasa justo después de la hibernación y antes de la reproducción en la rana europea Rana temporaria es mayor en latitudes más altas y las diferencias sexuales en el almacenamiento de energía disminuyen en latitudes más altas. Las reservas de energía más grandes en latitudes más altas probablemente amortiguan la imprevisibilidad de las condiciones ambientales durante períodos de actividad relativamente cortos. Se han realizado observaciones similares sobre la rana china Rana chensinensis. Las poblaciones de elevaciones más altas de la salamandra norteamericana Plethodon cinereus tienen más grasa en sus colas que las de elevaciones más bajas, posiblemente por la misma razón general.
Figura 7.6. La Rana temporaria, también conocida como rana común o rana bermeja, es una especie de anfibio que se encuentra en diversas partes de Europa. Esta rana tiene un tamaño medio, llegando a medir alrededor de 5-9 centímetros de longitud. Su coloración varía, pero generalmente presenta tonos marrones, verdes o grises con manchas oscuras en la espalda. La Rana temporaria es conocida por su capacidad de adaptación a diferentes hábitats, desde bosques hasta praderas. Durante la temporada de reproducción, las hembras ponen sus huevos en charcas o estanques, y los renacuajos emergen y se desarrollan en el agua antes de convertirse en ranas adultas. Esta especie desempeña un papel importante en los ecosistemas como controladores de plagas y como presas para otros animales.
7.4 Ovulación
La ovulación ocurre en los anfibios y reptiles cuando las paredes folicular y ovárica se rompen, liberando los óvulos en la cavidad del cuerpo donde migran hacia el infundíbulo de cada oviducto. Los folículos postovulatorios existen solo por poco tiempo en la mayoría de los anfibios y no segregan hormonas. Las paredes del folículo se transforman en cuerpos lúteos en anfibios y reptiles vivíparas. La Corpora lutea produce progesterona, que previene la expulsión de embriones en desarrollo.
Cuando los óvulos pasan a través del oviducto, se depositan membranas protectoras alrededor de ellos. En los anfibios, el óvulo ya está encerrado en una membrana vitelina que fue producida por el ovario. Cada óvulo está recubierto con capas de glicoproteínas a medida que se mueve a través del oviducto. El número de capas fácilmente observables alrededor del óvulo es específico de la especie, aunque las técnicas histológicas y de imágenes especializadas pueden revelar capas o zonas adicionales dentro de las capas. Hasta ocho capas observables rodean el óvulo en algunas salamandras. Los anuros suelen tener menos capas que las salamandras. Los huevos de anfibios son anamnióticos porque carecen de las membranas extraembrionarias características de los reptiles y mamíferos.
7.5 Fertilización y fecundación
La fertilización ocurre cuando un espermatozoide y un óvulo se unen para formar un cigoto diploide “2n”. La fertilización externa ocurre cuando esta unión ocurre fuera de los cuerpos del macho y la hembra, y la fertilización interna ocurre cuando la unión ocurre dentro del cuerpo de la hembra, casi siempre en los oviductos. Los machos producen millones de espermatozoides pequeños, mientras que las hembras producen relativamente pocos huevos. Aunque los huevos de algunos anfibios son pequeños, son órdenes de magnitud más grandes que los espermatozoides.
Durante el apareamiento, muchos espermatozoides alcanzan la entrada del pronúcleo del esperma, la membrana vitelina se separa y eleva, levantando todos los demás espermatozoides de la superficie del óvulo. A medida que el pronúcleo exitoso de espermatozoides se mueve hacia el pronúcleo del óvulo, el óvulo del pronúcleo completa su división meiótica final. La fusión de los dos pronúcleos es la etapa final de la fertilización y restaura la condición diploide (2n) al óvulo fertilizado, que luego se denomina cigoto.
El cigoto pronto comienza el desarrollo a través de la división celular típica: la mitosis de tipo clivaje omitiendo las etapas de crecimiento. El desarrollo embrionario continúa en los huevos fecundados externamente. Las salamandras son inusuales porque tienen fertilización poliespérmica, en la cual más de un pronúcleo de esperma ingresa en el citoplasma del óvulo, pero solo un pronúcleo de esperma se fusiona con el pronúcleo del óvulo.
8. Comportamientos reproductivos
8. Comportamientos reproductivos
Los comportamientos de cortejo y apareamiento varían mucho entre las especies de anfibios. Las señales vocales (auditivas), visuales, táctiles o químicas utilizadas durante el cortejo no solo reúnen a los individuos con fines reproductivos, sino que también brindan oportunidades para la elección de pareja, muerte por depredadores o infección por parásitos que también los escuchan o detectan. Las hormonas influyen en los comportamientos reproductivos. Los machos, pero no siempre las hembras, tienen gametos maduros cuando se produce el apareamiento. En las hembras de algunas especies, los espermatozoides pueden almacenarse y utilizarse para fertilizar los huevos mucho tiempo después del apareamiento.
8.1 Fertilización
Ocurre en la región superior de los oviductos antes de la deposición de la cáscara del huevo. La fertilización también ocurre en la región superior de los oviductos en las cecilias. Por el contrario, la fertilización se produce en la cloaca en salamandras. El momento exacto de la fertilización varía entre las especies. Puede ocurrir inmediatamente después de la cópula o puede demorarse por algunas horas o años después de la cópula (salamandras). Las estructuras de almacenamiento de esperma, que se producen en las salamandras, facilitan la retención del esperma durante largos períodos de tiempo. La fertilización tardía permite que las hembras se apareen con más de un macho y puede resultar en paternidad múltiple entre la descendencia resultante. Por ejemplo, las salamandras manchadas (Ambystoma maculatum) pueden y con frecuencia recolectan paquetes de esperma de más de un macho, los almacenan y fertilizan sus huevos con esperma de múltiples machos.
8.2 Copulación
La cópula en anfibios es un fascinante y diverso proceso que desempeña un papel crucial en la reproducción de estas especies. Los anfibios, como las ranas, sapos y salamandras, presentan una amplia gama de comportamientos y estrategias de apareamiento que varían desde la simple unión temporal hasta rituales complejos y elaborados. En este artículo, exploraremos los diferentes aspectos de la cópula en anfibios, desde las señales de cortejo y atracción hasta los mecanismos de fertilización. Analizaremos cómo la anatomía y el comportamiento de los anfibios se han adaptado para garantizar el éxito reproductivo, y también examinaremos estudios recientes que han revelado descubrimientos sorprendentes sobre la copulación en estas fascinantes criaturas. A través de este artículo, descubriremos la increíble diversidad y complejidad de los procesos de apareamiento en el mundo de los anfibios.
Sapos y ranas
Los espermatozoides se transfieren a las hembras de varias maneras. En la mayoría de las ranas, salamandras criptobrancoides, y presumiblemente sirenidas, ocurre la fertilización externa; el macho libera esperma en los huevos cuando salen de la cloaca de la hembra. En la mayoría de las ranas, el macho agarra a la hembra para que su cloaca se coloque justo por encima de la cloaca de la hembra. Este comportamiento se llama amplexus, y la posición exacta del macho con respecto a la hembra varía entre las especies. En las dos únicas ranas que tienen un verdadero órgano intromitente (Ascaphus truei y A. montanus), el comportamiento de apareamiento se denomina coplexus. El amplexus puede ocurrir en salamandras con fertilización externa, o el macho sigue a la hembra y deposita su esperma directamente en la masa de huevos durante o después de la deposición.
Figura 8.1. Ascaphus truei, comúnmente conocido como la rana tailed frog o rana de cola, es una especie fascinante de anfibio que se encuentra en el noroeste de América del Norte. Esta rana posee características únicas que la distinguen de otras especies. Su nombre deriva de la peculiar estructura en forma de cola presente en los machos, la cual se utiliza en el proceso de reproducción. A diferencia de la mayoría de las ranas, las ranas tailed frog ponen sus huevos en corrientes de agua rápida, y los machos se aferran a las hembras para fertilizar los huevos con sus espermatozoides. Este comportamiento reproductivo y sus adaptaciones únicas hacen de Ascaphus truei un ejemplo notable de la diversidad y complejidad de los anfibios en su proceso de reproducción.
Relativamente pocos anfibios tienen fertilización interna. Entre las ranas, las dos especies de Ascaphus, posiblemente algunas de las 14 especies del género bufónido Mertensophryne, presumiblemente todas las 13 especies del género bufónido Nectophrynoides, una especie del género bufónido Altiphrynoides, la única especie del género bufónido Nimbaphryryides, y dos especies de Eleutherodactylus tienen fertilización interna. Todas las salamandras que no sean sirenidas y criptobrancoides, y todas las cecilias tienen fertilización interna. La fertilización interna generalmente requiere estructuras morfológicas para liberar esperma, y los rituales complejos de apareamiento a menudo se encuentran en estas especies. Las ventajas de la fertilización interna para las hembras incluyen mejores oportunidades para la elección de pareja, cierto control sobre la descendencia durante las etapas tempranas del desarrollo (salamandras) y el control sobre el desarrollo de la descendencia hasta que se depositan los huevos o renacuajos.
Todas las ranas con fertilización interna, excepto Ascaphus y Mertensophryne, utilizan la aposición cloacal para transferir el esperma. Las ranas Ascaphus y las cecilias tienen órganos intromitentes que depositan el esperma en la cloaca adyacente a las aberturas del oviducto. El órgano intromitente en Ascaphus se modifica de la cloaca; la vascularización del tejido permite la acumulación del órgano con sangre, lo que facilita el depósito de esperma en la cloaca de la hembra. Mertensophryne micranotis tiene un orificio espinoso que sobresale, que se puede usar para transferir esperma a la cloaca de la hembra. La estructura reproductiva masculina de las cecilias, el falodio, es una bolsa en la pared cloacal que se invierte en la cloaca de la hembra a través de una combinación de contracciones musculares y presión hidráulica vascular y se retira por un músculo retractor.
Figura 8.2. Mertensophryne micranotis, también conocida como "rana piquito de lanza", es una especie de anfibio perteneciente a la familia Bufonidae. Se encuentra principalmente en las regiones montañosas de África Oriental, como Kenia, Tanzania y Uganda. Esta rana tiene un tamaño pequeño, alcanzando alrededor de 5 centímetros de longitud. Su cuerpo es robusto y su coloración varía entre tonos de marrón y verde, lo que les permite camuflarse en su entorno. Al igual que otras ranas de su familia, Mertensophryne micranotis posee glándulas de veneno en la piel, utilizadas como mecanismo de defensa contra depredadores. Su llamado característico consiste en una serie de notas cortas y rápidas. Esta especie desempeña un papel importante en los ecosistemas donde habita, contribuyendo a controlar la población de insectos y siendo indicador de la salud ambiental.
Salamandras
Los machos de salamandras con fertilización interna producen espermatóforos que se depositan externamente. El espermatóforo consiste en un pedicelo proteináceo cubierto por un paquete de esperma; la estructura se produce a partir de secreciones de varias glándulas en la cloaca del macho. Las salamandras masculinas tienen cortejos elaborados que dependen de las secreciones de varios tipos de glándulas para estimular a las hembras a moverse sobre los espermatóforos y recoger los paquetes de esperma con los labios de la cloaca.
La estructura de almacenamiento de esperma en salamandras, la espermateca, se encuentra en el techo de la cloaca. La espermateca se compone de tubos simples, cada uno de los cuales se abre de manera independiente hacia la cloaca, o un grupo de túbulos que se abren por un conducto común hacia la cámara cloacal principal. Los espermatozoides almacenados son expulsados por la contracción muscular a medida que los huevos entran por los oviductos. Los túbulos de almacenamiento de esperma generalmente no se unen para formar un conducto común en reptiles. Están confinados a la sección media superior de los oviductos entre el infundíbulo y el área secretora de conchas en las tortugas, y a la base del infundíbulo y el extremo inferior de la zona secretora de conchas en los squamates. Debido a su ubicación en los squamates, se ha cuestionado su función para el almacenamiento a largo plazo de los espermatozoides. El mecanismo para expulsar el esperma de los túbulos es desconocido.
8.3 Anidación
Un nido es una estructura discreta construida por un adulto reproductor para la deposición de huevos. Muchos anfibios depositan huevos en el agua y, en consecuencia, un nido no se construye comúnmente. De manera similar, la mayoría de las ranas y salamandras que ponen huevos en la tierra no construyen nidos, sino que dependen de sitios preexistentes debajo de la hojarasca (p. Ej., Eleutherodactylus), encima o debajo de las hojas (p. Ej., Phyllomedusa, centrolénidos) o sobre el suelo debajo de los objetos de la superficie (por ejemplo, salamandras plethodontidas). Los anfibios con nidos terrestres se limitan a ambientes húmedos.
Figura 8.3. Nido de espuma de Engystomops pustulosus (YouTube). La rana túngara (Engystomops pustulosus) es un anfibio de la familia Leptodactylidae. Habita en bosques húmedos y secos en México, América Central, Colombia, Venezuela y Trinidad y Tobago. Mide alrededor de 3 cm y tiene verrugas dorsales pigmentadas. Su hocico es triangular y presenta una membrana timpánica anular y granulosa. No tiene dientes maxilares ni premaxilares. Durante la época lluviosa, el macho atrae a la hembra con su canto y exhibe un sorprendente saco vocal subgular. En el amplexo, el macho fertiliza los huevos de la hembra y los bate con sus piernas para formar una espuma protectora. La incubación dura de 1 a 2 días y la metamorfosis ocurre en 4 a 6 semanas. Estos sapitos comienzan a reproducirse después de 2 a 3 meses de la metamorfosis.
Las ranas de varias familias (por ejemplo, Leptodactylidae, Myobatrachidae, Rhacophoridae) construyen nidos de espuma en los que residen los huevos. Los nidos de espuma se construyen en la superficie del agua (por ejemplo, Leptodactylus ocellatus, Physalaemus) o en depresiones poco profundas en tierra (por ejemplo, Leptodactylus mystaceus). La espuma finalmente se disuelve, y los renacuajos caen al agua debajo y continúan desarrollándose. Los renacuajos de los nidos de espuma terrestre se lavan en pequeños arroyos o estanques cercanos durante las tormentas de lluvia o pueden desarrollarse completamente en el nido y emerger como ranas. Los renacuajos de algunas ranas con nidos de espuma terrestre (por ejemplo, Leptodactylus mystaceus) pueden generar su propia espuma en caso de que la espuma generada por la hembra comience a disolverse. Un craugastorido, Craugastor lineatus, llama desde las entradas de nidos de hormigas cortadoras de hojas (Atta) y construye nidos de espuma en cámaras subterráneas de hormigas.
Figura 8.4. Craugastor lineatus, conocida como rana listada, es un anfibio de la familia Craugastoridae. Se encuentra en América Central y América del Sur, en países como Costa Rica, Panamá, Colombia, Ecuador y Perú. Tiene un tamaño medio de alrededor de 5 cm y su piel presenta líneas y bandas distintivas. Habita en bosques húmedos, tanto en el suelo como en los árboles. Las hembras depositan sus huevos en el suelo o la hojarasca, donde se desarrollan en renacuajos oscuros con una cola larga. La conservación de Craugastor lineatus se ve amenazada por la pérdida de hábitat y la degradación ambiental.
Debido a que algunos de estos contienen agua, los renacuajos pueden desarrollarse allí. Las ranas gladiadoras (Hypsiboas rosenbergi y H. boans) construyen cuencas llenas de agua que aíslan los huevos de los arroyos; Los huevos se depositan como una película superficial sobre el agua en las cuencas. Algunas ranas africanas depositan huevos bajo tierra cerca del agua (por ejemplo, Leptopelis). Posteriormente los renacuajos emergen y entran en el agua. Otras ranas construyen nidos subterráneos, asisten a los huevos y hacen un túnel desde el nido hasta el agua (por ejemplo, Hemisus). Los nidos de salamandras y, presumiblemente, las cecilias con cuidado parental son simples cavidades en el suelo o debajo de la vegetación. Normalmente, las hembras y las salamandras se enrollan alrededor de sus garras al huevo (por ejemplo, Siphonops paulensis, Hemidactylium scutatum).
Figura 8.5. Hemidactylium scutatum, conocida como salamandra de cuatro dedos, es una especie de salamandra que se encuentra en el este de América del Norte, particularmente en áreas boscosas y húmedas. Es reconocida por su pequeño tamaño, alcanzando solo alrededor de 5-9 cm de longitud. Presenta una coloración variable, desde tonos de marrón, gris y verde hasta naranja brillante. Una característica distintiva es su capacidad de desprender la cola como mecanismo de defensa. Son animales principalmente acuáticos, que se alimentan de pequeños invertebrados acuáticos. La conservación de Hemidactylium scutatum se ve amenazada por la destrucción de su hábitat y la contaminación del agua.
Las hembras de anfibios con renacuajos acuáticos seleccionan un sitio de deposición de huevos en agua o en un lugar desde el cual los renacuajos pueden llegar al agua. La humedad alta es necesaria para prevenir la desecación en anfibios con garras terrestres o arbóreas. Cada tipo de sitio de deposición de huevos tiene su propio conjunto de riesgos de depredación. Los estanques temporales suelen albergar larvas depredadoras de libélulas, damiselas, caddis, escarabajos y crustáceos, así como serpientes y tortugas que pueden alimentarse de huevos de anfibios y renacuajos. Los renacuajos son sensibles a las señales químicas emitidas por algunas larvas de insectos y responden a estas larvas al disminuir la actividad o al permanecer en escondites durante largos períodos de tiempo. Las cohortes de Hyalinobatrachium y Agalychnis depositadas en microhábitats arbóreos están sujetas a la depredación de cangrejos grapsidos, serpientes de ojos de gato (Leptodeira) y varios insectos. Los huevos en arroyos y estanques o lagos permanentes están sujetos a la depredación adicional de peces, serpientes y tortugas.
8.4 Determinación del sexo
Si un individuo es masculino o femenino tiene efectos en cascada en su historia de vida, comportamiento, fisiología, a menudo morfología y una serie de otras funciones a lo largo de su vida. Aunque podría parecer intuitivo que el sexo se determinaría en anfibios y reptiles por las diferencias en los cromosomas sexuales, lo que se denomina determinación genética de sexo (GSD) igual que humanos (y en todos los mamíferos), esto no es del todo cierto.
Los tipos más comunes de GSD en anfibios son la heterogamia masculina / femenina como XY / XX (heteromorfos masculinos), ZZ / ZW (heteromorfos femeninos) o cromosomas sexuales homomórficos (cromosomas sexuales indiferenciados, pero la determinación del sexo se encuentra en formas heterogénicas). Todos los anfibios estudiados tienen GSD, aunque los machos son heteromorfos (XY) en algunos y las hembras son heteromorfas (ZW) en otros.
Figura 8.6. Cuidado parental en los anfibios. En el sentido de las agujas del reloj, desde la parte superior izquierda: Hyalinobatrachium valerioi macho que atiende tres masas de huevos de diferentes edades; hembra de Stefania evansi manteniendo huevos expuestos en su parte posterior; Flectonotus fitzgeraldi hembra empollando cinco huevos en bolsas dorsales; Un par amplex de Gastrotheca walkeri. Los huevos grandes, de color amarillo pálido, se expulsan individualmente de la cloaca de la hembra, se fertilizan por el macho y se manipulan en la bolsa de incubación en la espalda de la hembra.
9. Hibridogénesis y cléptogénesis
9. Hibridogénesis y cléptogénesis
La hibridogénesis y la cléptogénesis son fenómenos biológicos intrigantes que ocurren en ciertas especies, desafiando nuestra comprensión de la reproducción y la genética. En este artículo, exploraremos en detalle estos procesos únicos y fascinantes.
La hibridogénesis se refiere a un tipo de reproducción en el cual se producen híbridos entre dos especies distintas, pero estos híbridos solo pueden transmitir los genes de una de las especies progenitoras a su descendencia. Este mecanismo reproductivo crea una separación genética entre las especies involucradas y plantea preguntas intrigantes sobre cómo se mantienen las poblaciones híbridas a lo largo del tiempo.
Por otro lado, la cléptogénesis es un fenómeno en el cual una especie roba el esperma de otra especie sin tener una verdadera reproducción sexual. En lugar de producir su propia descendencia, la especie "cleptógena" utiliza el material genético de la especie donante para generar su progenie. Este proceso desafía nuestra comprensión tradicional de la reproducción y plantea cuestiones sobre los mecanismos moleculares y evolutivos involucrados.
A lo largo de este artículo, examinaremos ejemplos específicos de hibridogénesis y cléptogénesis en diferentes grupos de organismos, como anfibios, peces y insectos. También exploraremos los posibles beneficios y desafíos asociados con estos fenómenos, así como las implicaciones para la conservación y la comprensión de la diversidad biológica.
9.1 Hibridogénesis
Ocurre cuando la mitad del genoma inicial se transmite, pero la otra mitad no. Las hembras híbridas se originan como cruces de dos especies sexuales diferentes y no pueden reproducirse sin aparearse con el macho de una especie sexual. Estas hembras producen solo descendientes femeninos, todas con solo el genoma de la madre. Durante la gametogénesis, el genoma masculino no se incluye y el genoma femenino se duplica, reconstituyendo un cigoto diploide que se convierte en una hembra hibridogenética. Debido a que solo se transmite el genoma de la hembra, la hibrogénesis es hemiclonal.
Figura 9.1. Hibrogénesis en la rana Pelophylax esculentus. Existen dos sistemas generales de reproducción (LE y RE) con especies sexuales y unisexuales, con una variación considerable dentro de cada uno. En tres localidades de Dinamarca, el sur de Suecia y el norte de Alemania, se producen poblaciones totalmente híbridas de P. esculentus en ausencia de especies sexuales. Debido a que el factor "Y" que determina el sexo masculino está en el genoma L, la hibridación puede producir y produce híbridos masculinos. En el sistema RE, los híbridos masculinos (LyRx) son más exitosos que los híbridos femeninos (LxRx) en la reproducción con P. ridibundus, lo que hace que los híbridos femeninos sean menos comunes. Los triploides híbridos se producen en algunas poblaciones cuando un P. lessonae macho (LL) fertiliza un huevo de P.esculentus (LR).
En Europa, dos ranas estrechamente relacionadas, Pelophylax lessonae (genoma L) y P. ridibundus (genoma R), se hibridan en una amplia área geográfica, lo que resulta en la formación de un complejo de híbridos que se conoce colectivamente como Pelophylax esculentus. Pelophylax esculentus está muy extendida en Europa (desde Francia hasta Rusia central) y generalmente es simpátrica con P. lessonae. La hibrogénesis es más compleja en este sistema porque existen tanto diploides (LR) como triploides (LLR) de P. esculentus. Aunque la hibridación entre P. lessonae y P. ridibundus continúa produciendo algo de P. esculentus, la mayoría se produce cuando P. esculentus se hibrida con P. lessonae o P. ridibundus, y algunas se producen por hibridación entre dos P. esculentus.
Cuando P. esculentus ocurre con P. lessonae, el genoma L (P. lessonae) se pierde en la línea germinal (pero no en el soma) de P. esculentus durante la meiosis, y solo se producen gametos con el genoma R. Estos gametos surgen por un desprendimiento premeiótico del genoma de P. lessonae y luego una duplicación del genoma de P. ridibundus restante seguido de una división meiótica normal. Estos gametos deben combinarse con un genoma L de P. lessonae para producir nuevos híbridos, un proceso a menudo denominado parasitismo sexual (similar a la cleptogénesis).
Cuando dos P. esculentus se aparean, la descendencia de RR generalmente muere durante el desarrollo debido a una alta carga de genes deletéreos pareados. En las regiones donde P. esculentus ocurre con P. ridibundus, el genoma de R (P. ridibundus) se pierde en la línea germinal (pero no en el soma) de P. esculentus durante la meiosis, y solo se producen gametos con el genoma L. Estos gametos deben combinarse con un genoma R de P. ridibundus para producir nuevos híbridos. Los híbridos masculinos se producen debido a la determinación del sexo XX-XY y la presencia de gametos X e Y de los machos de P. lessonae, pero P. esculentus generalmente no se aparea con los machos híbridos porque prefieren los machos más pequeños de la especie sexual. En algunas áreas (Dinamarca, sur de Suecia y norte de Alemania) en las que no existe ninguna especie sexual, los individuos de P. esculentus se hibridan entre sí. Estas poblaciones tienen una alta frecuencia de triploides (LLR) que suministran a los gametos L.
Figura 9.2. El costo de la hibridación. El costo (carga híbrida) de la hibrogénesis en Pelophylax esculenta es alto, con aproximadamente el 63% de las crías producidas en híbridos completos que mueren antes o durante la metamorfosis. La aneuploidía ocurre cuando el nivel de ploidía no es un múltiplo del número haploide de cromosomas para las especies.
Las poblaciones completamente híbridas de P. esculentus son de particular interés porque el patrón de gametogénesis debería llevar a la generación de genotipos parentales (por ejemplo, LL y RR), así como a varios híbridos. Sin embargo, los adultos que contienen genotipos parentales no aparecen en la mayoría de las poblaciones híbridas, lo que lleva a la conclusión de que deben morir en una etapa temprana del desarrollo. Los genotipos parentales (LL o RR) aparecen en algunas poblaciones completamente híbridas como juveniles. En consecuencia, se producen genotipos parentales, pero desaparecen antes o poco después de la metamorfosis. Los embriones, las larvas, los renacuajos que se alimentan y los individuos en metamorfosis con genotipos parentales mueren, lo que indica una gran carga híbrida.
Figura 9.3. Ladrones de genes. Cuatro especies sexuales de Ambystoma de las cuales Ambystoma unisexual "roba" genomas. De izquierda a derecha, A. jeffersonianum, A. tigrinum, A. texanum y A. laterale.
En un giro interesante a la historia de P. esculentus, los investigadores ahora han descubierto que algunas de las poblaciones unisexuales se están reproduciendo sexualmente. Específicamente, los híbridos triploides producen huevos diploides que se combinan con una R o L (LL + R o RR + L) de otros individuos en la población, formando algunos nuevos triploides que no llevan solo el genoma de su madre. Debido a que se produce la recombinación, cada individuo difiere como en las especies típicas que se reproducen sexualmente, y por lo tanto está sujeto a selección. Tanto la capacidad de experimentar la recombinación genética como la reproducción independiente son pasos necesarios en la especiación. En lugares donde ocurren híbridos con especies sexuales parentales, esto no ocurre.
9.2 Cleptogénesis
En partes del noreste de América del Norte, muchas agregaciones de cría de salamandras molares como el complejo Ambystoma laterale – jeffersonianum consisten en machos y hembras diploides e individuos poliploides, generalmente hembras. Cuando se reconoció por primera vez la naturaleza compuesta de estas poblaciones reproductoras, se asumió que tanto los individuos diploides (A. laterale [genoma LL] y A. jeffersonianum [JJ]) como las hembras poliploides (A. tremblayi [LLJ] y A. platino [LJJ]) eran especies genéticamente distintas y reproductivamente aisladas, y que los poliploides unisexuales se mantenían mediante hibrogénesis o ginogénesis (un proceso en el cual el esperma de un macho de otra especie que se reproduce sexualmente es necesario para iniciar el desarrollo del huevo, pero el genoma del esperma no incorporado al huevo).
Figura 9.4. Ladrones de genes 2. La cleptogénesis ocurre en las salamandras del complejo Ambystoma laterale – jeffersonianum. El mtDNA ha permanecido sin cambios desde el origen híbrido de poblaciones unisexuales en el Plioceno, pero los unisexuales recogen y usan genomas de especies sexuales cada vez que se reproducen, aunque no pasan esos genomas de generación en generación. En efecto, están "robando" genes adaptados a las condiciones locales de los machos sexuales en cada generación concreta, pero esta no es transmitida, sien do esto un parasitismo genético.
Actualmente, se reconocen 22 ambistomas unisexuales distintos con un número de cromosomas que varían de diploide a pentaploide, y generalmente se asocian con una o más de las cuatro especies sexuales siguientes: A. laterale, A. tigrinum, A. jeffersonianum y A. texanum.
Los datos genéticos recientes ilustran la complejidad del complejo Ambystoma laterale-jeffersonianum y muestran que los unisexuales se separaron de una especie sexual, A. barbouri, hace 2.4–2.9 millones de años, una especie que hoy en día no se superpone geográficamente con los unisexuales. Por lo tanto, todas las poblaciones unisexuales comparten el mismo ADNmt (derivado de A. barbouri), y dependiendo de dónde ocurra cada población, los unisexuales locales "roban-parasitan" genomas nucleares de machos sexuales en los estanques de reproducción. Este proceso da como resultado que los individuos obtengan los beneficios adaptativos asociados con los genomas de las especies sexuales locales ya adaptadas, a la vez que conservan la capacidad de eliminar genes nocivos. A medida que las condiciones locales cambian con el tiempo, las frecuencias genéticas en las especies sexuales cambian a medida que se adaptan a los ambientes cambiantes, y los cleptógenos (unisexuales) obtienen los beneficios al continuar incorporando genomas de las especies sexuales en su soma a través de la cleptogénesis.
10. El huevo amniotico reptiliano
10. El huevo amniotico reptiliano
Amniotas o amniotes (del griego amnios, "membrana que rodea al feto) es un clado de vertebrados tetrápodos que comprende reptiles, aves, y los mamíferos. Los amniotes ponen sus huevos en la tierra o retienen el huevo fertilizado dentro de la madre, y se distinguen de los anamniotas (peces y anfibios), que generalmente depositan sus huevos en el agua. Las fuentes más antiguas, particularmente antes del siglo XX, pueden referirse a los amniotes como "vertebrados superiores" y a los anamniotes como "vertebrados inferiores", basados en la idea desacreditada de la gran cadena evolutiva del ser de las teorías evolutivas predarwinistas. Así pues, la propia definición del grupo se encuentra basada en caracteres relacionados con el ciclo de vida y la reproducción.
Los amniotes son tetrápodos (descendientes de animales de cuatro extremidades) que se caracterizan por tener un huevo equipado con un amnios, una adaptación para poner huevos en la tierra en lugar de en el agua, como suelen hacer los anamniotes (peces y anfibios). Los amnióticos incluyen sinápsidos (mamíferos junto con sus parientes extintos) y sauropsidos (reptiles y aves), así como sus ancestros, de vuelta a los anfibios. Los embriones de amniotas, ya sea puestos como huevos o llevados por la hembra, están protegidos y ayudados por varias membranas extensas. En los mamíferos euterianos (como los humanos), estas membranas incluyen el saco amniótico que rodea al feto. Estas membranas embrionarias y la falta de un estadio larvario distinguen a los amniotas de los anfibios tetrápodos (M. Benton, 2014).
Los primeros amniotes, denominados "amniotas basales", se parecían a pequeños lagartos y evolucionaron a partir de los reptiliomorfos anfibios hace unos 312 millones de años (Benton & Donoghue, 2006), en el período geológico carbonífero. Sus huevos pueden sobrevivir fuera del agua, permitiendo que los amniotes se ramifiquen hacia ambientes más secos. Los huevos también son capaces de "respirar" y hacer frente a los desechos metabólicos en un ambiente confinado, permitiendo que los huevos y los propios amniotas se conviertan en formas más grandes, aun desde que son crías.
10.1 El huevo amniótico
Los huevos de peces y anfibios tienen una sola membrana interna, la membrana embrionaria o Vitelio que sirve como reserva de alimento. El huevo de amniota desarrolló nuevas estructuras internas para acomodar el intercambio de gases entre el embrión y la atmósfera y para tratar los desechos. Después de que se desarrollaron estas estructuras, una mayor adaptación permitió a los amniotes poner huevos más grandes y reproducirse en hábitats más secos. La evolución de los huevos más grandes se abrió para crías más grandes y, en consecuencia, adultos más grandes, con aquellos que se adaptaron a una dieta de peces y otros animales acuáticos que se hicieron más grandes que los tetrápodos terrestres. Sin embargo, el crecimiento adicional de este último se vio limitado por su posición en la cadena alimentaria terrestre, que estaba restringida al nivel tres y por debajo, y solo los invertebrados ocupaban el nivel dos. Los amniotas eventualmente experimentarían radiaciones adaptativas cuando algunas especies desarrollaron la capacidad de digerir plantas y se abrieron nuevos nichos ecológicos, permitiendo un mayor tamaño corporal de herbívoros, omnívoros y depredadores.
Los amniotes modernos se separan de los tetrápodos basales principalmente por el hecho de que ponen huevos que tienen conchas semipermeables y que contienen suficiente líquido y alimento para que el embrión se desarrolle completamente como una cría terrestre, así pues, los amniotas tienen un desarrollo directo, con todas sus etapas larvarias contenidas en el huevo. Los huevos no se depositan en el agua, y no hay una etapa larvaria acuática, el renacuajo. En general, los amniotas ponen muchos menos huevos que los anfibios o los peces porque se debe invertir más energía reproductiva en cada huevo y porque los jóvenes están un poco más protegidos de la depredación a una etapa muy posterior en el desarrollo. La reproducción también tiene lugar en tierra seca, por lo que la fertilización interna es esencial, lo cual a su vez ofrece a las hembras mayor control sobre la selección de machos, y presiona a los machos a generar caracteres sexuales secundarios más marcados.
Figura 10.1. El huevo amniótico. Es un estanque en miniatura, donde la cría pasa todas sus etapas larvarias, antes de eclosionar como un adulto en miniatura, aunque sexualmente inmaduro. La yema o vitelio “yolk” es fuente de alimento, el alantoides “allantois” es la caneca de la basura, el amnios protege al embrión y el corión envuelve a los otros tres sacos junto al embrión.
huevo de los amniotas, llamado huevo amniótico o cleidoico (literalmente "cerrado") tiene dos características clave.
(a) Una cáscara semipermeable: generalmente calcárea, pero correosa en serpientes, algunas lagartijas y algunas tortugas, que permite que los gases pasen (oxígeno) o hacia afuera (dióxido de carbón residual), pero mantiene los fluidos en el interior.
(b) Membranas extraembrionarias: membranas especializadas que se encuentran "fuera" del embrión, el corion, el amnios, el alantoides mientras que el Vitelio ya estaba presente en linajes ancestrales. El corion rodea el embrión y al saco vitelino, mientras que el amnios rodea el embrión con agua. Ambas funcionan como protección y transferencia de gases metabólicos. El alantoides forma un saco que interviene en la respiración y almacena materiales de desecho. A medida que se desarrolla el embrión, el saco vitelino, lleno de alimentos altamente proteínicos, disminuye y la alantoides se llena con desechos.
Los huevos fósiles son raros. Los ejemplos más antiguos son del Triásico, mucho más jóvenes que el tiempo de origen de los amniotes. En ausencia de huevos carboníferos, ¿cómo podemos identificar a Hylonomus y Paleothyris como los amniotes más antiguos? El argumento es filogenético. Las características intrincadas del huevo cleidoico de todos los amniotas vivos se desarrollan de la misma manera, y por lo tanto es muy probable que el huevo cleidoico sea una apomorfia amniota, una característica que surgió solo una vez en el ancestro común de reptiles, aves y mamíferos. Hylonomus y Paleothyris ya se encuentran en uno de los principales linajes de amniota, por encima de la división inicial entre los ancestros de tortugas, lagartos y mamíferos, por lo que el huevo amniótico debe haber surgido en un punto del cladograma debajo de esos amniotas.
Figura 10.2. Abuelo reptil. Hylonomus (del griego hylo- "bosque" + nomos "habitante") es un género extinto de saurópsido (reptil) que vivió hace 312 millones de años a finales del período Carbonífero. Es el reptil más antiguo conocido de manera inequívoca hasta 2014. La especie tipo y única conocida es Hylonomous lyelli. Se cree que fue uno de los primeros reptiles terrestres, y sus fósiles han sido encontrados en Norteamérica y Europa. Tenía un cuerpo alargado y un cráneo estrecho con dientes pequeños y afilados, lo que sugiere que se alimentaba de insectos y otros invertebrados. Hylonomous lyelli desempeñó un papel importante en la evolución de los reptiles, al ser un antecesor de los reptiles modernos. Su existencia y características proporcionan valiosa información sobre la transición de los vertebrados hacia la vida terrestre.
10.2 Reproducción en los reptiles
Los reptiles generalmente se reproducen sexualmente, aunque algunos son capaces de reproducirse asexualmente. Toda la actividad reproductiva ocurre a través de la cloaca, la única salida / entrada en la base de la cola donde también se eliminan los desechos. La mayoría de los reptiles tienen órganos copulatorios, que generalmente se retraen o invierten y se almacenan dentro del cuerpo. En las tortugas y los cocodrilos, el macho tiene un solo pene mediano, mientras que los squamates, que incluyen serpientes y lagartos, poseen un par de hemipenes, solo uno de los cuales se usa típicamente en cada sesión. Las tuataras, sin embargo, carecen de órganos copuladores, por lo que el macho y la hembra simplemente presionan sus cloacas juntas mientras el macho descarga esperma (Lutz & Lutz, 2005).
Anatomía del huevo
La mayoría de los reptiles ponen huevos amnióticos cubiertos con corpiños o conchas calcáreas. Un amnios, corion y alantoides están presentes durante la vida embrionaria.
Figura 10.3. Partes del huevo amniótico. Diagrama de huevo de cocodrilo 1. cáscara de huevo, 2. saco vitelino, 3. yema (nutrientes), 4. vasos, 5. amnios, 6. corion, 7. espacio aéreo, 8. alantois, 9. albúmina (clara de huevo), 10. saco amniótico, 11. embrión de cocodrilo, 12. líquido amniótico.
La cáscara del huevo (Figura 10.3-1) protege al embrión de cocodrilo (Figura 10.3-11) y evita que se seque, pero es flexible para permitir el intercambio de gases. El corion (Figura 10.3-6) ayuda al intercambio de gases entre el interior y el exterior del huevo. Permite que el dióxido de carbono salga del huevo y que el gas de oxígeno ingrese al huevo. La albúmina (Figura 10.3-9) protege aún más al embrión y sirve como reservorio para el agua y las proteínas. La alantoides (Figura 10.3-8) es un saco que recoge los desechos metabólicos producidos por el embrión. El saco amniótico (Figura 10.3-10) contiene líquido amniótico (Figura 10.3-12) que protege y amortigua el embrión. El amnios (Figura 10.3-5) ayuda en la osmorregulación y sirve como depósito de agua salada. El saco vitelino (Figura 10.3-2) que rodea la yema (Figura 10.3-3) contiene proteínas y nutrientes ricos en grasa que son absorbidos por el embrión a través de los vasos sanguíneos (Figura 10.3-4) que permiten que el embrión crezca y se metabolice. El espacio de aire (Figura 10.3-7) proporciona oxígeno al embrión mientras se está incubando. Esto asegura que el embrión no se asfixie mientras se está incubando.
Viviparidad
No hay etapas larvales de desarrollo. La viviparidad y la ovoviviparidad han evolucionado en muchos clados extintos de reptiles, en lagartos y serpientes, muchas especies, incluidas todas las boas y la mayoría de las víboras, utilizan este modo de reproducción. El grado de viviparidad varía; algunas especies simplemente retienen los huevos hasta justo antes de eclosionar, otras proporcionan alimento materno para complementar la yema, y otras carecen de yema y proporcionan todos los nutrientes a través de una estructura similar a la placenta de los mamíferos. El primer caso documentado de viviparidad en reptiles es el de los mesosaurios pérmicos tempranos(Piñeiro, Ferigolo, Meneghel, & Laurin, 2012), aunque algunos individuos o taxones en ese clado también pueden haber sido ovíparos porque también se ha encontrado un supuesto huevo aislado. Varios grupos de reptiles marinos mesozoicos también exhibieron viviparidad, como mosasaurios, ictiososaurios y sauropterigios, un grupo que incluye paquipleurosaurios y plesiosaurios (Sander, 2012).
Reproducción asexual
Se ha identificado la reproducción asexual en los Squamata en seis familias de lagartos y una de serpientes. En algunas especies de Squamata, una población de hembras puede producir un clon diploide unisexual de la madre. Esta forma de reproducción asexual, llamada partenogénesis, ocurre en varias especies de gecko, y está particularmente extendida en los teides (especialmente Aspidocelis) y lacéridos (Lacerta). En cautiverio, los dragones de Komodo (Varanidae) se han reproducido por partenogénesis. Se sospecha que las especies partenogenéticas ocurren entre camaleones, agamidas, xantusidos y tiflópidos.
Algunos reptiles exhiben determinación de sexo dependiente de la temperatura (TDSD por sus siglas en inglés), en la cual la temperatura de incubación determina si un huevo en particular se incuba como macho o hembra. TDSD es más común en tortugas y cocodrilos, pero también ocurre en lagartos y tuataras (Capel, 2019). El cambio de macho a hembra o de hembra a macho también denominado "hermafroditismo secuencial" es común en peces, raro en anfibios y reptiles, y nunca ha sido reportado en aves y mamíferos (Balthazart & Ball, 2019).
Figura 10.4. Reptiles vivíparos. Los ictiosauros eran reptiles marinos, de los cuales se tiene evidencia fósil inequívoca de tener un modo reproductivo vivíparo, muy semejante al de los cetáceos modernos.
11. Sistema reproductor de los reptiles
11. Sistema reproductor de los reptiles
En los anfibios y reptiles, las gónadas femeninas y masculinas (ovarios y testículos, respectivamente) se desarrollan a partir de los mismos órganos embrionarios. Los órganos indiferenciados surgen en la pared del cuerpo entre la mitad de los riñones. Las células germinales o gametos migran hacia cada órgano e inician la reorganización y consolidación del tejido pregonadal en una corteza externa y una médula interna. Más tarde, cuando se produce la diferenciación sexual, la corteza se transforma en un ovario en las hembras y la médula en un testículo en los machos.
Figura 11.1. Anatomía urogenital de las hembras de tetrápodos. (a) Anfibios. (b) Reptiles y aves. (c) Mamíferos. En líneas segmentadas se encuentran estructuras renales que se pierden en el curso de la evolución y desarrollo embrionario.
Estructuralmente, las gónadas masculinas y femeninas son bastante diferentes. El ovario es un saco de pared delgada con células germinales intercaladas entre las paredes ovárica interna y externa. Las células germinales se dividen, se duplican y producen óvulos. Una sola capa de células foliculares en el epitelio de la pared ovárica encierra cada óvulo, proporcionando apoyo y nutrición. Esta unidad, el folículo, que consiste en las células del óvulo y el folículo, crece hacia la luz del ovario. Numerosos folículos en desarrollo forman la porción visible de los ovarios en hembras grávidas. El testículo es una masa de túbulos seminíferos enroscados y encerrados en un saco de pared delgada. Pequeñas cantidades de tejido intersticial llenan los espacios entre los túbulos.
11.1 Sistema reproductor femenino
En los reptiles, un par de ovarios ocupa el mismo lugar que los testículos de los machos, y el ovario derecho precede a la izquierda en los Squamata. Cada ovario es una agregación de células epiteliales, tejido conectivo, nervios, vasos sanguíneos y uno o más lechos de células germinales encajonados en una túnica elástica. Dependiendo de la etapa de la ovogénesis, cada ovario puede ser una estructura pequeña de apariencia granular o un saco lobular grande lleno de folículos esféricos o elipsoidales. Un oviducto es adyacente pero no continuo con cada ovario. El ostium (boca) del oviducto se encuentra al lado de la parte anterior del ovario; se agranda durante la ovulación para atrapar los óvulos. El cuerpo del oviducto tiene una porción secretora de albúmina seguida de una porción más gruesa que secreta la concha. Los oviductos se abren independientemente en el seno urogenital de la cloaca.
Figura 11.2. Sistemas urogenitales de hembras de tetrápodos, vistas ventrales. (a) Rana: Se extirparon el intestino, la vejiga urinaria y el ovario izquierdo para revelar las estructuras subyacentes. Los conductos urinarios del lado derecho se retiran del riñón para mostrar su curso. (b) Salamandra. (c) Reptil, Sphenodon. (d) Pájaro, Columba.
11.2 Sistema reproductor masculino
El testículo es una masa de túbulos seminíferos, células intersticiales y vasos sanguíneos encerrados en una vaina de tejido conectivo. Las paredes de los túbulos seminíferos están revestidas con tejido germinal. El esperma producido por estos túbulos se vacía a través del conducto eferente hacia el epidídimo en la cara medial del testículo. Los ductulos se unen en el epidídimo ductus que corre hacia la cloaca como el conducto (ductus) deferens. En forma, los testículos varían de ovoide a forma de huso. Los testículos suelen ser adyacentes entre sí, aunque el testículo derecho se encuentra antes, especialmente en las serpientes y la mayoría de los lagartos. Todos los reptiles vivos tienen órganos copulatorios, que son rudimentarios en Sphenodon. Los cocodrilos y las tortugas tienen un solo pene mediano que se origina en el piso de la cloaca. Los Squamata tienen un par de hemipenes, cada uno de los cuales se origina en la unión de la abertura cloacal y la base de la cola.
12. Gametogénesis en reptiles
12. Gametogénesis en reptiles
La gametogénesis es semejante en todos los vertebrados, así que puede consultar la descripción hecha en peces, anfibios o en el ser humano, así que nos enfocaremos en las características propias de los reptiles, que tienen que ver con el huevo.
En los reptiles, la vitelogenina se absorbe selectivamente durante un proceso llamado pinocitosis por los ovocitos y se convierte enzimáticamente en las proteínas de la plaqueta de la yema lipovitelina y la fosvitina. La primera fase de la vitelogénesis suele ser lenta, con poco crecimiento observable en los óvulos. Durante la última fase de la vitelogénesis, el crecimiento del óvulo es rápido. Antes de la ovulación (liberación de óvulos de los ovarios), un óvulo maduro es de 10 a 100 veces su tamaño original. La asignación de energía a la reproducción a menudo se ve como un continuo entre el uso de energía almacenada (capital) y la energía (ingreso) recientemente adquirida. La reproducción está soportada por la energía almacenada y recientemente adquirida en el lagarto australiano Amphibolurus muricatus, pero cada uno contribuye de manera diferente a la producción de huevos. El lípido del huevo se deriva en gran parte de la energía almacenada, mientras que la proteína del huevo se deriva de la energía almacenada y recientemente adquirida. Además, la hembra A. muricatus usa ambos tipos de energía entre la primera y la segunda vez en la temporada de apareamiento, pero las contribuciones relativas de cada tipo de energía varían.
Figura 12.1. Amphibolurus muricatus, conocido comúnmente como el dragón de agua espinoso, es una especie de lagarto que se encuentra en Australia. Este lagarto de tamaño mediano destaca por su aspecto único y su comportamiento interesante. Posee una cola espinosa y una piel rugosa que le ayuda a camuflarse en su entorno. Además, tiene una cresta dorsal prominente y una barbilla naranja brillante que utilizan en rituales de cortejo. Los dragones de agua espinosos son reptiles diurnos y se alimentan principalmente de insectos y otros pequeños invertebrados. Su capacidad para nadar y trepar los convierte en depredadores versátiles. Estos fascinantes lagartos son un ejemplo notable de la diversidad y adaptación de la vida en los ecosistemas australianos.
El óvulo está finalmente encerrado en una cáscara duradera y resistente en reptiles que ponen huevos. Mientras que, en la porción superior del oviducto, el óvulo está recubierto secuencialmente con albúmina y varias capas delgadas de fibras proteicas. La capa de fibra está impregnada con cristales de calcita en cocodrilos y escamatos, y cristales de argonita en tortugas.
Poco después de la ovulación y la fertilización (12 horas o menos en Sceloporus woodi), las glándulas endometriales en el oviducto producen las fibras proteicas que constituyen la estructura de soporte de la cáscara del huevo. La distribución de aminoácidos en la porción de proteína de las cáscaras de huevo escamosas afecta la permeabilidad. Los niveles relativamente bajos de aminoácidos, especialmente la prolina, en los huevos de gecko de cáscara rígida pueden contribuir a la capacidad de estos huevos para resistir la desecación en comparación con los huevos con cáscara flexible que contienen más aminoácidos y niveles más altos de prolina. La estructura de la concha varía considerablemente entre las especies de reptiles ovíparas, pero todas las conchas proporcionan cierta protección contra la desecación y la entrada de pequeños organismos.
Figura 12.2. Sceloporus woodi, conocido comúnmente como el lagarto de Wood, es una especie de lagarto endémico de México. Este lagarto de tamaño mediano se caracteriza por su cuerpo delgado y alargado, y su piel escamosa de color marrón claro con manchas oscuras. Este lagarto suele tener una coloración marrón o grisácea, a veces con manchas o rayas más oscuras en el cuerpo, lo que le permite camuflarse en su entorno rocoso y arbustivo. Es diurno y se alimenta principalmente de insectos y otros pequeños invertebrados.
13. Determinación del sexo en los reptiles
13. Determinación del sexo en los reptiles
Entre los reptiles, la determinación del sexo es mucho más compleja, y aún no se comprende del todo. Un descubrimiento notable en 1971 reveló que las temperaturas de incubación influyeron en el sexo de las crías en dos especies de tortugas, Testudo graeca y Emys orbicularis. Este descubrimiento fue sorprendente porque se asumió que el sexo estaba controlado genéticamente en todos los vertebrados. La inversión sexual ocurre en los anfibios y peces larvales, pero esto no es lo mismo.
Figura 13.1. Sexo y temperatura. Las relaciones de sexos para cuatro especies de tortugas (Gopherus polyphemus, G. agassizii, Testudo graeca, T. hermanni) aumentaron a diferentes temperaturas de incubación, lo que demuestra que los machos se producen a bajas temperaturas de desarrollo y las hembras se producen a altas temperaturas de desarrollo.
Estudios posteriores han demostrado que la determinación del sexo dependiente de la temperatura (TSD por sus siglas en inglés; más generalmente conocida como determinación del sexo ambiental o ESD por sus siglas en inglés) está generalizada en los reptiles, por ejemplo las tuataras, ambas especies de Sphenodon; cocodrilos: confirmados para 12 especies en tres familias, probablemente ocurren en todas las especies; tortugas: confirmadas para 68 de las 84 especies analizadas, con representantes de 12 familias; escamatas: confirmado para 20 de 27 especies analizadas en Gekkoidea (la mayoría en Diplodactylidae y Eublepharidae), 13 de 25 especies analizadas en Agamidae y cuatro de seis especies analizadas en Scincidae.
Entre las serpientes (Serpentes), ninguna de las 11 especies examinadas tenía EET. Debido a que los cromosomas sexuales no están involucrados y la ETS ocurre temprano durante el desarrollo, es claramente una determinación sexual y no una inversión sexual. La TSD generalmente se asocia con la falta de cromosomas heteromórficos, pero esto no necesariamente causa la TSD. Además, la determinación del sexo en algunos taxones no es ni GSD ni TSD. Se ha demostrado que elementos tanto de GSD como de TSD se producen dentro de especies individuales e incluso dentro de una sola población. La TSD es relativamente fácil de establecer en el laboratorio bajo condiciones controladas. Sin embargo, establecer que esto ocurre en la naturaleza ha sido un desafío. Entre las especies con ETS, el rango de temperatura en el que se determina el sexo es relativamente pequeño y varía algo entre las especies.
Análisis filogenéticos de los orígenes de la determinación del sexo en los vertebrados reveló que la GSD era la condición ancestral en los saurópodos, y que la ETS no solo surgió de manera independiente, sino que también se perdió varias veces. TSD es ancestral en tortugas y lepidosaurianos (Rhynchocephalia + Squamata). La GSD ha evolucionado desde la TSD al menos seis veces en las tortugas, y tanto la heterogeneidad masculina como la femenina han evolucionado varias veces. TSD puede haber evolucionado a partir de GSD en los Agamidae.
En las especies estudiadas con TSD, la determinación del sexo ocurre durante el segundo trimestre de desarrollo, y la temperatura “promedio” durante ese período regula la dirección de la diferenciación de las gónadas. En el rango de temperatura umbral, las gónadas pueden convertirse en ovarios o testículos.
(a) En la mayoría de los cocodrilos y lagartos, los machos resultan de altas temperaturas, mientras que las hembras resultan de bajas temperaturas.
(b) En las tortugas, las hembras se desarrollan a altas temperaturas y los machos a bajas
(c) En unos pocos cocodrilos, tortugas y lagartos, las hembras se desarrollan a altas y bajas temperaturas, los machos en las intermedias. El mecanismo fisiológico de la ETS apenas comienza a entenderse.
A temperaturas apropiadas para la producción de un sexo sobre el otro, la enzima aromatasa se produce en individuos que se convertirán en hembras y la 5-reductasa se produce en aquellas que se convertirán en machos. Estas enzimas inducen la conversión de testosterona en estradiol para iniciar la diferenciación ovárica o dihidrotestosterona para iniciar la diferenciación de los testículos, respectivamente. Los genes que codifican la producción de aromatasa o 5-reductasa se activan o desactivan según la temperatura. Las hormonas esteroides de la yema, que pueden afectar el desarrollo y crecimiento del embrión, también pueden influir en la determinación del sexo. Los factores genéticos, maternos y ambientales contribuyen a la determinación de los fenotipos sexuales.
Las implicaciones y consecuencias ecológicas de la ETS son fascinantes y complejas, y las hipótesis van desde la ETS que no tiene ningún valor adaptativo (neutral) a la ETS que afecta el comportamiento materno, la supervivencia, la fecundidad y las relaciones sexuales. Lo que surge es la comprensión de que los factores endógenos y ambientales que favorecen los cambios en el fenotipo sexual son complejos, y no es probable que una sola hipótesis explique todos los casos de ETS. La capacidad de manipular el sexo de la descendencia debe producirse cuando el rendimiento de la aptitud para la madre progenitora varía según el sexo de la descendencia. El modelo más robusto para la evolución de la determinación del sexo ambiental (TSD en particular) fue propuesto por los Dres. Eric Charnov y Mike Bull en 1977 y ahora se llama el modelo Charnov-Bull. Su modelo especifica que la TSD se verá favorecida si se cumplen tres condiciones:
(a) el entorno es irregular (espacial o temporalmente), de modo que un sexo producido en un parche en particular tiene una aptitud más alta de la que tendría si se produjera en otro parche,
(b) los parches no pueden ser elegidos por descendientes o padres, y
(c) el apareamiento es aleatorio con respecto al parche. Hasta hace poco, ninguno de los muchos estudios sobre TSD ha apoyado inequívocamente este modelo.
A medida que los climas cambian, ya sea debido a eventos cíclicos naturales o al calentamiento global inducido por el hombre, los cambios en las temperaturas en los hábitats de anidación podrían alterar la proporción de sexos de la población y, en última instancia, la supervivencia de las especies.
Figura 13.2. Genética vs ambiente. Los factores genéticos y ambientales afectan los fenotipos de embriones y crías y pueden afectar el sexo de las crías en especies que tienen la determinación de sexo dependiente de la temperatura (ETS). Los efectos maternos afectan a los efectos genéticos y ambientales, mientras que los efectos paternos son solo genéticos.
Ya se han observado sesgos en la proporción de sexos mayores en poblaciones de Alligator mississippiensis y Caretta caretta según la ubicación del nido. En ambos casos, las proporciones de sexos fueron altamente sesgadas hacia las hembras. Finalmente, cualquier esfuerzo por controlar las poblaciones de especies sensibles en las cuales ocurre la TSD debe considerar los efectos potenciales a largo plazo de la variación en las temperaturas de los nidos, ya sea en condiciones naturales o cuando los huevos se crían en el laboratorio para su liberación en el medio silvestre.
Figura 13.3. El Alligator mississippiensis, también conocido como el caimán americano o cocodrilo del Mississippi, es una especie de reptil que habita en las áreas pantanosas y ríos de América del Norte. Este imponente depredador se caracteriza por su cuerpo robusto, piel escamosa y una mandíbula poderosa llena de dientes afilados. Puede alcanzar tamaños impresionantes, llegando a superar los 4 metros de longitud. Su dieta se compone principalmente de peces, aves, mamíferos y reptiles. Los cocodrilos del Mississippi desempeñan un papel importante en los ecosistemas acuáticos, manteniendo el equilibrio y controlando las poblaciones de presas. Aunque han sido objeto de caza y la destrucción de su hábitat, han experimentado una recuperación exitosa gracias a los esfuerzos de conservación.
14. Partenogénesis reptiliana
14. Partenogénesis reptiliana
La partenogénesis ocurre cuando las hembras se reproducen sin la participación de machos o espermatozoides (YouTube). La herencia es clonal, y las crías hembras son genéticamente idénticas a sus madres. La partenogénesis se descubrió por primera vez en el lagarto armenio Darevskia saxicola, y ahora se sabe que la partenogénesis obligatoria ocurre naturalmente en ocho familias de lagartos y en una familia de serpientes. De las más de 50 especies de escamosos partenogenéticos reconocidos actualmente, casi todas las especies estrictamente clonales parecen haberse originado como resultado de la hibridación de dos especies sexuales o por retrocruzamiento con un sexual. Las pruebas de ADN han demostrado que la hibridación no estuvo involucrada en los dos orígenes de la partenogénesis en el género xantusídico Lepidophyma.
Figura 14.1. Genealogía de los lagartos partenogenéticos gimnftalmidios. Las líneas que se originan en los nombres de las especies denotan a los padres que hibridaron para crear las partenoformas / partenógenos (círculos negros). En muchos casos, un solo evento de hibridación produjo partenoformas diploides; en otros, una sola hibridación produjo partenoformas triploides, y en otras, retrocruzas entre partenoformas y una especie sexual produjo partenoformas triploides. La partenogénesis ha surgido independientemente en Teioidea varias veces.
La confirmación inicial de que la partenogénesis estaba ocurriendo en los lagartos fue el resultado de estudios en los cuales los individuos nacidos en laboratorios se criaron de forma aislada y comenzaron a producir crías. Debido a que la mayoría de estas partenoformas se produjeron por hibridación, la heterocigosidad es alta. La variación genética dentro de un individuo es alta, pero la variación genética entre individuos generalmente es casi inexistente. Se ha demostrado una baja variación genómica dentro de los clones de lagartos partenogenéticos con estudios sobre la histocompatibilidad de los trasplantes de piel. Casi el 100% de los injertos de piel trasplantados entre individuos (dos poblaciones) de las especies de partenoformas Aspidoscelis uniparens fueron aceptados permanentemente, mientras que no se aceptaron injertos de piel entre individuos dentro de una población de la especie sexual A. tigris, lo que sugiere que todos los A. uniparens pueden se remontan a un solo individuo.
Figura 14.2. Aspidoscelis uniparens, conocida comúnmente como la lagartija de la fertilidad, es una especie de lagarto nativo del suroeste de Estados Unidos y norte de México. Lo que hace a esta especie notable es su capacidad de reproducirse mediante partenogénesis, lo que significa que las hembras pueden producir crías viables sin la necesidad de aparearse con un macho. Esto se debe a su habilidad para duplicar sus cromosomas y desarrollar embriones sin fertilización. La lagartija de la fertilidad se alimenta de insectos y otros invertebrados, y es conocida por su agilidad y velocidad en la captura de presas. Estudios recientes han revelado más información sobre los mecanismos genéticos y reproductivos de esta fascinante especie.
A pesar de que algunos lagartos cola de látigo partenogenéticos parecen ser uniformes en todo su rango (por ejemplo, los uniparentales A generalizados), otros no. Existen tres clases distintas de patrones de color en el cola de látigo unisexual A. dixoni, cuyo origen se remonta a un único evento de hibridación entre la especie sexual A. tigris marmorata y A. gularis septemvittata. Los estudios de histocompatibilidad basados en trasplantes recíprocos de piel confirman el origen único y sugieren que las clases de patrones resultaron de la mutación o recombinación que se produce dentro del único histórico unisexual. La variación genética entre individuos de la lagartija de roca caucásica Darevskia unisexualis ha resultado de mutaciones en los microsatélites “variaciones genéticas mínimas empleadas para la identificación de paternidad”. Las mutaciones se producen en las primeras etapas de la embriogénesis e implican inserciones o deleciones de microsatélites individuales.
Figura 14.3. Darevskia unisexualis, también conocida como la lagartija partenogenética del Cáucaso, es una especie de lagarto que se encuentra en la región del Cáucaso, en Europa Oriental y Asia Occidental. Esta especie es particularmente interesante debido a su modo de reproducción exclusivamente partenogenético, lo que significa que las hembras pueden producir crías fértiles sin la necesidad de aparearse con un macho. Estas lagartijas son capaces de duplicar sus cromosomas y generar embriones viables sin fecundación, lo que les confiere una ventaja reproductiva única. La Darevskia unisexualis es conocida por su colorido patrón de escamas y su hábito de vivir en ambientes montañosos y rocosos. Estudios científicos han profundizado en los mecanismos genéticos y evolutivos de esta fascinante especie.
Los eventos citogenéticos que resultan en la producción de huevos con la misma ploidia que la madre se han detallado solo en A. uniparens. La duplicación premeiótica de los cromosomas produce un oogonio tetraploide, seguido de una meiosis normal que produce óvulos con el mismo número de cromosomas que la parental femenina. La mayoría de los squamates partenogenéticos son diploides, pero algunos son triploides. La condición triploide resulta del retrocruzamiento entre una hembra de origen híbrido y un macho normal de una de las especies parentales originales (Figura 14.1).
Algunas especies parecen ser facultativamente partenogenéticas. Las hembras cautivas de los dragones de Komodo, los monitores del Nilo, las serpientes de sierra y las pitones indias producen huevos o crías de vez en cuando sin la participación del esperma. En los pitones, todas las crías producidas partenogenéticamente eran genéticamente idénticas a las madres, mientras que, en los dragones de Komodo, las hembras producidas partenogénicamente eran homocigotas para todos los loci, pero existía una variación entre las crías. En ambos casos, las hembras parentales también se reproducen sexualmente. En consecuencia, estos sistemas representan instancias no inducidas por hibridación de la partenogénesis facultativa y presentan un sistema reproductivo que podría ser de particular interés para los estudios sobre la evolución del sexo. En el monitor del Nilo, una hembra que nunca había estado en contacto con un macho produjo 21 huevos, dos de los cuales contenían embriones.
Aunque el mecanismo citogenético que inicia el desarrollo es desconocido en los escamosos partenogenéticos, un comportamiento bastante extraño, la pseudocopulación, en la cual una hembra se comporta como un macho e intenta aparearse con otra hembra, ocurre comúnmente en condiciones de laboratorio en algunos partenógenos. Este comportamiento se ha observado en el campo, pero parece ser poco común. Las comparaciones de los niveles hormonales en las hembras cortejadoras y en las hembras cortejadas de tres partenógenos (Aspidoscelis tesselatus, A. uniparens y A. velox) muestran que la hembra cortejada es preovulatoria y la cortejadora femenina es postovulatoria u ovogenéticamente inactiva. El cortejo y la pseudocopulación estimulan la ovulación, lo que indica que la hembra cortejada está respondiendo como si hubiera ocurrido el apareamiento con un macho. L
Figura 14.4. El Aspidoscelis tesselata, conocido como el lagarto de cola ajedrezada o checkered whiptail en inglés, es una especie de lagarto que se encuentra en América del Norte. Este lagarto es reconocido por su patrón distintivo de escamas en forma de cuadros o ajedrezado en su cuerpo y cola. La coloración de fondo puede variar, pero generalmente es de tonos marrón o grisáceo. Son lagartos de tamaño mediano, con cuerpos alargados y colas largas y delgadas. Son animales diurnos y se alimentan principalmente de insectos y otros invertebrados. El lagarto de cola ajedrezada es ágil y rápido, y a menudo se encuentra en hábitats rocosos y secos.
Las hembras que experimentan pseudocopulación parecen producir óvulos a un ritmo más rápido que los que no se involucran en el comportamiento. La importancia evolutiva de la pseudocopulación sigue sin estar clara porque no se conocen diferencias genómicas entre las hembras en los clones que participan en la pseudocopulación y las que no lo hacen. Sin embargo, este sistema brinda oportunidades únicas para estudiar el papel de los comportamientos específicos (cortejo y comportamiento de la copulación) en la reproducción femenina sin las variables adicionales asociadas con los machos.
15. Comportamientos reproductivos
15. Comportamientos reproductivos
El comportamiento reproductivo es un aspecto fundamental en la vida de muchas especies, ya que garantiza la perpetuación de su linaje y la supervivencia de la población. A lo largo de la historia evolutiva, los animales han desarrollado una amplia variedad de estrategias y conductas relacionadas con la reproducción, adaptadas a su entorno y a las características de cada especie. Desde rituales de apareamiento y cortejo hasta la selección de parejas, construcción de nidos, cuidado parental y competencia por recursos, estos comportamientos son el resultado de complejas interacciones entre factores biológicos, ambientales y sociales. En este artículo, exploraremos diferentes aspectos de los comportamientos reproductivos en el reino animal, analizando estudios científicos recientes y examinando ejemplos concretos de diversas especies. A través de esta investigación, podremos comprender mejor los mecanismos y las implicaciones de la reproducción en la naturaleza.
15.1 La fertilización en los reptiles
(YouTube) Ocurre en la región superior de los oviductos antes de la deposición de la cáscara del huevo. El momento exacto de la fertilización varía entre las especies. Puede ocurrir inmediatamente después de la cópula (la mayoría de los lagartos) o puede demorarse por algunas horas o años después de la cópula (tortugas y serpientes). Las estructuras de almacenamiento de esperma, que se producen en las tortugas y los escamosos, facilitan la retención del esperma durante largos períodos de tiempo. La fertilización tardía permite que las hembras se apareen con más de un macho y puede resultar en paternidad múltiple entre la descendencia resultante.
15.2 Cópula
En tortugas y cocodrilos, el pene desempeña un papel crucial en la reproducción. Por ejemplo, en la tortuga de caparazón blando (Trionyx ferox), el pene está compuesto por tejido conectivo esponjoso que le permite volverse erecto y retraerse según la presión vascular. Esta estructura es similar en su función y probablemente homóloga al pene de los mamíferos.
En el caso de los lagartos, como el Dragón de Komodo (Varanus komodoensis), utilizan un órgano intromitente llamado hemipene para la intromisión en los machos. Los hemipenes son estructuras pareadas ubicadas en la base de la cola. Durante la cópula, se eliminan de las aberturas en la parte posterior de la cloaca mediante presión vascular. Sin embargo, es importante destacar que los hemipenes de los lagartos no son homólogos con los órganos intromitentes presentes en las tortugas y cocodrilos.
Figura 15.1. El Dragón de Komodo (Varanus komodoensis) es una especie de lagarto gigante que se encuentra en las islas de Komodo, Rinca, Flores y Gili Motang en Indonesia. Es conocido por ser el lagarto más grande del mundo, con una longitud promedio de 2 a 3 metros y un peso de hasta 70 kilogramos. Posee una poderosa mandíbula, dientes afilados y una lengua bífida. Su piel rugosa y escamosa es de color marrón grisáceo, lo que le proporciona un camuflaje eficaz. A pesar de su tamaño, el Dragón de Komodo es un depredador ágil y voraz, que se alimenta principalmente de carcasas de animales y ocasionalmente caza presas vivas. Su saliva contiene una variedad de bacterias y veneno, lo que hace que las heridas infligidas por sus mordeduras sean altamente infecciosas.
En la mayoría de los casos, solo un hemipene se desarrolla y se utiliza durante la cópula. Después del acto sexual, un músculo retractor se encarga de retirar el hemipene a su posición de reposo. Este proceso es crucial para garantizar el éxito reproductivo y el funcionamiento adecuado del órgano reproductor masculino.
Es importante destacar que estos ejemplos representan solo algunas de las muchas especies de tortugas, cocodrilos y lagartos que exhiben estas características reproductivas específicas. Cada especie tiene adaptaciones únicas en su sistema reproductor, lo que demuestra la diversidad y complejidad de los órganos reproductores en el reino animal. (YouTube).
15.3 Anidación
La mayoría de los reptiles ovíparos construyen nidos para la deposición de huevos (YouTube)(YouTube). Debido a que la mayoría de los huevos de reptiles requieren al menos un poco de agua para su desarrollo, los sitios de anidación generalmente se encuentran en el suelo húmedo, dentro de troncos en descomposición o pilas de material húmico, en áreas podridas de árboles en pie, debajo de troncos, rocas u otros elementos de superficie, o en la superficie en espacios relativamente cerrados, como grietas, donde la humedad es alta.
La colocación de huevos influye enormemente en la supervivencia y en las tasas de crecimiento de los embriones. Para muchos reptiles, la mortalidad es mayor en la etapa del huevo. Los anfibios también sufren una alta mortalidad de huevos, pero proporcionalmente, la mortalidad es mayor en la etapa larvaria. Tanto en anfibios como en reptiles, la selección femenina de un sitio para su puesta influirá en la supervivencia de su descendencia. La buena selección del sitio produce una alta supervivencia; la mala selección del sitio da como resultado una baja supervivencia o incluso una pérdida total de la cohorte. El sitio seleccionado debe tener el entorno biofísico adecuado para el desarrollo adecuado de los embriones y debe proporcionar cierta protección contra la depredación, los parásitos y los caprichos de las fluctuaciones ambientales, como evitar el secado del estanque o las temperaturas excesivas.
La mayoría de los reptiles ovíparos en ambientes de zonas templadas depositan huevos en la primavera o principios del verano, y los huevos se incuban a fines del verano o en el otoño. Estas crías (recién nacidos) deben comenzar a alimentarse inmediatamente para crecer y almacenar energía para el invierno. Sin embargo, en algunas especies, los huevos eclosionan en el nido en otoño, pero los neonatos permanecen en el nido durante el y emergen en la primavera. Este fenómeno está mucho más extendido de lo que comúnmente se reconoce. Entre las tortugas de todo el mundo, la aparición tardía se produce en al menos 12 géneros. Las tortugas pintadas recién nacidas (Chrysemys picta) emergen en otoño o primavera dependiendo de la localidad, y en algunas áreas, cualquiera de ellas puede ocurrir.
Figura 15.2. La Tortuga pintada (Chrysemys picta) es una especie de tortuga acuática que se encuentra en América del Norte. Es conocida por su caparazón colorido y distintivo, que exhibe patrones de rayas y manchas en tonos de amarillo, naranja y rojo. Estas tortugas tienen un tamaño mediano, con una longitud de caparazón que puede alcanzar alrededor de 20 centímetros. Son semiacuáticas y se encuentran tanto en agua dulce como en tierra firme. La Tortuga pintada es omnívora y se alimenta de una variedad de alimentos, incluyendo plantas acuáticas, insectos, crustáceos y pequeños vertebrados. Son conocidas por su capacidad de bajar la cabeza y las extremidades dentro del caparazón para protegerse de los depredadores.
Presumiblemente, los neonatos que sobreviven al invierno emergen en un momento (primavera) cuando los recursos son más abundantes y se reduce la depredación potencial. El calentamiento de las temperaturas de la primavera podría ser la clave para predecir la llegada de buenas condiciones. Pasar el invierno en el nido tiene costos asociados. En los inviernos con poca o ninguna capa de nieve, los nidos se congelan, matando a los neonatos, pero en los inviernos con nieve, los neonatos no se congelan porque la nieve aísla el nido. Un estudio de 5 años sobre la ecología de anidación de tortugas pintadas mostró que la mortalidad invernal debida a la congelación fue significativa, variando hasta un 80% en un año dado. Cuando las hembras de la serpiente tropical Tropidonophis mairii están listas para anidar, regresan al sitio donde fueron liberados como crías, que también son los sitios donde sus madres fueron capturadas antes de anidar. En consecuencia, la ubicación del nido se transmite de una generación a la siguiente, aunque este comportamiento no tiene una base genética obvia.
Cocodrilos
Entre los cocodrilos, la construcción de nidos es un comportamiento fundamental para garantizar la supervivencia de las crías. Cada especie tiene su propia estrategia de anidación adaptada a su entorno y hábitos de vida. Por ejemplo, el Cocodrilo de agua salada (Crocodylus porosus) y el Cocodrilo americano (Alligator mississippiensis) construyen nidos sobre el suelo, alejados del agua. Estos nidos están compuestos por montículos de vegetación, barro y tierra, que forman una estructura protectora donde se depositan los huevos. Esta construcción permite aislar los huevos de la humedad y protegerlos de las fluctuaciones del nivel del agua y los depredadores terrestres.
Figura 15.3. El Cocodrilo de agua salada (Crocodylus porosus) es una especie de cocodrilo que se encuentra en las regiones costeras del sureste de Asia y el norte de Australia. Estos cocodrilos construyen sus nidos en áreas cercanas a cuerpos de agua, como ríos, estuarios y manglares. Los nidos de Crocodylus porosus están hechos principalmente de vegetación y barro, y son construidos por las hembras para proteger los huevos de la inundación y los depredadores. Estos nidos son colocados en áreas elevadas para evitar las crecidas de agua y brindar un ambiente adecuado para la incubación de los huevos. La construcción de nidos es un comportamiento esencial para el éxito reproductivo de esta especie de cocodrilo.
Por otro lado, el Cocodrilo de Johnston (Crocodylus johnsoni) adopta una estrategia única al colocar sus huevos en madrigueras en la arena. Estas madrigueras son excavadas por las hembras en áreas de sustrato arenoso y proporcionan un ambiente seguro y protegido para la incubación de los huevos. La hembra excava la madriguera con sus poderosas patas traseras y utiliza su hocico para remover la arena. Una vez que los huevos son depositados en la madriguera, la hembra cubre la entrada con arena para ocultarla y protegerla de posibles depredadores.
Estas estrategias de anidación son crucial para el éxito reproductivo de los cocodrilos, ya que aseguran que los huevos estén resguardados y en condiciones óptimas de incubación. Además, el comportamiento de construcción de nidos también cumple un papel importante en la regulación de la temperatura de los huevos, ya que las hembras pueden ajustar la profundidad y la ubicación de los nidos para optimizar las condiciones de calor necesarias para el desarrollo embrionario. Estos comportamientos reproductivos demuestran la adaptabilidad y la sofisticación de los cocodrilos en su proceso reproductivo, asegurando la supervivencia de su especie a lo largo del tiempo. (YouTube).
Tortugas
Los reptiles, en particular las tortugas, exhiben una asombrosa variedad de comportamientos de anidación. La mayoría de las especies de tortugas, como Gopherus berlandieri, Malaclemys terrapin, Emydoidea blandingii, Chelydra serpentina, Kinosternon flavescens y Apalone mutica, prefieren cavar nidos en el suelo. Estas tortugas incansablemente excavan agujeros en la tierra, utilizando sus fuertes patas delanteras para remover la tierra y crear un espacio seguro y protegido para depositar sus huevos.
Cada especie tiene su propio estilo y preferencias cuando se trata de la ubicación del nido y la forma del agujero. Algunas tortugas seleccionan sitios cerca de cuerpos de agua, mientras que otras prefieren áreas secas y soleadas. Algunas especies excavan nidos poco profundos, mientras que otras pueden cavar agujeros profundos que alcanzan hasta medio metro bajo tierra (YouTube).
Figura 15.4. La Chelodina rugosa, también conocida como tortuga cuello de serpiente australiana, es una especie única de tortuga que presenta un comportamiento de anidación fascinante. A diferencia de la mayoría de las tortugas, esta especie deposita sus huevos en la arena bajo el agua durante la estación húmeda. Los huevos permanecen en estado de desarrollo suspendido hasta que la arena se seca durante la estación seca, momento en el que el desarrollo embrionario comienza. Este increíble proceso demuestra la adaptabilidad y la capacidad de supervivencia de la Chelodina rugosa en su hábitat acuático, asegurando el éxito reproductivo de la especie.
La tortuga Chelodina rugosa destaca por su inusual comportamiento de anidación. En lugar de cavar un nido en el suelo, esta especie deposita sus huevos en la arena bajo el agua durante la estación húmeda. Aprovechando las condiciones acuáticas favorables, las tortugas sumergen sus huevos en la arena y esperan pacientemente a que llegue la estación seca. En ese momento, el agua retrocede y la arena se seca, lo que desencadena el inicio del desarrollo embrionario.
Podocnemis expansa, conocida como la tortuga Arrau o tortuga del Amazonas. Esta tortuga es nativa de América del Sur, particularmente de la cuenca del río Amazonas y sus afluentes. Construye nidos impresionantes en las playas de los ríos, donde las hembras excavan hoyos grandes para depositar sus huevos. Estos nidos colectivos pueden ser muy profundos y albergar cientos de huevos. La construcción de estos nidos es un comportamiento fascinante y esencial para la supervivencia de la especie. sta especie sigue un comportamiento de anidación colectiva, donde varias tortugas comparten el mismo sitio de anidación.
Figura 15.5. Podocnemis expansa, también conocida como tortuga arrau, es una especie de tortuga de agua dulce que habita en América del Sur. Es una de las tortugas de río más grandes del mundo, pudiendo alcanzar tamaños de hasta 1 metro de longitud y superar los 50 kg de peso. Su caparazón es oscuro y aplanado, adaptado para desplazarse eficientemente en el agua. Son animales longevos y de crecimiento lento. La especie enfrenta amenazas significativas debido a la caza furtiva de sus huevos y carne, así como a la pérdida de hábitat. Es objeto de programas de conservación para proteger y preservar su población en peligro de extinción.
Esta estrategia aumenta las posibilidades de supervivencia de los huevos y crías. La construcción de estos nidos es un espectáculo impresionante y demuestra la dedicación y adaptabilidad de la Podocnemis expansa en su hábitat acuático.
Serpientes pitones
Los nidos de las serpientes pitones son fascinantes y presentan una variedad de características únicas y destacables. Dentro de esta familia de serpientes, existen diferentes especies que han desarrollado estrategias especializadas para proteger y incubar sus huevos en diversos entornos.
Una de las especies más conocidas, la pitón birmana (Python molurus), se encuentra en regiones de latitudes más altas y, por lo tanto, enfrenta ambientes más fríos. Estas serpientes han evolucionado para depositar sus huevos dentro de orificios ocultos en la vegetación, proporcionando un ambiente más cálido y protegido para su desarrollo. Una vez que los huevos son depositados, la hembra se enrosca alrededor de ellos, creando un abrazo cálido y protector. Mediante la contracción y relajación de sus músculos, ella genera un temblor constante que produce calor adicional para mantener una temperatura óptima para la incubación de los huevos.
Figura 15.6. Python molurus, también conocida como pitón india, es una especie de serpiente constrictora nativa del subcontinente indio. Es una de las serpientes más grandes del mundo, con ejemplares que pueden superar los 6 metros de longitud. Su cuerpo es musculoso y su piel varía en color, desde tonos claros hasta patrones oscuros y manchas. Son cazadoras sigilosas y se alimentan principalmente de mamíferos, aves y reptiles. Aunque no son venenosas, utilizan su fuerza para envolver a sus presas y asfixiarlas. La pitón india enfrenta amenazas debido a la pérdida de hábitat y la caza furtiva para el comercio de piel y mascotas exóticas. Se encuentra protegida por leyes y es objeto de programas de conservación.
Por otro lado, la pitón diamantina (Morelia spilota) es otra especie que también utiliza una estrategia similar en latitudes más altas. Estas serpientes seleccionan cuidadosamente huecos en los árboles, donde depositan sus huevos y se enroscan alrededor de ellos para proporcionar calor a través de la termorregulación muscular. Este comportamiento demuestra la sorprendente capacidad de estas serpientes para adaptarse a diferentes condiciones climáticas y proteger eficientemente a su progenie.
Sin embargo, no todas las pitones utilizan el temblor muscular para incubar sus huevos. La pitón de agua australiana (Liasis fuscus), por ejemplo, ha desarrollado una estrategia diferente. Estas serpientes construyen sus nidos en áreas húmedas y cálidas, donde depositan sus huevos en un montículo de vegetación en descomposición. A diferencia de las especies anteriores, las pitones de agua australianas no proporcionan calor al temblar, sino que confían en la temperatura ambiental para incubar sus huevos. La vegetación en descomposición genera calor a medida que se descompone, creando un ambiente adecuado para la incubación.
Figura 15.7. Liasis fuscus, también conocida como pitón de roca australiana, es una especie de serpiente no venenosa endémica de Australia. Presenta un patrón de coloración único, con un fondo marrón oscuro y manchas o líneas más claras que le permiten camuflarse entre las rocas. Es una serpiente de tamaño mediano, con una longitud promedio de 2 metros. Aunque prefiere hábitats rocosos y secos, también puede encontrarse en áreas arboladas. Se alimenta principalmente de pequeños mamíferos y aves. La pitón de roca australiana enfrenta amenazas debido a la pérdida de hábitat y la introducción de especies exóticas. Es protegida por la legislación australiana para su conservación.
Otra especie interesante es la pitón verde (Morelia viridis), originaria de las selvas tropicales del sudeste asiático y Nueva Guinea. Estas serpientes construyen sus nidos en las copas de los árboles, utilizando ramas entrelazadas y hojas para crear un ambiente protegido. Los nidos de las pitones verdes suelen estar ubicados a gran altura, lo que brinda mayor seguridad y dificulta el acceso a posibles depredadores.
Por último, la pitón de las rocas (Python sebae) también merece mencionarse debido a sus impresionantes habilidades para construir nidos. Estas serpientes habitan principalmente en regiones rocosas y desérticas, donde pueden construir sus nidos en hendiduras de rocas o cuevas subterráneas. Utilizan su cuerpo fuerte y musculoso para arrastrar rocas y crear un espacio protegido donde depositar sus huevos.
Figura 15.8. Python sebae, conocida como pitón africana, es una especie de serpiente constrictora que se encuentra en diversas regiones de África. Es una de las serpientes más grandes del continente, con ejemplares que pueden alcanzar longitudes de hasta 6 metros. Su cuerpo es robusto y su piel presenta un patrón característico de manchas y líneas marrones sobre un fondo amarillento. Son excelentes nadadoras y cazadoras sigilosas. Su dieta consiste principalmente en mamíferos de tamaño mediano, aves y reptiles. Aunque no son venenosas, utilizan su fuerza para constricción y asfixiar a sus presas. La pitón africana enfrenta amenazas debido a la caza indiscriminada y la pérdida de hábitat. Es importante promover su conservación para asegurar su supervivencia.
Lagartos y demás serpientes
El mundo de los reptiles alberga una gran diversidad de especies con comportamientos sorprendentes cuando se trata de la construcción de nidos. Si bien las pitones son conocidas por sus estrategias únicas, también existen otras lagartijas, serpientes y tortugas que presentan características destacables en la forma en que depositan sus huevos y crean nidos especiales.
Al explorar el reino de las lagartijas, encontramos varias especies fascinantes. Por ejemplo, el género Plestiodon incluye diversas especies que depositan sus huevos en el suelo húmedo, troncos podridos y humus. Estos lugares proporcionan una temperatura y humedad adecuadas para el desarrollo de los huevos, asegurando así la supervivencia de las crías. Además, el lagarto collar (Crotaphytus collaris) también sigue una estrategia similar, seleccionando áreas de suelo húmedo para depositar sus huevos.
Figura 15.9. Crotaphytus collaris, conocido como lagarto collar, es una especie de lagarto que se encuentra en el suroeste de Estados Unidos y el norte de México. Es conocido por su colorido patrón de escamas, que incluye rayas y manchas de colores vivos como el verde, amarillo y azul. Posee un collar distintivo alrededor de su cuello, de ahí su nombre común. Estos lagartos son rápidos y ágiles, adaptados para la vida en áreas rocosas y desérticas. Se alimentan de insectos y otros pequeños invertebrados. Su capacidad para cambiar de color les ayuda en la termorregulación y en la comunicación visual. El lagarto collar es una especie apreciada por los aficionados a los reptiles y se encuentra protegida en algunas áreas de su distribución debido a la pérdida de hábitat.
Por otro lado, la lagartija ameiva (Ameiva ameiva) se destaca por su preferencia por depositar sus huevos en nidos de termitas. Estos reptiles aprovechan las estructuras construidas por las termitas, ya que proporcionan un ambiente cálido y protegido. Las termitas, a su vez, pueden beneficiarse de esta relación, ya que los huevos de la lagartija pueden representar una fuente de alimento para ellas.
En el fascinante mundo de las serpientes, encontramos especies como la serpiente lobo (Farancia abacura), que elige hábilmente nidos de hormigas o termitas para depositar sus huevos. Estas serpientes evitan el esfuerzo de construir sus propios nidos, aprovechando los ya existentes y garantizando la protección y el suministro de alimento para sus crías.
Figura 15.10. Farancia abacura, conocida como serpiente lombriz, es una especie de serpiente no venenosa que se encuentra en el sureste de los Estados Unidos y partes de México. Es única en su apariencia, con un cuerpo alargado y delgado, similar a una lombriz. Su coloración varía, pero generalmente presenta tonos marrones, rojizos o grises con manchas o rayas más oscuras a lo largo de su cuerpo. Habita en áreas húmedas, como pantanos y riberas de ríos, y se alimenta de anfibios y peces. La serpiente lombriz es escurridiza y rara vez se ve, lo que la convierte en una especie de difícil estudio. Sin embargo, su hábitat está amenazado debido a la degradación y pérdida de humedales. La conservación de estos ecosistemas es crucial para proteger a la serpiente lombriz y mantener la biodiversidad en la región.
Al examinar el grupo de serpientes de los Pituophis melanoleucus, se observa que estas serpientes de pino depositan sus huevos en grietas en rocas. Estas grietas brindan un ambiente seguro y protegido, evitando la exposición a posibles depredadores y fluctuaciones extremas de temperatura.
Además, el género de lagartijas Plica, que incluye a la conocida lagartija de cresta (Plica plica), presenta una estrategia única para depositar sus huevos. Estas lagartijas crean nidos en forma de túneles bajo la corteza suelta de los árboles. Este hábitat proporciona aislamiento y protección contra depredadores, así como una temperatura y humedad estables para el desarrollo de los huevos.
No podemos dejar de mencionar al lagarto esmeralda (Sceloporus aeneus), que ha desarrollado una técnica interesante para depositar sus huevos. Estos lagartos cavan nidos poco profundos en el suelo y luego utilizan su hocico para empujar la tierra hacia atrás, cubriendo los huevos. Esta estrategia ayuda a proteger los huevos de la exposición y los depredadores.
Figura 15.11. Sceloporus aeneus conocido como el lagarto de cobre o lagarto verde metálico, es una especie de lagarto que se encuentra en América del Norte. Este lagarto presenta una coloración única y llamativa, con tonos brillantes de cobre, verde y azul en su cuerpo. Los machos suelen tener colores más intensos que las hembras. Son lagartos de tamaño mediano, con cuerpos robustos y una cresta dorsal distintiva. Habitan en una variedad de hábitats, desde áreas rocosas y bosques hasta pastizales abiertos. Son diurnos y se alimentan principalmente de insectos y otros pequeños invertebrados. El lagarto de cobre es conocido por su comportamiento territorial y su capacidad para trepar árboles y rocas.
15.4 Factores abióticos en el desarrollo
El ambiente biofísico del sitio del nido influye en la duración de la incubación, la tasa de desarrollo, el éxito de eclosión e incluso el tamaño de la descendencia. El corto tiempo de incubación debería ser ventajoso porque reduce el tiempo que los huevos están expuestos a factores de mortalidad. Sin embargo, los tiempos de incubación suelen ser bastante largos. Aparentemente, la reducción del tiempo de desarrollo puede tener altos costos en términos de éxito de eclosión y calidad de descendencia.
Por ejemplo, el éxito de eclosión es alto a temperaturas que varían de 24 ° C a 28 ° C y mucho más bajo a temperaturas superiores a 32 ° C en el lagarto europeo, Podarcis muralis. Además, las crías de huevos incubados a temperaturas más bajas son más grandes en tamaño corporal (longitud y masa), crecen más rápido y tienen un mejor desempeño en las pruebas de velocidad que las crías incubadas a temperaturas más altas, aunque el tiempo de incubación es más corto a temperaturas más altas. El mejor equilibrio entre el tiempo de incubación y la calidad de la descendencia en P. muralis se produce a temperaturas alrededor de 28 ° C, aunque esta temperatura es inferior a las temperaturas óptimas para el rendimiento de los adultos. Estos resultados apoyan la hipótesis de que algunas, quizás muchas, especies tienen múltiples óptimos. En este caso, existe una temperatura óptima para el desarrollo embrionario y otra para el desempeño adulto.
Figura 15.12. Podarcis muralis, conocida como lagartija de pared, es una especie de lagarto que se encuentra en gran parte de Europa. Estos lagartos son pequeños y ágiles, con una longitud que oscila entre los 15 y los 20 centímetros. Tienen un cuerpo esbelto y una cola larga, y su coloración varía desde el marrón claro hasta el verde oliva, con manchas o rayas más oscuras en su espalda. Son hábiles escaladores y se encuentran con frecuencia en muros, rocas y árboles. Se alimentan de insectos y otros pequeños invertebrados. Las lagartijas de pared son una especie adaptada a vivir cerca de los humanos y se consideran beneficiosas para el control de plagas. Son comunes y no están en peligro.
El tamaño de las tortugas determina, hasta cierto punto, dónde se depositan los huevos, porque las tortugas más grandes tienen patas traseras más largas para cavar nidos. Tortugas marinas rayadas (Kinosternon baurii) seleccionan sitios de nidos cerca de la vegetación (gramíneas y otras plantas herbáceas) con poco terreno abierto. Las temperaturas en los nidos son más bajas que el suelo en los sitios más expuestos. El éxito de eclosión en los huevos colocados experimentalmente en nidos cerca de la vegetación es sustancialmente mayor que en las áreas más expuestas. Las tortugas de mar cavan nidos poco profundos y, como resultado, los nidos cerca de la vegetación evitan temperaturas de incubación perjudiciales. Las especies de tortugas más grandes depositan sus huevos lo suficientemente profundo en áreas expuestas para evitar temperaturas extremas.
Figura 15.13. Kinosternon baurii, conocida como tortuga de concha blanda de Florida, es una especie de tortuga de agua dulce endémica de Florida, en Estados Unidos. Es reconocida por su caparazón blando y flexible, adaptado para moverse fácilmente en el agua. Tienen un tamaño pequeño, alcanzando entre 10 y 15 centímetros de longitud. Su caparazón es de color marrón oscuro o negro, con manchas y líneas amarillas. Son animales semiacuáticos, pasando tiempo tanto en el agua como en la tierra. Se alimentan principalmente de invertebrados acuáticos y plantas. Aunque son comunes en su rango de distribución, están amenazadas por la destrucción de su hábitat y la introducción de especies exóticas. Es importante preservar sus ecosistemas para asegurar la supervivencia de esta tortuga única.
16. Ciclo de vida de los reptiles
16. Ciclo de vida de los reptiles
Las historias de vida de todos los reptiles incluyen huevo (o embrión, en especies vivíparas), juvenil y adultos. Las historias de vida de los reptiles son mucho más simples que las de los anfibios porque no hay una etapa larvaria, y por ende no hay metamorfosis.
16.1 Cocodrilos y tortugas
Todos los cocodrilos y tortugas, en comparación con los escamosos, tienen una maduración tardía, se reproducen durante largos períodos de tiempo (muchos años) y son de larga duración. La mayoría de la mortalidad se produce en etapas tempranas de la historia de vida, los huevos y los juveniles. El tamaño de la cohorte varía de 6 a 60 huevos entre las especies de cocodrilos (19 especies) y es el más grande en Crocodylus niloticus (60) y Crocodylus porosus (59) en promedio. El tamaño de cohorte más grande para un individuo fue un C. porosus con 150 huevos. Las especies más grandes y los individuos tienden a producir nidos más grandes. El cocodrilo filipino Crocodylus mindorensis ejemplifica una historia de vida típica del cocodrilo. Las hembras producen múltiples nidos de 7 a 25 huevos que eclosionan después de 77 a 85 días. Las hembras cuidan el nido, y las vocalizaciones de los jóvenes aplastados hacen que las hembras abran el nido y transporten a los juveniles al agua.
Figura 16.1. Crocodylus mindorensis, conocido como cocodrilo de Mindoro, es una especie de cocodrilo endémica de la isla de Mindoro en Filipinas. Es uno de los cocodrilos más pequeños del mundo, con una longitud promedio de 2 a 3 metros. Su piel es de color marrón oscuro y presenta un patrón de escamas distintivo. Habita principalmente en ríos de agua dulce y se alimenta de peces, reptiles y mamíferos pequeños. Debido a la destrucción de su hábitat y la caza furtiva, el cocodrilo de Mindoro se encuentra en peligro crítico de extinción. Los esfuerzos de conservación, como la protección de su hábitat y programas de reproducción en cautiverio, son fundamentales para preservar esta especie única y frágil.
16.2 Lagartos y serpientes
Existe una considerable variación en los rasgos de la historia de la vida de los escamosos “serpientes y lagartos verdaderos”. Muchos lagartos pequeños, como Uta stansburiana, tienen una maduración temprana (9 meses), se reproducen repetidamente y tienen una vida útil corta. Otros, como Cyclura carinata, tienen una maduración tardía (78 meses), producen una única cría por año y son relativamente longevos.
Entre las serpientes, existe una variación similar en la historia de la vida. Sibon sanniola alcanza la madurez en 8 meses y produce una sola cohorte por año, mientras que Crotalus horridus alcanza la madurez sexual en 72 meses y produce una cría cada dos años. Los primeros intentos para determinar las relaciones entre las características de la historia de vida de los escamosos se basaron en un conjunto limitado de datos. Sin embargo, estaba claro que las historias de vida de los lagartos se podían agrupar en especies que maduran a gran tamaño, producen crías más grandes y alcanzan la madurez sexual a una edad relativamente tardía “características de la estrategia de vida ” y aquellas que maduran a tamaño pequeño, producen crías más pequeñas y alcanzan la madurez sexual antes de tiempo “características de la estrategia de vida ”. en la vida.
Figura 16.2. Sibon sanniola, conocida como culebra de montaña de Sanniola, es una especie de serpiente no venenosa que se encuentra en las regiones montañosas de Costa Rica y Panamá. Tiene un tamaño pequeño, alcanzando alrededor de 30 centímetros de longitud. Su coloración varía desde el verde claro hasta el verde oscuro, con manchas o rayas más oscuras a lo largo de su cuerpo. Estas serpientes son principalmente arborícolas y se alimentan de pequeños invertebrados, como caracoles y lombrices. Debido a su estilo de vida discreto y su distribución restringida, se sabe poco sobre esta especie. Sin embargo, se considera vulnerable debido a la destrucción del hábitat y la fragmentación de los bosques en los que habita. Su conservación es importante para mantener la biodiversidad en estas regiones montañosas.
Los análisis más sofisticados basados en conjuntos de datos más extensos y la inclusión de variables adicionales confirman algunas de estas generalizaciones y refutan otras. Las historias de vida de los lagartos se pueden clasificar principalmente en función de la frecuencia de cría. Las especies de cría única se subdividen en tres categorías:
(a) especies ovíparas con madurez tardía y gran tamaño de cría;
(b) especies ovíparas con pequeñas crías;
(c) especies vivíparas.
Las especies de cría múltiple incluyen lo siguiente:
(a) especies de cuerpo pequeño, maduración temprana con crías pequeñas;
(b) especies de cuerpos más grandes, con madurez temprana y crías grandes.
Las historias de vida de las serpientes se dividen en tres categorías.
(a) El primero incluye especies ovíparas y de cría simple (en su mayoría colúbidos) que tienen mayor tamaño corporal, tamaño de embrague y retraso en la madurez.
(b) La segunda categoría está compuesta por especies vivíparas que se reproducen anualmente (algunos elapidos y colubridos).
(x) El tercer grupo está formado por especies vivíparas que se reproducen cada dos años (todas las víbridas y la culebra Thamnophis sirtalis de la parte norte de su área de distribución).
Figura 16.3. Thamnophis sirtalis, conocida como serpiente de liga común, es una especie de serpiente no venenosa que se encuentra en América del Norte. Es una de las serpientes más reconocibles y extendidas en la región. Su coloración varía según la subespecie y la ubicación geográfica, pero generalmente tiene un cuerpo delgado y rayas longitudinales de colores, como rojo, naranja, amarillo o verde, en un fondo oscuro. Se encuentra en diversos hábitats, incluyendo áreas acuáticas y terrestres. Las serpientes de liga común se alimentan principalmente de anfibios y pequeños peces. Son apreciadas por su papel en el control de poblaciones de plagas y son comunes en su distribución.
16.3 Resumen
La diversidad de patrones reproductivos, historias de vida y modos reproductivos de anfibios y reptiles ofrece oportunidades casi ilimitadas para probar la teoría ecológica y evolutiva. Las decisiones que toman las hembras cuando seleccionan los nidos y construyen nidos pueden tener efectos profundos en la supervivencia y el desarrollo de los huevos, así como en la morfología, el rendimiento y, en algunos casos, incluso el sexo de los descendientes.
Los anfibios y reptiles pueden reproducirse en períodos de tiempo muy cortos, en períodos de tiempo prolongados, o incluso pueden saltarse años entre episodios reproductivos. La inversión en reproducción es costosa en términos de energía y supervivencia. La interacción entre el esfuerzo reproductivo específico de la edad y sus costos de supervivencia ha producido una impresionante diversidad de patrones de historia de vida en anfibios y reptiles. Las historias de vida varían desde especies con altos esfuerzos reproductivos, logro temprano de la madurez sexual y períodos de vida cortos hasta esfuerzos reproductivos bajos, madurez tardía y períodos de vida largos.
Los patrones de historia de vida están limitados por la filogenia, con algunos linajes compuestos de especies que tienen historias de vida bastante diferentes de las especies de otros linajes. Existen restricciones similares debido a la morfología y al comportamiento de forrajeo. Entre las especies con tamaño de cohorte variable, existe una compensación entre el tamaño de la descendencia y el número de descendientes producidos.
Las especies que producen muchas crías generalmente producen crías pequeñas “estrategia de vida r”, mientras que las especies que producen pocas crías generalmente producen crías relativamente grandes “estrategia de vida K”. La gran cantidad de especies en las que el tamaño de la descendencia no parece variar apoya la idea de que el tamaño de la descendencia está optimizado. Sin embargo, la variación en el tamaño de la descendencia en algunas especies parece estar relacionada con la disponibilidad de recursos, las limitaciones morfológicas o incluso la posibilidad de que exista más de un solo óptimo.
El viviparismo ha liberado a muchos escamosos y algunos anfibios de la mortalidad asociada con la deposición de cohortes de renacuajos y los periodos de incubación prolongados, sin protección, pero no sin costos asociados. El rendimiento de las hembras que tienen descendencia puede reducirse y las modificaciones de comportamiento se asocian con llevar a la descendencia durante largos períodos de tiempo. La viviparidad en los escamosos ha evolucionado independientemente más veces que en todos los demás vertebrados combinados, lo que convierte a los escamosos en un sistema ideal para examinar la evolución de la viviparidad.
R. Referencias bibliográficas
R. Referencias bibliográficas
Balthazart, J., & Ball, G. F. (2019). Male Sexual Behavior and Hormones in Non-Mammalian Vertebrates. In Encyclopedia of Animal Behavior (Second Edition),. Retrieved from https://www.sciencedirect.com/science/article/pii/B9780128096338010591
Benton, M. (2014). Vertebrate palaeontology. John Wiley & Sons.
Benton, M. J., & Donoghue, P. C. J. (2006). Paleontological evidence to date the tree of life. Molecular Biology and Evolution, 24(1), 26–53.
Callery, E. M., Fang, H., & Elinson, R. P. (2001). Frogs without polliwogs: evolution of anuran direct development. BioEssays, 23(3), 233–241.
Capel, B. (2019). Sex Determination in Vertebrates (Vol. 134). Academic Press.
Daugherty, C. H., & Sheldon, A. L. (1982). Age-determination, growth, and life history of a Montana population of the tailed frog (Ascaphus truei). Herpetologica, 461–468.
Duellman, W. E., & Trueb, L. (1994). Biology of amphibians. JHU press.
Dünker, N., Wake, M. H., & Olson, W. M. (2000). Embryonic and larval development in the caecilian Ichthyophis kohtaoensis (Amphibia, Gymnophiona): A staging table. Journal of Morphology, 243(1), 3–34.
Hopkins, G. R., & Brodie Jr, E. D. (2015). Occurrence of amphibians in saline habitats: a review and evolutionary perspective. Herpetological Monographs, 29(1), 1–27.
Kardong, K. V. (2011). Vertebrates, comparative anatomy, function, evolution (6th ed.). McGraw-Hill New York.
Kardong, K. V. (2014). Vertebrates: Comparative Anatomy, Function, Evolution (7th ed.). McGraw-Hill Education.
Kupfer, A., Nabhitabhata, J., & Himstedt, W. (2005). Life history of amphibians in the seasonal tropics: habitat, community and population ecology of a caecilian (genus Ichthyophis). Journal of Zoology, 266(3), 237–247.
Laudet, V. (2011). The origins and evolution of vertebrate metamorphosis. Current Biology, 21(18), R726–R737.
Lutz, D., & Lutz, R. L. (2005). Tuatara: a living fossil. Dimi Press.
Natchev, N., Tzankov, N., & Gemel, R. (2011). Green frog invasion in the Black Sea: habitat ecology of the Pelophylax esculentus complex (Anura, Amphibia) population in the region of Shablenska Тuzla lagoon in Bulgaria. Herpetol. Notes, 4, 347–351.
Piñeiro, G., Ferigolo, J., Meneghel, M., & Laurin, M. (2012). The oldest known amniotic embryos suggest viviparity in mesosaurs. Historical Biology, 24(6), 620–630.
San Mauro, D., Gower, D. J., Oommen, O. V, Wilkinson, M., & Zardoya, R. (2004). Phylogeny of caecilian amphibians (Gymnophiona) based on complete mitochondrial genomes and nuclear RAG1. Molecular Phylogenetics and Evolution, 33(2), 413–427.
Sander, P. M. (2012). Reproduction in early amniotes. Science, 337(6096), 806–808.
Vitt, L. J., & Caldwell, J. P. (2014). Herpetology An Introductory Biology of Amphibians and Reptiles (4th ed.). Oklahoma: Elsevier Inc.
(Dünker, Wake, & Olson, 2000)
(San Mauro, Gower, Oommen, Wilkinson, & Zardoya, 2004)
(Kardong, 2011, 2014; Vitt & Caldwell, 2014)















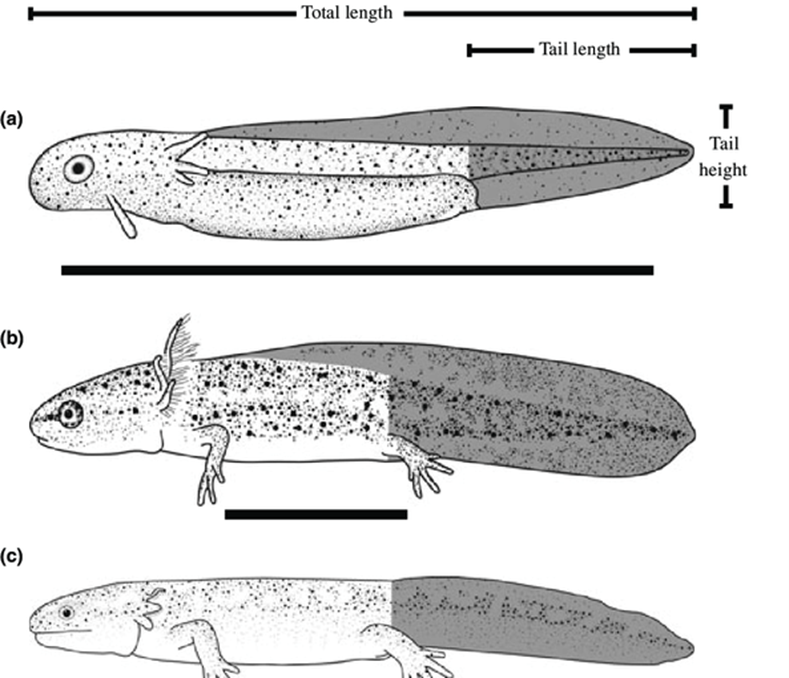






































































No hay comentarios:
Publicar un comentario