1. Introducción
De acuerdo al tercer postulado de la
teoría celular (Baker, 1948; Mazzarello, 1999), las nuevas células se originan únicamente a partir de células
preexistentes bajo las condiciones actuales del planeta. El proceso que permite
este proceso se denomina reproducción celular, replicación celular o división
celular. Para los seres vivos multicelulares como el ser humano o los olmos,
divisiones incontables de un solo cigoto producen un organismo de una gran
organización y complejidad. La división celular no se detiene con la formación
del organismo maduro, sino que por el contrario continúa en ciertos tejidos a
través de toda la vida. Millones de células residen en el interior del tuétano
de nuestros huesos, o en revestimiento del tracto gastrointestinal, y además de
sus funciones vitales individuales y colectivas, también deben llevar a cabo el
proceso de replicación celular para reparar las que mueren en el proceso de
interacción con el medio ambiente.
A pesar de que la división celular debe
ocurrir en todos los seres vivos, el modo en que se lleva a cabo muy diferente
según si las células son procariotas o eucariotas. Estos procesos de división
celular son los clásicos, mitosis y meiosis. Existen una serie de
modificaciones para estos procesos y que reciben nombres específicos, pero lo
más básico es entender estos dos. La división celular completa el procedo de
replicación genética, lo cual a su vez es uno de los grandes temas de la
biología, junto con los procesos de flujo de energía y de evolución.
En los eucariotas la división celular
ocurre generalmente como parte de un ciclo celular más grande. En los
eucariotas, hay dos tipos distintos de división celular: una división
vegetativa, por lo que cada célula hija es genéticamente idéntica a la célula
madre (mitosis), y una división celular reproductiva, por lo que el número de
cromosomas en las células hijas es reducido a la mitad para producir gametos/esporas
haploides (meiosis). La meiosis resulta en cuatro células haploides hijas. Los
cromosomas homólogos se separan en la primera división, y las cromátides
hermanas se separan en la segunda división. Ambos ciclos de división celular se
utilizan en el proceso de reproducción sexual en algún momento de su ciclo de
vida. Se cree que ambos están presentes en el último antepasado eucariota
común.
Los procariotas experimentan una división
celular vegetativa conocida como fisión binaria, donde su material genético es
segregado igualmente en dos células hijas, el principio es semejante a la
mitosis, pero debido a la arquitectura más simple del cromosoma procariota, no
se puede hablar de fases mitóticas, de hecho, lo que complejiza el cromosoma
procariota es la rápida replicación, por lo un cromosoma puede estar haciendo
replicación para células hijas, y a su vez cada cromosoma hijo puede estar
iniciando la replicación para las células nietas sin que la célula ancestral se
hubiera dividido todavía.
Los
detalles del ciclo celular varían de un organismo a otro y en diferentes
momentos en la vida de un organismo, incluso en una misma etapa, diferentes
tejidos pueden experimentar ciclos celulares diferentes. Ciertas
características, sin embargo, son universales. Como mínimo, la célula debe
cumplir su tarea más fundamental: la transmisión de su información genética a
la siguiente generación de células. Para producir dos células hijas
genéticamente idénticas, el ADN de cada cromosoma debe ser fielmente replicado
para producir dos copias completas. Los cromosomas replicados deben entonces
ser distribuidos con precisión (segregados) a las dos células hijas, de modo
que cada uno recibe una copia de todo el genoma. Además de duplicar su genoma,
la mayoría de las células también duplican sus otros orgánulos y
macromoléculas; De lo contrario, las células hijas serían más pequeñas con cada
división, lo que de hecho ocurre en las divisiones por clivaje en el desarrollo
embrionario. Para mantener su tamaño, las células divididas deben coordinar su
crecimiento (es decir, su aumento en la masa celular) con su división.
Las células exhiben una notable
diversidad en sus patrones de crecimiento, proliferación y muerte. Por ejemplo,
algunas células humanas (neuronas) nacen alrededor del momento del nacimiento y
viven hasta que la persona muere -más de 100 años en algunos casos. El destino
de otras células es vivir sólo un día o dos (por ejemplo, las células en el
revestimiento intestinal). Muchas células diferenciadas se forman por vías
elaboradas que emplean una serie cuidadosamente coreografiada de señales internas
y tisulares. Otras células, como muchas en el sistema inmunológico, se generan
en exceso, seguido por la selección natural de los pocos con genes
correctamente reordenados o con conexiones productivas a las células asociadas.
La desafortunada mayoría de células inmunes cuya diferenciación no fue tan
adecuada mueren por suicidio celular programado. Las estrategias muy diferentes
mantienen poblaciones de células. Las células de larga vida se dividen rara
vez, si es que lo son. En contraste, las células que participan en la
producción del revestimiento intestinal crecen y se dividen a máxima velocidad.
La mayoría de las células humanas se diferencian para llevar a cabo funciones
específicas y luego ya no proliferan.
1.1 Walther Flemming
(21 de abril de 1843 - 4 de agosto de
1905) fue un biólogo alemán y fundador de la citogenética. Haciendo uso de
tintes pudo encontrar una estructura a la que llamó cromatina. Identificó que
la cromatina estaba correlacionada con estructuras filiformes en el núcleo
celular, los cromosomas (que significa cuerpo coloreado). Edouard Van Beneden
(1846-1910) también los había observado de forma independiente.
Flemming investigó el proceso de división celular y la distribución de cromosomas a los núcleos hijos, un proceso que llamó mitosis de la palabra griega que significa hilo. Sin embargo, no vio la división en mitades idénticas, las cromátidas hijas. Estudió la mitosis, tanto en vida como en preparaciones teñidas, utilizando como fuente de material biológico las aletas y branquias de las salamandras. Estos resultados se publicaron por primera vez en 1878 y en 1882 en el libro seminal Zellsubstanz, Kern und Zelltheilung (1882; Sustancia celular, núcleo y división celular). Sobre la base de sus descubrimientos, Flemming supuso por primera vez que todos los núcleos celulares procedían de otro núcleo predecesor (acuñó la frase omnis nucleus e nucleo, después de omnis cellula e cellula de Virchow).
Flemming desconocía el trabajo de Gregor
Mendel (1822-1884) sobre la herencia, por lo que no estableció la conexión
entre sus observaciones y la herencia genética. Pasarían dos décadas antes de
que la importancia del trabajo de Flemming se hiciera realidad con el
redescubrimiento de las reglas de Mendel. Su descubrimiento de la mitosis y los
cromosomas se considera uno de los 100 descubrimientos científicos más
importantes de todos los tiempos, y uno de los 10 descubrimientos más
importantes en biología celular.
2. El ciclo celular
En una población de células en división, sea en el interior de un ser vivo multicelular o en una caja de petri para cultivo de tejidos in vitro, cada célula pasa a través de una serie de estados o fases determinadas durante su vida activa, y a estas fases se las denomina en su conjunto el ciclo celular. El ciclo celular puede ser dividido en dos grandes fases, la fase de mitosis o división celular y la fase intermedia entre dos mitosis llamadas interfase. Dependiendo del tipo de célula, la interfase puede durar desde unos cuantos minutos, hasta años. Un detalle importante a tener en cuenta es que la mayoría de los textos en los que se presenta el ciclo celular, incluyendo el libro de biología molecular que sirve de base para los presentes escritos, es que se enfocan en el modelo eucariota para describirlo.
Figura 2.1. El ciclo
celular es una idealización, no todas las células lo completan, y la duración
de cada etapa es variable, además, solo aplica para las células eucariotas.
Por ejemplo, en las bacterias, la fase de
síntesis de ADN es ininterrumpida, en base a que estas células se reproducen a
gran velocidad. Debido a que el modelo eucariota es el que se impone a la hora
de explicar el ciclo celular, debemos tener en cuenta que conceptos tales como
la condensación de los cromosomas no pueden ser aplicados a modelos
bacterianos, por tal razón se realizará un artículo en esta sección
correspondiente a cómo opera el ciclo celular en las bacterias y arcaicas. Las
etapas del ciclo celular son:
2.1 Interfase
La interfase se define como todo lo que
ocurre en el periodo en que una mitosis concluye y otra comienza. El periodo de
tiempo que dura esta fase del ciclo celular es extremadamente variable, siendo
entre unos cuantos minutos en células que experimentan una rápida reproducción,
hasta varios años en las células del tejido nervioso como las neuronas.
Independientemente a ello, en la interfase se cumplen una serie de funciones
básicas de los seres vivos que serán relacionadas con los temas básicos de la
biología. Los tres temas básicos de la biología se relacionan con la obtención
de energía, la reproducción y la evolución, y todas se llevan a cabo de manera
completa o parcial durante la interfase.
(YouTube) El ciclo celular
Durante la interfase la célula se
alimenta, es decir desarrolla todas sus actividades metabólicas enfocadas con
la obtención de masa y energía del medioambiente, además de las funciones que
apoyan a esta, como la relación con el medioambiente y otros seres vivos dentro
de su población, su comunidad y su ecosistema. Durante la interfase también
tiene lugar la replicación del ADN, es decir, la preparación del material
genético para que este se encuentre en las copias suficientes en el momento en
que inicie una nueva fase de mitosis. Esta función se la relaciona directamente
con el tema de biología de reproducción, pero también es el eje fundamental de
la evolución. Para que la evolución se dé a cabo, es necesario que el genoma
“como conjunto de proteínas y ADN y ARN” experimente cambios más o menos
regulados y aleatorios “que NO son mutuamente excluyentes” que alteran las
nuevas copias de material genético formadas, las cuales a su vez generen cambios
en como las células hijas se relacionarán con el medioambiente.
Estas copias luego se transfieren a las
células hijas que a su vez experimentaran alteraciones en su funcionamiento en
su interfase futura. En seres vivos unicelulares y eucariotas esta es una
fuente de cambio evolutivo, pero no la única. Sin embargo, en los seres vivos
eucariotas multicelulares, esta fuente de cambio tiene la tendencia a ser
perjudicial, siendo la causa más común para un conjunto de enfermedades
denominadas cáncer. En los seres vivos multicelulares eucarióticos la fuente de
cambio evolutivo útil se traslada desde la mitosis hacia un segundo proceso de
reproducción celular restringido a un pequeño conjunto de células y que
denominaremos en su conjunto meiosis. En resumen, durante la interfase deben
ocurrir los procesos de crecimiento celular y de síntesis de nuevo material
genético, ahora la pregunta es, ¿suceden de manera simultánea?, la respuesta a
esta pregunta es lo que ha conllevado a los biólogos a dividir la interfase en
una serie de subfases celulares, que generalmente se simbolizan con la primera
letra de su palabra en inglés.
2.2 Mitosis
Consistente en el reparto equitativo del
material hereditario (ADN) característico. ste tipo de división ocurre en las
células somáticas y normalmente concluye con la formación de dos núcleos separados
(cariocinesis), seguido de la separación del citoplasma (citocinesis), para
formar dos células hijas. La mitosis completa, que produce células
genéticamente idénticas, es el fundamento del crecimiento, de la reparación
tisular y de la reproducción asexual. La otra forma de división del material
genético de un núcleo se denomina meiosis y es un proceso que, aunque comparte
mecanismos con la mitosis, no debe confundirse con ella, ya que es propio de la
división celular de los gametos. Produce células genéticamente distintas y,
combinada con la fecundación, es el fundamento de la reproducción sexual y la
variabilidad genética.
2.3 Alteraciones en el ciclo
celular
Una de las propiedades que distingue a
varios tipos de célula en el interior de organismos multicelulares como plantas
y animales es su capacidad para crecer y dividirse. Por lo anterior, las
células pueden ser clasificadas en tres tipos de categorías generales.
Altamente especializadas: Son células como las nerviosas, los glóbulos rojos y
las musculares carecen de la habilidad para reproducirse, es decir, una vez que
han alcanzado su función definida, ellas permanecen en interfase hasta que
mueren.
Medianamente especializadas: son células
que en sus contextos normales no se dividen, pero que pueden ser inducidas a
hacerlo si reciben un estímulo como una lesión. Por ejemplo, las células
hepáticas pueden ser inducidas a reproducirse después de la remoción de grandes
partes del hígado de manera quirúrgica; o mediante la reacción a adecuados
medicamentos.
Células de reproducción rápida y muy poco
especializadas: en esta categoría se encuentran las células madre de varios
tipos de estadio de desarrollo o de tejidos. Un ejemplo en los tejidos adultos
son las células hematopoyéticas.
Las células vegetales de los meristemas
apicales de las plantas exhiben las propiedades de baja especialización y un
periodo de interfase corto, lo cual les permite crear nuevos tejidos a medida
que las plantas van creciendo.
2.4 Células cancerígenas
¿El control del ciclo celular es importante? Si le preguntas
a un oncólogo - un médico que trata a pacientes con cáncer - él o ella
probablemente responderá con un rotundo sí.
El cáncer es básicamente una enfermedad de la división celular
incontrolada. Su desarrollo y progresión suelen estar vinculados a una serie de
cambios en la actividad de los reguladores del ciclo celular. Por ejemplo, los
inhibidores del ciclo celular evitan que las células se dividan cuando las
condiciones no son correctas, por lo que muy poca actividad de estos
inhibidores puede promover el cáncer. Del mismo modo, los reguladores positivos
de la división celular pueden conducir al cáncer si son demasiado activos. En
la mayoría de los casos, estos cambios en la actividad se deben a mutaciones en
los genes que codifican las proteínas reguladoras del ciclo celular, siendo
casi un tercio debido al azar y otros dos a la herencia familiar.
Las células cancerosas se comportan de manera
diferente que las células normales del cuerpo. Muchas de estas diferencias
están relacionadas con el comportamiento de la división celular. Por ejemplo,
las células cancerosas pueden multiplicarse en cultivo (fuera del cuerpo en una
caja de Petri) sin que se añadan factores de crecimiento, o señales de
proteínas estimuladoras del crecimiento. Esto es diferente de las células
normales, que necesitan factores de crecimiento para crecer en la cultura. Las
células cancerosas pueden crear sus propios factores de crecimiento, tener vías
de factores de crecimiento que están atrapadas en la posición de
"encendido" o, en el contexto del cuerpo, incluso atraer a las
células vecinas a producir factores de crecimiento para sostenerlas.
Las células cancerosas también ignoran las
señales que deberían hacer que dejen de dividirse. Por ejemplo, cuando las
células normales adultas en una caja de Petri son apiñadas por vecinos en todos
los lados, ya no se dividirán. Las células cancerosas, por el contrario, siguen
dividiéndose y apilándose una encima de otra en capas grumosas. El ambiente en
una caja de Petri es diferente del ambiente en el cuerpo humano, pero los
científicos piensan que la pérdida de la inhibición del contacto en las células
cancerosas adultas in vitro refleja la pérdida de un mecanismo que normalmente
mantiene el equilibrio del tejido en el cuerpo. Otro signo distintivo de las células
cancerosas es su "inmortalidad replicativa", un término de fantasía
para el hecho de que pueden dividirse muchas más veces que una célula normal
del cuerpo. En general, las células humanas pueden pasar sólo alrededor de
40-60 rondas de división antes de que pierdan la capacidad de dividir,
"envejecer" y finalmente se suiciden apoptóticamente.
Un tumor en específico es famoso por su pervivencia casi
ilimitada. La primera vez que se cultivaron células humanas de manera
artificial “in vitro” fue en 1941 por los investigadores George y Martha Gey de
la universidad de Johns Hopkins. Las células fueron obtenidas de un tumor
maligno y nombradas células HeLa en honor a la donante Henrietta Lacks.
Henrietta Lacks, nacida en 1920 y murió
en 1951, sin embargo, las células de su tumor siguen tan vivas hoy, como lo
estuvieron en los años 20s. Las células HeLa aún siguen siendo cultivadas en el
laboratorio aun hoy, después de que la donante original hubiera muerto muchos
años atrás. Lo que implica un fenómeno importante, una de las características
de las células cancerígenas es que no pueden morir. Es tan fuerte esta
propiedad que incluso se han convertido en contaminantes comunes de los medios
de cultivo de biología celular, en otras palabras las células HeLa se han
convertido en un ser vivo independiente en toda regla (Skloot & Turpin, 2010). Lo anterior si
lo comparamos con las bacterias nos confiere una característica básica de los
seres vivos, la muerte no es una característica esencial de la vida a nivel
celular; a ese nivel la vida nunca envejece y potencialmente puede existir para
siempre.
2.5 Control del ciclo celular
El estudio del ciclo celular no es solo importante en términos de la acumulación de conocimiento básico de la biología, sino que aún más importante, posee implicaciones prácticas para combatir el cáncer, una enfermedad que se basa en la pérdida de control de la célula de su propio ciclo de vida. En 1970, una serie de experimentos basados en fusión celular llevados a cabo por Potu Rao y Robert Johnson de la universidad de Colorado ayudó a abrir las puertas del entendimiento de cómo es que el ciclo celular es regulado. Rao y Johnason deseaban saber si el citoplasma de las células contiene elementos reguladores que afectan las actividades celulares (Rao & Johnson, 1970). Ellos se aproximaron a la cuestión median la fusión de células de mamíferos en diferentes estadios del ciclo celular.
Figura 2.2. Puntos de
control. A pesar de que el ciclo celular tiene varios puntos de control, algunas
mutaciones pueden saltarlos, dando origen a células cancerígenas
En un experimento, ellos fusionaron las
células en mitosis con otras que se encontraban en periodos de interfase. Las
células en mitosis siempre inducían a la compactación de la cromatina en los
núcleos de las células no mitóticas. Si se fusionan dos células, una en G1 y la
otra en mitosis, el núcleo de la célula que está en G1 lleva a cabo una
compactación cromosoma prematura “condensa los cromosomas antes de tiempo”. Si
una célula en G2 se fusionó con una célula en mitosis, los cromosomas de la
célula en G2 también se condensan, pero a diferencia de lo que sucede en la
célula en G1, los cromosomas de la célula G2 están visiblemente duplicados,
reflejando el hecho de que la fase S ya se ha llevado a cabo.
Si una célula en mitosis es fusionó con
una célula en fase S, la cromatina de la célula en fase S también se condensa.
Sin embargo, la compactación de la cromatina en la fase S conlleva fácilmente
al daño del ADN y se pulveriza en fragmentos rápidamente. Los resultados de estos tipos de experimentos
sugirieron que el citoplasma de una célula en mitosis poseen factores que
inducen respuestas en los núcleos en una célula que no se encuentra en mitosis.
Este hallazgo sugirió que la transición de G2 a M se encuentra bajo un control
positivo, es decir, que la transición se induce mediante la presencia de un
agente estimulante, lo cual en la biología casi siempre es una proteína.
2.6 Puntos de control del
ciclo celular
Las redes de control y los puntos de control regulan la
progresión del ciclo celular. Los puntos de control son circuitos bioquímicos
que detectan estímulos externos o internos y envían señales apropiadas al
sistema de ciclo celular. El punto de restricción en la fase G1 es una red de
control que integra el estado fisiológico de la célula con su entorno,
incluyendo la entrada de otras células y las interacciones con la matriz
extracelular circundante. Las células deben recibir estímulos de crecimiento
adecuados de su entorno para avanzar más allá de este punto en la fase G1; Si
no pueden vivir sin morir o suicidarse por apoptosis.
Los puntos de control del daño del ADN operan a través de la interfase. Si
se detecta daño, la respuesta al daño del ADN inicia una cascada de eventos que
bloquea la progresión del ciclo celular y también puede desencadenar la muerte
celular por apoptosis. Los problemas con la replicación del ADN generalmente
producen ADN monocatenario y activan la respuesta al daño del ADN. Esta respuesta
estabiliza las horquillas de replicación bloqueadas para que puedan repararse.
Durante la mitosis, el punto de control del conjunto de huso retrasa la
aparición de la segregación cromosómica hasta que todos los cromosomas se unen
adecuadamente al huso mitótico.
La respuesta al daño del ADN regula la progresión del ciclo celular en una vía de tres niveles. Los primeros sensores detectan daños en el ADN. Estos sensores activan transductores, que incluyen tanto proteínas quinasas como activadores transcripcionales. Los transductores actúan sobre los efectores que en última instancia bloquean la progresión del ciclo celular y también pueden cumplir otras funciones. Dos principales proteínas quinasas, ataxiatelangiectasia mutada (ATM) y ataxia-telangiectasia y Rad9 relacionados (ATR), se encuentran en la cabeza de la vía y también pueden actuar como sensores de daño del ADN. Activan dos quinasas transductoras, Chk1 y Chk2, así como un factor de transcripción denominado p53 que induce la expresión de una cohorte de genes que detienen la progresión del ciclo celular inhibiendo las quinasas dependientes de ciclinas, así como los genes que desencadenan la muerte celular por apoptosis.
3. Etapas del ciclo celular
En base a los experimentos con nucleótidos
marcados, y a la reorganización lógica de las fases encontradas, los biólogos
organizaron las subfases de la interfase del siguiente modo:
Figura 3.1. El esquema
clásico del ciclo celular fue propuesto originalmente en 1953 por Alma Howard y
Stephen Pelc del hospital de Hammersmith en Londres, basados en experimentos de
meristemos vegetales.
3.1 G1 “Growing 1”
Es típicamente la fase de ciclo celular más larga y más
variable. Cuando las células "nacen" en la citocinesis, son
aproximadamente la mitad del tamaño que tenían antes de la mitosis, y durante
G1, crecen hacia un tamaño óptimo. Durante este tiempo, muchas actividades
implicadas en la progresión del ciclo celular se reprimen para que la célula no
pueda iniciar una nueva ronda de proliferación. Este sistema de control
represivo se llama el punto de restricción. Si el suministro de nutrientes es
pobre o si las células reciben un estímulo antiproliferativo como una señal
para embarcarse en la diferenciación terminal, retrasan su progreso a través
del ciclo celular en G1 o salen del ciclo para entrar en G0. Sin embargo, si se
reciben estímulos positivos apropiados, las células superan el bloqueo del
punto de restricción y activan un programa de expresión génica que los
compromete a un nuevo ciclo de replicación del ADN y división celular. Las
células cancerosas a menudo tienen defectos en el control del punto de
restricción y continúan creciendo e intentan dividir incluso en ausencia de
señales ambientales apropiadas. Sin embargo, la supresión de la etapa G1 y G2
no siempre es una anormalidad, durante el desarrollo embrionario de los
mamíferos placentados los blastómeros se reproducen en un ciclo celular en el
que la interfase no se da, esto se debe a que el embrión no tiene fuente de
alimento externo, por lo que el tamaño del cigoto es el mismo que el del
blastocito compuesto ya por un centenar de células o incluso levemente menor
debido al consumo metabólico de la síntesis del ADN.
3.2 G0 “Growing control”
La mayoría de las células de organismos multicelulares se diferencian
para llevar a cabo funciones especializadas y ya no se dividen. Tales células
se consideran en fase G0. Las células a menudo entran G0 directamente cuando
salen de su última mitosis. Las células G0 no están latentes; De hecho, a
menudo se dedican activamente a la síntesis y secreción de proteínas, y pueden
ser altamente móviles. Muchas células G0 tienen un cilio primario no móvil, que
es un organelo sensorial importante. La fase G0 no es necesariamente
permanente. En algunos casos especializados, las células G0 pueden ser
reclutadas para reingresar al ciclo celular en respuesta a estímulos
específicos. La reentrada de ciclo celular implica cambios en la expresión
génica y la estabilidad de proteínas y desmontaje del cilio primario, si está
presente. Este proceso debe estar altamente regulado, ya que la proliferación
incontrolada de células en un organismo multicelular puede conducir al cáncer.
Pero sin ella no se podrían reparar los tejidos dañados por lesiones mecánicas
o infecciones.
3.3 S “Synthesis”
La fase S es aquella en la que el genoma
del núcleo se duplica, para ello es necesario que el núcleo absorba materiales
como nucleótidos y aminoácidos. Sin embargo, no es solo ADN, el genoma se lo
debe entender como una entidad completa, como ARN y proteínas reguladoras como
las histonas. La duración de la fase de síntesis en un cultivo asincrónico
mediante el porcentaje de células que se encuentran en realidad una determinada
actividad. Si se conoce la duración del ciclo celular completo, desde el fin de
una mitosis a otra mitosis, es posible calcular la duración de las subfases de
la interfase. Estos análisis conllevaron a concluir la existencia de otra etapa
de crecimiento en a que no se sintetiza material genético, previa a la
síntesis, pero posterior a la última parte de mitosis. Es decir, después de que finaliza la mitosis,
pero antes de la síntesis de ADN la célula experimenta un primer momento de
crecimiento o fase G1.
3.4 G 2 “Growing 2”
Iniciamos el recorrido a través de las
subfases del ciclo celular de este modo tan, bueno desordenado, y es que
clásicamente uno siempre empieza la explicación de las partes de la interfase
con la G1, después con la S y finalmente con la G2. Sin embargo, este orden
desdibujaría el propósito implícito puesto por los autores del texto que sirve
de base para este artículo, y es responder a la pregunta: ¿La síntesis de
material genético y el crecimiento celular durante la interfase se dan al mismo
tiempo? Una respuesta ingenua a esta pregunta sería asumir que de hecho es de
este modo, por lo que nuestros esfuerzos son con el objeto de mostrar como en
realidad, los datos de experimentos relacionados con la replicación del
material genético, específicamente del ADN nos llevan a pensar que la síntesis
y el crecimiento son procedimientos más o menos independientes.
Los estudios a los que se hace referencia
fueron realizados en la década de 1950 mediante el empleo de nucleótidos
marcados de manera radioactiva. Este procedimiento sirve para marcar los
núcleos que absorben los nucleótidos marcados durante su fase de síntesis. Sí
los núcleos se vuelven radioactivos al mismo tiempo en que las células
experimentan crecimiento, podremos decir que efectivamente la síntesis de nuevo
material genético ocurre al mismo tiempo que el crecimiento celular. Por el
contrario, si la célula detiene su crecimiento en el momento que se hace
radioactivo el núcleo, podremos determinar que la interfase tiene fases
diferentes.
Cuando estos experimentos fueron
realizados, ocurrieron resultados extraños, por ejemplo, se observaron células
que habían iniciado la mitosis sin que sus núcleos de hubieran vuelto
radioactivos. Si el proceso se dejaba por varias horas, todos los núcleos
terminaban por volverse radioactivos. De lo anterior se concluye que después de
la síntesis de ADN existe un periodo de tiempo en que la célula sigue
alimentándose, pero no ocurre más síntesis. A este periodo de tiempo se la pasó
a denominar fase de crecimiento 2, simbolizada por la expresión en ingles grow
“crecimiento” como G2.
3.5 Rangos del ciclo celular
Con rangos hacemos referencia al intervalo
de tiempo entre el fin de una mitosis a otra mitosis. Los ciclos celulares
pueden ser tan cortos como 30 minutos como en las células embrionarias que
carecen de las fases de crecimiento G1 y G2. Los ciclos celulares pueden llegar
a tener meses en tejidos de crecimiento lento como el hígado. Con unas pocas
excepciones notables, las células prácticamente se han detenido en una
interfase en la que no hay crecimiento, a esta fase de no crecimiento, no
síntesis y no mitosis se la denomina G0 “no crecimiento, no síntesis y no
mitosis”.
3.6 Rol de las proteínas quinasas
en el control del ciclo celular
Mientras que los experimentos de fusión de
células revelaron la existencia de factores que regulan el ciclo celular, ellos
no proveen información acerca de las propiedades bioquímicas de estos factores.
Detalles acerca de la naturaleza de los agentes que promueven el ingreso de la
célula en la mitosis “o meiosis” fueron obtenidos en primera instancia por una
serie de experimentos en los óvulos y embriones tempranos de ranas y algunos
invertebrados. Se demostró que la entrada de la célula en la fase M se inicia
por una proteína denominada factor de maduración-promoción “MPF por sus siglas
en inglés” MPF consiste en dos subunidades:
👉 Una
subunidad con propiedad que quinasa “las quinasas hacen mover cosas” que
transfiere grupos fosfato desde el ATP a residuos específicos de serina y
treonina en otras proteínas.
👉 Una unidad
regulatoria llamada ciclina. El termino ciclina fue acuñada debido a que la
concentración de esta proteína regulatoria sube y naja en un patrón predecible
y rítmico en cada célula de manera coordinada con el ciclo celular.
Cuando la concentración de ciclina es
baja, la subunidad quinasa permanece inactiva. Cuando la concentración de
ciclina es alta, la quinasa se activa, causando de la célula ingrese en la fase
de mitosis/meiosis. La progresión de una célula en la mitosis depende de la
actividad de una enzima cuyo único efecto es la de transferir grupos fosfato
desde ATP a otras proteínas activando una cascada de reacciones. Como segunda
instancia se tiene que esta enzima clave está regulada por la concentración de
una de sus subunidades. Esta enzima se denomina factor de maduración-promoción
A través de las décadas de 1990, y los 2000 un gran número de laboratorios se
enfocaron en las enzimas semejantes al factor de maduración-promoción, que
fueron denominadas quinasas dependientes de ciclina “Cdks por sus siglas en inglés”.
Se ha encontrado que las Cdks no están
involucradas únicamente en la inducción de la fase M, también son agentes que
regulan otras actividades a través del ciclo celular. El modelo biológico que
más se ha empleado para la identificación de la existencia, función y genes que
producen a las Cdks ha sido las confiables levaduras, especialmente dos
especies, que presentan el fenómeno de mutantes sensibles a la temperatura. Los
mutantes resistentes a la temperatura son aquellos que presentan un fenotipo
normal a temperatura normal, pero cuando la temperatura se incrementa, el gen
mutante se desactiva, presentando el fenotipo alterado o mutante. Las dos
especies de levadura que presenta la propiedad de mutantes sensibles a la
temperatura están relacionadas lejanamente y se reproducen de forma diferente. La
primera es Saccharomyces cerevisiae, la cual se reproduce a través de la
formación de pequeñas burbujas en un extremo apical de la célula. La segunda
especie es Schizosaccharomyces pombe, la cual se reproduce mediante un proceso
más clásico de elongación y separación en dos células hijas de tamaño
semejante.
Cuando se identificación las proteínas y genes homólogos que controlan el ciclo celular en varios modelos biológicos eucariotas se demostró que la base molecular es extremadamente semejante y conservada. Una vez que un gen es relacionado a una proteína de interés en una levadura, puede emplearse la secuencia de este gen y buscar copias con similitudes aproximadas en otros seres vivos incluyendo el ser humano. Y casi siempre se encuentran. Mediante la combinación de los análisis genéticos, bioquímicos y moleculares, los grupos de investigación alrededor del mundo han obtenido un conocimiento comprensivo de las actividades principales que permiten a la célula crecer y reproducirse en las cajas de Petri de laboratorio.
Figura 3.2. Saccharomyces
cerevisiae.
La investigación en el control genético
del ciclo celular de las levaduras inicio en la década de 1970 en dos
laboratorios, inicialmente el grupo de investigación de Leland Hartwell y
colaboradores en la universidad de Washington comenzaron trabajando con Saccharomyces
cerevisiae; y subsecuentemente el grupo de Paul Nurse de la universidad de
Oxford trabajando con Schizosaccharomyces pombe. Ambos laboratorios
identificaron un gen que, cuando era mutado, causaría que el crecimiento en las
células a temperaturas elevadas se detuviera en ciertos puntos del ciclo
celular. El producto de este gen, que fue denominado cdc2 en S. pombe y
cdc28 en S. cerevisiae, fue identificado como homologo a la subunidad
catalítica del factor de maduración-promoción; en otras palabras, se trata de
quinasas dependientes de dominios ciclina.
3.7 Regulación del ciclo
celular
Investigaciones posteriores en las células
de levadura al igual que en muchas células de vertebrados han reforzado el
concepto de la existencia de una progresión de fases y subfases de la célula
eucariota a través de su periodo de vida. La regulación entre las fases se da
de manera enzimática, para las fases de crecimiento la regulación o, mejor
dicho, la activación a la siguiente fase ocurre al final. Estos momentos los
denominaremos fronteras. Estas fronteras representan puntos en el ciclo celular
donde las células se ven comprometidas en el inicio de un evento crucial, como
ingresar en la síntesis de material genético o en la etapa de mitosis. El
complejo enzimático también incluye una serie de proteínas que sirven de frenos
o aceleradores, para regular el tiempo de duración de las etapas del ciclo
celular según sean las condiciones.
Se debe recordar que las fases del ciclo
celular, especialmente de la interfase son altamente dependientes de las
condiciones ambientales en las que está inmersa la célula. Si la célula se
encuentra en un ambiente con pocos nutrientes, las gases G “grow” de
crecimiento deben dilatarse, con el fin de que se reunan los materiales
necesarios para que la célula pueda soportar ya sea el crecimiento, la
duplicación del material genético y la división celular misma. Lo anterior implica que los mecanismos de
control deben medir en cada una de las subfases de la mitosis y comenzando
desde G1 los siguientes eventos:
👉 G1:
Acumulación de nutrientes mínima para la síntesis de material genético
👉 S:
copia fiel del material genético, en caso contrario se activa la célula para
suicidio celular programado o apoptosis.
👉 G2:
Acumulación de nutrientes mínima necesaria para que la célula se pueda dividir
de manera exitosa en dos, de modo tal que las células hijas tengan los
suficientes materiales para interactuar con el medio antes de comenzar a
alimentarse por ellas mismas.
👉 M: Verificación de que el material genético se ha repartido de manera adecuada en los nuevos núcleos, que pertenecerán a las células hijas, en caso contrario se induce a las células hijas defectuosas para la muerte celular programada.
Figura 3.3. Ya sé que está
en inglés, pero concentrémonos en buscar la palabra apoptosis, la cual
significa muerte celular programada. Ese es el evento más importante de control
del ciclo celular de una célula de un animal multicelular, y se llevan a cabo
en las fronteras donde ha concluido algún evento en que el material genético es
alterado o transportado. Esto se debe a que las alteraciones en estos puntos
tienden a generar mutaciones cancerígenas.
3.8 Los clivajes embrionarios
y el ciclo celular
Las células embrionarias poseen un ciclo celular acelerado en el que no existe fases de crecimiento G1 o G2. Lo anterior implica que, las células que experimentan el clivaje tienen células hijas de la mitad del tamaño que la célula madre. Un embrión en desarrollo que no se alimenta contiene una biomasa cercana a la que tenía el ovulo original del cual se formó, pero con un menor contenido de energía. Solo hasta que el embrión se implanta ya sea en el útero u en otras zonas ricas en nutrientes es que sus células pueden experimentar el crecimiento celular en las fases G1 y G2.
Figura 3.4. El desarrollo
del embrión será tratado con mayor profundidad en temas futuros, por el momento
la idea importante que deseo resaltar es el hecho de que las células del
embrión temprano no se alimentan, por lo que el sistema siempre conserva el
mismo tamaño, aun cuando el número de células se incrementa exponencialmente
tal como se ve en la imagen.
4. Apoptosis o muerte celular programada
La apoptosis o muerte celular programada,
es un fenómeno natural de las células, en las cuales se desencadenan una serie
de eventos fijos que terminan con la muerte de la célula. Por La muerte por apoptosis no tiene nada de
accidental o de aleatorio que se caracteriza por un colapso del volumen de la
célula y su núcleo sobre sí misma, la perdida de adhesión a las células
vecinales, la formación de burbujas en la superficie celular, la disección de
la cromatina y el rápido reciclado de los restos celulares por los macrófagos
fagocitados.
Debido a que es un proceso seguro y
ordenado, la apoptosis puede ser comparada con una implosión controlada de un
edificio usando explosivos puestos de manera muy precisa para que los restos no
afecten a las construcciones vecinales. ¿Por qué nuestro cuerpo posee células
no deseadas? ¿Dónde encontramos células que sean blancos de esta eliminación
controlada? La respuesta corta es en todas partes. Se ha estimado que E10-E1
células en el cuerpo humano mueren cada día solo por apoptosis. Por ejemplo, la
apoptosis está involucrada en la eliminación de células que han sufrido daños
genéticos irreparables. Esto es importante porque los daños en la información
genética pueden resultar en una replicación celular no regulada, y por lo tanto
en el desarrollo de cáncer.
(YouTube)
Vías de la apoptosis
Durante el desarrollo embrionario, las
neuronas crecen fuera del sistema nervioso central para inervar órganos que se
encuentran en la periferia del cuerpo. Usualmente muchas más neuronas crecen
fuera de los lugares donde son necesarias para una inervación normal. Las
neuronas que llegan a su sitio blanco reciben la orden hormonal de seguir con
vida. Las neuronas que fallan en encontrar el tejido a donde deben ir no
reciben la señal de supervivencia, y son eliminadas finalmente por apoptosis.
Los linfocitos Y son células del sistema
inmune que reconocen células anormales que han sido infectadas por patógenos
intracelulares como los virus. Estas células se reconocen mediante un sistema
de proteínas llamado sistema de histocompatibilidad tipo II, el cual señala
sobre la superficie de la célula infectada que sucede algo anormal en su
interior. Los linfocitos T a su vez poseen una serie de receptores específicos
en sus membranas que encajan con estas señales de alarma. Una vez se ha
identificado a la célula anormal mediante el reconocimiento, los linfocitos T
estimulan la producción de proteínas que estimulan la muerte celular de la
célula anormal y todo el tejido adyacente.
Durante el desarrollo embrionario, los
linfocitos T son producidos con propiedades diversas, algunos pueden reconocer
las células del propio cuerpo, lo cual podría genera que el sistema inmune
ataque los tejidos del mismo cuerpo desencadenando necrosis y la muerte. Estos
linfocitos peligrosos son eliminados por medio de la apoptosis. Finalmente, la
apoptosis parece estar involucrada en enfermedades neurodegenerativas graves
como el Alzheimer, el Parkinson y la enfermedad de Huntington. La eliminación
de neuronas esenciales por la progresión de la enfermedad genera perdida de la
memoria y disminución de la coordinación muscular. Estos ejemplos muestran como
la apoptosis es importante en el mantenimiento de la homeostasis en los
organismos multicelulares y que la falla en la regulación de la apoptosis puede
degenerar en serios daños para el organismo.
4.1 Definición e historia
El termino apoptosis fue acuñado en 1972
por John Kerr, Andrew Wyllie y A. R. Currie de la universidad de Aberdeen en
escocia, en un artículo paradigmático donde se describieron por vez primera los
eventos coordinados de ocurren dentro de la muerte celular programada de una
amplia gama de células. Los primeros
vistazos moleculares de la apoptosis fueron revelados mediante estudios en el
gusano nematodo Caenorhabditis elegans, cuyas células están numeradas y
trazadas con absoluta precisión desde el cigoto y a través de todas las fases
del desarrollo embrionario (Cotter, 2009;
Granville, Carthy, Hunt, & McManus, 1998; Kerr, Wyllie, & Currie, 1972;
Reynolds, 2014; Yang & Goping, 2013).
De las 1090 células producidas durante el desarrollo de este gusano 131 son normalmente eliminadas por medio de la apoptosis. En 1986 Robert Horvitz y sus colegas del Instituto de Tecnología de Massachisetts descubrieron gusanos con una mutación en el gen CED-3 que genera un desarrollo embrionario carente de apoptosis. Este descubrimiento sugiere que el producto del gen CED-3 juega un papel crucial en el proceso de apoptosis en este organismo. Una vez que un gen ha sido identificado en un modelo biológico, los investigadores buscan sus homólogos en otros organismos como los mamíferos y el ser humano (Ellis & Horvitz, 1986; Horvitz, 1999).
Figura 4.1. En el modelo
anterior podemos ver a la Caspasa-3 esta es la proteína dispensadora de muerte,
pues ejecuta numerosos cortes en proteínas diferentes que desencadenan en el
suicidio celular, este es un modelo basado en cristalografia.
La identificación de CED-3 en los
nemátodos conllevó al descubrimiento no a uno, sino a una familia de proteínas
en los mamíferos que son actualmente denominadas caspasas. Las caspasas son un
grupo de proteasas de cisteína que son activadas en un estado bastante temprano
de la apoptosis y que son responsables por gatillar la mayoría, sino es que
todos los cambios observados durante la muerte celular programada.
Específicamente la caspasa que ejecuta los "cortes de muerte" es la
caspasa-3 y su activación representa el punto de convergencia de las rutas de
apoptosis.
Las caspasas logran este evento mediante
el corte de un grupo de proteínas esenciales "cortes de muerte".
Dentro de los blancos de la caspasa-3 se encuentran:
👉 Más
de una docena de quinasas, incluyendo la quinasa de adhesión focal (FAK), PKB,
PKC y raf1. La inactivación de por ejemplo FAK afectaría la adhesión
conllevando a la separación de la célula en apoptosis del resto de sus vecinos.
👉 Láminas,
estas proteínas mantienen la cohesión de la membrana nuclear, el corte de estas
proteínas conlleva al desensamble de la lámina y el colapso del núcleo.
👉 Proteínas
del cito-esqueleto, el corte del andamiaje de la célula conlleva a un colapso
generalizado de la forma de la célula.
👉 La
caspasa activa a una endonucleasa de manera similar a como ocurre con las
proteasas de serina, esta endonucleasa (CAD) corta el ADN en fragmentos de modo
tal que sea irreparable.
Los estudios recientes se han enfocado en
los eventos que conllevan a la activación del programa de suicidio celular. La
apoptosis puede ser activada por estímulos internos como anormalidades en el
ADN; o por estímulos externos, como ciertas citoquinas (proteínas segregadas
por células del sistema inmune). Por ejemplo, las células del epitelio de la
próstata se vuelven apoptóticas cuando son privadas de la testosterona. Esta es
la razón por la cual el cáncer de próstata que ha invadido a otros tejidos es
generalmente atacado con drogas que intervienen con la producción de testosterona.
Algunos estudios indican que los estímulos externos que activan a la apoptosis
mediante una ruta de señalación llamada ruta extrínseca, la cual se distingue
de los estímulos internos de la ruta intrínseca.
4.2 Ruta extrínseca
En este caso el estímulo apoptótico es
transportado por un mensajero extracelular llamado factor de necrosis tumoral
(TNF) el cual es célebre por su habilidad para inducir a las células de tumores
cancerígenos a suicidarse en masa. El factor de necrosis tumoral es producido
por ciertas células del sistema inmune en respuesta a diversas condiciones como
la exposición a radiación ionizante, la elevación de la temperatura,
infecciones virales, agentes químicos tóxicos tales como los que se emplean en
la quimioterapia contra el cáncer.
Todo mensajero en los seres vivos requiere
de una proteína integral de la membrana que funge como su receptor especifico,
en este caso existe no una, sino toda una familia de proteínas llamada
“receptores de muerte” llamada formalmente TNFR. La evidencia indica que los
receptores de muerte TNFR están presentes en la membrana como un trímero
pre-ensamblado. El dominio citoplasmático de cada subunidad de TNFR contiene un
segmento de unos 70 aminoácidos llamados “dominio de muerte” que median en las
interacciones entre proteínas.
Cuando el mensajero TNF se une al receptor
TNFR se produce un cambio conformacional en los dominios de muerte en el
citoplasma celular, el cual conlleva al reclutamiento de cierto tipo de
proteínas llamadas FADD. Estas proteínas llamadas FADD reclutan una segunda
serie de proteínas pro-caspasas debido a que son precursores inactivos de la
caspasa. La caspasa funciona de manera muy similar a los factores de
coagulación al ser una proteasa que se encuentra inactiva normalmente, y que para
activarse debe ser cortada debido a la presencia de un segmento inhibidor en su
región activa, pero se diferencia de las proteasas de serina en que además de
un corte debe fucionarse con otra procaspasa. En resumen, el receptor con las
FADD que son como dedos separa una parte de cada pro-caspasa y luego une lo que
ceda para formar la caspasa-8.
Sin embargo, a diferencia de la gran
mayoría de las pro-enzimas líticas, las pro-caspasas exhiben ciertos niveles
proteolíticos remanentes. De hecho en ocasiones esta actividad remanente puede
causar que dos caspasas puedan activarse una a otra generando reacciones en
cadena no controladas. En cualquier caso, la enzima final madura llamada
caspasa-8 contiene cuatro cadenas de polipéptidos, derivadas de dos precursores
pro-caspasa. La activación de la caspasa-8 es similar a la activación de los
efectores mediante la hormona de factor de crecimiento. La caspasa-8 como se ha
mencionado antes es una proteína lítica pero que activa a la procaspasa-3, el
resultado es la caspasa-3 que corta en una diversa cantidad de proteínas
celulares, pero que también causa la activación de otras pro-caspasas lo que la
convierte en el “ejecutor de muerte” de la apoptosis.
4.3 Ruta intrínseca
Mediante estímulos internos como el daño
genético irreparable, la falta de oxígeno, concentraciones extremadamente altas
de ion calcio (II), infecciones virales, estrés oxidativo elevado (producción
de grandes cantidades de especies químicas oxidantes) activan la apoptosis por
medio de la ruta intrínseca. La activación de la ruta intrínseca es regulada
por miembros de la familia de proteínas Bcl-2, la cual se caracteriza por la
presencia de uno o más dominios BH, en general también se las conoce como
reguladores de la apoptosis. Los miembros de la familia Bcl-2 pueden ser
divididos en dos grupos:
👉
Miembros pro-apoptóticos que estimulan la apoptosis como Bax y Bak.
👉
Miembros anti-apoptóticos que protegen a la célula de la apoptosis como Bcl-xl;
Bcl-w y Bcl-2.
En cualquier caso, la diversidad de
proteínas es amplia, y en términos generales estas pueden ejercer su efecto de
inducción de la apoptosis por medio de dos mecanismos, dependiendo de las
proteínas particulares involucradas. En algunos casos aparentemente la
apoptosis se promueve mediante la inhibición de los miembros anti-apoptóticos
de la case Bcl-2, mientras que en otros casos aparentemente la apoptosis es
promovida mediante la activación de los miembros apoptóticos de la clase Bcl-2.
En cualquiera de los casos, son las
proteínas con dominios BH3 las que son determinantes en el destino de la
célula. En una célula sana las proteínas de do minios BH3 están ausentes o
fuertemente inhibidas, y los miembros anti-apoptóticos son capaces de regular a
los miembros apoptóticos. El mecanismo exacto aún se encuentra bajo mucho
debate, en cualquier caso, lo que sucede es un rompimiento de este equilibrio,
que induce a que las proteínas Bax y/o Bak cambien conformacionalmente
haciéndose hidrófobas e insertándose en la membrana, una vez allí se
polimerizan formando canales iónicos que permeabilizan la membrana externa de
la mitocondria.
Una vez allí, la permeabilidad de la
membrana mitocondrial a proteínas de esta se incrementa, liberándose grades
cantidades como la citocromo c la cual reside en el espacio inter-membranal. La
permeabilización de la membrana externa de la mitocondria es reforzada por el
incremento en la concentración de iones calcio (II) en el citoplasma debido a
su liberación masiva por el retículo endoplasmático. Casi todas las moléculas
de citocromo c presente en todas las mitocondrias de la célula pueden ser
liberadas de una célula en apoptosis en un periodo tan corto como cinco
minutos. De hecho, es casi como si fuera una toxina o factor de patogenicidad
de un invasor, una vez que el citocromo c es liberado al citoplasma ya no
existe vuelta atrás.
Una vez en el citoplasma la citocromo c forma un complejo multi-proteico bastante grande llamado apoptosoma, la cual también agrupa a otras proteínas como la procaspasa-9. La procaspasa-9 es activada por el proteosoma. La caspasa-9 es una caspasa de ejecución de muerte, lo cual indica que puede activar a otras caspasas y realizar también los cortes que causan la apoptosis.
5. Historia del ciclo celular
Desde principios del siglo XX, los científicos han observado
células en proceso de división, pero no entendían cómo lo hacían (Nurse, Masui, & Hartwell, 1998). En los últimos
40 años, los científicos han hecho descubrimientos monumentales sobre el
mecanismo molecular del control del ciclo celular (Bertoli, Skotheim, & De Bruin, 2013; Bretones,
Delgado, & León, 2015; Kastan & Bartek, 2004; Lilly & Duronio,
2005; Orford & Scadden, 2008; Sánchez & Dynlacht, 2005). Estas
investigaciones han tenido impactos significativos sobre cómo vemos los
trastornos humanos como el cáncer, y los investigadores involucrados han
recibido reconocimiento mundial. Sin embargo, la búsqueda de entender la
regulación del ciclo celular no siempre fue popular entre la comunidad
científica. Sí, incluso los científicos experimentan la presión de los
compañeros. Muchos científicos creyeron que tenías que adquirir una comprensión
de los fundamentos de los eventos del ciclo celular, como la replicación del
ADN, la segregación cromosómica, etc., antes de que pudieras entender cómo
estaban regulados. Este sentimiento fue descrito por el Dr. Andrew Murray,
quien dijo que el pensamiento común era que "Si no pudieras entender el
control de los procesos independientes, no podrías entender el circuito de
control" (Garber,
2001).
En 2001, el Premio Nobel de fisiología y medicina fue
entregado a tres científicos que realizaron importantes descubrimientos sobre
cómo se regula el ciclo celular. Cada científico utilizó un organismo único que
le permitió abordar la cuestión de la regulación. Leland Hartwell y Paul Nurse,
que el diario The Sun ha descrito como el "David Beckham de la
ciencia", que puede o no ser una buena cosa, dependiendo de si usted es un
fanático del fútbol, ambos realizaron sus estudios en levadura. Paul Nurse
utilizó la levadura de la fisión Schizosaccharomyces pombe (Kim et al., 2010; Nurse, Thuriaux, & Nasmyth,
1976; Nurse & Thuriaux, 1980), un tipo de
levadura que se nombra por de la cerveza africana que se utiliza para
producirla. Pombe es la palabra swahili para la cerveza; Y con eso, estamos de
vuelta al Rey León, porque hakuna matata también se toma de Swahili. Lee
Hartwell utilizó la levadura que es utilizada hoy por panaderos y cerveceros
por igual (Hartwell, 1991).
El tercer científico, Tim Hunt, usó la bioquímica en lugar de
la genética para descubrir la proteína clave importante para la progresión del
ciclo celular (Evans, Rosenthal, Youngblom, Distel, & Hunt,
1983; Hochegger et al., 2001; Hunt, 2004). Trabajando con
embriones de erizo de mar, Hunt y sus colegas descubrieron la proteína ciclina,
cuya producción y degradación regula la progresión del ciclo celular. Su
trabajo, junto con el de estudios realizados en huevos de rana por otros
destacados científicos (Yoshio Masui, Marc Kirschner y John Gerhart), demostró
que un mecanismo de reloj existente en el citoplasma podría controlar la
progresión del ciclo celular (Garber, 2001; Hunt, 2002; Kirschner, 1992; Marx,
1989).
Estos diferentes estudios se reunieron cuando Lee Hartwell
sugirió pensar en la progresión del ciclo celular en términos de "puntos
de control". La idea fundamental del modelo de punto de control era que un
sistema de control en la célula activaría una alarma que retrasaría el progreso
del ciclo hasta que se completase el evento anterior. Lee Hartwell y Ted
Weinert hicieron un experimento crítico para probar el modelo de punto de
control. Usaron controles de levadura que murieron cuando su ADN fue dañado.
Curiosamente, los mutantes no detuvieron su ciclo celular después de su ADN se
dañó. Esto significaba que estas células no dispararon la alarma para indicar
que su ADN necesitaba reparación, como lo haría una célula normal. Se
dividieron de todos modos, dando como resultado dos células hijas con ADN
dañado. Con el ADN dañado, estas células pudieron sobrevivir posteriormente.
Este importante experimento llevó a la identificación de
importantes proteínas que actuaron como un "botón de parada" o
"punto de control" para asegurarse de que todo el ADN se repara antes
de la división celular. Se demostró que las mismas proteínas de "botón de
parada" eran importantes no sólo en otras levaduras, sino también en seres
humanos. Andrew Murray describió la belleza de este experimento. Él dijo:
"Una de las mayores fortalezas de Hartwell es hacer cosas que, en
principio, hubieran sido posibles durante un período de tiempo bastante
largo." Después de que terminaron, "Oh, mi señor, eso es tan simple,
¿alguien más pudo haberlo hecho?”. Al final todo se demuestra que hacer lo que
es popular no siempre es el camino a seguir. Para estos científicos que
estudian la progresión del ciclo celular, la decisión de tomar el camino menos
transitado terminó dando grandes beneficios, como un Premio Nobel.
6. Resumen de la mitosis y la meiosis
La reproducción celular
en la mayoría de los eucariotas se puede dividir en dos tipos, sexual y asexual.
La reproducción celular asexual se encuentra mediada por la mitosis, mientras
que la reproducción sexual depende de la combinación de la mitosis y la
meiosis. EWn esta sección veremos sus generalidades, mientras que en la
discusión subsecuente ahondaremos en las características de cada una de sus
etapas.
6.1 La mitosis
La palabra es de origen alemán y de
etimología incierta, aunque puede significar hilos enredados, aunque una
aproximación mas cercana a lo que hace el proceso es el acto de desenredar
hilos. De esta manera podemos entender a la mitosis como un proceso
en el cual, las fibras del ADN que se encuentran desorganizadas en el núcleo se
autoorganizan para formar cromosomas, luego estos se separan, para poder dar
lugar a los núcleos de las células hijas. En biología celular, la mitosis es
una parte del ciclo celular en la que los cromosomas replicados se separan en
dos nuevos núcleos. La división celular por mitosis da lugar a células
genéticamente idénticas en las que se mantiene el número total de cromosomas.
Por lo tanto, la mitosis también se conoce como división ecuacional.
En general, la mitosis está precedida por
la fase S de la interfase (durante la cual se produce la replicación del ADN) y
a menudo está compuesta por las etapas:
👉 Preprofase:
Solo en las células vegetales altamente vacuoladas ocurre esta etapa, el núcleo tiene que
migrar al centro de la célula antes de que pueda comenzar la mitosis.
Impulsado por una reorganización del citoesqueleto, de forma tal que los
futuros núcleos y los cromosomas divididos a la mitad “cromátides hermanas”
puedan migrar de manera organizada a los polos opuestos de la célula en
división.
👉 Profase: Durante
la profase, que ocurre después de la interfase G2 en las células no-vegetales,
la célula se prepara para dividirse condensando fuertemente su material
genético y eliminando su núcleo celular, el cual se encontraba disperso para
poder ser leído y convertido en proteínas. El producto de condensar y
organizar el material genético se denomina cromosoma. En esta etapa,
los cromosomas son largos, delgados y con forma de hilo. Cada cromosoma tiene
dos cromátidas. Las cromátidas son en realidad cromosomas duplicados, que
deberán separarse posteriormente. Estas cromátides se encuentran unidas por una
estructura intermedia llamada centrómero.
Figura 6.1. Resumen de las
etapas de la mitosis.
Cerca del núcleo de las células animales
hay estructuras llamadas centrosomas, los cuales son estructuras relacionadas
con el citoesqueleto, y cuya función es formar estructuras citoesqueléticas
especiales llamadas huso mitótico. El uso mitótico son una especie de rieles
mecánicos que se proyectan para hilarse entre sí, y luego expandirse de manera
opuesta, generando dos polos celulares.
👉 Metafase:
En esta etapa el huso mitótico se conecta al centrómero de los cromosomas, y
por lo tanto obliga a los cromosomas a moverse y organizarse en el plano
ecuatorial de la célula. Tenga en cuenta que en la mayoría de las
microfotografías o en los micro-videos es difícil ver al hiso mitótico, por lo
que se necesitan marcadores fluorescentes especiales para verlo.
Figura 6.2. En esta
microfotografía de la metafase se puede observar con claridad los cromosomas
marcados con proteínas de fluorescencia azul, y al huso mitótico marcado con
proteínas de fluorescencia verde.
👉 Anafase:
En esta etapa, el huso mitótico de cada polo opuesto jala en sentido opuesto
cada mitad del centrómero, hasta que este se parte, dividiendo a las dos
cromátides hermanas, las cuales son jaladas mecánicamente hacia su
respectivo centriolo.
👉 Telofase:
Es lo opuesto a la profase, pues los cromosomas de enredan nuevamente, dispersándose,
para retomar sus funciones en la producción de proteínas encerrados en un nuevo
núcleo celular.
👉 Citocinesis:
la separación del citoplasma para dar lugar a dos células hijas.
6.2 La meiosis
La palabra meiosis significa disminución,
ya que su objetivo primordial es la de dividir el material genético a la mitad,
siendo esto dos procesos de separación. En el primero se separan las cromátides
hermanas como en la mitosis, pero en la segunda se separan las cromátides que
eran homólogas, sin que exista una etapa de duplicación genética. Lo anterior
trae como consecuencia que la meiosis tiene dos etapas generales, siendo algo
así como dos mitosis interconectadas si interfase, pero es mucho más que eso.
Figura 6.3. Infografía que
compara las principales etapas de la mitosis y la meiosis.
Durante la primera gran división que
recibe el nombre de la meiosis I, en la profase I, las cromátides hermanas se
unen tanto que intercambian material genético, proceso denominado recombinación genética.
Este proceso puede interpretarse como una mutación forzada que aumenta la
biodiversidad a las malas, pero con un menor riesgo de mutaciones dañinas, asegurando
que la carga genética de cada cría es única e irrepetible. Este proceso es
importante ya que fortalece el sistema inmune. El producto de la meiosis son células
haploides recombinantes, las cuales posteriormente mediante procesos de maduración
darán lugar a los gametos.
6.3 Gametogénesis
Tenga en cuenta que la producción de
óvulos y espermatozoides, aunque se basa en la meiosis, poseen sus diferencias
particulares. Por ejemplo, en la espermatogénesis, que es la producción de
espermatozoides, los productos de la meiosis son espermas inmaduros llamados espermátidas,
las cuales deben madurar para convertirse en verdaderos espermatozoides.
Por otro lado, lo que llamamos óvulo es en
realidad una célula que se encuentra en el final de si meiosis I, pero sin
haber comenzado su meiosis II. El óvulo solo madura a su meiosis II si un espermatozoides
lo penetra.
7. Introducción e historia de la mitosis
La mitosis es el proceso de división
nuclear en el cual, el material genético que ha sido duplicado a la mitad de la
interfase es extraído del núcleo viejo, posteriormente se distribuye de manera
equitativa en los polos opuestos de la célula, formando luego dos núcleos nuevos.
La mitosis es usualmente acompañada con el proceso de citocinesis, en el cual
el citoplasma de la célula con dos núcleos se separa, rodeando a los dos
núcleos nuevos, y generando así dos células hijas, cada una de menor tamaño que
la célula madre.
(YouTube) Reproducción
celular mitosis y meiosis.
Las dos células hijas resultantes de la mitosis y la citocinesis poseen un material genético similar “prácticamente idéntico” entre ellas y la célula anterior que les dio origen. La mitosis mantiene los números de cromosomas constantes entre las células madre y las células hijas, permitiendo la dispersión de los seres vivos unicalulares, o el crecimiento y reparación de los tejidos de los seres vivos multicelulares. La mitosis es extremadamente demandante en términos energéticos, una vez que una célula ingresa en este estado, se hace relativamente insensible a los estímulos externos.
Figura 7.1. Walther Flemming
(21 de abril de 1843 - 4 de agosto de 1905) fue un biólogo alemán y fundador de
la citogenética. Utilizando tintes pudo encontrar una estructura que denominó
cromatina. Identificó que la cromatina estaba correlacionada con estructuras
filiformes en el núcleo celular: los cromosomas (que significa cuerpo
coloreado).
7.1 Historia de la mitosis
A diferencia de los datos conocidos a
cerca de la interfase que se deben casi de manera exclusiva, a los estudios en
los modelos biológicos de levaduras, la fase M “mitosis” poseen una larga
tradición de estudios al nivel citológico, genético y bioquímico tanto en
modelos vegetales como animales. La palabra mitosis viene de la palabra griega
mitos, que tiene un significado relacionado a la costura como enhebrar, enhilar,
o ensartar, en otras palabras, la idea de una fibra que se conecta con una
superficie a través de un punto de conexión adecuado.
Aunque nombre fue acuñado en 1882 por el
biólogo alemán Walther Flemming para describir los cromosomas con forma de hilo
que aparecían de manera misteriosa en las células animales, justan antes de
iniciar la división en dos (Mitchison & Salmon, 2001;
Paweletz, 2001), el
proceso como tal fue descrito 6 años antes por Otto Bütschli.
La monografía de Bütschli de 1876, "Studien
über die ersten Entwickelungsvorgänge der Eizelle, die Zelltheilung und die
Konjugation der Infusorien" (Butschli, 1876), fue
importante como trabajo pionero en el desarrollo de varias áreas de la citología
y la teoría celular. En él fue el primero en identificar y ordenar
secuencialmente las etapas de la división nuclear mitótica en varios tipos de
células animales, simultáneamente con el trabajo de Strassburger sobre la
división de las células vegetales y varios años antes de los estudios de
Flemming sobre la mitosis. Bütschli demostró que los cuerpos polares de los óvulos
surgen a través de la división celular atípica “meiosis”, y al estudiar la
fertilización fue el primero en describir el cono de fertilización y demostrar
que normalmente sólo un espermatozoide entra en el óvulo (Fokin, 2013).
7.2 El efecto de la mitosis en
un ciclo de vida, definición de haploide y diploide
Aunque trataremos luego los ciclos de vida
con mayor profundidad, resulta relevante definir algunas de sus propiedades, de
modo tal que podremos determinar cuál es la función general de la mitosis, y su
efecto en los seres vivos.
(YouTube) Cromosomas y
genes.
Las células eucariotas pueden alternar entre dos estados diferentes, los cuales se definen de acuerdo al número de cromosomas que se condensan en sus núcleos justo al final de la interfase. Cabe anotar que esta alternancia de generaciones solo se da en las especies con reproducción sexual. De este modo definimos a una célula diploide, como la generación celular cuyo núcleo condensa cromosomas en parejas, es decir copias redundantes de un mismo material genético. Si simbolizamos al material genético de una especie con el símbolo n, entonces la mejor forma de describir a una célula diploide es con la expresión 2n. La mitosis se puede llevar a cabo en cualquier generación celular, pero existe variación entre las especies, por ejemplo, en los humanos, la generación celular haploide no realiza mitosis.
Figura 7.2. Dependiendo del momento del ciclo celular, los cromosomas pueden ser simples “justo al inicio de G1” o duplicados “justo al inicio de la mitosis”. A la izquierda tenemos un cromosoma con copia única de genes tal como queda después de que termina la mitosis casi al inicio de la fase G1. A la derecha tenemos un cromosoma con copia doble de genes, esta carga doble de material genético se ve debido a que poseen dos cromátides a las cuales se les denomina cromátides hermanas, este tipo de cromosomas son los que se forman al inicio de la fase M con el material que proviene de la fase G2.
Figura 7.3. A: Célula
haploide con cromosomas de cromátide simple tal como queda una célula después
de que termina la mitosis. B: Célula diploide en la misma fase que el ejemplo
A. C: Célula haploide con cromosomas de cromátides hermanas tal como se
condensan al inicio de la mitosis. D: célula diploide en la misma fase que C.
En términos del material genético A solo tiene una copia de cada gen, B, tiene
dos copias de cada gen, C tiene dos copias de cada gen y D tiene cuatro copias
de cada gen.
7.3 Modelos biológicos para la
mitosis
A lo largo de los años, muchos han sido
los modelos biológicos que han permitido los estudios celulares como las
proteínas y otras moléculas involucradas, el modelo biológico empleado ha sido
el de los huevos de rana. Los preparados de huevos de rana pueden ser
preparados de modo tal que es posible separar e identificar a las proteínas
independientes, más aun, se las puede recuperar funcionalmente en preparados
libres de células para estudiar sus propiedades de auto-ensamblado. Los huevos
de rana también pueden ser estudiados in vivo mediante la técnica de
inmunosupresión, en este caso se emplean anticuerpos monoclonales que atacan
proteínas específicas impidiendo su acción.
De este modo es posible estudiar el efecto
de una proteína específica en el contexto completo de la reproducción celular
llevada a cabo en los huevos de rana. Estos datos sirven luego para identificar
la función de la proteína y proponer modelos teóricos generales del proceso de
mitosis como un todo, tanto en la especie estudiada, como en otros seres vivos.
Un modo de validar estas extrapolaciones es mediante la identificación de los
genes que almacenan la información de las proteínas identificadas, secuenciarlo
y buscar sus respectivos homólogos en otras especies, cercana o lejanamente
emparentadas. La mitosis es generalmente dividida en 5 fases: profase,
Prometafase, metafase, anafase y telofase; cada una de las cuales se
caracteriza por una serie de eventos en particular.
Hay que tener en cuenta que estos estadios son segmentos de un proceso completamente continuo, por lo que las fases como tal se señalan justo cuando son más evidentes; la división de la mitosis en una serie de segmentos arbitrarios es realizada únicamente con el objeto de poder discutir y almacenar su información de manera que nos es lógica para aquellos que hemos sido educados de acuerdo al modo de pensar de occidente.
8. Profase mitótica, condensación de los cromosomas
La profase es la fase de promoción de los eventos posteriores de la mitosis y se inicia una vez que han completado dos requisitos críticos. Lo primero es que la célula tenga dos copias de cada uno de sus cromosomas, de modo tal que cuando el material sea dividido, el contenido genético de la célula durante la interfase sea constante en cualquier ocasión. El segundo prerequisitorio es la acumulación de energía y biomasa que soporten el esfuerzo que la célula realiza durante la mitosis. Durante la profase ocurren eventos de gran importancia, los cuales son:
Figura 8.1. Eventos que
suceden durante la profase, condensación de la cromatina en cromosomas, desaparición
de la membrana del núcleo y formación del huso mitótico "fibras".
La condensación de los cromosomas. A pesar
de lo que muchos esperarían, los cromosomas no son estructuras permanentes en
una célula, de hecho, son relativamente momentáneos. Estos se forman al inicio
de la profase por la condensación del material genético distribuido de manera
homogénea en el núcleo. También empieza la síntesis de polímeros de proteína
que formarán el huso mitótico, fibras de proteína que serán empleadas sobre los
cromosomas en fases posteriores. Finalmente, el núcleo de la célula se
disuelve, liberando a los cromosomas condensados para las fases posteriores de
la mitosis.
8.1 Condensación de la
cromatina
El núcleo de la célula durante la
interfase contiene una tremenda cantidad de fibras de cromatina. Estas fibras
se encuentran en un estado disgregado y extendido, ideal para que el material
genético pueda expresar la información que almacena en forma de proteínas
generalmente. Sin embargo, en esta estructura dispersa, la cromatina
difícilmente puede organizarse de forma tal que permita una adecuada separación
de su contenido en los polos opuestos de la célula. Es por esto, que para que
una célula pueda experimentar adecuadamente la separación de su material
genético “proceso al cual denominaremos de aquí en adelante como segregación”,
este debe compactarse en estructuras que sea más fáciles de guiar, separar y
distribuir. Estas estructuras se denominan cromosomas. El proceso por el cual
un cromosoma se forma a partir de la condensación de la cromatina del núcleo se
denomina compactación cromosomal o condensación cromosomal. La compactación
cromosomal ocurre durante la primera parte de la interfase.
(YouTube) Empaquetamiento del ADN en los cromosomas.
Superenrollamiento del ADN. El proceso
comienza con las histonas "molécula purpura 0:17, la cual enrolla el ADN
como si fuera un tubito de hilo. Cuando cuatro histonas forman un giro o bucle
0:26 se las denomina nucleosoma, y una fibra de nucleosomas es lo que se
denomina la cromatina 0:33. En la
interfase, la cromatina alterna entre el estado mostrado en 0:33 y la fibra de
ADN desplegada en 0:15. Cuando la célula ingresa a la mitosis, otras proteínas
no mostradas en el modelo del video se anclan a la cromatina y empiezan a
enrollarla varias veces más hasta formar el cromosoma.
Todos sabemos que el ADN almacena
información genética, y que los cromosomas están hechos de ADN, sin embargo, la
parte que no se cuenta es el intermedio. El ADN se encuentra altamente
relacionado con proteínas estructurales que lo desenvuelven o lo enrollan, las
más comunes se llaman histonas "bolitas amarillas en el video". En la
interfase, el ADN se mantiene en un estado de enrollado ligero o desplegado
para poder expresar su información genética, pero cuando la célula ingresa en
mitosis sufre el proceso denominado super-enrollamiento.
8.2 Organización de la cromatina
La cromatina de una célula en interfase se
organizan en fibras de aproximadamente 30 nanómetros de diámetro. Los
cromosomas mitóticos están compuestos por fibras semejantes, tal como se ve en
las microfotografías de cromosomas completos de células aisladas durante la
mitosis. Aparentemente, la compactación de la cromatina en un cromosoma no
afecta de manera sustancial la naturaleza misma de la fibra de cromatina. Una
analogía que podemos emplear es la del hilo y un tejido. El cromosoma es una
entidad compuesta por fibras de cromatina que tejen una estructura de tres
dimensiones. Los cromosomas no se forman solos, requieren del apoyo de
proteínas relacionadas íntimamente al material genético que lo controlan, lo
regulan e incluso hasta lo alteran. Un ejemplo de estas proteínas son las
histonas, que sirven como un tubino de hilo. Las histonas siempre están
activas, por lo que durante la profase, otras proteínas las estimulan para
super-enrollarse.
8.3 Condensinas y la
condensación de los cromosomas
En años recientes, la investigación en la
compactación de los cromosomas se ha enfocado en un abundante complejo de
múltiples proteínas denominado condensina. Las proteínas de la condensina
fueron descubiertas mediante la incubación de extractos de núcleos de rana e
identificando las proteínas que se asocian con los cromosomas a medida que
estos experimentan la compactación. Actualmente, los mecanismos moleculares que
le permiten a la condensina actuar son desconocidos, o propuestos mediante
modelos especulativos.
8.4 Superenrollamiento del ADN
La condensación de la cromatina en un cromosoma se da mediante un proceso llamado super-enrollamiento, en el cual las fibras de cromatina son enrolladas varias veces para formar una estructura muy densa y compacta. El ADN super-enrollado ocupa un volumen mucho menor que el del ADN relajado en cromatina dispersa, y los estudios sugieren que el super-enrollamiento del ADN juega un papel fundamental en la compactación de la fibra de cromatina en el pequeñísimo volumen ocupado por un cromosoma. En presencia de proteínas como la topoisomerasa y una fuente de energía como ATP, la condensina es capaz de unirse al ADN in vitro y enrollarlo de manera efectiva.
Figura 8.2. El ADN es
enrollado en histonas, luego en nucleoidoe y posteriormente en cromatina tal
como se muestra en (YouTube).
Posterior a la cromatina otras proteínas como la topoisomerasa continúan
enrollando más, formando los bucles de solenoide y cromomero. El cromomero es
la unidad estructural de la cual está formado el cromosoma.
Estos hallazgos concuerdan muy bien con
las observaciones de la compactación de los cromosomas, la cual durante la
profase requieren de la presencia de la topoisomerasa II, la cual junto a la
condensina son parte del sistema de enrollamiento de un cromosoma. La
condensina es presumiblemente uno de los blancos que las quinasas dependientes de
ciclina activan durante el cambio de fase del ciclo celular desde la G2 a la
fase M.
8.5 Cromátides hermanas
Como resultado de la compactación, los
cromosomas de la célula que inicia la mitosis aparecen como entidades
individualizables, con apariencia de bastón. Las hebras en forma de bastón no
son las mismas siempre. Las que aparecen al inicio de la mitosis tienen una
estructura de hebra doble o de X, si a esto lo visualizamos como un bastón
doble, cada filamento recibirá el nombre de cromátide hermana. Las cromátides
hermanas son el resultado de la duplicación del material genético durante la
fase S del ciclo celular.
8.6 Rol de la cohesina en la
profase
Antes de la replicación en la fase S, el
ADN es anclado por un complejo de proteínas múltiples denominado cohesina. Una
vez que el ADN es replicado, la cohesina ancla el material genético de modo tal
que cuando se condensen los cromosomas, cada una de las cromatinas posea el
material genético correcto y homologo al de la cromátide hermana. Experimentos
en los que la cohesina es inactivada, las cromátides hermanas se separan antes
de tiempo. La cohesina es retirada de los cromosomas a mitad de la mitosis,
debido a que las cromátides hermanas deben separarse en eventos posteriores.
8.7 Centromeros y cinetocoros
Una de las características más notables
del cromosoma es la formación de una constricción primaria que marca la
posición del centrómero. Aunque en los
modelos esquemáticos la posición del centrómero siempre o casi siempre se ubica
en el centro del cromosoma, en la realidad la ubicación del centrómero puede
variar, haciendo que los brazos de las cromátides tengan longitudes variables
entre los diferentes cromosomas. Lo anterior causa que la forma de los
cromosomas sea altamente variable, lo cual a su vez permite que los pares de
cromosomas puedan ser identificados con relativa facilidad mediante
microscopia. En los humanos, por ejemplo, todos los cromosomas son
identificables por la morfología de las Cromátides y la posición del
centrómero, asignándoles nombres del 1 al 22 donde la pareja 23 al no ser
homologas tienen nombres propios “cromosoma x y cromosoma y”.
8.8 Centrómeros y telómeros
El material genético generalmente se
asocia a la expresión de proteínas, pero en los eucariotas, este ADN es una
minoría generalmente. Dentro de la mayoría del ADN se encuentran secuencias
reguladoras, y otras secuencias de estabilización estructural. Las primeras se
encargan de controlar como, cuando y porqué un gen es expresado. Las secuencias
de estabilización estructural permiten que cuando el ADN se empaqueta en el
cromosoma, el ADN pueda ser protegido y controlado por las proteínas durante la
mitosis. Por lo general las secuencias de estabilización estructural son
secuencias de ADN altamente repetitivo y que dependiendo de su ubicación en el
cromosoma poseen una función diferente de las anteriormente mencionadas.
El ADN que se ubica en el centrómero sirve como sitio de acoplamiento para las proteínas con forma de hilo llamadas huso y que sirven para mover a los pares homólogos en fases posteriores de la mitosis.
Figura 8.3. Consumo de los
telómeros (YouTube).
Por otra parte, las secuencias que se
ubican en las puntas de las cromátides se denominan telómeros. Los telómeros
juegan un rol importante en el envejecimiento somático de las células. Cuando
las células de un cuerpo se reproducen por mitosis, parte del material genético
ubicado en las puntas de las Cromátides se pierde. Se ha propuesto que una vez
que se pierden la mayoría de secuencias de telómeros, las secuencias que
codifican para proteínas empiezan a perderse generando mutaciones graves en las
células que conllevan al cáncer y al síndrome de envejecimiento.
8.9 Cinetocoros
El cinetocoro es un conjunto de proteínas que se ensamblan sobre los centrómeros y sirven como lugar de ancla para las fibras del huso mitótico. Esta no es la única función del cinetocoro, las proteínas del cionetocoro también funcionan como motores del movimiento para el cromosoma. No todos los eucariotes poseen un cinetocoro ubicado únicamente en el centromero, algunos gusanos redondos pueden llegar a tener proteínas del cinetocoro difusos distribuidos relativamente distribuidos por la cromátide.
9. Profase mitótica, el huso y los organelos
9.1 El huso mitótico, el rol
del citoesqueleto
La mitosis es un proceso que generalmente es descrito empleando la analogía del tejido, y esto es más evidente con la expresión huso "Spindle”.
Figura 9.1. El huso es una
herramienta empleada para tejer fibras a partir de la lana cruda, es decir no
se trata de la fibra en sí sino de la herramienta para organizarla e hilarla.
Nosotros los citadinos actualmente no tenemos idea de tejido o hilado, es por
esto que las analogías empleadas en la mitosis son un poco extrañas. Tal vez
una de los pocos contactos que se tiene es con el cuento de la bella durmiente,
en la imagen siguiente tenemos a la bruja con los dos componentes del hilado,
en su mano izquierda posee un copo de lana cruda de la cual se extraen las
fibras que son transformadas en hilo gracias al huso que se encuentra en su
mano derecha. Otras versiones del cuento emplean una rueca en lugar del copo.
El huso mitótico es un complejo de
proteínas especiales que se relacionan con e citoesqueleto de la célula
eucariota. El citoesqueleto es una especie de andamio que le da forma y
movilidad a la célula. En los animales su ensamblado es iniciado por una
estructura de organización especial denominada centrosoma.
(YouTube) El
citoesqueleto
👉 Andamio celular durante la profase:
A medida que una célula pasa por l frontera de la fase G2 a la mitosis, los
microtubulos del citoesqueleto pasan por un desensamblado arrollador en
preparación para su reensamblado como componentes de un complejo denominado
huso mitótico. Se piensa que el rompimiento rápido del citoesqueleto durante la
interfase es logrado mediante la desactivación de proteínas que estabilizan los
microtubulos formando el andamio del citoesqueleto.
👉 El ciclo del centrosoma: Para entender la formación del huso mitótico tenemos que examinar en primera instancia el ciclo del centrosoma y como este progresa en relación directa al ciclo celular. Cuando una célula animal sale de la mitosis, el citoplasma contiene un solo centrosoma que contiene dos centriolos ubicados en ángulos rectos uno contra el otro.
Figura 9.2. Antes de la
citocinesis, los dos centriolos de cada célula hija futura pierden su
asociación estrecha. Este evento es activado por una proteasa denominada
separasa, la cual se vuelve activa en la fase final de la mitosis.
Posteriormente, cuando inicia la fase de síntesis “S” durante el ciclo celular,
cada centriolo del centrosoma inicia su propia replicación en el interior del citoplasma.
Cuando inicia la fase de síntesis de ADN el centrosoma inicia su propio proceso de replicación. El proceso inicia con la aparición de un pequeño protocentriolo cerca de cada uno de los centriolos preexistentes, y se orientan a los ángulos rectos. Subsecuentemente, la elongación de los microtubulos convierte a cada protocentriolo en un centriolo completo. Al inicio de la mitosis, el centrosoma se divide en dos centrosomas adyacentes, cada uno conteniendo un par de centriolos. La iniciación de la duplicación del centrosoma es activada por transferencias de grupos fosfato mediante proteínas reguladoras Cdk2, el mismo agente encargado de estimular la replicación del ADN. La duplicación del centrosome es un proceso altamente regulado para que cada centriolo madre produzca únicamente un centriolo Nuevo durante cada ciclo celular. La formación de centriolos adicionales puede conllevar a la división celular anormal y descontrolada, lo cual contribuye a la formación del cáncer.
Figura 9.3. El ciclo del
centrosoma, versión resumida. El centrosoma es un orgánulo que debe
reproducirse igual que una célula, su división total se da entre la fase de
síntesis y la segunda fase de crecimiento o G2.
👉 Formación del huso mitótico por el centrosoma: La primera fase de formación del huso mitótico en una célula animal típica es la aparición de una forma de llamarada solar o aster alrededor de cada centrosoma durante el inicio de la profase. Los microtubulos crecen por la adición de subunidades nuevas en sus puntas terminales no asociadas con el centrosoma.
Figura 9.4. Formación del
huso mitótico por el centrosoma.
El proceso de la formación del aster es
seguida por la separación de los centrosomas, uno del otro y su movimiento
subsecuente hacia los polos opuestos de la célula. Eventualmente, los dos
centrosomas llegan a los puntos opuestos, estableciendo dos polos. Hacia estos
polos será donde los cromosomas serán jalados a la fuerza en las fases finales
de la mitosis. Posterior a la mitosis, cada centrosoma será distribuido a cada
una de las células hijas.
👉 Los centrosomas no son siempre necesarios para la formación del
huso mitótico: Los centrosomas no son siempre
necesarios, varios tipos de animales, incluyendo los embriones de ratón además
de todas las células vegetales son capaces de formar un huso mitótico bipolar
en ausencia de los centrosomas. El huso mitótico funcional se puede formar
incluso en células de mosca de la fruta mutantes que carecen de centrosomas, o
en células de mamíferos en los que el centrosoma ha sido experimentalmente
removido. En todos estos casos, los microtúbulos del huso se forman cerca de
los cromosomas en lugar de los polos generados por los centrosomas.
Posteriormente, las puntas terminales en crecimiento de los microtúbulos son
mantenidas juntas a través de un motor de proteínas. Esto implica que las
células poseen al menos dos mecanismos redundantes y totalmente funcionales
para la formación del huso mitótico. Estudios recientes demuestran que ambos
procesos se dan de manera simultánea en las células normales.
9.2 Disolución de la membrana
nuclear durante la profase
En la mayoría de las células de los
eucariotas, el huso mitótico es ensamblado en el citoplasma, mientras que los
cromosomas son compactados en el nucleoplasma al interior del núcleo. El
proceso requiere necesariamente la conexión de las fibras del huso con los
cromosomas a la altura de sus cinetocoros, los cuales generalmente están sobre
los centrómeros. Esta interacción es solo posible si las membranas del núcleo
son destruidas durante el proceso de formación del huso mitótico. Este
rompimiento se hace especialmente evidente al final de la profase.
Los tres componentes principales de núcleo
denominados: complejo de poros nucleares, lamina nuclear y membranas nucleares;
deben romperse en procesos diferenciados. Se piensa que todos estos procesos
son activados por la transferencia de grupos fosfato a proteínas especiales, es
decir, es un proceso que debe sacrificar energía celular en forma de ATP. El
complejo de poros nucleares es desensamblado a medida que la interacción entre
los complejos de nucleorporinas se rompen y las proteínas de disocian en el
medio circundante. La lámina nuclear se desensambla mediante el rompimiento de
sus fibras constituyentes. La integridad de las membranas nucleares es alterada
inicialmente mediante la ampliación de los orificios asociados a la membrana
nuclear externa. En resumen, al final de la profase, los núcleos de las células
desaparecen permitiendo la interacción futura entre los cromosomas y las fibras
del huso mitótico en crecimiento.
9.3 Suerte de los demás
orgánulos
Solo a membrana del núcleo parece verse
afectada durante el proceso de mitosis, los demás orgánulos membranosos tendrán
destinos diferentes, algunos más controversiales que otros. Por lo general,
todos los orgánulos de los que se sospecha tienen un origen por endosimbiosis
pasan a través de la mitosis intactos y sin replicarse. Los ciclos de división
de mitosis y cloroplastos toman lugar en momentos diferentes del resto de la
célula. Otros orgánulos que sufren suertes semejantes al de la mitocondria y el
cloroplasto son el lisosoma y el peroxisoma.
El destino del restante sistema de membranas internas es más controversial. Clásicamente el sistema de membranas internas compuesto por los retículos endoplasmáticos y el aparato de Golgi se los describe como orgánulos que se fragmentan durante la mitosis. En este proceso, los contenidos del aparato d Golgi se incorporan al retículo endoplasmático durante la profase y el aparato de Golgi deja de existir brevemente como un orgánulo distinguible. Sin embargo, este modelo no es compartido por todos los especialistas, otros proponen que el aparato de Golgi se fragmenta para formar una población de vesículas pequeñas que son distribuidas entre las células hijas.
Figura 9.5. Las
mitocondrias y cloroplastos tienen sus propios ciclos reproductivos, pero
estarán duplicados al inicio de la mitosis.
Una tercera alternativa ha sido propuesta
en base de estudios de algas y protistas, en donde el aparato de Golgi se
fragmenta en dos, cada uno siendo distribuido a una de las células hijas. Los
retículos endoplasmáticos también han sido descritos como poseedores de
diferentes destinos dependiendo de la célula, en algunas este sistema de
membranas se fragmenta, mientras que en otras pasa a través de la mitosis relativamente
intacta. Una postura más parsimoniosa emerge de ver a la biología como una
ciencia de excepciones y diversidad, por lo que diferentes tipos de célula
pueden tener diferentes formas de encausar a sus membranas internas a través de
la mitosis.
10. Prometafase mitótica
La disolución de la membrana del núcleo marca el final de la profase y el inicio de la prometafase, en la cual el huso mitótico es terminado de ensamblar y se inicia la dinámica del movimiento cromosomal. En esta fase ocurren dos fenómenos básicos, el primero es el de la conexión. La conexión es el proceso que le permite a los microtúbulos conectarse a los cinetocoros u otras estructuras homólogas del cromosoma. El segundo fenómeno durante la prometafase es el de la congregación, en donde los cromosomas empiezan a moverse al unísono por la acción de las fuerzas de los microtúbulos que los tienen firmemente conectados. Posteriormente a esto, los cromosomas iniciaran su tránsito para congregarse de manera aún más organizada durante la siguiente fase de la mitosis.
Figura 10.1. En la
prometafase/metafase los microtúbulos del huso mitótico se insertan con (1) los
cromosomas formando el plato de división (2) entre ellos mismos reforzando a la
célula para el esfuerzo de la división y (3) con otras piezas del citoesqueleto
generando los marcos de las futuras células hijas.
10.1 Buscando el cinetocoro,
los microtúbulos pescadores
Al inicio de la prometafase, los cromosomas condensados están distribuidos de manera poco organizada en el espacio que antes pertenecía al núcleo celular. A medida que los microtúbulos del huso mitótico penetran en la región central de la célula, las puntas libres de los microtúbulos aparentan crecer y compactarse de una manera dinámica, a medida que buscan a los cromosomas y sus posiciones de anclaje.
Figura 10.2. El cinetocoro
es el blanco que posee el cromosoma "verde en el modelo" que sirve
como puerto para los microtúbulos del huso mitótico que son generados por los
centrosomas ubicados en los polos opuestos de la célula "amarillos en el
modelo".
(No es del todo claro si esta búsqueda es
del todo aleatoria, tal como la evidencia lo sugiere los microtúbulos tienden a
crecer de manera preferente en las regiones donde se encuentran los cromosomas.
Esto sin embargo es completamente determinista, pues de lo contrario el
crecimiento de los microtúbulos se haría de manera directa hacia el cinetocoro
del cromosoma, y no se observaría ese movimiento de búsqueda. Los microtúbulos
que se conectan al cinetocoro se estabilizan y, iniciando el proceso de
conexión.
(YouTube) Prometafase
10.2 Conexión del huso mitótico
con el cinetocoro
Un cinetocoro típicamente realiza el
contacto inicial sobre una parte lateral del microtúbulo más que por su punta.
Un contacto inicial es realizado por algunos cromosomas que se mueven de manera
activa a través de la pared de los microtúbulos. Esta proeza es lograda por
proteínas que otorgan movimiento ubicadas a la altura de los cinetocoros. Es por
esta razón que su nombre cinetocoro obtiene su significado, ya que viene de las
raíces “cineto” para movimiento y coro “núcleo”, por lo que la palabra
cinetocoro significaría núcleo del movimiento de los cromosomas.
Posteriormente, el cinetocoro tiende a
estabilizarse y a asociarse de manera más fuerte con la punta libre de uno o
más microtúbulos del huso mitótico de uno de los polos celulares. Una vez
“pescado” no tarda mucho hasta que el cinetocoro del lado opuesto sea cazado
por un microtúbulo del polo opuesto de la célula. Estudios en otros modelos
celulares han reportado que los cinetocoros también pueden servir como sitio de
inicio para el ensamblado de microtúbulos que buscaran los polos opuestos de la
célula. Independientemente de cómo se realiza la conexión, los cromosomas de
cromátides dobles terminarán conectados por sus cinetocoros opuestos a cada uno
de los polos de la célula.
10.3 Congregación de los
cromosomas en la prometafase
Una vez que todos los cromosomas se conectan por ambos cinetocoros a un microtúbulo empiezan a movilizarse en un proceso llamado congregación, el cual se caracteriza por una súbita organización de los cromosomas. Este proceso resulta de las fuerzas de tención de los microtúbulos a ambos lados del cromosoma, las cuales lo mueven al tensarse en una posición intermedia de la célula. Esta tención es un poco más compleja que la imagen de fibras de tela. La tensión se da por el acortamiento de los microtúbulos más largos, y el alargamiento de los microtúbulos más cortos, hasta un punto donde la longitud de los microtúbulos a ambos lados es semejante. Resulta interesante que los microtúbulos se alargan y se acortan por la punta conectada al cinetocoro por adición y extracción de subunidades, mientras que la conexión a su respectivo cinetocoro resulta inalterada.
Figura 10.3. Congregación
ecuatorial.
Eventualmente cada cromosoma se mueve a
una posición a lo largo de un plano imaginario de la célula en el centro, en
otras palabras los cromosomas se alinean en el centro de la célula formando una
especie de línea ecuatorial.
11. Metafase, anafase, telofase y citocinesis mitóticas
11.1 Metafase
Una vez que los cromosomas se congregan en la región ecuatorial de la célula da inicio a la metafase. Aunque en esta fase no existe movimiento de cromosomas, los cuales permanecen en su línea de organización, si ocurren otros eventos relacionados con los microtúbulos. Estos movimientos de los microtúbulos conllevan no solo a la formación del plato mitótico, sino también al desarrollo del plato de división del citoplasma. En resumen, la metafase es una fase intermedia de preparación para los eventos de la segunda mitad de la mitosis.
Figura 11.1. En la metafase
los microtúbulos de los centriolos generan una apariencia de estrella.
En la metafase, toda preparación dependerá
de los microtúbulos. Todos los microtúbulos son generados por el centriolo en
la estructura del huso mitótico. Sin embargo, no todas las fibras del huso
mitótico se conectan con los cromosomas, otras cumplen funciones muy
diferentes, pero siempre relacionadas con el movimiento de las estructuras
celulares. Lo cual es natural puesto que las fibras del huso están compuestas
por los mismos materiales que el citoesqueleto, el cual tiene como una de sus
funciones básicas proporcionar movimiento a la célula. De esta forma
identificaremos tres tipos de microtúbulos generados por el huso mitótico: los
microtúbulos astrales, los microtúbulos cromosomales y los microtúbulos
polares.
👉 Microtúbulos astrales: Los
microtúbulos astrales son aquellos irradiados en una posición paralela del
plato mitótico, en otras palabras, son fibras que van desde los centriolos
hacia la membrana de la célula. Estos nunca atraviesan la célula en dirección
del centriolo opuesto o se conectan con los cromosomas. Su función primordial
es la de servir de demarcadores del espacio que será ocupado por las células
hijas durante la citocinesis. En otras palabras, sirven como demarcadores de
fronteras de las dos células hijas en formación.
👉 Microtúbulos cromosomales: Estos
son los microtúbulos clásicos, es decir los que se anclan desde el centriolo
hacia el cinetocoro tensando a los cromosomas en el medio. Cada cromosoma se
encuentra unido a unos 20 o 30 microtúbulos, los cuales forman una fibra
bastante fuerte. La tención de ambas fibras no es exactamente la misma, por lo
que los cromosomas orbitan en una guerra de tira y afloje por los microtúbulos
opuestos. Durante la anafase de la mitosis estos microtúbulos resultarán
primordiales.
👉 Microtúbulos polares: Estos son
microtúbulos que no se conectaron con un cinetocoro, pero que continúan su
crecimiento. Crecen hasta que se conectan con un microtúbulo que crece desde el
polo opuesto conectándose entre sí. De cierta forma se lo puede describir como
la formación de un marco rígido que ayuda a mantener la integridad del uso
mitótico durante las siguientes fases de la mitosis en las que será necesaria
la administración de una gran fuerza para fracturar a los cromosomas sin que el
resto de la célula se rompa.
11.2 Anafase
Una vez que se alcanza el estado del plato mitótico la célula ingresa a un estado de revisión de alineación de los cromosomas. Este punto es crucial ya que es uno de los momentos de control que tiene la célula sobre la división celular de manera correcta. Si los cromosomas no se alinean correctamente en el plato mitótico la célula tiene dos opciones. La primera opción es la de retrasar la activación de la anafase y la segunda es la muerte celular programada. Si el plato de separación se genera correctamente, inicia la anafase con el rompimiento de las cromátides hermanas de los cromosomas, desde aquí en adelante los podemos visualizar como cromosomas de una sola cromátide, o simplemente cromátides a secas “la segunda es la propuesta más comúnmente aceptada, ya que la mayoría de los autores definen al cromosoma como la estructura compuesta por dos cromátides hermanas”.
Figura 11.2. Separación de
los cromosomas duplicados.
La anafase de la mitosis se caracteriza
por la separación de los cromosomas. La resolución de esta foto es muy buena y
permite no solo ver a los cromosomas sino también a los microtúbulos astrales
proyectándose de manera radial desde los polos de la célula.
La separación de las cromátides no se logra solo por la fuerza ejercida por los microtúbulos sobre los cinetocoros, también por la activación de proteasas que cortan a las proteínas que mantienen la integridad de los cromosomas, especialmente la cohesina.
Figura 11.3. Célula en
anafase.
Estas proteasas solo se hacen activas
después de la metafase, y cualquier activación previa conllevaría a una
separación incorrecta de los cromosomas durante la anafase, o a la no
alineación de los cromosomas en el plato mitótico. Una vez que los cromosomas
se rompen, estos migran hacia los polos opuestos de la célula, la cual ya ha
sido dividida en parte gracias a la generación de los microtúbulos astrales del
huso mitótico.
11.3 Telofase
La telofase se la describe como la reversión de los eventos ocurridos durante la profase, los microtúbulos del huso mitótico desaparecen, los cromosomas se agrupan en una masa indiferenciable y los núcleos de las células hijas se sintetizan. Aunque el citoplasma se mantiene unificado, los núcleos de las células hijas poseen ya volúmenes diferenciados gracias a los microtúbulos astrales que marcan los límites de las futuras células hijas. Por lo general tiende a pensarse que la división del citoplasma se da inmediatamente después de la formación de las células hijas, pero no siempre es así. En los hongos las células pueden permanecer un largo periodo de tiempo de su ciclo de vida con células en el estado de dos núcleos diferentes al cual se le denomina dicarionte “dos núcleos diploides y simbolizado con la expresión 2n + 2n” para distinguirlo del estado diploide en el cual solo existe un núcleo con material genético duplicado “2n” o del haploide con material genético simple “n”.
Figura 11.4. Durante la
telofase los eventos de la profase se invierten, los cromosomas se dispersan y
los núcleos reaparecen. La citocinesis o separación puede ocurrir al mismo
tiempo o retardarse dependiendo del ser vivo que la sufre.
11.4 Citocinesis
La mitosis tiene como objetivo la separación de los cromosomas previamente duplicados en la fase de síntesis “S” del ciclo celular y su segregación para formar dos nuevos núcleos. En este puto se duce que la célula ingresa en un estado de dicarionte “2n + 2n” en el que existen dos núcleos diploides. El siguiente proceso es el de la separación del citoplasma y recibe un nombre formal, citocinesis. La primera pista de la citocinesis en la mayoría de las células animales ocurre durante la anafase como una irregularidad de la superficie celular por una banda delgada alrededor de la célula “probablemente generada por los microtúbulos astrales”.
Figura 11.5. La citocinesis
es la separación final de las células hijas.
Con el tiempo, la irregularidad se
profundiza, formando un surco que rodea a la célula. El plano del surco se da
en el mismo plano que ha sido ocupado previamente por el plato mitótico,
permitiendo que los dos núcleos que permanecen cercanos a su respectivo polo
puedan ser particionados en su propia célula hija, de volumen inferior a la
célula madre. La irregularidad es generada por un anillo de proteína miosina,
la cual forma un anillo debajo de la membrana celular que con el tiempo la
aprieta formando las dos células hijas. La selección del punto de corte puede
darse a partir de dos puntos, (1) desde el polo donde está el centrosoma y (2)
a partir de las fibras de microtúbulos, independiente a esto, son los
microtúbulos astrales los encargados de seleccionar el punto donde se formará
el anillo de miosina.
12. Tipos de mitosis
La mitosis tal como fue descrita
anteriormente puede tener modificaciones, algunas que dependen de la cantidad
de citoplasma que se llevan las células hijas, o del comportamiento del
andamiaje mitótico al interior de las células. Dependiendo de la cantidad de
citoplasma podemos clasificar a la mitosis como simétrica o asimétrica. La
mitosis simétrica se caracteriza por que las células hijas se quedan con la
misma cantidad de citoplasma y es la que hemos descrito hasta el momento.
La mitosis es fundamental para toda la vida eucariótica, sin
embargo, muchas variaciones de la forma en que se realiza han evolucionado en
la naturaleza. Sin embargo, todas estas variaciones mitóticas permiten al
organismo alcanzar el objetivo de una mitosis exitosa, la segregación fiel de
los cromosomas. Muchos hongos logran
mitosis sincrónicas exitosas de múltiples núcleos en un citoplasma común
confinando cada huso dentro de una envoltura nuclear completa “mitosis
cerradas”. En estas mitosis cerradas, los microtúbulos nucleares emanan de los
cuerpos polares del huso incrustados dentro de la envoltura nuclear. Para
formar un huso, estos organismos deben reubicar la tubulina del citoplasma al
núcleo y utilizar los Poros Nucleares Polares o NPC por sus siglas en inglés
para hacerlo. El acceso nuclear de la tubulina a través del NPC puede ocurrir
ya sea aumentando la permeabilidad del NPC o modificando el transporte activo a
través del NPC (De Souza & Osmani, 2007).
Es evidente que los organismos con centrosomas
citoplasmáticos necesitan romper su envoltura “mitosis abierta” nuclear para
permitir el acceso de los microtúbulos a los cromosomas y, por lo tanto, sufrir
una mitosis abierta. Sin embargo, si la desintegración de la envoltura nuclear
se produce en un citoplasma que contiene múltiples núcleos sincrónicamente
sometidos a mitosis, los microtúbulos nucleados centrosomalmente podrían
interactuar con cromosomas de varios núcleos diferentes. Para ayudar a prevenir
esto, tales organismos inicialmente restringen la desintegración de la
envoltura nuclear a las áreas adyacentes a los centrosomas. El resto de la
envoltura nuclear ayuda a proteger los cromosomas, impidiéndolos unirse a los
microtúbulos nucleados de los centrosomas inapropiados “mitosis semiabierta” (De Souza & Osmani, 2007).
12.1 Mitosis asimétrica
La división celular, específicamente una
mitosis puede ser realizada de manera simétrica o asimétrica. Por lo general,
en los esquemas de los libros de texto, y en lo que se observa en el
microscopia lo que se tiene son divisiones simétricas "Imagen
principal", en la que las dos células hijas poseen las mismas propiedades
entre sí, es decir son células hermanas con propiedades semejantes. En la mitosis
simétrica por el contrario, una de las células hijas posee propiedades
diferentes a su célula hermana.
Figura 12.1. La miotosis
asimétrica puede entenderse como un "chichón"... ya en serio, la
mitosis asimétrica se caracteriza porque una de las células hijas emerge de la
otra como si fuera una protuberancia que se infla poco a poco (YouTube).
Esta propiedad de mitosis asimétrica es
vital para las células madre, ya que permite que una de las células hijas
retenga las propiedades de ser célula madre, mientras que la otra puede
comenzar a reproducirse rápidamente para formar un tejido especializado.
12.2 Tipos de mitosis por
comportamiento del andamiaje mitótico
Existen 6 tipos diferentes de mitosis en
los protistas, los cuales están definidos en base al huso mitótico y a la
membrana nuclear, que podemos dividir en dos, ortomitosis y pleuromitosis (Brusca, Brusca, & Haver, 2003).
👉 Ortomitosis: El concepto de ortomitosis hace referencia a que el huso mitótico es simétrico y se puede observar un plano ecuatorial fácilmente definible. La ortomitosis puede ser abierta, semi-abierta o cerrada intranuclear. Es abierta si el núcleo de diluye y el huso atraviesa libremente, es semi-abierta si el núcleo se abre y permite la entrada del uso; y es cerrada si el núcleo no se diluye, en este caso, el huso se forma al interior del núcleo.
Figura 12.2. Ortomitosis.
👉 Pleuromitosis: La pleuromitosis hace referencia a un uso mitótico que no es simétrico con respecto al plano celular, por lo que no se puede referenciar un plano ecuatorial. La pleuromitosis puede semiabierta, cerrada intracelular o cerrada extracelular. Las dos primeras son semejantes a las que suceden en la ortomitosis, sin embargo, aún una diferente, la extra-nuclear cerrada. En este caso el huso mitótico se forma afuera y luego interactúa con el núcleo para formar un segundo huso al interior del núcleo.
Figura 12.3. Pleuromitosis.
12.3 Mitosis asincrónica
Muchos organismos contienen núcleos múltiples dentro de un
citoplasma común, añadiendo más obstáculos para lograr mitosis exitosas. Estos
núcleos a menudo están presentes en una alta densidad, pero es vital para
asegurar que el aparato del huso se fije correctamente a los cinetocoros de los
cromosomas del núcleo apropiado. Una forma de lograr esto es que los núcleos
dentro de un citoplasma común experimenten mitosis asíncronas. En este
escenario, ya que sólo un núcleo está en mitosis en un momento dado, los
microtúbulos sólo pueden unirse a los cromosomas del núcleo correcto. Sin
embargo, muchos organismos con núcleos sincíticos experimentan mitosis
síncronas o parasíncronas, dando como resultado múltiples núcleos sometidos a
mitosis al mismo tiempo en el mismo citoplasma. Otra forma de evitar la unión
inadecuada de los microtúbulos a los cromosomas del núcleo incorrecto es
encerrar cada huso dentro de su propio núcleo celular “mitosis cerradas”. Por
ejemplo, la mitosis en A. nidulans ocurre en una onda parasincrónicamente
a lo largo de la hifa, dando por resultado varios núcleos que están en mitosis
al mismo tiempo (De Souza & Osmani, 2007).
12.4 ¿Por qué existe variación
en la mitosis?
¿Por qué los organismos han desarrollado tales mecanismos
aparentemente diferentes para lograr la mitosis? La evolución dicta que la
mitosis debe ocurrir en su forma más eficiente. Sin embargo, diferentes
organismos y tipos de células tienen diferentes obstáculos que superar para
lograr una mitosis exitosa. Para obtener una mejor visión de la variación
mitótica, es necesario considerar la biología de estas diferentes células (De Souza & Osmani, 2007).
La localización del centro organizador de
microtúbulos (MTOC) en diferentes tipos de células proporciona algunas pistas
sobre si la envoltura nuclear necesita ser descompuesta durante la mitosis. El
MTOC mitótico de los hongos es el cuerpo polar del huso, el cual está
incrustado en los sobre la membrana nuclear de A. nidulans, S.
cerevisiae y muchos otros hongos. Como los cuerpos polares del huso pueden
nuclear los microtúbulos desde su cara citoplásmica o nuclear, no es esencial
descomponer la envoltura nuclear para formar un huso mitótico. Más bien, los
cuerpos polares del huso sólo necesitan cambiar su sitio de nucleación de
microtúbulos desde la cara citoplasmática durante la interfase a la cara
nuclear durante la mitosis. Una forma de regular esto es restringir cuando la
tubulina puede entrar en los núcleos durante el ciclo celular (De Souza & Osmani, 2007).
En muchas células sometidas a una mitosis abierta, el
centrosoma actúa como el MTOC durante la interfase y la mitosis. Dado que el
centrosoma es citoplásmico mientras que el ADN es nuclear, es necesario
descomponer la envoltura nuclear para formar un huso que pueda interactuar con
los cromosomas. Notablemente, sin embargo, la desintegración completa de la
envoltura nuclear no es necesaria para la formación de huso, como lo ilustran
las mitosis de C. elegans y Drosophila melanogaster. En otras
ocasiones, puede ocurrir un proceso intermedio en el que el MTOC sea
citoplasmático cuando está inactivo y se inserte en la membrana nuclear cuando
es hora de formar el huso mitótico como en S. pombe (De
Souza & Osmani, 2007).
13. Introducción e historia de la meiosis
La meiosis es una reproducción celular en la que se disminuye a la mitad la cantidad de cromosomas de la especie, representando la primera mitad de un ciclo de vida sexual. Su complemento es la fecundación o singamia en la cual dos células producidas por la meiosis y que se denominan haploides se combinan para restituir una célula diploide. En algunas especies la primera célula producto de la singamia no es un diploide sino un dicarionte, pero tarde o temprano el núcleo se combinará para formar el estado diploide.
Figura 13.1. Oscar Hertwig
(Friedberg, Hesse; 21 de abril de 1849-Berlín, 25 de octubre de 1922) fue un
zoólogo alemán. Hermano mayor del también zoólogo Richard Hertwig. Oscar
Hertwig fue uno de los investigadores más sobresalientes en el campo de la
embriología comparada y la embriología experimental. Descubrió la fertilización
de los erizos de mar y reconoció el papel del núcleo celular en la herencia y
la reducción cromosómica durante la meiosis: en 1876 descubrió que la
fertilización incluye la penetración de un espermatozoide en el óvulo.
13.1 Historia de la meiosis
Los descubrimientos de la mitosis y la meiosis se cuentan entre los 100 descubrimientos científicos más importantes de todos los tiempos, y es uno de los 10 más importantes de la biología celular. La meiosis fue descubierta y descrita por primera vez por otro biólogo pruso-alemán llamado Oscar Hertwig “1849-1922” en 1876 y confirmada posteriormente en 1883 al nivel de los cromosomas por Van Beneden en huevos de áscaris “un gusano parasítico”(Churchill, 1970; Hamoir, 2003).
Figura 13.2. Édouard Joseph
Louis-Marie Van Beneden (1846-1910) fue un biólogo belga nacido en Lovaina y
muerto en Lieja. Estudió e investigó el área de la citología y la embriología.
También fue profesor de zoología en la Universidad de Lieja.
La importancia de la meiosis para la reproducción y la herencia, sin embargo, fue descrita sólo en 1890 por el biólogo alemán August Weismann, quien señaló que dos divisiones celulares eran necesarias para transformar una célula diploide en cuatro células haploides si el número de cromosomas debía mantenerse (Baxter & Farley, 1979; Churchill, 1970; Meirmans, 2009; Winther, 2001). En 1911 el genetista estadounidense Thomas Hunt Morgan detectó entrecruzamientos cromosómicos en la meiosis en la mosca de la fruta Drosophila melanogaster, lo que ayudó a establecer que los rasgos genéticos se transmiten en los cromosomas (Lobo & Shaw, 2008; Thomas Hunt Morgan, 1915, 1916).
Figura 13.3. August Weismann
(1834, Fráncfort del Meno - 1914, Friburgo de Brisgovia) fue un biólogo alemán.
Se formó en la Universidad de Gotinga y enseñó zoología en Friburgo
(1866-1912). Ernst Mayr lo situó como el segundo más notable teórico
evolucionista del s. XIX, detrás de Charles Darwin.
13.2 El significado de la
meiosis
De lo anterior obtenemos que la meiosis
está íntimamente relacionada con la reproducción sexual. En el ciclo sexual
tenemos el mecanismo de disminución de contenido genético y el mecanismo de
restauración, a los cuales hemos acuñado como meiosis y fecundación. El término
de meiosis fue acuñado en 1905 a partir de una palabra griega que significa
precisamente “reducción”. La meiosis asegura la producción de una fase haploide
en los ciclos de vida, siendo esta de una célula o millones de células;
mientras que la fecundación restaura la fase diploide sea esta de una célula o
millones de células. Para comparar a la mitosis con la meiosis en términos de
sus productos finales debemos tener en cuenta que las células diploides no
siempre almacenan dos copias de cada gen. Durante la fase S una célula diploide
duplica su cantidad de 2n a 2(2n) en un núcleo, y luego es esta cantidad de
genes la que ingresa a la mitosis que divide la cantidad nuevamente a 2n.
Al igual que la mitosis, la célula que ingresa en meiosis viene en un estado de 2(2n) por cada gen, pero en esta ocurren dos divisiones consecutivas, en la primera denominada meoisis I el contenido genético es reducido a 2(n) "cantidad simple de cromosoma, pero duplicada de material genético", e inmediatamente inicia una segunda división sin que se de interfase, los cromosomas aun condensados son nuevamente separados generando un estado célula de una copia por cada gen o n. La meiosis no solo importante por su capacidad para disminuir el contenido genético de una célula, también es importante porque en ella ocurre el fenómeno de recombinación genética en la cual la diversidad genética de los descendientes se incrementa de manera independiente a la mutación aleatoria.
Figura 13.4. A diferencia de
la mitosis que mantiene el número de cromosomas, aunque los rompe a la mitad,
en la meiosis los cromosomas homólogos se separan (meiosis I) y luego se rompen
(meiosis II).
La meiosis consta de dos procesos de
división on citocinesis, entre el fin de una meiosis y el inicio de la otra no
se da una interfase, por lo que las células no crecen, esto implica que, en
condiciones ideales, la célula final haploide (n) tiene un cuarto del volumen
de la célula inicial que ingresa a la meiosis.
13.3 Tipos de meiosis
La meiosis no se da de manera semejante en
todos los eucariotas, cuando se examinan varios linajes lejanamente
emparentados sale a relucir que existen diferencias marcadas con respecto al
punto en el ciclo de vida en el cual la meiosis ocurre y también con respecto a
la duración de las fases haploide y diploide. Por lo general estamos
acostumbrados a juzgar los ciclos de vida en base a como se da el ciclo de vida
en los seres humanos, todos animales mamíferos. Sin embargo, esto no representa
a la totalidad de las especies de eucariotas. Los tipos de meiosis están
directamente relacionados con los ciclos de vida de los eucariotas. Los
siguientes tres grupos pueden ser identificados como diferentes modos en los
cuales la meiosis determina el ciclo de vida.
👉 Meiosis gamética o terminal: En este grupo incluimos a todos los animales multicelulares como el ser humano, así como muchos eucariotas clasificados clásicamente como protistos. En esta, la división meiotica tiene como objeto directo la producción de los gametos. En los vertebrados machos, la meiosis ocurre antes de la maduración de los espermatozoides, algo semejante ocurre con los óvulos femeninos.
Figura 13.5. Los humanos
presentamos meiosis terminal.
👉 Meiosis cigótica o inicial: Es
característica de algunos eucariotas clasificados de manera clásica como
protistas, así como muchas especies de hongos.
Figura 13.6. Los hongos
zigomicetos son un ejemplo de meiosis inicial ya que sus cuerpos son haploides.
La división meiótica ocurre justo después
de la fecundación, por lo que el estadio de vida diploide es muy pasajero. En
estos seres vivos el cuerpo que se alimenta es o haploide o dicarionte.
👉 Meiosis intermedia o generadora de espora: En este grupo se encuentran las plantas y varios tipos de algas.
Las divisiones meióticas se realizadas en una fase diferenciada de la
maduración del gameto o de la fertilización. La consecuencia de esto es que las
dos generaciones celulares generan un cuerpo que se alimenta independiente uno
del otro.
Figura 13.7. Plantas que
presentan alternancia de generaciones poseen dos cuerpos, uno haploide y otro
diploide.
La fase diploide genera un cuerpo
multicelular la cual genera esporas. Cuando las esporas germinan las células
haploides generan otro cuerpo multicelular que si genera gametos. El cuerpo
generador de gametos puede ser independiente o estar vinculado al cuerpo
generador de esporas como ocurre en las plantas terrestres más recientes; lo
contrario ocurre con los linajes de plantas más antiguo, aunque ahondaremos en
esto en otros artículos.
15. Meiosis I, profase I y recombinación genética
Una de las diferencias más evidentes entre
la mitosis y la meiosis es que a segunda es más compleja, constando de dos
procesos de diacinesis. Sin embargo, existen otras diferencias relacionadas con
la profase. En la meiosis solo existe una profase antes de la primera
diacinesis, pero en la meiosis II no se da. Más aún, la única profase que
ocurre en la meiosis es un proceso altamente complejo y se extiende por un
rango de tiempo mucho mayor que su contraparte en la mitosis. En la hebra humana,
por ejemplo, los ovocitos inician la profase I de la meiosis antes de salir del
útero, e ingresan inmediatamente en un estado de latencia prolongado. Los
ovocitos retoman su desarrollo cuando la mujer inicia su ciclo menstrual
durante la pubertad uno a la vez. Esto implica que, en los humanos y muchos
mamíferos, los ovocitos permanecen paralizados en la profase I por rangos de
tiempo que pueden durar años o más de una década. La profase I es un proceso
altamente complejo que tradicionalmente se ha dividido en varias etapas
denominadas leptoteno, cigoteno, paquiteno, diploteno y diacinesis.
(YouTube) La meiosis.
14.1 Leptoteno
La primera etapa de la profase de la
meiosis I se denomina leptoteno. Durante el leptoteno los cromosomas se
condensan. A diferencia de la mitosis, los cromosomas no muestran de manera
evidente sus cromátides hermanas, pero mediante el microscópico electrónico la
resolución permite identificar la presencia efectiva de ambas cromátides. Es
importante resaltar que la copia de genes al inicio del leptoteno es de 2(2n),
cada cromosoma tiene 2n genes, y existen dos cromosomas homólogos con el mismo
contenido genético 2(2n). Dado que existe 2(2n) copias del material genético el
objeto de la meiosis será la formación de 4 células con n copias del material
genético.
14.2 Cigoteno
La segunda fase de la profase de la meiosis I se denomina cigoteno y se caracteriza por una asociación visible de los cromosomas homólogos. Este proceso de emparejamiento de los cromosomas homólogos se denomina sinapsis, un mecanismo importante en las teorías evolutivas modernas, pero que aún tiene una serie de preguntas que no se han respondido adecuadamente. ¿Cómo se reconocen los cromosomas homólogos? ¿Cómo los cromosomas homólogos se alinean perfectamente? ¿Cuándo empieza el reconocimiento de los cromosomas homólogos en primera instancia? Estudios recientes indican que esta asociación puede rastrearse como mínimo hasta el leptoteno. En otras palabras, los cromosomas homólogos vienen emparejados de antes, y en el cigoteno esta relación se hace evidente al microscopio óptico.
Figura 14.1. Etapas de la
profase de la meiosis I.
14.3 Rompimiento del ADN,
Leptoteno o cigoteno
Antes de pasar a la siguiente etapa de la profase de la meiosis I es importante resaltar la relación entre el leptoteno y el cigoteno. Varios estudios tanto en levaduras como en ratones sugieren que los cromosomas experimentan un rompimiento durante el leptoteno, mucho antes de que los cromosomas se han emparejado de manera visible. Otros estudios han identificado que el lugar donde se condensa un cromosoma no es aleatorio, más bien se trata de un territorio específico en el cual surge.
Figura 14.2. El cigoteno.
Esto implica que existen mecanismos de
regulación “posiblemente proteínas asociadas al material genético” que aseguran
que los cromosomas posean un territorio específico e independiente del
territorio de otros cromosomas. Ajustando esta regulación, los cromosomas
homólogos tendrán un territorio compartido propio independiente del de las
demás parejas. Estos descubrimientos implican que los cromosomas homólogos
vienen emparejados ya como cromatina, antes de que sean condensados durante el
leptoteno de la profase I de la meiosis.
14.4 Telómeros emparejamiento y
el envejecimiento
A diferencia de la mitosis, en la meiosis
los telómeros no son consumidos. Los telómeros son secuencias importantes que
se ubican en las puntas de los cromosomas. Varios estudios sugieren que su
perdida durante la mitosis está relacionada con el envejecimiento. Un ejemplo
de esto es que incrementar artificialmente la longitud de los telómeros es
capaz de hacer a una célula humana inmortal. Sin embargo, no en todas las
especies se observa una relación directa entre acortamiento del telómero y el
envejecimiento, pues muchas aves marinas y mamíferos presentan relaciones
inversas en las que entre más viejo el animal más largo es el telómero.
En la meiosis los telómeros se distribuyen
en el núcleo celular. Luego, cerca del fin del leptoteno existe una
reorganización dramática de los cromosomas en muchas especies de modo tal que
los telómeros se localizan en la superficie interna de la membrana nuclear a un
lado del núcleo. La agrupación de los telómeros a un lado de la membrana
nuclear ocurre en una amplia variedad de células eucariotas y hace que los
cromosomas se asemejen a un ramillete de flores tejidas. A pesar de ser
procesos cercanos en espacio tiempo, aun es cuestión de debate si los telómeros
ayudan a la formación de la sinapsis. Resulta interesante el hecho de que los
telómeros cumplen una función estructural y no de almacenamiento de información
genética siendo ADN.
14.5 Complejo sinaptonémico
El complejo sinaptonémico es una
estructura con forma de escalera transversa hecha de filamentos proteínicos que
conectan los dos elementos laterales. La cromatina de cada cromosoma homologo
se organiza en bucles que se extienden desde uno de los elementos laterales del
complejo sinaptonémico.
Figura 14.3. El complejo sinaptonémico
se forma gracias a la dispersión de la cromatina de los dos cromosomas
homólogos y la unión de esta mediante proteínas especiales que estabilizan al
complejo sinaptonémico.
Los elementos laterales se componen
primariamente de cohesina, la cual presumiblemente mantiene unidos a la
cromatina y a las cromátides hermanas. Por muchos años se pensó que el complejo
sinaptonémico mantiene unidos a los cromosomas homólogos de una manera adecuada
para iniciar la recombinación del material genético entre las cromadles
homólogas. Actualmente es evidente que el complejo sinaptonémico no es
requerido para la recombinación genética por dos razones. (1) El complejo
sinaptonémico se forma se forma después de que la recombinación genética se ha
iniciado y (2) ejemplares mutantes de levadura que son incapaces de formar las
proteínas del complejo sinaptonémico son capaces de realizar la recombinación
genética. Actualmente se piensa que el complejo sinaptonémico es un marco que
permite a interacción de las cromátides para completar el entrecruzamiento. El
complejo formado por un par de cromosomas uniéndose se denomina bivalente o
tétrada. Bivalente porque existen dos cromosomas completos interactuando; y se
lo llama tétrada porque existen 4 cromátides con el mismo contenido genético
unidas.
14.6 Paquiteno
Durante el paquiteno los bucles paralelos de cromátides homólogas forman una serie de cuerpos densos que contienen proteínas especializadas en la recombinación del material genético. El proceso de recombinación genética se completa durante la finalización del paquiteno.
Figura 14.4. En el paquiteno
se hilan los cromosomas homólogos para intercambiar material genético.
14.7 Diploteno
El inicio del diploteno se reconoce por la disociación del complejo sinaptonémico, que deja los cromosomas unidos en puntos específicos en estructuras entrecruzadas en forma de X denominada quiasma. Los quiasmas se ubican en sitios de los cromosomas donde el entrecruzamiento entre las moléculas de ADN de dos cromosomas ya ha ocurrido. El quiasma se forma con enlaces covalentes entre una cromátide de un cromosoma y una cromátide NO hermana “homóloga” del otro cromosoma. Estos puntos de unión proveen una impresionante estructura visual de la extensión de la recombinación genética. Los quiasmas son más visibles por la tendencia de los cromosomas homólogos a separarse durante el diploteno.
Figura 14.5. En el diploteno
inicia la separación de los cromosomas homólogos duplicados.
En los invertebrados, el diploteno puede
ser extremadamente intenso durante la ovogénesis pues al mismo tiempo los
ovules adquieren la mayoría de su volumen. El diploteno puede ser un periodo de
una gran intensidad metabólica, lo cual a su vez implica que el material
genético en los cromosomas puede ser empleado para la formación de proteínas
aun cuando está en su mayoría empaquetado.
14.8 Diacinesis
La última fase de la profase de la meiosis I se denomina diacinesis. En esta etapa el huso mitótico empieza a ensamblarse, y los cromosomas son preparados para la separación. En aquellas especies cuyos cromosomas tienden a dispersarse en cromatina durante el diploteno vuelven a compactarse durante la diacinesis. La diacinesis termina con la desaparición del nucléolo, el rompimiento de las membranas celulares y el movimiento de las parejas de cromosomas hacia el plato de la metafase. Los quiasmas son requeridos para mantener unidos a los cromosomas durante todo este proceso. En los humanos, los cromosomas más pequeños tienen al menos un quiasma, mientras que los cromosomas más largos poseen dos o tres quiasmas. Una formación anormal de un quiasma débil conlleva a la separación prematura de los cromosomas durante la primera citocinesis, lo cual puede causar problemas genéticos en los descendientes debido a una cantidad anormal de cromosomas como las trisomías.
15. Meiosis I y meiosis II
15.1 Metafase 1
Durante la metafase de la meiosis I se forma el plato de separación, pero en esta ocasión los microtúbulos solo conectan un cromosoma por cada lado, dejando uno de los cinetocoros de cada cromosoma homologo sin conectar. Las caras hacia las cuales se orientan los cromosomas paternos y maternos con respecto a un polo específico no están reguladas, por lo que la separación de los cromosomas se da de manera aleatoria. Una vez formado el plato de separación y conectados los cromosomas por un solo lado dará inicio la siguiente fase.
Figura 15.1. En la meiosis I
"arriba" durante la metafase los cinetocoros son conectados por una
de las caras del cromosoma, separando los cromosomas homólogos en la siguiente
fase, pero dejando intactas las cromátides hermanas.
15.2 Anafase 1 “primera ley de
Mendel”
La anafase de la meiosis I es el evento
real que se corresponde al modelo teórico propuesto en la primera ley de
Mendel. Como resultado de la organización independiente y aleatoria, los
organismos son capaces de generar una cantidad virtualmente ilimitada de
gametos. La separación de los cromosomas homólogos durante la meiosis I
requiere la disolución de los quiasmas que mantienen unidos a los cromosomas
homólogos. La separación de los quiasmas se logra por proteínas proteolíticas
que cortan las cohesinas que mantienen la integridad de los quiasmas. En
contraste la cohesión entre los centrómeros unidos de las cromátides germanas
permanece fuerte, debido a que la cohesina situada allí es protegida del ataque
proteolítico durante la meiosis I. Como resultado, los cromátides hermanas
siguen firmemente unidas mientras que los quiasmas se rompen de manera
selectiva.
Figura 15.2. Separación de
cromosomas homólogos en la anafase de la meiosis I.
15.3 Telofase 1 y citocinesis 1
La telofase de la meiosis I no se diferencia mucho de su contraparte de la mitosis. Los cromosomas son llevados a los polos de la célula. En algunas especies, los núcleos pueden volver a formarse y en otras no.
Figura 15.3. El fin de la
meiosis I no necesariamente activa la meiosis II, a veces se necesitan
estímulos externos.
Posterior a esto se genera la citocinesis
formando dos células hijas con una sola serie de cromosomas cada uno con
cromátides hermanas, es decir poseen una cantidad de material genético igual a
2(n). El proceso que permite llevar el contenido genético de 2(n) haploide a n
haploide es llevado a cabo por la segunda meiosis o meiosis II que inicia
inmediatamente termina la citocinesis de la meiosis I.
15.4 Diferencias entre la
mitosis y la meiosis I
Una diferencia fundamental entre la meiosis I y la mitosis (y
meiosis II) es que en la meiosis I los homólogos en lugar de separar cromátidas
hermanas y luego segregar, lo que hace se segregar los cromosomas homólogos.
Esta diferencia depende de tres características de la meiosis I que la
distinguen de la mitosis. Primero, los dos cinetocoros hermanos en un homólogo
deben unirse de forma estable al mismo polo del huso. Normalmente se evita este
tipo de apego durante la mitosis. En la meiosis I, sin embargo, los dos
cinetocoros hermanos se fusionan en una única unidad de unión de microtúbulos
que se une a un solo polo. La fusión de los cinetocoros hermanos se logra por
un complejo de proteínas que se localiza en ellos en la meiosis I, pero no
sabemos en detalle cómo funcionan estas proteínas. Se eliminan de los
cinetocoros después de la meiosis I, de modo que en la meiosis II los pares de
cromátidas hermanas pueden ser bi-orientados en el huso como están en la
mitosis normalmente.
En segundo lugar, los cruces generan una fuerte vinculación
física entre homólogos, lo que permite su bi-orientación en el ecuador del huso
-como la cohesión entre cromátidas hermanas es importante para su
bi-orientación en la mitosis (y la meiosis II). Tercero, la cohesión que se
elimina en la anafase I sólo es la de los brazos cromosómicos y no de las
regiones cercanas a los centrómeros, donde se localizan los cinetocoros. La
pérdida de cohesión de los brazos desencadena la separación de los cromosomas
homólogos al inicio de la anafase I. Este proceso depende de la activación de
APC / C, que conduce a la destrucción de securina, activación de separas y
escisión de cohesina a lo largo de los brazos.
15.5 La meiosis falla con
regularidad
La separación de los cromosomas que tiene lugar durante la
meiosis es una hazaña notable de contabilidad intracelular. En los seres
humanos, cada meiosis requiere que la célula inicial mantenga un registro de 92
cromátidas (46 cromosomas, cada una de las cuales se ha duplicado),
distribuyendo un conjunto completo de cada tipo de autosoma a cada una de las
cuatro progenies haploides. No es de extrañar que se produzcan errores al
asignar los cromosomas durante este elaborado proceso. Los errores son
especialmente comunes en la meiosis femenina humana, que se detiene durante
años después del diploteno: la meiosis I se completa sólo en la ovulación y la
meiosis II sólo después de que el óvulo se fertiliza. De hecho, tales errores
de segregación cromosómica durante el desarrollo del huevo son la causa más
común de aborto espontáneo y retraso mental en los seres humanos.
Cuando los homólogos no se separan correctamente -un fenómeno
llamado no disyunción- el resultado es que algunos de los gametos haploides
resultantes carecen de un cromosoma particular, mientras que otros tienen más
de una copia de él. Tras la fecundación, estos gametos forman embriones
anormales, la mayoría de los cuales mueren. Algunos sobreviven, sin embargo. El
síndrome de Down en humanos, por ejemplo, que es la principal causa de retraso
mental, es causado por una copia extra del cromosoma 21, que suele ser el
resultado de la no disyunción durante la meiosis I en el ovario femenino. Los
errores de segregación durante la meiosis aumentan mucho con el avance de la
edad materna.
15.6 Meiosis II
El periodo entre la primera citocinesis y la segunda citocinesis se denomina intercinesis y es donde tienen lugar los eventos de la meiosis II. En los animales, los gametos en esta fase de denominan espermatocitos secundarios y oocitos secundarios. Estas células son haploides en el contenido de cromosomas, pero contienen una cantidad de genes igual a 2(n). A la citocinesis I le puede seguir o no la profase II “algunos esquemas ni se molestan en mencionarla”. Si se han recreado núcleos pasajeros durante la telofase I, a profase I efectivamente los romperá y los cromosomas volverán a compactarse en caso de que se hubieran dispersado durante la citocinesis. Pero en los casos de que no la meiosis II iniciará casi de inmediato en la formación del plato de separación de la metafase II. A diferencia de a metafase I, en la metafase II ambos cinetocoros serán conectados por los microtúbulos, y la cohesina de las cromátides hermanas si será atacada. Esto permite la separación de las cromátides hermanas.
Figura 15.4. Resumen de toda
la meiosis.
15.7 Maduración de los gametos
En los seres humanos la meiosis
estandarizada tal como la mostramos en los esquemas de resumen no se da, por lo
que se debe hablar más bien de procesos especializados denominados
gametogénesis. En la gametogénesis la meiosis es el proceso central, pero está
acompañado de otros procesos mitóticos, siendo en mayor número para la
espermatogénesis y en menor número para la ovogénesis. De hecho, es interesante
resaltar que lo que denominamos óvulo maduro fértil no es más que una célula
que apenas ha salido de la meiosis I, y solo ingresa en meiosis II si un
espermatozoide ingresa.
En otras ocaciones los productos mitóticos no forman gametos realmente, sino que forman un cuerpo multicelular haploide conocido como gametangio o gametofito, el cual si se encarga de la generación de los gametos. En términos amplios es un proceso más complejo pero semejante a la maduración de los gametos, en el sentido de que, en ocasiones, y especialmente para los gametos masculinos, el producto de la meiosis II no es un gameto fértil maduro.
16. Importancia de la recombinación genética
La primera evidencia que se encontró de la recombinación genética vino del laboratorio de T. H. Morgan durante la segunda década del siglo XX gracias a las investigaciones realizadas en las moscas de la fruta (Lobo & Shaw, 2008; T H Morgan, Sturtevant, Muller, & Bridges, 1972; Thomas Hunt Morgan, 1915, 1916, 1919a, 1919b). Posteriormente las observaciones en este modelo biológico fueron extrapoladas y confirmadas en otros modelos eucariotas capaces de realizar la reproducción sexual vía la meiosis como lo somos los seres humanos.
Figura 16.1. Thomas Hunt Morgan
(25 de septiembre 1866 - 4 de diciembre 1945)1 fue un genetista
estadounidense. Estudió la historia natural, zoología, y macromutación en la
mosca de la fruta Drosophila melanogaster. Sus contribuciones
científicas más importantes fueron en el campo de la Genética. Fue galardonado
con el Premio Nobel de Fisiología y Medicina en 1933 por la demostración de que
los cromosomas son portadores de los genes, lo que se conoce como la teoría
cromosómica de Sutton y Boveri. Gracias a su trabajo, Drosophila melanogaster
se convirtió en uno de los principales organismos modelo en Genética.
La recombinación genética altera las
proporciones mendelianas clásicas y por eso hace parte de la genética
post-mendeliana. La recombinación genética también confirma otra de las grandes
hipótesis de A. Weismann y es concerniente al concepto de la reina roja y la
utilidad evolutiva del sexo (Lee, Ni, Li, Shertz, & Heitman,
2010; Meirmans, 2009; Zuccala, 2015). En resumen, el sexo es costoso biológicamente, por lo que debería
presentar una utilidad evolutiva muy grande, y esa utilidad es dada por la
recombinación genética. La recombinación es un mecanismo que incrementa la
variabilidad de las poblaciones de manera independiente a las mutaciones
espontáneas. Con una mayor variabilidad las poblaciones toleran con mayor facilidad
los cambios ambientales y las presiones ejercidas por los parásitos, los
competidores y los depredadores.
16.1 Historia
A pesar de que la asociación de los genes
en grupos de ligamiento fue confirmada por los trabajos de Morgan a mediados de
la segunda década del siglo XX, el problema es que el ligamiento aparecía de
forma estadísticamente incompleta, existía algo que seguía alterando las
frecuencias mendelianas al nivel estadístico. En otras palabras, los alelos de
dos genes diferentes como los que codifican para alas cortas y cuerpo negro que
originalmente se presentaban ligadas en un mismo cromosoma, no siempre
permanecían unidos durante la producción de los gametos. Por lo tanto, las
características maternales y paternales heredadas por in individuo en
cromosomas homólogos separados podían ser cruzadas y terminar presentes en el
mismo cromosoma de un solo gameto. Alternativamente, dos características que se
heredaron unidas en un mismo cromosoma parental podían terminar separadas una
de la otra en diferentes gametos.
En 1911 Morgan ofreció una explicación
para el rompimiento del ligamiento. Dos años antes F. A. Janssens había
observado que los cromosomas homólogos de los bivalentes se envolvían entre si
durante la primera fase de la meiosis I. Janssens había propuesto que esta
interacción entre los cromosomas paternos y maternos generaba un rompimiento e
intercambio de los brazos cromosomales.
(YouTube) teoría cromosómica de la herencia.
Si los cromosomas pasaran intactos se
generarían grupos de ligamiento como en este ejemplo hipotético. Sin
recombinación solo existirían 2 tipos de cromosomas con identidades genéticas
bien definidas que se heredarían de manera mendeliana en grupo.
El cruzamiento tiene el potencial de
generar cuatro cromátides con identidades genéticas diferentes, dos que son las
originales y dos que son recombinantes. De la imagen se puede anticipar que los
genes que están cerca unos de otros tienen altas posibilidades de ser
transferidos en grupos ligados cuando el cromosoma recombina, mientras que los
genes en posiciones lejanas tienen altas posibilidades de combinarse con alelos
alternativos generando cromosomas nuevos.
Capitalizando esta propuesta, Morgan
sugirió que este fenómeno que acuñó como entrecruzamiento o recombinación
genética podía explicar la aparición de descendientes con fenotipo
recombinante. Los análisis de los descendientes al nivel estadístico de una
alta cantidad de individuos adultos cargan una variedad de alelos en el mismo
cromosoma indicando que (1) el porcentaje de recombinación entre un par de
genes en un cromosoma como color de ojos o longitud de ala era constante entre
diferentes ciclos generados; y (2) los porcentajes de recombinación entre los
diferentes pares de genes como el color de ojos y la longitud de del ala contra
otro par de color de ojos y longitud de alas puede variar mucho.
El hecho de que un par de genes dado da
aproximadamente la misma frecuencia de recombinación en cada cruce sugiere
fuertemente que las posiciones de los genes a lo largo de los cromosomas son
fijas y no varía de una generación a otra. A esta posición fija se la denominó Locus “singular” o Loci “plural”. Si el locus de cada gen es fijo,
entonces la frecuencia de recombinación entre dos genes depende de la lejanía o
cercanía relativa entre este par de genes, es decir entre más recombinación más
lejos y entre menos recombinación más cerca. En 1911 A. Sturtevant un
estudiante del laboratorio de Morgan concibió la idea de que las frecuencias de
recombinación podían ser empleadas para dibujar mapas de distancia relativa
entre los diferentes genes al interior de un mismo cromosoma.
16.2 El costo evolutivo del
sexo
El término “Hipótesis de Weismann” ahora
se concentra en la proposición explicita de que la reproducción sexual funciona
como un proveedor de variación para la selección natural (Mayr, 1982). A pesar de la importancia
adaptativa del sexo (y el como el sexo evolucionó) ha permanecido como un área
de considerable debate debido al costo del 50% en la aptitud, lo que en teoría
debería favorecer a la reproducción asexual (Niklas, 1997). Nótese que, durante la
reproducción sexual, cada progenitor solo le hereda el 50% de su genoma a su
descendencia. El resultado de la vacación genómica introducido de esta forma
puede conllevar a la aparición de individuos mal adaptados. En contraste, la reproducción asexual,
asegura que los nuevos individuos están adaptados como sus padres al ambiente,
lo que conllevaría a que cada miembro de la población generase clones de sí
mismo. Por lo cual la pregunta del
millón es ¿Por qué es tan común entre los eucariontes, la reproducción sexual?
De acuerdo con Mayr (1982) el dilema de la
perdida de la aptitud en un 50% debido a la reproducción sexual se puede
resolver si consideramos el hecho de que el ambiente al que estaban adaptados
los padres cambia a través del tiempo y puede que no sea el mismo que
enfrentara la descendencia. Niklas
(1997) señaló que la reproducción sexual y asexual no son mutuamente excluyentes,
una combinación de ambas se puede observar en plantas, hongos y un sin fin de
organismos eucariontes microscópicos. La
descendencia variable producida por la reproducción sexual puede contener (y
debido al número, contiene) algunos individuos mejor adaptados a nuevos
ambientes, mientras que la reproducción asexual produce organismos que retienen
los caracteres adaptativos para un ambiente estable
Muchos hongos poseen ambos tipos de
reproducción, cuando llegan a un ambiente rico en recursos ellos empiezan a
generar una población clonal generada por reproducción asexual, cuando las
condiciones del ambiente se hacen menos favorables, los hongos entran en un
estado que induce la generación de gametos y estructuras secundarias que sirven
para dispersar a largas distancias los cigotos producidos por la reproducción
sexual. Esta estrategia no es única de los hongos, y la reproducción sexual
siempre emerge como un fenómeno de emergencia, cuando las condiciones del
ambiente se ponen poco favorables.
(YouTube) Evolución, el sexo.
Hamilton et al (1990) propusieron que la variabilidad genética que la reproducción
sexual provee ayuda a las plantas, animales, hongos entre otros a lidiar contra
parásitos y enfermedades. En la carrera
armamentista evolutiva, los organismos patogénicos pueden crecer y adaptarse
rápidamente debido a su gran número y corto ciclo de vida, lo que les permite
evadir las defensas del organismo huésped. Rice y Chippindale ( 2001) han mostrado evidencia de que la reproducción sexual es ventajosa
debido a que acelera la evolución genotípica sin el riesgo de la mutación
aleatoria que puede generar tanto alelos ventajosos como perjudiciales. Todas
estas ideas y experimentos soportan el concepto original de Weismann de que la
reproducción sexual produce una progenie variable lo que promueve la evolución
adaptativa.
16.3 Motor evolutivo
La variabilidad en el fenotipo y el
genotipo en poblaciones de plantas, animales hongos “entre otros” se genera mediante recombinación genética
(intercambio de brazos cromosomales en la segunda fase de la meiosis) resultado
de la reproducción sexual y de las mutaciones aleatorias a través de la
secuencia (parental – descendencia). La
cantidad de variación genética que una población que se reproduce sexualmente
puede producir es enorme. Considere a un solo progenitor con un numero N de
genes, cada uno con solo 2 alelos (Nota del traductor: El ser humano posee
alrededor de 25.000 a 30.000 genes cada uno con entre 10 y 20 alelos, algunos genes
pueden tener 100 alelos todos funcionales en la población, recuerden que cada
individuo solo puede llevar 2) Este
individuo “ideal” produce una cantidad diferente de gametos (óvulos y
espermatozoides) igual a (2 exponencial
N o sea 2 multiplicado N veces). Debido a que la reproducción sexual envuelve a
dos progenitores, cada combinación de gametos puede producir una cantidad de
cigotos igual a (4 exponencial N, o sea 4 multiplicado N veces) con diferentes
genotipos.
Si cada progenitor tuviera solo 150 genes con solo 2 alelos (una subestimación grosera del genoma de un eucarionte como el ser humano), cada pariente puede dar lugar a 1045 (10 multiplicado 45 veces) diferentes espermatozoides u óvulos; y solo una pareja de padres podría producir teóricamente más de 1090 (10 multiplicado 90 veces) de diferentes cigotos con genomas únicos (un número que es bastante cercano al estimado de partículas totales en todo el universo). Regresando a Darwin, una vez más, si la teoría de la evolución es fuera fundamentalmente incorrecta, la utilidad de la reproducción sexual no sería evidente, y se convertiría en otro “fallo de diseño”.
17. No disyunción durante la meiosis
El problema con la evolución no es que sea
falsa, sino que no posee dirección, para este sistema natural el individuo es
solo una víctima más de depredadores, competidores y parásitos, por lo que bien
es posible sacrificar poblaciones enteras a favor del único individuo que
estadísticamente se saca la lotería. El proceso de la meiosis evolucionó para estimular
la evolución, incrementando la tasa de variabilidad, pero como bien sabemos,
mucha de esa variabilidad genera individuos con índices menores de aptitud
reproductiva. La meiosis tiene una variaciones comunes o errores que conlleva a
enfermedades genéticas muy debilitantes. Normalmente una tribu de cazadores
recolectores intentaría proteger a estos individuos, pero tarde o temprano, los
depredadores se encargarían de ejecutar la “selección natural”.
La medicina humana, a medida que ha ido
avanzando busca fundamentalmente oponerse a las fuerzas de la selección
natural, lo cual no es malo, los humanos nos caracterizamos por oponernos a lo
natural de cierta forma, de allí el éxito de nuestra especie, y de allí nuestro
afán por proteger a individuos, que de otro modo solo serían pasto de los
depredadores.
En las plantas, por el contrario, la no
disyunción cromosómica no es vista como problemática, pues afecta a pocos
individuos, y después de todo son plantas, sin embargo, un fenómeno extremo de
no disyunción se ha convertido en el motor evolutivo de las plantas con flor,
la poliploidía.
17.1 Aneuploidia
Resulta evidente que la meiosis es un
proceso complejo, y que errores en el proceso pueden darse a pesar de todos los
mecanismos de control y salvaguardas impuestas en el proceso. Los procesos de
error en la meiosis generalmente se originan de una mala disyunción de los
cromosomas durante la anafase I o la anafase II, y su consecuencia primordial
es la formación de células con números de cromosomas anormales para la
fecundación. En los seres humanos esta condición es sorprendentemente común,
tanto con gametos con cromosomas faltantes o con cromosomas sobrantes. Si uno
de estos gametos llega a fusionarse con un gameto normar, el cigoto con un
número anormal de cromosomas presenta alteraciones en el modo en que expresa
sus proteínas, en otras palabras, es un tipo de mutación.
(YouTube) Abortos y nacidos vivos con aneuploidias
Dependiendo del modelo biológico, los
cambios en el número de cromosomas pueden ser mortales, tolerables o hasta
normales. En las plantas, por ejemplo, la no disyunción total de los cromosomas
puede dar lugar a la poliploidia, con individuos con la totalidad de su
material genético duplicado, siendo este un mecanismo de especiación y
diversificación muy rápido. En los animales como el ser humano, los cambios en
el número de cromosomas de la especie generalmente implican anormalidades en el
desarrollo muy limitantes en la normal interacción con la sociedad y el
medioambiente. Los cigotos que se desarrollan con células que poseen una
cantidad anormal de cromosomas se denominan aneuploides.
17.2 Trisomía y monosomía
Las consecuencias de la aneuploidía
dependen de cual o cuales cromosomas son afectados en su cantidad normal. En las células de la línea somática humana
normal la cantidad de cromosomas es igual a 46 = 2n durante la G1, durante G2
en adelante la cantidad de material genético es el doble, pero los cromosomas
que se condensan en la profase es la misma. Los cromosomas en 2n o en 2(2n)
vienen en parejas, sea simples “como son disueltos al final de la mitosis” o
sea en forma de X “cuando se condensan durante la profase” respectivamente.
Cuando se adiciona un cromosoma extra a una pareja se dice que la célula
presenta una trisomía. Una persona que posee tres cromosomas 21 se la define
como poseedora de una trisomía del cromosoma 21. Cuando falta un cromosoma para
completar una pareja (2n-1) se produce una monosomía.
17.3 Consecuencias de la
aneuploidia
La carencia de un cromosoma extra es
siempre letal durante alguna de las etapas del desarrollo embrionario. Por lo
tanto, los cigotos con cromosomas faltantes nunca dan lugar a un feto que logra
nace vivo. Aunque no se deberían esperar alteraciones debido a la posesión de
cromosomas extra, la posesión de trisomías, de hecho no presentan destinos
mucho menores que el de las monosomías. De los 22 autosomas en los seres
humanos, solo las personas con trisomías del cromosoma 21 pueden sobrevivir más
allá de las primeras semanas o meses de vida. La mayoría de las demás trisomías
son letales durante el desarrollo embrionario, mientras que las trisomías de
los cromosomas 13 y 18 pueden nacer, pero presentan anormalidades tan severas
que sucumben prontamente después del nacimiento. Cerca del 25% de los abortos
espontáneos son causados por trisomías. Se piensa que muchasas cigotos son
formados con trisomías tan severas, que se abortan muy temprano durante el
desarrollo embrionarios “antes de la primer semana de desarrollo” y por lo
tanto no son detectados clínicamente.
17.4 Proporción y causas de la
aneuploidia
Por cada cigoto trisómico formado en la
fertilización, existen probablemente un número igual de cigotos monosómicos,
los cuales se desarrollan aun peor. Se estima que aproximadamente el 20-25% de
los ovocitos humanos son aneuploides, lo cual es una proporción muchísimo más
alta que cualquier otra especie que ha sido estudiada hasta el momento. Los
óvulos de ratón de laboratorio exhiben tasas de aneuploidia entre el 1-2%. La
exposición de los ratones a compuestos homólogos al estrógeno “bisfenol A”
empleado en la fabricación de plásticos de policarbonato pueden incrementar la
tasa de no disyunción meiótica en los ratones. Esa ha sido la primera
demostración cara de la relación entre compuestos sintéticos en el ambiente y
la aneuploidía meiótica. El hecho de que este u otras sustancias ambientales
sean la causa de la alta tasa de aneuplodia humana permanece como foco de
debate. Sea cual sea la causa, un detalle se vuelve evidente, y es que los
óvulos humanos son los que presentan una tasa más alta de aneuploidia en
comparación con los espermatozoides.
17.5 Aneuploidia y síndrome de
Down
A pesar de que el cromosoma 21 es el más
pequeño de los autosomas humanos y que contiene menos de 400 genes, la
presencia de una copia extra a la pareja normal conlleva al desarrollo del
síndrome de Down.
(YouTube) Informe
especial sobre Síndrome de Down.
Las personas con el síndrome de Down
exhiben niveles variables de problemas en el desarrollo cognitivo, alteración
en la estructura corporal, problemas circulatorios, incremento en la
susceptibilidad a las enfermedades infecciosas, un incremento alto en la
probabilidad de desarrollo de leucemia y un desarrollo temprano de Alzheimer.
Se piensa que todos estos problemas médicos son resultado de un nivel anormal
de expresión de genes localizados en el cromosoma 21. Para que los efectos sean
de este modo es probable que estos genes sean regulatorios inversamente
proporcionales que impiden la expresión normal de otros genes en cromosomas
independientes al 21.
17.6 Síndrome de Turner
La aneuploidia en cromosomas normales
puede generar dos enfermedades, la primera que estudiaremos es el síndrome de
Turner. Un cigoto con un solo cromosoma X y sin otro cromosoma sexual (denotado
como X0) desarrolla una niña con síndrome de Turner, en el cual el desarrollo
genital se detiene en el estado juvenil.
(YouTube) indrome de Turner (TS) (Falta de Cromosoma X) ½ (YouTube)
Sindrome de Turner (TS) (Falta de Cromosoma X) 2/2.
Los ovarios no se desarrollan y la
estructura del cuerpo es visiblemente anormal, afentando principalmente el
sistema cardíaco.
17.7 Síndrome de Klinefelter y
síndrome de Xyy
Debido a que el cromosoma Y es
determinante para generar machos, una persona con al menos un cromosoma Y se
desarrolla como niño.
(YouTube)
Síndrome de Klinefelter y fertilidad. Unidad del Instituto Bernabeu para su
tratamiento
Un niño con un cromosoma X extra (XXY)
desarrolla el síndrome de Klinefelter, el cual se caracteriza con problemas
severos en el desarrollo cognitivo, genitales no desarrollados, y la presencia
de caracteres sexuales secundarios femeninos como el busto. Un cigoto con una
copia extra del cromosoma Y (XYY) desarrolla un niño con estado físico
aparentemente normal, pero más alto de lo normal. Existe un gran debate sobre
si los niños XYY tienden a desarrollarse como super-machos con niveles
incrementados de comportamiento violento y antisocial.
17.8 Probabilidades de la
aneuploidia
La probabilidad de tener hijos
aneuploides, por ejemplo con síndrome de Down se incrementa de manera dramática
con la edad de la mujer: 0,05% para madres de 19 años hasta un 3,00% para
mujeres con más de 45 años. La mayoría de los estudios demuestran que no existe
tal correlación con la edad del padre. Los estimados basados en comparaciones
de secuencias de ADN entre los hijos y sus padres indican que el 95% de las
trisomías del cromosoma 21 pueden ser rastreadas a una disyunción que no
ocurrió en el ovocito femenino.
17.9 Tipos de no disyunción
meiótica
La aneuploidia es causada por la no
disyunción de los cromosomas durante cualquier anafase de la meiosis. El asunto
es que los efectos causados son diferentes dependiendo de cuando ocurre la no
disyunción. Una disyunción primaria se da en la anafase I y transmite dos
cromosomas homólogos a una célula hija, y deja a la otra sin el respectivo
cromosoma. En un estudio de 433 casos de trisomía del cromosoma 21 resultaron
en una no disyunción maternal, donde 373 errores ocurrieron en la anafase de la
meiosis I y 60 fueron originados en la meiosis II. Varias hipótesis concuerdan
en que las causas más aparentes se deben a la prologada permanencia de los
ovocitos femeninos en la profase de la meiosis I, la cual puede causar una
estabilización excesiva de los quiasmas o de la cohesina de los cromosomas.
17.10 La poliploidía
La poliploidia es un evento en que todos
los cromosomas son afectados por la no disyunción en la meiosis. Cabría esperarse
que tal mutación fuera incompatible con la vida pero en las plantas y otros
seres vivos con una estructura genética menos rígida puedan conllevar a una
especiación instantánea. Varios estudios genéticos sugieren que más del 70% de
las plantas con flor evolucionaron gracias a la duplicación por poliploidia. La
razón para esto es que la poliploidia requiere de la autofecundación para ser
llevada a cabo con éxito, si un gameto diploide fecunda a uno normal el cigoto
resultante no prospera generalmente; pero si el gameto poliploide se combina
con otro poliploide el cigoto resultante posee un número apareado de
cromosomas.
Las flores son estructuras sexuales que tienen el potencial de producir gametos masculinos y femeninos de forma simultánea, en otras palabras tienden fácilmente a la autofertilización, esta eventialidad anatómica y fisiológica facilita el proceso de la poliploidia ya que esta se da más fácilmente por autofecundación. Este tipo de poliploidia se denomina autopoliploidia. Existen otros tipos pero de este tema se hablará con más profundidad cuando se abarque el tema de la genética post-mendeliana y la genética molecular en temas y artículos futuros.
18. Referencias bibliográficas
Alberts, B.,
Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P.
(2015). Molecular biology of the cell (5th ed.). Garland Science.
Baker, J. R. (1948). The
cell-theory: a restatement, history, and critique. Quarterly Journal of
Microscopical Science, 89(1), 103–125.
Baxter, A., & Farley, J.
(1979). Mendel and meiosis. Journal of the History of Biology, 12(1),
137–173.
Belk, C., & Maier, V. B.
(2013). Biology Science for Life with physiology. (Pearson, Ed.) (4th
ed.).
Bertoli, C., Skotheim, J. M.,
& De Bruin, R. A. M. (2013). Control of cell cycle transcription during G1
and S phases. Nature Reviews Molecular Cell Biology, 14(8),
518–528.
Bretones, G., Delgado, M. D.,
& León, J. (2015). Myc and cell cycle control. Biochimica et Biophysica
Acta (BBA)-Gene Regulatory Mechanisms, 1849(5), 506–516.
Brusca, R., Brusca, G. J.,
& Haver, N. J. (2003). Invertebrates (2nd ed.). Sinauer Associates.
Butschli, O. (1876). Studien
über die ersten Entwicklungsvorgänge der Eizelle, die Zelltheilung und die
Conjugation der Infusorien (Vol. 10). C. Winter.
Campbell, M. K., &
Farrell, S. O. (2009). Biochemistry (6th ed.). USA: Thomsom Brooks/Cole.
Campbell, M. K., &
Farrell, S. O. (2012). Biochemistry (7th ed.). Canadá: Brooks/Cole.
Churchill, F. B. (1970).
Hertwig, Weismann, and the meaning of reduction division circa 1890. Isis,
61(4), 429–457.
Cotter, T. G. (2009).
Apoptosis and cancer: the genesis of a research field. Nature Reviews Cancer,
9(7), 501–507.
Cox, M. M., Doudna, J. A.,
& O’Donnell, M. (2012). Molecular biology (1st ed.). Freeman.
De Souza, C. P. C., & Osmani, S. A. (2007). Mitosis, not just
open or closed. Eukaryotic Cell, 6(9), 1521–1527.
Ellis, H. M., & Horvitz,
H. R. (1986). Genetic control of programmed cell death in the nematode C.
elegans. Cell, 44(6), 817–829.
Evans, T., Rosenthal, E. T.,
Youngblom, J., Distel, D., & Hunt, T. (1983). Cyclin: a protein specified
by maternal mRNA in sea urchin eggs that is destroyed at each cleavage
division. Cell, 33(2), 389–396.
Fokin, S. (2013). OTTO
BüTSCHLI (1848-1920). WHERE WE WILL GENUFLECT? Protistology, 8(1).
Garber, K. (2001). Beyond the
Nobel Prize: cell cycle research offers new view of cancer. Oxford University
Press.
Granville, D. J., Carthy, C.
M., Hunt, D. W., & McManus, B. M. (1998). Apoptosis: molecular aspects of
cell death and disease. Laboratory Investigation; a Journal of Technical
Methods and Pathology, 78(8), 893.
Hamilton, W. D., Axelrod, R.,
& Tanese, R. (1990). Sexual reproduction as an adaptation to resist
parasites (a review). Proceedings of the National Academy of Sciences, 87(9),
3566–3573.
Hamoir, G. (2003). The discovery
of meiosis by E. Van Beneden, a breakthrough in the morphological phase of
heredity. International Journal of Developmental Biology, 36(1),
9–15.
Hartwell, L. H. (1991).
Twenty-five years of cell cycle genetics. Genetics, 129(4), 975.
Hochegger, H., Klotzbücher,
A., Kirk, J., Howell, M., le Guellec, K., Fletcher, K., … Hunt, T. (2001). New
B-type cyclin synthesis is required between meiosis I and II during Xenopus
oocyte maturation. Development, 128(19), 3795–3807.
Hoefnagels, M. (2015). Biology:
concepts and investigations (3rd ed.). McGraw-Hill New York.
Horvitz, H. R. (1999). Genetic
control of programmed cell death in the nematode Caenorhabditis elegans. Cancer
Research, 59(7 Supplement), 1701s–1706s.
Hunt, T. (2002). Nobel
lecture: protein synthesis, proteolysis, and cell cycle transitions. Bioscience
Reports, 22(5), 465–486.
Hunt, T. (2004). The Discovery
of Cyclin (I) Commentary.
Karp, G. C. (2013). Cell
and Molecular Biology, Concepts and Experiments (7th ed.). USA: Wiley
Online Library.
Kastan, M. B., & Bartek,
J. (2004). Cell-cycle checkpoints and cancer. Nature, 432(7015),
316–323.
Kerr, J. F. R., Wyllie, A. H.,
& Currie, A. R. (1972). Apoptosis: a basic biological phenomenon with
wide-ranging implications in tissue kinetics. British Journal of Cancer,
26(4), 239.
Kim, D.-U., Hayles, J., Kim,
D., Wood, V., Park, H.-O., Won, M., … Palmer, G. (2010). Analysis of a
genome-wide set of gene deletions in the fission yeast Schizosaccharomyces pombe.
Nature Biotechnology, 28(6), 617–623.
Kirschner, M. (1992). The cell
cycle then and now. Trends in Biochemical Sciences, 17(8),
281–285.
Lee, S. C., Ni, M., Li, W.,
Shertz, C., & Heitman, J. (2010). The evolution of sex: a perspective from
the fungal kingdom. Microbiology and Molecular Biology Reviews, 74(2),
298–340.
Lilly, M. A., & Duronio,
R. J. (2005). New insights into cell cycle control from the Drosophila
endocycle. Oncogene, 24(17), 2765–2775.
Lobo, I., & Shaw, K.
(2008). Thomas Hunt Morgan, genetic recombination, and gene mapping. Nature
Education, 1(1), 205.
Mackean, D. G., & Hayward,
D. (2014). Biology (3rd ed.). IGCSE Cambridge.
Mader, S. S. (2010). Biology
(10th ed.). McGraw-Hill Education.
Mader, S. S., &
Windelspecht, M. (2015). Biology (12th ed.). McGraw-Hill Education.
Mader, S. S., &
Windelspecht, M. (2018). Essentials of biology (5th ed.). McGraw-Hill
Education.
Marx, J. L. (1989). The cell
cycle coming under control: two disparate lines of research merge, revealing
that the biochemical machinery for controlling cell division is the same in
species ranging from yeast to man. Science, 245(4915), 252–256.
Mason, K. A., Losos, J. B.,
Singer, S. R., & Raven, P. H. (2014). Biology (7th ed.). McGraw-Hill
New York.
Mayr, E. (1982). The growth
of biological thought: Diversity, evolution, and inheritance. Harvard
University Press.
Mazzarello, P. (1999). A
unifying concept: the history of cell theory. Nature Cell Biology, 1(1),
E13–E15.
Meirmans, S. (2009). The
evolution of the problem of sex. In Lost Sex (pp. 21–46). Springer.
Mitchison, T. J., &
Salmon, E. D. (2001). Mitosis: a history of division. Nature Cell Biology,
3(1), E17–E21.
Morgan, T. H. (1915). The
mechanism of Mendelian heredity. Holt.
Morgan, T. H. (1916). A
Critique of the Theory of Evolution. Princeton University Press.
Morgan, T. H. (1919a). The
genetic and the operative evidence relating to secondary sexual characters.
Carnegie Institution of Washington.
Morgan, T. H. (1919b). The
physical basis of heredity. JB Lippincott.
Morgan, T. H., Sturtevant, A.
H., Muller, H. J., & Bridges, C. B. (1972). The Mechanism of Mendelian
Heredity (1915). New York.
Murray, R. K., Bender, D. A.,
Botham, K. M., Kennelly, P. J., Rodwell, V., & Weil, A. (2012). Harpers
Illustrated Biochemistry (29th ed.). McGraw-Hill Medical.
Niklas, K. J. (1997). The
evolutionary biology of plants. University of Chicago Press.
Nurse, P., Masui, Y., &
Hartwell, L. (1998). Understanding the cell cycle. Nature Medicine, 4(10),
1103–1106.
Nurse, P., & Thuriaux, P.
(1980). Regulatory genes controlling mitosis in the fission yeast
Schizosaccharomyces pombe. Genetics, 96(3), 627–637.
Nurse, P., Thuriaux, P., &
Nasmyth, K. (1976). Genetic control of the cell division cycle in the fission
yeast Schizosaccharomyces pombe. Molecular and General Genetics MGG, 146(2),
167–178.
Orford, K. W., & Scadden,
D. T. (2008). Deconstructing stem cell self-renewal: genetic insights into
cell-cycle regulation. Nature Reviews Genetics, 9(2), 115–128.
Paweletz, N. (2001). Walther
Flemming: pioneer of mitosis research. Nature Reviews Molecular Cell Biology,
2(1), 72–76.
Pollard, T. D., Earnshaw, W.
C., Lippincott-Schwartz, J., & Johnson, G. T. (2017). Cell Biology
(3rd ed.). Elsevier.
Rao, P. N., & Johnson, R.
T. (1970). Mammalian cell fusion: studies on the regulation of DNA synthesis
and mitosis. Nature, 225(5228), 159–164.
Reece, J. B., Urry, L. A.,
Wasserman, S. A., Cain, M. L., Minorsky, P. V, & Jackson, R. B. (2014). Campbell
Biology (10th ed.). Pearson Higher Ed.
Reynolds, A. S. (2014). The
deaths of a cell: how language and metaphor influence the science of cell death.
Studies in History and Philosophy of Science Part C: Studies in History and
Philosophy of Biological and Biomedical Sciences, 48, 175–184.
Rice, W. R., &
Chippindale, A. K. (2001). Sexual recombination and the power of natural
selection. Science, 294(5542), 555–559.
Sadava, D., Berenbaum, M.,
& Hillis, D. (2014). Life the Science of Biology (10th ed.). Sinauer
& MacMillian.
Sánchez, I., & Dynlacht,
B. D. (2005). New insights into cyclins, CDKs, and cell cycle control. In Seminars
in cell & developmental biology (Vol. 16, pp. 311–321). Elsevier.
Simon, E., Reece, J., &
Dickey, J. (2013). Essential biology with physiology (4th ed.). Pearson.
Skloot, R., & Turpin, B.
(2010). The immortal life of Henrietta Lacks.
Solomon, E., Martin, C.,
Martin, D. W., & Berg, L. R. (2014). Biology (10th ed.). Cengage
Learning.
Starr, C., Evers, C., &
Starr, L. (2013). Biology: Today and Tomorrow With Physiology (4th ed.).
Brooks/Cole.
Weaver, R. F. (2012). Molecular
biology (5th ed.). McGraw-Hill Education.
Winther, R. G. (2001). August
Weismann on germ-plasm variation. Journal of the History of Biology, 34(3),
517–555.
Yang, N., & Goping, I. S.
(2013). Apoptosis. In Colloquium Series on Building Blocks of the Cell: Cell
Structure and Function (Vol. 1, pp. 1–101). Morgan & Claypool Life
Sciences.
Zuccala, E. (2015). Evolutionary genetics: Red Queen dynamics in fruit fly sex. Nature Reviews Genetics.










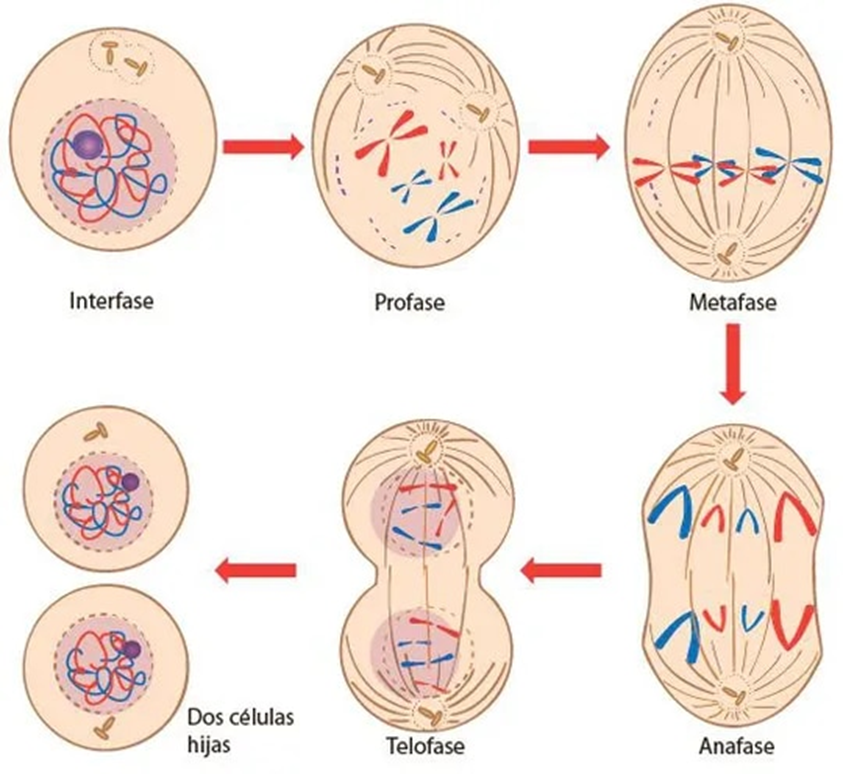









































No hay comentarios:
Publicar un comentario