Indice
|
||1|| Introducción ||2|| Patos Anatidae 2.1
Dendrocygna autumnalis o Iguaza común 2.2 Spatula discors
Cerceta aliazul 2.3 Oxyura jamaicensis Pato turrio ||3|| Zambullidores Podicipedidae 3.1
Podilymbus podiceps Zambullidor piquipintado ||4|| Palomas, Torcazas o Tórtolas Columbidae 4.1
Columba livia Paloma doméstica 4.2 Zenaida auriculata
Abuelita ||5|| Cucos y Garrapateros Cuculidae 5.1
Crotophaga major Garrapatero mayor 5.2 Crotophaga ani Garrapatero menor ||6|| Buitres del nuevo mundo Cathartidae 6.1 Coragyps atratus Chulo o zopilote ||7|| Colibríes Rochilidae 7.1
Colibri coruscans Colibrí chillón 7.2
Chaetocercus mulsant Colibrí abeja ||8|| Tinguas o Pollas de agua Allidae 8.1
Rallus semiplumbeus Tingua bogotana 8.2
Porphyrio martinica Tingua azul 8.3 Porphyriops
melanops Tingua moteada 8.4 Porzana carolina
Polluela norteña 8.5 Gallinula galeata
Tingua piquirroja 8.6 Fulica americana
Tingua piquiamarilla ||9|| Avefrías o Teros Charadriidae 9.1 Vanellus
chilensis Alcaraván ||10|| Playeros, Correlimos y Becacinas Scolopacidae 10.1 Tringa solitaria Andarríos solitario 10.2 Tringa melanoleuca Patiamarillo mayor ||11|| Patos buzo o Cormoranes Phalacrocoracidae 11.1 Phalacrocorax brasilianus Cormorán neotropical ||12|| Garzas y Garcitas Ardeidae 12.1 Nycticorax nycticorax Guaco 12.2 Butorides virescens Garcita verde 12.3 Butorides striata Garcita rayada 12.4 Bubulcus ibis Garcilla del ganado 12.5 Ardea alba Garza real 12.6 Egretta thula Garza patiamarilla ||13|| Ibis y Corocoras Threskiornithidae 13.1 Eudocimus ruber Corocora 13.2 Phimosus
infuscatus Coquito ||14|| Águila Pescadora Pandionidae 14.1 Pandion haliaetus Águila
pescadora ||15|| Águila Pescadora Pandionidae 15.1 Pandion haliaetus Águila
pescadora ||16|| Gavilanes y Águilas Accipitridae 16.1 Elanus
leucurus Gavilán bailarín 16.2 Rupornis
magnirostris Gavilán caminero 16.3 Buteo
platypterus Gavilán aliancho ||17|| Búhos o Tecolotes Strigidae 17.1 Megascops choliba Currucutú común 17.2 Asio
clamator Búho rayado 17.3 Asio
stygius Búho negruzco 17.4 Asio
flammeus Búho campestre |
||18|| Horneros y Espineros Furnariidae 18.1 Synallaxis subpudica Chamicero ||19|| Mosqueritos, Piojitos o Atrapamoscas Tyrannidae 19.1 Mecocerculus
leucophrys Atrapamoscas gorgiblanco 19.2 Serpophaga cinérea Mosquerito guardarríos 19.3 Machetornis
rixosa Sirirí bueyero 19.4 Myiodynastes
luteiventris Atrapamoscas sulfurado 19.5 Empidonomus
varius Atrapamoscas veteado 19.6 Tyrannus
savana Tijereta 19.7 Tyrannus tyrannus Tirano norteño 19.8 Myiarchus
crinitus Copetón 19.9 Pyrocephalus
rubinus Petirrojo 19.10 Contopus
virens Pibí oriental ||20|| Aviones y Golondrinas Hirundinidae 20.1 Orochelidon
murina Golondrina vientriparda ||21|| Cucaracheros Troglodytidae 21.1 Troglodytes
aedon Cucarachero ||22|| Mirlas y Zorzales Turdidae ||23|| Mimidos, Mirlas y Sinsontes Mimidae 23.1 Mimus
gilvus Sinsonte ||24|| Canarios, Jilgueros o Pinzones Fringillidae 24.1 Spinus
spinescens Chisga cabecinegra ||25|| Gorriones y Semilleros Passerellidae 25.1 Zonotrichia
capensis Copetón ||26|| Changos y Turpiales Icteridae 26.1 Sturnella
magna Chirlobirlo 26.2 Molothrus
bonariensis Chamón 26.3 Quiscalus
lugubris Tordo negro 26.4 Gymnomystax
mexicanus Turpial lagunero 26.5 Chrysomus
icterocephalus Monjita cabeciamarilla ||27|| Reinitas y Chipes Parulidae 27.1 Setophaga
fusca Reinita gorginaranja ||28|| Cardenales Cardinalidae 28.1 Piranga
rubra Tangara veranera 28.2 Piranga
olivácea Tangara escarlata 28.3 Pheucticus
aureoventris Bababuy ||28|| Tangaras Thraupidae 29.1 Conirostrum
rufum Picocono rufo 29.2 Sicalis
flaveola Canario coronado 29.2 Catamenia
analis Semillero colifajado ||R|| Referencias
|
(Nota), las aves no están dibujadas en el mismo orden que en el índice.
1. Introducción
¿Son las ciencias naturales un área del conocimiento
humano donde lo único válido son los números y la interpretación lógica de los
datos? Tal vez esta sea una tendencia que se ha venido implementando en la
cultura popular desde la época de la revolución científica de corte newtoniano,
donde los modelos científicos comenzaron a verse como abstracciones matemáticas
del mundo natural, sin embargo, la realidad dista mucho de esta visión reduccionista
de la variedad de instrumentos a la mano de la ciencia, en otras palabras, las
ciencias usan las matemáticas como un instrumento poderoso de modelado de la
realidad, pero el arte también juega un papel fundamental para desarrollar
hipótesis.
La ilustración biológica es el uso de la
ilustración técnica para comunicar visualmente la estructura y los detalles
específicos de los sujetos biológicos de estudio. Esto se puede utilizar para
demostrar anatomía, explicar funciones o interacciones biológicas,
procedimientos quirúrgicos directos, distinguir especies y otras aplicaciones.
El alcance de la ilustración biológica puede variar desde el nivel del
organismo completo hasta el nivel microscópico.
1.1 Importancia histórica
Históricamente, las ilustraciones biológicas
se han utilizado desde el comienzo de la exploración del hombre y los intentos
de comprender el mundo que lo rodea. Las pinturas rupestres paleolíticas eran
tan detalladas que incluso podemos reconocer especies y razas de muchos de los
animales representados en la actualidad (Pruvost et al., 2011). Por ejemplo, en la cueva Chauvet-Pont-d'Arc (alrededor del 30.000
aC), se han identificado al menos 13 especies diferentes (Weil, n.d.). En una cueva prehistórica (alrededor del año 15.000 a. C.), hay
un dibujo de un mamut con un área oscura donde debería estar el corazón. Si
esta es realmente la intención de la ilustración, sería la primera ilustración
anatómica del mundo (Hajar, 2011).
Figura 1.1. Pinturas
rupestres de Chauvet (Francia)
Durante el Renacimiento, el artista y
científico Leonardo Da Vinci esbozó sus observaciones a partir de disecciones
humanas, así como sus estudios de plantas y el vuelo de las aves. A mediados
del siglo XVI, el médico Andreas Vesalius compiló y publicó De humani corporis fabrica, una colección
de libros de texto sobre anatomía humana superior a cualquier ilustración que
se hubiera producido hasta ese momento. A principios del siglo XVII, el
explorador Étienne de Flacourt documentó sus viajes a Madagascar e ilustró la
fauna única allí, sentando un precedente para los futuros exploradores a medida
que los viajes por el mundo se convirtieron en una realidad más factible.
Durante su viaje de cinco años a bordo del
HMS Beagle, Charles Darwin escribió e ilustró The Voyage of the Beagle, que se publicó en 1839 (Bates & MISSING-VALUE, 2018).
Figura 1.2. Fósiles de
mamíferos ilustrados por el propio Charles Darwin.
Figura 1.3. Lámina artística
de arácnidos dibujada a mano por Ernst Haeckel Kunstformen der Natur.
A principios del siglo XX, uno de los
ilustradores biológicos más prolíficos, Ernst Haeckel, descubrió, describió: y
nombró miles de nuevas especies, y su obra publicada, Kunstformen der Natur (Haeckel, 2015), contenía cientos
de impresiones de varios organismos, muchos de los cuales fueron descritos por
primera vez por el propio Haeckel.
1.2 ¿Las cámaras fotográficas
no pasaron a la ilustración al olvido?
Ahora que sabe qué es la ilustración científica,
quizás se pregunte por qué es tan importante. Tenemos cámaras que pueden tomar
fotografías instantáneamente en ultra HD 8K con filtros UV, etc, etc, entonces,
¿por qué necesitamos ilustraciones dibujadas con técnicas clásicas?
No todo se puede capturar con fotografías
o videos. A medida que los científicos profundizan en lo desconocido de
nanopartículas, especies extintas, procesos subcelulares y materia oscura,
nuestras cámaras pueden fallarnos. Un artista educado en el tema y que colabore
con profesionales e investigadores puede visualizar y dar vida a estos temas
para ayudar a otros a comprenderlos mejor.
La necesidad de artistas visuales
capacitados en ciencias aumenta a medida que la tecnología y la ciencia
avanzan. Ahora podemos percibir información y recopilar datos de procesos y objetos
a escalas extremadamente pequeñas y masivas sin poder verlos. Los artistas
pueden tomar estos datos y crear ilustraciones comprensibles para mostrar estos
objetos invisibles y crear una descripción de lo que los científicos aprenden
de los datos.
En todas las etapas de la comunicación
científica, desde el interés de la infancia por “dibujitos de animales” hasta
la educación secundaria, los profesionales y la investigación de frontera, los
ilustradores intervienen para traducir la información en materiales que se
adapten a las necesidades de las personas en todos los niveles de comprensión.
La capacidad de transformar y crear imágenes, gráficos y modelos atractivos que
brinden información precisa es una habilidad exclusiva del ilustrador científico
que ha permanecido como una constante de importancia crítica desde la edad de
la exploración.
1.3 La fotografía llegará a
reemplazar a la ilustración científica
La respuesta corta es no. La fotografía es
una herramienta maravillosa que se puede utilizar tanto con fines artísticos
como técnicos, pero no reemplazará el papel del artista científico o
ilustrador.
A medida que la tecnología se ha
desarrollado, el campo de la ilustración científica ha cambiado para satisfacer
las necesidades de científicos y educadores.
El arte científico sigue siendo esencial a
pesar de que la fotografía se está volviendo más avanzada. El papel del artista
científico ahora incluye con frecuencia la visualización de procesos microscópicos
o macroscópicos (a gran escala) y subcelulares que no se pueden fotografiar,
así como de reconstrucción paleontológica, y forense. Esto implica la hábil
fusión de diferentes pensamientos creativos, así como la comprensión científica
del tema para elaborar una descripción precisa del tema.
La tecnología utilizada para capturar imágenes
se ha vuelto impresionante y ahora se puede usar para fotografiar sujetos
grandes y pequeños, sin embargo, tiene sus restricciones. Los microscopios
electrónicos de barrido y otras tecnologías pueden producir imágenes de muestras
microscópicas hasta un cierto tamaño, pero aún existen límites en la capacidad
de fotografiar muestras a escala atómica. Los telescopios terrestres y
espaciales (como el telescopio espacial Hubble) se pueden utilizar para ver y
capturar imágenes de planetas distantes y objetos celestes. Sin embargo, como
muchos objetos en el espacio distante están fuera del alcance de nuestros
telescopios, y las misiones y los telescopios que enviamos al espacio exterior
tienen limitaciones en cuanto a su alcance, la calidad y el detalle de estas
fotografías e imágenes pueden carecer de información importante para la
divulgación, ya sea especializada o popular.
Aquí es donde el ilustrador interviene
para completar los espacios en blanco. Los artistas pueden ayudar a representar
tanto los objetos submicroscópicos demasiado pequeños para ser vistos por un
microscopio como los objetos masivos en el espacio distante que de otra manera
no podemos imaginar, así como organismos extintos que solo conocemos por sus
carcasas fósiles. Usando información científica y conocimiento artístico, el
ilustrador puede representar átomos y procesos atómicos en formas altamente
complejas o más simplificadas que capturan la información importante de cómo
están estructurados estos átomos. En el otro extremo del espectro de tamaños,
los artistas también pueden ayudar a crear imágenes de objetos celestes en el
espacio distante que nuestros telescopios y cámaras no pueden capturar. Esto
ayuda a llevar la ciencia y los datos a una forma tangible que ayuda tanto en
la comprensión como en el interés de estos temas. A pesar de sus diferencias
con una fría ecuación matemática, estas ilustraciones también gozan de un
estatus en el método científico denominado modelo
científico.
1.4 Haciendo la ciencia
accesible
Los ilustradores científicos trabajan con
el mismo objetivo que tienen muchos científicos: lograr un impacto en el mundo
haciendo que la ciencia sea accesible y ayudando al público a comprender los
nuevos descubrimientos e información científicos. La comunicación, la educación
y el desarrollo científico son algunos de los componentes clave hacia los que
trabajan los artistas en la educación científica.
Los ilustradores científicos son
esenciales para la comunicación de información científica debido a su capacidad
para traducir ideas en elementos visuales que se pueden utilizar para comunicar
información a una amplia gama de audiencias. El arte es importante para
compartir conceptos, detalles y temas complejos con el público de una manera
atractiva y fácil de entender.
Por esta razón, los libros de texto de
medicina y ciencia a menudo incluirán ilustraciones en lugar de fotografías
debido a esta ventaja que tiene el arte sobre la fotografía. A veces puede
resultar difícil comprender lo que se muestra en una fotografía, sobre todo si
se trata de sistemas corporales internos “todos son masas rojas o grises
malolientes sin etiquetas convenientes”. Las ilustraciones pueden representar
de manera realista la anatomía interna, pero también distinguir partes mediante
el uso de diferentes “colores didácticos” u otra manipulación artística para
ayudar a llamar la atención y proporcionar una mayor comprensión de una imagen.
Para la educación pública, la ilustración
científica es extremadamente importante. Proporciona una forma de compartir
ideas de una manera atractiva y educativa. Los artistas tienen la habilidad
necesaria para traducir la información científica en obras de arte accesibles y
comprensibles que pasan por alto términos y explicaciones científicas difíciles.
Se puede utilizar en carteles informativos, folletos y sitios web para
proporcionar una explicación de los temas. Un ejemplo es el siguiente póster,
que combina ilustraciones de la mosca linterna manchada con información
educativa para captar la atención del espectador y ayudarlo a aprender
información importante para ayudar a la comunidad.
Figura 1.4. Bichos malos: La
mosca linterna manchada, Ilustración y póster educativo de Kara Perilli.
Las obras de arte y los modelos se
utilizan a menudo en los museos de ciencia como parte de exhibiciones para
representar y describir temas a la audiencia. Las obras de arte pueden ir más
allá del complicado lenguaje científico que se usa a menudo para describir
temas y traducen la información en una imagen universal. A diferencia de leer
un artículo o mirar una fotografía, las obras de arte científicas pueden diseñarse
para incluir la información principal de una manera concisa que pueda
proporcionar información y adaptarse a audiencias de todos los diferentes
niveles de comprensión.
Por último, es importante tener en cuenta
que los ilustradores científicos a menudo desarrollan experiencia dentro de sus
especialidades, muchos con títulos avanzados o incluso doctorados (Ph.D.) en
medicina, biología y otros campos de estudio relacionados. Algunos ilustradores
se convierten en autores o coautores de artículos de revistas científicas
porque su trabajo contribuyó en gran medida a los descubrimientos. Los
ilustradores a menudo deben estudiar el tema con tal detalle que pueden hacer
descubrimientos que los científicos con los que colaboran pueden haber pasado
por alto. En general, está claro que los ilustradores científicos son una parte
indispensable de la comunidad científica.
1.5 Nuestro objetivo
Yo no soy un ilustrador profesional, pero entre todos iremos aprendiendo diversas técnicas para el dibujo de seres vivos de nuestro mundo, y en específico, de nuestro país.
Referencias
Albin, E. (1738). A Natural History of
Birds: Illustrated with Two Hundred and Five Copper Plates, Curiously Engraven
from the Life. And Exactly Colour’d by the Author Eleazar Albin. To which are
Added, Notes and Observations by W. Derham,... In Two Volumes.... (Vol. 1). W.
Innys and R. Manby.
Allende, L. M.,
Rubio, I., Ruíz-del-Valle, V., Guillén, J., Martínez-Laso, J., Lowy, E., …
Arnaiz-Villena, A. (2001). The old world sparrows (genus passer) phylogeography
and their relative abundance of nuclear mtDNA pseudogenes. Journal of Molecular
Evolution. https://doi.org/10.1007/s002390010202
Altshuler, D. L.
(2003). Flower color, hummingbird pollination, and habitat irradiance in four
neotropical forests1. Biotropica, 35(3), 344–355.
Arango, C.
(2014). Pellar Común (Vanellus chilensis). Retrieved March 28, 2018, from
http://www.icesi.edu.co/wiki_aves_colombia/tiki-index.php?page=Pellar+Común+-+Vanellus+chilensis
Auer, S. K.,
Bassar, R. D., Fontaine, J. J., & Martin, T. E. (2007). Breeding biology of
passerines in a subtropical montane forest in northwestern Argentina. Condor.
https://doi.org/10.1650/0010-5422(2007)109[321:BBOPIA]2.0.CO;2
Avery, M. L.,
& Cummings, J. L. (2004). Livestock depredations by black vultures and
golden eagles.
Baldassarre, G.
(2014). Ducks, geese, and swans of North America. JHU Press.
Banks, R. C.
(1978). Nomenclature of the Black-bellied Whistling-Duck. The Auk, 95(2),
348–352.
Bartram, W.
(2021). Travels through North and South Carolina. In Travels, Explorations and
Empires (pp. 141–160). Routledge.
Bates, M., &
MISSING-VALUE, M.-V. (2018). The Voyage of the Beagle. In Charles Darwin.
https://doi.org/10.4324/9781315081519-3
Bechstein, J. M.
(1793). Johann Lathams allgemeine Uebersicht der Vögel. In der kaiserlich
privilegirten Kunst-und Buchandlung AC Weigels und Schneiders.
Belles-Isles,
J.-C., & Picman, J. (1986). Nesting losses and nest site preferences in
House Wrens. The Condor, 88(4), 483–486.
BirdLife
International. (2016). Troglodytes aedon. Retrieved from
https://www.iucnredlist.org/species/103886826/111242743
BirdLife
International. (2019). Rock Dove. Retrieved September 24, 2022, from
https://www.iucnredlist.org/species/22690066/155493121
BirdLife
International. (2021). Eared Dove Zenaida auriculata. Retrieved January 22,
2021, from http://datazone.birdlife.org/species/factsheet/eared-dove-zenaida-auriculata/distribution
BirdLife
International. (2022). Neotropical Cormorant Nannopterum brasilianus. Retrieved
May 28, 2022, from http://datazone.birdlife.org/species/factsheet/22696773
Birds, F. A. P.
(n.d.). Sagittarius serpentarius.
Birdscolombia.
(2019). Rascón Bogotano/Bogota Rail/Rallus semiplumbeus. Retrieved from
https://birdscolombia.com/2019/06/01/rascon-bogotano-bogota-rail-rallus-semiplumbeus-e/#:~:text=The
Bogotá rail (Rallus semiplumbeus,is threatened by habitat loss.
Bochenski, Z.,
& Bochenski, Z. M. (2008). An Old World hummingbird from the Oligocene: a
new fossil from Polish Carpathians. Journal of Ornithology, 149(2), 211–216.
Bonaparte, C. L.
(1838). A geographical and comparative list of the birds of Europe and North
America. London.
Braun, E. L.,
& Kimball, R. T. (2021). Data types and the phylogeny of Neoaves. Birds, 2(1),
1–22.
Brewer, D.
(2010). Wrens, dippers and thrashers. Bloomsbury Publishing.
Brewer, D. E. K.
D. (2005). Family Troglodytidae (wrens). InHandbook of the Birds of the World, 10,
356–447.
Browning, M. R.
(1989). The correct name for the Olivaceous Cormorant," Maiague" of
Piso (1658). The Wilson Bulletin, 101(1), 101–106.
Buechley, E. R.,
& Sekercioglu, C. H. (2016). Vultures. Current Biology, 26(13), R560–R561.
Campbell, K. E.
(2002). A new species of late Pleistocene lapwing from Rancho La Brea,
California. Condor. https://doi.org/10.1093/condor/104.1.170
Campbell, M. O.
(2015). Vultures: Their Evolution, Ecology and Conservation. CRC Press.
Carvalho, L. R.
de, Farias, L. M., Nicoli, J. R., Silva, M. C. F., Corsino, A. T. S. M., Lima,
L. A. de, … Pinto, M. E. B. M. (2003). Dominant culturable bacterial microbiota
in the digestive tract of the American black vulture (Coragyps atratus
Bechstein 1793) and search for antagonistic substances. Brazilian Journal of
Microbiology, 34, 218–224.
Christidis, L.,
& Boles, W. (2008). Systematics and taxonomy of Australian birds. Csiro
Publishing.
Cisneros-Heredia,
D. F. (2006). Notes on breeding, behaviour and distribution of some birds in
Ecuador. BULLETIN-BRITISH ORNITHOLOGISTS CLUB, 126(2), 153.
Clements, J. F.
(2007). Clements checklist of birds of the world. Comstock Pub.
Associates/Cornell University Press.
Cornell Lab of
Ornithology. (2021a). Blue-winged Teal Life History. Retrieved September 26,
2021, from https://www.allaboutbirds.org/guide/Blue-winged_Teal/lifehistory
Cornell Lab of
Ornithology. (2021b). House Wren Life History.
Cornell University.
(2017). Cattle Egret. Retrieved March 20, 2018, from
https://www.allaboutbirds.org/guide/Cattle_Egret/lifehistory
Coulson, J. O.,
Rondeau, E., & Caravaca, M. (2018). Yellow-headed caracara and black
vulture cleaning baird’s tapir. Journal of Raptor Research, 52(1), 104–107.
Couve, E., &
Vidal-Ojeda, C. (2003). Aves de Patagonia, Tierra del Fuego y Península
Antártica. Fantástico Sur Birding.
Culzac-Wilson, L.
(2008). St. Vincent & the Grenadines. Important Bird Areas in the
Caribbean: Key Sites for Conservation. Bird-Life International, Cambridge,
UK.(BirdLife Conservation Series No. 15), 295–308.
Darwin, C.
(1866). On the Origins of Species by Means of Natural Selection or the
Preservation of Favored Races in the Struggle for Life (4th ed.). London: John
Murray.
del Hoyo, J.,
Elliot, A., & Christie, D. A. (2009). Handbook of the birds of the world,
vol. 10–14 Barcelona. Spain: Lynx Edicions.[Google Scholar].
Dickerman, R W.
(1989). Notes on Sturnella magna in South America with a description of a new
subspecies. Bulletin of the British Ornithologists’ Club, 109, 160–162.
Dickerman, Robert
W, & Phillips, A. R. (1970). Taxonomy of the Common Meadowlark (Sturnella
magna) in central and southern México and Caribbean Central America. Condor,
305–309.
Dlamini, S. T.
(2020). Documenting the alien birds in a high-altitude wetland adjacent to a
peri-urban development in Qwaqwa.
Dod, A. S.
(1992). Endangered and endemic birds of the Dominican Republic. Cypress House.
Donne-Goussé, C.,
Laudet, V., & Hänni, C. (2002). A molecular phylogeny of anseriformes based
on mitochondrial DNA analysis. Molecular Phylogenetics and Evolution, 23(3),
339–356.
EAAB, E. de A. y
A. de B. y A. de B. (2021). Aves de los humedales hurbanos de Bogotá. Bogotá
DC: Aguas de Bogotá.
Elliott, K. H.,
Ricklefs, R. E., Gaston, A. J., Hatch, S. A., Speakman, J. R., & Davoren,
G. K. (2013). High flight costs, but low dive costs, in auks support the
biomechanical hypothesis for flightlessness in penguins. Proceedings of the
National Academy of Sciences, 110(23), 9380–9384.
eNature. (2021).
Black-bellied Whistling-Duck Dendrocygna autumnalis. Retrieved September 14,
2021, from
https://web.archive.org/web/20140606204030/http://www.enature.com/fieldguides/detail.asp?recNum=BD0588
Eo, S. H.,
Bininda‐Emonds, O. R. P., & Carroll, J. P. (2009). A phylogenetic supertree
of the fowls (Galloanserae, Aves). Zoologica Scripta, 38(5), 465–481.
Ericson, P. G. P.
(2012). Evolution of terrestrial birds in three continents: biogeography and
parallel radiations. Journal of Biogeography, 39(5), 813–824.
Ericson, P. G.
P., Irestedt, M., & Johansson, U. S. (2003). Evolution, biogeography, and
patterns of diversification in passerine birds. Journal of Avian Biology.
https://doi.org/10.1034/j.1600-048X.2003.03121.x
Escobar Riomalo,
M. P., Gongora, E., & Arsitizabal Leost, S. (2017). Great Thrush (Turdus
fuscater). Neotropical Birds. https://doi.org/10.2173/nb.grethr1.01
Escobar Riomalo,
M. P., Gongora, E., & Arsitizabal Leost, S. (2020). Great Thrush (Turdus
fuscater). In Birds of the World. https://doi.org/10.2173/bow.grethr1.01
Eyton, T. C.
(1838). A monograph on the Anatidae or duck tribe. Longman, Orme, Brown, Green,
& Longman.
Feduccia, A.
(1999). The origin and evolution of birds. Yale University Press.
Fergus, C.
(2003). Wildlife of Virginia and Maryland and Washington, DC. Stackpole Books.
Ferguson-Lees,
J., & Christie, D. A. (2001). Raptors of the World. London: Christopher
Helm. 992 p.
Fisher, H. I.
(1944). The skulls of the cathartid vultures. The Condor, 46(6), 272–296.
Fjeldså, J.
(1993). The decline and probable extinction of the Colombian Grebe Podiceps
andinus. Bird Conservation International, 3(3), 221–234.
Fjeldså, Jon.
(1984). Three endangered South American grebes (Podiceps): case histories and
the ethics of saving species by human intervention. In Annales Zoologici
Fennici (pp. 411–416). JSTOR.
Floyd, T., Hess,
P., & Scott, G. (2008). Smithsonian field guide to the birds of North America.
Collins.
Foster, M. S.
(2007). The potential of fruit trees to enhance converted habitats for
migrating birds in southern Mexico. Bird Conservation International.
https://doi.org/10.1017/S0959270906000554
Fraser, I., &
Gray, J. (2019). Australian Bird Names: Origins and Meanings. CSIRO PUBLISHING.
Frisch, J. D.,
& Frisch, C. D. (2005). Aves brasileiras e plantas que as atraem. Dalgas
Ecoltec.
Galbraith, C. a,
Stroud, D. a, & (Eds). (2006). Waterbirds around the world. The Stationary
Office, Edinburgh, UK.
García-Alfonso,
M., van Overveld, T., Gangoso, L., Serrano, D., & Donázar, J. A. (2020).
Vultures and livestock: The where, when, and why of visits to farms. Animals, 10(11),
2127.
Garro Barrera, J.
D. (2017). Rehabilitación último tramo del malecón de Guatapé.
Gibbs, D.,
Barnes, E., & Cox, J. (2010). Pigeons and doves: A guide to the pigeons and
doves of the World. Soho Square. London, A&C Black Publisher Ltd.
Gibbs, J. P.
(1992). Podilymbus podiceps. Migratory Nongame Birds of Management Concern in
the Northeast, 31.
Gill, F., &
Donsker editors, D. (2017). IOC world
bird list (v 7.3). International Ornithologists’ Union.
Gill, F.,
Donsker, D., & Rasmussen, P. (2021). IOC world bird list. IOC.
Global Raptor
Information Network. (2022). Species account: Roadside Hawk Rupornis
magnirostris. Retrieved April 15, 2022, from
http://globalraptors.org/grin/SpeciesResults.asp?specID=8015
Gonzalez, J.,
Düttmann, H., & Wink, M. (2009). Phylogenetic relationships based on two
mitochondrial genes and hybridization patterns in Anatidae. Journal of Zoology,
279(3), 310–318.
Greenewalt, C. H.
(1990). Hummingbirds. Courier Corporation.
Greeney, H. F.,
& Nunnery, T. (2006). Notes on the breeding of north-west Ecuadorian birds.
BULLETIN-BRITISH ORNITHOLOGISTS CLUB, 126(1), 38.
Guayasamin, J.
M., Tapia, E., Aldás, S., & Deichmann, J. (2011). Anfibios y Reptiles de
los Tepuyes de la Cuenca Alta del Río Nangaritza, cordillera del Cóndor. Conservation
International (Eds.), Evaluación Ecológica Rápida de La Biodiversidad de Los Tepuyes
de La Cuenca Alta Del Río Nangaritza, Cordillera Del Cóndor, Ecuador.
Conservation International, Quito, 56–61.
Gutiérrez, T.,
Vázquez, J., & Ros, F. (2016). Caso de estudio para manejar ataques de
Rupornis magnirostris en una instalación escolar larense. Revista Del Colegio
de Médicos Veterinarios Del Estado Lara, 6(12), 1.
Haeckel, E.
(2015). 23. Kunstformen der Natur / Art forms of nature. In Form Follows Nature.
https://doi.org/10.1515/9783990437056-025
Hajar, R. (2011).
Medical illustration: art in medical education. Heart Views: The Official
Journal of the Gulf Heart Association, 12(2), 83.
Hertel, F.
(1995). Ecomorphological indicators of feeding behavior in recent and fossil
raptors. The Auk, 112(4), 890–903.
ITIS. (2021).
Turdus Linnaeus, 1758. Retrieved from
https://www.itis.gov/servlet/SingleRpt/SingleRpt?search_topic=TSN&search_value=179752#null
IUCM. (2016).
Chaetocercus mulsant. Retrieved from
https://www.iucnredlist.org/species/22688251/93189389
Jaramillo, S. M.
R. (2017). Forrajeo de Chactocercus mulsant sobre pequeños artrópodos,
Pasochoa-Ecuador. Boletín Técnico, Serie Zoológica, 13(12–13).
Johnsgard, P. A.
(2010). Ducks, Geese, and Swans of the World, Revised Edition [complete work].
Johnston, R. F. (1992).
Geographic size variation in rock pigeons, Columba livia. Italian Journal of
Zoology, 59(1), 111–116.
Kanaujia, A.,
& Kushwaha, S. (2013). Vulnerable Vultures of India: Population, Ecology
and Conservation. Rare Animals of India. Bentham Publication, 113–144.
Kennedy, M.,
& Spencer, H. G. (2014). Classification of the cormorants of the world. Molecular
Phylogenetics and Evolution, 79, 249–257.
Ksepka, D. T.,
Balanoff, A. M., Bell, M. A., & Houseman, M. D. (2013). Fossil grebes from
the T ruckee F ormation (M iocene) of N evada and a new phylogenetic analysis
of P odicipediformes (A ves). Palaeontology, 56(5), 1149–1169.
Lerner, H. R. L.,
Klaver, M. C., & Mindell, D. P. (2008). Molecular phylogenetics of the
Buteonine birds of prey (Accipitridae). The Auk, 125(2), 304–315.
Liddell, H. G.,
& Scott, R. (1961). A Greek-english lexicon.
Linnaei, C.
(1758). Systema Naturae (10th ed.). Stockholm.
Linnaeus, C. von.
(1758). Systema Naturae per regna tria naturae. Secundum classes, ordines,
genera, species, cum characteribus, differentiis, synonymis, locis. Editio, 1(10),
823.
Lyra-Neves, R. M.
de, Oliveira, M. A. B., Telino-Júnior, W. R., & Santos, E. M. dos. (2007).
Comportamentos interespecíficos entre Callithrix jacchus (Linnaeus)(Primates,
Callitrichidae) e algumas aves de Mata Atlântica, Pernambuco, Brasil. Revista
Brasileira de Zoologia, 24, 709–716.
Machado, C. G.
(1999). A composição dos bandos mistos de aves na Mata Atlântica da Serra de
Paranapiacaba, no sudeste brasileiro. Revista Brasileira de Biologia.
https://doi.org/10.1590/s0034-71081999000100010
Maglianesi, M.
A., Blüthgen, N., Böhning-Gaese, K., & Schleuning, M. (2014). Morphological
traits determine specialization and resource use in plant–hummingbird networks
in the neotropics. Ecology, 95(12), 3325–3334.
Mahmood, M. T.
(2015). Avian raptor evolution: a thesis presented in partial fulfilment of the
requirements for the degree of Doctor of Philosophy in Genetics, Institute of
Fundamental Sciences, Massey University, New Zealand. The Author.
Mayr, G. (2004).
Old World fossil record of modern-type hummingbirds. Science, 304(5672),
861–864.
Mayr, G. (2007).
New specimens of the early Oligocene Old World hummingbird Eurotrochilus
inexpectatus. Journal of Ornithology, 148(1), 105–111.
McDonald, H.
(2021). What’s the Difference Between Pigeons and Doves? | Mental Floss.
Retrieved January 22, 2021, from https://www.mentalfloss.com/article/554182/what-is-difference-between-pigeons-and-doves
McGuire, J. A.,
Witt, C. C., Remsen Jr, J. V, Corl, A., Rabosky, D. L., Altshuler, D. L., &
Dudley, R. (2014). Molecular phylogenetics and the diversification of
hummingbirds. Current Biology, 24(8), 910–916.
Mlíkovský, J.
(2002). Cenozoic birds of the world. Part 1. Europe.
Montaño, F. N.
(2016). Ave Vanellus chilensis.
Mullay, A. J.
(2011). The Helm Dictionary of Scientific Bird Names: From Aalge to Zusii (New
edition). Reference Reviews.
Muller-Schwarze,
D. (2006). Chemical ecology of vertebrates. Cambridge University Press.
Muller, M. J.,
& Storer, R. W. (1999). Pied-billed Grebe(Podilymbus podiceps). The Birds
of North America, (410), 32.
Navas, J. R.
(2002). Rálidos del mundo (Taylor: Rails. A guide to the rails, crakes,
gallinules and coots of the world). El Hornero, 17(02), 112–113.
O’Shea, B. J.,
Milensky, C. M., Claramunt, S., Schmidt, B. K., Gebhard, C. A., Schmitt, C. G.,
& Erskine, K. T. (2007). New records for Guyana, with descriptions of the
voice of Roraiman Nightjar (Caprimulgus whitelyi). Bulletin of the British
Ornithologists’ Club.
Ogada, D. L.,
Keesing, F., & Virani, M. Z. (2012). Dropping dead: causes and consequences
of vulture population declines worldwide. Annals of the New York Academy of
Sciences, 1249(1), 57–71.
Pereira, J. F. M.
(2008). Aves e pássaros comuns do Rio de Janeiro. Technical Books Editora.
Pereira, S. L.,
Johnson, K. P., Clayton, D. H., & Baker, A. J. (2007). Mitochondrial and
nuclear DNA sequences support a cretaceous origin of columbiformes and a
dispersal-driven radiation in the paleogene. Systematic Biology. https://doi.org/10.1080/10635150701549672
Perrins, C. M.
(2003). Firefly encyclopedia of birds. Firefly Books Limited.
Peters, J. L.
(1931). Check-list of birds of the world.
Peterson, R. T.
(1947). A Field Guide to the Birds: Eastern Land and Water Birds. Houghton.
Pruvost, M.,
Bellone, R., Benecke, N., Sandoval-Castellanos, E., Cieslak, M., Kuznetsova,
T., … Hofreiter, M. (2011). Genotypes of predomestic horses match phenotypes
painted in Paleolithic works of cave art. Proceedings of the National Academy of
Sciences, 108(46), 18626–18630.
Rafinesque, C. S.
(1815). Analyse de la nature, ou tableau de l’univers et des corps organisés.
Aux dépens de l’auteur.
Ranciaro, A.,
Campbell, M. C., Hirbo, J. B., Ko, W.-Y., Froment, A., Anagnostou, P., … Omar,
S. A. (2014). Genetic origins of lactase persistence and the spread of
pastoralism in Africa. The American Journal of Human Genetics, 94(4), 496–510.
Redacción el
Tiempo. (2015). Una tingua para homenajear a la fauna de Bogotá. El Tiempo.
Retrieved from https://www.eltiempo.com/archivo/documento/CMS-16383790
Reedman, R.
(2016). Lapwings, loons and lousy Jacks: The how and why of bird names. Pelagic
Publishing Ltd.
Rosselli, L., De
La Zerda, S., & Candil, J. (2017). Changes in the Avifauna of a Relict
Forest in the Peri-Urban Area of Bogota Throughout Fourteen Years. Acta
Biológica Colombiana, 22(2), 181–190.
Rubiano, L. G.
(2010). Gavilán Caminero (Rupornis magnirostris). Retrieved April 15, 2022,
from https://www.icesi.edu.co/wiki_aves_colombia/tiki-index.php?page=Gavilán+Caminero
Salthe, S. N.
(2013). Evolution, Convergent. In Encyclopedia of Sciences and Religions (pp.
798–803). Springer.
Sazima, I.
(2007). Unexpected cleaners: Black Vultures (Coragyps atratus) remove debris,
ticks, and peck at sores of capybaras (Hydrochoerus hydrochaeris), with an
overview of tick-removing birds in Brazil. Revista Brasileira de Ornitologia, 15(3),
417–426.
Schodde, R.,
& Mason, I. J. (1997). Aves (Columbidae to Coraciidae) (Vol. 2). CSIRO
PUBLISHING.
Sclater, P. L.
(1989). on some additional species of birds received in collections from Bogota.
Seibold, I.,
& Helbig, A. J. (1995). Evolutionary history of New and Old World vultures
inferred from nucleotide sequences of the mitochondrial cytochrome b gene. Philosophical
Transactions of the Royal Society B: Biological Sciences, 350(1332), 163–178.
Simpson, D. P.
(1977). Cassell’s Latin dictionary. Macmillan.
Steadman, D. W.
(2006). Extinction and biogeography of tropical Pacific birds. University of
Chicago Press.
Stiles, F. G.
(1981). Geographical aspects of bird-flower coevolution, with particular
reference to Central America. Annals of the Missouri Botanical Garden, 323–351.
Swainson, W.
(1836). On the natural history and classification of birds (Vol. 1). Longman.
Taylor, B., &
Sharpe, C. (2020). Rascón Bogotano/Bogota Rail/Rallus semiplumbeus. Retrieved
from https://birdsoftheworld.org/bow/species/bograi1/cur/introduction
Wang, X., Huang,
J., Hu, Y., Liu, X., Peteya, J., & Clarke, J. A. (2018). The earliest
evidence for a supraorbital salt gland in dinosaurs in new Early Cretaceous
ornithurines. Scientific Reports, 8(1), 1–12.
Weil, N. (n.d.).
Origins and Early Developments of Culture. Speaking of Culture.
Wendell, L.
(1977). The Pigeon. Sumter, SC. Levi Publishing Co, Inc.
Willughby, F.,
& Ray, J. (1676). Ornithologiae libri tres. (John Martyn, Ed.), Joannus
Martyn, London.
WorldBirdNames.org.
(2021). IOC World Bird List. Retrieved January 22, 2021, from
https://web.archive.org/web/20100717074221/http://www.worldbirdnames.org/n-sandgrouse.html
19.7. Tirano norteño
19.7.1. Taxonomía.
También conocido como el rey del este,
nombre científico (Tyrannus tyrannus),
es un ave perteneciente al clado o familia (Tyrannidae)
o simplemente los tiranos. Este clado recibe su nombre debido a que sus aves, a
pesar de ser extremadamente tiernas, tienen mal carácter y tienden a pelearse
entre sí, y con otros animales, incluso aves más grandes, por lo que son los
originales angrybirds. El clado de
los tiranos a su vez está contenido en un clado más grande, denominado orden (Passeriformes), que traduce, con forma
de gorrión, el cual es el clado más exitoso de las aves modernas, acumulando
más de la mitad de especies vivientes, por lo que sí, al dibujar aves deberá
acostumbrarse a dibujar muchos paserinos (Ericson, Irestedt, & Johansson,
2003).
Fue descrito por el naturalista sueco Carl
Linnaeus en 1758 en la décima edición de su Systema
Naturae bajo el nombre binomial de Lanius
tyrannus. El actual género Tyrannus
fue introducido en 1799 por el naturalista francés Bernard Germain de Lacépède
con el nombre trivial de pájaro rey oriental como especie tipo en norteamérica.
No presenta razas o subespecies (Foster, 2007).
Fig. 19.7.1. Tyrannus tyrannus.
19.7.2. Descripción.
Los adultos son de color gris negruzco en
las partes superiores con partes inferiores claras; tienen una cola larga y
negra con un extremo blanco y alas largas y puntiagudas. Tienen una mancha roja
en la coronilla, rara vez vista. Son de tamaño medio para un tirano, de 19 a 23
cm de largo, y de 33 a 38 cm de envergadura y pesan entre 33 y 55 g.
La llamada es un chirrido agudo, zumbante
y poco musical, a menudo comparado con una cerca eléctrica. Los tiranos de
dorso negro son conspicuos y se encuentran comúnmente en áreas abiertas con árboles
y arbustos dispersos, donde se posan mientras buscan insectos.
19.7.3. Distribución.
Es migratorio, con su área de reproducción
esparcida por América del Norte y su área de invernada en América Central y del
Sur.
19.7.4. Dieta.
Sobre todo, insectos y algunos frutos. Los
insectos conforman la mayor parte de la dieta en verano, lo que incluye
escarabajos, avispas, abejas, hormigas voladoras, saltamontes, moscas,
chicharritas y otros. En ocasiones se lo consideró un predador peligroso para
la población de abejas melíferas, pero no existen muchas pruebas al respecto.
También consume muchas bayas y frutos silvestres. La dieta durante el invierno
es poco conocida, pero consume una gran cantidad de bayas en los bosques
tropicales.
Busca su alimento observando desde una
posición elevada para luego levantar vuelo y capturar insectos. Puede capturar
presas en el aire o cernerse mientras toma su alimento (insectos, bayas) del
follaje. En clima frío, cuando hay pocos insectos voladores, puede alimentarse
en el suelo.
19.7.1. Reproducción.
Durante el cortejo, el macho sube y baja
en zigzag con un vuelo veloz, hace volteretas hacia atrás y otras acrobacias aéreas.
Durante estas exhibiciones, puede verse la mancha roja en las plumas de la coronilla,
que por lo general está oculta. Nido: suelen ubicarse en árboles caducifolios o
en arbustos grandes, a una altura de entre 2 y 9 metros, a veces a mayor o
menor altura. En ocasiones se sitúan sobre torres de alta tensión, en troncos secos,
en la parte superior de postes de cercos o en otros lugares extraños. El nido
(construido por la hembra, quizás con ayuda del macho) tiene la forma de un
amplio cuenco hecho con tallos de malezas, ramas pequeñas, hierbas y recubierto
con hierbas finas y, a veces, pelo de animales.
Pone 3 o 4, a veces entre 2 y 5 huevos. De
color blancuzco a rosa pálido, con muchas manchas de color marrón, lavanda y
gris. La hembra se ocupa de la mayoría o la totalidad del proceso de incubación,
que dura entre 16 y 18 días (en ocasiones quizá un poco menos).
Ambos padres llevan alimento a las crías.
Las crías comienzan a volar entre los 16 y 18 días de vida; los padres pueden
ocuparse de ellas durante más de un mes después de emplumecer.
19.7.6. Conservación.
Las investigaciones indican que existe una
disminución gradual en la población desde la década de 1960, si bien todavía es
una especie ampliamente expandida y común.
19.7.7. Hábitat.
Lindes de bosques, arboledas en orillas de
ríos, granjas, cortinas rompevientos, huertos y bordes de caminos. En el
verano, necesita espacio abierto para cazar y árboles para nidificar; su hábitat
varía desde claros en los bosques hasta pastizales abiertos con pocos árboles.
Su presencia es común en bordes de ciénagas, tierras de cultivo y praderas de
pastizales autóctonos. Pasa el invierno en bosques tropicales, en especial en
las lindes y a lo largo de los ríos.
25.1. Gorrión andino
25.1.1. Taxonomía.
También conocido como gorrión de cuello
rufo o gorrión andino, nombre científico (Zonotrichia
capensis), es un ave perteneciente al clado o familia (Passerellidae) que traduce como, los gorriones del nuevo mundo o
gorriones americanos. Son aves que comen semillas con picos cónicos, de color
marrón o gris, y muchas especies tienen patrones de cabeza distintivos. Aunque
comparten el nombre de gorrión, los gorriones del Nuevo Mundo están más
estrechamente relacionados con los empavesados del Viejo Mundo que con los
gorriones del Viejo Mundo (familia Passeridae)
(Allende et al., 2001). Los gorriones del Nuevo Mundo también son similares en apariencia
y hábito a los pinzones, con los que a veces solían ser clasificados. El clado
de los gorriones del nuevo mundo a su vez está contenido en un clado más
grande, denominado orden (Passeriformes),
que traduce, con forma de gorrión, el cual es el clado más exitoso de las aves
modernas, acumulando más de la mitad de especies vivientes (Ericson et al., 2003).
Figura 25.7.2. Zonotrichia
capensis.
Difícilmente se confunden con otras
especies, los adultos se reconocen fácilmente por cabeza gris con listas negras
y collar rufo. Se reconocen 25 subespecies de las cuales dos se encuentran en
Colombia: Z. c. costaricensis y Z. c. roraimae.
25.1.2. Descripción
El gorrión de cuello rufo mide entre 13,5
y 15 cm de largo y pesa entre 20 y 25 g. El adulto tiene un pico gris regordete
y una cabeza gris con franjas negras anchas en los lados de la coronilla y
franjas más delgadas a través del ojo y debajo de las mejillas. Los lados de la
nuca y el pecho son rojizos, y las partes superiores son de color marrón beige
con rayas negras. Hay dos barras laterales blancas. La garganta es blanca y las
partes inferiores blanquecinas, tornándose marrones en los flancos y con una
mancha negra en el pecho.
Los pájaros jóvenes tienen un patrón de
cabeza más apagado e indistinto, con rayas marrones y un color de fondo beige.
Carecen del cuello rojizo y tienen partes inferiores rayadas.
Hay entre 25 y 29 subespecies. En general,
las formas más pequeñas ocurren en las montañas costeras, las aves intermedias
en los Andes y las formas grandes y más oscuras se reproducen en los tepuyes.
Figura 25.7.2. Los tepuyes son
ecosistemas representativos del Escudo Guyanés en Suramérica, el cual cubre
parte de países como Colombia, Venezuela, Brasil y principalmente Las Guayanas.
Se trata de islas biológicas en tierra, donde el aislamiento generado por la
roca montañosa provoca que se comporten como laboratorios naturales evolutivos.
El nombre de este tipo de montañas proviene lengua pemón, propia del pueblo indígena
pemón que habitan en Venezula, en la frontera con Guyana y Brasil (Guayasamin, Tapia, Aldás, & Deichmann, 2011).
La más grande de las subespecies de tepuy,
Z. c. perezchincillae, tiene partes
inferiores grises y el cuello rojizo se extiende como una banda negra de pecas
a lo largo del pecho. Esta forma podría
ser separable como una especie distinta, o podría ser simplemente una población
particularmente distinta debido a los efectos de cuellos de botella genéticos
generados por el aislamiento geográfico como predecía Charles Darwin.
25.1.3. Distribución
En la parte norte y oeste de su área de
distribución (Fig. 8),
esta ave generalmente abundante se encuentra típicamente en altitudes de 600-4.000
metros, pero en la parte sur y este se encuentra comúnmente hasta cerca del
nivel del mar. Se puede ver en prácticamente cualquier hábitat abierto o
semiabierto, incluidos cultivos, jardines, parques, pastizales y arbustos
secundarios o cerrado. Se adapta bien a los entornos urbanos y suburbanos, pero
está ausente en las secciones densamente boscosas de la cuenca del Amazonas. También
es escasa en el escudo de Guayana, y se encuentra principalmente en algunos
tepuyes y en las montañas Pakaraima de Guyana (O’Shea et
al., 2007).
Explicar la presencia de esta especie en
la isla de La Española y su ausencia en el resto del Caribe, puede ser una teoría
similar a la propuesta para el pico cruzado de La Hispaniola (Loxia megaplaga), un ave simpátrica. En
ese escenario, los antepasados de las aves estuvieron presentes en toda la
región durante los climas mucho más fríos del último período glacial, pero
quedaron abandonados en las montañas más altas de La Española (las más altas
del Caribe) una vez que comenzó el calentamiento global al finalizar la última
edad del hielo (Dod, 1992).
Figura 25.7.3. Distribución de Zonotrichia capensis.
25.1.4. Dieta
El gorrión de cuello rojizo se alimenta en
el suelo de semillas, granos caídos, insectos y arañas. A veces se une a bandadas
de alimentación de especies mixtas y se ha observado que recoge termitas de las
telarañas (Machado, 1999). Suele verse en parejas que ocupan pequeños territorios o en pequeñas
bandadas.
25.1.5. Reproducción
La temporada de reproducción está limitada
por la disponibilidad de alimentos y, en última instancia, por las lluvias. En
los yungas subtropicales del noroeste de Argentina, las hembras comienzan a
construir nidos a fines de octubre, cuando llega la temporada de lluvias, pero
a principios de diciembre la mayor parte de la actividad de anidación ya ha
terminado.
Figura 25.7.4. El ecosistema de
los Yungas situada en una estrecha franja del noreste al sur de Bolivia-norte
de Argentina y se caracteriza por ser una zona húmeda, con nieblas constantes y
precipitaciones abundantes, además de contener una mezcla de verdes laderas,
precipicios, ríos, cascadas y una exuberante vegetación, se sitúan en la bajada
de la cordillera oriental de los Andes hacia la cuenca amazónica con una
Altitud que varía entre los 600 y los 2500 metros sobre el nivel del mar. Es
una de las ecorregiones más ricas del país al contener gran cantidad de
especies animales y vegetales. En los cálidos valles de Los Yungas bolivianos
es frecuente que se labren terrazas (tacanas) o bancales para el cultivo de
coca, café, caña de azúcar, cacao, bananas, papayas, lacayotes, lúcumas,
amaranto, achupallas o bromelias, maíz etc.
Por el contrario, a 2000 m en los Andes de
la provincia de Pichincha (Ecuador), los huevos se incuban en diciembre y la
actividad de construcción de nidos se registró en marzo y abril, lo que sugiere
una reproducción prolongada durante la temporada de lluvias. El nido de copa
abierta consiste en material vegetal revestido con hierbas finas. Se construye
con vegetación enmarañada en el suelo, bajo en un árbol o arbusto, o en un
nicho en una pared, tal vez a 2 m de altura en el mejor de los casos, pero
generalmente a menos de 0,5 m sobre el suelo (Auer, Bassar, Fontaine, &
Martin, 2007; Greeney & Nunnery, 2006).
Figura 25.7.5. Molothrus bonariensis, el parasitismo de
cría interespecífico en aves es una estrategia reproductiva en la que un
individuo de una especie (el parásito), deposita sus huevos en nidos de otro
individuo de otra especie (el hospedador) que se encarga de la incubación de
los huevos y de la alimentación de los pichones del parásito.
La hembra pone dos o tres huevos de color
azul verdoso pálido con manchas de color marrón rojizo. Los huevos miden
aproximadamente 19 a 21 mm por 15 a 16 mm y pesan 2,6 a 2,8 g cada uno. Son
incubados por la hembra durante 12 a 14 días, durante los cuales pasa
aproximadamente dos tercios del día incubando o asiste al nido de alguna otra
manera. Sin embargo, el macho ayuda a alimentar a los polluelos, que permanecen
en el nido unas dos semanas más. No son muy voraces, e incluso cuando se
acercan a emplumar, los padres solo los alimentan cada 10 minutos
aproximadamente. Sus susceptibles a especies parásitas de crianza por el tordo
brillante (Molothrus bonariensis), y
el fracaso reproductivo debido a la depredación es muy frecuente durante el período
de incubación (Auer et al., 2007; Greeney &
Nunnery, 2006).
25.1.6. Conservación
Domesticado y accesible, es común en toda
su amplia distribución y no se considera amenazado por la UICN “International Union for Conservation of Nature”.
4.2. Paloma abuelita
4.2.1. Taxonomía.
También conocida como la paloma orejona,
nombre científico (Zenaida auriculata)
es una paloma del Nuevo Mundo.
Figura 4.2.1. Zenaida auriculata.
Las palomas son un grupo mayoritariamente
monofilético de aves, su clado o agrupación recibe el nombre científico de Columbidae. Estas son aves de cuerpo
robusto con cuellos cortos y picos cortos y delgados que en algunas especies
presentan ceres carnosos, el ceres es una estructura cerosa que cubre
la base de su pico. Esta estructura normalmente contiene las fosas nasales. En
inglés, las especies más pequeñas tienden a llamarse "doves" y las más grandes "pigeons" (McDonald, 2021). Sin embargo, la distinción no es coherente) y no existe en la mayoría de los demás idiomas, en español, por
ejemplo, todas son palomas. Las palomas son uno de los grupos más diversos y
antiguos después de los gorriones, y aparecieron evolutivamente en el cretáceo,
la última era de los dinosaurios(S. L. Pereira, Johnson, Clayton,
& Baker, 2007). La familia se encuentra en todo el mundo, pero
la mayor variedad se encuentra en los reinos de Indonesia y Australasia. La
familia contiene 344 especies divididas en 50 géneros. Trece de las especies
están extintas (Schodde & Mason, 1997).
Figura 4.2.2. Zenaida aurita
El género “Zenaida” son aves que se encuentran en américa, de allí que reciben
el nombre de palomas del nuevo mundo, el género fue introducido en 1838 por el
naturalista francés Charles Lucien Bonaparte (Bonaparte, 1838).
El nombre conmemora a su esposa, Zénaïde Laetitia Julie Bonaparte,
sobrina de Napoleón Bonaparte. La primera especie descrita en el género fue la
paloma Zenaida aurita. Actualmente se
reconocen 11 subespecies (WorldBirdNames.org, 2021): Zenaida auriculata
antioquiae Chapman, 1917; Zenaida
auriculata auriculata Des Murs, 1847; Zenaida
auriculata caucae Chapman, 1922; Zenaida
auriculata hypoleuca Bonaparte, 1855; Zenaida
auriculata jessieae Ridgway, 1888; Zenaida
auriculata marajoensis Berlepsch, 1913; Zenaida
auriculata noronha Sharpe, 1890; Zenaida
auriculata rubripes Lawrence, 1885; Zenaida
auriculata ruficauda Bonaparte, 1855; Zenaida
auriculata vinaceorufa Ridgway, 1884; Zenaida
auriculata virgata Bertoni, W., 1901.
Figura 4.2.3. Área
de distribución de Zenaida auriculata (BirdLife International, 2021).
4.2.2. Descripción
La abuelita mide 24 cm de largo con una
cola larga en forma de cuña y pesa normalmente alrededor de 112 g. Los machos
adultos tienen principalmente el plumaje de la parte superior de color marrón
oliva, con manchas negras en las alas. La cabeza tiene una corona gris, una línea
negra detrás del ojo y un negro azulado en las coberteras auriculares
inferiores. Estas marcas negras le dan a la especie sus nombres. Las partes inferiores
son vinosas y la cola tiene punta de canela. El pico es negro y las patas de
color rojo oscuro. La hembra es más apagada que el macho, y las aves inmaduras
son de color marrón grisáceo, muy apagadas, con barrado pálido. El llamado de
la especie es un profundo y suave.
4.2.3. Distribución
La abuelita se distribuye desde Colombia
hasta el cono sur en Chile y Argentina, de hecho, habita en toda américa
exceptuando la selva amazónica y el tapón del Darién en el Chocó Colombiano.
El ave es nativa en toda su área de
distribución. Es común en sabanas y otras áreas abiertas, incluido cultivos y
pareas urbanas, casi en todos los espacios públicos de grandes ciudades como en
Bogotá, Colombia.
4.2.4. Dieta
Las abuelitas se alimentan principalmente
de semillas extraídas del suelo. Pueden ser plagas agrícolas. Es un ave
gregaria cuando no se alimenta y forman bandadas, especialmente en el momento
de la migración o en los refugios comunales.
4.2.5. Reproducción
Tiene una exhibición de cría con una
subida empinada y deslizamiento semicircular hasta su posición original.
Construye un nido de palitos a varios metros de altura en un árbol y pone dos
huevos blancos. Estos eclosionan en 12 a 14 días con otros 9 días para
emplumar. No se observa una temporada de reproducción fija en la mayor parte de
su área de distribución y, si se les proporciona abundante alimento y hábitat,
las aves se reproducen casi continuamente, lo que favorece su gran
adaptabilidad y grandes números, lo cual nos lleva a su característica especial
(Cisneros-Heredia, 2006).
4.2.6. Conservación
Se cree que más de 23 millones de estas
palomas se encuentran en los campos alrededor de Córdoba en el norte de
Argentina, y estimaciones recientes sitúan la cifra en el rango de los 32
millones. No es raro que un solo cazador pueda disparar 1000 pájaros en un día,
a pesar de esto, la abuelita parece ser una especie particularmente resistente
a la extinción por caza excesiva. De hecho, al igual que ocurre con las palomas
migratorias, las poblaciones de abuelitas en Argentina y Bolivia a veces
"oscurecen los cielos". Por lo tanto, las poblaciones de las fincas
deportivas de Argentina parecen mantenerse firmes, con las aves que se
reproducen cuatro veces al año y prosperan en las vastas áreas de grano,
algunas cultivadas para su beneficio, la mayoría en granjas comerciales, que
están felices de controlar las poblaciones de estas voraces comedoras de granos
de cultivo. Docenas de albergues de lujo se especializan en la caza de palomas,
y la temporada se extiende durante todo el año (Couve & Vidal-Ojeda, 2003).
Más al norte, en Bolivia, alrededor de la
región del Gran Chaco, cerca de las inmensas plantaciones de soja y sorgo
alrededor de Santa Cruz de la Sierra, la caza de palomas es más estacional, va
de mayo a septiembre, con grandes bandadas que llegan desde Argentina para
asaltar los cultivos de cereales. Los lugareños atestiguan que estas aves
llamadas allí como totakys, eran
bastante raras en la región hace solo unas décadas, un testimonio no solo de la
resistencia de la especie, sino también del enorme impacto que tienen los
grandes cultivos industrializados en la prevalencia de las especies de animales
en nuestro continente (Couve & Vidal-Ojeda, 2003).
22.1. Mirla
22.1.1. Taxonomía.
La paraulata morera, mirla patinaranja, o mirla (Turdus fuscater) es una especie de ave paseriforme sudamericana de la familia del género Turdus y a la familia (Turdidae). Los turdidos son una familia de aves paseriformes que comprende trescientas especies distribuidas casi por todo el mundo. Sus miembros, denominados comúnmente zorzales, mirlos o tordos, son pájaros de tamaño medio, en su mayoría forestales, y principalmente insectívoros. La mayoría son aves sedentarias, aunque algunas son migratorias. Turdus es un género de aves paseriformes perteneciente a la familia Turdidae (ITIS, 2021). Sus miembros suelen denominarse con el nombre común de zorzal o tordo, aunque a toda especie en la cual el plumaje del macho adulto sea negro suele denominarse mirlo. Además, el nombre de tordo o zorzal también se aplica a otros miembros de la familia Turdidae y aves de aspecto similar. Representantes típicos del género son el zorzal común (Turdus philomelos), mirlo común (Turdus merula), el zorzal real (Turdus pilaris), el mirlo capiblanco (Turdus torquatus) y el yigüirro (Turdus grayi).
Figura 22.1.1 Turdus fuscater.
Se reconocen siete subespecies: T. f. fuscater se puede encontrar en el
oeste de Bolivia. T. f. cacozelus se
puede encontrar en la cordillera de Santa Marta en Colombia. T. f. clarus habita la frontera entre
Venezuela y Colombia, en la Sierra del Muerto. T. f. quindio, esta subespecie se encuentra en el sur de Colombia y
el norte de Ecuador. T. f. gigas es
originaria de la Cordillera de los Andes de Venezuela y Colombia. T. f. gigantodes se puede encontrar
desde Ecuador hasta el centro sur de Perú. T.
f. ockendeni se puede encontrar en el sureste de Brasil (Escobar Riomalo, Gongora, &
Arsitizabal Leost, 2017, 2020).
22.1.2. Descripción
Los adultos miden de 28 a 33 cm de largo y
pesan de 128 a 175 g, lo que convierte a la especie en el tordo más grande. Se
puede identificar fácilmente por su pico y patas de color naranja amarillento y
un anillo amarillo alrededor del ojo. A veces se presenta un ligero dimorfismo
sexual, y los machos tienen patas y anillos oculares de colores más intensos.
Las plumas de la cola son largas. El plumaje es negro-marrón, más oscuro en las
alas y la cola y pálido en el vientre. Los juveniles son predominantemente de
color gris verdoso con un vientre pálido y algunas manchas de color beige en la
cabeza y las alas. La variedad muestra sutiles diferencias de coloración, con T. f. ockendeni siendo el más oscuro,
seguido de T. f. quindio y T. f. gigantodes. Las subespecies más pálidas
son T. f. gigas T. f. cacozelus y T. f.
fuscater. Se sabe que existen especímenes albiunos, pero son muy raros (Escobar Riomalo et al., 2017, 2020).
22.1.3. Distribución
La especie es un ave típica del altiplano
andino. Su área de distribución cubre los Andes occidentales y septentrionales
de Venezuela hasta Lara y Trujillo, los Andes de Colombia, Ecuador, Perú y
finalmente el noroeste de Bolivia. Ocurre en altitudes de 1800-4000 metros.
El gran zorzal o mirla hace uso de una
variedad de hábitats, incluidos bosques abiertos, patios traseros, parques e
incluso tierras de cultivo con árboles dispersos o restos de bosques. También
ocurre en los bordes de diferentes clases de bosques andinos, incluidos los
bosques húmedos montanos, secundarios y templados. Es más probable que se
encuentre en altitudes superiores a los 2000 m. La especie tiende a evitar las
condiciones secas y las áreas densamente boscosas, pero a veces se encuentra en
los bordes del páramo andino o matorrales. Habita habitualmente en hábitats
urbanos en las tierras altas, p. Ej. en Quito y Bogotá. Las poblaciones son
generalmente sedentarias.
22.1.4. Dieta
El zorzal común es un alimentador
generalista, principalmente busca frutas y bayas, pero también captura
invertebrados e incluso roba huevos y polluelos. Tiende a tragar frutas
enteras. Generalmente se alimenta a nivel del suelo, preferentemente en la
hierba corta, pero también visita árboles frutales y arbustos. Los picos de
actividad son al amanecer y al anochecer.
22.1.5. Reproducción
Los adultos se vuelven muy territoriales
en la temporada de reproducción, pero pueden formar grupos de hasta 40
individuos en otras épocas del año. Es probable que estos grupos formen una
percha comunal en los árboles hasta que llegue la próxima temporada de reproducción.
La reproducción ocurre en diferentes épocas
del año dependiendo de la localidad: marzo-abril en Venezuela, enero-agosto en
Colombia y Ecuador, en octubre, febrero y junio en Perú. El nido es
comparativamente grande y tiene forma de copa, está hecho de pequeñas ramitas,
hojas, pasto y barro, y se coloca en lo alto de los árboles o arbustos. La
hembra pone dos huevos de color azul verdoso pálido con manchas rojizas, con un
tamaño medio de 2 cm.
22.1.6. Conservación
La mirla es común en una variedad de hábitats
a lo largo de su área de distribución y ha sido clasificado como vulnerable por
la UICN “International Union for
Conservation of Nature”. En apariencia se adapta fácilmente a las
perturbaciones antropogénicas y puede aprovechar las áreas urbanas o agrícolas
deforestadas.
26.1. Chirlobirlo
26.1.1. Taxonomía.
Turpial oriental, carmelo, zacatero común,
pradero común, cantor de pradera o chirlobirlo (nombre científico Sturnella magna) es una especie de ave
paseriforme de la familia Icteridae
que vive en América. Se trata de un pájaro de tamaño medio y de aspecto muy
similar al turpial gorjeador.
Esta especie fue descrita por primera vez
por Carl Linnaeus en su décima edición de 1758 de Systema Naturae como Alauda
magna, aunque es esa oportunidad Lineo confundió al menos tres especies
semejantes.
Figura 26.1.1. Sturnella magna.
Ciertas aves africanas llamadas bisbitas o
género Macronyx, como la bisbita del
cabo (M. capensis) y la bisbita
garganta amarilla (M. croceus)
comparten ecosistemas semejantes, comportamientos y formas semejantes, pero
ciertas estructuras internas indican que los dos géneros no tienen un
parentesco cercano, lo que indica que se trata de un caso de evolución paralela.
Linneo reconoció su error menos de una década
después, separando a las bisbitas de estos estorninos. El nombre científico Sturnella magna en latín significa, de
manera bastante confusa, "estornino grande y pequeño", el nombre genérico
se le ha dado debido a que el comportamiento de las alondras es similar a los
estorninos.
El género Sturnella son aves de pastizales de América del Norte llamadas
alondras. El género fue previamente agrupado con las alondras sudamericanas
ahora ubicadas en el género Leistes.
Incluye dos o tres especies de aves de pastizales en gran parte insectívoras.
En todas las especies, el macho tiene al menos un dorso negro o marrón y partes
inferiores muy amarillas.
A su vez, el género Sturnella se encuentra incluído en el gran clado de las aves peseriformes
( Passeriformes)
que relaciona a las aves relacionadas con el gorrión común, siendo este el
clado de aves modernas más exitoso, agrupando la mayor cantidad de especies e
individuos.
En Colombia se reconocen 3 subespecies: S. m. meridionalis, S. m. paralios y S. m.
praticola.
26.1.2. Descripción
Mide entre 21,4 y 22,5 cm de longitud y
pesa en promedio 85 g. Los adultos tienen las partes inferiores de color
amarillo con una "V" negra en el pecho y con flancos blancos con
rayas negras. La parte superior es principalmente de color castaño
con rayas negras. Tienen un pico puntiagudo. La cabeza presenta franjas de
delante hacia atrás, alternando el negro con colores claros, como el blanco, amarillento
y el castaño claro (Dickerman, 1989;
Dickerman & Phillips, 1970).
26.1.3. Distribución
En Colombia se encuentra desde la Sierra
Nevada de Santa Marta (hasta 2700 m) hasta la base oeste de la Cordillera
Oriental cerca de Aguachica. Desde tierras altas de la Cordillera Oriental sur
hasta las cabeceras del Valle del Magdalena en San Agustín. También se
encuentra en la vertiente este de la Cordillera Central en el parque nacional
natural Puracé, este de los Andes sur hasta el sur del Meta. Se encuentra
además en el este hasta Venezuela, Guayanas y norte de Brasil. Se ha reportado
en la cordillera Oriental hasta los 3500 metros.
Figura 26.1.2. Distribución mundial de Sturnella magna.
En Colombia es residente común en dehesas
y sabanas húmedas desde paramo bajo y la transición entre este y el límites de
vegetación arbórea hacia abajo. Habita en pastizales húmedos, prados, campos de
alfalfa (Medicago), campos de heno y tierras agrícolas.
En el mundo esta especie alcanza las
regiones del sur de Canadá oriental, El oriente de Estados Unidos, Méjico,
algunas zonas de América Central, en Sudamérica desde el occidente de Colombia,
Venezuela, las Guayanas y el norte de Brasil.
26.1.4. Dieta
Busca alimento en el suelo o en la
vegetación baja, a veces sondeando con su pico. Se alimenta principalmente de
insectos (Orthoptera, Lepidoptera y Coleoptera), arañas y lombrices de tierra. Ocasionalmente se ha
reportado que se alimentan de lagartos, carroña de pequeños mamíferos y aves
muertos en carretera. Adicionalmente puede consumir semillas y bayas.
26.1.5. Reproducción
Se ha reportado que la época reproductiva
en Estados unidos comprende los meses de Abril-Agosto y en Cuba entre los meses
de Enero-Julio. Exhiben una estrategia reproductiva mixta, pueden ser monógamos
o polígamos. Anidan solitarios. La hembra se encarga de construir el nido, el
cual es construido en el suelo sobre depresiones superficiales. El nido es un
domo que es construido utilizando pasto seco, tallos de hierbas e incluso
corteza de árboles. El nido suele estar adherido a la vegetación, bien oculto
en sitios en donde la hierba es densa y alta. El número de huevos por nido es
de 3-7, los cuales son blancos con manchas marrones sobre toda la superficie,
sus dimensiones son 27.8 x 20.4 mm. La incubación es hecha solo por la hembra
durante un periodo de 13-14 días. La alimentación de los polluelos es hecha
principalmente por la hembra ya que el macho es menos constante. Los polluelos
permanecen en el nido por un periodo de 10-12 días, fuera del nido los
parentales los cuidan por aproximadamente 2 semanas.
26.1.6. Conservación
Su estado de preocupación es menor.
9.1. Alcaraván
9.1.1. Taxonomía.
El tero, también conocido como avefría
tero, traile, queltehue o alcaraván, avefría austral entre otros nombres. Vanellus
chilensis es un ave limícola del orden Charadriiformes. Las limícolas,
aves zancudas o aves playeras son aves del orden Charadriiformes que se
encuentran comúnmente a lo largo de las costas y marismas que vadean para
buscar alimento (como insectos o crustáceos) en el lodo o la arena. El término
"ave zancuda" se usa en Europa, mientras que "ave playera"
se usa en América del Norte, donde "ave zancuda" se puede usar en su
lugar para referirse a aves de patas largas como cigüeñas y garzas.
Hay alrededor de 210 (Galbraith, Stroud, & (Eds),
2006)
especies de limícolas, la mayoría de las cuales viven en humedales
o ambientes costeros. Muchas especies de las regiones árticas y templadas son
fuertemente migratorias, pero las aves tropicales a menudo son residentes o se
mueven solo en respuesta a los patrones de lluvia. Algunas de las especies del Ártico,
como el pequeño stint (Calidris minuta), se encuentran entre los
migrantes de mayor distancia, y pasan la temporada de no reproducción en el
hemisferio sur.
Muchas de las especies más pequeñas que se
encuentran en los hábitats costeros, en particular, pero no exclusivamente, los
calidridos, a menudo se denominan "playeros", pero este término no
tiene un significado estricto, ya que el playerito de montaña es una especie de
pastizal.
Debido a que la mayoría de estas especies
pasan gran parte de su tiempo cerca de cuerpos de agua, muchas tienen patas
largas adecuadas para vadear (de ahí el nombre de "limícolas o zancúdas").
Algunas especies prefieren lugares con rocas o barro. Muchas aves playeras
muestran patrones migratorios y a menudo migran antes de la temporada de
reproducción. Estos comportamientos explican las largas longitudes de las alas
que se observan en las especies y también pueden explicar los metabolismos
eficientes que dan energía a las aves durante las migraciones largas.
Figira. 9.1.1. Vonellus
chilensis.
9.1.2. Descripción
Vanellus chilensis es
la única ave zancuda con cresta en América del Sur. Mide de 32 a 38 cm (13 a 15
pulgadas) de largo y pesa aproximadamente de 250 a 425 g (8,8 a 15,0 oz). Las
partes superiores son principalmente de color gris pardusco, con un brillo
bronceado en los hombros. La cabeza es particularmente llamativa;
principalmente gris con un parche negro en la frente y la garganta que se
extiende hasta el pecho negro. Un borde blanco separa el negro de la cara del
gris de la cabeza y la cresta. El resto de las partes inferiores es de color
blanco y el anillo del ojo, las patas y la mayor parte del pico son de color
rosa. Está equipado con extensiones de huesos rojos debajo de las alas
(espuelas), que se utilizan para intimidar a los enemigos y luchar contra las
aves de presa.
Durante su vuelo de aleteo lento, Vanellus
chilensis del sur muestra una amplia barra de ala blanca que separa
el color marrón grisáceo de la espalda y las coberteras del ala de las plumas
de vuelo negras. La rabadilla es blanca y la cola negra. La llamada es un
keek-keek-keek muy fuerte y áspero.
Hay tres o cuatro subespecies, que
difieren ligeramente en la coloración de la cabeza y la voz. Vanellus
chilensis fretensis de la Patagonia a veces se incluye en la
subespecie nominal Vanellus chilensis chilensis. La subespecie del
norte — Vanellus chilensis. cayennensis del norte y Vanellus chilensis lampronotus
del sur del río Amazonas, a veces se separan como una especie distinta, Vanellus
cayennensis. Estas dos subespecies tienen una cabeza más marrón,
particularmente las aves más al norte, y la banda blanca de la cara (ancha en
el norte y angosta en el sur) no llega al centro de la corona.
9.1.3. Registro fósil
En tiempos prehistóricos, la especie
parece haber estado más extendida. Los huesos del tero del Pleistoceno tardío
de Florida se describieron inicialmente como Dorypaltus prosphatus,
pero desde entonces se han considerado indistinguibles del tero del sur moderno,
excepto por ser más pequeños. Aunque es posible que no sean específicamente
distintas, la falta de presencia de estas aves fuera de América del Sur de
manera regular hoy en día sugiere que pueden ser mejor consideradas una
paleosubespecie Vanellus chilensis prosphatus. Esta habría
desaparecido cuando terminó la última edad de hielo, pero la biogeografía
sugiere que la especie también debe haber ocurrido en América Central y / o el
Caribe. La especie prehistórica completamente extinta Vanellus
downsi
está estrechamente relacionada con el tero del sur que se encuentra en
California; sus restos se han encontrado en La Brea Tar Pits (las
trampas de brea) en Los Ángeles. Separada por las Montañas Rocosas, Vanellus
downsi
es un antepasado poco probable del tero del sur moderno, pero ciertamente es
posible que fuera una especie hermana del noroeste (Campbell, 2002).
9.1.4. Distribución
Habita en pastizales de áreas abiertas,
praderas húmedas y en áreas pantanosas con vegetación enmarañada de baja
altura. Generalmente se le encuentra en pastizales cortos. Es un residente común
y extendido en toda América del Sur, excepto en las regiones densamente
boscosas (por ejemplo, la mayor parte del Amazonas), las partes más altas de
los Andes y la costa árida de una gran parte del oeste de América del Sur. Esta
ave es particularmente común en la cuenca del Río de la Plata. También se ha
extendido por Centroamérica en los últimos años. Llegó a Trinidad en 1961 y a
Tobago en 1974, y ha aumentado rápidamente en ambas islas, dirigiéndose esporádicamente
hacia el norte hasta Barbados. El tero es el ave nacional de Uruguay y uno de
los símbolos del estado brasileño de Rio Grande do Sul.
Fig.
2. Distribudión del tero o Vonellus
chilensis
9.1.5. Dieta
En su dieta incluye principalmente
saltamontes, larvas de insectos, lombrices de tierra, peces pequeños e
invertebrados terrestres.
9.1.6. Reproducción
En Colombia se han registrado nidos en los
meses de enero, febrero, mayo, junio y julio. Anida en una pequeña depresión en
el suelo en la cual pone 3 o 4 huevos de color café oliva con puntos y manchas
negras los cuales incuba alrededor de 27 días. Es un ave monógama y presenta un
sistema de cría cooperativa en el que 2 o 3 adultos o inmaduros ayudan en la
defensa del territorio. Exhiben una conducta bastante agresiva durante el
periodo reproductivo alejando cualquier intruso cercano al nido. Es un ave
bastante ruidosa y puede ser observada solitaria, en parejas o en grupos laxos.
Generalmente vuelan cortas distancias lentamente y con altibajos. Cuando se siente
amenazada emiten un llamado estridente y repetido que también producen cuando
regresan a sus dormideros al atardecer (Arango, 2014; Montaño, 2016;
Rosselli, De La Zerda, & Candil, 2017).
9.1.7. Conservación
Esta especie tiene un rango de distribución
extremadamente grande y, por lo tanto, no se acerca a los umbrales de Vulnerable
según el criterio del tamaño del rango (Extensión de la ocurrencia menor a 20,000
km2 combinada con un tamaño de rango decreciente o fluctuante,
extensión / calidad del hábitat o tamaño de la población y un número pequeño de
ubicaciones o fragmentación severa).
La tendencia de la población parece estar
aumentando y, por lo tanto, la especie no se acerca a los umbrales de Vulnerable
según el criterio de tendencia de la población (disminución a menos del 30% en
diez años o tres generaciones). El tamaño de la población es extremadamente
grande y, por lo tanto, no se acerca a los umbrales de Vulnerable
según el criterio del tamaño de la población (menos de 10,000 individuos
maduros con una disminución continua estimada en menos del 10% en diez años o
tres generaciones, o con una estructura poblacional específica). Por estas
razones, la especie se evalúa como Preocupación menor.
21.1. Cucarachero
21.1.1. Taxonomía.
En Colombia recibe el nombre de
cucarachero común, aunque también es reconocido como Chochín Criollo o reyezuelo
(Troglodytes aedon) es un pájaro cantor muy pequeño de la familia de los
reyezuelos, Troglodytidae. Se encuentra desde Canadá hasta el extremo
sur de América del Sur y, por lo tanto, es el ave nativa de mayor distribución
en las tres Américas (Brewer, 2010). Ocurre en la mayoría de las áreas suburbanas de su área de
distribución y es el reyezuelo más común. Su taxonomía es muy compleja y algunos
grupos de subespecies a menudo se consideran especies separadas. El nombre
trogloditas significa "habitante de agujeros" y es una referencia a
la tendencia de las aves a desaparecer en las grietas cuando cazan insectos o
buscan refugio.
Figura 21.1.1. Troglodytes aedon
El cucarachero común generalmente se
divide en tres grupos de subespecies distintos y una o varias subespecies endémicas
de islas distintas. Algunos o todos estos a menudo se consideran especies
distintas.
-Troglodytes aedon aedon, o
cucarachero común del norte, habita desde Canadá al sur de los Estados Unidos
-Troglodytes aedon musculus, o
cucarachero común del norte, habita desde el sur de México, Centroamérica y
Sudamérica.
-Troglodytes aedon brunneicollis, o
cucarachero común de garganta marrón, habita desde el sur de los Estados Unidos
y cordilleras centrales de México
-Troglodytes aedon beani, o
cucarachero común de la isla de Cozumel frente a la península de Yucatán, México
También se ha sugerido que los taxones de
las Antillas Menores representan una o más especies separadas, pero hay menos
acuerdo en cuanto a su subdivisión, porque en la medida en que se han estudiado
hasta la fecha, hay poca estructura biogeográfica clara entre estas
poblaciones.
Los cucaracheros trogloditas son una
familia de aves paseriformes marrones de la familia Troglodytidae,
predominantemente del Nuevo Mundo. La familia incluye 88 especies divididas en
19 géneros. Solo el reyezuelo euroasiático se encuentra en el Viejo Mundo,
donde, en las regiones anglófonas, se lo conoce comúnmente simplemente como el
"reyezuelo" o pequeño rey de la casa. El nombre de reyezuelo se ha
aplicado a otras aves no relacionadas, en particular los reyezuelos de Nueva
Zelanda (Acanthisittidae) y los reyezuelos australianos (Maluridae).
La mayoría de los reyezuelos son pequeños
y discretos (siendo, de hecho, el
pájaro más pequeño de Inglaterra)
aunque tienen cantos fuertes y a menudo complejos. Las excepciones
incluyen los miembros relativamente grandes del género Campylorhynchus,
que pueden ser bastante atrevidos en su comportamiento. Los reyezuelos tienen
alas cortas que están barradas en la mayoría de las especies y, a menudo, mantienen
la cola erguida. Los reyezuelos son principalmente insectívoros, comen
insectos, arañas y otros pequeños invertebrados, pero muchas especies también
comen materia vegetal y algunas comen pequeñas ranas y lagartijas (D. E. K. D. Brewer, 2005).
La taxonomía de algunos grupos es muy
compleja y es probable que se produzcan divisiones a nivel de especies en el
futuro. Además, se sabe que existen taxones no descritos.
21.1.2. Descripción
Es un pájaro pequeño, rechoncho y de cola
estrecha. Los adultos miden de 11 a 13 cm de largo, con una envergadura de 15 cm
y pesan entre 10 y 12 g (Cornell Lab of Ornithology, 2021b). Entre las medidas estándar, la cuerda del ala es de 4,7 a 5,3 cm
(1,9 a 2,1 pulgadas), la cola es de 3,9 a 4,4 cm, el culmen es de 1,1 a 1,3 cm
y el tarso es 1,6 a 1,8 cm (Brewer, 2010). Las subespecies varían mucho, con las partes superiores que van
desde el marrón grisáceo opaco al marrón rojizo intenso, y las partes
inferiores van desde el marrón, sobre beige y gris pálido, hasta el blanco
puro. Todas las subespecies tienen barreras negruzcas en las alas y la cola, y
algunas también en los flancos. Todas las subespecies muestran un anillo ocular
y una ceja tenues y tienen un pico largo y delgado con una mandíbula superior
negruzca y una mandíbula inferior amarillenta o gris pálida de punta negra. Las
patas son rosadas o grises. La cola corta generalmente se mantiene ladeada (Peterson, 1947).
El rico canto burbujeante de esta ave se
escucha comúnmente durante la temporada de anidación, pero rara vez después.
21.1.3. Dieta
Estas aves se alimentan activamente en la
vegetación. Se alimentan principalmente de insectos como larvas de mariposas,
también arañas y caracoles. Los cucaracheros del sur rara vez asisten a
bandadas de alimentación de especies mixtas (Machado, 1999).
21.1.4. Distribución
En América del Norte, se cree que el cucarachero
alcanza la mayor densidad en los bosques de llanuras aluviales en las grandes
llanuras occidentales, donde utiliza agujeros de pájaros carpinteros como
sitios de anidación. En América del Sur y Central se puede encontrar en prácticamente
cualquier hábitat y, como lo indica su nombre común, a menudo se asocia con los
humanos. Las aves norteamericanas migran al sur de Estados Unidos y México para
pasar el invierno. La mayoría regresa a las zonas de reproducción a finales de
abril o mayo, y se va de nuevo a los cuarteles de invierno entre septiembre y
principios de octubre (Peterson, 1947).
En Colombia habita hasta 3400 m (tierras
bajas a límite de vegetación arbórea o más arriba). En todo el país, a veces
ausente de áreas selváticas extensas.
21.1.5. Reproducción
Los hábitos de anidación no parecen diferir
significativamente entre los cucaracheros del norte y del sur. Por lo general,
construyen un nido de copa grande en varios tipos de cavidades, y demoran
aproximadamente una semana en construirse. El nido está hecho de pequeños palos
secos y generalmente está revestido con una variedad de materiales diferentes.
Estos incluyen: plumas, cabello, lana, capullos de araña, tiras de corteza,
raicillas, musgo y basura. El cucarachero encuentra palos secos, que agrega al
nido. Una vez que termina, la hembra inspecciona el nido; pero si no aprueba la
construcción, arrojará al suelo los palos que no desee. Después de este
proceso, la hembra recubre el nido. Las cavidades de los nidos suelen estar a
unos pocos metros sobre el suelo como máximo (Belles-Isles & Picman, 1986), pero ocasionalmente en acantilados de hasta 15 m (49 pies) y más
al menos en las poblaciones del sur; pueden ser naturales o artificiales, a
menudo utilizando casas para pájaros.
Los cucaracheros son animales luchadores y
belicosos considerando su pequeño tamaño. Se sabe que ocasionalmente destruyen
los huevos de otras aves que anidan en su territorio perforando la cáscara del
huevo. También se sabe que llenan los nidos de otras aves dentro de su
territorio con palos para inutilizarlos (https://www.nytimes.com/2016/07/31/opinion/sunday/red-in-beak-and-claw.html).
Dependiendo de la población exacta, la
nidada de los cucaracheros suele tener entre dos y ocho huevos de color blanco
crema con manchas rojas (del Hoyo, Elliot, & Christie,
2009), que
pesan aproximadamente 1,4 g (0,05 oz) cada uno y miden aproximadamente 17 y
13,4 mm (0,67 y 0,53 pulgadas). ) en los puntos más anchos. Solo la hembra los
incuba, durante unos 12-19 días (del Hoyo et al., 2009), y de vez en cuando abandona el nido por diversas razones.
Mientras ella está en el nido, el macho la abastece de comida. Las crías, que
como todos los paseriformes nacen casi desnudas e indefensas, tardan entre 15 y
19 días más o menos en emplumar. Ambos padres los alimentan y necesitan mucha
comida dado su pequeño tamaño (ver también la Regla de Bergmann). A medida que
los jóvenes están a punto de emplumar, los padres pasan gran parte de su tiempo
comprándoles comida. Se encontró que la pérdida de cría debido a la depredación
era leve en los Yungas Andinos del Sur, siendo la depredación de los polluelos
casi insignificante (Auer et al., 2007). Los depredadores conocidos de cucaracheros en el nido incluyen
gatos, ratas, zarigüeyas, pájaros carpinteros, zorros, mapaches, ardillas,
serpientes y búhos. Los adultos que están lejos de los nidos generalmente
pueden evitar a estos depredadores, aunque tanto los halcones pequeños como los
búhos ocasionalmente capturan cucaracheros adultos que vuelan libremente.
21.1.6. Estado de conservación
El reyezuelo común puede haber sido
desplazado un poco en algunas partes del norte de su área de distribución por
la introducción del gorrión común, pero todavía es común y está muy extendido
en la mayor parte de las Américas. No se considera amenazada por la UICN (BirdLife International, 2016), aunque esto ciertamente no sería cierto para varias de las
poblaciones de la isla si resultan ser especies verdaderas.
Algunos taxones, especialmente de las
Antillas Menores, son raros y están en peligro de extinción o posiblemente ya
estén extintos. Varios factores parecen haber contribuido en grado variable al
declive de estas aves, a saber, la destrucción del hábitat, la depredación por
mangostas introducidas y los huracanes:
Reyezuelo común de Martinica, Troglodytes
aedon martinicensis) - Martinica, aparentemente extinta (c.1890)
Reyezuelo de Guadalupe, Troglodytes
aedon guadeloupensis - Guadalupe, posiblemente extinta (¿finales del siglo XX?)
Reyezuelo doméstico de Santa Lucía, Troglodytes
aedon mesoleucus - Santa Lucía, que se creía extinta en la década de 1970,
posteriormente redescubierta pero aún precariamente rara
El reyezuelo de San Vicente (Troglodytes aedon musicus) de San Vicente estuvo cerca de la extinción a mediados y finales del siglo XX; desde entonces se ha recuperado y hoy en día no es infrecuente (Culzac-Wilson, 2008).
2.1. Iguaza común
2.1.1. Taxonomía.
El pato silbante de vientre negro, iguaza común,
yaguasa de pico rojo, pijije común, piche, sirirí vientre negro, pato silbador
pico rojo, pato silbón ala blanca, pato pisingo (Dendrocygna
autumnalis), es un ave que pertenece al clado Anatidae o
simplemente, los patos que también incluye a los gansos y a los cisnes. Los
patos silbadores o patos arborícolas son una subfamilia, Dendrocygninae,
de la familia de aves de los patos, gansos y cisnes, Anatidae. En otros
esquemas taxonómicos, se consideran una familia separada, Dendrocygnidae.
Algunos taxonomistas enumeran solo un género, Dendrocygna, que contiene
ocho especies vivas y una especie extinta no descrita de Aitutaki de las
Islas Cook, pero otros taxonomistas también enumeran el pato de lomo blanco (Thalassornis
leuconotus) en la subfamilia.
Los patos silbadores fueron descritos por
primera vez por Carl Linnaeus en la décima edición de Systema Naturae en
1758: el pato silbador de vientre negro (entonces Anas autumnalis) y el
pato silbador de las Indias Occidentales (entonces Anas arborea) (Linnaei, 1758). En 1837, William John Swainson nombró al género Dendrocygna
para distinguir a los patos silbadores de las otras aves acuáticas (Swainson, 1836). La especie tipo fue catalogada como el pato silbante errante (D.
arcuata), anteriormente nombrado por Thomas Horsfield como Anas arcuata
(Eyton, 1838).
La taxonomía de los patos silbadores,
incluida la de todo el infraorden Anseriformes, es complicada y
controvertida (Donne-Goussé, Laudet, & Hänni,
2002). Según
una clasificación tradicional propuesta por el ornitólogo Jean Théodore
Delacour basada en rasgos morfológicos y de comportamiento, los patos
silbadores pertenecen a la tribu Dendrocygnini bajo la familia Anatidae
y subfamilia Anserinae (Donne-Goussé et al., 2002). Siguiendo las revisiones del ornitólogo Paul Johnsgard, Dendrocygnini
incluye el género Thalassornis (el pato de lomo blanco) (Johnsgard, 2010).
Actualmente se reconocen ocho especies de
pato silbador en el género Dendrocygna. Sin embargo, Johnsgard (2010) considera que el pato de lomo blanco (Thalassornis leuconotus)
de África y Madagascar es una novena especie distinta, un punto de vista
propuesto por primera vez en 1960 y apoyado inicialmente por similitudes de
comportamiento. Más tarde, las similitudes en la anatomía, las vocalizaciones
de los patitos y las proteínas de las plumas proporcionaron un apoyo adicional.
El análisis molecular en 2009 también sugirió que el pato de lomo blanco estaba
anidado dentro del clado del pato silbante (Eo, Bininda‐Emonds, & Carroll,
2009).
Además de las especies existentes, se han encontrado restos subfósiles de una
especie extinta no descrita en Aitutaki de las Islas Cook (Steadman, 2006).
La iguaza común se divide en dos
subespecies, que se intergran en Panamá:
1. Pato silbante de vientre negro del
norte, D. a. fulgens: desde el sur de los Estados Unidos hasta el oeste
de Panamá (Banks, 1978). Es más grande, con el pecho y la parte superior de la espalda
marrones.
2. Pato silbante de vientre negro del sur,
D. a. autumnalis - Este de Panamá a Paraguay y regiones adyacentes. Más
pequeño, con pecho y parte superior de la espalda grises (Banks, 1978).
Antes de 1978, las aves desde el oeste de
Panamá al norte hasta el sur de los Estados Unidos se denominaban erróneamente D.
a. autumnalis y las aves desde el este de Panamá hasta Sudamérica se
denominaron D. a. decolorar (Banks, 1978).
2.1.2. Descripción
El pato silbante de vientre negro es una
especie de ave acuática de tamaño mediano. La longitud varía de 47 a 56 cm , la
masa corporal de 652 a 1020 g y la envergadura de las alas varía de 76 a 94 cm (eNature, 2021). Tiene un pico rojo largo, cabeza larga y patas alargadas, cabeza
gris pálida y plumaje mayormente marrón grisáceo. El vientre y la cola son
negros, y el plumaje del cuerpo, la parte posterior del cuello y la gorra son
de un rico marrón castaño. La cara y la parte superior del cuello son grises y
lucen un anillo ocular blanco delgado pero distintivo. El blanco extenso en las
alas es obvio en vuelo, menos en el suelo; está formado por las rémiges
secundarias mientras que las primarias son negras; las coberteras alares son
marrones. Los machos y las hembras se parecen; los juveniles son similares,
pero tienen un pico gris y un vientre menos contrastante.
Figura 2.1.1. Dendrocygna autumnalis
La barra de alas es única entre los patos
que silban. Cuando está en el suelo, puede ser difícil discernir los flancos
claros presentes en muchas de estas aves acuáticas. Los juveniles de D.
autumnalis son bastante similares a los jóvenes del pato silbador
cariblanco (D. viduata), que tienen un pico más oscuro y no tienen
mancha blanca en las alas; incluso cuando están sentados nunca parecen
mostrarse blancos a los lados, ya que su delgada barrera blanca vertical en los
flancos negros es muy indistinta. Como su nombre lo indica, estos son pájaros
ruidosos con un claro silbido.
2.1.3. Comportamiento
La iguaza común es una especie común que
es "bastante mansa, incluso en la naturaleza". Es muy gregario o
social, forma grandes bandadas cuando no se reproduce. Suele anidar en árboles
huecos (en Sudamérica muchas veces en palmeras). El hábitat son estanques de
agua dulce poco profundos, lagos, humedales y marismas, tierras cultivadas o
embalses con abundante vegetación, donde este pato se alimenta principalmente
por la noche de semillas y otros alimentos vegetales.
2.1.4. Alimentación
La alimentación a menudo ocurre durante la
noche, pero se les puede encontrar comiendo a cualquier hora del día. Las
iguazas comunes ingieren una amplia variedad de material vegetal, pero también
consumen artrópodos e invertebrados acuáticos cuando están disponibles. A
menudo se alimentan de vegetación sumergida vadeando en aguas poco profundas.
Como su nombre en latín (autumnalis = del otoño o de la cosecha) lo
indica, comúnmente se lo ve rebuscando campos recién cosechados en busca de
semillas e invertebrados sobrantes que los recolectores levantan al alterar el
suelo.
2.1.5. Distribución y
desplazamiento
La iguaza común es parcialmente no-migratorio
pero las poblaciones en las porciones del extremo norte de su área de
distribución (Arizona, Luisiana y partes de Texas) se desplazan hacia el sur en
invierno. En el corazón de su área de distribución, hay una tendencia a viajar
en bandadas durante los meses de invierno, aunque este comportamiento no es una
verdadera migración de largo alcance sino una dispersión local.
Figura 2.1.2. Distribución de la Iguaza
común
Esta ave se
distribuye principalmente en la zona tropical de América, desde el sur de los
Estados Unidos y las costas occidentales y orientales de México, el resto de
Centroamérica, todo Panamá, la zona norte de América del Sur, incluyendo
Colombia, las Guayanas, Venezuela, gran parte del Brasil y algunas regiones de
Perú y Ecuador, pero excluyendo la selva amazónica.
2.1.6. Habitat en Colombia
En los Parques Ecológicos Distritales de
Humedal de Bogotá Colombia (PEDH), se ha evidenciado que utiliza los espejos de
agua para nadar y desplazarse en los herbazales de Botoncillo (Bidens laevis),
Barbasco (Polygonum punctatum), vegetación flotante de buchón de agua (Eichhornia
crassipes), lenteja y helecho de agua (Lemna sp.,
y Azolla filiculoides), los cuales frecuenta con sus crías y polluelos
para alimentarse. Se ha podido registrar 5 actividades de reproducción en el PEDH El
Burro, de las cuales 2 han sido anidaciones en zonas de Eneales (Typha
latifolia) y en árboles exóticos poniendo de 12 a 14 huevos.
Así mismo se ha evidenciado en espejos de agua con sus polluelos nadando y
alimentándose en grupos de 3 a 5 adultos. En los PEDH se considera una especie
Escasa en las áreas de mantenimiento (EAAB, 2021).
2.1.7. Reproducción
La iguaza común es bastante única entre
los patos por su fuerte vínculo de pareja monógama. Sus parejas a menudo
permanecen juntas durante muchos años, un rasgo que se asocia más a menudo con
gansos y cisnes. Ambos padres comparten todas las tareas asociadas con la
crianza de las crías, desde la incubación hasta la crianza de los patitos. Los
patos, principalmente los que anidan en cavidades, prefieren los confines de un
árbol hueco, pero anidan en el suelo cuando sea necesario. También hacen uso de
chimeneas, edificios abandonados o cajas de nido, estas últimas se les han
proporcionado cada vez más en las últimas décadas, especialmente en el sureste
de Texas y México. Los patitos saltan de las cavidades del nido dentro de los
dos días posteriores a la eclosión, pueden alimentarse por sí mismos de
inmediato y permanecer con los padres hasta ocho semanas.
2.1.8. Estado de conservación
El pato silbador de vientre negro está catalogado como una especie de menor preocupación por la Unión Internacional para la Conservación de la Naturaleza (UICN); su población mundial se estima en 1.100.000-2.000.000 de aves y sigue aumentando.
2.2. Cerceta aliazul
2.2.1. Taxonomía.
La cerceta de alas azules (Spatula
discors) es una especie de ave de la familia Anatidae que agrupa a
los patos, gansos y cisnes. La primera descripción formal de la cerceta de alas
azules fue realizada por el naturalista sueco Carl Linnaeus en 1766 en
la duodécima edición de su Systema Naturae (Linnaei, 1758). Acuñó el nombre binomial Anas discors. Un estudio
filogenético molecular que comparó las secuencias de ADN mitocondrial publicado
en 2009 encontró que el género Anas, como se definió entonces, no era
monofilético o natural (Gonzalez, Düttmann, & Wink,
2009). Posteriormente, el género se dividió en
cuatro géneros monofiléticos con diez especies, incluida la cerceta de alas
azules, que se trasladó al género resucitado Spatula (Gill &
Donsker editors, 2017).
Este género había sido propuesto originalmente por el zoólogo alemán Friedrich
Boie en 1822 (Fraser & Gray, 2019). El nombre Spatula es el latín para una "cuchara"
o "espátula". El epíteto específico discors es el latín para
"diferente" o "en discordia".
Figura 2.2.1 Spatula discors
2.2.2. Descripción
La cerceta de alas azules mide 40 cm de
largo, con una envergadura de 58 cm y un peso de 370 g. El macho adulto tiene
una cabeza azul grisácea con una media luna facial blanca, un cuerpo marrón
claro con una mancha blanca cerca de la parte trasera y una cola negra. La
hembra adulta es de color marrón moteado y tiene un área blanquecina en la base
del pico. Ambos sexos tienen coberteras alares de color azul cielo, un espéculo
verde y patas amarillas. Tienen dos mudas por año y una tercera muda en su
primer año. La llamada del macho es un silbido corto; la llamada de la hembra
es un graznido suave (Floyd, Hess, & Scott, 2008).
2.2.3. Comportamiento
Estas aves se alimentan jugando en aguas
poco profundas al borde de los pantanos o en aguas abiertas. Se alimentan
principalmente de plantas; su dieta puede incluir moluscos e insectos
acuáticos. Las cercetas de alas azules son generalmente los primeros patos al
sur en el otoño y los últimos al norte en la primavera. Los machos adultos
abandonan los lugares de reproducción mucho antes que las hembras adultas y los
inmaduros. La mayoría de las bandadas de cerceta de alas azules vistas después
de mediados de septiembre están compuestas principalmente por hembras adultas e
inmaduras en las regiones del norte, allí experimentan una disminución
constante en las poblaciones de cerceta de alas azules desde principios de
septiembre hasta principios de noviembre. La cerceta de alas azules en las
áreas de migración central tiende a permanecer hasta septiembre, luego
disminuyen rápidamente durante octubre, y quedan pequeñas cantidades hasta
diciembre. Un gran número de cerceta de alas azules aparece en las zonas de
invernada en Florida, Luisiana y Texas en septiembre (Baldassarre, 2014).
2.2.4. Alimentación
La cerceta de alas azules se alimenta en
la superficie y prefiere alimentarse en marismas, en campos o en aguas poco
profundas donde hay vegetación flotante y poco sumergida, además de abundante
vida de pequeños animales acuáticos. Se alimentan principalmente de materia
vegetativa que consiste en semillas o tallos y hojas de juncia, pasto, alga de
estanque, alga inteligente (Polygonum spp.), Lenteja de agua (Lemna spp.),
petagna (Ruppia cirrhosa) y pasto almizclero (Chara spp.). Este
pato consume con avidez las semillas de plantas que crecen en llanuras de
barro, como la hierba de nuez (Cyperus spp.), el mijo (Panicum
spp.) yla hierba cortada de arroz (Leersia oryzoides). Una cuarta parte
de los alimentos que consume la cerceta de alas azules es materia animal como
moluscos, crustáceos e insectos (Baldassarre, 2014).
2.2.5. Distribución y
desplazamiento
El rango es toda América del Norte excepto
el oeste y norte de Alaska, el norte del territorio del Yukón, el norte de los
territorios del noroeste y el área noreste de Canadá. La cerceta de alas azules
es rara en el desierto del suroeste y en la costa oeste. El hábitat de
reproducción de la cerceta de alas azules son las marismas, humedales y
estanques (Floyd et al., 2008).
Figura 2.2.2. Distribución de Spatula discors: anaranjado, territorio de
reproducción nativa; amarillo, territorio de paso durante la migración; púrpura,
nativo no migratorio; azul, territorio de invierno.
El área de reproducción se extiende desde
el centro-este de Alaska y el distrito sur de Mackenzie hacia el este hasta el
sur de Quebec y el suroeste de Terranova. En los Estados Unidos contiguos, se
reproduce desde el noreste de California al este hasta el centro de Luisiana,
el centro de Tennessee y la costa atlántica. La cerceta occidental de alas
azules habita en esa parte del área de reproducción al oeste de los Apalaches.
La cerceta de alas azules del Atlántico anida a lo largo de la costa atlántica
desde New Brunswick hasta Pea Island, Carolina del Norte (Floyd et al., 2008).
Migran en bandadas para pasar el invierno
al sur de su área de reproducción. Durante la migración, algunas aves pueden
volar largas distancias sobre mar abierto. Son vagabundos ocasionales en
Europa, donde sus patas amarillas son una distinción de otros patos pequeños
como la cerceta común y la garganey, y en los últimos años han sido vagabundos
anuales en Gran Bretaña e Irlanda. La cerceta de alas azules pasa el invierno
desde el sur de California hasta el oeste y el sur de Texas, desde la costa del
Golfo hasta la costa atlántica, el Caribe y desde el sur hasta América Central
y del Sur. A menudo se le ve invernar tan al sur como Brasil y el centro de
Chile (Floyd et al., 2008).
2.2.6. Hábitat en Colombia
Este pato migratorio boreal suele verse en
parvadas de hasta 80 individuos en los diferentes espejos de agua y en el suelo
desnudo tomando el sol o acicalándose. En las actividades de
mantenimiento se han protegido 13 anidaciones ubicadas en los humedales
Capellanía, El Burro, El Tunjo, La Conejera, De Techo y Torca-Guaymaral.
Su hábitat predilecto es la vegetación flotante, también suele verse
forrajeando en zonas de juncales, eneales y lodazales durante la época de
sequía. Es una especie abundante en las zonas de mantenimiento de los Parques Ecológicos
Distritales de Humedales (EAAB, 2021).
2.2.7. Reproducción
El inicio del cortejo entre cerceta de
alas azules inmaduros a menudo comienza a fines de enero o principios de
febrero. En áreas al sur de las áreas de reproducción, la cerceta de alas
azules es más activa en el cortejo durante la migración de primavera que la
mayoría de los otros patos (Floyd et al., 2008).
La cerceta de alas azules se encuentra
entre los últimos patos en anidar, generalmente anida entre el 15 de abril y el
15 de mayo. Pocos nidos se inician
después de mediados de julio. La cronología de la anidación puede variar de un
año a otro como resultado de las condiciones climáticas. El nido es una
depresión poco profunda en el suelo bordeada de pasto y hacia abajo,
generalmente rodeada de vegetación. Generalmente pone de 10 a 12 huevos. El
tamaño de la puesta también puede variar con la edad de la hembra. La
incubación toma de 21 a 27 días (Floyd et al., 2008).
Las cerceta de alas azules son sexualmente
maduras después de su primer invierno. Durante la incubación, el macho deja a
su pareja y se mueve a una cubierta de muda adecuada donde se vuelve incapaz de
volar durante un período de 3 a 4 semanas. Los patitos de alas azules pueden
caminar hacia el agua dentro de las 12 horas posteriores a la eclosión, pero no
empluman hasta las 6 a 7 semanas (Floyd et al., 2008).
2.2.8. Estado de conservación
Cerceta de alas azules es el segundo pato
más abundante en América del Norte, detrás del pato silvestre. Las poblaciones
se mantuvieron estables entre 1966 y 2014, según la Encuesta de aves
reproductoras de América del Norte. Su número fluctúa entre aproximadamente 2.8
millones y 7.4 millones de aves, principalmente como respuesta a las
condiciones del agua, y la sequía hace que las poblaciones disminuyan. No están
en la lista de observación del estado de las aves de 2014. Al financiar a los
agricultores para que dejen algunos de sus campos en barbecho, el Programa de
Reserva de Conservación del USDA ha ayudado a aumentar el hábitat de anidación
de pastizales en aproximadamente 1.8 millones de acres en el rango de
reproducción de baches de pradera de esta especie. Los cerceta de alas azules
son los primeros migrantes, por lo que se no se encuentran en USA cuando la
temporada de caza de patos en muchos estados da inicio. Aun así, los cazadores matan
de 200 000 a más de 500, 00 individuos por año (esta presión de caza se maneja
cuidadosamente para mantener los objetivos de población). La cerceta de alas
azules, al igual que otros patos, es vulnerable a la pérdida o degradación de
los humedales, la contaminación por pesticidas (particularmente en sus áreas de
invernada, en países donde el DDT todavía es legal) y el consumo de perdigones
de plomo donde todavía se usan (Cornell Lab of Ornithology, 2021a).
7.2. Colibrí abeja
7.2.1. Taxonomía.
El colibrí de Mulsant, colibrí abeja,
coqueta verde y blanca, rumbito buchiblanco, estrella de la madera de vientre
blanco (Chaetocercus mulsant) es una especie de ave de la familia Trochilidae,
que se encuentra en Bolivia, Colombia, Ecuador, y el Perú (Jaramillo, 2017). La palabra (Trochilidae) es el modo en que los científicos
de todo el mundo hacen
referencia a los colibríes (Greenewalt,
1990). Usted se preguntará por qué
utilizar esa palabra tan complicada y pomposa, la razón es muy simple y se
fundamenta en los principios de la taxonomía moderna. En ingles estas aves son
denominadas hummingbirds, en japonés son Hachidori, en chino Fēngniǎo,
pero los científicos de todo el mundo tienen la necesidad de referirse a estas
aves bajo una sola etiqueta que no genere confusiones.
Los
colibríes (Trochilidae), también conocidos como picaflores, chuparrosas,
tucusitos, pájaros mosca, ermitaños, quindes, chupamirtos, chuparrosas, huitzitzilin
(en náhuatl), mainumby (en guaraní) o guanumby (Garro Barrera,
2017) son un conjunto de aves apodiformes,
palabra que significa sin patas formadas haciendo referencia a sus patas cortas.
Figura 7.2.1 Chaetocercus
mulsant macho
Los
colibríes son aves nativas de las Américas con alrededor de 360 especies, se
encuentran desde Alaska hasta Tierra del Fuego, pero la gran mayoría de las
especies se encuentran en los trópicos. Son aves pequeñas, y la mayoría de las
especies miden 7.5–13 cm de largo. La especie de colibrí más pequeña que existe
es el colibrí abeja de 5 cm, que pesa menos de 2.0 g. La especie de colibrí más
grande es el colibrí gigante de 23 cm, con un peso de 18 a 24 gramos. Están
especializados en alimentarse de néctar de flores, pero todas las especies
también consumen insectos voladores o arañas (Greenewalt,
1990).
Los
colibríes se separaron de su grupo hermano, los vencejos y los vencejos
crestados, hace unos 42 millones de años (McGuire et al.,
2014). Se estima que el ancestro común de
los colibríes actuales vivió hace 22 millones de años en América del Sur (Bochenski &
Bochenski, 2008; Mayr, 2004, 2007). Se les conoce como aves zumbadoras
“hummingbirds” por el zumbido creado por su batir las alas, que aletean
a altas frecuencias audibles para los humanos, se ciernen en el aire a
velocidades rápidas de aleteo, que varían de alrededor de 12 pulsos por segundo
en las especies más grandes a alrededor de 80 por segundo en los colibríes
pequeños. Taxonómicamente los colibríes se dividen en 6 grupos, siendo Trochilinae
al que pertenece nuestro colibrí.
La
subfamilia Trochilinae se divide en tres tribus: Lampornithini (colibríes
gema de montaña) que contiene 18 especies, Mellisugini (colibríes abeja)
que contiene 37 especies, que es donde pertenece nuestro colibrí y Trochilini
(colibríes esmeraldas) que contiene 115 especies. Y a su vez los colibrís abeja
se dividen en 17 géneros.
El género Chaetocercus
es uno de estos géneros, y la palabra se deriva de las palabras griegas khaitē,
que significa "pelo" y kerkos, que significa "cola",
por lo que el nombre completo de nuestra ave es colibrí cola peluda de Mulsant,
haciendo referencia a sus colas extremadamente cortas, sin embargo, en inglés las
especies de este género tienden a recibir el nombre de estrellas de la madera “Woodstars”.
El género contiene las siguientes especies:
Estrella de
madera de vientre blanco, Chaetocercus mulsant.
Estrella de
madera, Chaetocercus bombus.
Estrella de
madera con garganta, Chaetocercus heliodor.
Estrella de
madera de Santa Marta, Chaetocercus astreans.
Estrella de
madera de Esmeraldas, Chaetocercus berlepschi.
Estrella de
madera de eje rufo, Chaetocercus jourdanii.
7.2.2. Descripción
Este pequeño colibrí de 7 cm, presenta
diferenciación sexual, lo que significa que el macho y la hembra presentan
patrones en su coloración diferentes y distinguibles. Los machos son mayormente
verde esmeralda arriba con el pecho y el vientre blancos brillantes, flancos
verde oscuros, garganta púrpura brillante y cola bifurcada. Sus alas hacen un
zumbido metálico distintivo en vuelo. Las hembras tienen la garganta blanca,
línea blanca del ojo y flancos beige anaranjado intenso. Ambos sexos tienen
parches blancos muy prominentes a los lados de la parte inferior de la espalda.
Las hembras en particular pueden ser difíciles de distinguir de otras estrellas
de madera (EAAB, 2021).
7.2.3. Comportamiento y
alimentación
Frecuenta los árboles secos o muertos del
arbolado nativo donde percha para descansar o acicalarse mientras recibe el sol.
Se ha visto forrajear en los juncos (Schoenoplectus californicus) donde
come insectos y néctar de flores de color amarillo, rojo y naranja de abutilon
(Callianthe sp.) (EAAB, 2021).
Los colibríes son nectarívoros
especializados (Stiles, 1981) y están atados a las flores ornitófilas “es decir plantas que se han vuelto dependientes
de las aves y por lo tanto se describen como amantes de aves para su
reproducción” de las que se alimentan. Esta
coevolución implica que los rasgos morfológicos de los colibríes, como la
longitud del pico, la curvatura del pico y la masa corporal, se correlacionan
con los rasgos morfológicos de las plantas, por ejemplo, la longitud, la
curvatura y el volumen de la corola, eso implica que
las especies son codependientes para su existencia, si un grupo desaparece el
otro también (Maglianesi,
Blüthgen, Böhning-Gaese, & Schleuning, 2014).
Muchas plantas polinizadas por colibríes
producen flores en tonos de rojo, naranja y rosa brillante, aunque las aves
también toman néctar de flores de otros colores. Los colibríes pueden ver
longitudes de onda en el ultravioleta cercano “algo así como tonos de púrpura o morado que
nuestros ojos no pueden ver”, pero las flores
polinizadas por colibríes no reflejan estas longitudes de onda como lo hacen
muchas flores polinizadas por insectos. Este estrecho espectro de colores puede
hacer que las flores polinizadas por colibríes pasen relativamente
desapercibidas para la mayoría de los insectos, lo que reduce el robo de néctar
(Altshuler, 2003).
7.2.4. Distribución y
desplazamiento
Se encuentra en Bolivia, Colombia, Ecuador
y Perú. Sus hábitats naturales son bosques montanos húmedos tropicales o
subtropicales y antiguos bosques muy degradados. No se trata de un AVE migratoria por lo que sus
patrones de desplazamiento suelen ser muy limitados a las áreas donde se
encuentren los bosques tropicales de montaña húmedos entre los 1500 a los 2800
metros sobre el nivel del mar (IUCM, 2016).
Figura 7.2.2. Distribución, como pueden darse cuenta, los parches de
distribución están limitados a las áreas montañosas de la región tropical.
7.2.5. Hábitat en Colombia
El Colibrí abeja se ha considerada una
especie rara, registrándose en los humedales El Burro, La Conejera y
Torca-Guaymaral, al realizar las actividades de mantenimiento por parte de la Empresa de Acueducto
y Alcantarillado de Bogotá. Realiza un sonido muy
parecido al de un abejorro cuando se encuentra en vuelo, su desplazamiento en
el aire suele ser lento, pausado y en diferentes direcciones (EAAB, 2021).
7.2.6. Reproducción
Se conoce poco de la biología reproductiva
de esta especie.
7.2.7. Estado de conservación
El tamaño de la población mundial no se ha
cuantificado, pero esta especie se describe como "bastante común", con una tendencia de fluctuación
estable, por lo que su estado de conservación se clasifica como de preocupación
menor.
8.1. Tingua bogotana
8.1.1. Taxonomía.
La tingua o rascón bogotana (Rallus
semiplumbeus) es una especie de ave de la familia Rallidae, endémica
de Colombia que pertenece al género Rallus. Las aves del género Rallus
son aves de humedales. Seis de las especies se encuentran en las Américas, y
las tres especies que se encuentran en Eurasia, África y Madagascar están muy
estrechamente relacionadas entre sí, lo que sugiere que descienden de una sola
invasión de un ancestro del Nuevo Mundo (Navas, 2002).
Figura 8.1.1. La tingua o rascón bogotana
(Rallus semiplumbeus)
Los rálidos son aves delgadas de pico
largo con patas delgadas. Sus cuerpos aplanados lateralmente son una adaptación
a la vida en cañaverales y pantanos húmedos, lo que les permite deslizarse
fácilmente a través de la densa vegetación semiacuática. Por lo general, estas
aves tienen partes superiores marrones con rayas, azul grisáceo en la cara o el
pecho y flancos barrados. Solo la tingua africana tiene el dorso liso, y la
tingua de flancos lisos carece de gris azulado en su plumaje y no tiene barras
en los flancos (Navas, 2002).
Tres especies endémicas de América del Sur
están en peligro de extinción por la pérdida de hábitat, y el rascón de
Madagascar se está volviendo raro.
El género Rallus fue erigido en
1758 por el naturalista sueco Carl Linnaeus en la décima edición de su Systema
Naturae (Linnaeus,
1758). La especie tipo
fue designada posteriormente como rascón acuático (Rallus aquaticus) (Peters, 1931). El nombre del género Rallus proviene del nombre latino
prebinomial Rallus aquaticus para el rálido de agua utilizado por el
ornitólogo inglés Francis Willughby en 1676 (Willughby & Ray, 1676), y por el naturalista inglés Eleazar Albin en 1731 (Albin, 1738). Recibe su nombre del la expresión en Frances se pronuncia como râle,
del francés antiguo rasle. Recibe su nombre por su áspero grito, en
latín vulgar *rascula, del latín rādere ("raspar") (Reedman, 2016).
El género contiene 14 especies (Gill, Donsker, & Rasmussen,
2021):
👉 La tinga
ecuatorial Rallus aequatorialis que se encuentra en Colombia y Ecuador
👉 La tinga austral Rallus antarcticus
que se encuentra en Argentina y Chile
👉 La tigua acuática Rallus
aquaticus que se encuentra en el continente euroasiático y el norte de
África siendo esta especie la especie tipo de todo el género.
👉 La tingua africana Rallus
caerulescens que se encuentra en el sur de África hasta Etiopía.
👉 La tingua crepitante Rallus
crepitans que se encuentra en el este de Estados Unidos, el Golfo de México,
el este de México, algunas islas del Caribe y el sudeste de América central.
👉 La tingua real Rallus elegans
que se encuentra en el sur de Estados Unidos, el norte de Méjico también se
puede encontrar en Canadá y algunas han encontrado en el sur de Ontario.
👉 La
tingua de mejillas marrones Rallus indicus se encuentra en el norte de Mongolia, el este
de Siberia, el noreste de China Corea y el norte de Japón.
👉 La tingua de virginia Rallus
limícola que se encuentra en el sur de Estados Unidos y en América central.
👉 La tingua de los manglares Rallus
longirostris que se encuentra en el noreste de Colombia, el noreste de
Venezuela, en Brasil y Trinidad.
👉 La
tingua de Madagascar Rallus madagascariensis que es endémica de la isla de Madagascar.
👉 La
tingua de Ridgway Rallus obsoletus
que se encuentra
en el sudeste de California el sur de Arizona y el noroeste de Méjico.
👉 La
tingua de Bogotá Rallus semiplumbeus que es endémica de los humedales de Bogotá Colombia.
👉 La
tingua azteca Rallus tenuirostris endémica de Méjico.
👉 La
tingua de Wetmore Rallus wetmorei endémica de Venezuela.
El género Rallus
pertenece Rallidae, comúnmente conocidos en el idioma
inglés como los rieles, son una gran familia cosmopolita de aves terrestres de
tamaño pequeño a mediano. La familia exhibe una diversidad considerable e
incluye las gallinetas, gallaretas y fochas. Muchas especies están asociadas
con los humedales, aunque la familia se encuentra en todos los hábitats
terrestres, excepto en los desiertos secos, las regiones polares y las áreas
alpinas por encima de la línea de nieve. Los miembros del clado Rallidae
se encuentran en todos los continentes excepto en la Antártida. Se conocen
numerosas especies insulares. Los hábitats de los rieles más comunes son los
pantanos y los bosques densos. Les gusta especialmente la vegetación densa (Perrins, 2003).
La familia Rallidae
fue introducida (como Rallia) por el erudito francés Constantine Samuel
Rafinesque en 1815 (Rafinesque,
1815). La familia se ha agrupado
tradicionalmente con dos familias de aves más grandes, las grullas y las
avutardas, así como varias familias más pequeñas de aves anfibias de tamaño
mediano generalmente denominadas como "primitivas", para formar el
orden Gruiformes (con forma de grulla). La taxonomía alternativa
de Sibley-Ahlquist, que ha sido ampliamente aceptada en América, eleva a la
familia al nivel de orden como Ralliformes (con forma de rálido). Dada
la incertidumbre sobre la monofilia de los gruiformes, esto puede ser correcto
o no. La familia contiene 152 especies distribuidas en 44 géneros. Además,
muchos rálidos prehistóricos de géneros existentes solo se conocen a partir de
restos fósiles o subfósiles, como el rascón de Ibiza (Rallus eivissensis)
(Mlíkovský,
2002).
La especie
bogotana Rallus semiplumbeus fue
descrita por primera vez en 1856 por el ornitólogo estadounidense Philip
Sclater, basándose en un espécimen que le enviaron los coleccionistas franceses
Jules y Édouard Verreaux (Sclater, 1989). El nombre específico semiplumbeus
proviene del latín plumbum (plomo), lo que sugiere que el ave tiene algo
del color del plomo (Mullay, 2011).
Hay dos
subespecies conocidas:
Rallus
semiplumbeus semiplumbeus (Sclater, 1856), encontrado en el oriente de Colombia.
Figura 8.1.2. Distribución de Rallus semiplumbeus
semiplumbeus.
R. s.
peruvianus,
conocido a partir de un solo espécimen recolectado en Perú y ahora considerado
extinto (WorldBirdNames.org,
2021).
8.1.2. Descripción
Esta tingua
es de tamaño pequeño, mide unos 25 cm. Posee un pico largo y delgado de color rojo
intenso con la punta fusca. Su coloración gris plomizo se extiende desde su cabeza, pasando por el
cuello y el pecho. La coronilla y el dorso son listados de color café y negro,
y sus hombros son rufo castaño, color que combina con sus patas rojizas. Sus
partes inferiores son gris plomizo con el centro de la garganta blanquecino y
sus flancos negros densamente barrados de blanco (EAAB, 2021).
8.1.3. Hábitat y
comportamiento
A pesar de
la amplia evidencia de alta capacidad de dispersión, los rálidos a menudo
tienen áreas de distribución extremadamente restringidas, y la tingua de Bogotá
no es una excepción: esta especie se encuentra solo en sabanas y pantanos de
páramo en la zona templada de los Andes orientales de Colombia. Aunque está muy
localizada, esta especie parece tener una población sana y estable, pero
cualquier presión de desarrollo humano sobre el hábitat podría afectarla
gravemente (Taylor &
Sharpe, 2020).
Esta
especie endémica de la sabana de Bogotá se encuentra en los humedales de los Parques
Naturales Nacionales Chingaza, Sumapaz y probablemente Cocuy, así como el
sistema de Parques de Humedales Distritales. Presenta un comportamiento
particular y es que suele escucharse su vocalización durante el amanecer sin
que sea visible y durante el resto del día se le puede ver desplazándose muy
sigilosamente en áreas abiertas sin escucharse vocalización alguna. Desde las actividades de
mantenimiento, en la franja acuática, se busca conservar y mejorar aquellos
parches de Juncales (Schoenoplectus californicus y Juncus effusus),
Eneales (Typha latifolia) y algunas Cyperaceas (Cyperus
xanthostachyus), en los humedales de Torca-Guaymaral, La Conejera, Juan
Amarillo (Tibabuyes) y Jaboque, donde se han registrado forrajeando,
desplazándose, apareándose, vocalizando y cuidando a sus polluelos (EAAB, 2021).
Igualmente,
la Empresa de Acueducto del Alcantarillado de Bogotá hace la recuperación de su
hábitat por medio de la rehabilitación de eneales de borde y resiembra de junco
en áreas dominadas por herbazales emergentes y en zonas terrificadas en los
otros humedales (EAAB, 2021).
8.1.4. Alimentación
Principalmente se alimenta de
invertebrados acuáticos y larvas de insectos, pero también gusanos, moluscos,
peces muertos, ranas, renacuajos y material vegetal. Activo desde el amanecer
hasta el anochecer; forrajea en áreas con una alfombra delgada de plantas
flotantes, en los bordes de cañaverales, en la costa pantanosa, en pastos y
pantanos inundados, y en parches de vegetación muerta anegada (Taylor &
Sharpe, 2020).
8.1.5. Reproducción
Los juveniles son dependientes de los
adultos de julio a agosto; estas y otras observaciones sugieren que estas aves
se reproducen de julio a septiembre, pues los nidos ya se encuentran vacíos en
octubre. Aparentemente monógamo y territorial. No hay detalles de nidos o
huevos disponibles; el pollito velloso negro tiene la mandíbula superior blanca
con una barra central negra y la mandíbula inferior negra, el cual es cuidado
por ambos padres (Taylor &
Sharpe, 2020).
8.1.6. Estatus y
conservación
Su estado
de conservación se considera vulnerable debido a lo limitado de su distribución
geográfica y a la destrucción paulatina pero sistemática del sistema de
humedales de Bogotá. Todas las principales localidades de humedales de sabana
están gravemente amenazadas, principalmente por el drenaje, pero también por la
invasión, los agroquímicos y otros tipos de contaminación como los desechos de
construcción, el turismo, la caza, las quemas, el pisoteo del ganado, los
cultivos, la fluctuación de los niveles de agua y la pérdida de agua para el
riego (Taylor &
Sharpe, 2020).
Los perros
callejeros presentes principalmente en los humedales del Distrito Capital
pueden depredar nidos y cazar o afectar la supervivencia de adultos. Es posible
que el control de los perros en La Conejera explique la alta población en ese
humedal. Tanto en Bogotá como en Fúquene y Tota, las quemas que se dan
repetidamente en los juncales pueden afectar a las tinguas por destrucción de
hábitat o de nidos (Birdscolombia,
2019). Otras amenazas incluyen la cacería
furtiva y la quema de junco, y la explotación agrícola intensa para cultivos de
cebolla en el borde y ronda de la laguna de Tota con la que se elimina la
vegetación acuática nativa y se secan áreas inundables. También representan
factores de amenaza la falta de información y de interés por parte de los
habitantes que contaminan el lago con agroquímicos y desechos orgánicos e
inorgánicos y el uso incontrolado de agua.
Figura 8.1.3. Escultura
del Rallus semiplumbeus elaborada
por la escultora cartagenera Elsa Marina Posada.
Con el
objetivo de crear conciencia sobre el peligro en que se encuentra la especie a
causa de la destrucción de su hábitat natural, los humedales de la sabana, en
septiembre de 2015 se inauguró en la avenida Circunvalar con calle 76 una
escultura del ave elaborada por la escultora cartagenera Elsa Marina Posada,
conocida como Elmar. La obra mide 3 m de alto, 2,30 de largo y 1 de ancho, fue
elaborada en concreto, recubierta con mosaico en cerámica y soportada sobre una
base de concreto (Redacción el
Tiempo, 2015).
16.2 Gavilán caminero
16.2.1. Taxonomía.
El gavilán caminero o halcón del borde de la carretera (Rupornis magnirostris) es un ave rapaz relativamente pequeña que se encuentra en las Américas. Esta especie vocal es a menudo la rapaz más común en su área de distribución. Taxonómicamente hablando subgénero Rupornis no contiene más especies, aunque esa especie en particular contenga una gran variedad de subespecies. Anteriormente la especie se clasificaba como Buteo magnirostris, pero estudios filogenéticos recientes han concluido que es conveniente clasificarlo en su propio género (Lerner, Klaver, & Mindell, 2008)
El género Rupornis
pertenece a la subfamilia
de aves de presa Buteoninae. Las Buteoninae son rapaces que
consta de especies de alas anchas de tamaño mediano a grande. Tienen picos
grandes, poderosos y ganchudos para desgarrar la carne de sus presas, patas
fuertes y garras poderosas. También tienen una vista extremadamente aguda que
les permite detectar presas potenciales desde la distancia. Algunas especies de
esta subfamilia se han especializado en la función del buitre “recuerde que los
buitres no son especies que desciendan de un solo ancestro común, sino varias
especies que comparten características adaptativas, pero descendiendo de
diferentes grupos de aves rapaces (Seibold &
Helbig, 1995)”.
La
subfamilia Buteoninae incluye alrededor de 55 especies actualmente
reconocidas. A diferencia de muchos linajes de la familia Accipitridae,
que parecían haberse originado en África o el sur de Asia, los Buteoninae
claramente se originaron en las Américas según los registros fósiles y las
distribuciones actuales de especies (más del 75% de las rapaces existentes de
este linaje se encuentran en las Américas) (Lerner et al.,
2008).
A su vez la
subfamilia Buteoninae pertenece al orden Accipitriformes, palabra
que significa con forma de halcón, ya que la palabra en latín para halcón es accipiter.
Se trata de un orden de aves que incluye la mayoría “pero no todas” las aves
rapaces diurnas, incluidos halcones (Accipitriformes), águilas, buitres
y milanos, pero no a los halcones Falconiformes. La confusión anterior
se debe a que las aves de presa en general no descienden de un ancestro común
único “igual que con los buitres”. Esta confusión de nomenclatura no es tan
grave en el idioma inglés donde los Accipitriformes reciben el nombre de
Hawks mientras que los Falconiformes recibe nombre de Falcons.
Y para completar, otro grupo de aves rapaces que no están tan directamente
relacionados ni con Accipitriforme ni con Falconiformes son los Buhos
(Strigiformes). Esas conclusiones han sido llevadas a cabo gracias a
estudios de ADN, bueno los cuales van en contra de nuestra tradición de agrupar
a todas las rapaces en un solo grupo, que como lo demuestra la información
genética sería un grupo artificial o como lo denominamos los biólogos polifilético
o artificial (Braun &
Kimball, 2021).
Regresando
al género Rupornis, recalcamos que éste sólo tiene una especie Rupornis magnirostris, pero es ampliamente diverso en cuanto a sus subespecies o razas
biológicas:
Las
subespecies y sus distribuciones son (Clements, 2007):
👉 R m griseocauda: encontrada en México (al sur de
Colima, Nuevo León y Tamaulipas, excepto Yucatán y Tabasco) al sur al noroeste
de Costa Rica y al oeste de Panamá (Chiriquí).
👉 R m conspectus: encontrada
en el sureste de México (Tabasco y península de Yucatán) y norte de Belice.
👉 R m gracilis: encontrada en
Cozumel e Isla Holbox, cerca de Yucatán (México).
👉 R m sinushonduri: encontrado
en la isla Bonacca y Roatán, frente a Honduras.
👉 R m petulans: encontrada en
el suroeste de Costa Rica y la vertiente del Pacífico del oeste de Panamá hasta
el río Tuira e islas adyacentes.
👉 R m alius: encontrada en San
José y San Miguel, en Islas de las Perlas (Golfo de Panamá).
👉 R m magnirostris: nominal,
encontrado en Colombia al sur del oeste de Ecuador, al este de Venezuela y las
Guayanas, y al sur de la Amazonía brasileña (río Madeira al este de la costa
atlántica).
👉 R m occiduus: encontrado en
el este de Perú, oeste de Brasil (sur del Amazonas, oeste del río Madeira) y
norte de Bolivia.
👉 R m saturatus: se encuentra
en Bolivia, a través de Paraguay y el suroeste de Brasil (suroeste de Mato Grosso)
hasta el oeste de Argentina (sur de La Rioja).
👉 R m nattereri: encontrado en
el noreste de Brasil al sur de Bahía.
👉 R m magniplumis: encontrada
en el sur de Brasil, norte de Argentina (Misiones) y Paraguay adyacente.
👉 R m pucherani: se encuentra
en Uruguay y el noreste de Argentina (al sur de la provincia de Buenos Aires).
Estas han
sido separadas con base en la coloración del plumaje y el tamaño corporal, el
cual es mayor en las subespecies que se encuentran en el sur del área de distribución.
La única subespecie reportada para Colombia es B. m. magnirostris (Rubiano, 2010).
16.2.2. Descripción
Este
pequeño gavilán de unos 38 cm tiene alas cortas y redondeadas. En adultos su dorso es de color
gris café, cabeza y pecho gris más claro, el resto de las partes inferiores son
blanquecinas barreteadas con café, cola gris con bandas negras e infracaudales
blancas (EAAB, 2021).
Figura 16.2.1 Rupornis magnirostris.
Los machos
son un 20 % más pequeños que las hembras, pero por lo demás los sexos son
similares (Ferguson-Lees
& Christie, 2001). En la mayoría de las subespecies,
la parte inferior del pecho y las partes inferiores tienen barras marrones y blancas,
y la cola tiene cuatro o cinco barras grises. Por lo general, se reconocen doce
subespecies y existe una variación significativa de plumaje entre ellas.
Dependiendo de la subespecie involucrada, el halcón de carretera es
principalmente marrón o gris. Es bastante común observar un toque de rufo (es
decir, un marrón rojizo claro) en las alas del ave, especialmente cuando se ve
en vuelo (Frisch & Frisch,
2005). Su llamada es un chillido
penetrante muy agudo. Los ojos de los gavilanes adultos son blanquecinos o
amarillos. Como sugiere su nombre específico (magni = grande; rostri
= pico), su pico es relativamente grande (Ferguson-Lees
& Christie, 2001).
Puede
confundirse con el Águila Barrada (Asturina nitida), pero esta se
diferencia porque es enteramente barrada debajo y sin rufo en las plumas
primarias. También se asemeja al Águila Migratoria (Buteo platypterus)
la cual es un poco más grande, con barrado más denso en el pecho, garganta
blanca y el dorso café grisáceo y no gris como en el Gavilán Caminero (Rubiano, 2010).
16.2.3. Hábitat y
comportamiento
El halcón del borde de la carretera es común en toda su área de distribución: desde México a través de América Central hasta la mayor parte de América del Sur al este de la cordillera de los Andes. Se encuentra desde la costa norte del Caribe de América del Sur hacia el sur hasta el noreste de Argentina.
Figura 16.2.2 Área de
distribución de Rupornis magnirostris.
Con la
posible excepción de las densas selvas tropicales, el halcón de la carretera
está bien adaptado a la mayoría de los ecosistemas en su área de distribución.
También es un ave urbana, y es posiblemente la especie de halcón más común que
se ve en varias ciudades a lo largo de su área de distribución, o quizás solo
la más llamativa, ya que se vuelve agresiva cuando anida y se ha registrado que
ataca a los humanos que pasan cerca del nido (Frisch &
Frisch, 2005; Gutiérrez, Vázquez, & Ros, 2016; J. F. M. Pereira, 2008).
Según la
empresa de acueducto de alcantarillado de Bogotá Colombia (EAAB, 2021), esta rapaz suele volar sobre
espejos de agua, pasto kikuyo (Pennisetum clandestinum) y áreas abiertas
(herbazales, juncales y canales) para llegar a las zonas boscosas. Se ha registrado en todos los
humedales principalmente perchando. Los mayores registros han sido tomados en
la franja terrestre sobre la cobertura arbórea nativa durante los traslados de
las cuadrillas de operarias y operarios a los puntos de mantenimiento, donde es
considerada una especie escasa.
16.2.4. Alimentación
La dieta
del halcón de la carretera consiste principalmente en insectos, escamosos y pequeños
mamíferos, como titíes comunes jóvenes y monos pequeños similares que son
cazados con bastante frecuencia donde están disponibles (Lyra-Neves,
Oliveira, Telino-Júnior, & Santos, 2007). También tomará pájaros pequeños.
En Bogotá suele verse volar en el sotobosque, donde captura aves, mamíferos y
reptiles (EAAB, 2021).
16.2.5. Reproducción
El nido es
una plataforma pequeña y compacta de palos, revestida con finas tiras de
corteza y hojas, a menudo colocada a una altura media en la horca de un árbol
que crece en el borde del bosque o en un segundo crecimiento. Los nidos en
Argentina están revestidos con líquenes (Usnea sulcata), y con
frecuencia se agregan materiales de hojas verdes durante los períodos de
incubación y cría. Los nidos rara vez se reacondicionan y reutilizan en años
sucesivos, y la mayoría de las parejas construyen nuevos nidos en diferentes árboles
en la próxima temporada. El tamaño de puesta varía de 1 a 3 huevos, con un
promedio de 1,92 huevos en todo el rango de la especie, y los huevos son de
color blanco opaco con marcas marrones. Bierregaard (1994) afirmó que el
período de incubación es de unos 37 días, comenzando con el primer huevo. En
Argentina, el período de cría es de unos 35 días (Global Raptor
Information Network, 2022).
Estatus y conservación
Por lo
general, esta es la rapaz más común y conspicua en toda su extensa área de
distribución, y su número está aumentando en muchas regiones a medida que se
despejan los hábitats principales. Categorizada como una especie de
"Preocupación menor" por BirdLife International (Global Raptor
Information Network, 2022).
11.1 Cormorán Neotropical
11.1.1. Taxonomía.
El cormorán neotrópico, cormorán oliváceo también
conocido como biguá, mbiguá, cormorán, cormorán negro, cuervo de mar, yeco,
pato yeco o marshelous, pato cuervo o patillo (Nannopterum
brasilianum) es un cormorán (clado Phalacrocoracidae) de tamaño
mediano. Hay al menos dos subespecies: N. b. mexicanum desde Nicaragua
hacia el norte y N. b. brasilianum más al sur. En Perú, el cormorán
neotrópical es utilizado por el pueblo Uru para la pesca.
Figura 11.1.1. Phalacrocorax
brasilianus
La especie fue documentada en 1658 por
Willem Piso después de viajes por Brasil. Esto formó la base para la
descripción y el nombre de la especie por Johann Friedrich Gmelin en 1789.
Muchos autores posteriores prefirieron usar el nombre Phalacrocorax
olivaceus basado en la descripción de Alexander von Humboldt de 1805 porque
la identidad de las aves de Piso se consideraba incierta. Más tarde, muchas
autoridades, como la Unión Estadounidense de Ornitólogos, comenzaron a usar Phalacrocorax
brasilianus después de que M. Ralph Browning argumentara que la descripción
y las pinturas de Piso se refieren al cormorán neotrópical (Browning, 1989).
Los cormoranes o clado Phalacrocoracidae
son una familia de aproximadamente 40 especies de aves acuáticas. Se han
propuesto varias clasificaciones diferentes de la familia, pero en 2021 el
Unión Internacional de Ornitólogos adoptó una taxonomía de consenso de siete
géneros (Kennedy & Spencer, 2014).
Los cormoranes son aves medianas a
grandes, con un peso corporal en el rango de 0.35 a 5 kilogramos y una envergadura
de 60 a 100 centímetros. La mayoría de las especies tienen plumas oscuras. El
pico es largo, delgado y en forma de gancho. Sus pies tienen membranas entre
los cuatro dedos. Todas las especies son comedores de peces, atrapando a la
presa zambulléndose desde la superficie. Son excelentes buceadores, y bajo el
agua se impulsan con sus pies con la ayuda de sus alas; Se ha descubierto que
algunas especies de cormoranes se sumergen a una profundidad de hasta 45
metros. Tienen alas relativamente cortas debido a su necesidad de un movimiento
económico bajo el agua y, en consecuencia, tienen los costos de vuelo más altos
de cualquier ave voladora (Elliott et al., 2013).
Los cormoranes anidan en colonias
alrededor de la costa, en árboles, islotes o acantilados. Son aves costeras más
que oceánicas, y algunas han colonizado aguas continentales. El antepasado
original de los cormoranes parece haber sido un ave de agua dulce. Se
distribuyen por todo el mundo, excepto en las islas del Pacífico central.
Los cormoranes tienen un plan corporal muy
antiguo, con pájaros similares que se remontan a la época de los dinosaurios.
De hecho, el ave moderna más antigua conocida, Gansus yumenensis (125 a
113 millones de años), tenía esencialmente la misma estructura (Wang et al., 2018), aunque no necesariamente sea el ancestro de estas aves,
tratándose de un caso de evolución convergente o paralela. Los detalles de la
evolución del cormorán son en su mayoría desconocidos. Incluso la técnica de
usar la distribución y las relaciones de una especie para averiguar de dónde
proviene, la biogeografía, generalmente muy informativa, no brinda datos muy
específicos para este grupo probablemente bastante antiguo y extenso. Sin
embargo, los parientes vivos más cercanos de los son las otras familias del
suborden Sulae (dardos, alcatraces y piqueros) que tienen una
distribución principalmente de Gondwana, el bloque supercontinental que alguna
vez agrupó a américa del sur con áfrica. Por lo tanto, al menos la diversidad
moderna de Sulae probablemente se originó en el hemisferio sur. La
evidencia filogenética indica que los cormoranes se separaron de sus parientes
más cercanos, los dardos también llamados aníngidos (clado Anhingidae),
durante el Oligoceno tardío que es una era geológica donde los dinosaurios ya
se habían extinto, lo que indica que la mayoría de las afirmaciones de
ocurrencias de cormoranes del Cretácico o Paleógeno temprano son probablemente
identificaciones erróneas.
11.1.2. Descripción
La biguá mide 64 cm de largo con una
envergadura de 100 cm. Los machos adultos pesan de 1.1 a 1.5 kg, las hembras
adultas de 50 a 100 g menos que el macho. Las aves de las poblaciones del sur
tienden a ser más grandes que las aves del norte. Es pequeño y delgado,
especialmente en comparación con el cormorán de doble cresta más grande y de
aspecto más pesado. Tiene una cola larga y con frecuencia mantiene su cuello en
forma de S. El plumaje de los adultos es principalmente negro, con un parche en
la garganta de color marrón amarillento. Durante la reproducción, aparecen
mechones blancos a los lados de la cabeza, hay filoplumas blancos dispersos a
los lados de la cabeza y el cuello, y el parche de la garganta desarrolla un
borde blanco. Las alas superiores son algo más grises que el resto del cuerpo.
Los juveniles son de color marrón.
11.1.3. Habitat y comportamiento
Se encuentra en los trópicos y subtrópicos
de América, desde el medio Río Grande y las costas del Golfo de Méjico y
California de los Estados Unidos al sur a través de México y América Central
hasta el sur de América del Sur, donde se le llama con el nombre indio de
biguá. También se reproduce en las Bahamas, Cuba y Trinidad. Se puede encontrar
tanto en las costas (incluidas algunas áreas de manglares) como en aguas
interiores. A diferencia de otros cormoranes, esta ave se puede ver a menudo
posada en cables. Esta ave es en gran parte un residente permanente, y algunas
aves vagan ocasionalmente hacia el norte en los meses más cálidos.
Figura 11.1.2. Distribución geográfica.
Es una especie que frecuenta espejos de
agua profundos y con abundantes peces y crustáceos. En el humedal
Juan amarillo de Tibabuyes se han registrado hasta 35 individuos, entre adultos
y juveniles, acicalándose en bordes del buchón (Eichhornia crassipes),
así como nadando, buceando, volando bajo y alimentándose de carpas (Cyprinus
carpio) y langostas de rio (Procambarus clarkii) que habitan allí (EAAB, 2021).
También se han registrado en los humedales
El Tunjo en tunjuelito, de Córdoba en Suba, de Jaboque en Engativá, de Tibanica
en Bosa y de Torca-Guaymaral de Suba-Usaquen, donde perchan en los árboles
secos o muertos para descansar y acicalarse. Algunos de
estos lugares son rutas que usan para llegar a espejos de aguas grandes y
profundas , lo que permite verlos en vuelo. Es de
aclarar que, era una especie de tierras bajas y ahora suele verse en algunos
espejos de agua del distrito. Es considerado, en las áreas de mantenimiento, como Escasa (EAAB, 2021).
11.1.4. Alimentación
Su dieta consiste principalmente en peces
pequeños, pero también come renacuajos, ranas e insectos acuáticos. La información
sobre sus presas es escasa, pero las aves del interior parecen alimentarse de
peces pequeños y abundantes en estanques y ensenadas protegidas, de menos de 10
cm de largo, con un peso individual de uno o dos gramos, como las especies de Poecilia
especialmente la aleta de vela molly Poecilia latipinna.
Este cormorán busca comida sumergiéndose bajo el agua, impulsándose con sus
patas. Sus inmersiones son breves, entre 5 y 15 segundos. También se sabe que
se alimenta en grupos, con varias aves batiendo el agua con sus alas para
empujar a los peces hacia las aguas poco profundas.
11.1.5. Reproducción y estatus de conservación
Los cormoranes neotrópicales son monógamos
y se reproducen en colonias. El nido es una plataforma de palos con una
depresión en el centro rodeada de ramitas y pasto. Se construye a pocos metros
sobre el suelo o el agua en arbustos o árboles. Se ponen hasta cinco huevos
calcáreos de color blanco azulado. La mayoría de las parejas ponen tres huevos,
pero el número medio de huevos es menos de dos. Los huevos pronto se tiñen del
nido. Ambos sexos incuban durante unos 25 a 30 días y ambos padres alimentan a
las crías hasta alrededor de la semana 11. Para la semana 12, son
independientes. Se cría una cría por año. Sus heces fecales son bastante ácidas,
por lo que pueden afectar negativamente los árboles donde anidan.
El estado de conservación de esta especie
se clasifica como de preocupación menor, debido a que esta especie tiene un
área de distribución extremadamente grande y, por lo tanto, no se acerca a los
umbrales de Vulnerable según el criterio del tamaño del área de distribución.
La tendencia de la población parece estar aumentando y, por lo tanto, la
especie no se acerca a los umbrales de Vulnerable según el criterio de tendencia
de la población. El tamaño de la población es extremadamente grande y, por lo
tanto, no se acerca a los umbrales de Vulnerable según el criterio del tamaño
de la población. Por estas razones, la especie se evalúa como de Preocupación
Menor (BirdLife International, 2022).
3.1 Zambullidor piquipintado
3.1.1. Taxonomía.
El zambullidor común (Podilymbus
podiceps) es una especie de la familia de aves acuáticas de los somormujos.
Debido a que el zampullín de Atitlán (Podilymbus gigas) se ha
extinguido, el zambullidor común es ahora el único miembro existente del género
Podilymbus (Ksepka, Balanoff,
Bell, & Houseman, 2013).
El zambullidor común se encuentra principalmente en estanques en todo el
continente americano. Otros nombres de esta ave incluyen: zampullín de pico
grueso, zaramagullón grande (en Cuba), zambullidor común (en Colombia), zambullidor
pico-anillado (en México), patico buzo (en Venezuela), zampullín pico grueso,
macá pico grueso (en Uruguay), o picurio (en Chile) etc.
El zambullidor común fue descrito por Carl
Linnaeus en la décima edición de su Systema Naturae en 1758 como Colymbus
podiceps (Linnaei, 1758). El nombre binomial se deriva del latín Podilymbus, ("pies
en las nalgas"). Fuera de su propio género, los parientes más cercanos
del zambullidor común son los somormujos pequeños del género Tachybaptus
(Christidis & Boles, 2008). La especie cuenta con tres subespecies:
👉 P. p podiceps,
América del Norte a Panamá y Cuba.
👉 P. p antillarum, Antillas Mayores y Menores.
👉 P. p antarcticus, América del Sur hasta el centro de Chile y Argentina.
Los somormujos son aves acuáticas
buceadoras del orden Podicipediformes (con forma de somormujo). Los
somormujos son aves de agua dulce ampliamente distribuidas, y algunas especies
también se encuentran en hábitats marinos durante la migración y el invierno.
También existen algunas especies no voladoras, sobre todo en lagos estables. El
orden contiene una sola familia, Podicipedidae, que incluye 22 especies
en seis géneros existentes. Aunque, superficialmente, se asemejan a otras aves
buceadoras como los patos, los colimbos y las fochas, están más estrechamente
relacionados con los flamencos, como lo respaldan los datos morfológicos,
moleculares y paleontológicos. Muchas especies son monógamas y son conocidas
por sus exhibiciones de cortejo, con la pareja realizando danzas sincronizadas
sobre la superficie del agua. Las aves construyen nidos vegetativos flotantes
donde ponen varios huevos.
Alrededor de un tercio de los somormujos
del mundo se enumeran en varios niveles de preocupaciones de conservación: las
mayores amenazas incluyen la pérdida de hábitat, la introducción de peces
depredadores invasivos y la caza furtiva humana. Como tal, tres especies se han
extinguido, incluyendo una especie que también habitaba los humedales
bogotanos, el zambullidor andino (Podiceps andinus) (Fjeldså, 1993, 1984).
3.1.2. Descripción
Los zambullidores comunes son pequeños, robustos y de cuello corto. Miden de 31 a 38 cm de largo, con una envergadura de 45 a 62 cm y pesan de 253 a 568 g (Muller & Storer, 1999). Los adultos poseen un pico de color blanquecino con una banda negra en la mitad y sus ojos son oscuros con presencia de un anillo ocular blanco. En plumaje del adulto en temporada reproductiva presenta garganta negra y el resto del cuerpo es café grisáceo, un poco más pálido en partes inferiores con plumas infracaudales y centro del abdomen blancos. Los jóvenes son similares al adulto en estado no reproductivo con estriado irregular en los lados de la cabeza (EAAB, 2021).
Figura 3.1.1. Podilymbus podiceps
Estos somormujos pueden confundirse con el
somormujo menor, aunque esa especie es mucho más pequeña y tiene un pico más
delgado. Otros somormujos de tamaño similar son muy distintos en el plumaje, es
decir, el somormujo orejudo y el somormujo cornudo. Ambas especies tienen un
plumaje nupcial mucho más colorido, con lados rojizos, crestas doradas a lo
largo del costado de la cabeza contra un color pizarroso contrastante (también
un cuello rojizo en los cuernundos); mientras que, en invierno, tanto los
somormujos orejudos como los cornudos están salpicados de color pizarra y crema
y tienen ojos rojos. Debido a los hábitos parecidos a los patos del zambullidor
común, algunos observadores inexpertos pueden confundirlo con un pato. Sin
embargo, los zambullidores comunes tienen una forma de pico muy diferente (más
corto, puntiagudo en la punta y aplanado a lo largo de los lados), además de
tener el cuello y el cuerpo más cortos que un pato.
3.1.3. Hábitat y comportamiento
Se encuentran más comúnmente en América
del Norte, América Central, el Caribe y América del Sur durante todo el año.
Durante la temporada de reproducción de verano, son más frecuentes en el
centro, norte y noreste de Canadá. Si viven en un área donde el agua se congela
en invierno, migrarán. Las aves migratorias generalmente se encuentran con aves
durante todo el año en septiembre y octubre. Migran de noche. La mayoría de las
aves migratorias parten en marzo o abril. Hacen apariciones ocasionales en
Europa y Hawái. En el Reino Unido, las visitas han sumado 45 avistamientos a
partir de 2019, apareciendo generalmente de octubre a enero. Un pájaro en
Inglaterra se reprodujo con un somormujo chico, produciendo crías híbridas. Es
el único somormujo registrado que ha visitado las Islas Galápagos (Gibbs, 1992).
Figura 3.1.1. Distribución
Se encuentran en humedales de agua dulce
con vegetación emergente. Ocasionalmente se encuentran en agua salada. Cuando
se reproducen, se encuentran en la vegetación emergente cerca de aguas
abiertas, y en el invierno se encuentran principalmente en aguas abiertas
debido a la falta de nidos que mantener. Pueden vivir cerca de los ríos, pero
prefieren las aguas tranquilas. Se pueden encontrar en elevaciones más altas
cuando migran. Se reproducirán en humedales restaurados y artificiales (J. P. Gibbs, 1992).
En el sistema de humedales de Bogotá se ha
evidenciado la presencia de parejas de zambullidores comunes alimentándose
cerca de la vegetación de buchón (Eichhornia crassipes) y en las raíces
de eneales y juncales, donde se acumulan los cardúmenes de peces nativos (Grundulus
bogotensis) e introducidos (Carassius auratus y Cyprinus carpio),
así como de cangrejo americano (Procambarus clarkii). Se considera una
especie escasa, aunque ha sido avistada en el humedal del salitre (EAAB, 2021)
Los zambullidores comunes rara vez vuelan.
Hacen una inmersión lenta con frecuencia, especialmente cuando están en
peligro, sumergiéndose a unos 6.1 metros o menos. Se sumergen durante unos 30
segundos y pueden moverse a un área más apartada del agua, permitiendo que solo
la cabeza sea visible para ver cómo se disipa el peligro. Esta frecuencia en el
buceo les ha valido la descripción de ser solitarios o tímidos por naturaleza.
También les ha valido apodos como "buceador del infierno". Pueden
atrapar aire en sus plumas, lo que controla su flotabilidad. Raramente pasan
tiempo en bandadas. Su cortejo incluye llamadas y a veces duetos. Los machos
mostrarán un comportamiento territorial si otro macho está en el borde de su
territorio, por lo que puede haber enfrentamientos rituales (J. P. Gibbs, 1992).
3.1.4. Alimentación
Se alimentan principalmente de
invertebrados acuáticos, y también de pequeños peces y anfibios (ranas,
renacuajos). Se sumergen para obtener comida. Sus picos les permiten triturar
crustáceos, como cangrejos de río. También pueden comer plantas. Se ha
demostrado que comen sus propias plumas, como otros somormujos, para ayudar en
la digestión (prevenir lesiones de huesos pequeños). También alimentarán con
sus plumas a sus crías (J. P. Gibbs, 1992).
3.1.5. Reproducción y estatus de conservación
Se reproduce en el centro-sur de Canadá, a
lo largo de los Estados Unidos, América Central, el Caribe y la zona templada
de América del Sur. Estos somormujos pueden poner hasta dos conjuntos de huevos
al año. Sus nidos se construyen sobre el agua, sus huevos se asientan en la
vegetación que reside en el agua. Los somormujos ponen entre tres y diez huevos
elípticos lisos de color blanco azulado y la hembra comienza el proceso de
incubación. Ambos padres los incuban durante unos 23 días, y la hembra se hace
cargo de las tareas de incubación hacia el final de ese período de tiempo.
Cubrirán el nido con material de anidación si tienen que dejarlo por un período
prolongado de tiempo (J. P. Gibbs, 1992).
Los somormujos jóvenes pueden abandonar el
nido dentro de un día de la eclosión. Son suaves al nacer. Se ve piel amarilla
entre el lore y la parte superior de la cabeza. No nadan bien y se mantienen
fuera del agua. Duermen sobre la espalda de sus padres. A las cuatro semanas
empiezan a nadar. Cuando se les alerta, se suben a la espalda de un somormujo
padre y eventualmente maduran para sumergirse bajo el agua como sus padres.
Ambos padres comparten el papel de criar a los jóvenes, tanto alimentarlos como
llevarlos a la espalda. A veces, los padres se sumergen bajo el agua para conseguir
comida con los polluelos sobre sus espaldas (J. P. Gibbs, 1992).
Son extremadamente sensibles a las
perturbaciones, especialmente por parte de los humanos. Mientras se reproducen,
si tienen miedo, los adultos pueden abandonar sus nidos sin proteger los
huevos. Las olas de los barcos pueden destruir los nidos y sus sonidos asustan
fácilmente a las aves. La pérdida de hábitat es la mayor amenaza del somormujo.
El drenaje, relleno y destrucción general de los humedales provoca una pérdida
en sus hábitats de reproducción (J. P. Gibbs, 1992). Sin embargo, siguen siendo comunes en la mayoría de sus áreas de
distribución, aunque en Bogotá son una especie extremadamente rara.
4.1 Paloma doméstica
4.1.1. Taxonomía.
La paloma bravía, paloma asiática bravía,
paloma asiática doméstica, paloma de las rocas o paloma común (Columba
livia) es un miembro de la familia de aves Columbidae
o simplemente las palomas. En el uso común, a menudo se la conoce simplemente
como la "paloma". De esta especie desciende la paloma doméstica (Columba
livia domestica, que incluye unas 1000 razas diferentes).
Las palomas asilvestradas son de color
gris pálido con dos barras negras en cada ala, mientras que las palomas
domésticas y las verdaderamente salvajes varían en color y diseño. Se observan
pocas diferencias entre machos y hembras. La especie es generalmente monógama,
con dos pichones (jóvenes) por nidada. Ambos padres cuidan de los jóvenes por
un tiempo (Johnston, 1992; Wendell, 1977).
Figura 4.1.1. Paloma doméstica
Los hábitats incluyen varios ambientes
abiertos y semiabiertos. Los acantilados y salientes rocosos se utilizan para
posarse y reproducirse en la naturaleza. Las palomas, que originalmente se
encontraban en estado salvaje en Europa, el norte de África y el oeste de Asia,
se han establecido en ciudades de todo el mundo. La especie es abundante, con
una población estimada de 17 a 28 millones de aves salvajes y asilvestradas
solo en Europa y hasta 120 millones en todo el mundo (BirdLife International, 2019).
El nombre común oficial es paloma bravía. La
paloma bravía fue descrita formalmente en 1789 por el naturalista alemán Johann
Friedrich Gmelin en su edición revisada y ampliada de Systema Naturae de
Carl Linnaeus. Lo colocó con todas las demás palomas del género Columba
y acuñó el nombre binomial Columba livia (Dlamini, 2020). El nombre del género Columba es la palabra latina que
significa "paloma", [cuya etimología más antigua proviene del griego
antiguo κόλυμβος (kolumbos), "buceador (Liddell & Scott, 1961). Aristófanes y otros usan la palabra κολυμβίς (kolumbis),
"buceador", para el nombre del ave, debido a su movimiento semejante
al de natación en el aire. El epíteto específico livia es una variante
latina medieval de livida , "color gris azulado". Los
polluelos de paloma se llaman "pichones". Tenga en cuenta que los
miembros del género de palomas Petrophassa,
menos conocido, y la paloma moteada (Columba
guinea), también tienen el nombre común de "paloma bravía". La
paloma bravía fue fundamental para el desarrollo del modelo evolutivo de
Charles Darwin y apareció en cuatro de sus obras entre 1859 y 1872. Darwin
postuló que, a pesar de las amplias diferencias morfológicas, los muchos
cientos de razas de palomas domésticas se remontaban al paloma bravía; en
esencia, la selección humana de razas de palomas era análoga a la selección
natural (Darwin, 1866).
Se han descrito 12 subespecies distribuidas
alrededor del mundo (D. Gibbs, Barnes, & Cox, 2010).
👉 La paloma bravía europea (Columba
livia livia) - La subespecie nominal; Se encuentra en el oeste y el sur
de Europa, el norte de África y Asia hasta el oeste de Kazajstán, el norte del
Cáucaso, Georgia, Chipre, Turquía, Irán e Irak.
👉 La paloma bravía india (Columba
livia intermedia) (Strickland, 1844): se encuentra en Sri Lanka y en la
India hasta el sur de la cordillera del Himalaya de Columba.
👉 La paloma bravía egipcia (Columba
livia schimperi) (Bonaparte, 1854) – Encontrada en el delta del Nilo
desde el sur hasta el norte de Sudán.
👉 La paloma bravía de Senegal (Columba
livia gymnocyclus) (Gray, 1856) – Se encuentra desde Senegal y Guinea hasta
Ghana, Benin y Nigeria, es más pequeña y mucho más oscura que la subespecie
nominal. Es casi negruzco en la cabeza, la rabadilla y las partes inferiores
con el dorso blanco y la iridiscencia de la nuca se extiende hasta la cabeza.
👉 Paloma bravía de Hume (Columba
livia negligencia) (Hume, 1873): se encuentra en las montañas del este
de Asia Central, es similar a la subespecie nominal en tamaño pero más oscura,
con un brillo iridiscente más fuerte y más extenso en el cuello. Se integra con
la siguiente subespecie en el sur.
👉 La paloma bravía iraní (Columba
livia gaddi) (Zarodney & Loudoni, 1906) – Se reproduce desde
Azerbaiyán e Irán al este hasta Uzbekistán. Es más grande y más pálido que
Columba livia palaestinae, con la que se integra en el oeste. También se
integra con la siguiente subespecie en el este.
👉 La paloma bravía de Mongolia (Columba
livia nigricans) (Buturlin, 1908) – Encontrada en Mongolia y el norte
de China, es una subespecie variable y probablemente se deriva de palomas
salvajes.
👉 La paloma bravía árabe (Columba
livia palaestinae) (Zedlitz, 1912) – Desde Siria hasta el Sinaí y
Arabia, es un poco más grande que Columba livia schimperi y tiene un plumaje
más oscuro.
👉 Paloma bravía canaria ( Columba
livia canariensis ) (Bannerman, 1914) – Se encuentra en las Islas
Canarias, es más pequeña y generalmente más oscura que la subespecie nominal.
👉 La paloma bravía del Sahara (Columba
livia targia) (Geyr von Schweppenburg, 1916) – Se reproduce en las
montañas del Sahara al este de Sudán. Es un poco más pequeño que la subespecie
nominal, con un plumaje similar, pero el dorso es del mismo color que el manto
en lugar de blanco.
👉 La paloma bravía del oasis (Columba
livia dakhlae) (Richard Meinertzhagen, 1928): se encuentra solo en dos
oasis en el centro de Egipto, es más pequeña y mucho más pálida que la
subespecie nominal.
👉 La paloma bravía de Cabo Verde (Columba
livia atlantis) (Bannerman, 1931) – Encontrada en Madeira, las Azores y
Cabo Verde, es una subespecie muy variable con partes superiores a cuadros que
oscurecen las barras negras de las alas y es casi seguro que se deriva de
palomas salvajes.
4.1.2. Descripción
Siglos de domesticación han alterado mucho
a la paloma bravía. Las palomas salvajes, que han escapado a la domesticación a
lo largo de la historia, tienen variaciones significativas en el plumaje.
Cuando no se especifica, las descripciones son para el tipo salvaje supuesto,
aunque el tipo salvaje puede estar al borde de la extinción o ya extinguido.
El adulto de la subespecie nominal de la
paloma bravía mide de 29 a 37 cm de largo con una envergadura de 62 a 72 cm. El
peso de las palomas silvestres o salvajes varía de 238 a 380 g, aunque los
individuos domésticos y semidomésticos sobrealimentados pueden superar los
pesos normales. Tiene la cabeza, el cuello y el pecho de color gris azulado
oscuro con una iridiscencia brillante de color amarillento, verdoso y púrpura
rojizo a lo largo del cuello y las plumas de las alas. El iris es de color
naranja, rojo o dorado con un anillo interior más pálido, y la piel desnuda
alrededor del ojo es de color gris azulado. El pico es gris-negro con una
conspicua cera blanquecina, y las patas son de color rojo púrpura. Entre las
medidas estándar, la cuerda del ala suele ser de alrededor de 22.3 cm, la cola
es de 9.5 a 11 cm, el pico es de alrededor de 1.8 cm y el tarso es de 2.6 a 3.5
cm.
La hembra adulta es casi idéntica en
apariencia externa al macho, pero la iridiscencia en su cuello es menos intensa
y más restringida a la parte trasera y los costados, mientras que la del pecho
es a menudo muy oscura; y el cuello y pecho son menos voluminosos. La parte
inferior de la espalda blanca de la paloma bravía pura es su mejor
característica de identificación; las dos barras negras en sus alas de color
gris pálido también son distintivas. La cola tiene una banda negra en el
extremo y la red exterior de las plumas de la cola está bordeada de blanco.
Cuando vuela en círculos sobre su cabeza,
la parte inferior de las alas blancas del ave se vuelve llamativa. Aunque es un
volador relativamente fuerte, también se desliza con frecuencia, manteniendo
sus alas en una forma de V muy pronunciada mientras lo hace. Cuando se las
molesta, una paloma dentro de una bandada despegará con un ruidoso sonido que
indicará a otras palomas que tomen vuelo. El ruido del despegue aumenta cuanto
más rápido una paloma bate sus alas, anunciando así la magnitud de una amenaza
percibida para sus compañeros de bandada.
Las palomas salvajes son esencialmente del
mismo tamaño y forma que la paloma bravía original, pero a menudo muestran una
variación mucho mayor en color y patrón en comparación con sus antepasados
salvajes. El patrón de barras azules que muestra la paloma bravía salvaje
original es generalmente menos común en áreas más urbanas. Las palomas urbanas
tienden a tener un plumaje más oscuro que las de las zonas más rurales.
La esperanza de vida de una paloma bravía
varía de 3 a 5 años en la naturaleza a 15 años en cautiverio, aunque se han
informado especímenes más longevos. Las principales causas de mortalidad en la
naturaleza son los depredadores y la persecución por parte de los humanos.
4.1.3. Habitat y comportamiento
Antes del Intercambio Colombino, las
palomas bravías estaban restringidas a un rango de residencia natural en el
oeste y el sur de Europa, el norte de África y se extendían hasta el sur de
Asia. Fueron llevados al Nuevo Mundo a bordo de barcos europeos entre 1603 y
1607. La especie (incluidos los salvajes) tiene un amplio rango, con una
extensión global estimada de ocurrencia de 10 000 000 km2 (3 900 000 millas
cuadradas). Tiene una gran población mundial, que incluye entre 17 y 28
millones de individuos en Europa. La evidencia fósil sugiere que la paloma
bravía se originó en el sur de Asia, y los restos óseos, desenterrados en
Israel, confirman su existencia allí durante al menos 300 000 años. Sin
embargo, esta especie tiene una historia tan larga con los humanos por lo que
es imposible identificar exactamente su área de distribución original.
Figura 4.1.2. Distribución mundial de la
paloma doméstica.
Las palomas salvajes residen en
formaciones rocosas y paredes de acantilados, de allí el nombre paloma de las
rocas, asentándose en grietas para anidar. Anidan en comunidad, a menudo
formando grandes colonias de muchos cientos de individuos. Los sitios de anidación
silvestres incluyen cuevas, cañones y acantilados marinos. Incluso vivirán en
el Sahara siempre que un área tenga rocas, agua y algo de materia vegetal.
Prefieren evitar la vegetación densa.
Las palomas bravías tienen una relación
comensal con los humanos, obteniendo un amplio acceso a la comida y lugares de
anidación en áreas civilizadas. Las estructuras humanas proporcionan una
excelente imitación de las estructuras de los acantilados, lo que hace que las
palomas bravías sean muy comunes alrededor de las viviendas humanas. Los
rascacielos, los pasos elevados de las carreteras, los edificios agrícolas, los
edificios abandonados y otras estructuras humanas con amplias grietas son
propicias para la anidación de la paloma bravía. Por lo tanto, el área de distribución
moderna de la paloma bravía se debe en gran parte a los humanos. Prefieren los
asentamientos agrícolas a los arbolados. Los atributos ideales de anidación
humana combinan áreas con edificios altos, espacios verdes, amplio acceso a
alimentos humanos y escuelas. Por el contrario, las áreas suburbanas que están
lejos del centro de la ciudad y tienen una alta densidad de calles son las
menos propicias para las palomas. Pueden dañar estas estructuras a través de
sus heces; las aves hambrientas solo pueden excretar uratos, que con el tiempo
corroe la mampostería y el metal. Por el contrario, un ave bien alimentada
expulsa heces en su mayoría sólidas, que contienen solo pequeñas cantidades de
ácido úrico.
En los humedales del Distrito Capital de
Bogotá Colombia, estas palomas suelen verse asociadas a las obras de
infraestructura y canales, realizando actividades de percha, vocalizando, en
vuelo o forrajeando. Es una especie que permanece en bandadas grandes de hasta 60
individuos. El macho, al momento de realizar su cortejo, mueve la cabeza
adelante y atrás de dos a tres veces, luego da una vuelta en su sitio para
llamar la atención de la hembra y ostentar la iridiscencia de su cuello. A
pesar de ser una especie cosmopolita introducida y que frecuenta zonas urbanas,
en las áreas de mantenimiento es considerada como rara debido a la competencia
natural con otras aves (EAAB, 2021).
4.1.4. Alimentación
Las palomas bravías son omnívoras,
pudiendo comer insectos y arañas, pero prefieren materia vegetal:
principalmente frutas y granos. La comida adicional también suele estar
disponible en los contenedores de basura, los turistas o los residentes que
alimentan a las palomas con alpiste por razones como empatía, diversión,
tradición y como un medio para la interacción social. Las palomas tienden a congregarse
en bandadas grandes, a menudo densas, cuando se alimentan de alimentos
desechados, y se las puede observar volando hábilmente alrededor de árboles,
edificios, postes y cables telefónicos e incluso a través del tráfico en
movimiento solo para llegar a una fuente de alimento.
4.1.5. Reproducción y estatus de conservación
La paloma bravía se reproduce en cualquier
época del año debido a la capacidad de segregar leche de buche. Los sitios de
anidación se encuentran a lo largo de los acantilados costeros, así como en los
acantilados artificiales creados por edificios de apartamentos con salientes
accesibles o espacios en el techo. Las palomas pueden competir con las aves
nativas por los sitios de anidación. Para algunas especies de aves, como las
aves marinas, podría ser un problema de conservación, por lo que son
consideradas especie invasora. La evidencia actual sugiere que las palomas
silvestres, domésticas y asilvestradas se aparean de por vida, aunque sus lazos
a largo plazo no son inquebrantables. Son socialmente monógamos, pero se
producen apareamientos fuera de la pareja, a menudo iniciados por los machos.
Las palomas se reproducen cuando el suministro de alimentos es lo
suficientemente abundante como para apoyar el desarrollo del huevo embrionario,
que en las ciudades puede ocurrir en cualquier época del año. La puesta de
huevos puede tener lugar hasta seis veces al año.
Los rituales de cortejo se pueden observar
en los parques urbanos en cualquier época del año. El macho en el suelo o en
los tejados hincha las plumas de su cuello para parecer más grandes y así
impresionar o llamar la atención. Se acerca a la hembra a un paso rápido
mientras emite notas tranquilas repetitivas, a menudo haciendo una reverencia y
girándose a medida que se acerca. Al principio, la hembra invariablemente
camina o vuela una corta distancia y el macho la sigue hasta que se detiene. En
este punto, continúa con el movimiento de reverencia y muy a menudo hace medias
o completas piruetas frente a la hembra. Luego, el macho procede a alimentar a
la hembra regurgitando la comida, como lo hacen cuando alimentan a las crías.
El apareamiento es muy breve, con el macho batiendo sus alas para mantener el
equilibrio encima de la hembra.
El nido es una plataforma endeble de paja
y palos, colocada sobre una repisa, cubierta, a menudo en los alféizares de las
ventanas de los edificios. Se ponen dos huevos blancos; la incubación,
compartida por ambos padres, dura de 17 a 19 días. El pichón recién nacido
tiene el plumón de color amarillo pálido y el pico de color carne con una banda
oscura. Durante los primeros días, los pichones son cuidados y alimentados (a
través de la regurgitación) exclusivamente con "leche de buche"
(también llamada "leche de paloma”). La leche de paloma se produce en los
buches de ambos progenitores en todas las especies de paloma. El período de
emplumamiento es de unos 30 días.
4.1.6. Vectores de enfermedades
El contacto con los excrementos de las
palomas presenta un riesgo menor de contraer histoplasmosis, criptococosis y
psitacosis y la exposición a largo plazo tanto a los excrementos como a las
plumas puede inducir una alergia conocida como pulmón del criador de aves. Las
palomas no son una preocupación importante en la propagación del virus del Nilo
Occidental: aunque pueden contraerlo, aparentemente no lo transmiten.
Algunas infecciones son transmitidas por
palomas; por ejemplo, la bacteria Chlamydophila
psittaci es endémica entre las palomas y causa psitacosis en humanos. En
los humanos, los síntomas son fiebre, artralgia, conjuntivitis, diarrea,
epistaxis, escalofríos, leucopenia, y en algunos casos puede llegar a
neumonía. En las aves, los síntomas incluyen falta de apetito, apariencia
desgreñada, secreción ocular o nasal y diarrea. Las aves pueden morir a raíz de
esta enfermedad. Ciertas aves pueden excretar el microorganismo, aun cuando no
presenten síntomas. Generalmente se transmite por el manejo de palomas o sus
excrementos (más comúnmente este último). La psitacosis es una enfermedad grave
pero rara vez mortal (menos del 1% de los casos). Las palomas también son
vectores importantes de varias especies de la bacteria Salmonella, que
causa enfermedades como la salmonelosis y la fiebre paratifoidea.
También se sabe que las palomas albergan
ácaros aviares, que pueden infestar viviendas humanas y morder a los humanos,
una condición conocida como gammasidosis. Sin embargo, la infestación de
mamíferos es relativamente rara.
6.1 El chulo o buitre negro
6.1.1. Taxonomía.
El buitre negro (Coragyps atratus),
también conocido como buitre negro americano, buitre mexicano, zopilote, urubú,
chulo o gallinazo, es un ave de la familia de los buitres del Nuevo Mundo cuya
distribución se extiende desde el noreste de Estados Unidos hasta Perú, Chile
central y Uruguay. Aunque es una especie común y extendida, tiene una
distribución algo más restringida que el buitre pavo (Cathartes aura),
que se reproduce bien en Canadá y al sur de Tierra del Fuego. Es el único
miembro existente del género Coragyps, que pertenece a la familia Cathartidae.
El naturalista estadounidense William
Bartram escribió sobre el buitre negro en su libro de 1791 Los viajes de
Bartram, llamándolo Vultur atratus "buitre negro" o
"cuervo carroñero" (Bartram, 2021). El trabajo de Bartram ha sido rechazado con fines de nomenclatura
por la Comisión Internacional de Nomenclatura Zoológica ya que el autor no usó
consistentemente el sistema de nomenclatura binomial. El ornitólogo alemán
Johann Matthäus Bechstein describió formalmente la especie usando el mismo
nombre en 1793 en su traducción de A General Synopsis of Birds de John
Latham (Bechstein, 1793). El nombre común "buitre" se deriva de la palabra latina
vulturus, que significa "desgarrador" y es una referencia a
sus hábitos alimenticios . El nombre de la especie, ātrātus, significa
"vestido de negro", del latín āter 'negro opaco' (Simpson, 1977). "Buitre negro" ha sido designado como el nombre oficial
por la Unión Internacional de Ornitólogos (COI) (Birds, n.d.).
Figura 6.1.1. Coragyps
atratus.
Desde el Pleistoceno temprano hasta el
final, una especie prehistórica de buitre negro , C. occidentalis ,
conocida como buitre negro del Pleistoceno, se encontraba en todo el rango de
la especie actual. Esta ave no se diferenciaba mucho del buitre negro actual
excepto en el tamaño; era entre un 10% y un 15% más grande y tenía un pico
relativamente más plano y más ancho (Fisher, 1944). Llenó un nicho ecológico similar al su versión moderna, pero se
alimentaba de animales más grandes (Hertel, 1995).
Nuestra expresión
“buitre” hace referencia a dos linajes que han evolucionado paralelamente al
interior del orden de los Accipitriformes, que también incluye
a las demás aves rapaces diurnas como águilas, halcones, pájaros secretarios,
águilas pescadoras, buitres del viejo mundo y buitres del nuevo mundo. Según el
modelo taxonómico moderno, el ancestro de todas las rapaces diurnas probablemente
fue un ave de presa con hábitos carroñeros facultativos, de los cuales se
distinguiesen dos ramas principales, los que conllevarían al primer linaje de
buitres y el linaje de las demás aves de presa. Los buitres del nuevo mundo se
clasifican en la familia de catartidos “Cathartidae” que proviene de la
palabra griega, limpiadores, porque los buitres hacen eso precisamente, limpiar
los ecosistemas de las carcasas de mamíferos grandes muertos (M. O. Campbell,
2015; Ericson, 2012; Mahmood, 2015; Ranciaro et al., 2014; Salthe, 2013;
Seibold & Helbig, 1995)
El otro gran grupo de
buitres evolucionó al interior del linaje de las aves de presa diurnas, siendo
evolutivamente más cercanos a las águilas y halcones que a los buitres del
nuevo mundo. Al interior de la familia Accipitridae de aves de
presa diurnas, los buitres del viejo mundo han evolucionado varias veces de
forma convergente y paralela, desde ancestros con hábitos duales de depredador
y carroñero. Los linajes principales son Gypaetinae que son
especies más cercanamente emparentadas con los halcones de tamaño medio de la
subfamilia Perninae. Mientras que los demás grupos de buitres que
no son monofiléticos tampoco están más cercanamente emparentados con las
águilas verdaderas de la familia Aquilinae (Campbell, 2014,
2015; Ericson, 2012; Mahmood, 2015; Salthe, 2013; Seibold & Helbig, 1995).
Figura 6.1.2.
Destinados a existir siendo feos y despreciados por los humanos, no
podríamos vivir sin ellos. Los buitres del viejo mundo habitan en Eurasia
y África, mientras que los del nuevo mundo habitan en las américas, el más
grande es el cóndor de los Andes Vultur gryphus
En resumen, los
buitres han evolucionado varias veces desde un mismo grupo de aves semejantes
para especializarse en el consumo de carne en descomposición “aunque
facultativamente algunas especies pueden retornar a hábitos predatorios”, para
ello han creado algunas adaptaciones importantes como la perdida de plumaje en
la cabeza, que es su rasgo más distintivo.
El hecho que como
público general sepamos tan poco de los buitres y los veamos como una cosa
aberrante y despreciable relata un aspecto importante de nuestra percepción y
simbolización arbitraria de la naturaleza, las águilas se llevan toda la gloria
como emblemas nacionales, de la guerra y la sabiduría militar, mientras que las
palomas son un símbolo de belleza, paz y del espíritu humilde de Dios. Los
buitres son considerados vividores aprovechados de la desgracia ajena, a pesar
de que juegan un valor importante para los ecosistemas y para la vida humana.
La importancia del
despreciado y feo solo se hace evidente cuando desaparecen, sin el servicio de
limpieza que realizan los buitres, las carcasas de los mamíferos muertos se
acumulan en los ecosistemas, atrayendo a depredadores con hábitos oportunistas
mucho más molestos como las ratas, artrópodos y perros salvajes, todos ellos
con mayores probabilidades de transmitir enfermedades peligrosas a las
sociedades humanas. Esto se ha hecho evidente especialmente en la India donde
muchas especies de buitres se encuentran en vías de extinción (Buechley
& Sekercioglu, 2016; Demos, 2013; Kanaujia & Kushwaha, 2013; Ogada,
Keesing, & Virani, 2012).
6.1.2. Descripción.
El buitre negro es un carroñero bastante
grande, mide de 56 a 74 cm de largo, con una envergadura de 1.33 a 1.67 m. El
peso de los buitres negros de América del Norte y los Andes varía de 1.6 a 3 kg,
pero en los buitres más pequeños de las tierras bajas tropicales es de 1.18 a 1.94
kg. El ala mide de 38.6 a 45 cm, la cola más corta mide de 16 a 21 cm y el
tarso relativamente largo mide de 7 a 8.5 cm. Su plumaje es principalmente
negro brillante. La cabeza y el cuello no tienen plumas y la piel es de color
gris oscuro y arrugado. El iris del ojo es marrón y tiene una sola fila
incompleta de pestañas en el párpado superior y dos filas en el párpado
inferior. Las patas son de color blanco grisáceo, mientras que los dos dedos
delanteros del pie son largos y tienen pequeñas membranas en sus bases (Cornell University, 2017).
Las fosas nasales no están divididas por
un tabique, sino que están perforadas; de lado se puede ver a través del pico.
Las alas son anchas pero relativamente cortas. Las bases de las plumas
primarias son blancas, produciendo una mancha blanca en la parte inferior del
borde del ala, que es visible en vuelo. La cola es corta y cuadrada, apenas
sobrepasando el borde de las alas plegadas (Cornell University, 2017).
6.1.3. Distribución y hábitat
El buitre negro tiene una distribución
Neártica y Neotrópical (es decir abarca el continente americano de sur a norte).
Su área de distribución incluye los estados del Atlántico medio, las regiones
más al sur del medio oeste de los Estados Unidos, el sur de los Estados Unidos,
México, América Central y la mayor parte de América del Sur (Cornell University, 2017).
Figura 6.1.3. Distribución.
Por lo general, es un residente permanente
en toda su área de distribución, aunque las aves en el extremo norte de su área
de distribución pueden migrar distancias cortas y otras a lo largo de su área
de distribución pueden experimentar movimientos locales en condiciones
desfavorables. En América del Sur, su área de distribución se extiende hasta
Perú, el centro de Chile y Uruguay. También se encuentra como vagabundo en las
islas del Caribe. Prefiere terrenos abiertos intercalados con áreas de bosques
o maleza. También se encuentra en bosques húmedos de tierras bajas, matorrales
y pastizales, humedales y pantanos, pastizales y antiguos bosques muy
degradados. Prefiriendo las tierras bajas, rara vez se ve en las zonas
montañosas. Por lo general, se lo ve volando o posado en postes de cercas o
árboles muertos (Cornell University, 2017).
El gallinazo negro o chulo se puede
observar en Bogotá, sobrevolando y alimentándose en zonas abiertas y
semiabiertas como humedales, parques y cerca de rellenos sanitarios, o
descansando en diferentes tipos de infraestructura urbana. Es una especie común
en Colombia.
6.1.4. Comportamiento
El buitre negro vuela alto en busca de
comida, manteniendo sus alas en posición horizontal cuando se desliza. Aletea
en ráfagas cortas que son seguidas por períodos cortos de planeo. Su vuelo es
menos eficiente que el de otros buitres, ya que las alas no son tan largas,
formando un área alar más pequeña (Fergus, 2003). En comparación con el buitre pavo, el buitre negro bate sus alas
con más frecuencia durante el vuelo. Se sabe que regurgita “vomita la comuda de
manera controlada” cuando se le molesta, lo que ayuda a disuadir a los
depredadores y a emprender el vuelo al disminuir su peso de despegue.
Como todos los buitres del Nuevo Mundo, el
buitre negro a menudo defeca sobre sus propias patas, usando la evaporación del
agua en las heces y/o la orina para refrescarse, un proceso conocido como
urohidrosis (Feduccia, 1999). Enfría los vasos sanguíneos de los tarsos y las patas sin plumas,
y hace que el ácido úrico blanco raye las patas. Debido a que carece de
siringe, el buitre negro, al igual que otros buitres del Nuevo Mundo, tiene muy
pocas capacidades de vocalización. Generalmente es silencioso, pero puede
emitir silbidos y gruñidos cuando está agitado o mientras se alimenta. El
buitre negro es gregario y se posa en grandes grupos. En zonas donde sus áreas
de distribución se superponen, el buitre negro se posará en las ramas desnudas
de los árboles muertos junto a grupos de buitres pavo.
Al igual que el buitre de pavo, este
buitre se ve a menudo de pie en una postura con las alas extendidas. Se cree
que la postura cumple múltiples funciones: secar las alas, calentar el cuerpo y
eliminar las bacterias. Este mismo comportamiento lo muestran otros buitres del
Nuevo Mundo, buitres del Viejo Mundo y cigüeñas.
6.1.5. Alimentación
En entornos naturales, el buitre negro se
alimenta principalmente de carroña (Buechley & Sekercioglu, 2016). En áreas pobladas por humanos, puede hurgar en los vertederos de
basura, pero también toma huevos, frutas (tanto maduras como podridas),
pescado, estiércol y material vegetal maduro/en descomposición y puede matar o
lesionar a mamíferos recién nacidos o incapacitados. Al igual que otros
buitres, desempeña un papel importante en el ecosistema al deshacerse de la
carroña que, de lo contrario, sería un caldo de cultivo para las enfermedades (M. O. Campbell, 2015; Kanaujia
& Kushwaha, 2013; Ogada, Keesing, & Virani, 2012).
El buitre negro localiza el alimento a
simple vista o siguiendo a los buitres del Nuevo Mundo del género Cathartes
hasta los cadáveres. Estos buitres —el buitre pavo, el buitre cabeciamarillo
menor y el buitre cabeciamarillo mayor— se alimentan al detectar el olor del
etil mercaptano, un gas producido por el comienzo de la descomposición en
animales muertos (Muller-Schwarze, 2006). Su mayor capacidad para detectar olores les permite buscar
carroña debajo del dosel del bosque.
El buitre negro también se alimenta
ocasionalmente de ganado o ciervos. Es la única especie de buitre del Nuevo
Mundo que se alimenta del ganado. Ocasionalmente acosa a las vacas que están
dando a luz, pero principalmente se alimenta de terneros recién nacidos, así
como de corderos y lechones (Avery & Cummings, 2004). En sus primeras semanas, un ternero permitirá que los buitres se
le acerquen. Los buitres enjambran al ternero en grupo, luego picotean los ojos
del ternero, o la nariz o la lengua. El ternero luego entra en estado de shock
y es asesinado por los buitres (García-Alfonso, van Overveld,
Gangoso, Serrano, & Donázar, 2020).
A veces se han observado buitres negros
quitando y comiendo garrapatas de capibaras (Sazima, 2007) descansando y tapires de
Baird (Tapirus bairdii) (Coulson, Rondeau, & Caravaca,
2018). Se
sabe que estos buitres matan crías de garzas y aves marinas en las colonias de
anidación y se alimentan de patos domésticos, pájaros pequeños, zorrillos,
zarigüeyas, otros mamíferos pequeños, lagartijas, serpientes pequeñas, tortugas
jóvenes e insectos. Al igual que otras aves de hábitos carroñeros, el buitre
negro presenta resistencia a los microorganismos patógenos y sus toxinas.
Muchos mecanismos pueden explicar esta resistencia. Los agentes antimicrobianos
pueden ser secretados por el hígado o el epitelio gástrico, o producidos por
microorganismos de la microbiota normal de la especie (Carvalho et al., 2003).
6.1.6. Reproducción
El momento de la temporada de reproducción
de los buitres negros varía según la latitud en la que viven. En los Estados
Unidos, las aves de Florida comienzan a reproducirse en enero, por ejemplo,
mientras que las de Ohio generalmente no comienzan antes de marzo. En América
del Sur, las aves argentinas y chilenas comienzan a poner huevos desde
septiembre, mientras que las que se encuentran más al norte del continente
suelen esperar hasta octubre. Algunos en América del Sur se reproducen incluso
más tarde: los buitres negros en Trinidad generalmente no comienzan hasta
noviembre, por ejemplo, y los de Ecuador pueden esperar hasta febrero. Las
parejas se forman siguiendo un ritual de cortejo que se realiza en el suelo:
varios machos rodean a una hembra con las alas parcialmente abiertas mientras
se pavonean y menean la cabeza. A veces realizan vuelos de cortejo, buceando o
persiguiéndose unos a otros sobre el sitio elegido para anidar .
El buitre negro pone sus huevos en el
suelo en un área boscosa, un tronco hueco o alguna otra cavidad, rara vez a más
de 3 m sobre el suelo. Si bien por lo general no usa ningún material para
anidar, puede decorar el área alrededor del nido con trozos de plástico de
colores brillantes, fragmentos de vidrio u objetos metálicos como tapas de
botellas. El tamaño de puesta es generalmente de dos huevos, aunque esto puede
variar de uno a tres. El huevo es ovalado y mide en promedio 7.56 cm × 5.09 cm.
El caparazón liso, de color gris verdoso, azulado o blanco, está manchado o
manchado de forma variable con lavanda o marrón pálido alrededor del extremo
más grande.
Ambos padres incuban los huevos, que
eclosionan después de 28 a 41 días. Al nacer, las crías están cubiertas de un
plumón beige, a diferencia de los polluelos de buitre de pavo que son blancos.
Ambos padres alimentan a los polluelos, regurgitando la comida en el sitio del
nido. Las crías permanecen en el nido durante dos meses y después de 75 a 80
días pueden volar hábilmente. La depredación de buitres negros es relativamente
poco probable, aunque los huevos y los polluelos se comen fácilmente si los
depredadores mamíferos como mapaches, pizotes y zorros los encuentran. Debido a
su agresividad y tamaño, pocos depredadores pueden amenazar al buitre adulto.
Sin embargo, varias águilas pueden matar a los buitres en los conflictos e
incluso el águila-halcón adornada (Spizaetus ornatus), un ave un poco
más pequeña que el buitre, puede cazar individuos adultos .
6.1.7. Estatus de conservación
Recibe protecciones legales especiales
bajo la Ley del Tratado de Aves Migratorias de 1918 en los Estados Unidos, por
la Convención para la Protección de Aves Migratorias en Canadá, y por la
Convención para la Protección de Aves Migratorias y Mamíferos de Caza en
México. En los Estados Unidos es ilegal capturar, matar o poseer buitres negros
sin un permiso y la violación de la ley se castiga con una multa de hasta 15000
dólares estadounidenses y prisión de hasta seis meses. Está catalogada como una
especie de Preocupación Menor por la Lista Roja de la UICN. Las poblaciones
parecen permanecer estables y no ha alcanzado el umbral de inclusión como
especie amenazada, lo que requiere una disminución de más del 30 % en diez años
o tres generaciones.
El buitre negro es considerado una amenaza
por los ganaderos debido a su depredación sobre el ganado recién nacido. Los
excrementos producidos por los buitres negros pueden dañar o matar árboles y
otra vegetación. Como defensa, los buitres también “regurgitan un vómito
maloliente y corrosivo”. El ave puede ser una amenaza para la seguridad del
tráfico aéreo, especialmente cuando se congrega en gran número en las
inmediaciones de los basureros, como es el caso del Aeropuerto Internacional
Tom Jobim de Río de Janeiro. El buitre negro puede ser mantenido en cautiverio,
aunque la Ley del Tratado de Aves Migratorias solo lo permite en el caso de
animales heridos o que no pueden regresar a la naturaleza.







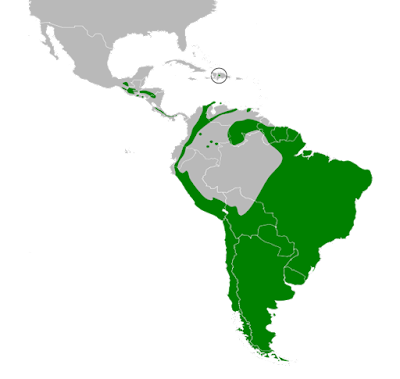



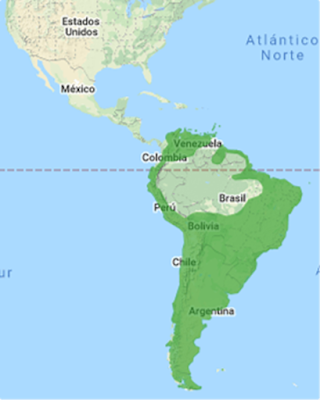











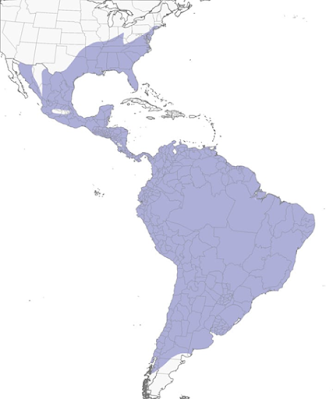
Es fundamental seguir promoviendo la educación ambiental y el avistamiento responsable para proteger y valorar estos espacios naturales.
ResponderEliminar