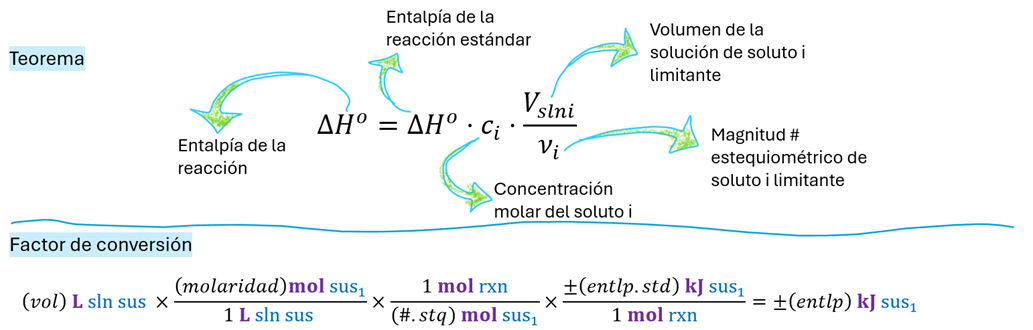
[Demostración] La entalpía de la reacción de un reactivo disuelto es una modificación del modelo general de entalpía de reacción cuando el reactivo limitante se encuentra en disolución. A diferencia de expresarlo directamente en moles, este algoritmo toma en cuenta su concentración molar y el volumen de la disolución que lo contiene. Esta forma es útil cuando el reactivo se introduce como disolución y no como sólido, lo que permite trabajar con variables más accesibles en el laboratorio escolar, como mililitros y molaridad. En este enfoque, se conserva el término de entalpía estándar se ajusta con un número estequiométrico, que representa la cantidad de sustancia según la ecuación balanceada.
El segundo algoritmo, presentado como factor de conversión, traduce estas variables experimentales en el valor energético buscado. Se inicia con el volumen medido de la disolución del reactivo limitante y se lo multiplica por su molaridad, lo que permite obtener los moles de reactivo. Luego, se aplican sucesivos factores de conversión: la relación estequiométrica con la reacción y la entalpía estándar por mol de reacción. El resultado final es la entalpía real liberada o absorbida en el experimento, expresada en kilojulios, y constituye un método directo y reproducible para obtener datos termodinámicos a partir de mediciones simples.

No hay comentarios:
Publicar un comentario