La ionización es el proceso mediante el cual una
sustancia forma iones al ganar o perder electrones, y puede
ocurrir de forma espontánea en disolución acuosa o ser inducida
mediante una fuente externa de energía, como en la electrólisis. En
soluciones acuosas, la ionización espontánea ocurre por la interacción con el agua,
que estabiliza los iones sin que haya una transferencia neta de electrones,
mientras que en la electrólisis, se requiere una corriente eléctrica que
provoca reacciones redox, forzando el movimiento de electrones.
Por ahora, nuestro enfoque se centrará exclusivamente en la ionización
espontánea en agua, dejando de lado los sistemas con equilibrios y
los electrolitos débiles, para facilitar la comprensión de los procesos
más directos y completos. Trataremos los casos como si las sustancias se ionizaran
totalmente o precipitaran por completo, sin estados intermedios ni
equilibrios reversibles.
Debido a esta simplificación, no será necesario introducir
aún conceptos como la constante de equilibrio (K) o el factor de
Van’t Hoff (i), ya que estos se abordarán más adelante. El objetivo inicial
es construir una base sólida sobre los fenómenos de disolución, precipitación
y ionización completa antes de avanzar hacia modelos más complejos.
Descomposición y síntesis.
La ionización puede entenderse como una reacción de descomposición idealizada, en la que un compuesto iónico, formado por cationes y aniones en proporciones que aseguran una carga neta cero, se separa en sus iones constituyentes. Si expresamos esta reacción en términos de una ecuación química simbólica, obtendríamos:
\[1\,\text{cat}_{a}\text{ani}_{b}→a\,\text{cat}^{\vec{z}}+b\,\text{ani}^{\vec{z}}\]
En esta notación, los subíndices "a" y "b" representan los coeficientes estequiométricos necesarios para neutralizar la carga, mientras que las flechas sobre las cargas indican la direccionalidad del signo: positiva para los cationes y negativa para los aniones.
El proceso opuesto es la síntesis iónica, en la que los iones libres se combinan para formar el compuesto neutro:
\[a\,\text{cat}^{\vec{z}}+b\,\text{ani}^{\vec{z}}→1\,\text{cat}_{a}\text{ani}_{b}\]
En ambas ecuaciones, subrayamos una convención clave: el coeficiente estequiométrico del compuesto iónico se asume siempre como uno, reflejando que lo que se forma o descompone es una unidad fórmula del compuesto, sin importar la cantidad real en la muestra, lo cual facilita el análisis teórico en esta etapa.
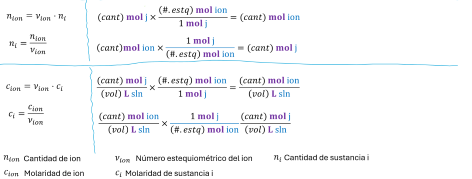
Figura
1. Teoremas y factores de conversión para la estequiometría de ionizaciones en
ausencia de equilibrio químico. Demostración.
Secuestración de iones
Observa que en las reacciones iónicas es común la formación de sales insolubles que precipitan, es decir, que salen de la solución acuosa en forma de sólido. Este proceso reduce la concentración de iones libres en la disolución, ya que los iones que forman el precipitado quedan "secuestrados" fuera del medio acuoso, integrados en la red cristalina del sólido.
Este fenómeno es especialmente relevante en cálculos estequiométricos gravimétricos, donde no solo interesa la cantidad de sustancia total involucrada, sino también la distribución final de los iones: cuáles permanecen disueltos y cuáles se han incorporado al precipitado. Ignorar este detalle puede llevar a errores en la cuantificación de especies químicas, en especial en procedimientos analíticos como la gravimetría por precipitación, donde la masa del sólido formado se utiliza para calcular la cantidad del ion presente inicialmente.
Por tanto, es fundamental identificar correctamente las especies que reaccionan para formar compuestos insolubles y considerar su efecto sobre las concentraciones restantes en solución. Este enfoque permite establecer balances de materia precisos y formular interpretaciones químicas coherentes en sistemas acuosos.
Algunas de las sales insolubles más comunes (sin ser exhaustivos ni demasiado rigurosos en este contexto introductorio) incluyen:
Haluros de plata, como cloruro de plata (AgCl), bromuro de plata (AgBr) y yoduro de plata (AgI), que son notoriamente poco solubles en agua.
Haluros de plomo(II), como PbCl₂, PbBr₂ y PbI₂, que muestran una solubilidad muy limitada, especialmente a temperatura ambiente.
Sulfuros metálicos, tales como sulfuro de hierro(II) (FeS), sulfuro de zinc (ZnS) y sulfuro de plomo(II) (PbS), que tienden a precipitar en medios neutros o básicos.
Hidróxidos de metales de transición o de grupo II, como hidróxido de aluminio (Al(OH)₃), hidróxido de hierro(III) (Fe(OH)₃) y hidróxido de magnesio (Mg(OH)₂), que son poco solubles y pueden precipitar fácilmente según el pH.
Carbonatos y fosfatos de metales alcalinotérreos o de transición, como carbonato de calcio (CaCO₃) o fosfato de hierro(III) (FePO₄), los cuales forman sólidos insolubles en condiciones acuosas normales.
Estas sales juegan un papel clave tanto en reacciones químicas como en procesos de purificación, análisis cualitativo y control de contaminantes en sistemas naturales y tecnológicos. Su formación está directamente relacionada con las reglas de solubilidad, que permiten anticipar qué combinaciones iónicas darán lugar a precipitados.
Referencias.
Baeza
Baeza, J. J., & García Álvarez-Coque, M. C. (2014). Extent of reaction
balances. A convenient tool to study chemical equilibria.
da Silva,
D. J. (2017). The basis of the limiting reagent concept, its identification and
applications. World Journal of Chemical Education, 5(1),
1-8.
García García, J. L. (2020). El álgebra de la
estequiometría. Educación química, 31(1), 138-150.
García García, J. L. (2021). Deduciendo las relaciones entre
las unidades de concentración en disoluciones líquidas. Educación
química, 32(3), 38-51.
García García, J. L. (2021b). Hacia un equilibrio químico
verdaderamente analítico. Educación química, 32(1), 133-146.
Garst, J.
F. (1974). The extent of reaction as a unifying basis for stoichiometry in
elementary chemistry. Journal of Chemical Education, 51(3),
194.
Moretti, G.
(2015). The “extent of reaction”: a powerful concept to study chemical
transformations at the first-year general chemistry courses. Foundations
of Chemistry, 17(2), 107-115.
Mousavi, A.
(2019). Stoichiometry of equations through the Inverse de Donder
relation. Chemistry Teacher International, 1(1),
20180006.
Schmitz, G.
(2005). What is a reaction rate?. Journal of chemical education, 82(7),
1091.
Smith, W.
R., & Missen, R. W. (1979). What is chemical stoichiometry?. Chemical
Engineering Education, 13(1), 26-32.
SOLAZ, J. J., & Quilez, J. (2001). Changes of extent of reaction in open chemical
equilibria. Chemistry Education Research and Practice, 2(3),
303-312.
Vandezande,
J. E., Vander Griend, D. A., & DeKock, R. L. (2013). Reaction extrema:
Extent of reaction in general chemistry. Journal of Chemical Education, 90(9),
1177-1179.

No hay comentarios:
Publicar un comentario