[Carga y lenguaje químico] Sección 5. Conceptos clave [Los libros de colores de la IUPAC] [Reacciones y ecuaciones químicas] Otros conceptos [El litio]
Una reacción química es un proceso en el cual una o
más sustancias, llamadas reactivos, se transforman en una o más
sustancias nuevas, llamadas productos, mediante la reorganización de sus
átomos y enlaces químicos. Durante una reacción química, se conservan la masa y
los elementos, pero cambian las propiedades químicas y físicas de las
sustancias involucradas.
La ecuación química es una herramienta esencial del
lenguaje químico, utilizada para describir de manera formal una reacción
química. Si consideramos los nombres de las sustancias como las
"palabras" del lenguaje químico, las ecuaciones químicas representan
su "sintaxis", permitiendo construir mensajes completos que
expresan qué reactivos participan, en qué proporciones (basadas en la ley de
conservación de la masa), qué productos se obtienen y qué cambios de energía
o estado acompañan al proceso. Una ecuación química indica no solo las
fórmulas de las sustancias involucradas, sino también datos adicionales como la
cantidad de energía liberada o absorbida (ΔH), los estados de agregación
(sólido, líquido, gas, acuoso) y las condiciones específicas necesarias
(temperatura, presión, catalizadores).
Figura 1. Componentes de una ecuación química
Identidad de la sustancia
El primer componente de una ecuación química son las
identidades de las sustancias, que pueden presentarse como fórmulas
moleculares, fórmulas desplegadas, códigos o nombres. Si estas sustancias se
encuentran en el lado izquierdo de la ecuación, desde donde parte la flecha que
indica el sentido de la reacción, se les denomina reactantes o reactivos.
En cambio, si se encuentran en el lado derecho, hacia donde apunta la flecha,
se consideran productos.
Figura
2. Ecuación de la combustión de metano resaltando en azul los reactantes y en
rojo los productos.
En el ejemplo dado en la figura 2, los reactivos son
el metano (CH₄) y el oxígeno atmosférico (O₂), mientras que los productos
generados son el dióxido de carbono (CO₂) y el agua (H₂O). Este
proceso ilustra una reacción de combustión, donde el metano, al
reaccionar con el oxígeno, produce los mencionados productos. La
relación entre los reactivos y los productos se expresa en una ecuación
química balanceada, que refleja la transformación de las sustancias
iniciales en nuevas sustancias con diferentes propiedades
Número estequiométrico
El número estequiométrico (símbolo \(\nu\)) indica la
cantidad de entidades de reactivos y productos necesarios
para llevar a cabo un evento de reacción, o bien un mol de eventos de
reacción, dependiendo de si interpretamos la ecuación química desde
una perspectiva molecular o macroscópica. Normalmente, el número
estequiométrico se toma únicamente como su magnitud positiva; sin
embargo, en varios contextos será necesario considerar que, en realidad, se
trata de un vector químico con dirección: negativo para los reactivos
y positivo para los productos. Para evitar ambigüedades,
marcaremos el número estequiométrico con una flecha vectorial \(\vec{\nu}\)
cuando deba considerarse su sentido, y lo escribiremos sin flecha
cuando nos refiramos solamente a su valor absoluto positivo.
Figura
3.
En la Figura 3 resaltamos en azul los números
estequiométricos de los reactivos y en rojo los de los productos.
Por razones didácticas, ubicamos explícitamente los valores de 1
en los compuestos que corresponden; sin embargo, tal como se observa en la Figura
4, formalmente los números estequiométricos igual a 1 no
se escriben en la ecuación química. Esta omisión responde a la
convención de simplificar la representación, ya que se sobreentiende que la
ausencia de un coeficiente explícito implica un número estequiométrico
de 1.
Figura
4.
Flecha de reacción
La flecha de reacción en una ecuación química
se lee como "produce" y señala el sentido químico de la
transformación. Aunque los átomos se conservan durante el
proceso, las sustancias originales se destruyen y se reorganizan
para formar nuevas especies químicas. La flecha indica así la dirección
en la que ocurre la transformación química.
Figura
5.
Figura
6. El ciclo de Krebs, también conocido como ciclo del ácido cítrico,
es un excelente ejemplo del sentido químico complejo en sistemas donde
múltiples reacciones encadenadas ocurren de manera controlada. En este
ciclo, una molécula de acetil-CoA reacciona con oxalacetato para
formar citrato, iniciando una serie de transformaciones químicas donde
se generan nuevos compuestos y se regeneran otros, permitiendo la continuidad
del proceso. Cada paso implica reacciones específicas
—descarboxilaciones, oxidaciones, hidrataciones— que, aunque conservan los
átomos globalmente, reorganizan profundamente las moléculas. Además, algunas
sustancias del ciclo pueden salirse hacia otras rutas metabólicas, o
bien, productos de otras vías pueden entrar en el ciclo, mostrando un
sistema de flechas múltiples y entrecruzadas, muy distinto a la simple
transformación de un reactivo en un único producto.
Cuando la flecha apunta en una sola dirección (→), esto
puede significar que únicamente existe un sentido de reacción posible, o
que la reacción inversa es despreciable por ser muy poco
significativa. Si, en cambio, aparecen dos flechas cortadas a la mitad (⇌),
se representa un equilibrio químico, donde las reacciones directa e
inversa ocurren simultáneamente. Si se presentan varias flechas en
diferentes direcciones, esto indica que una misma cantidad de reactivos
puede generar productos diferentes; y en el caso de reacciones
bioquímicas, se pueden observar bifurcaciones, fusiones, salidas
alternativas, como si se tratara de una red de autopistas compleja y
dinámica.
Condiciones y catalizadores
Sobre o debajo de la flecha de reacción, o a veces
(aunque menos común y considerado incorrecto en ciertos enfoques) del lado de
los reactivos, se colocan las condiciones especiales y los catalizadores
necesarios para que la transformación ocurra. Estas condiciones pueden incluir temperatura,
presión, tipo de disolvente o presencia de energía externa.
Figura
7.
Por ejemplo, para la combustión del metano (CH₄), se
requiere como mínimo una atmósfera de oxígeno y una chispa
inicial que aporte energía de activación. Otras reacciones requieren catalizadores,
sustancias que intermedian el proceso químico acelerándolo pero sin
consumirse en el transcurso de la reacción. Idealmente, los catalizadores
permanecen intactos, aunque en la práctica pueden degradarse debido a transvases,
vaporizaciones o contaminaciones durante las operaciones de
laboratorio.
Mezclas
Los símbolos de adición (+) en una ecuación química
deben interpretarse como una mezcla de sustancias, ya sea en el lado de
los reactivos o de los productos.
Figura
8.
Esto significa que las entidades químicas mencionadas se
encuentran juntas en el mismo entorno físico o sistema. En algunos
casos, como en soluciones homogéneas, estas sustancias permanecen mezcladas
durante todo el proceso. En otros casos, especialmente entre los productos de
una reacción, pueden separarse espontáneamente debido a diferencias de
estado físico (por ejemplo, un gas liberado de una solución) o a propiedades
como la insolubilidad. Así, el símbolo "+" no indica unión química
permanente, sino coexistencia en el mismo espacio antes o después de la
reacción
Calor de Reacción
El calor de reacción estándar, ubicado a la derecha
de la ecuación química, indica cuánta energía en kilojulios (kJ)
es requerida o emitida por la reacción. La entalpía está
definida como una diferencia de energía, y este hecho tiene
implicaciones similares a una flecha vectorial: posee un sentido
químico.
Figura
9.
Los signos que acompañan al valor del calor de
reacción siguen la misma convención que los del número estequiométrico: negativo
(–) para indicar emisión de calor (reacción exotérmica) y positivo
(+) para indicar absorción de calor (reacción endotérmica). Esto
se debe a que, en una diferencia estándar, se calcula productos –
reactivos. Si los productos tienen mayor energía que los reactivos,
la diferencia es positiva, interpretándose que se debe introducir
energía al sistema para que la reacción ocurra. Por el contrario, si los
productos tienen menor energía, la diferencia es negativa,
indicando que la reacción libera energía espontáneamente.
Estado de la materia
Las ecuaciones químicas también pueden incluir información sobre el estado físico de las sustancias participantes. Este dato se representa mediante subíndices entre paréntesis inmediatamente después de cada fórmula química: (g) para gases, (l) para líquidos, (s) para sólidos y (aq) para sustancias disueltas en agua (soluciones acuosas).
Figura 10.
Esta notación proporciona un nivel adicional de detalle sobre las condiciones físicas en las que ocurre la reacción, lo cual es fundamental para comprender correctamente el comportamiento y la dinámica de los reactivos y productos en el proceso químico.
Lectura
Finalmente, el cuerpo completo de la ecuación química debe ser capaz de traducir un párrafo con sentido a una sintaxis de texto químico. Para nuestro ejemplo, podemos interpretar la ecuación de la siguiente manera:
"La mezcla de reacción entre metano (CH₄) y oxígeno molecular (O₂), a una presión de 1 atmósfera y en presencia de una chispa, produce una mezcla de agua (H₂O) y dióxido de carbono (CO₂), acompañada de la emisión de 890 kilojulios de energía por cada mol de eventos de reacción."
De esta forma, la ecuación funciona como un lenguaje condensado que comunica, de manera precisa, los materiales, las condiciones, la transformación química y el cambio energético involucrados.
Referencias
Brown, T.
L., LeMay, H. E. J., Bursten, B. E., Murphy, C. J., Woodward, P., &
Stoltzfus, M. W. (2015). Chemistry the Central Science.
Brown, T.
L., LeMay, H. E. J., Bursten, B. E., Murphy, C. J., Woodward, P., Stoltzfus, M.
W., & Lufaso, M. W. (2022). Chemistry, the central science (15th ed.).
Pearson.
Chang, R.
(2010). Chemistry (10th ed.). McGraw-Hill New York.
Chang, R.,
& Overby, J. (2021). Chemistry (14th ed.). McGraw-Hill.
Seager, S.
L., Slabaugh, M. M., & Hansen, M. M. (2022). Chemistry for Today (10th
ed.). Cengage Learning.
Zumdahl, S. S., Zumdahl, S. A., DeCoste, D. J., & Adams, G. (2018). Chemistry (10th ed.). Cengage Learning.










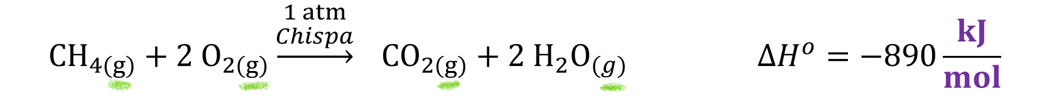
No hay comentarios:
Publicar un comentario