[Mitosis y meiosis] [Microorganismos] [Plantas] [Invertebrados] [Peces] [Anfibios y reptiles] [Aves] [Humanos] [Enfermedades humanas]
Índice
Índice
1. Introducción
1. Introducción
Las enfermedades reproductivas pueden distinguirse en dos grandes grupos, las causadas por infecciones y las causadas por desordenes hormonales. En este capítulo examinaremos ambas categorías, enfocándonos principalmente en las infecciosas, y de ellas, le edicaremos mas tiempo a la infección por el virus de la deficiencia inmune humana o VIH, causante de el síndrome de la deficiencia del sistema inmune adquirido.
Debido al impacto de las enfermedades causadas por las relaciones ecológicas, específicamente las provocadas por el parasitismo, estas serán el foco de nuestra atención inicialmente. Una enfermedad de transmisión sexual es aquella cuyo vector de transmisión es el acto sexual en cualquiera de sus formas, clásicamente también se las denomina enfermedades venéreas.
El nombre de enfermedad venérea viene de Venus la diosa del deseo sexual y el amor, por lo que hace referencia a las enfermedades que se transmiten durante el coito vaginal, anal, bucal, o durante analigus “besar el ano del compañero sexual”. En esta definición también ingresan las enfermedades congénitas que son transmitidas de la madre al infante que sean causados por los agentes etiológicos transmitidos por el acto sexual.
Françoise Barré-Sinoussi
Françoise Barré-Sinoussi, nacida el 30 de julio de 1947 en París, Francia, es una destacada viróloga y científica francesa. Es reconocida por su papel fundamental en el descubrimiento del virus de inmunodeficiencia humana (VIH), causante del SIDA. Como cofundadora y líder del equipo de investigación, sus contribuciones fueron fundamentales para identificar y caracterizar el VIH en la década de 1980, abriendo el camino hacia la comprensión y el tratamiento de esta enfermedad devastadora. Su trabajo pionero la hizo merecedora del Premio Nobel de Fisiología o Medicina en 2008.
Contexto social
Françoise Barré-Sinoussi desarrolló su carrera científica en un contexto político, económico, social, religioso y cultural en constante cambio. Durante su vida y trabajo, ha presenciado varios momentos clave en la historia reciente.
Políticamente, Barré-Sinoussi vivió en un período de agitación y transformación. La década de 1980, cuando hizo su descubrimiento del VIH, fue testigo de la propagación global del virus y la creciente conciencia sobre el SIDA. Esta crisis de salud pública llevó a una respuesta política significativa en términos de investigación, prevención y tratamiento.
Económicamente, Barré-Sinoussi trabajó en un momento de avances científicos y tecnológicos que tuvieron un impacto en la investigación médica. La financiación y el apoyo económico desempeñaron un papel crucial en su capacidad para llevar a cabo su trabajo y establecer colaboraciones internacionales.
Socialmente, el descubrimiento del VIH y la epidemia del SIDA generaron un impacto profundo en la sociedad. Se produjo un aumento en la conciencia pública sobre la enfermedad, así como estigmatización y discriminación hacia las personas afectadas. La lucha por los derechos de los pacientes y la promoción de una respuesta compasiva y basada en la evidencia fueron temas importantes en ese momento.
Religiosamente, el contexto varió según las creencias y actitudes individuales. Algunas comunidades religiosas enfrentaron desafíos y tensiones en torno a la sexualidad, la prevención y el tratamiento del VIH, mientras que otras abogaron por enfoques compasivos y la protección de los derechos humanos.
Culturalmente, la época en la que Barré-Sinoussi realizó su trabajo científico estuvo marcada por la emergencia de movimientos sociales y cambios culturales. La revolución sexual, la lucha por los derechos LGBTQ+ y la conciencia sobre la salud y el bienestar se convirtieron en temas fundamentales que influyeron en su investigación y en la forma en que se abordaron los problemas de salud pública.
Infancia
Françoise Barré-Sinoussi mostró un gran interés por la ciencia desde una edad muy temprana. Durante sus vacaciones de infancia, pasaba horas analizando insectos y animales, comparando sus comportamientos y tratando de entender por qué algunos corrían más rápido que otros, por ejemplo. Pronto, Barré-Sinoussi se dio cuenta de que tenía un talento especial para las ciencias en comparación con sus asignaturas humanísticas. Expresó a sus padres su interés por asistir a la universidad para estudiar ciencias o convertirse en investigadora. Su curiosidad innata y su deseo de explorar el mundo natural sentaron las bases de su futura carrera científica, que la llevaría a realizar descubrimientos cruciales en la lucha contra el VIH y el SIDA.
Logros
Françoise Barré-Sinoussi recibió una sólida educación científica que sentó las bases para sus destacados logros en el campo de la virología. Después de expresar su interés por la ciencia, asistió a la Universidad de Ciencias de París, donde se especializó en virología y obtuvo su doctorado en 1974.
Sus principales logros científicos se centran en su trabajo pionero en la identificación y caracterización del virus de inmunodeficiencia humana (VIH), el agente causante del SIDA. En la década de 1980, junto con su colega Luc Montagnier, aisló y describió por primera vez el virus en el Instituto Pasteur de París. Su descubrimiento fue un hito crucial en la comprensión de esta enfermedad devastadora.
Entre sus contribuciones más destacadas se encuentra la demostración de que el VIH ataca y destruye el sistema inmunológico del organismo, lo que lleva a la aparición del SIDA. Además, Barré-Sinoussi y su equipo desarrollaron métodos para cultivar y estudiar el virus, sentando las bases para investigaciones posteriores en diagnóstico y tratamiento.
Sus logros científicos se vieron reconocidos con numerosos premios y reconocimientos, siendo el más notable el Premio Nobel de Fisiología o Medicina que recibió en 2008, compartido con Luc Montagnier. Este prestigioso premio destacó su trabajo fundamental en el descubrimiento del VIH y su contribución para el avance de la investigación y el desarrollo de terapias antirretrovirales.
En cuanto a publicaciones, Barré-Sinoussi ha sido autora y coautora de numerosos artículos científicos en revistas de renombre, contribuyendo así al conocimiento y la comprensión del VIH y el SIDA.
Comunidad
Françoise Barré-Sinoussi es parte de una amplia comunidad científica que se dedica a la investigación en virología y enfermedades infecciosas. Durante su carrera, ha trabajado en colaboración con numerosos científicos y expertos de renombre en el campo.
Uno de sus colaboradores más destacados es Luc Montagnier, con quien compartió el Premio Nobel de Fisiología o Medicina en 2008 por su descubrimiento del VIH. Juntos, llevaron a cabo investigaciones pioneras que llevaron a la identificación y caracterización del virus. Su trabajo conjunto sentó las bases para futuras investigaciones y avances en el campo del VIH/SIDA.
Reconocimientos
Françoise Barré-Sinoussi ha recibido numerosos reconocimientos a lo largo de su vida en reconocimiento a sus destacados logros científicos y su contribución a la lucha contra el VIH/SIDA. A continuación, se enumeran algunos de los reconocimientos más destacados:
(a) Premio Nobel de Fisiología o Medicina (2008): Barré-Sinoussi fue galardonada con el Premio Nobel junto con Luc Montagnier por su descubrimiento del VIH. Este premio es uno de los máximos reconocimientos en el campo de la ciencia y ha destacado su contribución a la comprensión y tratamiento del SIDA.
(b) Legión de Honor (Francia): Se le otorgó la Legión de Honor, la máxima distinción en Francia, en reconocimiento a su destacada trayectoria científica y su compromiso con la investigación médica.
(c) Doctorados honoris causa: Barré-Sinoussi ha recibido doctorados honorarios de varias universidades de renombre en reconocimiento a su destacada carrera científica y sus contribuciones a la virología y la lucha contra el VIH/SIDA.
(d) Medallas y premios internacionales: Ha recibido numerosas medallas y premios internacionales por su trabajo, incluyendo la Medalla Robert Koch, el Premio Japón en Ciencias Médicas y el Premio Internacional Giuseppe Sciacca.
Además de estos reconocimientos formales, es posible que Barré-Sinoussi haya sido honrada en eventos espontáneos o celebraciones organizadas por la comunidad científica y la comunidad afectada por el VIH/SIDA. Estos eventos pueden incluir homenajes, conferencias o simposios en los que se destaca su labor y se reconoce su valioso aporte a la ciencia y la salud pública.
Por que ella es importante?
El trabajo de Françoise Barré-Sinoussi ha tenido un impacto significativo en nuestras vidas cotidianas al contribuir a la comprensión y el tratamiento del VIH/SIDA. Aquí hay algunas formas en las que su trabajo nos afecta:
(a) Diagnóstico y tratamiento del VIH: El descubrimiento del VIH por parte de Barré-Sinoussi sentó las bases para el desarrollo de pruebas de diagnóstico precisas y confiables. Gracias a su trabajo, hoy en día existen pruebas de detección del VIH que nos permiten identificar la presencia del virus y recibir un diagnóstico temprano, lo que a su vez facilita el acceso a tratamientos adecuados y el seguimiento médico adecuado.
(b) Terapias antirretrovirales: Barré-Sinoussi y su equipo fueron fundamentales en la investigación y desarrollo de terapias antirretrovirales para tratar el VIH. Estos medicamentos han transformado el panorama del VIH/SIDA, permitiendo que las personas infectadas vivan vidas más largas y saludables, y reduciendo significativamente la transmisión del virus.
(c) Prevención y educación: El trabajo de Barré-Sinoussi también ha contribuido a la prevención y la educación en relación con el VIH/SIDA. Sus investigaciones han permitido comprender mejor cómo se propaga el virus y cómo prevenir su transmisión. Esto ha llevado a campañas de concientización sobre el uso de preservativos, la importancia de las pruebas regulares del VIH, la promoción de prácticas sexuales seguras y la eliminación del estigma asociado a la enfermedad.
(d) Impacto en la sociedad: El VIH/SIDA ha tenido un impacto significativo en la sociedad en general. El trabajo de Barré-Sinoussi ha contribuido a una mayor conciencia y comprensión de la enfermedad, lo que ha llevado a una mayor compasión y apoyo a las personas afectadas. Ha ayudado a reducir el estigma y la discriminación asociados al VIH/SIDA, permitiendo que las personas vivan con dignidad y sin miedo al rechazo.
¿Que debemos aprender de ella?
Françoise Barré-Sinoussi demostró una determinación excepcional al superar obstáculos en su camino hacia el éxito. A pesar de enfrentar desafíos como el sexismo en la comunidad científica y la falta de apoyo financiero inicial, persistió en su búsqueda de respuestas en la investigación del VIH/SIDA. Su capacidad para superar adversidades nos inspira a no rendirnos ante las dificultades y a perseverar en nuestros objetivos.
Barré-Sinoussi ejemplifica el poder del liderazgo científico. Fue una figura clave en la identificación del VIH y su relación con el SIDA, liderando un equipo de investigación en el Instituto Pasteur de París. Su liderazgo científico ha dejado un legado duradero y ha allanado el camino para futuros avances en la lucha contra el VIH/SIDA.
A lo largo de su carrera, Barré-Sinoussi ha trabajado en estrecha colaboración con otros científicos y expertos en el campo del VIH/SIDA. Su capacidad para colaborar de manera efectiva y aprovechar los conocimientos y habilidades de otros científicos ha sido fundamental para su éxito. Nos enseña la importancia de la colaboración y el trabajo en equipo en la búsqueda de soluciones científicas.
El trabajo de Barré-Sinoussi en el VIH/SIDA va más allá de la investigación científica. También ha sido una defensora incansable de la salud global y ha trabajado para garantizar el acceso equitativo a la atención médica y los tratamientos para las personas afectadas por el VIH/SIDA en todo el mundo. Su compromiso nos inspira a tomar conciencia de las inequidades en la salud y a luchar por un acceso igualitario a la atención médica.
El trabajo de Barré-Sinoussi ha tenido un impacto directo en la vida de las personas afectadas por el VIH/SIDA. Sus contribuciones han llevado al desarrollo de terapias antirretrovirales efectivas y han mejorado la calidad de vida de millones de personas en todo el mundo. Su impacto nos recuerda el poder transformador de la ciencia y cómo puede marcar la diferencia en la vida de las personas.
2. Generalidades
2. Generalidades
Debido al impacto de las enfermedades causadas por las relaciones ecológicas, específicamente las provocadas por el parasitismo, estas serán el foco de nuestra atención inicialmente. Una enfermedad de transmisión sexual es aquella cuyo vector de transmisión es el acto sexual en cualquiera de sus formas, clásicamente también se las denomina enfermedades venéreas. El nombre de enfermedad venérea viene de Venus la diosa del deseo sexual y el amor, por lo que hace referencia a las enfermedades que se transmiten durante el coito vaginal, anal, bucal, o durante analigus “besar el ano del compañero sexual”. En esta definición también ingresan las enfermedades congénitas que son transmitidas de la madre al infante que sean causados por los agentes etiológicos transmitidos por el acto sexual.
Clasificación
En base al sistema taxonómico de Woese dos de los tres dominios de la vida poseen especies parasíticas involucradas en el acto sexual humano, estos son el domino eucariota y el dominio bacteria, adicionalmente los virus que no se clasifican al interior de los seres vivos “pero son una cosa muy próxima a la vida” también son una causa muy importante de enfermedades de transmisión sexual. En este orden de ideas el sistema clasificatorio para las enfermedades de transmisión sexual depende del tipo de ser vivo que lo provoca:
(a) Enfermedades virales de transmisión sexual
(b) Enfermedades bacterianas de transmisión sexual
(c) Enfermedades eucariotas de transmisión sexual.
Al interior de los eucariotas se emplea la clasificación taxonómica de Wittaker para distinguir entre:
(d) Enfermedades de transmisión sexual causadas por protozoos.
(e) Enfermedades de transmisión sexual causadas por hongos.
(f) Enfermedades de transmisión sexual causadas por metazoos.
Historia
De todas las enfermedades infecciosas que existen tal vez ninguna es comparable a las enfermedades de transmisión sexual en términos de lo que pueden llegar a decirnos sobre el comportamiento del ser humano. Una sociedad puede tener altos ideales y reglas a cerca del comportamiento sexual decoroso, pero la presencia de estas infecciones en la población siempre quita la máscara de hipocresía de cualquier sociedad. Las enfermedades de transmisión sexual siempre han existido en nuestra historia, en algunos momentos se han vuelto más importantes que en otros, pero lo que nos dice esto acerca del comportamiento humano sobre su sexualidad es universal, y no muy moral. El problema es que esta dualidad entre una hipocresía ideal y una realidad promiscua provoca un caos en el tratamiento de dichas enfermedades, los prestadores de salud no pueden asumir que los individuos se comportarán de forma virtuosa, y es por esta razón que los mecanismos de control de estas enfermedades como el condón deben ser reforzados. En los siguientes artículos expondremos algunos reportes de las ITSs en algunos momentos históricos de importancia.
La antigüedad
El factor de riesgo más importante para la transmisión de cualquier ITS es sin duda la promiscuidad, la cual puede ser entendida de dos formas, ya sea mediante la realización de actos sexuales por fuera del matrimonio y el uso extendido de la prostitución ya sea religiosa “si, si la hubo de este tipo” o por dinero. El uso de prostitutas "de ambos sexos", y las violaciones pueden ser uno de los vectores principales para la transmisión de enfermedades de transmisión sexual en el mundo antiguo, especialmente gracias a los mercaderes viajeros o a los ejércitos en marcha. Debido a estos factores de riesgo, la descripción de ITSs con sintomatología similares a la gonorrea han sido descritas en textos médicos como el papiro de Ebers escrito en el año 1550 antes de Cristo. La biblia también describe algunos de sus síntomas en Levítico 15 2-33.
Figura 2.1. El Papiro de Ebers es uno de los documentos médicos más antiguos y completos que se conservan. Escrito en lengua egipcia alrededor del año 1550 a.C., consta de aproximadamente 110 páginas de papiro y abarca una amplia gama de conocimientos médicos de la antigua civilización egipcia. Describe enfermedades, diagnósticos, tratamientos y fórmulas medicinales, incluyendo remedios a base de hierbas. El papiro proporciona una visión única de las prácticas médicas y las creencias de la época, y ha sido una valiosa fuente de información para los estudiosos de la historia de la medicina. Su nombre se debe al egiptólogo alemán Georg Ebers, quien lo adquirió en 1872.
En cuanto a otras enfermedades el diagnostico puede ser complicado, los antiguos griegos y romanos describen pústulas o ulceras en las regiones genitales lo cual puede ser provocado por una amalgama de infeccionas, aunque en otras ocasiones es fácil reconocer las ITSs. Un caso es el de la escabiosis púbica causada por las ladillas, en este caso el síntoma típico es el prurito sin paralelo “picor, picor, picor”. En cualquier caso, la asociación del acto sexual con enfermedades relacionadas al tracto reproductor externo e interno ya era conocida por lo menos desde la antigüedad egipcia, la antigüedad del medio oriente y la antigüedad clásica.
La antigua China
Donde quiera que existan humanos, siempre han existido todo tipo de comportamientos sexuales consentidos, románticos, económicos e incluso violentos, y la China antigua no es la excepción. Las enfermedades de transmisión sexual del oriente antiguo eran las mismas que en occidente gracias a un aspecto muy fundamental, el comercio ya fuera por la ruta de la seda o por las rutas marítimas. En cada puerto del desierto o del mar entre China y Europa había burdeles y prostitutas que amenizaban el viaje de los hombres solitarios. Para la dinastía Tang “618-906” los médicos imperiales ya habían descrito con cierta precisión enfermedades como la Gonorrea. Sin embargo, no sería hasta la era del colonialismo europeo donde la prevalencia de las enfermedades de transmisión sexual se incrementaría de forma radical, siendo una de las enfermedades más importantes la sífilis.
El mundo islámico medieval
La edad dorada del islam “900-1100 DC” no solo está determinada por importantes avances en matemáticas, ingeniería, alquimia o botánica, también por un marcado interés por la anatomía médica, la medicina y el estudio de las enfermedades infecciosas. Un ejemplo es Abu Ali al Hussein ibn Sina Avicenna reportó un tratamiento para la gonorrea en su tratado de medicina al-Qānūn fī’ţ-Ţibb. Al interior del contexto árabe, sabios judíos como Maimónides también describieron la gonorrea en términos de una descarga de fluidos del pene, sin erección o sensación de placer, relacionada con los excesos sexuales. Es probable que conocieran otras enfermedades “de hecho las mismas de los griegos de quienes tomaron las bases de sus ciencias”, pero como se ha mencionado antes, resulta difícil identificar una enfermedad por descripciones genéricas a menos que se trate de síntomas muy típicos.
La edad media y renacimiento europeo
Durante la edad media de Europa a pesar de lo que podría pensarse, las enfermedades de transmisión sexual continuaron siendo las mismas que las reportadas por los griegos e inclusive los egipcios como la gonorrea, la escabiosis y las verrugas vaginales. La prostitución y las violaciones por parte de los soldados durante las ocupaciones u conquistas militares continuaron siendo los principales vectores de diseminación, en últimas, el control religioso y la iglesia no cambiaron el modo en que se comportaban los humanos. De hecho, se tomaron medidas más pragmáticas que idealistas como impedir que las prostitutas infectadas con gonorrea prestaran sus servicios en las grandes plazas de Londres, Avignon y Hamburgo. Algunos naturalistas que reportan estas enfermedades fueron Roger de Solerno, William de Salicet, Juan de Gaddesden, Richard Wiseman y Jean Astruc.
El renacimiento nos demuestra que cualquier cambio en el conocimiento médico se encuentra permeado por la sociedad, la geopolítica y las fuerzas económicas tanto como por los descubrimientos intrínsecos de la medicina. El renacimiento inicia con múltiples eventos durante los siglos XIV y XV pero se tomará el descubrimiento de América como punto de referencia estándar. En este contexto la enfermedad venérea más importante es sin duda la sífilis, no solo por los debates a cerca de su origen, sino por la influencia que ejerció en la moralidad, la conducta sexual y las medidas sanitarias implementadas por los diferentes gobiernos.
El origen de la sífilis es altamente controversial estableciéndose dos hipótesis generales, el origen euroasiático y el origen americano. El origen euroasiático establece que la sífilis se originó en algún lugar del viejo mundo, siendo ya endémica en Europa antes de la invasión de Carlos VIII en 1494, y que con la licencia del ejército de mercenarios ese mismo año la enfermedad se dispersó por toda Europa. La hipótesis del origen americano establece que la sífilis es endémica de los indígenas americanos que fueron contactados por la invasión de España y Portugal durante el descubrimiento de América. Los marinos españoles al violar a las mujeres americanas contrajeron la enfermedad y la dispersaron en Europa en los primeros puertos con rameras que pudieron encontrar. Existe una gran cantidad de literatura científica que apoya o desmiente ambas hipótesis, así como terceras posturas que proponen un origen africano de la enfermedad, en cualquier caso, para el siglo XV la sífilis era el equivalente del SIDA en la actualidad, una enfermedad misteriosa e incurable con horribles síntomas.
Figura 2.2. Aparentemente los síntomas de la sífilis aguda durante la edad media eran más severos.
Dejando de lado las controversias, la enfermedad se describe ya en 1495 en el libro conocido como la Dieta de los Gusanos, y originalmente se le dio el nombre de mal francés “Malum Francicium” mientras que en Francia era conocida como la enfermedad napolitana. Todos se echaban la culpa de la enfermedad y a pesar de las prescripciones morales de la iglesia, aparentemente la perspectiva de una muerte horrible no disminuyó en lo más mínimo el comportamiento sexual de los seres humanos. Para algunos la sífilis era una demostración de la ira de Dios y el castigo para la inmoralidad, e incluso se le fueron dadas explicaciones astrológicas. En cualquier caso, la sífilis del renacimiento era más virulenta que la actual, pues en su fase aguda podía generar laceraciones de la piel muy semejantes a las de la lepra –por no mencionar su ataque al hueso– y mientras que en la actualidad la fase aguda es rara vez mortal, en aquella época, pasar por la primera fase de la infección por sífilis y sobrevivir era ya un gran logro.
Los orígenes sexuales de la infección de la sífilis fueron identificados rápidamente y reportados crudamente por Andrew Boord en 1547 “cuando las personas pecan de lujuria los unos con los otros. Todos los órganos se vuelven infecciosos”. De hecho, la sífilis es la primera enfermedad que es catalogada como venérea “lues venérea”, término empleado por Jacques de Bethencourt de Rouen en 1527 refiriéndose a la sífilis. Se intentaron muchos tipos de medicamentos para tratar la sífilis incluyendo mercurio – si no lo mata la fase aguda de la sífilis, lo debería matar el mercurio, y de igual forma si no lo enloquece la fase crónica, lo vuelve loco el mercurio. Sin embargo, en una época sin antibióticos la única opción posible para la sífilis era la prevención, o el empleo de barreras, de hecho, los condones datan de esta época, aunque se podría cuestionar su eficacia dadas las limitaciones tecnológicas. En cualquier caso, ya para 1717 Daniel Turner aconseja el uso de condones para prevenir la sífilis.
La modernidad
Con el advenimiento del siglo XIX el estudio de las enfermedades infecciosas de transmisión sexual pasa a una etapa madura de investigación científica, especialmente gracias al nacimiento de la microbiología médica. Adicionalmente, el frente químico comenzó a mejorar gracias al descubrimiento de nuevos medicamentos que sometidos a las reglas de la investigación y el escrutinio científico dio buenos resultados, aunque con efectos secundarios inconvenientes. Con el cambio de siglo la gran mayoría de las ITSs causadas por bacterias serian controladas gracias al descubrimiento de la penicilina, sin embargo, todos estos temas serán discutidos con mayor profundidad en los siguientes artículos, al igual que uno de los problemas más graves que puede afrontar la investigación en este campo y es el negacionismo.
3. Introducción al VIH
3. Introducción al VIH
Los virus se encuentran en el limbo de lo vivo y lo no vivo, siendo de las estructuras más difíciles de identificar en un aislamiento tratando de seguir las reglas de Koch. Adicionalmente la mayoría de los virus son semejantes en estructuras, por lo que es poco relevante aislar la imagen de agente etiológico, pues una misma estructura puede ser presentada por muchos virus semejantes. Los virus pueden clasificarse en varias categorías dependiendo del material genético presente al interior de su cascarón de proteína llamada cápside, algunas veces puede ser ADN otras ARN. En la actualidad muchos virus se reconocen mediante la presencia de anticuerpos en suero que son específicos contra ellos, además la presencia de su material genético, con lo cual se pueden realizar estudios de parentesco “filogenética” con lo cual se los puede clasificar naturalmente “taxonomía-filogenética”.
¿Por qué hablamos de los virus? O más precisamente ¿por qué nos enfocaremos tanto en el Virus de la Inmunodeficiencia Humana VIH en este capítulo sobre las enfermedades del sistema reproductivo? La razón más importante radica en que este virus no causa una enfermedad en sí misma, sino un conjunto de enfermedades, que normalmente son TODAS LAS DEMAS infecciones de transmisión sexual “ITS” que afectan inicialmente al sistema reproductivo. Por ende, a través del estudio del VIH veremos a las otras ITS, así como conceptos asociados al sistema reproductor, al sistema inmune, la evolución y la sociedad misma.
Existe una enorme cantidad de información y desinformación a cerca del Síndrome de Inmuno-Deficiencia Adquirida SIDA a través de toda la red, de hecho si usted busca documentales en youtube es más probable que encuentre aquellos relacionados con teorías conspiranóicas (Leung, 2009) que con un documental que describa de forma efectiva la virología, patología, epidemiología y prevención sobre esta terrible enfermedad.
Si bien es cierto que existe cierto debate al interior de las comunidades científicas el asunto es que ese es el estado de normalidad en las ciencias naturales (Fenstermacher, 1994; Sfard, 1998; Songer & Linn, 1991; Yager, 1996), los científicos disienten unos de otros sobre las teorías que explican los fenómenos, sin embargo cabe preguntarse si una controversia que ha ido superándose desde los años 90 del siglo XX debería afectar a las políticas públicas de salud. En la siguiente serie de artículos trabajaremos el problema del SIDA con algo de profundidad, especialmente su patogénesis celular y su taxonomía evolutiva, esta última puede dar luces sobre la historia que el virus pudo haber realizado en nuestra propia especie.
VIH y SIDA
VIH y SIDA a pesar de ser acrónimos conectados no son lo mismo, VIH es el agente etiológico y SIDA es la sintomatología. VIH significa Virus de InmunoDeficiencia Humano, mientras que SIDA significa Síndrome de InmunoDeficiencia Adquirida (Gross & Tyring, 2011; Knipe & Howley, 2013; Roitt & Delves, 2011). Esta distinción se debe a que no todas las deficiencias del sistema inmunitario son adquiridas, algunas son causadas por factores genéticos intrínsecos al organismo (Hong, 1998; Krueger, Friedman, & Kuta, 2013). En cualquier caso, SIDA tampoco es una enfermedad, al menos no una enfermedad única, se trata de un coctel de enfermedades que atacan al individuo con un sistema inmune debilitado en uno solo de sus tipos de célula, pero lo suficientemente importante como para dejar inactivo al resto (Gross & Tyring, 2011; Knipe & Howley, 2013; Roitt & Delves, 2011)..
El VIH no es un virus mortal en sí mismo (Amwata, 2015; Nitheshkumar, Kiranmai, & Chandrasekhar, 2013), matar un linaje específico del sistema inmunitario ciertamente no afecta la viabilidad del metabolismo, pero si hace que cualquier microorganismo comensalita que se encuentra normalmente en el cuerpo se convierta en un agente etiológico mortal.
Agente etiológico y enfermedad
Cando estudias la historia de la genética una de las controversias más álgidas es sin duda el debate entre lo heredado y lo adquirido, resulta irónico que tal debate pueda trasladarse también a la medicina. En base a los postulados de Koch (Breitschwerdt et al., 2013; Byrd & Segre, 2016) uno espera que las enfermedades infecciosas obedezcan al espectro de lo adquirido, es decir una enfermedad infecciosa es una condición que emerge de la adquisición se un microorganismo mediante la relación de parasitismo que causa una enfermedad.
Sin embargo, en términos generales para cualquier enfermedad, los postulados de Koch no siempre se cumplen, es decir existen individuos que portan los agentes etiológicos, pero que no experimentan enfermedad, y allí vuelve a jugar el debate entre lo heredado y lo adquirido. Los pacientes asintomáticos pueden serlo porque naturalmente son mutantes con un sistema inmune con una variación natural, que les permite responder a la infección y mantenerla bajo control transformando al parasito en un comensal (Casadevall & Pirofski, 2015; Méthot & Alizon, 2014). Esta fluidez de la relación de simbiosis parasítica a una simbiosis comensalista está reportada para muchos seres vivos (Furness, 2012; Méthot & Alizon, 2014; Parmentier & Michel, 2013; Thompson, Nuismer, & Gomulkiewicz, 2002; Werren, Baldo, & Clark, 2008). De hecho, existen falsas simbiosis mutualistas en las que el parasito destruye una función del hospedero para luego el poderla realizar (Flegr, 2006).
Sin embargo, usted puede omitir la parte adquirida y argumentar que la resistencia a la enfermedad se debe a que el individuo se encuentra bien alimentado, vive en un amiente sin toxinas ambientales y realiza sus adecuados ejercicios. En cualquiera de los casos, la enfermedad es un fenómeno muy complejo en el cual el agente etiológico depende de factores intrínsecos de su anfitrión, así como de factores extrínsecos como la alimentación, el punto es que esto es cierto para todas las enfermedades, no solo para el coctel de enfermedades generado por el VIH, encontrar un individuo asintomático o inmune aunque sea sero-positivo, solo nos dice que ese individuo presenta una inmunidad natural, y ha convertido un parásito en un comensal, pero no nos dice nada sobre el comportamiento de ese mismo agente a nivel de una población grande, llena de otros individuos incapaces de controlarlo.
Virulencia y Morbilidad
No puede esperarse que la tasa de mortalidad de ninguna enfermedad sea de 100% o 0%, como todo fenómeno multifactorial la potencia se describe en torno a una gradualidad darwiniana, un espectro continuo desde la muerte a la carencia de los síntomas (Casadevall & Pirofski, 2000, 2015).
Figura 3.1. Virulencia. Por lo general la virulencia y la morbilidad son inversamente proporcionales (Casadevall & Pirofski, 2000, 2015), a mayor virulencia menos probabilidad de contagio, y viceversa.
Toda población darwiniana experimenta la enfermedad de cualquier tipo en base a este espectro en el que algunos mueren, otros experimentan los síntomas con más fuerza y otros se recuperan rápidamente sin mayores cuidados. Incluso enfermedades tan famosas y mortíferas como la viruela, el ébola o la peste negra, dejaban a su paso individuos que soportaban los síntomas con menor intensidad o nula intensidad (Lederberg, 1997).
Por esta razón en epidemiologia médica se establecen dos conceptos que obedecen a la idea básica darwiniana de una variación continua, la virulencia y la morbilidad. La morbilidad es la tasa con la cual un agente infeccioso se disemina en una población y puede ser entendida en términos de velocidad de propagación (Casadevall & Pirofski, 2000, 2015). Esta velocidad de propagación cambia dependiendo de la población afectada de forma continua y gradual. La virulencia es la potencia de los síntomas y su mortalidad. Ninguna enfermedad ha demostrado poseer una virulencia del 100% y el síndrome generado por el VIH no es la excepción.
Figura 3.2. El Ébola es muy virulento. Aun virus con altísima virulencia como el ébola raras veces sobrepasan el 90%, siempre en toda población darwiniana hay mutantes inmunes espontáneos.
Infección aguda
Las enfermedades infecciosas pueden pasar por dos etapas sintomatológicas de denominadas etapa aguda y etapa crónica (Soler, 2012). La etapa aguda se genera unos cuantos días o semanas después de que el agente etiológico ingresa al organismo, nuevamente el tiempo que se registra para cualquier enfermedad es un promedio con una variabilidad continua de corte darwiniano.
Esta etapa aguda se caracteriza por una mezcla de síntomas creados por el agente etiológico y otros causados por el cuerpo humano. Los síntomas intrínsecos generalmente no son específicos y no permiten un diagnóstico, todos los hemos sentidos y los llamamos comúnmente como gripa. Muchas enfermedades virales, bacterianas o causadas por protozoos pueden desencadenar los síntomas inespecíficos de la gripa y nosotros los pasaremos de largo como una simple gripa. En casos raros mezclados con los síntomas inespecíficos pueden presentarse los síntomas propios de la enfermedad como en el caso de la varicela, el sarampión o las paperas.
Infección crónica
Una infección crónica es aquella serie de síntomas que se dilatan en el tiempo afectando la calidad de vida del paciente y pueden llegar a matarlo, ejemplos de este tipo de infecciones son la tripanosomiasis o el coctel de enfermedades generados por el VIH (Soler, 2012). Las infecciones crónicas requieren dos requisitos, el primero es que el paciente sobreviva a la etapa aguda y la segunda que el agente etiológico logre acostumbrarse al sistema inmune de su anfitrión y logre entablar un estado semicomensal/semiparasítico, es decir que, al vivir en el cuerpo, aunque debilite a su anfitrión no lo mate.
Las infecciones crónicas tienden a tener síntomas más específicos y son muy difíciles de tratar, ya que sus síntomas generalmente se manifiestan cuando ya se ha realizado un daño muy fuerte a los tejidos del hospedero, el ejemplo típico es la fase neuronal de la sífilis que puede acarrear locura. Aunque el paciente se cure de las espiroquetas, su sistema nervioso no se recuperará nunca.
4. Etapas de la infección por VIH
4. Etapas de la infección por VIH
La infección por el Virus de Inmunodeficiencia Humana (VIH) es un tema de gran relevancia en la salud pública a nivel mundial. Comprender las etapas de esta infección es fundamental para el diagnóstico temprano, el tratamiento oportuno y la prevención efectiva. En este artículo, exploraremos las cuatro etapas principales de la infección por VIH: la fase de infección aguda, la fase de infección crónica, la fase de inmunodeficiencia sintomática y la fase de Síndrome de Inmunodeficiencia Adquirida (SIDA). Analizaremos los síntomas, la progresión de la enfermedad, los métodos de diagnóstico y las opciones de tratamiento disponibles en cada etapa. Con esta información, buscamos proporcionar una visión clara y concisa de las diferentes etapas de la infección por VIH, brindando a los lectores una comprensión más completa de esta enfermedad y fomentando una respuesta informada y empática hacia las personas afectadas.
Etapa aguda de la infección por VIH
La etapa aguda de la infección por el Virus de Inmunodeficiencia Humana (VIH) es un período crucial en el curso de la enfermedad. Durante esta fase inicial, el virus invade el organismo y desencadena una serie de eventos que marcarán el curso de la infección. En este artículo, nos adentraremos en la etapa aguda de la infección por VIH, explorando los síntomas característicos, los mecanismos de transmisión, los métodos de diagnóstico y las implicaciones clínicas. Además, analizaremos la importancia de la detección temprana y el tratamiento oportuno durante esta etapa para minimizar el impacto a largo plazo del virus en el sistema inmunológico. Al comprender en detalle la etapa aguda de la infección por VIH, esperamos fomentar la conciencia y el conocimiento necesarios para una respuesta efectiva y compasiva ante esta enfermedad de alcance global.
Síntomas de la infección aguda del VIH
El periodo inicial después de la infección por VIH se denomina VIH agudo o síndrome retroviral. El síndrome retroviral es inespecífico y para tener una idea de los síntomas, la gripa también es un retrovirus, solo que ambos linajes atacan diferentes tipos de células. Muchos individuos de hecho desarrollan síntomas de influenza o mononucleosis entre 2 y 4 semanas después de una exposición, sin embargo, algunos individuos pueden no presentar ningún síntoma.
Figura 4.1. Algunos síntomas de la etapa aguda. El problema con el VIH es que muchas veces los síntomas extremos como la inflamación de los nóodulos o la reactivación de la varicela no se presentan.
SIDA en la etapa aguda por VIH
El ataque agudo y el ataque crónico del VIH afectan a los mismos linajes celulares del sistema inmune y en consecuencia algunos individuos particularmente propensos pueden experimentar SIDA en la etapa aguda (Altfeld et al., 2003; Cooper et al., 1985). Por tal razón varias infecciones oportunistas pueden desarrollarse de forma concomitante a los síntomas inespecíficos semejantes a la gripa como nausea, vómito, diarrea, neuropatías periféricas y síndrome de Guillain-Barre.
De hecho, los síntomas de mononucleosis pueden deberse a infecciones paralelas con microorganismos típicos oportunistas como el virus Epstein-Barr. Los síntomas neuropáticos pueden ser provocados por el VIH en persona ya que también es capaz de afectar las células gliales del sistema nervioso.
Figura 4.2. Factores de riesgo para la infección con VIH.
La etapa aguda del VIH raras veces es reconocida
Debido a su naturaleza inespecífica, los síntomas de la etapa aguda de la infección por VIH, esto raras veces son reconocidos como tales. Incluso en casos donde el paciente consulta al doctor local o al hospital, el mal diagnóstico es común si no se tiene en cuenta los factores de riesgo entre dos y cuatro semanas antes de los primeros síntomas.
Por tal razón es necesario estar atentos a los factores de riesgo como son la transfusión de sangre, compartir jeringas, prácticas sexuales de todo tipo sin preservativos de tipo barrera “condones” o manejo de material biológico posiblemente contaminado (Cameron et al., 1989; Koblin et al., 2006). En cualquier caso, una vez que ya ha llegado a la etapa aguda el VIH permanecerá en su portador hasta la muerte en la inmensa mayoría de los casos.
Crecimiento de la concentración del VIH en etapa aguda
La línea celular que ataca el VIH es el de los linfocitos T CD4+ encargados de activar la respuesta inmune y son denominados efectores.
Figura 4.3. Carga viral y linfocitos T CD4+ contra tiempo, etapa aguda. La carga viral se mide por medio de la concentración de su ARN, el cual puede detectarse de manera muy precisa con la técnica de Reacción en Cadena de la Polimerasa o PCR con sus siglas en inglés, así que no esperen que eso se mida con un microscopio.
Durante la etapa aguda la carga viral aumenta exponencialmente hasta que causa un semicolapso, sin embargo, la concentración inicial de linfocitos T permite una activación inicial del sistema inmune adaptativo que conlleva a la regulación de la carga viral.
Sin embargo, los virus remanentes se adaptan a esta respuesta y continúan sobreviviendo con lo que inicia la etapa de latencia. La carga viral en la etapa de latencia varía según el individuo. La concentración de los virus no se asume por viriones sino por copias de su ARN detectadas por técnicas de biología molecular como la PCR.
Etapa de latencia de la infección por VIH
Los síntomas iniciales son reemplazados por una prolongada etapa sin síntomas también denominada etapa crónica o de latencia, estarás sintomatológicamente sano, incluso será muy complicado poder detectar carga viral alguna. Aunque parece que el virus se hace más lento y letárgico, realmente el virus continúa su replicación a gran velocidad pero sin diezmar aun al sistema inmune. Esta etapa posee una duración variable que depende de los factores intrínsecos del virus y su anfitrión, así como de factores extrínsecos al anfitrión como la alimentación o el modo de vida.
Síntomas de la etapa de latencia
Aunque la falta de síntomas es precisamente la característica de la etapa de latencia, el agotamiento del sistema inmune empieza a hacerse notar de forma gradual cerca del final de la latencia. En este punto intermedio mucha gente experimenta fiebres nocturnas sin causa aparente, pérdida de peso, problemas gastrointestinales recurrentes y dolores musculares posiblemente causados por la reactivación de parásitos intramusculares como toxoplasma.
Figura 4.4. Síntomas en la etapa de latencia. Cuando el virus está en latencia no hay muchos síntomas, en casos raros hay linfadenopatías recurrentes.
Entre el 50-70% de las personas desarrollan una linfadenopatía persistente y generalizada que se caracteriza por una dilatación de los nódulos linfáticos sin dolor y sin experimentar fiebre. Estos síntomas pueden extenderse por seis meses. La linfadenopatía regresa poco antes del final de la etapa de latencia, y desde aquí en adelante las cosas irán de mal en peor.
Control de la carga viral de HIV
Aunque la mayoría de los pacientes con la variante 1 del VIH poseen una carga viral detectable en ausencia de tratamientos antiretrovirales, la mayoría retiene una concentración normal del linaje celular que es atacado de forma específica por el VIH. Estos individuos experimentan una progresión muy lenta de la etapa crónica a la etapa de SIDA y son denominados progresivos a largo plazo o controladores.
Figura 4.5. El darwinismo viral. El control sobre el VIH es un ejemplo más de la variabilidad continua y gradual o darwiniana de los seres vivos, donde los extremos de morir pronto o no morir son rarezas en comparación con aquellos que mueren en un período intermedio de alrededor de 15-20 años.
Otros individuos también mantienen una carga viral pero tan baja sin la ayuda de los antiretrovirales que no es detectable por ningún método, a este grupo de individuos se los denomina controladores de élite o supersores de élite. En cualquier población cerca de 1 de cada 300 individuos es un supresor de élite.
Progresión de la carga viral del VIH
En la etapa de latencia el virus no se queda quieto y aun cuando el anfitrión sea un supresor de élite con el tiempo la carga viral se adapta al sistema inmune diezmándolo y agotándolo hasta llegar a un punto crítico.
Por norma se considera este punto crítico cuando la carga de linfocitos T efectores disminuye a menos de 200 células por milímetro cúbico de sangre. La progresión de la etapa crónica cambia mucho dependiendo del anfitrión, muchas veces sus sistemas inmunes son muy potentes y entre menor sea la carga viral después de la etapa crónica más lenta será la progresión a la etapa de SIDA. El control de VIH corre de manos de los linfocitos T citotóxicos quienes se encargan de eliminar los virus y los canceres matando el tejido infectado, su código es CD8.
Los individuos con una baja respuesta de sus CD8 hacia las células infectadas son normales, los que poseen una respuesta moderada son controladores y los que poseen una respuesta alta son supresores de élite (Casartelli et al., 2003; Kumar, 2013; Raghwani, Bhatt, & Pybus, 2016; Sheppard, Lang, Ascher, Vittinghoff, & Winkelstein, 1993). El problema es que los linfocitos T CD4 que son el blanco del virus solo se encuentran en los nódulos linfáticos en masa, en los demás lugares están circulando, por lo que aunque los CD8 barran con la infección en los nódulos linfáticos inflamándolos, jamás logran eliminar la infección en todo el cuerpo debido a los CD4 remanentes que circulan en todo el sistema.
Consecuencias de la etapa de latencia
La etapa de latencia tan prolongada en el VIH es su factor más aterrador ya que lo convierte en una pandemia silenciosa que se expande a gran velocidad sin que las personas se den cuenta. Los individuos en la etapa de latencia son contagiosos, y si poseen muchos compañeros sexuales en la década de latencia “que coinciden con los años de mayor apetito sexual” el contagio se realiza de forma muy extensa.
Etapa de SIDA de la infección por VIH
El Síndrome de InmunoDefciencia Adquirida se caracteriza por una disminución de los linfocitos T efectores de forma sostenida por debajo de una concentración de 200 células por mililitro. En ausencia de un tratamiento que extienda la etapa de latencia la mayoría de los individuos –pero no todos –desarrollan la etapa de SIDA antes de 10 años, pero esto varía mucho dependiendo de si el individuo es controlador o supresor de élite de la carga viral.
Figura 4.6. Carga viral y linfocitos T CD4+ contra tiempo, etapa de SIDA. En la etapa de latencia es donde se da el conflicto real entre el VIH y el sistema inmune, este conflicto normalmente lo ganará el VIH después de un período que varía entre los 2 a los 30 años o más, con individuos raros que no se infectan o que la controlarán permanentemente.
Las condiciones iniciales son leves, pero a medida que el sistema inmune pierde la batalla contra el virus del VIH el cuerpo es incapaz de enfrentar aun las infecciones más débiles y comunes. A parte de los síntomas específicos generados por cada una de las infecciones oportunistas existe una gama de síntomas generales como la sudoración nocturna sin ninguna causa aparente, la inflamación de los nódulos linfáticos, escalofríos, temblores, debilidad y pérdida de peso. Por lo anterior, esta sección no está dedicada al VIH en sí mismo, sino a las infecciones oportunistas en la etapa de SIDA.
Figura 4.7. SIDA y la sociedad. En la película Filadelfia (Demme, 1993), específicamente en la escena de la biblioteca se nos muestra cómo fue, y de hecho, como es aun el comportamiento de la sociedad ante un enfermo con SIDA, el estigma provoca una muerte social que antecede a la muerte física (Airhihenbuwa, Ford, & Iwelunmor, 2013; Alonzo & Reynolds, 1995; Turan & Nyblade, 2013), el problema es que cuando se tiene SIDA, es poco probable que contagies a otras personas, el peligro es a la inversa, que las demás personas de maten a ti, con un simple estornudo.
Otras causas para las enfermedades oportunistas
Del VIH se puede decir que causa dos cosas, una disminución del conteo de linfocitos efectores y una neuropatía debido a su capacidad de infectar algunas células gliales, por lo demás no causa nada más, los síntomas asesinos son provocados por la ausencia de los linfocitos T efectores. El asunto es que cualquier otra causa que inhabilite al sistema inmune en su sección adaptativa puede generar los mismos síntomas. SIDA no es una enfermedad, es un conjunto de enfermedades causada por muchos otros agentes etiológicos. En cualquier caso, otras causas que pueden causar un debilitamiento del sistema inmune son:
(a) Desnutrición, en cuyo caso se acompaña con anemias.
(b) Fatiga crónica.
(c) Inmunosupresión para el trasplante de órganos.
(d) Quimioterapia para el tratamiento del cáncer.
(e) Varios tipos de cáncer como linfoma, leucemia y mieloma múltiple.
(f) Envejecimiento.
(g) Factores genéticos que inhabilitan al sistema inmune.
(h) Algunos tratamientos con antibióticos.
5. Infecciones oportunistas en la etapa de SIDA: virus
5. Infecciones oportunistas en la etapa de SIDA: virus
Esta es la razón por la cual nos enfocamos tanto en el VIH, la gran mayoría de infecciones de transmisión sexual también son infecciones oportunistas, o viajan en combo con el VIH. Las que no veamos en esta sección, las discutiremos al final.
Los virus son entidades que se consideran no vivas (Sadava et al., 2014) debido a que no poseen un metabolismo, debido a esto deben secuestrar el metabolismo de una célula viva para poder reproducirse. Todos los virus son parásitos de anfitriones vivos. A continuación, mencionaremos los virus con mayor implicación en la etapa de SIDA.
Herpes tipo 8
El herpes tipo 8 genera la patología denominada Sarcoma de Kaposi. El Sarcoma de Kaposi es un tumor causado por un virus de tipo herpes de clase 8 del cual se conocen 4 variantes. Solo dos se relacionan con la inmunosupresión, por lo general cuando no está relacionado con una inmunosupresión, el sarcoma de Kaposi es muy raro afectando hombres de etnias del Mediterráneo y de Europa oriental.
Figura 5.1. El sarcoma de Kaposi. (Arriba) El sarcoma de Kaposi también ataca las membranas mucosas como las encías y el tracto gastrointestinal, en la imagen anterior podemos ver un sarcoma en la encía infectado de forma secundaria con un hongo tipo levadura llamado cándida. (Abajo) Lesiones cutáneas típicas del sarcoma de Kaposi.
Las lesiones del sarcoma de Kaposi generalmente se presentan como lesiones cutáneas que comienzan como una o varias maculas rojo-purpúreas. Estas máculas posteriormente se convierten en pápulas, nódulos y placas las cuales se diseminan por la cabeza, espalda cuello, tronco y membranas mucosas como las encías.
Sin embargo, el sarcoma de Kaposi se convirtió en una de las enfermedades acompañantes de la etapa de SIDA más reconocidas durante los años 80s, pues debido a que muchos pacientes de étnicas caucásicas y afroamericanas que no habían recibido jamás trasplante de órganos o nunca habían requerido de ciclosporinas presentaban súbitamente una enfermedad tan rara hasta ese momento los doctores empezaron a sentirse algo confundidos.
Figura 5.2. El sarcoma de Kaposi 2. En las fotos anteriores presentamos algunos tipos de lesiones por sarcoma: (A) pápulas, (B) máculas y (C) nódulos. Originalmente el sarcoma de Kaposi se presentaba en otras poblaciones distintas a las del mediterráneo o europa del este cuando la inmunosupresión era mediada por medicamentos como las ciclosporinas necesarias para el trasplante exitoso de órganos, debido a la incompatibilidad tisular entre donante y receptor.
Debido a la ineptitud del sistema inmune en la etapa de SIDA el sarcoma puede avanzar indiscriminadamente hacia el tracto gastrointestinal y los pulmones. Estadísticamente, el sarcoma de Kaposi para inmunosuprimidos es 300 veces más común en un paciente en etapa de SIDA que en un paciente con inmunosupresión por transplante de riñón. Cabe anotar que el herpes virus 8 también es una enfermedad de transmisión sexual por sí misma, pero no es capaz de infectar de forma exitosa a su anfitrión con un sistema inmune sano.
Virus del papiloma humano VPH
Este es un virus extremadamente variable, existen más de 120 variantes donde algunas poseen una mayor propensión a producir cáncer, mientras que otras tienden a generar pápulas y verrugas genitales. Adicionalmente el virus del papiloma humano tiene la mala tendencia a provocar mutaciones en los tejidos que afecta incrementando la probabilidad de cáncer en diversos sistemas de órganos tanto en hombres como en mujeres.
Figura 5.3. Virus del papiloma humano. En relación con un paciente en etapa de SIDA las verrugas genitales pueden progresar mucho y a diferencia de un paciente con un sistema inmune sano, los tratamientos contra estas verrugas son generalmente inefectivos en la etapa de SIDA. Las verrugas pueden aparecer en otras mucosas debido a ciertas posiciones sexuales y a un sistema inmune debilitado.
Herpes simple
Aunque el herpes virus 2 es el genital y el herpes virus 1 es el bucal ambos pueden tener fuertes efectos en el desarrollo de la patología del VIH. Nuevamente recalcamos que el herpes virus 2 será tratado con mayor profundidad en artículos futuros, pero por el momento nos enfocaremos en sus efectos sobre el VIH. La mayoría de los individuos que se infectan con el VIH ya están infectados con los herpes 1 y 2 y aunque el herpes bucal y genital es una infección leve o asintomática puede acelerar la progresión de la etapa de latencia del VIH.
Figura 5.4. Herpes potenciado. Las pápulas del herpes crónico causado por una confección con SIDA son mucho más grandes que en una infección normal y adicionalmente puede extenderse más allá de las mucosas bucal y genital.
Varios estudios han encontrado que una infección previa con los virus del herpes incrementa en un 300-400% la posibilidad de infectarse con el virus del VIH después de una exposición con un factor de riesgo. Adicionalmente la carga viral en la etapa asintomática aumenta. Por otro lado, las reactivaciones de la infección por herpes son muy comunes en la etapa de SIDA. Las razones de esta sinergia entre las dos infecciones no son muy bien conocidas.
Hepatitis B y C
Como muchas de las enfermedades oportunistas, los virus de la hepatitis B y C son diseminados por los mismos factores de riesgo que el VIH y en consecuencia pueden ocurrir coinfecciones. A diferencia de otras enfermedades virales que hemos tratado con anterioridad la hepatitis tiene pocos síntomas dermatológicos, pero uno es muy determinante y es la ictericia, aunque esta es rara especialmente en la versión C.
El síntoma principal de la hepatitis la describe su propio nombre: hepatos = hígado; itis = inflamación; por lo anterior las hepatitis son infecciones que inflaman el hígado y lo dañan inutilizándolo. Lo anterior puede provocar otros problemas al cuerpo debido a que el hígado filtra toxinas de los alimentos y también recicla la hemoglobina y la expulsa del cuerpo a través de la glándula biliar.
Figura 5.5. La hepatitis. (Arriba) La ictericia es una coloración amarillenta de la piel y especialmente de las esclerótidas "lo blanco de los ojos"; (Abajo) El modelo anterior muestra la progresión de la hepatitis es mostrada mediante el siguiente modelo que describe textura y color. A la izquierda se encuentra un hígado normal de un color rojo oscuro, luego está el hígado inflamado y con una coloración amarillenta típica de la hepatitis, si no es tratado pasa a la etapa de cirrosis y cáncer hepático a la derecha. La hepatitis viral es considerada una de las principales causas de muerte entre las personas VIH positivas, debido a que puede ocasionar problemas crónicos en el hígado, falla o insuficiencia del hígado y cáncer de hígado. En consecuencia, muchas personas VIH positivas deben combatir dos infecciones al mismo tiempo.
Herpes de Zoster
El herpes de Zoster puede clasificarse en dos etapas, una es extremadamente común y la otra no tanto e inclusive puede suceder sin que exista una inmunosupresión. El herpes de Zoster en su primera etapa todos lo hemos tenido alguna vez a menos que la vacuna si funcione y lo llamamos varicela. Los síntomas de varicela se caracterizan por soros o lesiones cutáneas en el pecho, cuello rostro, cabeza y extremidades y en algunos casos raros puede ocasionar problemas pulmonares y neuronales.
Figura 5.6. La varicela potenciada. Síntomas normales de la varicela infantil normal (derecha), el virus jamás desaparece, sino que se resguarda en el nervio trigémino en el rostro (arriba izquierda) del cual puede emerger periódicamente con síntomas más leves, pero si el sistema inmune falla, las reapariciones pueden causar síntomas graves (izquierda abajo).
La varicela-Zoster o rubeola es una enfermedad típica de la niñez de la que creemos curarnos de forma definitiva una vez que los síntomas terminan. Lo que muchos no saben es que no nos curamos de su patógeno el herpes virus tipo 3, este permanece “como la mayoría de los herpes” en latencia en el sistema nervioso en el nervio trigémino. Hasta 1990 las reactivaciones del herpes virus III eras muy raras en comparación con las reactivaciones del herpes virus I “bucal” y del herpes virus II “genital”. Las reactivaciones pueden no estar acompañadas por el típico salpullido cutáneo y por el contrario pueden causar complicaciones series como inflamación de las meninges y del cerebro “meningoencefalitis”.
A pesar de que la reactivación puede ocurrir independientemente a la etapa de SIDA “un sero-negativo la puede sufrir igualmente” lo que sucede en la etapa de SIDA es que los episodios de reactivación son frecuentes y mucho más fuertes, adicionalmente sus síntomas se asemejan más a la viruela en el sentido de que inflama la córnea y puede dejar ciego a su portador. A demás, al igual que en la viruela, los soros o placas se extienden en las mucosas bucales y gastrointestinales.
Herpes tipo 5
También conocido como el citomegalovirus, es una enfermedad sexual en toda regla solo por un detalle, ¡es patético!, prácticamente se lo puede describir como un comensal indeseado y solo en casos raros su fase aguda causa síntomas de una gripa leve. Por tal razón cerca del 80% de los adultos mayores de 40 años es portador de este bicho indeseable pero completamente inocuo a menos que… tu sistema inmune falle.
Herpes tipo 4
También conocido como el virus Epstein-Bar. El herpes tipo 4 es de los virus más comunes en el ser humano, y siendo prácticos es mejor que te infectes con en la infancia debido a que sus síntomas en tal etapa del desarrollo no sobrepasan las de otras enfermedades de la infancia. Para la etapa de la adolescencia puede provocar mononucleosis entre el 40-50% de los casos a través de los primeros besos, y por tal razón se lo denomina la enfermedad del beso.
Figura 5.7. Herpes tipo 5. Síntomas normales de la enfermedad del beso, con inflamación de los ganglios linfáticos (A); Cuando se reactiva con un sistema inmude debilitado causa retinitis severa que puede llevar a la ceguera (B).
Sin embargo, la mononucleosis es el menor de los problemas en caso de que alguien desarrolle la etapa de SIDA o su sistema inmune se suprima por alguna otra causa. Si lo anterior sucede el herpes virus 4 emerge con una gama nueva de síntomas más problemáticos como, por ejemplo: linfomas “cáncer”, cáncer de garganta, leucoplaquia vellosa “imagen principal”, y linfoma del sistema nervioso central. En resumen, una palabra, cáncer, el herpes virus 4 con SIDA provoca varios tipos de cáncer.
Influenza
Una de las cosas que aprendes sobre la etapa de SIDA es que una persona sana puede ser la muerte para estas personas, esto es debido a que somos portadores de enfermedades que para un paciente con SIDA son mortales. La influenza, comúnmente denominada gripa es por mucho una de las enfermedades más comunes, especialmente en las estaciones del pico de infección. En los pacientes con SIDA la grupa puede desencadenar rápidamente una neumonía que puede debilitar su cuerpo rápidamente, y si este ya está mermado por otras enfermedades oportunistas el efecto sinérgico es devastador. La prevención de la gripa en un paciente con etapa de SIDA “y en tratamiento con antirretrovirales” requiere elegir bien la vacunación, deben considerarse las vacunas que suministran al virus muerto, un virus debilitado puede causar efectos inversos a los esperados. La influenza puede considerarse el más peligroso de los virus oportunistas, por su ubicuidad, facilidad de transmisión y poco cuidado que tienen sobre ella los individuos inmunocompetentes.
6. Infecciones oportunistas en la etapa de SIDA: bacterias
6. Infecciones oportunistas en la etapa de SIDA: bacterias
Las infecciones bacterianas oportunistas en la etapa de SIDA se caracterizan por una tendencia marcada a atacar los órganos internos, especialmente el sistema respiratorio siendo unas de las principales causas de muerte de los pacientes con VIH positivo. Las bacterias a diferencia de los virus si pueden ser atacadas por medio de antibióticos, los cuales actúan de forma independiente al sistema inmune, el problema emerge desde dos frentes que no son exclusivos. El primero, ya cuando la pandemia de VIH se detectó en los años 80s, hacía 10 años que también había empezado a reportarse indicios de cepas bacterianas inmunes a los antibióticos, lo cual provocó que se emplearan versiones cada vez más tóxicas y con más efectos secundarios.
En la actualidad la investigación sobre nuevos antibióticos no es un campo que sea muy explotado por las farmacéuticas, por lo que las cepas resistentes se han convertido en un problema tremendo para los médicos y mucho más para un paciente con SIDA ya que sin antibióticos efectivos está condenado a morirse. Lo mismo es cierto para cualquiera que presente una supresión del sistema inmune.
Acinetobacter baumanni
La infección por Actinobacter baumanii es causada por una bacteria Gram negativa de tipo coco. Puede causar infecciones inespecíficas que por efecto necrótico de los tejidos puede afectar la función de los pulmones, la sangre, el cerebro, el tracto urinario y renal, así como la piel expuesta por cortes. A. baumanii es muy contagioso especialmente en individuos que poseen un sistema inmune comprometido ya sea por su debilitamiento ante otras enfermedades, ante tratamientos contra el cáncer o por inmunosupresión intrínseca “como en los linfomas” o por inmunosupresión adquirida “SIDA”.
Figura 6.1. Síntomas cutáneos de una infección grave de A. baumanii resistente a antibióticos.
Dado que los hospitales se han convertido en los vectores más importantes para su diseminación se la ha clasificado como altamente peligrosa bajo el término de nosocomial “hospital de enfermos”. Por si mismo A. baumanii ya es malo –se la conoce actualmente como la peste irakí debido a que los soldados heridos han presentado una epidemia de infección con esta bacteria – pero dos casos lo hacen imparable, la primera es que se ha convertido en multiresistente, la segunda es que la inmunosupresión típica de la quimioterapia, el trasplante de órganos o la etapa de SIDA la convierten en una sentencia de muerte.
Clostridium difficile
Clostridium difficile es una especie bacteriana del género Clostridium, los cuales son bacilos Gram positivos formadores de esporas, anaerobios estrictos. El punto con C. difficile es que es un condenado comensal, había como parte de la biota normal del intestino con otras bacterias que nos colaboran en una relación mutualista. Las demás bacterias compiten por el espacio y los nutrientes impidiendo que C. difficile se expanda, pero con un tratamiento con antibióticos la cosa cambia. C. difficile es de por si resistente a la mayoría de los antibióticos y con la remoción de la competencia prospera. Al prosperar produce una toxina que causa una diarrea que se clasifica como endógena debido a que no es causada por una infección externa.
Figura 6.2. Este epitelio intestinal debería ser plano y rosado.
Las infecciones con C. difficile se hacen más frecuentes y potentes a medida que la etapa de SIDA se acentúa, aunque ha podido controlarse gracias a los tratamientos con anti-retrovirales. Este detalle nos revela que los antiretrovirales para el tratamiento del SIDA no causan las enfermedades oportunistas, por el contrario, retrasan su aparición mientras que el régimen del tratamiento sea estricto. La bacteria es ubicua y puede estar como comensal de algunas personas VIH-negativo, así como en alimentos o la superficie de mascotas.
Legionella pneumophila
Legionella pneumophila es una bacteria pleomórfica, flagelada, Gram negativa del género Legionella. En pacientes no inmunocomprometidos ya es de por si un problema ya que causa la enfermedad del legionario. Los pacientes con legionelosis tiene normalmente fiebre, escalofríos y tos, que puede ser seca o con moco. Algunos pacientes tienen también dolores musculares, dolor de cabeza, cansancio, pérdida de apetito y, ocasionalmente, diarrea. Las pruebas de laboratorio enseñan que los riñones de estos pacientes no funcionan correctamente. La radiografía de tórax muestra frecuentemente una neumonía. Es difícil distinguir la enfermedad del legionario de otros tipos de neumonía simplemente por los síntomas; se necesitan otras pruebas para establecer su diagnóstico.
El punto no son los síntomas sino el hecho de que muchas personas sanas entran en contacto con el patógeno y no se enferman. De hecho, en términos de probabilidad solo aquellas personas con enfermedades respiratorias previas, de edad avanzada o que se encuentran inmuno-comprometidas pueden presentar una probabilidad de desarrollar los síntomas de la enfermedad del legionario. En términos del SIDA, el desarrollo de la enfermedad del legionario se hace más probable, y de hecho aun cuando se trate la enfermedad puede regresar varias veces mermando al paciente en cada evento.
Pseudomonas aeruginosa
Pseudomonas aeruginosa es una bacteria Gram-negativa, aeróbica, con motilidad unipolar. A diferencia de muchas de las infecciones previas, P. aeruginosa no es patógena a menos que exista alguna causa subyacente que inhabilite el sistema inmune, puesto que las septicemias por esta bacteria en los pacientes inmunocompetentes es extremadamente rara.
Por lo anterior es una de las enfermedades que cumple estrictamente con la definición de infección oportunista en etapa de SIDA. Para un paciente inmunocomprometido, especialmente para aquellos en la etapa de SIDA es lo opuesto, siendo la principal causa de neumonía recurrente. Adicional a la neumonía P. aeruginosa también se disemina por el cuerpo causando septicemia general e infecciones renales muy serias.
Staphylococcus aureus
Es una bacteria anaerobia facultativa, Gram positiva, inmóvil y no esporulada que se encuentra ampliamente distribuida por todo el mundo, estimándose que una de cada tres personas se halla colonizadas, aunque no infectadas. En el video de la introducción se lo denomina como estafilococo dorado “aureus = dorado” y en consecuencia representa una infección común con el problema agravado de una amplia resistencia a los antibióticos. Aunque generalmente es un comensal de la piel, con heridas pueden presentarse infecciones graves, especialmente con las sepas hospitalarias que son las más virulentas. Por lo anterior se la clasifica como una enfermedad nosocomial.
Evidentemente un paciente en etapa de SIDA se hace más susceptible al ataque por S. aureus desarrollando inicialmente síntomas cutáneos similares a los que tienen los recién nacidos que no han desarrollado su sistema inmune. Aunque si hay que reconocer que S. aurerus multiresistente es capaz de matar tanto o más de forma independiente a una inmunosupresión.
Streptococcus pneumoniae
Es una bacteria Gram-genativa, inmóvil y que no forma endosporas. Es un patógeno del sistema respiratorio por sí solo, pero en inmunosuprimidos puede infectar profundamente causando septicemia y encefalitis. De hecho, la probabilidad con la que un individuo en etapa de SIDA contraiga este neumococo es 150 veces más alta que un paciente inmunocompetente de la misma edad, en términos de probabilidad se puede decir que el SIDA incrementa en un 1500% la probabilidad de contraer el pneumococo. Ahora como en la mayoría de estas infecciones, S. pneumoniae también presenta problemas de resistencia a los antibióticos, lo cual ha dejado a los doctores desarmados para tratar esta infección en pacientes inmunocomprometidos.
7. Infecciones oportunistas en la etapa de SIDA: Protistos
7. Infecciones oportunistas en la etapa de SIDA: Protistos
Aunque comúnmente se los denomina parásitos y de hecho así se los denomina en la literatura científica en términos de relaciones ecológicas tanto los virus como las bacterias patógenas establecen una relación de parasitismo si viven con o en nuestro interior y nos lastiman. Sin embargo, con el fin de que el lector pueda conectar lo dicho aquí con otros textos haremos referencia a estos organismos clasificados como protistas en la antigua taxonomía de Wittaker como parásitos.
Los protistas son aquellos eucariotas que no se clasifican como un animal, una planta o un hongo. No todos los protistas son parásitos, pero los que lo son pueden entablas ciclos de vida muy complejos como en el caso de Toxoplasma o Plasmodium. Aunque varias parasitemias son muy famosos como la de Plasmodium causante de la enfermedad más mortífera de la actualidad “la malaria”, haremos referencia solo a aquellas parasitemias que han sido reconocidas como oportunistas en un paciente inmunocomprometido.
Toxoplasma gondii
Como parásito del sistema digestivo lo hemos de tratar con más profundidad en artículos futuros, pero he aquí un resumen. Toxoplasma es un género de parásitos que aprovecha la relación depredador-presa para reproducirse y su característica más representativa es que el depredador sea un felino. Existen toxoplasmas para leones tigres y para el contexto humano el gato.
La especie que infesta al gato doméstico es Toxoplasma gondii. En la presa el parásito genera una etapa aguda y una etapa de latencia o crónica. La etapa aguda se caracteriza por síntomas inespecíficos como los de la gripa, mientras que la etapa crónica es generalmente asintomática y se caracteriza por quistes de protección en los tejidos musculares y del cerebro. El quiste espera hasta que la presa sea devorada por el depredador.
En el depredador genera una etapa aguda caracterizada por una gastroenteritis con diarrea que pasa rápidamente, Las heces durante esta gastroenteritis poseen los quistes que al quedar sobre el pasto son devorados por el herbívoro completando el ciclo. Los humanos entramos allí debido a que podemos consumir accidentalmente rastros de las heces del gato y somos introducidos como la presa, es decir el parasito se enquista en nuestro tejido hasta la muerte.
Con SIDA el problema es que los quistes se reactivan disolviendo los tejidos del cerebro, los pulmones y la sangre asemejándose a una septicemia necrosante, la muerte viene por la falla funcional de los órganos como el cerebro, el pulmón o el corazón. Aunque antes de ello múltiples síntomas neuronales se hacen presentes como demencia, o ceguera.
Figura 7.1. Ciclo de vida de Toxoplasma gondii. El humano entra en el ciclo de toxoplasma como la presa, así que las larvas del parásito que insertarán en el músculo a la espera de que el depredador nos coma.
Coccidias gastrointestinales
Isospora, Cyclospora y Cryptosporidium son parásitos apicomplejos “mismo grupo de los plasmodios” que infectan el tracto gastrointestinal. Infectan un solo anfitrión en su ciclo vital generando una dolencia aguda del tracto gastrointestinal con diarrea como principal síntoma. Sus quistes no se encuentran en los tejidos de los herbívoros como en toxoplasma sino en el ambiente, al ser aeróbicos contaminan el aire y los alimentos, por lo que su diseminación se interrumpe con un bien sistema de letrinas y desagües.
En un paciente en etapa de SIDA la isosporiasis/cripstosporiasis/ciclosporiasis puede provocar una gastroenteritis aguda que conlleva a una rápida deshidratación y a la muerte en caso de no ser tratada. Adicionalmente el parásito puede invadir hacia el interior del cuerpo afectando los nódulos linfáticos y otros órganos como los pulmones. El más común es Cryptosporidium pero en su conjunto se las denomina coccidias debido a que generan un cuadro clínico semejante.
8. Infecciones oportunistas en la etapa de SIDA: Hongos
8. Infecciones oportunistas en la etapa de SIDA: Hongos
En la etapa avanzada del Síndrome de Inmunodeficiencia Adquirida (SIDA), el sistema inmunológico debilitado se convierte en un terreno fértil para el desarrollo de infecciones oportunistas. Entre estas, los hongos representan una amenaza significativa para la salud de las personas afectadas. En este artículo, nos adentraremos en las infecciones fúngicas oportunistas que pueden surgir en la etapa de SIDA. Exploraremos los tipos de hongos más comunes, sus vías de infección, los síntomas asociados y los enfoques de tratamiento disponibles. Además, destacaremos la importancia de la prevención y el monitoreo regular de estas infecciones en personas con SIDA. Al aumentar la conciencia sobre las infecciones oportunistas por hongos en la etapa de SIDA, esperamos contribuir a una atención médica más temprana y efectiva, mejorando así la calidad de vida de las personas afectadas por esta compleja enfermedad.
Microsporidium
Aunque antes se lo consideraba un protozoo en años recientes estudios filogenéticos lo han puesto como grupo hermano de los demás hongos. Su estructura es muy simple exceptuando su ciclo sexual e infectivo lo cual es típico de los parásitos, pero carecen de otros organelos como las mitocondrias.
Por su simplicidad por varios años se lo clasificó en la base del árbol filogenético de los eucariotas, pero actualmente se lo clasifica formalmente como un hongo aun cuando muchos manuales de parasitología lo referencian como un protista. Los síntomas de la microsporidiosis son similares a los de las coccidias apicomplejas, es decir una infección gastrointestinal. Esta infección solo se reporta para los pacientes inmunocomprometidos.
Aspergillus sp
Los hongos del género Aspergillus son omnipresentes, pueden encontrarse esporas debido a su crecimiento en una hoja muerta, madera vieja de un tejado, una rata muerta bajo el piso, granos almacenados por mucho tiempo en condiciones húmedas, y en general madera muerta.
Debido a tan cosmopolita distribución deberíamos estar todos enfermos, ¿cierto? Pues la respuesta nuevamente es que la mayoría somos inmunocompetentes, Aspergillus es rebotado de nuestros cuerpos gracias a nuestro sistema inmune. En una persona inmunocomprometida como en los pacientes en la etapa de SIDA provoca la enfermedad llamada aspergiliosis. Las esporas de Aspergillus son aerotransportadas, lo que implica que las rutas de entrada son el tracto digestivo donde el aun ácido del estómago las detiene, el problema es que atacan los pulmones, que sin células inmunes se convierten en un caldo de cultivo para el hongo. La infección puede diseminarse al resto del cuerpo como ocurre en la mayoría de las infecciones oportunistas que en condiciones diferentes al SIDA se contienen en un órgano específico.
En África una de las condiciones que ha empeorado la pandemia del VIH y el SIDA son los múltiples parásitos, virus y hongos, incluso los intentos de ayuda se convierten en venenos, como por ejemplo el grano para alimentar a la población desnutrida, el cual si no es almacenado correctamente se convierte en un vector para Aspergillus.
Candida
Los hongos del género Cándida son un comensal común de las mucosas y la piel humana, así como del tracto reproductor femenino.
Figura 8.1. Infección grave por cándida.
La candidiasis o infección sistémica por Cándida se da por dos razones. La primera es por una contaminación de la sangre por la levadura, y la segunda es por un sistema inmune debilitado. Los síntomas de la candidiasis en un paciente inmunocomprometido son diversos, en las mucosas se da crecimiento de una colonia en placa “de color blanco” generalmente asociada a soros o lesiones causadas por otras enfermedades como los herpes.
Las mucosas son particularmente vulnerables al ataque de Cándida, tanto las bucales como las vaginales, del mismo modo puede atacar el tracto gastrointestinal como en esta imagen de un esófago severamente afectado. En el sistema interno de órganos ocasionan problemas en los pulmones, visión y corazón que pueden llegar a ser fatales.
Cryptococcus
Los criptococos son hongos del grupo de los basidiomicetos que permanecen en estado de levadura, la especie que genera problemas médicos se denomina Cryptococcus albidus. Aunque es una especie cosmopolita en países como Portugal y por lo tanto hace parte de la biota normal de comensales en la piel de los individuos inmunocompetentes, la cuestión es muy diferente en los inmunocomprometidos.
La enfermedad que se causa se denomina criptocococis caracterizada por lesiones cutáneas, sistémicas y oculares. Si es inhalado invade los pulmones causando una neumonía frecuentemente fatal. Este es un perfecto ejemplo de un patógeno oportunista, mientras el sistema inmune está sano entabla una relación de comensalita en la piel, pero sin el sistema inmune rápidamente cambia su relación a una parasítica mortal.
Histoplasma
La especie que genera la enfermedad se denomina Histoplasma capsulatum que causa la enfermedad llamada histoplasmosis, como en la mayoría de los hongos genera una neumonía aguda. En los pacientes inmunocompetentes los síntomas se restringen al pulmón y las reinfecciones presentan síntomas más suaves debido a la memoria del sistema inmune. En los pacientes inmunocomprometidos se tiene el problema de que los síntomas pulmonares son más fuertes, se dispersan a los demás órganos y todas las reinfecciones son igual de peligrosas.
La histoplasmosis es una enfermedad muy común en los pacientes en etapa de SIDA, en los brotes más fuertes ha llegado a estar en el 26% de los pacientes con SIDA en una población grande como Estados Unidos, aunque su prevalencia tiene un promedio del 5%. Es una de las principales causas de muerte de los pacientes inmunocomprometidos.
Pneumocystis
Aunque actualmente se lo denomina Pneumocystis jirovecii por muchos años fue conocido como Pneumocystis carinii. Los neumoquistes son comensales normales al interior del pulmón de los individuos inmunocompetentes. Sin embargo, pasa de comensal a parásito en el momento en que el sistema inmune se debilita y ya que su reservorio es el pulmón, este es su primer blanco.
Los síntomas del neumoquiste explican algunos de los síntomas típicos de la etapa de SIDA y del síndrome de desgaste como pérdida de peso sin motivo aparente y sudoraciones nocturnas. Adicionalmente hay fiebre tos sin esputo debido a que es muy viscoso para poder ser expulsado. La neumonía por neumoquiste también favorece infecciones secundarias por bacterias complicando el tratamiento. Es tan común en un paciente inmunocomprometido, que en ausencia de otras causas como cáncer linfático o tratamiento con inmunosupresores es prácticamente un aviso de que el paciente ha ingresado en la etapa de SIDA.
Resumen de las enfermedades oportunistas en la etapa de SIDA
Hemos tratado de cubrir las principales enfermedades oportunistas en la etapa de SIDA, aunque cabe anotar que algunas enfermedades bacterianas importantes no fueron mencionadas al ser mortales en sí mismos como el cólera o la tuberculosis, aunque la tasa de mortalidad de estas enfermedades reemergentes se ha elevado mucho debido al SIDA.
En cualquier caso, para resumir, las infecciones oportunistas pueden ocurrir por bacterias, virus, hongos y parásitos eucarióticos, adicionalmente debido a que el sistema inmune controla la aparición de células cancerígenas, el cáncer también es una dolencia que se hace más prevalente en la etapa de SIDA. Dependiendo de la región habitada por el individuo y las condiciones de salubridad e higiene el grupo de patógenos que le afectaran cambian de un lugar a otro incluso al interior de una misma población.
El sarcoma de Kaposi generado por un virus herpes es el más común y generalmente uno de los signos para sospecha de diagnóstico, presentándose en un 20% de la población con HIV. El segundo cáncer más común es el linfoma que causa la muerte de aproximadamente el 16% de los individuos. Ambos canceres están asociaos con el virus del herpes clase 8. En las mujeres compite el cáncer cervical por el virus del papiloma humano.
9. Otros síntomas en la etapa de SIDA
9. Otros síntomas en la etapa de SIDA
Síndrome de desgaste por VIH
El síndrome de desgaste por la etapa de SIDA se caracteriza por la pérdida de al menos un 10% de la masa corporal, especialmente del tejido muscular. Puede estar acompañado por al menos un mes de diarrea, debilidad extrema y fiebres no relacionadas a infecciones oportunistas. Los mecanismos celulares que le permiten al VIH
Figura 9.1. Síndrome de desgaste. El síndrome de desgaste por la etapa de SIDA se caracteriza por la pérdida de al menos un 10% de la masa corporal, especialmente del tejido muscular.
causar este síndrome aún no se han comprendido correctamente. En el presente es menos frecuente debido a los tratamientos con antiretrovirales denominados HAART/TARGA pero aún es una amenaza significativa. Debido a que debilita aún más el cuerpo favorece la adquisición de infecciones oportunistas aun cuando la pérdida de masa corporal sea de un 5%.
Causas posibles para el síndrome de desgaste por VIH
A la fecha se han propuesto tres causas posibles y no excluyentes para explicar el síndrome de desgaste independiente al efecto de las infecciones oportunistas.
Figura 9.2. SIDA. Algunos síntomas aparecen entre 600 células y 200 células por milímetro cúbico, pero las infecciones oportunistas más peligrosas se favorecen solo cuando el cuerpo baja de la marca de las 100 células por milímetro cúbico.
1- Falta de apetito: esto puede ser generado como un efecto secundario de algunos medicamentos –especialmente previos a la generación del HAART –o depresión.
2- Perdida de la capacidad de absorción de los nutrientes, esto se debe a que el sistema inmune es muy fuerte en el intestino, con grandes cantidades de nódulos linfáticos, los cuales son el principal blanco del VIH. Las causas anteriores se encuentran muy asociadas a medicamentos y mucho más a las infecciones secundarias, por esta razón la tercera causa puede considerarse más apropiada ya que depende del ciclo infectivo del VIH mismo.
3- Cambios en el metabolismo: a medida que la concentración de VIH crece, la velocidad con la que los linfocitos T efectores es producida se incrementa, y las materias o energía para crearlos no sale de la nada. El cuerpo se consume a si mismo fabricando linfocitos efectores para reemplazar los perdidos, solo para que el VIH los siga atacando.
Figura 9.3. SIDA 2. Sin embargo, hay que recordar que para otras organizaciones SIDA es sinónimo de la enfermedad subyacente del sistema inmune causada por el VIH y por lo tanto estadísticamente la asumen como algo no reversible.
Adicionalmente el cuerpo está lleno de citoquinas, que son las sustancias que coordinan el sistema inmune, pero también impiden funciones metabólicas normales como la síntesis de proteína muscular.
Diagnóstico y control del síndrome de desgaste
Al estar asociado al VIH en persona y no a las infecciones oportunistas, el doctor deberá operar por descarte tomando en cuenta la historia clínica y pruebas para las infecciones oportunistas más comunes de la población en la que trabaja. Adicionalmente debe realizar pruebas para verificar la velocidad a la cual se está perdiendo la masa muscular. Uno de los métodos de diagnóstico más comunes es la técnica de resistencia dieléctrica, la cual determina la masa de musculo y grasa en base a la resistencia del cuerpo a una pequeña descarga eléctrica. Debido a que el síndrome de desgaste está asociado solo al VIH su control depende de un estricto régimen de antiretrovirales, perder tan solo una dosis puede significar un enorme riesgo para el paciente.
Neuropatía y demencia por VIH
El VIH no ataca únicamente a los linfocitos T o a otras células del sistema inmune, cuando se encuentra muy concentrado en sangre puede causar síntomas neuronales como perdida de la coordinación motora, pérdida de memoria, cambios de personalidad, alucinaciones y en general demencia. Antes de la introducción de la terapia HAART la demencia secundaria debida al VIH era una manifestación neurológica típica de un paciente en etapa de SIDA. Actualmente la demencia por VIH es rara en pacientes sometidos a tratamiento, pero aún se manifiesta en algunos pacientes. Los individuos que no están al tanto de estar infectados son particularmente vulnerables.
Progresión de la carga viral en la etapa de SIDA
A pesar de que el paciente ingresa en etapa de SIDA debido a que su conteo de linfocitos T es inferior a 200 células por milímetro cúbico, esto no implica que el sistema inmune se ha dado por vencido, en todo momento se producen linfocitos T pero son inmediatamente atacados por el VIH debido a que su concentración ha crecido mucho. En la actualidad la terapia de antiretrovirales puede revertir los síntomas de la etapa de SIDA, pero son más efectivos si se administran cuando la carga viral no es muy grande, mientras menos viriones existan en sangre menos va a ser la velocidad de mutación.
Clasificación de las enfermedades oportunistas por la concentración de linfocitos
Aunque los linfocitos T efectores son un indicador de la carga viral, cabe resaltar que en realidad el sistema inmune está siendo afectado en otras líneas celulares. A pesar de lo anterior el conteo de linfocitos ha sido asociado con varias infecciones oportunistas en probabilidad y virulencia. Con el tratamiento adecuado un individuo puede restaurar su conteo de linfocitos por encima de los 200 por lo que podría decirse que la condición de SIDA es reversible, pero hay una tremenda confusión de terminología aun dentro de la comunidad médica.
Por ejemplo, para algunos SIDA es la etapa que se alcanza cuando el conteo de linfocitos baja por debajo de 200 células por milímetro cúbico, mientras que para otros se define como la enfermedad que sufre el sistema inmune como un todo. Aunque semejantes tienen sus diferencias, la primera es una condición reversible con tratamiento, la otra siempre es una condición subyacente aun con tratamiento. Por tal razón definiremos como la enfermedad del VIH como la condición subyacente que no es reversible, mientras que SIDA es la etapa posterior al conteo por debajo de 200 células por milímetro cúbico. Esta definición tiene coherencia histórica ya que SIDA era una herramienta de diagnóstico para el momento en que las infecciones oportunistas golpeaban a pacientes en una época en que no podía identificarse en agente etiológico.
Inmunocompetente
Un inmunocompetente es un individuo que posee un sistema inmune sano, en términos del conteo de linfocitos se los considera a aquellos que poseen un contento de linfocitos T efectores en una concentración de más de 500 células por milímetro cúbico con un promedio de 1500. En este caso el individuo puede entrar en contacto con o portar como comensales a una gran gama de microorganismos que se alimentan de lo que le sobra al cuerpo y en muy raras ocasiones acarrean problemas. Un individuo inmunocompetente es el mayor riesgo para un inmunocomprometido ya que puede ser vector para cualquier infección.
En los siguientes artículos discutiremos solo algunas infecciones oportunistas típicas de cada uno de los estados de la etapa de SIDA, otras infecciones pueden presentarse en cualquier etapa sin una asociación estadísticamente significativa al conteo de linfocitos T. Cabe resaltar que las infecciones son aditivas, una vez se atraviesa cada barrera, las enfermedades de la etapa anterior se hacen más peligrosas y se adicionan las de la etapa siguiente.
Infecciones oportunistas entre 500-200 células por milímetro cúbico
Una de las primeras infecciones en hacerse presente es la candidiasis que ataca a individuos que fluctúan en torno a la barrera de los 500 linfocitos efectores. Una vez el conteo empieza a bajar la candidiasis se acentúa y emerge la primera infección típica para el diagnóstico de la etapa de SIDA y es el sarcoma de Kaposi cutáneo.
Al ser causado por el virus del herpes clase 8 el sarcoma de Kaposi es una condición que advierte sobre la posibilidad de un linfoma. Algunas lesiones del sarcoma de Kaposi afectan el tracto gastrointestinal limitando la ingesta de alimentos, lo cual contribuye al síndrome de debilitamiento y a una pérdida progresiva de la masa corporal.
Infecciones oportunistas entre 200-100 células por milímetro cúbico
Las infecciones por sarcoma de Kaposi y candidiasis se hacen más virulentas y adicionalmente empieza la etapa pulmonar y gastrointestinal. Las infecciones de esta etapa son las coccidias que atacan al sistema gastrointestinal, histoplasma y los neumoquiestes que afectan el sistema respiratorio. En esta etapa el paciente experimenta fuerte debilidad física, no puede caminar correctamente y adicionalmente empieza a experimentar los primeros efectos del VIH neurológico con cambios de personalidad y demencia.
Infecciones oportunistas entre 100 o menos células por milímetro cúbico
Las infecciones por coccidias se hacen más peligrosas provocando deshidrataciones severas que requieren siempre una atención hospitalaria. Adicionalmente, los quistes de Toxoplasma gondii reactivan su etapa aguda disolviendo los tejidos a su alrededor a medida que se alimentan y reproducen. Si había quistes en el tejido cerebral el daño neuronal se acelera.
Por debajo de las 50 células por milímetro cúbico pueden encontrarse infecciones raras causadas por bacterias ambientales cosmopolitas. El efecto acumulativo de las infecciones golpea al cuerpo desde diversos flancos debilitándolo de forma sinérgica hasta el agotamiento y la muerte. Las coccidias pueden disolver el tracto gastrointestinal hasta impedir cualquier función de nutrición, los hongos disolver los pulmones impidiendo la función cardiorrespiratoria.
Otra nomenclatura para la infección del VIH
Algunos miembros de la comunidad médica sugieren dejar de lado el nombre de SIDA debido a que este era un instrumento de diagnóstico en una época en la que no podía detectarse en algente etiológico subyacente. En su lugar se refieren a la etapa crónica de la enfermedad por VIH la cual puede distinguirse en tres subetapas.
(a) La subetapa 1 va desde el fin de la etapa aguda hasta las primeras manifestaciones subclínicas. Es la misma etapa de latencia
(b) La subetapa 2 es constituida por síntomas inespecíficos subclínicos, en esta etapa la tasa de infecciones “normales” del individuo se elevan paulatinamente. Esta etapa era antes considerada al interior de la etapa de latencia debido a que los síntomas subclínicos no eran reportados para el diagnóstico.
(c) La subetapa 3 o avanzada es constituida por el coctel de enfermedades oportunistas que afectan al cuerpo.
Nuevamente, con el tratamiento adecuado un paciente puede retornar desde la etapa 3 a la etapa 2 o inclusive a la 1, pero nunca deja se sufrir la enfermedad por VIH. Esta clasificación hace más hincapié en la continuidad de la infección y como la concentración del VIH va aumentando progresivamente después de su etapa aguda, sin embargo, para efectos didácticos la clasificación por etapa aguda, de latencia y crónica es más sencilla de explicar, aunque hay que hacer incapié que en la etapa de latencia el VIH permanece activo y con capacidad infectante.
Resumen de las etapas de la infección por VIH
El virus del VIH es conocido por su coctel de enfermedades en una fase de infección crónica, pero pocos saben que también posee una etapa aguda con síntomas inespecíficos semejantes a los de la gripa. Después de que los síntomas inespecíficos de la etapa aguda merman el virus del SIDA pasa a una larga etapa de comensalista en la que sobrevive en el cuerpo del anfitrión reproduciendo a gran velocidad, pero sin llegar a agotar el sistema inmune, esta etapa puede durar desde varios años hasta décadas dependiendo del individuo. Nuevamente la variabilidad de esta etapa es multifactorial y varía de forma continua y darwiniana.
Con el tiempo la concentración viral en el plasma aumenta, agotando al sistema inmune y debilitando al anfitrión, con lo que se ingresa en la etapa crónica de la infección por VIH a la cual generalmente se la denomina SIDA. SIDA generalmente se caracteriza por una serie de dolencias como tumores cutáneos, del sistema gastrointestinal, gastroenteritis, problemas respiratorios, urinarios y finalmente neurológicos que debilitan sincronizadamente al paciente. Incluso parásitos que se han convertido en comensales en los tejidos reactivan sus ataques al cuerpo como el caso del toxoplasma.
Esta gráfica representa la progresión típica en la concentración de la carga viral del VIH "en rojo" con respecto a la concentración de células inmunes efectoras llamadas linfocitos T CD4+. El primer pico hace referencia a la etapa aguda, el valle intermedio representa la etapa asintomática y el segundo pico es la etapa de SIDA.
10. Transmisión del VIH
10. Transmisión del VIH
En esta sección trabajaremos las tres principales rutas para la infección con el VIH: contacto sexual, exposición a fluidos infectados y transmisión vertical de madre a hijos. También se expondrán las razones por las cuales otros tipos de contacto tienen baja probabilidad para el contagio. Algunas de esas otras posibilidades son las heces, las secreciones nasales, la saliva, el esputo, el sudor, la orina, las lágrimas o el vómito; aunque esta limitación solo se establece en caso de que estos fluidos se encuentren sin sangre, si están contaminados con sangre son tan contagiosos como la sangre.
Figura 10.1. Transmisión del VIH. Los medios más comunes para la infección con el VIH son relaciones sexuales sin uso de condón, y reciclaje de jeringas y/o émbolos por parte de adictos. Los menos comunes en países desarrollados involucran el parto, la lactancia y la transfusión de sangre.
Otra posibilidad que es muy interesante pero poco tratada es el papel de los ectoparásitos que se alimentan de sangre más de una vez en su ciclo vital, lo cual nos lleva a una pregunta típica: ¿Por qué un mosquito no puede transmitir una infección, mientras que una aguja hipodérmica su puede? Finalmente, debido al potencial evolutivo del VIH y a algunos factores de riesgo, es probable que un solo individuo se vea infectado con dos o más variantes filogenéticamente diferentes del VIH, condición que se conoce como superinfeccion.
Transmisión del VIH por contacto sexual
El contacto sexual es la ruta de infección más frecuente para el contagio del VIH. La mayoría de las infecciones en todo el mundo ocurren por contacto sexual de tipo heterosexual –contactos sexuales entre personas de sexo diferente –sin embargo, los promedios cambian dependiendo de los patrones de comportamiento al interior de cada cultura y década.
En estados unidos por ejemplo, la mayor tasa de transmisión sexual ocurre en actos sexuales de tipo homosexual masculino –hombres que realizan actos sexuales con otros hombres –de hecho la diseminación al interior de esta población fue tan alta en los años 80s que fue catalogada como peste gay a pesar de que puede ser transmitida por contactos sexuales de tipo hetero (Hethcote & Van Ark, 2013). Al igual que con la sífilis, los religiosos adujeron que el SIDA era una evidencia de la ira de Dios contra el pecado de sodomía (Centers for Disease Control and Prevention, 2015; Gilder, 1987; Sutton & Parks, 2013).
Diferentes actividades sexuales y la probabilidad de infección con el VIH
Con respecto a los actos sexuales sin condones, los estimados de riesgo de transmisión del VIH por acto sexual parecen ser entre 4 y 10 veces más altos en países pobres que en los países ricos (Boily et al., 2009). En los países pobres, el riesgo de transmisión de la mujer al hombre se estima en un 0,38% por acto sexual, y de hombre a mujer en un 0,3% por acto sexual; los valores equivalentes en los países con altos ingresos es de 0,04% y 0,08% respectivamente (Boily et al., 2009).
El riesgo de transmisión en la penetración anal es especialmente alto llegando a valores de 1,4-1,7% por acto sexual tanto en relaciones heterosexuales y homosexuales (Beyrer et al., 2012; Boily et al., 2009). Mientras que el riesgo de transmisión por sexo oral es relativamente bajo en condiciones ideales, caries, gingivitis y otras lesiones que provocan sangrado leve lo pueden hacer muy contagioso llegando a valores de 2,4% por acto sexual (Dosekun & Fox, 2010; Pattman, Sankar, Elawad, Handy, & Price, 2010; Schumacher, 2007; Yu & Vajdy, 2010).
Úlceras en los tejidos de contacto sexual y la infección con el VIH
Las úlceras genitales incrementan el riesgo de contagio 5 veces (Boily et al., 2009). Otras infecciones como la gonorrea, la clamidia, las tricomonas y la vaginosis bacterial se encuentran asociadas a incrementos en la probabilidad de infección (Dosekun & Fox, 2010). Por lo anterior los anticonceptivos de tipo barrera son tan importantes para evitar el contagio de las enfermedades de transmisión sexual, pues limitan el contacto de los fluidos sexuales y de los fluidos causados por úlceras de otras enfermedades.
La prostitución y los actores porno
Cuando el acto sexual se realiza a un nivel comercial –y esto incluye aquellos que trabajan en pornografía –la probabilidad de infección es muy alta, no por el acto en sí, sino por la cantidad de veces a la que el prestador del servicio sexual se encuentra expuesto (Aral, Fenton, & Lipshutz, 2012; Kerrigan et al., 2012).
Estos riesgos se incrementan a medida que el trabajador sexual realiza su labor en condiciones sociales menos favorables –especialmente cuando no puede elegir otra cosa. Los actos sexuales sadomasoquistas y los actos sexuales abusivos incrementan la probabilidad de contagio del VIH debido a la presencia de sangre (Asthana & Oostvogels, 1996; C. Campbell, 2000).
Como los jinetes del apocalipsis, el hambre, y la guerra favorecen la aparición de la peste. En África y sus condiciones de guerra continuas, las violaciones han ayudado a diseminar el VIH en la población haciéndola muy prevalente. En la Europa posterior a la II guerra mundial hubiera pasado lo mismo con la sífilis, si no hubiera sido por los antibióticos.
Figura 10.2. La actriz porno Cameron Bays cuyo diagnóstico en 2010 destapó un problema fundamental en la industria, ¡NO USAN CONDONES! (Giami, de Colomby, & Paterson, 1995). El evento hizo que los productores examinaran a varios actores del casting de la película que se estaba realizando y varios dieron positivo (Quigley, 2013).
Carga viral y la probabilidad de infección por VIH
Unas 72 horas después del contacto con una carga viral infectiva, el paciente empieza a sufrir la producción de nuevos viriones en su torrente sanguíneo.
Transmisión del VIH por contacto con fluidos corporales no sexuales
Transmisión del VIH por jeringas
A pesar de presentar probabilidades de infección más altas por acto, que los contactos sexuales, las infecciones debidas a contactos de fluidos no sexuales son solo la segunda causa más frecuente de transmisión del VIH (Rom & Markowitz, 2007). La transmisión del VIH a través de contacto se fluidos no sexuales está asociado a las jeringas, por ejemplo reciclar jeringas, compartir jeringas para la administración de drogas vía intravenosa, heridas en inyectología, transfusión con sangre contaminada, productos sanguíneos contaminados o empleo de instrumentos cortopunzantes no esterilizados en el ejercicio médico (Cardo et al., 1997).
El riesgo de contagio por uso de drogas inyectables al compartir o reciclar jeringas o émbolos varía entre el 0,63 al 2,4% por acto, con un promedio del 0,8%. El riesgo de adquirir el VIH por un pinchazo durante un proceso de inyectología es aproximadamente del 0,3% (1 en 333) por acto (Baggaley, Boily, White, & Alary, 2006).
La adicción a las drogas inyectables no solo favorece la transmisión del VIH, cualquier patógeno transmitido por la sangre puede ser transmitido, del mismo modo bacterias oportunistas pueden infectar las heridas que no son tratadas higiénicamente "el algodón con alcohol no lo ponen por chiste" (Broz et al., 2014; Choopanya et al., 2013; Conrad et al., 2015; Mathers et al., 2013; Westergaard, Hess, Astemborski, Mehta, & Kirk, 2013).
Los pinchazos en inyectología son muy raros, ya que el personal es entrenado para evitarlos, adicionalmente se ha reportado que una terapia de choque durante las primeras horas de la infección con VIH puede evitar la seroconversión (Baeten & Celum, 2013; Choopanya et al., 2013; Marrazzo et al., 2015; Wilburn & Eijkemans, 2013).
El problema reside en el reciclaje de jeringas por adictos o por personal médico poco escrupuloso, en los Estados Unidos por ejemplo, los adictos a drogas inyectables constituyen cerca del 12% de los nuevos casos de VIH positivo para 2009 y en algunas áreas de toda la población de adictos a las drogas inyectables cerca del 80% son VIH positivo (ABUBAKAR, 2013).
Transmisión del VIH por transfusiones de sangre
La transfusión de sangre contaminada es uno de los actos que con mayor probabilidad provoca una sero-conversión, con una probabilidad de 93% por acto. Sin embargo esta altísima tasa de infección se contrapone a la muy baja tasa de actos realizados y a la aún más baja probabilidad de que la sangre se encuentre contaminada –en países con un sistema médico que funcione adecuadamente (Baggaley et al., 2006).
En países con un sistema medico bien desarrollado el riesgo de adquirir la infección del VIH por una transfusión de sangre es extremadamente baja, menos de 1 en 500.000 en USA, gracias a la detección en los donadores de sangre (Rom & Markowitz, 2007). En Inglaterra la probabilidad es aún más baja, siendo de 1 en 5´000.000 (NHS Blood and Transplant, 2013).
En los países con un sistema médico deficiente la cosa si se hace problemática, si la sangre no es examinada para patógenos indicadores de riesgo o para el propio VIH, la probabilidad de infecciones nuevas aumenta y en algunas zonas la tasa de infectados nuevos debido a una transfusión oscila entre el 5% y el 15% (Abramov, 2000).
Transmisión del VIH por procedimientos médicos y dentales
Todo procedimiento médico invasivo acarrea un riesgo médico intrínseco para la transmisión de infecciones sanguíneas. Escalpelos, catéteres, e incluso instrumentos dentales pueden convertirse en vectores para la transmisión del VIH si no se toman las debidas precauciones (Sethi et al., 2016). De modo inverso también son una fuente de infecciones nosocomiales con resistencia a antibióticos, un paciente en etapa de SIDA que adquiere una infección nosocomial resistente a antibióticos está sentenciado a una muerte horrible.
Los riesgos de infección van en ambas vías, es famoso un caso de un dentista VIH positivo que infectó a 6 pacientes, lo cual fue confirmado mediante un análisis filogenético de las cepas de los 7 individuos (L. K. Altman, 1994).
Transmisión del VIH por procedimientos estéticos como tatuajes
Al igual que sucede con las prácticas médicas, el tatuaje es un factor de riesgo cuando se realiza bajo condiciones sanitarias deficientes. La transmisión de enfermedades a través del tatuado y otras prácticas que implican la generación de cicatrices ornamentales en la piel ocurre por varias razones (Cainelli, 2013; Kazandjieva & Tsankov, 2007; Lee, 2012; Simunovic & Shinohara, 2014).
La primera es el reciclaje de agujas de un individuo al siguiente, práctica que es más común en los procedimientos de tatuado tribal y aficionado. Los tintes también pueden ser un vector ya que sus materiales químicos no matan el virus. Otros instrumentos que pueden servir como vectores son las esponjas y trapos empleados para la remoción de la tinta sobrante.
El VIH permanece infeccioso en soluciones acuosas como las de los colorantes por casi 15 días. Como resultado la pistola de tatuado también puede ser un vector de transmisión potencial. Es importante conocer mejor los peligros inherentes a las técnicas de tatuado profesional, para mejorar la tecnología y disminuir la probabilidad de infección en un procedimiento estético profesional.
Transmisión del VIH por vía materna
También denominada vía vertical, es la transmisión del VIH realizada desde la madre a sus hijos en diferentes etapas del embarazo, sorprendentemente una mujer con VIH puede tener una tasa sorprendente de hijos sin VIH. El tiempo exacto y el mecanismo molecular para la infección viral de un feto de una madre VIH positivo han sido investigados con gran intensidad, pero aún no ha podido determinar ni el tiempo ni el mecanismo exacto. De hecho, cualquier etapa puede conllevar a la infección vertical como la etapa de gestación, el parto y la lactancia (Coutsoudis, Kwaan, & Thomson, 2010; Thorne & Newell, 2013).
Los estudios varían, algunos han encontrado que el VIH puede infectar al feto en el útero a través del cordón umbilical y la placenta, otros estudios han encontrado que, en un parto natural, la sangre de la madre puede infectar el feto, mientras que otros han demostrado que la leche materna es un vector potencial para la infección por VIH.
De hecho, se ha demostrado en algunos fetos abortados espontáneamente a unas 15 semanas que ya poseen ADN viral en su sistema. También se ha documentado la infección de los fetos a pesar de que el parto se realiza a través de una cesárea. La mayoría de los recién nacidos aparenta ser clínica e inmunológicamente normales en el momento de nacer. Algunos niños se infectan cuando se alimentan de leche materna o con la sangre de la madre en el momento del nacimiento.
Aún se desconoce si el virus puede cruzar la placenta, pero la sangre maternal infectada ha sido encontrada en el sistema circulatorio de algunos neonatos y los linfocitos presentes son capaces de realizar infecciones in vitro. Adicionalmente, la infección por VIH-1 ha sido observada por métodos inmunoquímicos y moleculares tejidos derivados del trofoblasto de embriones de 8 semanas de desarrollo. Tal vez el detalle más importante es el hecho que entre el 65-80% de todos los nacimientos de una madre infectada escapan a ser infectados siempre y cuando se realicen los cuidados adecuados.
Las picaduras de artrópodos
Muchos patógenos que afectan al ser humano pueden transmitirse a través de los fluidos corporales y especialmente la sangre, por ejemplo: VIH, Plasmodium, Virus de la hepatitis B y C, virus del Nilo occidental, el virus del dengue entre muchas otras fiebres hemorrágicas. Aunque muchos de estos patógenos encuentran su principal vía de transmisión a través de los órganos alimenticios de artrópodos que succionan sangre del cuerpo humano, el VIH es una excepción (Bockarie & Paru, 1996; Crans, 1993). La transmisión del VIH a través de los artrópodos fue una seria preocupación inmediatamente el virus fue descrito a mediados de los años 80s (Bockarie & Paru, 1996), sin embargo tanto la evidencia epidemiológica como experimental han demostrado de forma inequívoca que la transmisión por ectoparásitos no se ha dado, hasta ahora.
Razones por las cuales los artrópodos parásitos no transmiten el VIH
La pregunta de oro es ¿Por qué el VIH no puede ser transmitido a través de la picadura de artrópodos? Si se le preguntara a un epidemiólogo daría cualquiera o todas las razones siguientes:
(a) El VIH generalmente se encuentra en bajas concentraciones en la sangre en los pacientes en etapa de latencia para permitir la infección, esto se adiciona al hecho de que la mayoría de los artrópodos no consumen mucha sangre por picadura.
(b) El VIH es incapaz de sobrevivir periodos de tiempo muy largos fuera de los seres humanos, aunque algunas garrapatas pueden mantenerlo viable hasta 10 días.
(c) El VIH no puede replicarse fuera de las células humanas o de primates como los chimpancés, los gorilas o los mangabeyes.
(d) El sistema de alimentación de los artrópodos en su mayoría no es simple como en los mamíferos, los mosquitos, por ejemplo, poseen un conducto de ingreso y otro de salida. Aunque los mosquitos regurgitan saliva al picar, esta saliva va por un conducto independiente al del ingreso de la sangre, por esto es que el agente etiológico debe poder reproducirse al interior del artrópodo, para colonizar todo el sistema bucal y salir regurgitado.
Cada una de estas razones posee soporte empírico y pueden funcionar en conjunto.
La transmisión mecánica del VIH por una picadura es plausible
Los datos experimentales sugieren que, en principio, la transmisión mecánica del VIH es plausible, aunque exista una serie de limitantes celulares y ecológicas, la principal razón sigue siendo la baja concentración en la etapa de latencia. Si el VIH evolucionara en una cepa con mayor concentración en la etapa de latencia, también se haría más evidente en sus síntomas causando la muerte del paciente en menor tiempo, lo cual lo convertiría en autocontenido por falta de tiempo para su dispersión.
Sin embargo, estas causas no son por completo satisfactorias en sentido de que otros virus transmitidos por artrópodos pueden infectar y transmitirse a diferentes continentes como los plasmodios causantes de la malaria o el virus del dengue y el chikungunya.
Mutabilidad del VIH y su posible transmisión por picaduras
Ninguna de las razones dadas en los artículos anteriores es completamente satisfactoria, existen cepas del VIH que pueden ingresar en la etapa avanzada de la infección en tres años, por lo que la aceleración de la infección no sería un problema. En términos evolutivos si algo no evoluciona es porque no puede debido a una presión de selección negativa o porque es mecánicamente inviable. En cierto sentido es una pregunta semejante a la de ¿Por qué un guepardo no tiene alas? Esto tiene que ver con la contienda evolutiva entre maximización y optimización.
Los seres evolutivos deben encontrar un equilibrio entre rasgos óptimos para sobrevivir, pero siendo incapaces de llegar a máximos, esto se debe a que el todo debe actuar en conjunto, un rasgo máximo deteriora al todo y lo hace menos apto. Si el VIH evolucionara en una forma que puede replicarse en las células de los artrópodos maximizaría rápidamente su capacidad para infectarlos “debido a que evoluciona a muy alta velocidad”, pero al mismo tiempo perdería la afinidad para infectar al ser humano. Esto implica que aun cuando tal virus hubiese evolucionado, al picar a otro individuo la nueva cepa no afectaría al ser humano.
11. SIDA infantil
11. SIDA infantil
El Síndrome de Inmunodeficiencia Adquirida (SIDA) es una enfermedad devastadora que afecta a personas de todas las edades, incluidos los niños. La propagación del VIH de madre a hijo durante el embarazo, el parto o la lactancia puede resultar en la infección por VIH en los niños, quienes desarrollan lo que se conoce como SIDA infantil. En este artículo, exploraremos en profundidad la problemática del SIDA infantil, analizando los desafíos únicos que enfrentan los niños infectados, las formas de transmisión, los síntomas característicos y las estrategias de prevención y tratamiento disponibles. También examinaremos las implicaciones emocionales y sociales para los niños y sus familias. Al aumentar la conciencia y comprender los aspectos complejos de esta enfermedad en la infancia, esperamos impulsar una respuesta más efectiva y compasiva para proteger a los niños más vulnerables y brindarles una mejor calidad de vida en su lucha contra el SIDA.
El VIH y los bebes de países ricos y pobres
Existen diversas características que distinguen el VIH de los adultos del de los niños e infantes. La gran mayoría obtiene su infección por vía vertical, es decir desde la madre hasta el niño ya sea por la placenta, el parto o la lactancia. Procedimientos médicos como la cesárea puede disminuir la probabilidad de infecciones verticales siempre que sean realizados de forma correcta.
Sin embargo, este tipo de intervenciones solo pueden realizarse de forma correcta con las instalaciones adecuadas, o lo que es lo mismo, solo pueden realizarse en países ricos. La mayoría de los nacimientos en el África subsahariana no cuentan con tanta suerte.
Progresión de la infección de VIH en recién nacidos
Posiblemente debido a que la infección por VIH en los recién nacidos es menos contralada inmunológicamente por los adultos, la infección procede a mayor velocidad. La mitad de los bebes infectados morirán antas de cumplir los 2 años de edad. Lo anterior implica que no existe una etapa de latencia como tal si la infección se realiza antes de que el neonato haya madurado su propio sistema inmune. Por lo tanto, para la mayoría de los niños infectados la historia natural del VIH es el de una infección progresiva y continua "sin etapa de latencia" en caso de que no se intervenga con una terapia antiretroviral.
Moral y ética del VIH pediátrico
Sea cual sea el designado de Dios, lo que sí se puede reprochar moralmente es la afirmación de que el VIH surge como producto de su ira, especialmente cuando son los niños los que experimentan este mal a un nivel tan cruel. El VIH es producto de procesos naturales –de hecho, el modus operandi de la selección natural negativa es arrasar con las crías de cualquier especie –y la irresponsabilidad humana durante la era de los imperios coloniales, y como seres humanos debemos asumir la responsabilidad de su tratamiento.
La pediatría es la rama de la medicina que se encarga de estudiar las enfermedades de los infantes, y la subespecialidad del VIH pediátrico se ha convertido en un área de mayor avance en la reducción de la morbilidad y virulencia, hasta el punto de casi detener las infecciones verticales. La diseminación de los métodos de control pediátrico de mujeres en embarazo es solo el segundo lugar de los esfuerzos para el control y erradicación del VIH, la primera sigue siendo la búsqueda de una vacuna efectiva.
Visión global del VIH a nivel pediátrico
Para noviembre de 2007 cerca de 33.2 millones de personas alrededor del mundo están infectados con el VIH, y 2.5 millones de estos son niños y niñas menores de 15 años. Los menores de 15 años representan cerca del 16,5% de todas las nuevas infecciones, 7,5% del total absoluto de infecciones y 15,7% de las muertes anuales por la etapa avanzada de la infección.
El número de niños que conviven con la infección de VIH era para 2001 de 1,5 millones, mientras que para 2007 ya era de 2,5 millones, y cerca del 90% de estos casos suceden en el África subsahariana. En este siglo, las muertes globales debida a la etapa avanzada por la infección del VIH suma entre 33.000 a 360.000 al año. Alrededor del mundo el 4% de todas las muertes infantiles de menores de 5 años son atribuibles a la etapa avanzada de la infección por VIH.
Epidemias del VIH a nivel pediátrico
Las diferencias de ricos y pobres se acompañan por dos patrones opuestos en la infección por VIH en el mundo. La infección en los países ricos se encuentra asociada con diagnósticos tempranos, bajas tasas de infección vertical, supervivencia prologada gracias a tratamientos con antiretrovirales, complicaciones a largo plazo, síntomas neuronales a largo plazo, resistencia al tratamiento a largo plazo y problemas asociados al tránsito de la infancia a la edad adulta.
Lo opuesto ocurre para el 95% de los niños infectados con VIH en los países en desarrollo, donde la falta de un diagnóstico temprano, lactancia de madres infectadas, acceso a tratamiento tardío o inexistente, y opciones de tratamiento limitadas a tipo placebo han conllevado a una mortalidad temprana muy alta.
Estas características se encuentran directamente relacionadas con la disponibilidad mundial de antiretrovirales de última generación, un diagnóstico eficiente, altos niveles educativos, bajas tasas de embarazo en adolescentes, sistemas de vigilancia médica eficientes y una alimentación apropiada se encuentran disponibles para la población general.
Infección por VIH pediátrico entre niños y niñas
Los estudios sobre género son contradictorios y dependen de las condiciones. En Malawi se encontró una fuerte asociación del VIH postnatal con las niñas, donde el 12,6% estaban infectadas en contraste con un 6.3% de los niños. En el contexto Europeo las diferencias entre las tasas de infección no fueron estadísticamente significativas. Otros estudios en USA y otras regiones africanas han mostrado una probabilidad de infección semejante a ambos géneros. Aunque no existe una justificación aparente para resultados tan dispares, se ha postulado que tal vez los embarazos con varones que se infectan en el útero en ciertas condiciones ambientales tienden a ser abortados espontáneamente.
Migración y el VIH a nivel pediátrico
El VIH y la inmigración de niños menores de 15 años a países desarrollados pueden convertirse en un asunto ético, moral y político particularmente molesto, por lo que solo mencionaremos algunos datos por el momento. En países con una baja incidencia del VIH, la infección por inmigración de niños infectados puede convertirse en un asunto de atención médica emergente.
En 2002, Canadá introdujo la rutina legal de realizar un análisis rutinario de ELISA para VIH como requisito para aplicar a la residencia, lo cual incluye los niños elegibles. Desde 2002 hasta 2005 se encontraron 36 casos pediátricos, 32 de los cuales procedían de África. La adquisición en todos los casos fue vertical. El 94% de los casos tenían todos los requisitos para ingresar a Canadá.
Los niños menores de 15 años no pueden ser analizados según la normatividad de estados Unidos. En un estado de 119 niños nacidos durante o después de ingresar a los Estados Unidos procedentes de Bélgica documentó 7 infecciones. La migración es una fuente de HIV pediátrico en países con bajas tasas de infección, especialmente si provienen de contextos pobres con violencia y guerras.
La adopción de niños a nivel internacional y el VIH
Otro asunto ético, moral y políticamente problemático es la adopción de niños a nivel internacional. Un número significativo de niños nacidos en países pobres con alta prevalencia de VIH son adoptados cada año por ciudadanos de naciones ricas como Estados Unidos. Desde 1986 hasta 2003 cerca de 220.000 niños fueron adoptados por ciudadanos Norteamericanos. A pesar de la amplia preocupación pública a cerca de la infección por VIH en los niños de adopciones internacionales, el riesgo real es bajo. En siete estudios, de un total de 1.089 niños adoptados por ciudadanos norteamericanos, australianos y franceses, ninguno estaba infectado.
El VIH y los niños de África
A pesar de que África posee el 68% de las infecciones de adultos, cerca del 90% de los menores de 15 años infectados en el mundo se encuentran en la región sur del continente. Se estima que 2 millones de niños infectados y 11.4 millones de huérfanos por VIH habitan el África subsahariana. La infección en la etapa avanzada por VIH es la mayor causa de mortalidad ya que exacerba otras infecciones mortales en sí mismas como la malaria o el ébola.
Los mayores vectores de infección de VIH son la transmisión vertical, la lactancia y la transfusión de productos sanguíneos. Debido a la alta prevalencia en la población, aun las regiones con un sistema de rastreo de donantes presentan altas tasas de infección por transfusión.
12. Taxonomía del VIH
12. Taxonomía del VIH
Como hemos visto en artículos anteriores, aunque el VIH genera una etapa de supresión del sistema inmune llamada SIDA ambas son cosas diferentes, es decir VIH no es SIDA. El VIH es una infección que típicamente conlleva a la etapa de SIDA en los pacientes que no experimentan tratamientos o que en casos muy raros pasa asintomáticamente debido a la inmunidad natural –se resalta que es muy raro.
SIDA tampoco es una enfermedad, es un coctel de enfermedades que sobrepasa la veintena y son causadas por otros agentes etiológicos, la mayoría de los cuales no causarían infecciones graves –algunos infectan sin síntomas en pacientes inmunocompetentes – a menos que el sistema inmune este suprimido.
Adicionalmente, factores como la desnutrición no pueden considerarse causas para SIDA por la simple razón de que la guerra y el hambre siempre han existido, pero que un solo individuo sea lo suficientemente desafortunado para recibir la infección de patógenos raros y generalmente no letales a niveles tan graves y reiterativos excede cualquier lógica, si no existe una razón subyacente.
Clasificación taxonómica del VIH
Aunque los virus no son seres vivos, debido a que poseen la propiedad de evolucionar –evolvability –se los estudia al interior de la biología en la rama de la taxonomía, formando un grupo de filogenia no conocida con los demás seres vivos. Al interior de los seres vivos se sigue el esquema de clados agrupados por similitud en su estructura genética, la monifilesis de todos los grupos de virus es más que incierta. Existen 6 grupos de virus: Cadena doble de ARN; Cadena simple negativa de ARN; Cadena simple positiva de ARN; Cadena simple de ADN; Cadena doble de ADN; Retrovirus. Dentro de los retrovirus existen muchos grupos de clasificación compleja excepto uno que forma un grupo bastante evidente llamado familia Retroviridae.
Los lentivirus infectan muchas especies de mamíferos causando una infección característica, una etapa aguda fuerte, una etapa de latencia que se prolonga por años y en algunos casos una etapa crónica. Un ejemplo es el Virus de Inmunodeficiencia Simia VIS, el virus en su etapa de latencia excede la expectativa de vida de su anfitrión, lo que implica que no se alcanza a desarrollar la etapa crónica en algunas especies.
Para su descubrimiento en 1983 (Barre-Sinoussi et al., 1983), el VIH era un patógeno relativamente aislado dentro del mundo natural, una rareza a tal nivel que parecía haber sido diseñado –tal hipótesis sigue siendo sostenida por los negacionistas del VIH/SIDA. Sin embargo tal aseveración no se sostiene taxonómica y evolutivamente debido a que en los años posteriores al descubrimiento del VIH otros lentivirus fueron descritos (Chakrabarti et al., 1987), y muchos de ellos generaban inmunodeficiencias en otros mamíferos al igual que el VIH. En los siguientes artículos describiremos las generalidades de los lentivirus relacionados al VIH que generan síndromes de deficiencia inmune en otros mamíferos.
Virus de inmunodeficiencia en simios VIS
El Virus de Inmunodeficiencia en Simios (VIS) ha jugado un papel fundamental en nuestra comprensión de la historia y los orígenes del Virus de Inmunodeficiencia Humana (VIH), el agente causante del Síndrome de Inmunodeficiencia Adquirida (SIDA). En este artículo, nos adentraremos en el mundo del VIS, explorando su origen, su relación con el VIH y su impacto en la investigación científica. Analizaremos las similitudes y diferencias entre ambos virus, los diferentes subtipos de VIS y su distribución geográfica. También examinaremos los estudios sobre la transmisión del VIS entre simios y humanos, y cómo esto ha contribuido a nuestra comprensión de la propagación del VIH. Al explorar en detalle el VIS, esperamos arrojar luz sobre la historia evolutiva de los virus de inmunodeficiencia y su impacto en la salud humana, proporcionando así una visión más completa de esta compleja y fascinante área de investigación.
Descubrimiento del VIS
Al igual que en los seres humanos, la inmunodeficiencia adquirida en simios (SIDAS) fue reportada antes del descubrimiento de un agente etiológico en 1983. El virus de inmunodeficiencia de los simios VIS fue aislado en 1985 (Daniel et al., 1985) de estos animales cautivos pertenecientes a la especie Macaca mulatta que sufrían de SIDAS (Lerche, Yee, & Jennings, 1994).
Figura 12.1. Monos Rhesus. Macaca mulatta, frecuentemente denominado el mono Rhesus, es una especie de primate catarrino de la familia Cercopithecidae, una de las más conocidas de monos del Viejo Mundo.
El reporte del VIS fue realizado poco después del VIH-1 y conllevó al descubrimiento del VIH-2 en la zona occidental de África (Daniel et al., 1985). Existen múltiples sepas del VIS que pueden pasar la barrera de especies (Brown, 1991), la especie anfitriona ancestral generalmente no experimentan SIDAS aun cuando la carga viral es alta, pero en anfitriones de especies diferentes se desarrolla SIDAS.
El VIS y su relación con el VIH
Los virus de inmunodeficiencia en simios son retrovirus que infectan a 45 especies de primates no humanos africanos (Peeters, Courgnaud, & Abela, 2001).
Basados en análisis de las cepas de cuatro especies de monos de la isla de Bioko, la cual fue aislada del continente hace unos 11.000 años se ha concluido de los VIS han estado presentes por al menos 32.000 años o más (Worobey et al., 2010). Las cepas de los virus de dos especies de primates el VISsmm de los mangabeyes grises “Cercocebus atys” y el VIScpz en los chimpancés “Pan troglodytes” arrojan ser las cepas hermanas del VIH-2 y del VIH-1 respectivamente (Worobey et al., 2010).
En otras palabras, los VIH 1 y 2 no son monofiléticos, evolucionaron convergentemente de dos virus diferentes del VIS. A diferencia de sus parientes humanos, los VIS no son patogénicos en sus hospederos naturales, posiblemente a que su expectativa de vida corta evita que se desarrolle la etapa de inmunosupresión.
Figura 12.2. Los mangabeys grises (Cercocebus atys) son primates africanos pertenecientes a la familia Cercopithecidae. Estos animales, conocidos por su distintivo pelaje gris plateado y su rostro oscuro, habitan en las selvas y bosques de África occidental. Los mangabeys grises son omnívoros y se alimentan principalmente de frutas, hojas, semillas, insectos y pequeños vertebrados. Son altamente sociales y viven en grupos numerosos liderados por una hembra dominante. Su comportamiento incluye vocalizaciones complejas y el uso de herramientas para obtener alimentos. Sin embargo, estos fascinantes primates se enfrentan a amenazas como la pérdida de hábitat y la caza furtiva, lo que ha llevado a una disminución de sus poblaciones en estado salvaje.
Evolución convergente de VIS a HIV
La evolución convergente de los virus de la inmunodeficiencia en simios no solo ha sido registrada para los subtipos VIH-1 y VIH-2. Como se mencionó el VIH-1 está relacionado taxonómicamente con el virus de la inmunodeficiencia en simios de grupo de los chimpancés VIScpz. El punto es que varios reportes han demostrado que existen al menos tres cepas del VIH que proceden del VIScpz, solo una de las tres cepas corresponden al VIH-1 pandémico (Worobey et al., 2010).
En otras palabras, el potencial para el paso de especies siempre ha estado allí presente, pero la razón por la cual el VIH solo se hizo importante a mediados del siglo XX sigue siendo un misterio. Una posible razón se deba a causas sociales y es el desarrollo del colonialismo, el neocolonialismo y las líneas de comercio mundial altamente eficientes.
Figura 12.3. El chimpancé común (Pan troglodytes) es una especie de primate que habita en las selvas y bosques de África central y occidental. Estos fascinantes animales son conocidos por su inteligencia excepcional, habilidades sociales y comportamiento complejo. Tienen un cuerpo robusto cubierto de pelo negro y cuentan con una capacidad notable para utilizar herramientas y resolver problemas. Los chimpancés comunes son omnívoros, alimentándose de frutas, hojas, insectos y pequeños animales. Además, viven en grupos sociales, liderados por un macho dominante. Aunque están amenazados por la pérdida de hábitat y la caza ilegal, los chimpancés comunes son considerados nuestros parientes más cercanos en el reino animal y son objeto de amplia investigación científica para comprender mejor su comportamiento y conservar su existencia.
En la actualidad las hipótesis para el surgimiento de la pandemian del VIH-1 están enfocadas a los efectos del colonialismo y el neocolonialismo europeo a finales del siglo XIX y la totalidad del XX. La depredación de recursos naturales conlleva a la zoonosis, el hambre en las colonias a la prostitución, las líneas de comunicación con las metrópolis a la diseminación, el racismo y a la negación de la existencia del virus y/o la enfermedad misma.
Figura 12.4. La edad de los imperios coloniales. El imperialismo económico es una práctica social que favorece la degradación de las poblaciones periféricas y la aparición de enfermedades zoonóticas “accidentales procedentes de animales” como de la nada, debido a la explotación de recursos naturales en zonas apartadas.
Virus de inmunodeficiencia felina VIF
El virus de inmunodeficiencia felina VIF es un lentivirus que afecta a los gatos de todo el mundo, con prevalencias que rondan el interval de 2,5-4,4% (Lara, Taniwaki, & Araújo Júnior, 2008). Aunque el VIF no es el único lentivitus que causa un síndrome semejante al SIDA, en los gatos se caracteriza por no ser fatal (Hosie et al., 2009), es probable que al igual que en los primates se deba a una expectativa de vida corta, con lo cual el gato se muere de viejo antes de la etapa avanzada de la infección. Aunque una vacuna está disponible a nivel comercial su eficacia permanece en controversia (Wardley & Lowery, 1998).
El VIF se contagia por las mismas rutas que el VIH, es decir contacto de fluidos sexuales y no sexuales/sangre. El VIF fue descrito en 1986 por investigadores de la escuela de medicina veterinaria de Davis (Walker, Moody, Stites, & Levy, 1986) en una colonia de gatos con una alta prevalencia de infecciones oportunistas y condiciones degenerativas en gatos domésticos. Originalmente fue denominado Virus Linfotrófico Felino VLTF.
Virus de inmunodeficiencia bovina VIB
El Virus de Inmunodeficiencia Bovina o VIB fue descubierto a final de la década de los 60s haciéndolo el primer de los lentivirus causantes de inmunodeficiencias en mamíferos en ser descrito. Originalmente la investigación conllevó a la descripción de tres variantes que afectan el ganado. El VIB fue identificado por Cameron Seger un veterinario de la Universidad del Estado de Louisiana en su Centro de Agricultura mientras estudiaba el Ganado del sur del estado. Las vacas presentaban altos conteos de glóbulos blancos, estado conocido como linfocitosis que se asociaba al desarrollo de una leucemia o linfosarcoma (Gonda, 1992).
La inmunodeficiencia adquirida de bovinos fue reportada inicialmente en una vaca Holstein de dos años de edad, Sin embargo, debido a que todos los virus de la inmunodeficiencia causan patologías de forma indirecta, los análisis patológicos del VIB no explicaron la razón de la aparición de ciertos tumores. No fue hasta el descubrimiento del HIV-1 que el mecanismo de acción del VIB pudo entenderse como una inmunodeficiencia que indirectamente favorecía patologías, pero que no las causaba en sí mismo (Gonda, 1992).
13. Genética del VIH
13. Genética del VIH
El VIH es un lentivirus típico en tamaño, forma y función. Como la mayoría de los virus su estructura se basa en el material genético y partículas proteicas de apoyo al interior de una cascara hecha de proteínas llamada cápside, para el caso de los lentivirus hay dos cápsides, una externa incosaédrica y una interna con forma de cono. Alrededor de la cápside se encuentra una membrana lipídica obtenida a partir de la célula anfitriona a partir de la cual el virus nació. Insertadas en esta membrana se encuentran dos glicoproteínas que activan el sistema inmune.
Figura 13.1. Anatomía del VIH.
Su componente más grande se denomina gp120 y es la proteína de adhesión principal –y también en el mayor dolor de cabeza de los investigadores médicos. La glicoproteína más pequeña se denomina gp41 promueve la fusión de la membrana viral con la membrana de la célula blanco. El conjunto de gp41 y gp120 se conoce como gp160.
Al interior de la cápside se encuentra el material genético almacenado en la forma de una cadena simple de ARN de sentido positivo simbolizado como RNAss+ (ARNcs+ en español). Acompañando al material genético se encuentran varias proteínas: la ARN polimerasa reversa, la integrasa de ADN y una proteasa.
Proteínas estructurales y no estructurales
El VIH está compuesto por 14 productos génicos que pasan a proteína, las cuales se dividen en dos categorías, estructurales y no estructurales. Las estructurales hacen parte de las dos cápsides o de la superficie de la membrana y las no estructurales se encuentran al interior de la nucleocápside "cápside interna". Las proteínas son almacenadas en grupos o marcos de lectura, algunos son comunes para todos los lentivirus, pero otros son específicos del VIH.
Tabla 13.1. Proteínas estructurales del VIH con los dos tipos de código empleados.
Tabla 13.2. Proteínas no estructurales del VIH con los dos tipos de código empleados.
Membrana y cápside
Los viriones activos de un lentivirus típico como el VIH-1 poseen un tamaño variable entre 100-150 nanómetros, con una membrana externa lipídica que extraen del anfitrión que les dio nacimiento. La membrana está salpicada con las proteínas de adhesión que son alrededor de 72, cada una de estas 72 unidades consta a su vez de dos subunidades mencionadas en el artículo anterior: gp120 “proteína de superficie” y gp41 “proteína transmembranal”. Nota, gp significa glicoproteína.
El virión del VIH es complejo, a parte de la membrana posee dos cápsides, una externa en forma de icosaedro formado por la proteína p24 y una cápside interna con forma de féretro-cono compuesto por las proteínas p24, p7 y p9. Al interior de la segunda cápside se encuentra el genoma viral del VIH, compuesto por el ARN de cadena simple y las proteínas acompañantes.
Interior de la cápside
Los lentivirus son virus de ARN de cadena simple de sentido positivo. El que sean de sentido positivo y al mismo tiempo retrovirus es extraño debido a que técnicamente no requieren -en teoría –pasar a ADN para activarse. Esto se debe a que el ARN en sentido positivo se define como aquel ARN viral capaz de actuar como su propio mensajero, produciendo partículas virales al ser leído. Al interior de la nucleocápside se encuentra una serie de proteínas que apoyan la función de infección a saber:
Transcriptasa reversa RT, p66/51
Su función es la de transcribir el ARN en sentido de mensajero a ADN de sentido positivo y posteriormente su cadena complementaria de forma tal que pueda pasar por ADN endógeno del anfitrión.
Integrasa IN, p32
Es una proteína típica de los retrovirus, y su función es la de conectar el genoma viral en ADN al ADN del anfitrión.
Proteasa PR, p14
Las proteínas de VIH al ser producidas se generan en estructuras pilíméricas “poliproteínas” que deben ser cortadas para generar las proteínas individuales activas, este corte es llevado a cabo por la proteasa.
Complejo ARN de transferencia-lisina 3, tARN
Es un ARN de transferencia aparentemente vinculado a un aminoácido que sirve como cebador de la polimerasa reversa durante la transcripción de ARN a ADN.
Genética del VIH
El genoma del VIH consta de alrededor de 9719 pares de bases, los cuales almacenan la información para 14 proteínas y otros elementos de importancia. Tres tipos de productos génicos pueden ser identificados en el genoma del VIH:
(a) Proteínas de la estructura viral: Representa la parte más conservada del VIH y la cual le da su identidad como lentivirus, es decir, todos los lentivirus poseen esta región que codifica para las proteínas de la estructura del virión. A su vez esta puede ser dividida en los segmentos gag, pol y env. Los genes estructurales son los más grandes y abarcan la mayor parte del genoma del VIH,
(b) Elementos reguladores esenciales: Hacen parte de la diversidad única de los virus de la inmunodeficiencia de los primates “incluyendo al humano como primate”. Está constituido por dos genes, el gen tat y el gen rev.
(c) Elementos reguladores accesorios: También hacen parte de la diversidad única de los virus de la inmunodeficiencia de los primates. Está constituido por los genes vpr, vif, nef y tev.
(d) Elementos del marco: A cada lado del genoma viral se encuentran secuencias de flanqueo llamadas LTR.
(e) Estructura secundaria: Adicionalmente, el ARN viral tiende a formar una estructura en bucles o cabezas de martillo típicas del ARN.
Figura 13.2. Genética del VIH. Una característica del genoma del VIH es que varios genes pueden compartir el mismo espacio genético, es decir, un locus para más de un gen.
Secuencias LTR en el VIH
LTR significa Long Terminal Repeats, es decir, repeticiones repetitivas terminales. Son secuencias altamente repetitivas que son encontradas en los retrotrasposones y los retrovirus. Su función es favorecer la integración del ADN exógeno con el ADN del anfitrión.
La secuencia LTR del VIH es altamente compleja, y se encuentra segmentada en tres regiones principales llamadas U3, R y U5. Las secciones U3 y U5 han sido subdivididas de acuerdo a las regiones de acoplamiento para los factores de transcripción y su impacto en la actividad de la expresión de genes virales. Ambas LTR poseen las mismas secciones y pueden llevar a cabo en potencia las mismas funciones, sin embargo, de acuerdo a sus carbonos terminales se los clasifica como extremo cinco prima (5´) y extremo tres prima (3´).
Región promotora o cebadora para el VIH
Por lo general la región 5´actua como promotor general para el genoma del virus integrado en el genoma de la célula, en este sentido es la propia maquinaria molecular de la célula la que da inicio a la producción del virus en la etapa infectiva. La sección 3´ provee un sitio para la poliadenilación del ARN mensajero del virus una vez se ha transcrito, esto protege al ARN viral de ser degradado por la maquinaria molecular del anfitrión. Adicionalmente en los VIH de los primates –incluyendo al hombre como un primate –la región 3´ almacena el gen nef. La región U-5 del VIH-1 ha sido caracterizada de acuerdo a su función y estructura en diferentes regiones: TAR, Poly A, PBS, Psi y DIS.
La región U5 de las secuencias LTR
Poseen subfunciones debido a subsecuencias importantes como:
(a) TAR: Elemento de respuesta de transactivación, juega un rol crítico en la activación transcripcional por medio de la interacción de proteínas virales. Forma un bucle estable que consiste en 26 pares de bases que interactúa con el factor de transcripción viral llamado tat.
(b) Poly A: Región necesaria para la poliadenilación y el clivaje diferencial.
(c) PBS: Región de unión del cebador, constituye 18 nucleótidos con una secuencia específica que se una a uno de los productos que vienen en el virión, la ARNt(lis) que sirve como el cebador en la etapa de ARN viral.
(d) Psi: Elemento de empaquetamiento psi, es una sección que sirve en la etapa de ARN viral para un correcto empaquetamiento en la nuclecápside. Está compuesto por un bucle en una punta llamado SL.
(e) DIS: Región de inicio del dímero, es una región conservada que permite formar la estructura secundaria del ARN al interior de la cápside, esto hace que el ASN viral tenga las típicas puntas en martillo de muchos ARN como el ARN de transferencia.
Componentes de los segmentos gag, pol y env en el HIV
Los genes gag, pol y env son los genes básicos de le otorgan al HIV su identidad como lentivirus, todos los lentivirus poseen estos genes, pero los virus de la inmunodeficiencia en todos los primates poseen genes extra producidos mediante splicing diferencial y splicing alternativo. Cada uno de los tres genes sintetiza una poliproteína que debe cortarse en puntos específicos para producir las proteínas individuales activas.
Diagrama de los loci del genoma del VIH-1 con los genes gag, pol y env. Puede notarse que gag y pol tienen un sobrelapamiento entre p6 y la proteasa, las proteínas son producidas mediante splicing alternativo, que permite a un mismo locus almacenar información para dos o más genes.
(a) Gag: Antígenos de grupo específico, codifica el precursor de la poliproteína gag. Cuando gag es clivada genera: p17 o proteína de la matriz, p24 o proteína de la capside, p2/p1 o péptidos espaciadores, p7 o proteína de la nucleocapside y p6. En resumen, el gen gag almacena la información para varios componentes de la capside.
(b) Pol: Por polimerasas, lo cual implica que almacena la información de la transcriptasa reversa o p66/51, la proteasa o p14 (o prot), p32 o integrasa. Todas son enzimas que ejercen funciones importantes en el ciclo de vida del VIH.
(c) Env: Por envoltura, codifica la proteína compuesta por los péptidos gp160 y gp41. Esta poliproteína es trasladada al retículo embolismático del anfitrión donde es procesada y translocada a la membrana externa del anfitrión a la espera de las cápsides formadas.
Variación en la estructura gag, pol, env en algunos lentivirus
Varios lentivirus, como el virus del linfoma múltiple (VLMu), del VIH-1. El VIH-2 y el virus linfotrófico humano (VLTH) presentan los loci de los genes gag, pol y env, aunque puede existir cierto nivel de cambio en la posición. Los loci se pueden sobrelapar y aun así generar los genes independientes gracias al splicing alternativo de los ARN mensajeros, este es el detalle que permite explicar porque el ARN de cadena simple positiva no es leído directamente por el ribosoma en la infección.
El ARN genómico viral aunque puede ser leído por el ribosoma no generaría correctamente las proteínas debido a que varios genes se encuentran compartiendo partes del mismo locus. En este orden de ideas el ARN viral pasa a ADN y se inserta en el genoma del anfitrión.
Figura 13.3. Estructura genética de otros lentivirus. En el modelo anterior podemos ver la ubicación relativa de los de varios lentivirus humanos, las secuencias gag, pol y env son comunes aunque el nivel se sobrelapado entre gag y pol cambia. Adicionalmente cada lentivirus es caracterizado por una serie de proteínas accesorias que determinan sus capacidad infectiva y patología.
Cuando es leído por la maquinaria del anfitrión, el VIH secuestra la maquinaria del splicing alternativo y diferencial, produciendo varios ARN mensajeros maduros a partir de su información, de modo tal que genera varias proteínas contenidas en una secuencia genética relativamente corta.
Elementos únicos del genoma de los lentivirus de los primates como el VIH
El VIH 1 y 2 han incorporado una serie de elementos únicos que los distinguen de otros lentivirus humanos como el virus del linfoma múltiple, aunque cabe destacar que cada linaje puede evolucionar sus propios genes específicos como el caso del virus linfotrófico humano VLTH. Varios de estos elementos accesorios como tat, rev y vpu se almacenan en los mismos loci que los genes pol y env, por lo que deben ser producidos por splicing alternativo de sus ARN mensajeros.
Muchos de estos elementos median procesos relativamente complejos en la función viral como el propio splicing alternativo y diferencial de los ARN mensajeros, la conformación de la estructura del ARN genómico viral al interior de la nucleocápside y el empaquetamiento de las cápsides virales. Como detalle adicional, los elementos accesorios de VIH-1 son diferentes a los de VIH-2. En este sentido en los siguientes artículos discutiremos exclusivamente los elementos accesorios del VIH-1 ya que es la cepa que se encuentra universalmente distribuida, en contraste VIH-2 es un virus menos agresivo que se encuentra contenido en la región de África central y occidental.
Proteínas extras del VIH y los VIS
Figura 13.4. Detalle de la genética del VIH.
(a) Tat: transactivador en trans del VIH. Juega un papel importante en la regulación de la transcripción reversa desde el ARN viral hacia el ADN monocatenario, adicionalmente regula la síntesis de los ARN mensajeros virales en términos de splicing y también controla la liberación correcta de los viriones de las células infectadas. Los exones de tat se encuentras separados por gran parte del gen env –de hecho el segundo exón de tat se encuentra al interior de env.
(b) Rev: regulador de la expresión de las proteínas del virión. La proteína rev es un factor de trasnsporte que se une al genoma viral recientemente producido, de forma tal que lo traslada desde el núcleo hacia el citosol a la espera de la formación de la cápside. Adicionalmente actúa como un factor de transcripción para varias proteínas virales. Al igual que tat, rev se encuentra dividido en dos exones separados por parte del gen env, y el segundo exón de env se encuentra al interior del gen env. Ambas proteínas son producidas mediante una combinación de splicing diferencial y alternativo.
(c) Vpr: También conocida como la proteína R de los lentivirus, vpr es un virión asociada a la proteína de translocación núcleo-citoplasma. Es importante en la replicación del virus, específicamente en la importación del complejo de integración proteínico. La proteína vpr también detiene el ciclo celular, manteniendo a la célula en la fase de crecimiento G2. Esto activa la maquinaria de reparación del ADN, la cual es reencausada por el virus para su propia síntesis. El VIH-2 y algunos VIS codifican otra proteína llamada vpx con funciones similares a vpr.
(d) Vif: Es una proteína altamente conservada importante en la infectividad del VIH dependiendo de la célula objetivo. Es necesaria cuando se encuentra infectando los macrófagos, linfocitos y dendríticas, pero no es importante para la infección de linajes experimentales como HeLa y COS.
(e) Nef: factor negativo, su función principal es la de regular la apoptosis de la célula incrementando la infectividad del virus.
(f) Vpu: Proteínas del virus U, juega varias funciones, pero la principal es la mediación de la liberación de los viriones activos de la célula anfitriona degradándola paulatinamente.
(g) Tev: Solo está presente en algunas cepas del VIH-1, consiste en una proteína con partes de tat, env y rev, sus funciones reportadas son semejantes a tat pero aún no ha sido investigada a profundidad.
Estructura secundaria del genoma de VIH
A diferencia del ADN, el ARN no forma una espiral doble y simétrica, los dos cromosomas de ARN que posee un virión del VIH se enroscan sobre si mismos formando estructuras con cabeza de martillo o bucles típicas de los ARN. La estructura que forman los cromosomas virales no son aleatorias, sino que, por el contrario, al depender de la secuencia general de los genes almacenados tienden a formar siempre un mismo complejo plano o en 2D.
Se piensa que esta estructura puede jugar roles cruciales en el inicio de la transcripción reversa y el empaquetamiento de los viriones nuevos. Los bucles o cabezas de martillo de la estructura secundaria del ARN genómico del VIH se encuentran en los genes de la proteasa y la transcripción reversa.
14. Como ingresa el VIH al cuerpo, tropismo
14. Como ingresa el VIH al cuerpo, tropismo
El objetivo celular más común y más conocido del VIH es sin duda alguna los linfocitos T efectores o ayudadores, de hecho, es la concentración de linfocitos T la que se emplea para describir la progresión de la infección, la carga viral y en últimas para definir la misma etapa de SIDA. SIDA se define como la etapa de la infección por VIH crónica en la que la concentración de linfocitos T efectores es inferior a 200 células por milímetro cúbico. Lo que no es tan conocido es que el VIH puede atacar a otras células del sistema inmune de forma directa como gran parte del linaje monocitario –léase las dendríticas y los macrófagos –y también es capaz de afectar de forma indirecta a otros componentes del sistema inmune. Adicionalmente, el VIH es capaz de infectar células microgilales. En esta sección examinaremos algunos detalles del tropismo –las líneas celulares que son afectadas por la infección de un virus –del VIH, poniendo énfasis en los mecanismos moleculares que permiten su adhesión e ingreso a la célula blanco.
Receptores y correceptores en la infección por VIH
El estudio del tropismo se centra no solo en los linajes celulares que pueden ser atacados por el VIH, sino también por las causas moleculares –que en últimas son proteínas –que le permiten al virión anclarse en la superficie de una célula e ingresar a ella. Las muestras del VIH-1 fueron clasificadas inicialmente a sus propiedades trópicas, citopáticas y replicativas. Es decir, se basaban de cualidades del virus. El estudio del tropismo a nivel molecular ha permitido clasificar las infecciones del VIH de acuerdo a una nomenclatura sistemática que emerge de los códigos de las proteínas que le permiten ingresar o atacar a una célula.
Figura 14.1. El VIH solo puede ingresar a las células que poseen receptores específicos en sus membranas.
El Receptor CD4 es una inmunoglobulina en ramillete que le da su nombre a los linfocitos T efectores o ayudadores, este receptor interactúa con el complejo mayor de histocompatibilidad durante la presentación del antígeno y permite dar inicio a la respuesta inmune humoral y adaptativa.
Figura 14.2. Receptores y correceptores. CD4 "rojo" se conecta junto con otros correceptores al complejo mayor de histocompatibilidad o su homólogo gp120. En la imagen tenemos a gp120 presentado por el VIH.
CD4 es una proteína de tipo cuaternario muy alargada que interactúa con el complejo mayor de histocompatibilidad del tipo II y con el receptor gp120 del VIH. El nombre CD va por dos rutas, la primera hace referencia a expresión clúster de diferenciación 4. Clúster de Diferenciación (CD) es un sistema de nomenclatura para nombrar de forma sistemática las inmunoglobulinas de la superficie, algo semejante al sistema de nomenclatura IUPAC para sustancias químicas simples.
Por otro lado, CD también hace referencia a 4 inmunoglobulinas pegadas “de allí la expresión ramillete y el doble significado de clúster” y una cola Citoplasmática/intracelular –la C viene de citoplasmática. Las inmunoglobulinas están codificadas desde D1 hasta D4, donde D1 y D3 son variables mientras que D2 y D4 son constantes.
El receptor emplea la porción D1 para interactuar con el dominio beta2 del complejo mayor de histocompatibilidad del tipo II –por lo cual la inmunidad por vía del CMH-I no está mediada por este receptor. Aparentemente la proteína de superficie en VIH llamada gp120 es un homólogo al domino beta2 del complejo mayor de histocompatibilidad, lo cual le permite al virus anclarse al receptor CD4 al inicio de su ciclo vital.
Clasificación de la infección del VIH
Clasificación de la infección del VIH por velocidad de la infección
Los primeros estudios de aislamiento del virus del VIH clasificaban las cepas de acuerdo a su velocidad de infección, por lo cual se empleaban las etiquetas rápido/lento para distinguir las cepas con alta carga viral y una rápida progresión a la etapa de SIDA de las cepas con poca carga viral y un lento progreso a la etapa de SIDA. Otros rasgos que distinguían a las cepas rápidas de las lentas eran la cinética –velocidad –con la cual los viriones se acoplan de forma efectiva a la superficie de las células que atacan y la cantidad de viriones liberados de una célula anfitrión que se encuentra secuestrada y en proceso de producción de más virus.
Históricamente las cepas lentas fueron las primeras en ser descritas. Esto se debe a que, durante una infección por contacto sexual, los mecanismos de infección generalmente son células dendríticas y macrófagos comunes en las mucosas sexuales, y los viriones lentos tienden a estar asociados a estas células del sistema inmune. Con los años y cuando llega la etapa de SIDA la cepa rápida se desarrolla, lo cual hizo de la descripción de las cepas rápidas fuera más lenta y/o a que los resultados de las publicaciones parecieran ser incoherentes –lo cual es aprovechado por los negacionistas del VIH.
En cualquier caso la respuesta es simple, la velocidad de la infección muta gradualmente desde lenta y de baja productividad al inicio de la infección a rápida y de alta productividad en la etapa subclínica y de SIDA.
Clasificación de la infección del VIH por la capacidad de formar sincitios
Otros de los primeros aislamientos, particularmente aquellos obtenidos de individuos en etapa de SIDA, inducían a la formación de sincitios –células polinucleadas mediante la sinapsis viral. Estas cepas fueron clasificadas como formadoras de sincitios (SI por sus siglas en inglés) para distinguirlas de las que no formaban sincitios (NSI por sus siglas en inglés).
Figura 14.3. Los sincitios virales. Los sincitios son células que han mutado por efecto del VIH y los receptores virales gp120, se forman al fusionar células sanas con infectadas. Algunos tipos de cáncer también forman sincitios, es un carácter diagnóstico en las citologías.
El mecanismo inductor del sincitio son los receptores CD4 y el coreceptor CXCR4. El coreceptor CXCR4 atrae con más fortaleza cualquier cosa homóloga a una citoquina y lo ingresa a la célula, lo cual incluye a otras células. Durante la infección por VIH la proteína GP160 se forma a partir de GP41 y GP120 en la membrana de la célula infectada, si está célula interactúa con otro linfocito, primero formando una sinapsis continua y luego haciendo que las dos se fusionen -en caso de que la cepa que produjo el gp 160 sea afín con CXCR4 -formando una célula polinucleada llamada sincitio.
Algunas cepas formadoras de sincitios son capaces de infectar las líneas de células T CD4+ pero no a los descendientes del linaje de los monocitos –como los macrófagos y las dendríticas. Estas cepas del VIH fueron designadas como Virus del linaje de las células T o virus de trofismo de células T. En inglés se las describe como TCL-trofic pero también se las puede describir simplemente como T-tróficas tanto en inglés como en español.
Clasificación de la infección del VIH por los linajes celulares que infecta
Resulta conveniente realizar un breve resumen de los componentes celulares del sistema inmune, para poder tener una visión de cuáles son los tipos de célula que el VIH ataca. Los glóbulos blancos se dividen de polimorfonucleares y mononucleares, en los textos sobre VIH los blancos son generalmente referenciados como los mononucleares en su conjunto.
Figura 14.4. Los glóbulos blancos. En general los leucocitos principales son 5, neutrófilos, eosinófilos, basófilos, linfocitos y monocitos.
El VIH posee como blanco a las células mononucleares, pero no todas, por lo cual resulta conveniente describir sus tipos. En primera instancia los linfocitos Figura 40, Luego los descendientes de los monocitos Figura 41.
El trofismo/tropismo celular fue la tercera propiedad para clasificar los primeros aislamientos del VIH- Todas las cepas del VIH-1 son capaces de reproducirse en las células activadas “células mononucleádas de la sangre periférica como los linfocitos, los monocitos y los macrófagos”.
Algunas pueden replicarse en cultivos sintéticos como MDM “Modified Dulbecco's Medium” y han sido clasificadas como cepas con tropismo de macrófago o cepas M-tróficas. Otros aislamientos iniciales del VIH-1 son capaces de infectar preferentemente las células T y ha sido designada como T-tróficas. Otros aislamientos primarios poseen la capacidad de infectar sin preferencia alguna cualquiera de los linajes del sistema inmune, ya sea el linaje de los linfocitos T o el linaje de los monocitos. Adicionalmente se encontró una asociación ya que las cepas lentas y de baja producción tienden a ser también las M-tróficas, mientras que las cepas rápidas y de alta producción tienden a ser T-tróficas.
Figura 14.5. Los linfocitos se ven iguales. Se resalta la población de linfocitos atacados por el VIH, en este caso únicamente los linfocitos con el receptor CD4 resultan atacados.
Figura 14.6. Los monocitos si se ven diferentes. A diferencia de la línea linfocitaria, la monocitaria si experimenta grandes cambios en su activación, el problema es que todas, incluso el precursor monocito posee el receptor CD en sus membranas, lo cual los hace vulnerables al ataque del VIH.
Aparentemente las clasificaciones del trofismo no tenían en cuenta a las cepas que atacan a las microgliaes, sin embargo, debido a que estas son afectadas en las etapas terminales, las cepas que las atacan son T-tróficas, ya que estas son las más comunes en la etapa de SIDA.
Clasificación de la infección del VIH por los correceptores
Con el descubrimiento de que receptores de quimioquinas alfa y beta sirven como un segundo requisito de acceso a la célula blanco para que el VIH pueda infectar, los protocolos de clasificación fueron alterados a un sistema mucho más sistemático, la infección del VIH será ahora clasificada en base al código del correceptor y no a cualidades variables como la velocidad de la infección.
A parte del receptor CD4 el VIH requiere uno o cualquiera de dos receptores de citoquinas. Estos receptores son proteínas G acopladas a un activador –el receptor de citoquinas –normalmente las citoquinas son los señalizadores de emergencia en el sistema inmune. Esto implica que la otra parte de importancia de la proteína gp160 que es altamente conservada en los VIH es un homólogo de citoquinas.
Los dos receptores acoplados a una proteína G son denominados CCR5 y CXCR4. Las cepas que emplean el receptor CCR5 son denominadas VIH-1 R5, mientras que las cepas que emplean el coreceptor CXCR4 son denominadas VIH-1 X4. A parte de los dos grupos emergió uno nuevo –uno transicional –intermedio que se caracteriza por un tropismo dual y que explica los casos de una velocidad y productividad intermedios llamado R5/X4.
Resumen de la clasificación de la infección por VIH
En la siguiente tabla de plantea un resumen del tropismo del VIH-1. Cabe resaltar que existen excepciones. Por ejemplo, algunos precursores linfocitarios puedes expresar los dos receptores de citoquinas y por lo tanto, ser atacados por versiones del VIH-1 R5. Un aspecto curioso sobre la investigación del VIH. Por lo general los primeros intentos de aislar el VIH emplearon células T cancerígenas para investigación debido a que pueden ser cultivadas a grandes velocidades.
Sin embargo, como cualquier linfocito T, estos no expresan el receptor CCR5, por lo cual un cultivo de etapa aguda del VIH será incapaz de infectar al cultivo arrojando un falso negativo. Esto se debe a que las infecciones iniciales son causadas por la versión R5 del virus el cual necesita el receptor CCR5 presente en la línea monocítica.
El correceptor CCR5 y la infección por VIH-1
Función del correceptor CCR5
El correceptor de quimioquinas del tipo 5 conocido en inglés por los códigos CCR5 o CD195. Es una proteína de la superficie de las células blancas del sistema inmune que se encuentra involucrada como receptor de quimioquinas "también llamadas citocinas". Las quimioquinas son moléculas promiscuas –no específicas y por lo tanto poco diversas –que dirigen la activación de las células del sistema inmune, así como la activación y proliferación del mismo, en últimas son una señal de alarma para el sistema inmune. Específicamente, permite los linfocitos T y a los monocitos y sus descendientes ser atraídos a los tejidos donde se encuentran causados por virus, cáncer, bacterias, hongos o parásitos eucarióticos.
Figura 14.7. Los correceptores más importantes para la infección por VIH.
Tabla 3. Clasificación de la infección por VIH-1, por tropismo y fenotipo infeccioso.

Estructura del correceptor CCR5
El correceptor CCR5 pertenece al grupo de receptores que quimioquinas beta, una familia de proteínas integrales de la membrana, el cual se encuentra acoplado a un dominio externo de un efector tipo G. Las proteínas G transfieren señales desde el exterior de la célula al interior, son muy versátiles ya que lo único que alteran es el receptor, dicho receptor puede ser modificado para activarse por luz –para la visión –o ser activado por hormonas –como es el caso de la reproducción.
CCR5 es expresada de forma predominante en los linfocitos T inmaduros, pero es mucho más importante los macrófagos y células dendríticas. Las células microgliales expresa ambas, así como otro correceptor menos famoso para la infección del VIH llamado CCR3, pero aparentemente las células microgliales son atacadas gracias a su receptor CCR5, lo cual crea una paradoja, esto es debido a que en ese contexto las microgliales deberían ser atacadas en la etapa aguda de la infección.
Tropismo del VIH-1 R5 y formación de sincitios
Las cepas del VIH afines al receptor CCR5 son denominadas cepas R5 y atacan preferentemente a las células del linaje del monocito, es decir monocitos, macrófagos y dendríticas, generalmente son clasificadas como cepas M-tropicas. Estas cepas se reproducen lentamente, producen muy poca carga viral por célula afectada y no forman sincitios. Los sincitios son células que expresan receptores del VIH que inducen a interactuar con otras del mismo tipo fusionándose, el producto son células gigantes polinucleadas con una alta producción vírica.
Mutantes resistentes contra el VIH R5
Algunos individuos poseen una deleción de 32 pares de bases llamada delta 32 en el gen que codifica el receptor CCR5. Si el individuo es homocigoto delta 32, su línea monocitaria se hace fuertemente resistente al ingreso del VIH. Esto es posiblemente un arma de doble filo, un caso ha reportado que un individuo delta 32 homocigoto fue infectado por una cepa dual R5/X4, sufriendo de una rápida eliminación de sus linfocitos T CD4, esta es sin embargo una excepción, pero demuestra el efecto de la carrera armamentista de la Selección Natural.
Figura 14.8. La peste negra. Aparentemente Yersinia pestis tiene un mecanismo de ingreso a la célula dependiente al receptor CCR5, lo cual provocó la generación de mutantes para este receptor, especialmente en Europa, donde esta bacteria generó una grave epidemia llamada la peste negra.
La prevalencia de la mutación Delta-32 se encuentra en países del norte de Europa, la cual ayuda a que varios pacientes desarrollen lentamente la etapa de SIDA. Por lo general, debido a las rutas de infección, las primeras cepas que infectan a las personas son del tipo R5, con lo cual ser un mutante homocigoto Delta-32 es una enorme ventaja evolutiva. Los individuos heterocigotos delta 32 tienden a ser progresivos lentos, es decir, son afectados por el VIH pero su etapa de latencia es muy prolongada. En este sentido la mutación tiende a convertir al VIH en un comensal.
Otras mutaciones contra el VIH-1 R5
Otras mutaciones han sido reportadas para el gen CCR5 o para las citoquinas con las cuales el VIH-1 compite para acoplarse. Algunas veces se trata de polimorfismos, es decir de variantes informacionales como es el caso del polimorfismo 59353-C del CCR5.
Algunos individuos de progresión lenta, muy lenta o que han convertido el VIH en un comensal poseen versiones modificadas de varias quimioquinas que activan al receptor CCR5 compitiendo de forma eficiente con el VIH e impidiendo que su carga viral sea muy alta de forma permanente.
Existe una tasa representativa de individuos en la población con estas mutaciones, las cuales reducen la probabilidad de infección del VIH, el problema nuevamente son las cepas duales y la posibilidad de una cepa X4.
El correceptor CXCR4 y la infección por VIH
Mucho de lo dicho ya en el receptor CCR5 aplica para este en términos de estructura –se trata de un receptor acoplado a una proteína G –sin embargo, el receptor CXCR4 posee una característica diferente, es un factor de fusión. A las cepas que emplean este correceptor se las llama X4. En este sentido favorece la función de la célula blanco con el VIH o con una célula infectada en producción de receptores GP160. Y esto es justamente lo que las hace tan peligrosas, la versión X4 puede infectar a otras células T CD4 no solo en estado de virión, también cuando está al interior de una célula.
Las células productos de la función se las llama sincitios y se caracterizan por una alta producción de viriones, productor de la labor combinada de varios núcleos de forma simultánea. Las cepas X4 emergen naturalmente de una población R5 durante los años de la latencia, y el incremento de su prevalencia está asociado al desarrollo de la etapa de SIDA. Al igual que con las cepas R5 algunos individuos de la población poseen mutaciones que inhabilitan la expresión adecuada del receptor CXCR4 haciendo que la progresión a etapa de SIDA sea lenta o no se dé. Las razones para que las X4 emerjan a partir de las R5 se desconocen en gran medida en la actualidad, lo que sí se sabe es que si una persona es infectada con una cepa X4 la progresión de la infección será más rápida.
Interacción receptor y correceptor en la adhesión del VIH
Estructura de la llave de ingreso del VIH a la célula blanco
La llave de entrada del VIH se denomina gp160, una proteína compuesta por dos subunidades, gp41 y gp120. Gp41 actúa como un tallo o grúa móvil, que cambiará de forma cuando gp120 realice su segundo cambio conformacional. Por su parte, gp120 puede ser considerada como los dientes de la llave, esta está conformada para acoplarse a las dos guardas de la célula que va a atacar.
La primera guarda es el receptor CD4, cuando GP120 se acopla a este receptor cambia su estructura nativa –cambio denominado enmascaramiento conformacional –lo cual permite la aparición de un segundo dominio que interactúa con un correceptor, los principales con CXCR4 y CCR5 pero existen otros de menor importancia. Los correceptores son la segunda guarda y una vez GP120 se ha acoplado a estas dos guardas induce que GP41 haga ingresar al virión mediante la fusión de las membranas.
Enmascaramiento conformacional del VIH
Los linfocitos B actúan contra el VIH produciendo anticuerpos anti gp120 en estado nativo. Sin embargo existen dos problemas con respecto a esta respuesta inmune inicial. La primera es el tiempo que tarda la activación del linfocito B específico, y el tiempo de retraso con respecto a la hipermutación somática. La activación del sistema inmune y la mejora de la especificidad vía hipermutación somática tiene un tiempo de retraso de unas dos semanas o más, tiempo en el cual el VIH se arraiga en el sistema inmune del anfitrión.
El segundo problema es que estos anticuerpos han evolucionado para atacar la estructura nativa, pero una vez GP120 ha hecho contacto con CD4 esta estructura nativa cambia y los anticuerpos ya no la reconocen. Este proceso es denominado enmascaramiento conformacional.
Fusión del VIH
Una vez que GP120 se ha acoplado al receptor y el correceptor, GP41 cambia de forma, jalando el virión hacia la célula blanco. Este proceso se facilita si el receptor es la fusina CXCR4, la cual también jala la membrana del virus hacia la célula acelerando la fusión. Una vez que la célula anfitriona empieza a expresar las proteínas de la membrana del virus, su propia membrana se llena de la proteína GP160 lo cual implica que puede interactuar con otras células. Para el caso de la cepa X4 la consecuencia es que la célula anfitriona infectada puede jalar a otras células blanco fusionándose con ellas creando una nueva célula más grande y con un potencial para crear viriones más importante, estas células polinucleadas son llamadas sincitios.
Cerca del 90% de las nuevas infecciones son por la cepa R5 debido a contacto sexual, mientras que la X4 requiere de contacto directo de sangre que contenga los linfocitos T CD4 que la poseen. Una vez que el virión ha ingresado a la célula los anticuerpos son inefectivos, pero los linfocitos T CD8+ se convierten en su principal amenaza junto con las células asesinas naturales NK.
15. Respuesta inmune contra el VIH
15. Respuesta inmune contra el VIH
Una cosa es la enfermedad y otra el agente causante de la enfermedad –agente etiológico –distinguir entre estos dos factores es vital para entender, no solo la inmunidad contra el VIH, sino la inmunidad para muchos virus.
Figura 15.1. Ciclo de vida del VIH. (1) Virión libre; (2) adhesión y fusión al receptor CD4 y los correceptores, ya sea CCR5 o CXCR4; (3) infección o ingreso del genoma viral; (4) Transcripción de ARN a ADN; (5) integración con el genoma de la célula anfitriona; (6) transcripción de los elementos virales y traducción a proteínas; (7) ensamblaje de las proteínas virales, (8) evaginación, secuestrando parte de la membrana de la célula anfitriona con proteínas de membrana aun inmaduras (9) y finalmente maduración por corte de algunas proteínas (10).
Por ejemplo, las personas que desarrollan el herpes de Zoster causada por el virus de la varicela de Zoster manifiestan lesiones cutáneas y otra serie de síntomas que son contenidos por una potente respuesta inmune. El herpes de Zoster como la mayoría de los Herpes se oculta en el sistema nervioso y no emergen normalmente gracias a que el sistema inmune los mantiene bajo control. Existen tres clasificaciones para la velocidad en la que se llega a la etapa de SIDA, los progresivos rápidos llegan en un año o menos, los progresivos moderados "la gran mayoría de las personas" llegan a la etapa SIDA después de 8 años, pero los progresivos lentos y no progresivos pueden morirse de forma efectiva de cualquier otra cosa antes de llegar a la etapa de SIDA. Aunque son una minoría su presencia puede alimentar la creencia popular de que VIH no está conectado a SIDA.
El VIH aunque genera una supresión del sistema inmune en su etapa avanzada, no infecta de igual forma a todos los individuos. La variación en el curso de la infección es debida a múltiples causas: como la ruta de la infección, la genética del virus y la suerte “deriva genética”, genética del individuo, factores ambientales como el modo de vida, la alimentación, el estrés, y en gran parte a la capacidad de respuesta inmune. Si todos estos factores se acoplan de forma positiva extrema, el individuo es un no-progresivo "non-progressor", o en sentidos coloquiales, un portador asintomático permanente, capaz de convivir con el VIH permanentemente. Por el contrario, si los factores se asocian en su extremo negativo la etapa de SIDA se alcanza poco después de un año –o menos –después de la infección original, individuos como estos se los llaman progresivos acelerados “rapid-progressor”.
Respuestas del sistema inmune innato contra el VIH
El sistema inmune innato está compuesto por células que atacan de forma poco específica, procesan al atacante y lo presentan al sistema inmune adaptativo –menos las asesinas naturales que siguen una ruta diferente, pero igual son poco específicos. La respuesta inmune por la ruta sexual es iniciada por las células dendríticas mieloides, que aparte de ser el primer blanco de la infección, convocan una potente respuesta inmune que disemina la infección del VIH. Se dice que, si esta primera respuesta inmune fuese bloqueada de alguna forma, el VIH solo lograría realizar ina infección localizada y autolimitada después de la destrucción de las células dendríticas mieloides.
De todas las líneas del sistema inmune innato, se ha documentado que las células asesinas naturales incrementan sus números durante la etapa aguda de la infección atacando de forma citotóxicos a las células infectadas. De hecho, ellas causan las inflamaciones en los nódulos linfáticos debido a su efecto citotóxicos, el cual si es efectivo contribuye a una progresión más lenta a la etapa de SIDA.
El sistema inmune humoral contra el VIH
La infección inicial del VIH activa a los linfocitos B que inician la producción de anticuerpos. Los anticuerpos buscarán pegarse a la GP160, sin embargo, aun cuando estos logran pegarse, no son capaces de inhabilitar los viriones. Adicionalmente, la superficie de la membrana viral posee componentes que dificultan la adhesión de los anticuerpos. Por otro lado, el VIH iterativamente muta para evadir la respuesta inmune, lo que en poco tiempo causa un agotamiento de los linfocitos B inhabilitándolos en el curso de la etapa crónica de la infección por VIH. A pesar de lo anterior, el suero de individuos crónicos posee anticuerpos capaces de inhabilitar algunas cepas del VIH de forma amplia, lo cual implica la existencia de marcadores conservados que pueden emplearse para tratamientos o para una hipotética vacuna.
La respuesta de los linfocitos T CD8+ contra el VIH
El sistema inmune adaptativo celular contra el ataque de los virus involucra la expansión de la población linfocitaria T CD8+, los cuales reconocen las proteínas virales por medio del complejo mayor de histocompatibilidad del tipo I. Una vez que un linfocito T CD8+ reconoce un marcador extraño activa su función citotóxica, eliminando la célula que presentó su marcador y adicionalmente a las células circundantes. Dependiendo de la cinética del virus, la presentación del antígeno, el efecto citotóxico de los linfocitos T CD8+ puede llegar a inhabilitar una infección antes de que genere síntomas.
Durante las primeras semanas de la infección por VIH, la carga viral disminuye desde más del 1´000.000 de copias por mililitros a menos de 30.000 copias por mililitro. Coincidiendo con la caída de la carga viral, se da un aumento en la concentración de los linfocitos T CD8+, lo cual apoya la conclusión de que los linfocitos T CD8+ tienen una labor en controlar la infección del VIH. En los modelos animales, cuando los linfocitos T CD8+ son removidos por la administración de medicamentos supresores, la carga viral aumenta drásticamente en la etapa de latencia, y cuando los medicamentos dejan de ser administrados, los linfocitos T CD8+ regresan, lo cual coincide con una restauración de la etapa de latencia del VIH. Aunque todos estos datos inducen a pensar que los linfocitos T CD8+ controlan la infección, los datos en los modelos humanos no son consistentes.
Mientras que estos datos sugieren que los linfocitos T CD8+ están involucrados en la respuesta inmune contra el VIH, la exacta contribución de estas células contra la infección del VIH ha sido muy difícil de determinar. Una de las razones es que ambas, los VIH y los linfocitos intentan adaptarse el uno al otro en lo que se conoce como –carrera armamentista evolutiva. Aparentemente, no todo el complejo mayor de histocompatibilidad del tipo I es capaz de movilizarse durante la infección aguda del VIH. Por otra parte, los pocos marcadores reconocidos por el sistema logran escapar por variabilidad del VIH, lo cual dificulta la activación de los linfocitos T CD8+.Lo que sí es claro es que una respuesta sostenida de los linfocitos T CD8+ puede hacer que el individuo desarrolle SIDA lentamente o que incluso no desarrolle SIDA.
La respuesta de los linfocitos T CD4+ contra el VIH
La producción optima de anticuerpos por parte de los linfocitos B, o la activación eficiente de la capacidad cititoxicas de los linfocitos T CD8+ requiere la presencia de linfocitos T CD4+ específicos contra marcadores del VIH presentados por los macrófagos, las células dendríticas, los linfocitos B y otros linfocitos T CD4+. Tenga en cuenta que muchas de estas células son precisamente los blancos de la infección por VIH. La infección aguda no elimina a los linfocitos T CD4+ de la sangre debida a que estos no expresan el receptor CCR5, lo cual hace que la primera respuesta inmune contra el VIH sea efectiva y la etapa de latencia de inicio.
Los linfocitos T CD4+ y CD8+ pierden la capacidad de proliferar in vitro después de los primeros meses de infección sin tratamiento, pero los defectos proliferativos de los linfocitos T CD8+ se restauran rápidamente mediante la administración de linfocitos T CD4+ externos. A pesar de que la función de los linfocitos T CD4+ ha sido mejorada artificialmente mediante intervenciones médicas: vacunas, interrupciones en los tratamientos y terapia con interleuquina 2; ninguna de estas aproximaciones ha mejorado de forma particular el resultado de la infección a largo plazo. Los linfocitos T CD4+ pueden ser clasificados en base a funciones específicas, pero el VIH parece afectar todas las subfunciones de los linfocitos T CD4+.
Nuevamente, la respuesta inmune contra el VIH depende de la presencia de linfocitos T CD4+ específicos contra el VIH. El problema es que son estos mismos linfocitos los blancos preferenciales de infección del VIH. Mientras que los linajes X4 no aparecen en sangre, estos linfocitos T CD4+ están operando, lo cual permite que el sistema inmune controle la infección durante los años de la latencia, pero tan pronto como las versiones X4 aparecen, los linfocitos T CD4+ desaparecen y el sistema inmune queda inhabilidad. Incluso, las subpoblaciones de linfocitos T CD4+ específicos contra VIH que producen quimioquinas beta que bloquean al VIH son los blancos preferentes de infección y eliminación por citotoxicidad.
Genética del anfitrión y control del VIH
La gran variación en la duración de la etapa de latencia e incluso la manifestación de la etapa de SIDA involucra una gran gama de factores ecológicos. Uno de los factores que afectan la progresión de la infección es la diversidad de los alelos del complejo mayor de histocompatibilidad, moléculas encargadas de detectar marcadores específicos del VIH para presentarlos al sistema inmune. Entre más alelos que responden a VIH estén presentes, la presentación de antígeno será más efectiva y la respuesta inmune mucho más eficiente. Han sido reportados alelos que hacen de la progresión a la etapa de SIDA más lenta y otros asociados a una progresión más rápida.
16. Ciclo de vida del VIH
16. Ciclo de vida del VIH
El ciclo de vida del VIH ocurre como en cualquier otro lentivirus. Cabe recordar que, en el caso de los sincitios, el ciclo de vida del VIH no involucre la formación de viriones nuevos, una vez que la célula produce las proteínas y se ensamblan en forma de gp160, esta célula procede a funcionarse con células sanas.
Adhesión del VIH a la célula blanco
Toda célula que exprese el receptor CD4 y los correceptores CCR5, CXCR4 puede ser infectada por el VIH, adicionalmente existen otros marcadores que permiten infecciones menores. De los dos componentes de la gp160, es gp120 la que media la adhesión con el blanco tanto con CD4 como con el correceptor.
La infección puede distinguirse en tres tipos:
1- Adhesión, infección y producción eficiente: Linfocitos T CD4+, células del linaje monocitario –monocitos, macrófagos y dendríticas –y finalmente las microgliales.
2- Adhesión, infección, sin producción: el VIH es capaz de ingresar a la célula, pero no produce una infección productiva. Varios tejidos no inmunitarios pueden ser infectados por el VIH como musculo liso de la pared arterial, neuronas, hepatocitos y algunas células epiteliales especializadas.
3- Adhesión sin infección: el VIH se queda pegado a la superficie de la célula y es transmitido de una célula a otra por medio de sinapsis viral. Ejemplos de esto es presentado por los linfocitos B.
Ingreso del VIH a la célula blanco
La interacción de gp120 con CD4+ induce un cambio conformacional en ambas, lo cual permite que gp120 adquiera la forma y la posición para interactuar con los correceptores CCR5 y CXCR4. Una vez que se da la interacción con el correceptor, la sección gp41 de gp160 cambia de forma atrayendo la membrana viral a la membrana celular.
Si el correceptor de acoplado es CXCR4 el proceso de fusión de las dos membranas de acelera, lo cual contribuye al fenotipo de las cepas X4, es decir cepas de cinética de infección alta. Una vez suficientemente cerca, las membranas se fusionan espontáneamente liberando el VIH en el citoplasma celular.
Pérdida de la cápside del VIH
La cápside pierde estabilidad una vez ha ingresado al citoplasma, desintegrándose de forma espontánea debido a una relación de equilibrio químico, liberando el complejo de trascripción. Las condiciones citoplasmáticas impiden la formación de cápsides y nucleocápsides, ya sean nuevas o viejas. El complejo de trascripción viene por duplicado debido a que cada virión almacena dos cadenas con los mismos loci, condiciones que es conocida cono pseudidiploidía. Este estado permite crear viriones haploides y diploides que contribuyen a su variabilidad.
El complejo de transcripción es una entidad compuesta no solo por ARN y la transcriptasa reversa, sino también por las proteínas de la cápside, nucelocápside, integrasa y Vpr. La pérdida de estabilidad de la cápside está vinculada al inicio de la transcripción reversa, debido a que una proteína de la cápside interna se encuentra presente en el complejo de transcripción.
Transcripción reversa del VIH
La transcripción reversa inicia con la síntesis de la cadena de ADN de sentido negativo, simultáneamente el complejo de transcripción destruye la cadena de ARN de sentido positivo menos algunas secciones que sirven como cebadores. Posteriormente, da inicio a la síntesis de la cadena complementaria de ADN mediante los cebadores de ARN y un cebador que venía integrado en el complejo de transcripción. La síntesis de la cadena positiva y complementaria del ADN es llevada a cabo también por la transcriptasa reversa, esto gracias a un segundo dominio que funciona como polimerasa.
Esta es la razón por la cual la transcriptasa reversa tiende a cometer tantos errores mutacionales. Una polimerasa normal tiene el dominio de copia en base a ADN y el segundo dominio de corrección; mientras que la transcriptasa reversa posee dos dominios para copiar en base a ADN o ARN pero carece del dominio de corrección. Finalmente, la cadenadoble de ADN viran es transferida al interior del núcleo.
Integración del ADN viral con el anfitrión
El VIH es un virus latente, es decir un virus capaz de integrarse al genoma de la célula blanco, convirtiéndose en parte permanente de esta y de sus descendientes. Después de 72 horas después de que el VIH ha infectado la célula, su ADN ya hace parte del genoma de la célula blanco. La integración está mediada gracias al complejo de transcripción, especialmente a la proteína integrada. Una vez el ADN viral se ha integrado al genoma pasa a denominarse provirus.
El provirus es una estructura cuasi-inmune al ataque el sistema inmune, esto es porque a pesar de que existen anticuerpos capases de distinguir algunas secuencias del ADN, es poco probable que posean la especialización necesaria para distinguir una molécula tan grande, y la razón más importante, los anticuerpos están a fuera de la célula y el provirus está en el interior del núcleo.
La única forma de que el sistema inmune detecte que algo pasa, es que el provirus empiece a enviar ARN mensajeros que generan proteínas virales, las cuales pueden ser capturadas por el complejo mayor de histocompatibilidad de tipo I. En este caso, los linfocitos T CD8+ realizan su función citotóxica eliminando la célula infectada. Por el contrario, si el provirus se queda inactivo, el linfocito puede seguir viviendo por un largo periodo sin que el sistema inmune o los antirretrovirales puedan afectar al provirus en su interior.
Síntesis de ARN mensajero viral
Debido a que varios loci de los genes del VIH se superponen –están ubicados en las mismas secuencias de ADN – la producción de ARN mensajero debe pasar por maduración, lo cual permite la formación de diferentes ARN mensajeros maduros. Este mecanismo es denominado splicing diferencial y splicing alternativo. Los ribosomas captan los ARN mensajeros como propios y sintetizan las proteínas virales en su forma inactiva, a la espera de la síntesis de la proteasa que las activarán una vez los ARN virales sintetizados a partir del ADN del provirus.
Cabe anotar dos detalles. El primero es que para que el virus pueda realizar una infección productiva efectiva, a parte de los ARN mensajeros enviados al ribosoma, también se generan nuevos ARN genómicos que son exportados del núcleo como si fueran mensajeros, pero en lugar de ser capturados por el ribosoma, se asocian a proteínas virales. Las proteínas virales se sintetizan originalmente en segmentos multiprotéicos que viajan a la membrana externa de la célula junto con el ARN genómico a la espera de que se acumulen suficientes. Esta es la etapa más vulnerable del VIH al sistema inmune ya que las proteínas gp160 pueden inducir el ataque de los linfocitos citotóxicos.
Ensamblaje y maduración de los nuevos viriones de VIH
Cuando la cantidad suficiente de proteínas virales se acumulan en la membrana junto con dos segmentos de ADN genómico viral, las interacciones moleculares como las fuerzas de Van der Waals provoca que las proteínas se agrupen entorno al material genético y simultáneamente la membrana de la célula realiza una gemación. La gema o virión inmaduro posee aun sus proteínas desorganizadas, por lo que estos viriones no se encuentran activos. En este contexto, la proteasa corta las poli-proteínas, en este punto las proteínas de la cápside un al nucleocápside liberadas se organizan espontáneamente conformando finalmente el virión maduro e infectivo con una transcriptasa activa.
Dispersión
La dispersión viral puede lograrse por tres mecanismos. El primero es mediante la liberación de viriones en la fase líquida de la matriz intracelular, en cuyo caso encontraran a sus blancos por azar. El segundo proceso involucra transformar al linfocito infectado como un enorme vector. Esto se debe a que, en la etapa final de la infección, la membrana del linfocito se tapiza con el complejo gp41/gp160, el cual es el que le permite al virus pegarse a un linfocito. De este modo el linfocito infectado se pega a un linfocito sano creando un linfocito infectado más grande que producirá más viriones. Este nuevo linfocito polinucleado llamado sincitio no se muere debido a que el VIH bloquea la apoptosis celular. Este proceso es útil cuando el VIH alcanza los ganglios linfáticos, donde las células linfáticas monstruo puede generarse fácilmente dado que los linfocitos se encuentran cercanamente empaquetados.
El segundo mecanismo también reside en las proteínas que se insertan en la membrana del linfocito infectado y que ayudan a formar la sinapsis viral que mencionamos anteriormente. El segundo mecanismo se aprovecha de la burocracia del sistema inmune. Cuando las células inmunes se comunican entre sí la presencia de una infección, lo hacen presentando proteínas virales entre sí, ya sea para iniciar procesos de liberación de anticuerpos o para iniciar procesos inflamatorios. Muchos virus buscan evitar tal detección, pero el VIH lo que busca es hacerse visible, de modo tal que nuevos linfocitos y otras células del sistema inmune vulnerables se acerquen a las células infectadas.
Para que el mecanismo sincitial sea efectivo el VIH debe alcanzar regiones con alta concentración de linfocitos, el primer blanco es el epitelio gastrointestinal, generando una gastroenteritis temprana, y posteriormente los nódulos linfáticos, generando la típica linfadenopatía.
Reservorios
Como veremos en capítulos posteriores, el proceso de terapia combinatoria de antirretrovirales TARGA se ha convertido en el proceso estandarizado para el tratamiento de la infección por VIH, sin embargo, la habilidad del virus del VIH para persistir en el cuerpo a pesar de la presencia de medicamentos que efectivamente inhiben pasos clave de su ciclo de vida (Pierson, McArthur, & Siliciano, 2000). Este éxito y fracaso simultáneo de la terapia TARGA contra el VIH-1 ha generado gran interés en la comunidad científica por investigar los mecanismos por los cuales el VIH logra persistir por largos periodos de tiempo, y de hecho se ha logrado determinar algunas rutas de sobrevivencia a las cuales llamaremos reservorios (Pierson et al., 2000).
La producción viral en los individuos infectados es un proceso dinámico que involucra rondas de producción continua de nuevos viriones infectantes, incluso en la etapa de latencia. Y aunque el blanco principal son los linfocitos T CD4 activos también involucra a otros linajes celulares. Se ha vuelto bastante claro que la terapia TARGA se enfoca demasiado en el proceso “activo” de la infección por VIH que involucra específicamente a los linfocitos T CD4 activos, después de todo eso es lo que genera a largo plazo la etapa de SIDA, sin embargo bloquear el ciclo de vida del VIH es de poca utilidad en linajes celulares vulnerables, pero que no se encuentran activos como las células gliales (Pierson et al., 2000).
Sin embargo, un nuevo mecanismo ha sido reportado, el cual involucra el malicioso secuestro de otro de los procesos basales del sistema inmune. Cuando los linfocitos T CD4 son activados en el momento en que se les presenta un antígeno extraño pueden tomar dos rutas, la primera es la activa que conlleva a la proliferación y la generación de una respuesta inmune. Algunos de los linfocitos T CD4 activos generados por esta proliferación se desactivan parcialmente, conviert9iendose en células de memoria del sistema inmune (Pierson et al., 2000).
Este proceso es útil ya que durante la proliferación se da un proceso de evolución darwiniana conocido como hipermutación somática, que aumenta la sensibilidad del individuo a infecciones posteriores, mejorando su inmunidad. El problema es que el VIH infecta a estos linfocitos T CD4 de memoria, los cuales al permanecer desactivados no generan ciclos de infección activos. Los antirestrovirales solo pueden bloquear el ciclo vital del virus mientras que se encuentra activo, por lo que estas células de memoria infectadas pasan de ser percibidas por los antiretrovirales (Pierson et al., 2000).
Mientras que un ciclo de vida en un linfocito T CD4 activo se completa en 1.5 días, en una célula de memoria puede completarse en 44 meses, a esta velocidad de reproducción, el tratamiento TARGA requeriría 60 meses de administración disciplinada para erradicar el virus, y no se está teniendo en cuenta la posible existencia de otros reservorios. Esto conlleva a una ambición poco realista para la erradicación total del VIH-1 del anfitrión (Pierson et al., 2000).
17. Diversidad y adaptabilidad del VIH
17. Diversidad y adaptabilidad del VIH
Uno de los principales obstáculos para el tratamiento del virus de la inmunodeficiencia humana es una enorme variabilidad genética y con gran potencial evolutivo. El VIH puede ser dividido en dos categorías generales, que en realidad corresponden a dos cepas de origen diferente e independiente, de dos cepas del VIS que afecta a dos especies de primates diferentes, los chimpancés “VIS a VIH-1” (Faria et al., 2014; Hemelaar, 2012; Plantier et al., 2009) y los mangabeyes grises “VIS a VIH-2” (Santiago et al., 2005). El VIH-1 puede ser dividido en varias cepas, de las cuales al menos tres surgieron de forma independiente, o lo que es lo mismo, se han formado mediante tres cruces independientes del VIS al ser humano. Sin embargo, todas las cepas que se encuentran fuera del Africa descienden de un solo ancestro común, la cepa M del VIH-1. Algunos de los descendientes del VIH-1 M son más virulentos o presentan resistencia a varios antirretrovirales, lo cual dificulta el control del VIH.
Camino a entender la diversidad del VIH-1
Basados en los estudios sobre replicación y producción de viriones competentes para el MLV, ALV y HTLV, se pensó originalmente que el VIH-1 sería un virus con un genoma altamente homogéneo y poco variable. Sin embargo, a medida que más y más cepas fueron secuenciadas y categorizadas taxonómicamente en base a las normas de la Teoría Sintética de la Evolución, un resultado se hizo evidente, el VIH-1 presenta una extensa heterogeneidad. El punto es tan absurdo que no existen dos muestras del VIH-1 idénticas, o peor aún, un mismo individuo puede desarrollar cepas diferentes en una misma infección.
Aunque las mutaciones pueden distribuirse en todo el genoma, lo cual muestra la enorme flexibilidad de los genes virales al cambio, los loci hipervariables corresponden al gen Env que codifican para las proteínas de la superficie gp160. Sin embargo, en gp41 se encontró un dominio altamente conservado que permitió el diseño de anticuerpos de muestras independientes de diferentes continentes, sin embargo aun así existe variación, lo cual ha conllevado a cierta variación en los inmunoensayos como ELISA y westernblot.
Causas de la alta variabilidad del VIH-1
Existen varios factores que contribuyen a la extraordinaria diversidad genética del VIH1:
(a) La molécula de ARN es inestable y tiende a generar mutaciones de forma altamente espontánea.
(b) La ARN transcriptasa reversa es una enzima que carece de un dominio corrector como si poseen las ADN polimerasas, lo cual hace que la transcriptasa reversa tienda al error –así de la llama en ingles “error-prone” o tendiente al error.
(c) Altas frecuencias de recombinación genética acompañando la transcripción reversa.
(d) Altas tasas de replicación por ciclo de infección.
Recombinación genética en el VIH-1
La recombinación es un proceso que le permite a los seres vivos intercambiar loci con alelos diferentes para formar una nueva progenie con los alelos de los parentales y alelos nuevos recombinados que no existían en la generación anterior. Aunque la recombinación es un proceso que se enseña para las células eucariotas en su proceso de meiosis, muchos virus incluyendo a los retrovirus llevan a cabo frecuentemente procesos de recombinación. La recombinación en el VIH juega un rol crítico en el incremento de su diversidad de forma independiente a las mutaciones, adicionalmente es de mucha importancia en la formación de variantes de relevancia clínica y epidemiológica. Aunque se sabe que los fragmentos de los ARN virales no se recombinan al azar, los mecanismos exactos que permiten la recombinación aun no son del todo claros. Los datos de algunos estudios sugieren que la estructura secundaria del cromosoma viral, con sus bucles y cambios de dirección juega un rol importante en el intercambio de genes.
El virus de la inmunodeficiencia humana de tipo 1 VIH-1
El VIH-1 es el más común de los dos tipos generales del VIH, se encuentra universalmente distribuido, es más virulento y su contagio es mucho más probable que el VIH-2. El VIH-1 ha evolucionado al menos cuatro veces (o más, algunos estudios sostienen que del chimpancé al humano ha pasado tres veces), dos desde los chimpancé (Keele et al., 2006) y dos desde los gorilas que lo obtuvieron de los chimpancés (Plantier et al., 2009; Van Heuverswyn et al., 2006).
En cualquier caso, la mayoría de las personas hacen referencia al VIH en sentido común, aunque para ser precisos la pandemia global es causada por el VIH-1 del subtipo M, el cual puede ser dividido en diferentes categorías. Sin embargo, le daremos un vistazo a los cuatro grupos del VIH denominados clusters principales.
Los clústeres del virus de inmunodeficiencia humana VIH-1
Un clúster representa un punto en un diagrama taxonómico donde se agrupan muchas especies y/o linajes altamente emparentados con un antepasado común reciente. Mediante el análisis comparativo de varias muestras del VIH-1 y varios VIS se ha generado un sistema taxonómico dividido en cuatro clusters generales: M (Main o principal), O (outliner o externo), N (non-M, non-O = no principal y no externo) y el grupo P.
El esquema anterior es el diagrama taxonómico no enraizado para los cuatro grupos del VIH-1, dos de ellos están relacionados con el VIS de los chimpancés (M y N), mientras que los otros dos están relacionados con el VIS de los gorilas (O y P), el cual a su vez está relacionado con el VIS de los chimpancés. Por esto es que se dice que el VIH-1 ha evolucionado varias veces de forma independiente, aunque el linaje mundialmente distribuido es el (M).
Cluster M
M es el clúster más importante de los cuatro que han sido reportados para el VIH-1 y representa a más del 90% de las infecciones registradas alrededor del mundo. El clúster M anida a una serie de clados o subtipos que son designados también mediante una letra. Las formas recombinantes poseen códigos específicos. El código viene antecedido las las letras CRF por forma recombinante circulante “Circulating Recombinant Form” seguido por un numero serial de tres dígitos y terminado por las letras de los clados que se recombinaron.
Si tenemos una cepa recombinada de los clados A y B que resulta ser la 12 en en orden de descubrimiento, su código es CRF12_AB. A su vez los clados pueden ser divididos en subclados como A1, A2 y así sistemáticamente. Los clados del cluster M son: A, B, C, D, E, F, G, H, I, J y K, mientras que las formas recombinantes ampliamente distribuidas superan las 49.
(a) Distribución del cluster M:
A continuación, describiremos los clados en los que se divide el clúster M del VIH-1 y su ubicación más prevalente, teniendo en cuenta que todos los clados pueden ser aislados en África:
A: es común en áfrica occidental, américa del Norte, América Central y la región norte de América del Sur.
B: es representativo de Europa, las américas, Japón, Tailandia y Australia.
C: Se encuentra en el cono sur africano, África del este, India, Nepal y algunas partes de China.
D: Concentrado en áfrica central y del este.
E: Nunca ha sido aislado independientemente, siempre está presente con secciones de otros clados en formas recombinantes por lo que es un virus hipotético.
F: África Central, América del Sur, y el Este de Europa.
G: Ha sido encontrado en África y Europa Central.
H: contenido en África Central.
I: no es un clado en sí, sino el producto especial de varios recombinantes complejos.
J: África Central, Occidental y del Norte, así como en el Caribe.
K: Limitado en la República democrática del Congo y Camerún.
(b) Variación de la distribución del cluster M: El virus del VIH evoluciona a gran velocidad, lo cual ha hecho que el mapa de la distribución de sus clados haya cambiado con los años, y ciertamente el mapa que hoy expresamos como imagen principal sea obsoleto en unos cinco o diez años en el futuro. En cualquier caso, todos los clados del VIH-1 se originaron en África, porque es allí donde se los puede aislar a todos –lo cual es una evidencia más de que el VIH posee un origen africano. Con la rápida diseminación del VIH-1 en la región del sur de África a finales de los años 90s gracias a la política de negacionistas del VIH/SIDA, el clado C se ha convertido es la cepa más prevalente a nivel mundial, acumulando casi la mitad de las infecciones del VIH-1M en el mundo.
Figura 17.1. Dendrograma no enraizado de los principales clados de VIH-1.
El Clado A, el grupo más común en África al inicio de la pandemia, en la actualidad solo representa el 12% de las infecciones mundiales, y se encuentra principalmente en las américas, así como en las regiones de África central y oriental. El clado B es el grupo más intensamente estudiado –y es de hecho el organismo tipo para el cual se diseñan la mayoría de los inmunoensayos –es muy prevalente en América del Norte y Australia.
(c) Efecto de la recombinación en el cluster M: Las altas tasas de recombinación son un sello distintivo de los retrovirus y son generados por el hecho de que una sola célula puede ser atacada de forma simultánea por viriones de cepas diferentes. Para 1995 se hizo medicamente significativo el hallazgo de que una fracción significativa de la diversidad global del VIH-1 clúster M emerge por la recombinación de clados conocidos, incluso de formas muy complejas. Los recombinantes tienen mayor tendencia a aparecer en las regiones donde existen varios clados coexistentes en proporciones significativas como África, América del Sur y el Sudeste de Asia.
Cluster N
El clúster N fue bautizado debido a que no encajaba ni con el clúster M o el clúster O. Este grupo fue identificado en 1998 y solo ha sido aislado en Camerún. A la fecha, menos de 15 individuos han sido identificados con este raro grupo del VIH gracias a las técnicas disponibles de inmunoensayos. Cabe anotar que el clúster N presenta variación en su gp41 a un nivel suficiente como para evadir la detección con versiones antiguas de los inmunoensayos.
En 2009 una nueva cepa del VIH fue secuenciada, encontrándose que formaba un clado con virus recientemente descubiertos aislados en gorilas (VISgor), es decir, su ancestro común estaba más cercanamente relacionado con el VIS de los gorilas que con el VIS de los chimpancés. El virus ha sido aislado de una mujer francesa residente en Camerún que fue diagnosticada con VIH-1 en 2004.
Cluster P
Pendiente de identificación de más casos humanos.
Cluster O
El Clúster O –outliner = externo –no se observaa de forma usual fuera del África del centro-occidente. Es más común en Camerún, en donde un muestreo realizado en 1997 encontró que cerca del 2% de las muestras obtenidas pertenecían al grupo O. El grupo O es problemático ya que presenta variaciones en gp41 y por lo tanto no podía ser detectado por las primeras versiones comerciales de los inmunoensayos. Nuevos kits de detección han sido desarrollados para poder incluir al clúster O dentro de los positivos.
Al inicio de la infección, el grupo O representaba casi el 20% de las infecciones, lo cual sumado al problema de los primeros kits para el diagnóstico conllevaba a una tasa muy alta de malos diagnósticos paraa el VIH-1 clúster O. Actualmente, los kits han mejorado, y la prevalencia de este clúster ha disminuido a cerca del 1%.
¿Por qué el chimpancé está relacionado con el VIH-1?
Aunque dos de los clúster del VIH-1 pueden rastrearse a VIS de gorilas, igual, los VIS de los gorilas pueden rastrearse al VIS del chimpancé como grupo más cercano al ancestro común del VIS de los primates antropomorfos. ¿Por qué el chimpancé?, para responder a esta pregunta hay que dejar claro una cosa, los chimpancés no son estrictamente vegetarianos, ellos también pueden organizar partidas de caza para atrapar a otros primates. Primates que poseen sus propios VIS. Al igual que con los humanos, comer carne cruda de primate es un vector para el contagio de virus de tipo lentivirus.
Figura 17.2. Los cercopitecos de nariz blanca (Cercopithecus nictitans) son primates que se encuentran en varias regiones de África, desde Guinea hasta Uganda. Estos hermosos monos se caracterizan por su pelaje espeso y su cola larga y peluda. Su nombre proviene de la distintiva nariz blanca y la cara oscura que contrasta con el pelaje. Son animales arbóreos y se desplazan ágilmente por los árboles en busca de frutas, hojas y semillas. Además, son conocidos por su comportamiento social y su capacidad para emitir una variedad de vocalizaciones. Aunque enfrentan desafíos debido a la destrucción del hábitat y la caza, los cercopitecos de nariz blanca continúan siendo una especie icónica de la fauna africana.
Análisis genéticos han arrojado que el VIS de los chimpancés, que es el más antiguo de los primates antropomorfos emergió por recombinación del VISgsn y del VISrcm, que son virus de especies de primates típicamente cazadas por los chimpancés, en este caso los cecopitecos de nariz blanca (Cercopithecus nictitans) y los mangabeyes de cabeza rora (Cercocebus torquatus) respectivamente (Vessière, Delaugerre, Plantier, & Simon, 2010). El modelo encaja en el sentido de que los gorilas y los chimpancés compiten y combaten por el territorio, y los conflictos pueden dejar heridas abiertas y contactos de fluido al morder, lo cual explica el paso del VIS progenitor a los gorilas.
Figura 17.3. Los mangabeyes de cabeza roja (Cercocebus torquatus) son primates que se encuentran en las regiones forestales de África occidental. Estos monos destacan por su distintivo pelaje de color rojizo en la cabeza y el cuello, que contrasta con el resto de su cuerpo de tono más oscuro. Son animales sociales y viven en grupos liderados por una hembra dominante. Su alimentación es omnívora, consumiendo frutas, hojas, semillas e insectos. Los mangabeyes de cabeza roja son conocidos por sus vocalizaciones variadas y complejas. Aunque enfrentan amenazas debido a la pérdida de hábitat y la caza, su presencia en los bosques africanos es vital para el equilibrio ecológico y la diversidad de especies.
El virus de la inmunodeficiencia humana del tipo 2 VIH-2
El VIH-2 ha sido reportado en otras partes del mundo, la primera vez que se reportó en USA fue en 1987, aunque los muestreos arrojan que se encuentra relativamente aislado en África. Muchos –pero no todos –los kits de diagnóstico para el VIH-1 pueden detectar al VIH-2. Hasta la fecha se han detectado 8 clústeres del VIH-2 que están nombrados por letras mayúsculas de la A hasta la H. De estos grupos solo los clústeres A y B son epidémicos. El Clúster A ha sido aislado principalmente en África occidental, pero también en Angola, Mozambique, Brasil, India y de forma muy limitada en Europa u USA. El clúster B se encuentra principalmente confinado a África occidental.
Figura 17.4. Potencial evolutivo. En el esquema anterior podemos ver un ejemplo del proceso darwiniano. Las variantes resistentes (R-1, R-2, R-3) se hacen prevalentes en la población cuando se administra una determinada droga, cuando se retira, la forma silvestre o normal se hace más prevalente, pero los genes de resistencia permanecen en la población.
El HIV-2 se encuentra cercanamente relacionado con el VIS de los mangabeyes grises (Cercocebus atys) y el código que este virus recibe es VISsmm –SIVsmm por sus siglas en inglés –los cuales habitan los bosques del África occidental (Lemey et al., 2003; Santiago et al., 2005). Los demás clúster del VIH-2 han sido aislados en solo una persona respectivamente. Lo anterior implica que han sido transmitidos de forma independiente desde los mangabeyes grices, lo cual indica que el VIH-2 ha evolucionado más de 5 veces de forma independiente desde un mismo linaje –evolución paralela y convergente.
Resistencia del VIH a los antirretrovirales
La resistencia a los antirretrovirales es un caso bastante conocido en el tratamiento de las infecciones contra el VIH y que cae en una categoría más general, la resistencia a los tratamientos contra enfermedades infecciosas. Los seres humanos esperamos que nuestras balas mágicas, una vez que han sido descubiertas, dieran para siempre en base a los años y millones de dólares invertidos en su investigación y desarrollo, pero los agentes infecciosos nos demuestran que los procesos ciegos y aleatorios pueden derrotar aun las moléculas más avanzadas. En estos artículos discutiremos brevemente algunas de las consecuencias de la arrogancia humana sobre la genética del VIH.
Arrogancia médica con respecto a la resistencia contra medicamentos
Se dice que la sífilis hubiera se hubiera convertido en una pandemia del grado del VIH o peor en la Europa posterior a la II guerra mundial si no hubiera sido por la intervención de los antibióticos. Estas drogas milagrosas dieron a la sociedad occidental un sentido de seguridad y confianza enormes, pero en la actualidad la resistencia a los antibióticos se ha convertido en un verdadero desastre. Del mismo ocurre con la infección con VIH, con un problema adicional, donde los antibióticos tenían éxito de erradicar la enfermedad, los antirretrovirales simplemente restauran la etapa de latencia o la etapa subclínica. A pesar de lo anterior no son raros los documentales y los médicos que sugieren alterar el epíteto de enfermedad mortal al de enfermedad crónica (Soler, 2012). Casi todas las drogas empleadas para combatir el VIH en la actualidad ya poseen algún tipo de inefectividad contra algunas cepas circulantes del VIH (Gupta et al., 2012; Johnson et al., 2013).
Los cocteles
El HIV ha desarrollado métodos de resistencia para evadir y/o tolerar los efectos de los tratamientos al punto que no existe molécula individual a la cual no existe un mecanismo de resistencia. El problema ocurre cuando la cepa individual ha desarrollado resistencia contra una mezcla amplia de medicamentos, en tal caso la etapa de latencia o subclínica mantenida por los medicamentos regresa rápidamente al SIDA avanzado.
Estudios han demostrado que cerca del 76.3% de los individuos VIH positivo en USA que reciben tratamiento con antirretrovirales poseen alguna forma de resistencia a los antirretrovirales y otros fármacos empleados en el tratamiento de la etapa de SIDA. De todos los rasgos del VIH el factor que más facilita la evolución de mecanismos de resistencia es su alta tasa de mutaciones (Richman et al., 2004).
Potencial evolutivo darwiniano
La transcriptasa reversa carece del segundo dominio que le permite normalmente a las enzimas replicadoras corregir los errores, esto se debe a que la transcriptasa lo que posee es un domino ARNasa que degrada el templado de ARN a medida que sintetiza el ADN bicatenario proviral. Como resultado, de todos los sistemas con la propiedad de evolución, el VIH es sin duda el que posee la tasa de mutaciones más alta conocida. Esto crea una situación ideal para que la Selección Natural entendida como toda interacción entre el virus y su ambiente permita la aparición de adaptaciones.
Las mutaciones se acumulan de generación en generación, y se recombinan con virus de otros linajes, creando una enorme variabilidad al interior de las poblaciones del VIH, y una probabilidad muy alta de que algunas de estas variantes puedan evadir o tolerar mecanismos moleculares que atacan a otras versiones del mismo virus al interior de la población. Lo anterior crea ciclos en los tratamientos, el paciente ingresa en etapa de SIDA, se lo trata, luego hay una mejoría inmediata pero paulatinamente regresa a la etapa de SIDA, momento en el cual hay que iniciar con otro tratamiento más potente y posiblemente con efectos secundarios más fuertes.
18. Diagnóstico del VIH
18. Diagnóstico del VIH
El diagnóstico del VIH es uno de los aspectos más controvertidos e investigados, esto es debido a que un correcto diagnóstico permite a los centros de prestación de salud un manejo adecuado del proceso de infección. Mientras más temprano se inicien los tratamientos, la expectativa de vida aumentará. El VIH se diagnostica por métodos diferentes, unos son cualitativos y otros cuantitativos, unos son indirectos y otros son directos. Cabe resaltar que ningún método diagnóstico es perfecto, especialmente para la gran mayoría de los virus. Los virus a diferencia de otros patógenos como los parásitos eucarióticos no se diagnostican por fotografías, sino por la medición de sustancias que los componen.
La razón de esto es que los virus son varios ordenes de magnitud más pequeños que cualquier célula de parásito o de bacteria, y en segundo lugar, muchos virus se parecen entre sí –cualquier lentivirus típico humano como el de la leucemia linfotrópica humana se ve igual al VIH – en las fotos, sus características diferenciadoras están en las secuencias de las proteínas y los ácidos nucleicos que los componen. Por esta razón –además de que tomarle una foto a un virus es impráctico tecnológica y económicamente –las fotos no son un método diagnóstico para el VIH como si lo es para enfermedades como la Plasmodium sp o Enthamoeba sp.
Diagnóstico cualitativo del VIH
El diagnóstico temprano del Virus de Inmunodeficiencia Humana (VIH) es crucial para brindar atención médica oportuna y tomar medidas preventivas para frenar su propagación. En este artículo, exploraremos el diagnóstico cualitativo del VIH, una herramienta precisa y confiable utilizada para identificar la presencia del virus en el organismo. Analizaremos las diferentes técnicas de detección, como las pruebas de anticuerpos, las pruebas de antígenos y las pruebas moleculares, y examinaremos sus ventajas y limitaciones. También destacaremos la importancia de la asesoría pre y post-test, así como el impacto emocional y psicológico que puede tener el diagnóstico. Al comprender en detalle el diagnóstico cualitativo del VIH, esperamos promover una mayor conciencia sobre la importancia de la detección temprana y la gestión efectiva de esta enfermedad, mejorando así la calidad de vida de las personas afectadas y contribuyendo a la prevención y control del VIH a nivel global.
Diagnóstico del VIH por Síndrome de InmunoDeficiencia Adquirida SIDA
El diagnóstico del VIH por la etapa de SIDA es lo más evidente, históricamente la etapa de SIDA fue la causa por la cual los grupos de investigación en epidemiología comenzaron a buscar su causa subyacente. En base a estas investigaciones fue identificado el VIH-1 y posteriormente el VIH-2. De esta forma, la presencia del Síndrome de Inmunodeficiencia no asociado a tratamientos por trasplante de órganos o por desórdenes genéticos es un indicativo de que ha sido Adquirida. Aunque otros lentivirus como HTLV pueden afectar el sistema inmune dañando la línea linfoide, el VIH es particular al dañar la línea monocitoide del sistema inmune.
Entre las infecciones oportunistas diagnósticas del VIH subyacente se encuentran la neumonía por Pneumocystis jirovencii, esofagitis y estomatitis por Candida albicans, meningitis por Cryptococcus, toxoplasmosis secundaria invasiva, herpes ulcerativo tipo I, II, Varicela de Zoster secundaria –la varicela solo da una vez en la vida en condiciones normales. Sudoraciones nocturnas, pérdida de más del 10% de la masa corporal, especialmente en músculo, fiebres recurrentes, inflamación de los ganglios linfáticos y diarrea. Finalmente, uno de los síntomas más evidentes son las lesiones cutáneas del sarcoma de Kaposi.
El elemento diagnóstico es que todas o varias ocurren de forma simultánea en el mismo paciente sin ser epidémicas o poseer mecanismos de patogenicidad extraños, además de ser recurrentes y con síntomas más severos de lo que generalmente se presentan. Una vez se diagnostica el Síndrome de Inmunodeficiencia se pasa a la etapa de detectar su causa, si es genética o adquirida, y si la adquisición depende de factores químicos como tratamientos, defectos adquiridos posteriormente como el linfoma o por patógenos como el VIH.
Problemas en el diagnóstico cualitativo de la etapa aguda del VIH
El hecho de que le llamemos síntomas inespecíficos a los que se presentan en la etapa aguda de la infección por VIH tiene una razón de ser, y es que literalmente no sirven para diagnosticar. La primera línea de defensa para muchas infecciones siempre es inespecífica e involucra al sistema inmune innato, que ataca diferencialmente a los patógenos del mismo modo, los síntomas generalmente son dolores en articulaciones, malestar general, fiebre, inflamación de los ganglios linfáticos, la mucosidad es opcional pero también se presenta.
Muchos otros agentes etiológicos como el herpes virus 4, el citomegalovirus, la influenza, los enterovirus, la enfermedad de Lyme, la sífilis secundaria, infecciones bacterianas, anaplasmosis y babesiosis manifiestan el mismo coctel de síntomas en la infección aguda, y debido a que las infecciones de transmición sexual usualmente se transmiten en combo es probable que junto con el VIH también se encuentren otras infecciones.
Coinfección y diagnóstico cualitativo del VIH
Otras Infecciones de Transmisión Sexual tienen los mismos factores de riesgo que el VIH al ser transmitida por el mismo acto sexual. De hecho, se ha determinado que muchas ITS se transmiten en grupo debido a la falta de uso de condones. Cuando una persona es diagnosticada con una ITS como el herpes 2, el VPH, la gonorrea o la sífilis siempre se le hacen pruebas secundarias para las demás ITS siendo la más relevante el VIH. Al igual que los demás métodos cualitativos, la coinfección es un heurístico que sirve para acelerar el proceso de diagnóstico, pero para asegurar que ocurrió la coinfección es necesario realizar las pruebas cuantitativas de laboratorio como ELISA.
La etapa de latencia y la necesidad de realizar diagnósticos cuantitativos rutinariamente
Debido a que la etapa de latencia es asintomática pero infectiva, se recomienda realizar diagnósticos cuantitativos de forma regular, mucho más en personas involucradas con factores de riesgo tales como: tatuado, inyectología, trabajadores sexuales –incluyendo actores porno – e investigadores clínicos.
Los protocolos de muestreo en países desarrollados como USA se están volviendo más amplios, de forma tal que cualquier paciente al cual se le extrae sangre, a parte de los exámenes específicos que deba realizarse también es muestreado para VIH. Esta medida puede parecer excesiva, pero el problema de la etapa de latencia hace que cerca del 25% de la población infectada e infectante no sepa que es portadora del virus y que puede en potencia diseminar la enfermedad a sus compañeros sexuales (Centers for Disease Control and Prevention, 2006).
Aunque la mayoría de los países requieren un consentimiento para realizar la prueba, si es recomendable realizarse periódicamente el examen con el fin de romper la cadena de transmisión.
Terminología en el diagnóstico del VIH
A diferencia de lo que podría esperarse, el diagnóstico médico no es un proceso tan simple, de hecho, series de televisión como Doctor House nos muestran lo complejo, tentativo y lento que un proceso de diagnóstico puede llegar a ser. Por esta razón deberemos emplear la terminología adecuada.
(a) Patrón dorado: Es el mejor mecanismo de diagnóstico para cualquier agente etiológico que puede aplicarse bajo las condiciones de investigación del momento. Es decir, posee la mayor sensibilidad, fiabilidad y el menor tiempo de silencio.
(b) Etapa de letargo, etapa de silencio o etapa de invisibilidad: Es el periodo de tiempo en el cual la infección no puede ser detectada ni con un patrón dorado. En promedio para el VIH este dura unos 12-25 días en el subtipo B. El patrón dorado “PCR” tiene un periodo de silencio 12 días, mientras que las pruebas con anticuerpos como ELISA tienen un periodo de silencio de unos 16 días.
(c) Sensibilidad: Porcentaje de positivos cuando el VIH se encuentra presente.
(d) Especificidad: Porcentaje de negativos cuando el VIH no está presente.
(e) Falso positivo: Diagnóstico incorrecto de la presencia del VIH.
(f) Falso negativo: Diagnóstico incorrecto de la ausencia del VIH.
Los anticuerpos generados para lentivirus semejantes al VIH o enfermedades autoinmunes como el lupus sistémico eritematoso pueden generar falsos positivos. Por el contrario, la mayoría de los falsos negativos son generados por el periodo de silencio, aunque en otros casos se debe a la presencia de una cepa muy rara del VIH contra la cual no se han estandarizado las pruebas de diagnóstico, cosa que era muy común en los años 90s.
Diagnóstico directo o indirecto del VIH
El VIH se puede diagnosticar cuantitativamente por ruta directa o indirecta. La parte cuantitativa se refiere a detectar cantidades de ciertas sustancias químicas. Las pruebas indirectas como ELISA y el westernblot son indirectas, es decir no detectan las partes del virus como tal. Como se mencionó en la sección sobre la respuesta inmune, los linfocitos B producen anticuerpos específicos contra algunas partes del VIH. Las pruebas indirectas se emplean para detectar estos anticuerpos, con lo cual se concluye de forma indirecta la presencia del VIH.
Las pruebas directas como la PCR del ARN viral, o el aislamiento y PCR del ADN integrado del virión son métodos directos ya que miden la cantidad de sustancia perteneciente al virus mismo, estas pruebas representan el estándar dorado para el diagnóstico del VIH, así como para evaluar la cantidad de viriones circulando en sangre en algún momento determinado de la infección.
Idealmente, las pruebas diagnósticas se combinan, un positivo obtenido por las pruebas indirectas que se confirma con las directas genera una certeza cercana al 100%, sin embargo antes de tener la tecnología de la PCR y de detectar la mayoría de las variantes del VIH la fiabilidad del diagnóstico podía rondar el 79% para el VIH-1 y del 50% para el VIH-2. Es probable que centros médicos sin acceso a los kits de última generación para el diagnóstico aun tengan niveles de diagnóstico muy bajos.
Diagnóstico del VIH por métodos indirectos
(a) Conteo de linfocitos T CD4+: El conteo de linfocitos T CD4+ no constituye una prueba directa para el VIH debido a que carece de especificad. Sin embargo, para monitorear el sistema inmune una vez que un individuo ha sido diagnosticado como VIH-postivo. Los conteos normales van entre 500-1500 células por milímetro cúbico de sangre. Cuando una persona desarrolla SIDA el conteo baja de los 200. El criterio definitorio de SIDA –menos de 200 células por milímetro cúbico –fue oficialmente introducido en 1992, el valor fue elegido debido a su asociación estadística con la mayoría de las infecciones oportunistas, aun cuando algunas cuantas ocurren por el lime superior a los 200.
Bajos conteos de las células T CD4+ están asociados a otras condiciones como otras infecciones virales, algunas infecciones bacterianas, tuberculosis, coccidiomicosis, quemaduras, trauma, malnutrición, mucho ejercicio, embarazo, variaciones normales diarias, estrés psicológico y aislamiento social. En últimas el conteo de linfocitos T CD4+ se emplea para determinar el estado general del sistema inmune.
(b) Seroconverción y VIH: Los métodos indirectos se basan en la detección de anticuerpos específicos contra el VIH.
Figura 18.1. La seroconversión es el momento en que los anticuerpos “línea azul” se hacen medibles.
Existen varios problemas asociados a estos métodos de diagnóstico cuando se los analiza de forma individual. En primera instancia, no sirven para detectar el VIH durante el tiempo de silencio, que para estas pruebas ronda los 16-20 días en el mejor de los casos, en otros casos el intervalo puede prolongarse desde tres semanas hasta seis meses. El punto en que los anticuerpos se hacen detectables se denomina seroconversión y se designa como positivo.
La mayor parte de las personas desarrolla anticuerpos detectables para los kits estandarizados después de 30 días de haberse infectado. El 97% de los individuos realizan la seroconversión en tres meses después de la infección. La terapia antirretroviral puede retrasar la seroconversión si se administra durante el periodo de silencio hasta 12 meses. Los pacientes que fueron expuestos al VIH y realizan tratamiento profiláctico de emergencia deben realizarse exámenes rutinarios que se extienden hasta más de un año para garantizar que no ocurra seroconversión.
(c) Diagnóstico del VIH por ELISA: En primera, no es el nombre de una señora (…), ELISA es un acrónimo para una técnica de la biología e inmunología molecular empleada para muchas otras cosas en los laboratorios. En español ELISA significa Ensayo de Absorción Inmune Vinculado a Enzimas.
En un ensayo ELISA el suero de una persona es diluido 400 veces y aplicado a un plato que contiene fragmentos virales sintetizados para que los anticuerpos se peguen. Posteriormente, se aplican anti-anticuerpos, es decir, anticuerpos que se pegan a los anticuerpos humanos formando un trímero: antígeno VIH preparado-anticuerpo del paciente-antianticuerpo preparado. El anti-anticuerpo se encuentra vinculado a una enzima que emite la señal medible ya sea por color o fluorescencia.
Finamente se adiciona un activador para la enzima, y que esta pueda efectuar el cambio de color. La intensidad del color es directamente proporcional a la cantidad de anticuerpos presentes en el suero. La prueba es buena para los extremos positivo y negativo, pero mala o al menos muy controversial para resultados intermedios, ya que ha sido muy problemático la estandarización de un punto de corte para falso positivo y falso negativo en caso de dudas.
El problema con ELISA es el ajuste de los antígenos anclados al plato, si estos no son lo suficientemente generales para detectar anticuerpos para todas las cepas de VIH se generarían muchos falsos negativos, pero hacerlo muy general también haría que otros virus generen reacciones cruzadas. El ajuste de este dilema está en constante investigación, además de que es la causa de tener que emplear otros métodos diagnósticos para confirmar.
(d) Diagnóstico del VIH por westernblot:Procedimiento del Westernblot y diagnóstico del VIH: Al igual que ELISA el westernblot es un método diagnostico empleado para muchas otras cosas en los laboratorios de biología e inmunología molecular que diagnostica de forma indirecta el VIH mediante la determinación de los anticuerpos. Sin embargo, cabe decir que no es tan indirecta. El primer paso del westernblot es realizar una electroforesis de las proteínas de interés, en este caso GAG –proteínas de la cápside – ENV –proteínas de la envoltura – y POL –polimerasas. Una vez se han separado las proteínas por peso, forma y carga molecular, se procede a realizar el blot.
Figura 18.2. Weestern-blot. El blot es el paso de las proteínas desde el gel de electroforesis hacia una hoja de papel mediante un campo eléctrico. Finalmente, las proteínas aisladas son detectadas mediante anticuerpos asociados a una enzima. Cuando se adiciona el sustrato, la enzima cambia de color generando una banda de diagnóstico.
Diagnostico indeterminado por Westernblot: Hasta aquí todo bien, el problema viene cuando se miran las barras coloreadas como resultado del ensayo. Los pacientes VIH negativos no muestran color en ningún carril, pero los pacientes que se encuentran cerca del fin de la etapa de silencio pueden presentar algunas bandas si y otras no. Originalmente cada país tenía un criterio diferente como se muestra en algunos documentales antiguos, lo cual dificultaba una unicidad en el diagnóstico. Actualmente, los pacientes con algunas barras marcadas y otras no son diagnosticados como indeterminados, y deben repetir la prueba varios meses después, a la espera que desarrollen más anticuerpos contra el VIH.
Error intrínseco de diagnóstico del VIH por westernblot: La mayoría de los pacientes con resultados indeterminados presentan ya el positivo normal después de un mes al repetirse la prueba. Por esto en algunos documentales se lo denomina como ensayo prognóstico y no diagnóstico. Pensar que la corroboración de ELISA al westernblot sin tomar en cuenta el periodo de silencio haría presentar un falso negativo. Si westernblot da un indeterminado se da un pronóstico y debe repetirse una vez que la infección ha avanzado. Por otro lado, el error intrínseco de la prueba, es decir que el individuo sea negativo pero que invariable y sostenidamente de indeterminado en el westernblot es raro y ocurre en 1 de cada 5000 pacientes. Por último, el westernblot ha sido particularmente problemático para el VIH-2 por lo que un diagnostico indeterminado para personas con riesgo de tener esta cepa deben realizarse pruebas más específicas como PCR.
Aspectos críticos del westerblot para el diagnóstico del VIH: Mientras que ELISA requiere que los antígenos sintetizados por la casa matriz en el kit sean lo suficientemente específicos, para el westernblot lo que se necesita es que los anticuerpos para cada una de las proteínas puedan asociarse al VIH de forma tal que respondan a dos criterios mutuamente excluyentes.
La primera es que deben ser lo suficientemente generales para detectar todas las cepas del VIH sin importar sus mutaciones, como los ensayos están enfocados al VIH-1, las cepas de VIH-2 tienden a arrojar muchos indeterminados sin importar el periodo de tiempo en que se analice –lo cual sí que es racista, el VIH-2 se encuentra contenido en África. La segunda es que los anticuerpos deben ser lo suficientemente restrictivos como para no reaccionar con otras proteínas de otros lentivirus que pueden estar presentes.
En conclusión, westernblot no hace referencia a un ensayo único, es más un procedimiento, lo que hace específico a westernblot son los anticuerpos empleados para la detección de las proteínas virales, y en este aspecto cada casa matriz puede tener diferentes criterios de diseño.
(e) Ensayos rápidos cualitativos: Los ensayos orales rápidos son un método que permite detectar portadores del VIH en estado de latencia, pero son particularmente malos para el diagnóstico inicial del VIH, la mayoría tiene un periodo de silencio de más de 20 días. Cabe anotar que la tecnología de diagnóstico rápido aún se encuentra en etapa de implementación, por lo que sus resultados deben evaluarse en conjunto con la historia clínica, los factores de riesgo y luego confirmada mediante los ensayos estandarizados ELISA y westernblot. A menos que tengas inicios de gingivitis o la suficiente placa como para que tus encías sangren levemente, el diagnostico oral del VIH es muy poco sensible, ya que la saliva por si misma posee baja concentración del virus. Pero a pesar de estas limitaciones, detectar pacientes con VIH en latencia es vital para romper la cadena de transmisión.
(f) Interpretación de los resultados para el diagnóstico del VIH: El diagnóstico de algo tan serio como el VIH necesariamente requiere de una aproximación holista, en donde los resultados de las pruebas cuantitativas como ELISA y Westernblot deben tomarse en cuenta junto con los factores de riesgo y el cuadro clínico. Adicionalmente el factor tiempo debe tomarse en cuenta, para diagnosticar el VIH es necesario que los ensayos diagnósticos se realicen más de una vez, de forma tal que el segundo diagnóstico sirva para confirmar el incremento de la carga viral.
Posterior a esto, se siguen realizando pruebas diagnósticas para evaluar la carga viral, así como pruebas cualitativas para determinar la cantidad de linfocitos T CD4+ presenten en sangre, ya que estos sirven como guía al prestador de servicio médico de cual tratamiento es conveniente realizar. Si nos vamos a lo más específico, en la actualidad se recomienda realizar PCR para determinar la cepa que causa la infección, ya que esta puede tener resistencia a algunos antirretrovirales, detalle relevante a la hora de diseñar el tratamiento.
(g) Eficacia del diagnóstico del VIH por combinación de ELISA y Westernblot: A pesar de los inmensos problemas para la estandarización de los kits de diagnóstico contra el VIH durante la década de 1990-2000 para el año 2005 la detección del VIH se ha convertido en algo bastante certero. El empleo de varios ensayos ELISA y westernblot en diferentes puntos de tiempo ha incrementado la sensibilidad a intervalos de 99.7%-98.5% para cada inmunoensayo. La posibilidad de un falso positivo en un ambiente con bajos niveles de riesgo es de 1 por cada 250.000 individuos. En algunos casos la posibilidad ha bajado a 1 en cada 379.000 individuos. Los cambios de probabilidad dependen de la prevalencia del VIH en la zona, así como la prevalencia de otros virus que pueden ocasionar reacciones cruzadas. En cualquier caso, exámenes periódicos para determinar la carga viral son la última línea de evidencia para el diagnóstico del VIH.
Diagnóstico del VIH por métodos directos
Existen dos rutas, la primera es emplear el ARN viral, pasarlo a ADN mediante una polimerasa artificial y luego realizar una amplificación por PCR. La segunda ruta es amplificar el ADN del provirus mediante la purificación de macrófagos y linfocitos T del plasma. En cualquiera de los dos casos se emplea la PCR, una técnica ampliamente difundida en la biología molecular –de hecho, no podría pensarse en biología molecular sin esta técnica – la cual permite amplificar una muestra de ADN a niveles muy altos, detectables por medio de una electroforesis en gel de poliacrilamida.
Esta técnica no solo es diagnóstica, también permite identificar el subtipo de VIH mediante una secuenciación del gen –lo cual de paso elimina la probabilidad de reacción cruzada, ya que al secuenciar el gen se detectaría si pertenece a otro lentivirus. El problema es que aún sigue siendo demasiado costosa para ser empleada en cualquier individuo. La PCR se emplea como patrón estándar, el más cotoso, pero al mismo tiempo el más específico, aun así, es el patrón dorado de diagnóstico en la actualidad.
19. Efecto del VIH en el sistema inmune
19. Efecto del VIH en el sistema inmune
El VIH es capaz de estimular una amplia variedad de células del sistema inmune, algunas son infectadas activamente, y en otros casos simplemente se manipulan con el fin de facilitar el contacto del virus con su célula blanco gracias al sistema de aglomeración de células del sistema inmune, las interleuquinas.
Figura 19.1. Receptores CD4 y CD8. CD4 interactúa con el complejo mayor de histocompatibilidad del tipo II, mientras que el CD8 interactúa con el complejo mayor de histocompatibilidad del tipo I. La GP120 imita al complejo mayor de histocompatibilidad del tipo II y una citoquina, pero aparentemente no es capaz de imitar el complejo mayor de histocompatibilidad del tipo I.
¿Por qué los linfocitos T CD8 no se mueren en la infección por VIH?
Los linfocitos T CD8 no son afectados directamente por el VIH, l pregunta es ¿Por qué? Aunque desde la perspectiva de los códigos, la expresión CD4 Y CD8 no son muy diferentes, desde la perspectiva de la estructura molecular los receptores son bastante diferentes. El clúster de diferenciación clase 8 es una glicoproteína transmembranal que sirve como correceptor para el receptor general TCR. El CD8 interactúa con un complejo mayor de histocompatibilidad de forma semejante al CD4, el asunto es que existen dos complejos de histocompatibilidad, el tipo II y el tipo I. En consecuencia, es incapaz de infectar los linfocitos T CD8+
¿Qué sucede con los linfocitos B durante la infección por VIH?
Anormalidades en las poblaciones de linfocitos B en la infección con VIH
Los viriones del VIH son incapaces de acoplarse al receptor CD8 o a los receptores de los linfocitos B, pero esto no implica que la infección no los afecte. Existe una diversidad de defectos en la población de linfocitos B inducida por la infección por VIH de forma indirecta. En los individuos inmunocompetentes VIH negativo, la mayoría de sus linfocitos B se encuentran o en estado inactivo o en estado de memoria, no más. En los individuos con infecciones por VIH se hacen presentes subpoblaciones de linfocitos B, los cuales son anormales desde una perspectiva poblacional. Estas incluyen linfocitos B transicionales inmaduras, linfocitos B agotados, linfocitos B activos maduros y plasmoblastos. Muchos de los defectos de los linfocitos B se atribuyen a la expansión o contracción de una o más de las subpoblaciones de linfocitos B. Estas alteraciones, junto con los mecanismos de evasión del virus, ayudan a explicar las deficiencias en las respuestas de los anticuerpos contra el VIH y otros patógenos en la etapa de VIH.
El VIH es capaz de manipular a los linfocitos B
Existen interacciones directas entre los viriones del VIH y los linfocitos B, aun cuando el virión no pueda ingresar a las células, las pueden afectar. Existen evidencia que sugiere que el VIH puede acoplarse a los receptores CD21, DC-SIGN, BCR/VH3+ de los linfocitos B. Se ha postulado que esta interacción estimula al linfocito la producción de citoquinas que median en la atracción de los linfocitos B efectores y macrófagos, facilitando al VIH la presencia de sus células blanco.
En resumen, el VIH se pega al linfocito B para estimularlo, esto hace que el convoque al linfocito CD4 y además que el linfocito B se lo presente al linfocito CD4 facilitando la infección por un proceso no estocastico. Se ha propuesto un mecanismo similar entre el VIH y las células dendríticas foliculares que también expresan el receptor CD21.
Efectos del VIH en los linfocitos B
Existen tres consecuencias principales de la infección del VIH en los linfocitos B: la hiperactividad de los linfocitos B, la anemia de los linfocitos B y el agotamiento de los linfocitos B po no expresión del receptor CR21.
La hiperactividad refiere a una sobre-estimulación de las poblaciones linfocitarias B, lo cual induce la atracción de los linfocitos T/CD4 y los macrófagos a las regiones donde están los linfocitos B activados acelerando la infección.
La anemia hace referencia a la disminución de poblaciones como los linfocitos B inactivos, porque son activados demasiado rápido.
Agotamiento hace referencia a la activación muy acelerada de los linfocitos inactivos, lo cual impide su adecuado desarrollo y actividad inmune. El agotamiento es un fenómeno de las infecciones crónicas que son capaces de evadir el efecto del sistema inmune.
Antirretrovirales, linfocitos B y el virus del VIH en la etapa de SIDA
Los mecanismos de inhabilitación de los linfocitos B y la disfunción generalizada del sistema inmune en los individuos en etapa subclínica y avanzada del VIH fueron difíciles de tratar antes de la terapia efectiva de antiretrovirales. Los antiretrovirales se han convertido en mecanismos de investigación para poder entender los mecanismos de patogenicidad del VIH.
Figura 19.2. VIH y linfocitos B. Aparentemente la respuesta de los linfocitos B es óptima en infecciones agudas, en las que se generan de forma adecuada los plasmoblastos y los linfocitos B de memoria "azul" que poseen una buena producción de Interferones e interleuquinas, poseen un potencial de proliferación alto y una baja tendencia al suicidio. Si la infección se hace crónica, los linfocitos van agotándose, acumulando receptores y perdiendo sus capacidades para proliferar, recibir o mandar interleuquinas, producir inmunoglobulinas además de tender al suicidio celular.
Se ha demostrado que, con la terapia de antiretrovirales, varias de las anormalidades de los linfocitos B inducidas por la infección del VIH pueden revertirse, pero otras no. Particularmente los linfocitos B de memoria retienen algunas anormalidades incluso por varios años de control efectivo vía terapia de antiretrovirales.
El VIH y su efecto en los linfocitos T CD4+
¿Las cepas M-trópicas del VIH-1 pueden atacar algunos linfocitos?
Si el virus del VIH-1 aumenta mucho en la etapa aguda, ¿Por qué no desencadena inmediatamente una etapa de SIDA? O ¿Por qué el sistema inmune es capaz de responder en la etapa aguda de la infección por VIH? Esta pregunta no puede responderse si se piensa que todos los linfocitos T CD4+ funcional del mismo modo. Las cepas M-trópicas R5 son las más comunes en la infección inicial con VIH-1, representando aproximadamente el 90%, y permanecen siendo las cepas dominantes durante la etapa asintomática. Esta es una primera explicación con respecto a las preguntas planteadas, sin embargo aunque no todos los linfocitos del cuerpo son atacados, aún hay cierta población que parece ser atacada por virus X4 T-trópicas.
El tejido linfoide sanguíneo y gastrointestinal con respecto al VIH-1
Los linfocitos T CD4+ en la sangre no expresan el receptor CCR5, pero eso no implica que todos los tejidos linfoides del tipo T CD4 sigan el mismo patrón.
Figura 19.3. Intestinos y VIH. Los pliegues del intestino poseen nódulos linfáticos que controlan la biota intestinal y protegen contra las infecciones, adicionalmente estos linfocitos expresan el receptor CCR5 lo que los convierte en blanco inicial de la infección por VIH-1 de la cepa R5. El tejido linfoide sanguíneo y el linfoide gastrointestinal están intercomunicados mediante linfocitos T CD4+ que pueden infiltrarse y transferirse entre ambos.
Durante esta primera infección aguda, el intestino es afectado gravemente debido a la gran cantidad de nódulos linfáticos que hay en el intestino, estos se inflaman y degradan creando una fuerte gastroenteritis. En contraste, el receptor CXCR4 es expresado solo en los linfocitos de las poblaciones en sangre y no en el tracto gastrointestinal, el problema es que esta versión es proliferativa y sincitial, típica de la etapa de SIDA.
Figura 19.4. Conversión R5/X4. Las cepas R5 siguen siendo altamente representativas en los individuos subclínicos, es decir, aquellos con más de 200 células por milímetro cúbico "primeras tres columnas", al ingresar en la etapa de SIDA, la cantidad de viriones X4 aumenta tres a seis veces.
Debido a que el VIH-1 de la cepa R5 predominan en la etapa aguda y en la etapa de latencia, las primeras células del sistema inmune linfoide atacadas son las del sistema gastrointestinal y los pulmones, pero las poblaciones en sangre se mantienen, y más aún, las poblaciones de sangre que se infiltran al tejido acatado permanecen inalteradas y permiten el inicio de la respuesta inmune contra el VIH durante la etapa aguda y de latencia.
Efecto de la aparición de las variantes X4 del VIH-1
La aparición de las cepas X4 durante la etapa subclínica ocurre temprano aproximadamente en el 50% de las infecciones con VIH-1 del clado B. Este proceso se denomina cambio del correceptor. Una vez que empiezan a circular variantes X4 en la sangre, el tejido linfoide sanguíneo se convierte en el blanco de ataque, y la respuesta inmune contra el VIH deja de ser efectiva. Lo anterior se encuentra asociado con un progreso a la etapa de SIDA avanzado en poco tiempo. Estos individuos poseen una probabilidad entre 30 y 70 veces más alta de tener sus linfocitos T CD4 inactivos destruidos que un individuo con cepas R5.
La disminución acelerada y específica de los linfocitos T CD4+ de la sangre después de la aparición de las variantes X4 representa el golpe clave al sistema inmune, hasta este punto el VIH y el sistema inmune se encuentran en un estado de equilibrio y el VIH se desarrolla como si fuera un comensal.
Activación de los linfocitos T CD4 durante la infección por VIH
Los estudios del VIH-1 así como de otros lentivirus como el VIS han demostrado que el tejido linfoide que es atacado durante la etapa aguda es efectivamente los que se encuentran en el tracto gastrointestinal y los pulmones. Paradójicamente, los linfocitos T CD4 no activos son altamente resistentes a la infección por el VIH, pero el VIH desencadena una respuesta inmune que en lugar de destruirlo favorece su propagación. Estudios in vitro han mostrado que una vez que los linfocitos T CD4 inactivos son tratados con citoquinas activadoras se hacen altamente susceptibles a la infección por el VIH.
Linfocitos T CD4+ de memoria, reservorios permanentes del VIH-1
El VIH no puede replicarse adecuadamente en células que se encuentran fuera de la etapa del ciclo celular llamada G1b, aunque su ADN puede estar integrado al ADN. Una vez que la célula alcanza la etapa G1b su ADN se activa y se sintetizan las sustancias del virión. A pesar de que una célula en G1b no produce viriones, es capaz de mantener el ADN viral integrado. Para el caso de los linfocitos T CD4+ de memoria, el ADN puede permanecer integrado sin producir partículas virales, haciendo de estos reservorios ideales.
Un linfocito T que expresa las GP160 puede hacerse blanco de anticuerpos, o mediante el complejo mayor de histocompatibilidad I puede hacerse blanco de los linfocitos T CD8+ citotóxicos. Pero los linfocitos con ADN no expresivo no son atacados por el sistema inmune, lo cual explica la persistencia del VIH.
Mecanismo de infección del VIH-1
Durante las infecciones in vitro con células T humanas se ha determinado dos mecanismos diferentes para la infección: Difusión en fase fluida y sinapsis viral. Adicionalmente existan otra forma in vivo y es la formación de sincitios en las cepas X4. La primera forma es la infección en fase fluida, en esta los viriones se encuentran fuera de las células y se acoplan al blanco.
Figura 19.5. Infección en fase fluida.
Debido a que en este caso el virión está expuesto al ataque del sistema inmune es el mecanismo menos eficiente de infección. La segunda es la sinapsis viral, en esta los viriones proyectan sinapsis, extensiones celulares que permiten aproximarse a células blanco cercanas aun estando dentro de su anfitrión. Este es un mecanismo que permite evadir el sistema inmune.
Figura 19.6. Sinapsis viral.
Figura 19.7. Formación de sincitios.
La tercera es la formación de sincitios, las células de la cepa X4 hace que el linfocito infectado absorba linfocitos circundantes creando una macrocélula polinucleada. Debido a que el VIH nunca sale, el sistema inmune no puede atacar al VIH de forma correcta. Formación de sincitios, una célula anfitriona interactúa (A) con una célula blanco funsionándola (B), el núcleo fusionado es infectado internamente (C). El VIH infecta en estado de ácido nucleico por lo que el sistema inmune no puede atacarle facilmente.
Factores de patogenicidad del VIH-1
El VIH sería un comensal molesto pero tolerable si no poseyera factores de patogenicidad, es decir rasgos que lo transforman en un parásito en lugar de un comensal inocuo. Otros lentivirus similares al VIH poseen mecanismos de patogenicidad diferentes como el oncogén que induce la formación de tumores. El VIH posee mecanismos de patogenicidad que inducen el suicidio celular pero no por apotosis, sino por citólisis celular. El proceso involucra la activación de proteasas de aspartato-cisteinila llamadas caspasas. Algunos genes virales como Vpr y Env codifican proteínas que son citotóxicos, tanto en el contexto in vitro aisladas del virus o en el contexto de una infección in vivo.
Debido a que la citotoxicidad del VIH es efectiva tanto desde el interior de la célula “in vivo” como desde el exterior de la célula “in vitro”, se ha propuesto que en la etapa avanzada del SIDA los linfocitos T CD4+ son eliminados aun cuando no han sido infectados. Los linfocitos T infectados al morir liberan viriones y citotoxinas que inducirán la muerte celular de las células alrededor. El efecto por daño colateral de testigos funciona mediante la siguiente analogía. Si el linfocito T infectado muere por la citotoxina del VIH, los linfocitos testigos alrededor también mueren, no por la infección sino por la citotoxina.
Adicionalmente los sincitios tienden a la apoptosis una vez que alcanzan cierto tamaño crítico, estas células al ser muy voluminosas, almacenan enormes cantidades de citotoxinas. Este efecto representa el golpe de gracia de la infección del VIH contra los linfocitos T CD4+
El linaje monocitario y la infección por VIH, macrófagos
Etapas de infección del VIH en la línea del macrófago
Todos los lentivirus conocidos retienen a capacidad de infectar y replicar los macrófagos e su etapa final de desarrollo. A diferencia de los oncovirus –aquellos lentivirus que poseen el oncogén causante del cáncer –que requieren una célula en mitosis, específicamente la etapa de disociación de la membrana del núcleo para poder completar su ciclo infectivo, el VIH puede infectar productivamente células estancadas en la etapa G1 –pero no en una pequeña sub-etapa después de la mitosis llamada G0.
La etapa G0 se denomina arresto del ciclo de vida, y es una etapa en la cual la célula no se divide de forma prolongada. G1 es la primera etapa de crecimiento celular. Este proceso es mediado por las proteínas de la capside y del complejo de preintegracion, compuesto por algunas proteínas del interior de la cápside y por el genoma viral. Este complejo atraviesa los poros nucleares.
El VIH avanza al sistema nervioso central
En los individuos VIH-1 positivos, los macrófagos infectados contribuyen no solo a la primera etapa de la infección, también se encargan de diseminar los viriones del VIH hacia el sistema nervioso central a través de la barrera hematoencefálica. El VIH-1 y la enfermedad neuronal no están bien entendidos aun, pues aun que los síntomas neuronales se manifiestan preferentemente en la etapa de SIDA, el VIH como tal invade la región cerebral pronto durante la etapa aguda.
El endotelio de los capilares nerviosos permite el paso restringido a algunos linfocitos, pero solo los macrófagos "rosado" pueden infiltrarse en el endotelio hacia el cerebro. Sin los macrófagos están produciendo viriones inician la etapa de infección neuronal de astrocitos "limitada" y microgliales, las cuales producen neurotoxinas que matan las neuronas. Se piensa que los vectores principales de tráfico del VIH son los macrófagos, linfocitos y posiblemente monocitos inactivos.
La neuropatía del VIH inicia en la etapa aguda
El VIH-1 es incapaz de infectar las neuronas debido a que estas no expresan en receptor CD4 o los correceptos CCR5, CXCR4 o CCR3, pero a cambio infectan los macrófagos perivasculares, dendríticas y las células microgliales. Varios factores han sido propuestos para explicar la razón de que los síntomas del neuro-SIDA se manifiesten tarde a pesar de que la infección es temprano. La primera –que ha sido mencionada anteriormente –es la hipoxia, aparentemente las microgliales expresan los receptores que las hacen vulnerables a la infección cuando el cerebro posee bajos niveles de oxígeno –lo cual presupone problemas pulmonares propios de la etapa del SIDA.
La segunda razón, es que la enfermedad neuronal se manifiesta solo cuando las células infectadas forman sincitios. La cepa que forma sincitios –X4 –aparece muy tarde en la infección por VIH, lo cual contribuye a que la neuropatía asociada al VIH solo se manifiesta en la etapa del SIDA. La enfermedad neuronal asociada al SIDA se observa entre el 40% y el 70% de los individuos.
El sistema nervioso central como reservorio del VIH
La replicación del VIH-1 en el linaje monocitario –monocitos, macrófagos, dendríticas –así como la que sucede en las microgliales persiste fuertemente en los pacientes que reciben un tratamiento con antirretrovirales debido a que estas moléculas son poco eficientes en atravesar la barrera hematoencefálica. Adicionalmente el VIH puede infectar de forma no proliferativa las astrogliales, las células de Langerhans y algunas neuronas. Esto convierte al cerebro en un reservorio para el VIH-1, que junto a los linfocitos T CD4+ latentes –infectados pero que no expresan proteínas virales –contribuyen a la reaparición rápida de la viremia en el momento en que el tratamiento se retira. Tome en cuenta que este mecanismo de resistencia es completamente independiente a las mutaciones de resistencia, y de hecho estos mecanismos le otorgan al VIH el tiempo suficiente para generar mutantes resistentes.
Figura 19.8. Vacuolas de latencia. El VIH puede tener una segunda forma latente, y es mediante la formación de vacuolas no digestivas al interior del macrófago (a), el cual puede activarse (b) para formar una infección proliferativa. Lo anterior contribuye a la característica fenotípica de las cepas R5, las cuales son de infección lenta y comensalista, radicalmente diferente de la forma X4 que es rápida y parasítica.
Los macrófagos son difíciles de infectar por el VIH
La noción de modelo es común a todas las ciencias, y en el estudio del VIH también se hace presente, prácticamente toda la información que se conoce a cerca de la replicación del VIH en los macrófagos se ha adquirido mediante métodos in vitro. La replicación activa de la cepa M-trópica en el linaje monocitario requiere que el monocito sea activado hasta llegar a la etapa de macrófago o dendrítica in vitro. Adicionalmente, las células del linaje monocitario expresan menores cantidades de los receptores CD4 y CCR5 y aún menos de los CXCR4 y CCR3. Esto hace que la infección del VIH en el linaje monocitario sea extremadamente ineficiente.
El linaje monocitario y la infección por VIH, dendríticas
Las células dendríticas son células procesadoras y presentadoras de antígeno por la ruta del complejo mayor de histocompatibilidad de tipo II y del tipo I, por lo cual es capaz de interactuar con los linfocitos T CD4+ y CD8+. Han sido identificadas dos subpoblaciones de las células dendríticas, las células dendríticas mieloides y las células dendríticas plasmacitoides. Las células dendríticas mieloides son una de las puertas de entrada para el VIH y simultáneamente la primera línea de defensa, que al atacar paradójicamente favorece la infección. Esto se debe a que las células dendríticas mieloides se encuentran en la mucosa genital y en el tracto gastrointestinal. El Segundo tipo de células dendríticas, llamadas plasmocitoides son menos abundantes, pero se encuentran en el plasma sanguíneo, los nódulos linfáticos y el timo, adicionalmente son convocadas por interleuquinas inflamatorias.
El VIH es capaz de manipular a las células dendríticas mieloides
Después de la activación, las células dendríticas mieloides segregan interleuquina 12, mientras que las células dendríticas plasmocitoides producen interferones del tipo I y citoquinas inflamatorias. En consecuencia, las células dendríticas plasmocitoides tienden a bloquear a los viriones –los interferones bloquean la acción de los retrovirus de forma inespecífica. Como se mencionó anteriormente, las células dendríticas mieloides son el mayor talón de Aquiles del sistema inmune en las formas del VIH contagiadas a través de vías sexuales. Estas células son el primer blanco del VIH, pero aparte de infectarlas, las estimula. Las células dendríticas son células presentadoras de antígeno, por lo que sus interleuquinas convocan a los linfocitos T CD4+. Es importante recalcar que, en la etapa inicial, los linfocitos no son atacados ya que son cepas R5 del VIH, el problema es que las dendríticas pasan los virus a los macrófagos que pueden entrar en contacto con el sistema gastrointestinal al patrullar, y los linfocitos de esa región si son vulnerables. Al estimular a las células dendríticas mieloides, estas convocan la respuesta inmune, atrayendo los macrófagos, linfocitos B y linfocitos T, lo cual favorece la dispersión de la infección por VIH. Adicionalmente, las células dendríticas mieloides y otras células inmunes transportan las partículas virales hacia los nódulos linfáticos, lo cual da inicio definitivo a la etapa aguda de la infección del VIH.
Capacidad infectiva del VIH con respecto a las células dendríticas
Las células dendríticas son poco comunes en la sangre, por lo que su estudio con respecto al VIH depende de experimentos in vitro de monocitos manipulados para que se transformen en células dendríticas. Al igual que en los macrófagos, las células dendríticas expresan pocos receptores clave para la infección del VIH, pero la cantidad de receptores aumenta desde su estado como monocito hasta ser una célula dendrítica activa y madura. Esto implica que los monocitos son difíciles de infectar, pero las células maduras son más fáciles. Aun así, en comparación con un linfocito T CD4+, las células dendríticas maduras son más difíciles de infectar, lo cual contribuye al fenotipo lento de las cepas M-trópicas –monocitos, macrófagos y dendríticas.
Mecanismo de infección del VIH en las células dendríticas mieloides
Inmunofluoresencia en verde ha mostrado que el VIH-1 no solo ataca las células dendríticas, también se pegan de forma no infectiva a la superficie del VIH, lo cual favorece la infección por sinapsis viral durante la presentación de antígeno a los linfocitos T CD4+. El VIH a través de la sinápsis viral puede permanecer muy poco tiempo como virión, lo cual le ayuda a evadir al sistema inmune humoral. Nuevamente este tipo de infección solo ocurre en la etapa aguda en los nódulos linfáticos del intestino y los pulmones, pero se manifiesta paulatinamente en la sangre solo al llegar a la etapa de SIDA. Más aun, estudios recientes han mostrado que los viriones pueden permanecer en vesículas a la espera de la célula dendrítica entre en contacto con los linfocitos T CD4+, momento en el cual el VIH avanza hacia el exterior quedando unida a una sinapsis viral. Estas vesículas se forman por el intento de la célula dendrítica de formar un fagosoma y degradar el VIH, pero este puede permanecer sin ser eliminado en algunas ocaciones. Las células mieloides tienden a presentar todos estos problemas, mientras que las plasmocitoides están protegidas debido a que, en lugar de citoquinas, liberan interleuquinas que bloquean la acción general de los lentivirus como el VIH.
El VIH es capaz de manipular a los neutrófilos
Del mismo modo que sucede con los linfocitos B, el VIH-1 puede interactuar con receptores de los neutrófilos, la célula inmune reconoce al VIH-1 como si fuera una citoquina –cosa que hace para acoplarse a los correceptores CCR5 y CXCR4 de cualquier forma –pero en lugar de ingresar para atacar a la célula, el neutrófilo es activado. En este caso el neutrófilo migra a ganglios linfáticos expresando a su vez citoquinas que disminuyen la actividad de los linfocitos. Los neutrófilos estimulados por el VIH se denominan PD-L1 y la ruta de supresión del sistema inmune mediada por los neutrófilos sobre los linfocitos de llama PD-1. Esta ruta fue reportada en 2013 y representa un mecanismo de patogenicidad alternativo del VIH para suprimir al sistema inmune.
20. Prevención, tratamiento y epidemiología del VIH
20. Prevención, tratamiento y epidemiología del VIH
El Virus de Inmunodeficiencia Humana (VIH) sigue siendo una de las mayores preocupaciones de salud a nivel mundial. En este artículo, exploraremos en detalle la prevención, el tratamiento y la epidemiología del VIH, con el objetivo de comprender mejor los desafíos asociados con esta enfermedad. Analizaremos las estrategias de prevención, como el uso de preservativos, la educación sexual y la profilaxis pre-exposición (PrEP), y discutiremos la importancia de la detección temprana y el acceso a la atención médica. También examinaremos los avances en el tratamiento del VIH, como la terapia antirretroviral (TAR), y discutiremos los desafíos en términos de adherencia y resistencia a los medicamentos. Además, abordaremos la epidemiología del VIH, destacando las tasas de prevalencia, los grupos de riesgo y las disparidades en el acceso a la atención. Al explorar estos aspectos fundamentales, esperamos generar conciencia y promover una respuesta integral para prevenir la propagación del VIH, mejorar el acceso al tratamiento y abordar los desafíos epidemiológicos que enfrentamos en la lucha contra esta enfermedad global.
Prevención del VIH
El Virus de Inmunodeficiencia Humana (VIH) continúa siendo una de las mayores amenazas para la salud pública en todo el mundo. En este artículo, nos adentraremos en la prevención del VIH, abordando estrategias cruciales para combatir esta epidemia y reducir su propagación. Exploraremos diversas medidas preventivas, como el uso de preservativos, la promoción de la educación sexual, la implementación de programas de intercambio de agujas para usuarios de drogas intravenosas y la profilaxis pre-exposición (PrEP) en poblaciones de alto riesgo. Analizaremos la importancia de la detección temprana del VIH y el acceso a servicios de atención médica, así como el papel de la promoción de la igualdad de género y la reducción del estigma en la prevención del VIH. Al aumentar la conciencia sobre las estrategias preventivas y su impacto en la salud pública, esperamos promover un enfoque integral para combatir la propagación del VIH y trabajar hacia un futuro sin esta devastadora enfermedad.
Estrategia social para la prevención del VIH y del SIDA
Las estrategias sociales no requieren de medicamentos, investigación o grandes inversiones, lo que se requiere es que las personas alteren sus comportamientos por tan solo una generación. Algunas estrategias sociales son: la educación sexual y de género, los programas de no reciclado de agujas, lugares higiénicos de tatuado y administración de medicamentos, empleo de preservativos en cualquier tipo de contacto sexual, pruebas diagnósticas rutinarias, abstinencia sexual, estabilidad con la pareja sexual, y controles migratorios.
Estas estrategias poseen diferentes niveles de efectividad, aceptación social y aceptación por parte de la comunidad científica y médica. Por ejemplo, mucha de la comunidad religiosa no acepta los métodos de anticoncepción como el condón. Otro ejemplo es que algunos países “como Sudáfrica” han llegado al extremo de negar la existencia del VIH disparando sus índices de infección.
Estrategia farmacéutica para la prevención del VIH y del SIDA
Aunque se han postulado múltiples estrategias farmacéuticas para impedir la transmisión del VIH como: microbicidas para los actos sexuales y vacunas, solo dos han demostrado alguna efectividad para evitar la transmisión del VIH. La primera es el tratamiento de choque con antirretrovirales y la segunda el condón.
El tratamiento de choque se emplea en casos de exposición al VIH entre las 0 y 24 horas después de la exposición, para esto se emplea un coctel especialmente concentrado de antirretrovirales, y aunque los efectos secundarios pueden ser molestos, es mejor que vivir con la enfermedad. La probabilidad de éxito disminuye desde las 24 hasta las 72 horas después de la exposición y es marcadamente inefectivo para detener la transmisión después de 72 horas.
El tratamiento de choque es empleado para disminuir la probabilidad de que una madre infectada de dar a luz a un hijo infectado. El único método que impide la diseminación del VIH es el condón empleado de forma correcta, sin embargo nociones culturales y/o religiosas han impedido su empleo de forma efectiva para detener la cadena de transmisión.
Las relaciones sexuales, la prevención del VIH y del SIDA
El uso consistente del condón reduce el riesgo de contagio en relaciones sexuales heterosexuales en un 80% a largo plazo. En una pareja donde uno de los miembros esté infectado, el uso consistente del condón disminuye la probabilidad de infección a menos del 1% por año. No todos los geles anticonceptivos son útiles, por ejemplo nonoxinol-9 si incrementa la probabilidad de infección, mientras que tenofovir disminuye la probabilidad de infección a un 40% de lo normal. Los programas que alientan la abstinencia sexual no han tenido resultados prácticos. La educación sexual correctamente realizada puede disminuir el riesgo de que los individuos tomen conductas peligrosas, pero estadísticamente cierto grupo de individuos jóvenes siguen realizándolas sin importar la posesión del conocimiento.
Tratamientos contra el VIH y el SIDA
Desde la aparición del Virus de Inmunodeficiencia Humana (VIH) y el posterior desarrollo del Síndrome de Inmunodeficiencia Adquirida (SIDA), la búsqueda de tratamientos efectivos ha sido una prioridad en la lucha contra esta enfermedad. En este artículo, exploraremos los avances, desafíos y esperanzas en el campo de los tratamientos contra el VIH y el SIDA. Analizaremos las terapias antirretrovirales, que han revolucionado el manejo de la enfermedad al suprimir la replicación viral y fortalecer el sistema inmunológico. Discutiremos los diferentes regímenes de tratamiento, los efectos secundarios y la importancia de la adherencia. Además, exploraremos las investigaciones en curso, como la búsqueda de una cura funcional y vacunas preventivas. Abordaremos también los desafíos en términos de acceso a los tratamientos en comunidades vulnerables y recursos limitados. Al profundizar en estos aspectos, esperamos generar conciencia sobre la importancia de la investigación continua, la mejora del acceso a los tratamientos y la búsqueda de soluciones innovadoras para enfrentar el VIH y el SIDA en todo el mundo.
¿Los antirretrovirales causan el SIDA?
Existen muchas preguntas y suposiciones a cerca del tratamiento del VIH en internet, y sin la información adecuada resulta realmente complejo dar una respuesta clara. ¿Será que los medicamentos causan el VIH? Tomando en cuenta que la mayor parte de los pacientes con VIH se encuentran en países pobres con poco acceso a los medicamentos se diría que no, ¿Cómo alguien va a enfermarse de un medicamento costoso que no puede obtener?
Más aún, una de las causas que provocó la investigación para descubrir el VIH fue precisamente SIDA, la etapa mortal, antes no se sabía si era una especie de cáncer, bacteria parásito, podía ser cualquier cosa, y en base a esto los medicamentos empleados no se habían desarrollado. Es solo hasta que se descubre la naturaleza del patógeno que se puede aconsejar alguna sustancia que lo pueda atacar.
Ahora el punto es más bien si los efectos colaterales de los tratamientos compensan el ataque de las infecciones oportunistas. En la siguiente serie de artículos realizaremos un breve recorrido sobre los tratamientos contra el VIH hasta la actualidad (mitad de la segunda década del siglo XXI).
Terapia Antirretroviral de Gran actividad (TARGA)
El majeo del VIH y de la prevención de la etapa de SIDA en la actualidad involucra múltiples medicamentos antirretrovirales. Existen múltiples clases de agentes atirretrovirales que diferente en diferentes etapas del ciclo vital de VIH. El uso de múltiples medicamentos que ataquen diferentes objetivos es en la actualidad la recomendación estandarizada y se conoce como “Terapia antirretroviral de gran actividad” por sus siglas en inglés es conocida como HAART en la literatura especializada, en español se emplea el acrónimo TARGA.
Progresión de nuevos casos infectados y de muertes por SIDA desde mediados de 1985 hasta 2003. La línea segmentada en 1996 representa la introducción del nuevo patrón de tratamiento o TARGA, con lo cual se ha logrado controlar o mitigar los efectos de la enfermedad y de su infectividad. TARGA disminuye la carga viral del paciente, mantiene la función del sistema inmune y previene el advenimiento de la etapa de SIDA o lo que es lo mismo, el ataque combinatorio de las infecciones oportunistas.
El tratamiento contra el VIH en los países más desarrollados de ha vuelto tan exitoso, que puede ser considerado una condición crónica más que una enfermedad mortal –pero con un virus tan evolutivo con el VIH esta posición puede ser en extremo arrogante –sin embargo los números sugieren que gracias a la administración de los antirretrovirales la progresión a la etapa de SIDA se ha vuelto un evento relativamente raro.
VIH, de sentencia de muerte ha dolencia crónica
Los regímenes de tratamiento para el VIH han cambiado mucho a través de la historia moderna de la medicina, junto con el modo en que se entiende el virus al nivel molecular. En décadas pasadas se había decidido emplear el tratamiento solo cuando se progresaba a la etapa de SIDA debido a los efectos secundarios del VIH.
Esta asociación cronológica conllevó a la aparición del primer mito urbano caracterizado por la expresión –no sé si lo mató el SIDA o el tratamiento. Gracias a estudios poblacionales experimentales como SPARTAC y al desarrollo de más y nuevas moléculas, los médicos son ahora capaces de alterar los regímenes de tratamiento antes de que las sustancias se acumulen a niveles venenosos, después de todo cualquier sustancia en suficientes cantidades es un veneno, incluida el agua.
De esta forma la recomendación actual es iniciar el tratamiento lo antes posible, esta práctica está estadísticamente vinculada a una progresión a etapa de SIDA mucho más tardía de lo que era con terapias de administración en etapas finales de la infección.
Los antirretrovirales son tan tóxicos como cualquier sustancia
Todo medicamento es potencialmente mortal, o puede llegar a poseer efectos secundarios, desde los aclamados e incluso santificados antibióticos hasta la más humilde aspirina, al acumularse en suficientes cantidades en la sangre pueden llegar a ser tóxicos. Los tratamientos contra las enfermedades y sus efectos secundarios han sido objeto de controversia desde que en 1910 Paul Ehrlich sintetizara la primera de estas sustancias, el Salvarsan. Al igual que los antirretrovirales en la actualidad –pero más para el Salvarsan que si era venenoso en extremo –en Salvarsan fue vilipendiado y acusado por teorías de la conspiración (Strebhardt & Ullrich, 2008)
Los antirretrovirales son como cualquier otra molécula, una sustancia que debe administrarse con sumo cuidado, y cuando sus niveles aumentan demasiado, el paciente con su médico deben realizar una planificación de las alternativas que puede seguir, como emplear otras moléculas, o en el caso de que no existan ya alternativas, evaluar el costo de los efectos secundarios.
El inicio del combate contra el VIH, el AZT
(a) Historia del AZT, como agente anticancerígeno: En 1960 la hipótesis de que la mayoría de los cánceres son causados por causas externas, es decir retrovirus ganaba popularidad y fundamentación. En los modelos biológicos aviares ya se sabía que la mayoría de sus cánceres eran causados por retrovirus gracias a los trabajos de Howard Temin y David Baltimore, pero los retrovirus humanos aún no habían sido descritos (De Clercq, 2009; Muckenthaler et al., 1992).
En un trabajo paralelo, otros compuestos que bloqueaban de forma exitosa la síntesis de ácidos nucleicos habían probado sus efectos como agentes antibacteriales, antivirales y anticancerígenos, lo que conllevó a los trabajos de George Hitchings y Gertrude Elion (foto siguiente) que produjeron el compuesto antitumoral llamado 6-mercaptopurina (Kent & Huber, 1999; Koenig, 2006). Jerome Horwitz desarrolló el zidovudin o azidotimidina (AZT) (Broder, 2010).
Se trataba de un anticancerígeno diseñado para atacar retrovirus, sin embargo las primeras pruebas con ratones demostraron ser muy tóxico para aplicaciones prácticas en el momento, simplemente no había una enfermedad tan grave como para tomar en consideración los efectos secundarios de forma seria.
(b) Primer medicamento contra el VIH: El AZT fue el primer medicamente aprobado formalmente por el gobierno de los Estados Unidos contra la creciente pandemia de SIDA. Los ensayos preliminares demostraron que era capaz de incrementar el conteo de linfocitos T CD4+, lo cual implicaba una disminución de la actividad del virus (Sneader, 2005). Antes de él, los médicos solo podían sentarse y mirar como a pesar de llenar a sus pacientes con antibióticos, antifúngicos y antiparasitarios, estos eran incapaces de recuperarse de las infecciones oportunistas atacando de forma simultánea a un mismo individuo, SIDA era una sentencia de muerte una vez se llegaba a tal etapa (Sneader, 2005).
El AZT es un homólogo de la timidina, el nucleócido del ARN, por lo que afecta todo lo que se hace con ARN, eso incluye la transcripción inversa y directa de los retrovirus, así como la función celular normal, es un arma de doble filo (Sneader, 2005). La pregunta es, ¿Cómo es que una sustancia descartada por su toxicidad terminó convirtiéndose en un salvavidas –defectuosos pero útil –para toda una generación durante los años 80s? La razón es una norma química muy antigua y conocida y tiene que ver con la concentración de la sustancia.
La molécula se considera medicamento o veneno dependiendo de su cantidad relativa consumida o concentración, si la concentración es baja como para aliviar la enfermedad sin presentar efectos secundarios se lo considera medicamento, y se lo sigue considerando tal mientras los efectos secundarios sean menos graves que los síntomas de la enfermedad. Cuando la concentración aumenta y los efectos secundarios superan la gravedad de la enfermedad se considera a la sustancia como un veneno.
(c) ¿De dónde lo sacaron?: En 1984, poco después de que el VIH fuera descrito como la causa detrás de la etapa de SIDA, Samuel Broder, Hiroaki Mitsuya y Robert Yarchoan del Instituto Nacional contra el Cáncer de los Estados Unidos iniciaron un programa para el desarrollo de terapias para curar o mitigar los efectos de dicha infección (Sneader, 2005). Usando células CD+ de cultivo prepararon ensayos para rastrear drogas capaces de proteger a los linfocitos. Debido a que el proceso involucraba trabajar a la antigüita, es decir someter a ensayo y error uno por uno –al modo de Ehrlich –los investigadores decidieron trabajar primero con sustancias ya aprobadas, y luego con sustancias que hubieran estado en procesos de validación y ya hubieran pasado etapas preliminares de aceptación –en otras palabras, probar con sustancias descartadas (Sneader, 2005).
Lo anterior aceleraría el tiempo necesario para que las instituciones como la FDA aprobaran la producción de la molécula que resultara elegida después de las pruebas. Una de las compañías que tenía registradas moléculas útiles era Burroughs-Wellcome en la cual trabajaban Gertrude Elion y David Barry, quienes con el apoyo de su grupo de investigación empezaron a enfocarse en las sustancias capaces de impedir la capacidad de la enzima transcriptasa reversa del VIH.
(d) AZT y sus hermanos: El AZT no fue una sustancia arbitraria que sacaron del baúl de venenos fabricados por las farmacéuticas malvadas, en realidad había varias moléculas diseñadas para atacar los retrovirus causantes del cáncer, una de estas moléculas que compitió en su momento con el AZT fue denominada BWA509X (Sneader, 2005).
De hecho, la farmacéutica no fue quien realizó las pruebas, ellos simplemente entregaron al Instituto Nacional contra el Cáncer en total, once moléculas para que la institución pública realizara los ensayos respectivos. En febrero de 1985 el Instituto Nacional contra el Cáncer encontró que el compuesto denominado BW A509X poseía una potente eficacia in vitro y en modelos biológicos. Meses después Broder, Mitsuya y Yarchoan iniciaron la etapa de pruebas clínicas bajo el nombre de AZT.
(e) Primera molécula activa contra el VIH distribuida: Los efectos en las pruebas clínicas fueron exitosos inicialmente, bajo las primeras dosis administradas no se manifestaban efectos secundarios problemáticos, adicionalmente permitía la ganancia de masa corporal de los pacientes que ya se encontraban caquécticos.
Estudios posteriores de doble-ciego y de grupos aleatorizados para administración de placebos sobre el AZT y su efecto sobre el VIH demostró que la sustancia podía extender la vida de los pacientes. La sustancia ya podía distribuirse a los pacientes adultos en 1987, para 1990 las mujeres embarazadas y los niños ya podían recibir el tratamiento(Sneader, 2005).
Inicialmente la concentración de las dosis era mucho más alta que en la actualidad debido a que era la única molécula activa contra el VIH, esto evidentemente causa toxicidad por acumulación. La dosis inicial era de 400 mg cada 4 horas de día y de noche.
(f) Efectos colaterales del AZT: Debido a la enorme concentración con la que se administraba el AZT y sumado a su toxicidad natural, los efectos secundarios del tratamiento contra el VIH no se hicieron esperar. Los dos síntomas más graves eran problemas cardíacos y anemia (Sneader, 2005).
Los problemas cardíacos debían tolerarse en la medida de lo posible, mientras que la anemia se trataba con vitaminas que estimulaban la recuperación de los glóbulos rojos. Sin embargo los efectos secundarios más comunes eran problemas estomacales, acidez, perdida de grasa –con ganancia en músculo –perdida de coloración en algunas partes del cuerpo, entumecimientos de las manos o las piernas y dolor de cabeza (Sneader, 2005).
Las reacciones alérgicas contra el AZT eran raras, pero nuevamente el problema era la concentración de administración, lo cual creaba una línea muy delgada entre beneficios obtenidos y daños por efectos secundarios.
(g) En la balanza, lucha contra el VIH y toxicidad del AZT: El VIH es el patógeno que más rápidamente evoluciona a los tratamientos, y esto se hizo evidente muy rápido con la administración del tratamiento de AZT. Nuevamente hay que recordar que la dosis basal –dosis mínima recomendada –era ya muy alta. Si la persona interrumpía alguna de sus 6 dosis diarias, alteraba los tiempos o se tomaba un día sabático podía generar una mutación del virus de forma rápida, lo cual conllevaba a tener que incrementar la concentración del AZT. Dado lo anterior, la concentración de AZT debía incrementarse (Sneader, 2005).
Esto provocaba un ciclo en el cual la balanza de lucha contra el VIH y la dureza de los efectos secundarios viraban a favor del VIH, llegando a un punto en el que subir la dosis de AZT podría llegar a ser fatal. En tal punto la administración del antirretroviral terminaba, y el paciente ingresaba en etapa de SIDA muriendo rápidamente (Sneader, 2005).
(h) Mecanismo de acción y resistencia del VIH contra el AZT: El AZT tiene su blanco de acción en la transcriptasa reversa que emplea el VIH para completar su ciclo de vida, lo cual en un paciente que ha llevado en etapa de latencia por más de diez años es ya una batalla perdida. Lo anterior es debido a que el virus ya se encuentra en estado de provirus al interior de muchas líneas celulares –llamadas reservorios internos – y en consecuencia el tratamiento con AZT solo estaba encaminado a retrasar al VIH, pero nunca a detenerlo o combatirlo (Sneader, 2005).
Aunque inicialmente el AZT fue elegido por su habilidad de limitar la transcriptasa reversa de forma selectiva –proteína viral sin homólogos en las células –cuando su concentración es muy alta es capaz de inhibir la ADN polimerasa III del ser humano, causando deficiencias en la producción de proteínas (Sneader, 2005).
Con lo anterior concluimos regresando nuevamente al mantra de la administración de medicamentos, cualquier sustancia en la concentración adecuada es un veneno. El problema es que al final de los 80s y principios de los 90s no había nada más con que paliar los efectos de la etapa del SIDA.
Combate contra el VIH y el SIDA, tipos de medicamentos
El AZT poseía dos problemas que lo hacían inefectivo y peligroso rápidamente como tratamiento contra el VIH antes de 1997. La primera era la toxicidad por acumulación de concentración y la segunda la resistencia. Los dos problemas se encontraban relacionados, cuando la cepa en sangre desarrollaba resistencia, debía incrementarse la concentración de AZT. La toxicidad basal del AZT entonces aumentaba mucho haciendo que los efectos secundarios se hicieran tanto o más penosos que el propio VIH (Sneader, 2005).
Para poder combatir este predicamento se desarrollaron durante la década de los 90s del siglo XX una nueva serie de moléculas antirretrovirales y también una nueva conciencia de administración. Al emplear un coctel de tres moléculas podría lograrse efectos sinergísticos con una toxicidad disminuida, esto es porque la concentración de cada una de las tres sustancias era mucho menor para lograr los mismos efectos, con menor probabilidad de generación de resistencia y de toxicidad (Sneader, 2005). A esta nueva conciencia de administración se la ha llamado TARGA “Terapia AntiRretoviral de Gran Actividad” o HAARP por sus singlas en inglés.
(a) Inhibidores de ingreso: Los inhibidores de ingreso o inhibidores de fusión, su función es la de interferir con el ingreso de del VIH-1 a la célula blanco mediante el bloqueo de los correceptores CCR5 y CXCR4. Ejemplo de este tipo de sustancias son el Maraviroc y el enfuvirtide. El Maraviroc funciona bloqueando el receptor CCR5 y por lo tanto interfiriendo con la progresión de la infección del VIH en las etapas: aguda y de latencia. Sin embargo en ocasiones en lugar de hacer más lenta la progresión a SIDA este tipo de medicamentos puede hacer virar el tropismo del VIH a la forma CXCR4 ciotóxica.
El tropismo del VIH acoplado a receptor CXCR4 se encuentra vinculado al momento en que la etapa de latencia termina e inicia la etapa de SIDA, en otras palabras, si no se afectan ambos receptores existe el riesgo de iniciar más rápido la etapa de SIDA. Para prevenir la fusión del virus con la membrana celular se emplea el enfuvirtide, esta sustancia debe inyectarse en el torrente sanguíneo, esta sustancia no se acopla al huésped sino al virus mismo. Su blanco es la proteína gp41 encargada de acercar las membranas una vez que gp120 ha reconocido el receptor CD4 y algún correceptor sea CCR5 o CXCR4.
(b) Inhibidores de la transcriptasa reversa: Nucleósidos inhibidores de la transcriptasa reversa (NITR) y nucleótidos inhibidores de la transcriptasa reversa (NtITR) son sustancias análogas a los nucleótidos guanina, citosina, timina y adenina o de los nucleósidos guanosina, citidina, timidina, uridina o adenosina. Existen muchas variantes de los nucleótidos y nucleósidos.
La función de los inhibidores es impedir la transcripción reversa, logrando que el virus quede bloqueado en el interior de la célula. Uno de los problemas de los inhibidores de la transcripción reversa es que en altas concentraciones inhibe la síntesis de proteínas normal del cuerpo, lo cual desencadena un serio déficit enzimático en muchos tejido. Lo anterior genera problemas metabólicos, neuronales y cardíacos. Ejemplos de NITR son el AZT, el abacavir, la lamiduniva, la emtricitabina y el tenofovir.
(c) Otros inhibidores de la transcriptasa reversa: Los Inhibidores de la transcriptasa reversa no dependientes de nucleósidos (NNITR) funcionan mediante la fusión con una posición de la enzima impidiendo que esta pueda llevar a cabo su función. El efecto es que la enzima no puede adquirir nuevos nucleótidos durante la etapa de síntesis de ADN. Estas moléculas han sido una de las fronteras de investigación más fuertes, generando moléculas clasificadas como de primera y de segunda generación.
Las moléculas de primera generación son la nevirapina y el efavirenz. Las moléculas de segunda generación incluyen la etravirina y la rilpivirina. Debido a que estas sustancias se acoplan de forma específica a la enzima del VIH-1 otras cepas como el VIH-2 son naturalmente resistentes a este tipo de tratamientos.
(d) Inhibidores de la integrasa: Una vez que el ARN del virus se ha transformado en una doble cadena de ADN depende de una enzima llamada integrasa para poder quedar aislado en forma de provirus al interior del núcleo. Los inhibidores de la integrasa, impiden la formación del provirus. Los inhibidores de la integrasa son moléculas de última generación y la mayoría se encontraba en etapa de pruebas clínicas para el año de 2007. Los mecanismos de acción generalmente dependen de uniones organometálicas como en raltegravir. Los primeros inhibidores de la integrasa han salido al mercado hasta 2014, y en la actualidad se dispone de dos moléculas elvitegravir y dolutegravir. Los efectos secundarios no están establecidos aun debido a que son moléculas muy nuevas.
(e) Inhibidores de la proteasa: Los inhibidores de la proteasa bloquean a enzima necesaria para que los viriones una vez formados y liberados puedan madurar, de este modo las moléculas quedan en su estado de poliproteínas inactivas. Aunque estos viriones aún pueden acoplarse a los receptores e ingresar a las células blanco, las moléculas de complejo de retrotranscripción-integración se encuentran inutilizadas deteniendo el ciclo vital del virus. Otros inhibidores afectan la poliproteína gag, impidiendo de la cápside y la nucleocápside se organice de forma espontánea. Aparentemente el complejo de retrotranscripción e integración requiere del apoyo den proteínas de la nucleocápside para actuar.
Ejemplos de inhibidores de la proteasa son lopinavir, indinavir, nelfinavir, amprenavir y ritonavir, pero los más empleados son duranavir y atazanavir. En cuanto a los inhibidores de gag solo dos moléculas han sido desarrolladas, y aún se encuentran en etapas preliminares de investigación denominadas bevirimat y vivecon. El desarrollo de resistencia a algunos inhibidores de la proteasa es alto, aunque las moléculas de segunda generación presentan una mayor estabilidad.
TARGA, el SIDA y la teoría de la evolución
Como vimos anteriormente, la época en la que solo se disponía de una sola molécula ha quedado atrás y en consecuencia los problemas de toxicidad por acumulación de sustancia en la sangre ha disminuido mucho. En la actualidad se emplea terapias que combinan múltiples moléculas generalmente en triadas también denominadas el triple coctel. El nombre más apropiado es Terapia AntiRetroviral de Gran Actividad o TARGA (en inglés se conoce como HAART). Las combinaciones de antirretrovirales no se hacen a la topa tolondra, existen reglamentos. Esto se debe a que existen sinergias negativas en algunas combinaciones, es decir las moléculas antirretrovirales se obstaculizan unas con otras conllevando a la formación de resistencia mucho más rápido. Por lo general se emplean dos inhibidores de la transcriptasa reversa que forman el esqueleto del coctel más una molécula extra, esta molécula extra generalmente es in inhibidor de la proteasa.
(a) Potencial evolutivo: El ciclo de vida del VIH puede completarse en 1.5 días desde el ingreso de un virión hasta la expulsión e ingreso de la siguiente generación de viriones. Esto adicionado a la alta tasa de errores de la transcriptasa reversa hace que el VIH mute a gran velocidad. Evidentemente se producen muchas partículas no infectivas en el proceso, pero las que permanecen viables se convierten en el sustrato para la Selección natural por parte del sistema inmune o de la Selección Artificial por parte de las moléculas creadas por los seres humanos para combatirlas. Si los antirretrovirales se emplean de forma poco apropiada se generan con rapidez cepas multiresistentes.
Antes de 1997 la progresión de formación, selección y acumulación de linajes multiresistentes al AZT, la didanosinam a zalcitabina, la stavudina y la lamivudina se venía convirtiendo en un serio problema de salud pública y de economía. Las grandes farmacéuticas gastan mucho dinero en la investigación de muchas moléculas, y esa inversión generalmente se pierde ya que la mayoría no sirven o son demasiado tóxicas para usos prácticos.
Si el VIH deja obsoletas con rapidez a las moléculas que pasan después de años y millones de dólares de investigación, se crea un enorme déficit financiero, costos que se transfieren en última instancia a los enfermos. En otras palabras, el gran potencial evolutivo “evolvability” del VIH hace del tratamiento con antiretrovirales escale su costo de forma constante hasta el punto en que solo algunos individuos privilegiados tienen acceso a las moléculas de última generación.
(b) Múltiples presiones de selección contra el VIH: Ante tal descontrol y sensación de impotencia emergió una idea, emplear una terapia combinatoria. En este sentido se llama a los lineamientos básicos de la evolución por Selección Natural. Una sola presión de selección conlleva rápidamente a la adaptación, pero varias presiones de selección simultáneas son más difíciles de enfrentar.
La combinación de varios antirretrovirales crea precisamente muchas presiones de selección para que el VIH pueda completar su ciclo de vida con éxito, y aunque es muy probable que se genere una mutación para enfrentar una sola molécula, la probabilidad de que se den tres mutaciones simultáneas para enfrentar tres moléculas diferentes es mucho más baja. Los ensayos clínicos conllevaron a la rutina de los cocteles de tres antirretrovirales que deben estar compuestos por al menos dos tipos diferentes de mecanismos de acción.
En los últimos años las farmacéuticas han diseñado cocteles triples en una sola unidad, lo cual hace que los regímenes complejos se simplifiquen a la ingestión de una simple tableta, esto se denomina: Combinación de Dosis Fija. Esto facilita la adherencia del paciente al tratamiento, y a su vez disminuye la probabilidad de generación de resistencia, esto se debe a que algunos pacientes podían tomar una o dos de las tres pastillas del coctel. En cualquier caso, la regularidad de la ingestión de los medicamentos debe ser lo más estricto posible, con el fin de disminuir al mínimo la probabilidad de formación de cepas multiresistentes.
(c) Efectos de las terapias triples en la percepción del VIH y del SIDA: Cuando inició la pandemia, los médicos solo podían saber de esta por la etapa de SIDA y luego sentarse a ver morir de forma desfigurante a los pacientes sin poder hacer nada realmente útil. El AZT fue la primera arma contra la etapa de SIDA, muy costosa e imperfecta, solo podía prologar brevemente la progresión de la etapa de SIDA. Esto se debía a que al ser una sola molécula se hacía inefectiva rápidamente contra el poder evolutivo del VIH. Lo anterior provocó que el VIH fuera asociado como una sentencia de muerte al individuo portador.
Las terapias triples han cambiado radicalmente esta percepción, incrementando de forma sensible la expectativa y calidad de vida de los portadores. Lo anterior ha hecho que muchas organizaciones de salud cataloguen a la infección con VIH como una dolencia crónica más que como una enfermedad mortal. El problema sigue siendo el potencial evolutivo del VIH que parece infinito, y tarde o temprano desarrolla resistencias. Esto conlleva a la necesidad de crear nuevas moléculas de forma constante, lo cual conlleva a suspicacias notables.
Suspicacia ante el tratamiento contra el VIH
Uno diría, desconociendo los problemas para la creación de una vacuna contra el VIH, que catalogar al VIH como enfermedad crónica crea una sensación de seguridad con la que las farmacéuticas pueden estar muy cómodas. El potencial evolutivo del VIH hace que las moléculas viejas queden obsoletas y nuevas tengan que investigarse constantemente, lo cual mantiene los costos del tratamiento de forma constate por las nubes. Los dineros son dados por los pacientes o por los gobiernos por medio de subsidios.
Lo anterior conlleva a la pregunta ¿es un buen negocio crear una vacuna contra el VIH? Antes de caer en una conducta conspiranóica sería conveniente poder examinar los problemas para la creación de la vacuna. Sin embargo, si resultara ser cierto que la vacuna no se desarrolla por cuestiones meramente comerciales, estaríamos ante uno de los mayores crímenes contra la humanidad en todos los tiempos, y ante una de las peores decisiones económicas de todos los tiempos, los infectados son relativamente una minoría poblacional, una vacuna, por barata que fuera, tendría que administrarse a todo el mundo, y eso es más rentable.
Lineamientos para el tratamiento del VIH
(a) Controversia sobre el punto de inicio del tratamiento contra el VIH: El tratamiento contra el VIH posee dos variables mutuamente excluyentes, la progresión en etapa de latencia y la evolucionabilidad. La latencia larga conlleva a que si se controla al virus desde muy temprano con un tratamiento fuerte, la etapa de la progresión a SIDA se retrasa. Pero la evolucionabilidad del virus conlleva a la formación de cepas multiresistentes rápidamente.
Se ha demostrado que administrar los antirretrovirales en pacientes con conteos de linfocitos inferiores a 350 células por milímetro cúbico de sangre incrementa en un 69% la probabilidad de muerte en etapa de SIDA. Cabe anotar que los primeros tratamientos como los de AZT se realizaban cuando el paciente tenía un conteo inferior a 200 células por milímetro cúbico. Esto implica que la estrategia de tratamiento temprano es recomendable aun cuando se expone al problema de la resistencia.
(b) El tratamiento como prevención del VIH: En un estudio –éticamente cuestionable, pero indudablemente útil –llevado a cabo en 1763 parejas serodiscordantes que eran sexualmente activas llevado a cabo durante 10 se determinó la utilidad de los antirretrovirales para disminuir la probabilidad de la infección. Como en cualquier estudio médico las parejas fueron distribuidas al azar en un grupo experimental y un grupo control. El grupo experimental recibía tratamientos antirretrovirales junto con la profilaxis con condón, mientras que el grupo control solo la educación de uso de condón.
Los resultados demostraron que los antirretrovirales conferían una disminución en la probabilidad de infección del 96%, evidentemente el ensayo se detuvo una vez que se obtuvieron resultados estadísticamente significativos. Estos resultados son consistentes con la idea de Golpear Duro y Golpear Rápido la infección del VIH tan pronto como sea práctico –tomando en cuenta el potencial evolutivo del VIH –resultaría muy útil desarrollar las suficientes moléculas antirretrovirales de forma tal que puedan administrarse por años de forma continua en la etapa de latencia. Tal idea, aunque lejos de la realidad actual ayudaría a disminuir mucho la cadena de transmisión.
(c) El tratamiento contra el VIH no puede detenerse una vez ha iniciado: El incremento en la diversidad y efectividad de los antirretrovirales ha facilitado su uso para pacientes que aún no se encuentran en etapa de SIDA, lo cual disminuye la carga viral extendiendo la expectativa y calidad de vida. Debido a la evolucionabilidad del VIH el consenso unánime entre los investigadores es que, una vez se ha iniciado el tratamiento este no puede detenerse –aunque si cambiar de moléculas constantemente –para prevenir la aparición de cepas multiresistentes lo más posible. Esto es especialmente cierto para individuos cuyos linfocitos T CD4+ han disminuido por debajo de las 500 células por milímetro cubico de sangre.
Otro aspecto es que los individuos con conteos inferiores a 200 células por milímetro cúbico de sangre generalmente no recuperan sus sistemas inmunes aun con fuertes tratamientos. Por otro lado, estudios en los que se administraban antirretrovirales de forma inconstante demostraron que la probabilidad de desarrollar infecciones oportunistas, cáncer y ataques cardíacos aumentaba significativamente.
(d) Inicio del tratamiento contra el VIH: A pesar de que, en última instancia, el inicio del tratamiento contra el VIH es una decisión que recae en el paciente y su médico, existen una serie de lineamientos que guían su administración. Por ejemplo, debido a que la postura de golpear rápido y golpear fuerte ha resultado ser útil, siempre y cuando se posean suficientes moléculas para alternar con el tiempo, se establece que el inicio del tratamiento debe realizarse tan rápido como sea posible. En términos prácticos es aconsejable que se inicie una vez se ha alcanzado un contenido inferior a 500 células por milímetro cúbico de linfocitos T CD4+. Si el paciente está por debajo de 350 células por milímetro cúbico es fuertemente aconsejable iniciar el tratamiento. Otros pacientes deben iniciar cuanto antes el tratamiento sin importar el conteo de células CD4+, por ejemplo, aquellos que poseen una coinfección con hepatitis B, tuberculosis o en parejas serodicordantes sexualmente activas.
Adicionalmente se recomiendan terapias de choque altamente concentradas para mujeres en embarazo, para agujetazos con jeringas contaminadas, agujas de tatuado contaminadas, transfusiones de sangre contaminada y violaciones para disminuir la probabilidad de infección.
Preocupaciones en el tratamiento contra el VIH
Existen varios tipos de problemas que crean preocupación para el tratamiento contra el VIH:
(a) Intolerancia: Muchas de las moléculas empleadas para combatir el VIH poseen efectos secundarios serios. Estudios han demostrado que el 22% de los pacientes deben abandonar algún tipo de régimen no debido a la mutación del virus sino debido a la acumulación tóxica en la sangre de alguno de los componentes del triple coctail. Por lo general los efectos son en el estómago y el intestino 28%, alergia 18.3%, problemas neuronales 17.3% y daño al hígado 11.5%.
(b) Resistencia: Es la segunda causa para alterar el régimen de tratamiento, y puede desencadenarse con mayor frecuencia si el paciente no es estricto con el horario.
(c) Costos: Las moléculas de primera generación han disminuido su costo debido a que han sido liberadas de sus patentes por tiempo, esto ha permitido la administración a menor costo de tratamientos contra el VIH. Aunque las moléculas de primera generación son viejas, su administración en coctel triple las hace efectivas con lo cual un paciente tiene que invertir algo más de 10 dólares al mes. Sin embargo, a medida que el virus muta, el costo de mantenerse vivo aumenta, de forma tal que los tratamientos con moléculas de última generación pueden escalar hasta 2400 dólares por paciente al mes.
(d) Salud pública y costo público: Los pacientes con tratamientos TARGA inefectivos pueden diseminar cepas multiresistentes a la población, incrementando los costos generales del tratamiento para toda la comunidad. En Estados Unidos e Inglaterra existen cocteles triples que son inefectivos en el 10% de los individuos debido a la dispersión de cepas multiresistentes.
Respuesta a la terapia contra el VIH
La terapia TARGA tiene varios objetivos. La primera es disminuir la carga viral a niveles indetectables (menos de 50 copias de ARN viral por mililitro de sangre). Con esto la cantidad de mutantes que el VIH puede exponer a la Selección Artificial es mucho menor, lo cual conlleva a una mejor respuesta de los linfocitos T citotóxicos y de los linfocitos B generadores de anticuerpos. Esto se alcanza generalmente 24 horas después de iniciado el tratamiento. Sin embargo, si se alcanzan 200 copias de ARN por mililitro se considera que el tratamiento ha fallado, por lo cual es mandatorio realizar secuenciación del virus para determinar cuál es la cepa y su capacidad de resistencia.
El problema es que controlar el virus no implica recuperar la función inmune, si el tratamiento se administra muy tarde, la capacidad citotóxica de la variante X4 del VIH-1 puede matar linfocitos sin que el número de infecciones sea alto. Esto conlleva a que a pesar de que la carga viral disminuya, la función inmune continúe suprimida.
Efectos secundarios de los tratamientos contra el VIH
Cada tipo de tratamiento antirretroviral trae consigo diferentes consecuencias que varían en toxicidad dependiendo de la genética del individuo, de la concentración y del tiempo de exposición. Los inhibidores de la transcriptasa reversa basados en nucleósidos y nucleótidos tienden a afectar el ADN de la mitocondria afectando el sistema nervioso, el hígado, los músculos y el tejido graso. Las moléculas de última generación tienen menor tendencia a estos efectos gracias a décadas de investigación e inversión económica. Los inhibidores alostéricos de la transcriptasa reversa tienden a ser más específicos lo cual genera menos efectos secundarios. Sin embargo, algunas moléculas específicas pueden causar problemas concretos, por ejemplo, el efavirenz fue descontinuado debido a la inducción de potentes estados de depresión a niveles suicidas. Mientras que navirapina puede generar problemas hepáticos, especialmente en mujeres que aún no han llegado a la etapa de SIDA.
Los inhibidores de la proteasa pueden inhibir algunos citocromos de la cadena de transporte de electrones causando problemas con el tejido nervioso, los triglicéridos y el corazón. Los inhibidores de la integrasa se encuentran entre las moléculas con menos efectos secundarios, sin embargo, debido a que son las más recientes en ser introducidas solo se tienen datos a corto y mediano plazo, pero no se sabe aún que pueden generar una vez se han acumulado lo suficiente. Algunos estudios recientes sostienen que pueden causar problemas musculares y cardíacos.
Hacia la vacuna contra VIH
En 1984 después de la confirmación de que el agente etiológico detrás de la etapa de SIDA era un retrovirus del género de los lentivirus actualmente conocido como HIV por varios científicos del Instituto Pasteur y del Instituto Nacional de Salud de los Estados Unidos, la secretaria de Servicios Humanos Margaret Heckler declaró que la vacuna estaría preparada en unos dos años. El problema es que el VIH no colaboró, de hecho las capacidades inusuales del VIH –es la estructura cuasi-viva con el mayor potencial evolutivo conocido entre virus y seres vivos conocidos – han conllevado a que varios investigadores sostengan que una vacuna o cura son prácticamente imposibles hasta que se genere algún salto tecnológico-teórico. Algunos de los problemas en crear una vacuna son:
1- El VIH muerto no retiene antigenicidad como si lo hacen otros virus, e intentar crear cepas atenuadas ha demostrado ser ética y tecnológicamente inviable.
2- El VIH posee un potencial evolutivo alto que le permite generar múltiples variantes que evaden los mecanismos naturales y artificiales para enfrentarlo. Las vacunas desarrolladas sufren del mismo problema del sistema inmune y los medicamentos de tratamiento, tarde o temprano el VIH muta para evadirlas.
3-La infección no se realiza por una cepa única, sino por una población altamente variable, una vacuna puede proteger contra parte de la población infectante, pero no contra la totalidad de viriones.
4- La membrana plasmática que protege la cápside viral y la alta glicosilación inespecífica de la región cercana a GP160 hace que los anticuerpos y las vacunas no reconozcan de forma eficiente al virión.
Tratamientos nutricionales contra el VIH
Solo en los Estados Unidos, aproximadamente el 60% de las personas diagnosticadas con el virus llevan a cabo algún tipo de medicina complementaria o alternativa aunque la efectividad de muchas de estas prácticas es más que cuestionable. De todas estas recomendaciones, las que reciben con mayor y unánime apoyo por parte de la comunidad científica son indudablemente la dieta y un estilo de vida saludable. Existe evidencia que suplementos multivitamínicos y minerales puede mejorar mucho la calidad y expectativa de vida de los pacientes, mientras que un estilo de vida saludable disminuye la presión sobre el sistema inmune.
Dormir bien, hacer ejercicio, alimentarse de forma balanceada, no tener factores que generen estrés emocional, no fumar, no beber y mucho menos emplear drogas adictivas más potentes son los componentes de un estilo de vida saludable. Lo anterior es especialmente irónico ya que los países con las tasas de infección más graves poseen las tasas de desnutrición más altas del mundo, además de poseer reservorios de múltiples enfermedades endémicas como el ébola. Como dirían en mi pueblo –al caído, caerle.
Prognosis
La prognosis es el arte de realizar diagnósticos sobre poblaciones, es semejante a la epidemiología, pero se diferencian en el tiempo, la epidemiología determina el presente y el pasado, mientras que la prognosis busca pronostica un futuro. Existe una distinción muy marcada entre países ricos y países pobres con respecto al pronóstico de desarrollo de la infección por el VIH. En los países ricos la infección con VIH ha sido controlada a niveles de una infección crónica a muy largo plazo.
La expectativa de vida de una infección por VIH es en promedio de 11 años, con variables de hasta 20 años si el sujeto es un mutante del CCR5. Después de alcanzar la etapa de SIDA la expectativa de vida no supera los dos años. La terapia TARGA ha disminuido la mortalidad en un 80% y elevado la expectativa de vida entre 20 y 50 años. Si el tratamiento se inicia tarde, su efectividad es mala.
Los bebes que nacen con VIH mueren rápido debido a la ausencia de etapa de latencia, la infección procede a etapa de SIDA muy rápido, por tal razón es mandatorio un tratamiento fuerte durante el nacimiento y que la madre No dé de lactar al infante. La progresión de la infección en los ancianos aún no está documentada, esto se debe a que solo hasta ahora los primeros individuos en llegar a la edad avanzada con VIH han logrado sobrevivir gracias a la terapia TARGA, sin embargo con el marcado aumento en la edad promedio de los países ricos es probable que se realice más investigación al respecto.
Epidemiología
Número de infectados y muertos por VIH y SIDA
La infección por VIH es una pandemia global, para el año 2012 aproximadamente 35.3 millones de personas conviven con la infección, y el número de infecciones nuevas roda el 2.3 millones de personas por año –¡el mismo tamaño de una ciudad mediana! En este sentido la tasa de nuevas infecciones ha mejora con respecto a la década anterior, pues para 2001 la tasa de nuevos infectados era de 3.1 millones de personas por año. De los 35.3 millones, cerca de 16.8 millones son mujeres y 3.4 millones son menores de 15 años. La etapa de SIDA cobra 1.6 millones de vidas al año, pero en comparación con la década precedente se ha tenido una mejora pues para el año 2005 los muertos eran 2.2 millones de personas al año.
El VIH, el SIDA y África
El África subsahariana es la región más severamente afectada por la infección. Para el año 2010 se estima que el 68% de todos los casos registrados y el 66% de las muertes por etapa de SIDA en el mundo se encuentran en estos países. Esto significa que al menos el 5% de todos los adultos se encuentran infectados, pero la distribución no es homogénea, en algunas regiones la tasa de infección ronda el 15% y algunos calculan que puede llegar a ser del 30%. Las mujeres componen cerca del 60% de los infectados.
Sudáfrica posee la población más grande de infectados con VIH en todo el mundo con 5.9 millones de casos reportados. El VIH junto con otras infecciones endémicas y una guerra civil constante ha disminuido la expectativa de vida de países como Botswana de 65 a 35 años. El Sur y el sudeste de Asia representan la segunda región más afectada por el VIH, esta región contiene un estimado de 4 millones de casos, de estos más de la mitad provienen de la India.
Contraste entre países pobres, países ricos y el VIH
En 2008 en los Estados unidos aproximadamente 1.2 millones de personas convivían con el VIH con un resultado de 17.500 muertes. Se estima que el 20% de la población de infectados no saben que lo están debido a la etapa de latencia. En Inglaterra para el año 2009 se estimaban aproximadamente 86.500 casos con 516 muertes. Canadá en 2008 presentaba 65.000 casos con 53 muertes.
Los países de Europa central y occidental también presentan bajos niveles de infección. Estos números contrastan fuertemente con los expresados por países pobres, sin embargo hay excepciones. Los países del bloque islámico –África del norte desde Marruecos hasta Egipto - los países del cercano oriente incluyendo Persia presentan bajos niveles de infección.
21. Descubrimiento del VIH y el SIDA
21. Descubrimiento del VIH y el SIDA
El descubrimiento del Virus de Inmunodeficiencia Humana (VIH) y el posterior reconocimiento del Síndrome de Inmunodeficiencia Adquirida (SIDA) marcaron un hito crucial en la historia de la medicina y la salud pública. En este artículo, exploraremos el emocionante viaje del descubrimiento del VIH y el SIDA, y cómo esto sentó las bases para una lucha sin tregua contra esta devastadora enfermedad. Analizaremos los primeros casos identificados, las investigaciones científicas que permitieron comprender la naturaleza del virus, y la identificación de los grupos de población más afectados. Discutiremos también la importancia de los avances en la detección, los tratamientos y la prevención, así como los desafíos en términos de estigma, discriminación y acceso a los servicios de salud. Al explorar este hito histórico y los avances logrados desde entonces, buscamos generar conciencia sobre la importancia de la educación, la investigación y la colaboración global para hacer frente al VIH y el SIDA, con el objetivo último de poner fin a esta epidemia.
Primeros individuos infectados con el VIH
Debido a la etapa de latencia del VIH cuando se tiene un muerto que da positivo para el virus uno debe calcular unos 10-20 años hacia atrás para la infección. En el año 2014 estudios computacionales han calculado que el origen del VIH se encuentra cerca de 1920 lo cual es congruente con otros estudios que lo presentaban cerca del intervalo de 1809-1918. La mayor parte de los estudios ubican geográficamente el origen de la infección en la ciudad de Kinshasa de la República Democrática del Congo. Esta ciudad se encuentra cerca de la costa occidental del África central (Faria et al., 2014; Hemelaar, 2012).
Figura 21.1. Robert Rayford. A pesar de que el SIDA era ya una enfermedad diseminada en países africanos, el primer paciente con un nombre propio es un caucásico -que ironía -Robert Rayford murió en 1969 por problemas pulmonares, probablemente causada por la neumonía de P. jirovencii.
Las primeras muestras del virus han sido encontradas en dicha ciudad de pacientes que murieron en 1959 –lo que implica puntos de infección cerca de 1949 o anterior. Específicamente dos muestras una proveniente de un hombre y otra de una mujer revelan ser cepas del VIH-1 D y del VIH-1 A (Worobey et al., 2008). La presencia de los subtipos del VIH en muestras tan antiguas favorece la hipótesis de un origen cercano al principio de siglo, ya que entre más antiguo es un virus más diversidad posee. Desde este punto los casos confirmados del VIH son relativamente esporádicos, pero muchos de ellos están relacionados con contactos con poblaciones africanas. Algunos de los casos más famosos son: el paciente cogolés “1959” (Zhu et al., 1998), Robert Rayford “1969” (Garry et al., 1988), Arvid Noe “1976” (Froland et al., 1988), Grethe Rask “1977” (Lazarus et al., 2013) entre otros.
Deficiencia Inmune Asociada a la Homosexualidad
Para 1981 la cosa se puso seria, especialmente por la prevalencia del VIH al interior de las comunidades de homosexuales de Estados Unidos. El 18 de mayo de 1981 un periódico gay llamado New York Native realizó el primer artículo sobre una extraña neumonía que era tratada con extremo cuidado en la ciudad de Nueva York. En el contexto de la discriminación, el artículo era más una queja sobre rumores infundados. Sin embargo, el Centro para el Control y Prevención de Enfermedades (CDC por sus siglas en inglés) de los Estados Unidos ya se encontraba rastreando estos casos de neumonías fatales que normalmente deberían ser poco comunes.
Figura 21.2. Una extraña enfermedad asociada a la homosexualidad. El recorte de periódico anterior muestra uno de los primeros reportes de los medios de comunicación cuando la enfermedad aun no tenía un nombre. También es el tema de esta famosa canción (YouTube).
Para junio 5 de 1981 se publicó un reporte de 5 homosexuales muertos por una extraña neumonía causada por Pneumocystis en la ciudad de Los Ángeles. Un mes después el Times publicó un reporte de 3 homosexuales muertos, y adicionalmente se describió al sarcoma de Kaposi como uno de los síntomas más prevalentes. Un día después el CDC reportó otro grupo de homosexuales muertos en California relacionados con el sarcoma de Kaposi y la neumonía por Pneumocystis (Gottlieb et al., 1981).
Para fines de 1981 cerca de 121 personas habían muerto por neumonías raras y otros síntomas asociados. La pandemia aparentaba estar concentrada en las poblaciones de homosexuales, por lo que no faltaron quienes la bautizaron como cáncer gay.
Deja de ser un síndrome asociado a la homosexualidad
La catástrofe de 1981 estuvo asociada especialmente a las comunidades de homosexuales de varias ciudades grandes de Estados Unidos. Por esta razón –y adicional a la discriminación contra los homosexuales –la extraña enfermedad fue denominada originalmente como GRID (gay-related immune deficiency) o en español Deficiencia Inmune Asociada a la Homosexualidad (L. Altman, 1982).
Figura 21.3. Filadelfia. En la película Filadelfia con Tom Hanks podemos apreciar las consecuencias de la histeria sobre el SIDA y la homosexualidad aproximadamente a principios de los años 90s y finales de los 80s (Demme, 1993).
Para junio de 1982 esta era la idea prevalente, por lo que se buscaba algo común al comportamiento de los homosexuales –como estimulantes sexuales, lubricantes entre otros –que pudiera afectar al sistema inmune. Adicionalmente la opinión pública empleo todo el evento para aislar a la comunidad homosexual, lo cual traería fuertes impactos de la cultura occidental. El 9 de julio un grupo de haitianos no homosexuales fueron diagnosticados con síntomas asociados al extraño síndrome como la presencia del antes muy raro sarcoma de Kaposi. Con estos y otros casos un factor comenzó a hacerse evidente, no todos los casos eran de homosexuales (CDC, 1982).
El SIDA es bautizado
El 27 de julio de 1982 fue una convención de líderes homosexuales –y no la comunidad científica –quien acuñó el término Síndrome de Inmunodeficiencia Adquirida para reemplazar el término Deficiencia Inmune Asociada a la Homosexualidad (Nobel, n.d.). Durante el mismo año la infección terminó por diseminarse alrededor del mundo, mientras que la comunidad científica empezaba a recopilar información, por ejemplo la asociación de la disminución de linfocitos asociada al recientemente bautizado SIDA.
Por otra parte la diferencia entre etapa aguda y etapa crónica ya empezaba a ser establecida, pues para 1983 los primeros estudios para la identificación del agente etiológico detrás del SIDA se basaron principalmente en la inflamación de los nódulos linfáticos asociados a la etapa aguda (Barre-Sinoussi et al., 1983).
Descubrimiento del VIH y su controversia
El descubrimiento del VIH tiene dos componentes que son igualmente controversiales, la primera es su descripción como agente etiológico causante de la etapa de SIDA y la segunda es el descubrimiento de su punto de origen y de las causas que lo vieron nacer. En términos concretos en la actualidad los modelos con mayor nivel de aceptación por parte de la comunidad científica son (1) el VIH es el agente etiológico causante de la etapa llamada SIDA aunque hay que anotar que el VIH no es la única causa para una inmunodeficiencia; (2) El VIH evolucionó por recombinación por una zoonosis de varias cepas del Virus de inmunodeficiencia de los simios ya fuera en el chimpancé o en los humanos y se ha originado como mínimo 4 veces de forma independiente (Hemelaar, 2012).
A pesar del consenso científico existe una gran cantidad de debates externalistas que aprovechan los debates y controversias internalistas de las comunidades científicas a finales de la década de los 80s y principio de los 90s sobre la relación de causalidad entre VIH y SIDA. La primera parte de esta serie de artículos tratará sobre el origen del VIH, cuestión de la que ya hemos abordado detalles en la sección de la taxonomía del VIH y sus tipos. Posteriormente abordaremos la controversia entre los grupos de investigación norteamericano y francés por la primera descripción del VIH, y como esta controversia internalista ha provocado el origen de suspicacias al exterior de la comunidad de expertos sobre el VIH.
La disputa por el descubrimiento del VIH
Existe una agria disputa sobre la prioridad de la primera descripción del VIH como agente causante del SIDA entre dos grupos de investigación, el primero liderado por Luc Montagnier del instituto Pasteur de Francia y el segundo liderado por Robert Gallo del Instituto Nacional de Cáncer de los Estados Unidos (Prusiner, 2002).
La lucha de prioridades científicas sería disparada por el grupo de Gallo quien en 1984 recibiría gran atención mediática por el "descubrimiento de virus causante del SIDA", cuestión que iba en contra del sistema estandarizado de prioridades y reconocimiento científico, basado en la prevalencia de las fechas de publicación en las revistas especializadas (Popovic, Sarngadharan, Read, & Gallo, 1984).
A pesar de lo anterior, los dos grupos de investigación, los dos institutos de investigación, e incluso políticos de los dos países se enfrascaron en un amargo debate que pudo haberse resuelto atendiendo al sistema de reconocimiento científico, que sin duda le daría la prioridad al grupo de investigación de Montagnier, pero en el que la preeminencia para el descubrimiento del virus debió haber sido adjudicado a una mujer, Françoise Barré-Sinoussi (Prusiner, 2002).
El trabajo del grupo de Montagnier fue publicado en 1983
Françoise Barré-Sinoussi es definitivamente quien debe recibir el crédito por el descubrimiento del VIH, en enero de 1983 ella junto con el grupo de investigación del instituto Pasteur extrajo material de nódulos linfáticos de homosexuales que los presentaban inflamados. En los meses posteriores se obtuvieron muestras de más individuos homosexuales y heterosexuales hemofílicos (Barre-Sinoussi et al., 1983). En las muestras se aislaron evidencias de un retrovirus que mataba los linfocitos T, cuestión que no era rara ya que unos años antes el grupo de investigación de Gallo ya había reportado el primero y segundo de estos nuevos retrovirus llamados Virus T-linfotrópico humano 1 y 2 en 1981-1982.
El artículo de Barré-Sinoussi termina con una caracterización del nuevo retrovirus y una asociación tentativa a la etapa de SIDA, por lo que los trabajos posteriores serían una confirmación o refutación de sus hallazgos, pero en cualquiera de los casos la prioridad la recibe el primero que la reporta. El virus fue denominado Virus Asociando a la Linfadenopatía VAL, es decir un virus asociado a la inflamación de los ganglios linfáticos con tropismo por los linfocitos T.
El grupo de Gallo reporta en 1984 de forma mediática
El propio Robert Gallo fue árbitro para la publicación del artículo de Barré-Sinoussi y colaboradores de 1983 y debido a su experiencia con los retrovirus que atacan los linfocitos T se encontraba trabajando ya en el asunto. El ataque de gallo se produce en 1984 publicando no uno sino cuatro artículos sobre el tema, en este sentido Gallo lo bautiza siguiendo su sistema de codificación HTLV “Virus T-linfotrópico humano” en este caso HTLV-3 a pesar de que Barré-Sinoussi y colaboradores ya habían reportado las diferencias que existían entre los dos grupos de retrovirus (Popovic et al., 1984).
El problema es que Gallo introdujo un factor que generalmente no está asociado a los trabajos científicos y es los medios de comunicación. El trabajo de Gallo se hizo altamente mediático en los Estados Unidos, con lo cual se lo asoció a él con el descubrimiento del virus causante del SIDA.
La disputa por el descubrimiento del VIH se extiende hasta 1985
A diferencia de lo que generalmente se piensa, las ciencias exactas no son tan exactas, especialmente la biología. El descubrimiento del VIH está asociado a las fechas de 1984-1983 pero el asunto no fue tan fácil. Para 1985 los grupos de Francia y Estados Unidos aún estaban enfrascados en la disputa por la preeminencia, y el argumento que empleó el grupo de Gallo fue que el virus aislado por el grupo francés no era el causante del SIDA pero el suyo sí.
En 1985 los dos grupos publicaron las secuencias genéticas de sus respectivos virus. Uno de los primeros resultados fue que el virus no pertenecía a la familia de los HTLV como había estado defendiendo Gallo. El segundo resultado es que ambos habían aislado el mismo virus, lo cual implicaba que a pesar de lo complejo de los métodos de Gallo para aislar el virus lo había logrado de forma independiente, pero cronológicamente después del grupo francés.
Lo anterior contrastaba con la comunidad científica y con los propios artículos de Gallo que citaban a Barré-Sinoussi como precedente en la investigación, aislamiento y caracterización. Algunos plantean que todo el royo mediático fue creado por el gobierno de Ronald Reagan para aparentar ante la opinión pública que su gobierno estaba realizando grandes avances con respecto a la epidemia a mediados de los 80s. En cualquier caso. aunque Gallo no estuviera directamente implicado todo el alboroto le pasaría factura al ser excluido del premio Nobel en 2008.
La lucha por las patentes para la identificación del VIH
Los científicos no son santos ni pretenden serlo, y la ciencia moderna es un motor de la economía capitalista y no se debería intentar ocultarlo, eso es algo pretencioso y da para malos entendidos. No nos equivoquemos en este sentido, los grupos de investigación no viven de ilusiones sino de subvenciones que emergen del patrocinio y las patentes. El grupo de investigación que ganara la lucha de las prioridades tendría un flujo de efectivo para sostener más investigaciones, mejores sueldos, más becarios y mejores investigaciones futuras. Todos soñamos con progresar en ese sentido, y quien no lo sea es un tonto.
Anteriormente hemos mencionado que uno de los aspectos importantes de la identificación del virus causante del SIDA fue su caracterización, lo cual incluía mecanismos para su identificación, lo que para la época implicaba necesariamente pruebas serológicas –las pruebas de ELISA y Westernblot se empleaban para la mayoría de los virus ya que estos no se identifican por microscopio.
En cualquier caso, la lucha de las prioridades terminó con un acceso compartido de ambos grupos de investigación a las patentes, son sin una enorme controversia. Sin embargo, el grupo francés si gozó de un mayor prestigio, ya que el artículo de 1983 circuló más y fue más citado por la comunidad de especialistas que el de Gallo.
El gran karma de Gallo
Los científicos no solo buscan dinero, sino también la gloria del reconocimiento de sus pares, de hecho, los dineros por las patentes se emplean para financiar más y mejores investigaciones. Gallo ganó la parte de las patentes, pero a largo plazo la gloria se le escaparía.
En 2008 el premio Nobel por el descubrimiento del VIH causante del SIDA fue dado únicamente a Barré-Sinoussi y a Montagnier excluyendo a Gallo del galardón –cuestión por la cual se ha quejado. Sin embargo cabe anotar que los miembros directamente involucrados en todo este enredo no poseyeron ninguna mala intención posteriormente, de hecho para el año de 2008 todos los involucrados escribieron artículos en conjunto de revisión sobre el VIH y el SIDA, sin embargo la exclusión del Nobel será algo que acompañe a Gallo el resto de su vida (Cohen & Enserink, 2008; Weiss, 2008).
22. VIH, historia y sociedad
22. VIH, historia y sociedad
En capítulos anteriores hemos visto que la taxonomía del VIH se rastrea al VIS de los primates africanos, el punto sobre la taxonomía exacta puede discutirse, pero es un hecho que el VIH evolucionó varias veces de forma independiente. Ahora examinaremos factores ecológicos, sociales y económicos que permitieron su desarrollo y escape de África. Es primordial pensar el origen del VIH en términos integrativos de las áreas de geografía, historia, economía, así como de ecología y virología para tener un panorama unificado de la ruta más probable para su propagación.
Figura 22.1. El Congo Belga. La zona del centro occidente de África es la región de origen del VIH-1 y también es la zona con más riesgo para la infección con Ébola. Mientras el continente africano y otras regiones selváticas e inexploradas sigan siendo explotados, la aparición de nuevas infecciones emergentes por zoonosis, se convertirán en titulares cada vez más comunes.
El SIDA, la ecología y la zoonosis
Una zoonosis es una infección accidental de un parásito que se encuentra adaptado para sobrevivir sin mayores complicaciones en un reservorio natural. Esta definición es básica, y por lo tanto fácil de olvidar a la hora de crear hipótesis sobre el origen del VIH, especialmente entre aquellos adherentes a las teorías de la conspiración (Gao et al., 1999). Pero, ¡hey! Igual sirve para echarle el pato al capitalismo salvaje a los ultramalignos imperios coloniales por una razón, el descuido ecológico. Los virus de la inmunodeficiencia en los simios son extremadamente antiguos y conviven muy bien en sus propios reservorios –claro está que entre uno y otro reservorio también se presentan zoonosis mortales, pero es raro –a menos que exista algo que afecte el equilibrio ecológico(Worobey et al., 2010).
A principios del siglo XX el colonialismo europeo había convertido a África en una despensa de recursos naturales: pieles exóticas, animales raros, maderas finas, gemas preciosas todas debían obtenerse más y más profundo en las selvas. Esto conllevó a que los seres humanos entraran cada vez más en contacto con reservorios de virus con los que nunca antes habían tenido contacto conllevando a la aparición de nuevas enfermedades (Sharp et al., 2001). El VIH no es el único virus emergente en el siglo XX por zoonosis de territorios que nunca debieron ser explotados, otras infecciones famosas son el Ébola, la fiebre de Lessa, el virus de Marburg, el virus del este del Nilo (Alonso & Cox, 2015).
Figura 22.2. Carne de monte. Esta alta prevalencia explica la razón del origen polifilético del VIH, debido a que los humanos son un reservorio anormal de varios tipos de VIH pueden existir recombinaciones accidentales, de las cuales cuatro han dado origen a una infección que deprime el sistema inmune humano, a diferencia del VIS comunes que causan síntomas muy leves.
El origen del VIH entre cazadores y carniceros
Identificar el punto de recombinación que dio origen al VIH es complejo, pero existen dos especies posibles, nosotros los seres humanos y los chimpancés. La razón es que ambas especies tienen hábitos deprecatorios, con lo cual consumen carne de otros primates, lo cual hace de ambas especies un punto de encuentro de diferentes cepas del virus de la inmunodeficiencia en simios (Sharp et al., 2001).
En África y otras partes del mundo se tiene la costumbre de cazar animales selváticos por su carne para el consumo, lo cual no es malo en sí mismo, el problema es que las poblaciones crecientes de seres humanos provocan más presión y la necesidad de cazar animales cada vez más raros que son reservorios de infinidad de infecciones, sean estas conocidas –tuberculosis, rabia, fiebre amarilla, paperas –o sean estas emergentes Éébola, Marburg, Lessa.
La razón no es solo la cacería sino el hecho de que la carne no es preparada adecuadamente, existen prácticas de consumo directo de carne por parte de los cazadores, así como de carne deshidratada. Adicionalmente cuando se corta la carne pueden existir lesiones accidentales del carnicero, o cuando se calienta la carne algunas secciones no quedan bien cocinadas y no falta el que le gusta el sabor de la sangre de una carne poco cocinada. Un estudio de 2009 en África Central demostró que el 2.3% de la población posee antígenos para el Virus de la Inmunodeficiencia en Simios en la población general; pero en las áreas rurales ese porcentaje podía elevarse al 17.1% (Kalish et al., 2005).
Los imperios coloniales y la aparición del SIDA
Los cazadores de África han comido carne cruda desde que nuestra especie evolucionó, así que la pregunta evidente es ¿Por qué en el siglo XX? La respuesta ya la hemos abordado en los factores sociales generales para la mayor parte de las Infecciones de Transmisión Sexual y fueron las relaciones de poder asimétricas entre los grandes imperios colonialistas europeos del siglo XIX y principios del XX con las poblaciones colonizadas. Los hombres fueron forzados a ser una mano de obra barata que debía mantenerse fuerte para tener altos índices de productividad, mientras que muchas de las niñas sin mayores oportunidades terminaban en los prostíbulos de las nacientes ciudades coloniales, las cuales también estaban conectadas a las metrópolis imperiales por medios de puertos (Sharp et al., 2001).
Figura 22.3. Vacunación primitiva. Algunas de las prácticas de vacunación involucraban hasta 10 inyecciones en un solo individuo al año, y algunas de ellas se realizaban vía intravenosa con jeringas de vidrio reutilizadas. Investigaciones han determinado que el VIS puede adaptarse con mayor efectividad a una nueva especie si se realiza inyecciones rápidas durante la etapa aguda tan solo unas tres o cuatro veces (Drucker, Alcabes, & Marx, 2001; Marx, Alcabes, & Drucker, 2001).
pico del colonialismo fue precisamente los años 20s del siglo XX, estos cambios sociales en áfrica también incluyeron cambios en el uso de los recursos de la selva y un cambio de relación general entre el ser humano y los animales que allí vivían (Sharp et al., 2001). Adicionalmente, la destrucción del sistema de valores tribal favoreció la aparición de nuevas conductas sexuales mucho más promiscuas en las ciudades que favorecieron el desarrollo y dispersión inicial del VIH. De hecho todo este es sinérgico, por un lado ITS traídas de Europa como la sífilis y las úlceras genitales se dispersaron en la población local de prostitutas de cada ciudad, estas úlceras favorecían la infección de los recombinantes del VIS entre los cuales se encontraba el VIH (Sharp et al., 2001).
Sin embargo, con el VIH circulando, existieron otras prácticas impuestas y realizadas de forma poco sanitaria que pudieron favorecer aún más la prevalencia de los recombinantes del VIS durante la primera mitad del siglo XX, ausentes en otros siglos y que por lo tanto explican la emergencia cronológica del flagelo del SIDA.
Campañas de vacunación masivas no-sanitarias
Si tu economía depende de una población de trabajadores económicos, lo primero que deseas es que se encuentren fuertes para el trabajo, y para ello lo más conveniente es que no presenten enfermedades debilitantes que afecten la productividad de la población. En este orden de ideas, varias campañas de vacunación contra infecciones de este tipo fueron realizadas en el África subsahariana desde 1910 y por todo el siglo XX. Debemos recordar que las buenas prácticas de manejo de jeringas hipodérmicas son una consecuencia del SIDA, en aquel tiempo se empleaban émbolos de vidrio y las jeringas se reciclaban de un paciente a otro, si es que la situación lo ameritaba (Drucker et al., 2001; Marx et al., 2001).
Costumbres sexuales africanas y la diseminación del VIH
Finalmente, las costumbres sexuales africanas favorecen mucho la transmisión de la ITS. Estas costumbres pueden dividirse en dos categorías, comportamientos sociales y modificaciones fisiológicas. En los comportamientos sociales se puede encontrar el incremento en la promiscuidad de las poblaciones que perdieron los lazos con sus valores tribales, estas sociedades son generalmente machistas y muy promiscuas, los hombres comúnmente poseen una gran cantidad de compañeras sexuales lo cual favorece la transmisión y prevalencia de las ITS. Por otra parte, se encuentran las prácticas de modificación fisiológica como la ablación del sistema reproductor femenino y el sexo en seco.
La ablación es la destrucción de las partes del sistema reproductor femenino vinculadas con el placer sexual con el fin de asegurar la fidelidad de la esposa, aunque la institucionalidad de los gobiernos a través de las escuelas advierte sus peligros, aún sigue siendo una práctica culturalmente arraigada (Fuller, 2008). En segunda instancia está el sexo en seco, es decir el uso de arena y otras sustancias en el pene y la vagina que impiden una adecuada lubricación durante el acto sexual, esto favorece el sangrado y el contacto de fluidos con una alta carga de patógenos entre los cuales está el VIH (Schwandt, Morris, Ferguson, Ngugi, & Moses, 2006).
23. Controversias sociales y negacionismo del VIH y el SIDA
23. Controversias sociales y negacionismo del VIH y el SIDA
Durante finales de los 80s y principios de los 90s no toda la comunidad científica estuvo de acuerdo con la asociación entre el VIH y el SIDA –y claramente la controversia entre los grupos francés y norteamericano no ayudó para nada – el origen de esta controversia se data desde 1987 (Duesberg, 1987). Peter Duesberg fue el primero en cuestionar los resultados de Gallo en el año de 1987 siendo concomitante con las primeras campañas de prevención y con los primeros ensayos clínicos del AZT. En 1989 Duesberg ejerció su influencia para publicar sin revisión por pares gracias a ser miembro de la Academia Nacional de Ciencias (Duesberg, 1987). En este artículo Duesberg establece las raíces de los argumentos de los negacionistas del VIH/SIDA. Lo irónico del asunto es que es el bando del negacionismo quien claramente hace uso de su influencia para publicar sin un debate de pares. El editor de la revista tuvo que obedecer aun cuando estaba en contra de Duesberg.
La controversia al interior de la ciencia
Estudios epidemiológicos sobre la hipótesis de Duesberg
Para Duesberg el VIH es un virus oportunista más que es inocuo, mientras que las verdaderas causas del SIDA son conductas de riesgo como la drogadicción, la promiscuidad y los mismos fármacos. Es muy evidente a estas alturas que los antirretrovirales no pueden causar el SIDA, el primero fue desarrollado para uso comercial hasta 1987 mientras que el SIDA estaba ya circulando en occidente desde 1969 (Duesberg, 1987). Dicha afirmación creó una guerra de flamas al mejor estilo de un blog de internet con afirmaciones y respuestas consecutivas (Blattner, Gallo, & Temin, 1988; Duesberg, 1988; Kalichman, Eaton, & Cherry, 2010; Weiss & Jaffe, 1990)
Por otro lado, para poner a prueba la hipótesis de Duesberg se realizaron estudios con poblaciones de homosexuales con conductas de riesgo (Ascher, Sheppard, Winkelstein, & Vittinghoff, 1993). Un grupo eran infectados recientes con VIH mientras que el otro era de individuos seronegativos. Los resultados del experimento demostraron que la disminución de los linfocitos CD4+ y el ataque de las infecciones oportunistas se asociaron años después de forma exclusiva a los individuos catalogados como serpositivos (Chao et al., 2008; Schechter et al., 1993).
Otros estudios llevados a cabo en un muestreo de 8000 individuos mostraron que la serpositividad era el único factor estadísticamente significativo asociado a un desarrollo de etapa de SIDA. Estos estudios se han venido realizando desde 1993 hasta 2008, lo cual implica que las hipótesis de los disidentes del VIH/SIDA son tomadas en cuenta para la investigación científica (Chao et al., 2008; Schechter et al., 1993).
La controversia se extiende por la década de los 90s
A medida que las pruebas epidemiológicas iniciaban –y eran lentas debido a la etapa de latencia –los argumentos en contra del VIH/SIDA iban y venían, otro de los principales científicos que trabajan en el tema llamado Robert Root-Bernstein publicó su opinión escéptica en 1990, sin embargo, allí el cuestionó también a los negacioncitas fuertes.
Sin embargo, las dudas de Root-Bernstein para la época aunque válidas no fueron fijas, las investigaciones sobre el VIH se hicieron cada vez más numerosas. Para 2011 el profesor Root-Bernstein había ya cambiado su opinión completamente (Lederer, 2005). Y aunque sigue afirmando que para el desarrollo del SIDA a partir del VIH hay otros cofactores importantes –lo cual es bastante cierto –por lo menos acepta que sin infección del VIH no puede haber desarrollo del SIDA. Otros autores como Joseph Sonnabend (Cohen, 1994) que fue bastante crítico con la correlación VIH/SIDA en la década de los noventa, han cambiado radicalmente su punto de vista a la luz de las nuevas investigaciones (Rjabtsev, 2016).
“Algunos individuos piensan que el VIH no tiene ninguna relación con el SIDA y me implican a mí en sus referencias y en sus páginas web. Antes de que el VIH fuera descubierto y su asociación con el SIDA establecida yo mantuve la postura apropiada para el momento de que dicha asociación no era conocida. He empleado en cientos de pacientes con SIDA los antirretrovirales y no tengo dudas de que el VIH juega un rol necesario en esta enfermedad”.
El fin de la controversia científica con respecto al VIH/SIDA
Como lo menciona Joseph Sonnabend uno de los aspectos que parecen haber eliminado las dudas sobre el vínculo del VIH y el SIDA fue la introducción del TARGA a mediados de la década de los 90s. Antes de ello, uno de los principales argumentos de los negacionistas fue que la descripción del VIH no había conllevado al desarrollo de ninguna terapia realmente efectiva, a tal punto de acusar al AZT de ser una de las causas de los síntomas de la etapa de SIDA.
Lo anterior es completamente válido, sin embargo, con el ingreso de las terapias TARGA a mediados de los 90s esto cambió, al eliminar de forma prolongada el efecto del VIH en la sangre, los síntomas de la etapa de SIDA pudieron revertirse a una etapa semejante a la latencia, demostrando que es la alta actividad del VIH la que favorece el ataque de las infecciones oportunistas. El problema es que el resolver los factores científicos nunca resolvió las controversias sociales.
El VIH, el SIDA y el Consenso Científico
Tal vez la palabra aquí es evadir los argumentos de falsas autoridades “argumentum ad verencundiam”. El consenso científico sobre el VIH ha sido alcanzado al nivel de expertos de han dedicado sus vidas a investigar de forma específica el VIH, sin embargo, un consenso nunca implica una unanimidad o tampoco ser una verdad. Los consensos científicos son afirmaciones metodológicamente útiles, y esta utilidad fue la que impidió alcanzarlo seriamente antes de la introducción del TARGA. Antes de eso el consenso sobre el VIH/SIDA no había sido útil para generar medicamentos o tratamientos.
En la actualidad sin embargo la mejora de los tratamientos ha conllevado a un consenso entre la comunidad científica, pero como sucede con otros campos como la Teoría Sintética de la Evolución o el cambio climático, el consenso de la comunidad científica no se traduce a un consenso social o que todos los científicos tengan que estar de acuerdo de forma unánime. En este sentido incluso científicos galardonados con el premio Nobel pueden ser señalables como opinadores externos o falsas autoridades en el sentido de que no realizan investigación directa en el campo del VIH/SIDA y por lo tanto su opinión es tan válida como la de un físico o un ingeniero mecánico.
La controversia al exterior de la ciencia
El negacionismo del VIH/SIDA es extremadamente heterogéneo y puede clasificarse como:
1- Negadores de la existencia del VIH.
2- Negadores de la patogenicidad del VIH.
3- Teóricos de la conspiración militar.
La mayoría sostiene que la etapa de SIDA es muy real, pero es un diagnóstico causado por otros agentes etiológicos. En este sentido emplean bibliografía de los años 90s acusando al estilo de vida y los fármacos como causantes del SIDA a pesar de que estudios epidemiológicos refutaron tales afirmaciones a lo largo de las décadas de los 90s y del 2000 (Chigwedere & Essex, 2010; Fourie & Meyer, 2016; Kalichman, 2014, 2015; Kalichman et al., 2010).
Algunos grupos se basan los argumentos de falsa autoridad como el grupo de Perth, en este sentido se trata de trabajadores médicos que no realizan su trabajo en las áreas del SIDA, y tampoco realizan investigación sobre el tema. Sin embargo logran promoverse a sí mismos como expertos en el tema, al punto de influir en las políticas de países completos como el caso de Sudáfrica (Chigwedere & Essex, 2010; Fourie & Meyer, 2016; Kalichman, 2014, 2015; Kalichman et al., 2010).
Con la introducción del TARGA y la mejora de los tratamientos contra el VIH, los objetivos de los negacionistas han pasado a un público menos especializado y se encuentran diseminados especialmente en el internet. Este tipo de negacionismo es extremadamente peligroso, por ejemplo, la influencia que realizó el grupo de Perth en la política sudafricana conllevó a unas 330.000 muertes por complicaciones en etapa de SIDA (Chigwedere & Essex, 2010; Fourie & Meyer, 2016; Kalichman, 2014, 2015; Kalichman et al., 2010).
24. Clamidia
24. Clamidia
Las enfermedades de transmisión sexual (ETS) tienen graves consecuencias para la humanidad, tanto por sus efectos directos sobre las personas infectadas como por el costo para la sociedad en general. Diecinueve millones de infecciones ocurren cada año en los Estados Unidos. Dos tercios de los residentes estadounidenses infectados son menores de 25 años. El costo del tratamiento de sus infecciones es de miles de millones de dólares. También deberíamos mencionar otro rasgo de las ETS: son sexistas. Afectan a las mujeres más severamente que a los hombres, causando esterilidad con mayor frecuencia en mujeres que en hombres, embarazo ectópico (un embarazo en el cual el embrión comienza a desarrollarse fuera del útero) y cáncer cervical (Mohseni, Sung, & Takov, 2019; Stephens, 1999).
Las ETS son más comunes entre adolescentes y adultos jóvenes (de 14 a 26 años) porque son el segmento de la población con mayor actividad sexual. De hecho, el 26% de las adolescentes de 14 a 19 años tienen al menos una ETS, y el 15% tiene más de una ETS. Además, el 20.1% de las mujeres que han tenido solo una pareja sexual de por vida (hasta ahora) han contraído al menos una ETS. Y, el 50% o más de las adolescentes con tres o más parejas tienen una ETS. La ETS más común son las infecciones genitales con el virus del papiloma humano (VPH).
Una razón por la cual las ETS son tan rampantes es que las personas a menudo no son conscientes de estar infectadas. Muchos casos de ETS carecen de síntomas. De hecho, la prevalencia de casos asintomáticos ha llevado al uso del término infección de transmisión sexual (ITS) en lugar de enfermedad de transmisión sexual. Además, los síntomas de algunas ETS, como la sífilis, desaparecen sin tratamiento, lo que lleva a la persona a creer, por error, que está curada.
La clamidiasis es una enfermedad de transmisión sexual (ETS) causada por la bacteria Chlamydia trachomatis. A pesar de ser una de las ETS más comunes en todo el mundo, muchas personas desconocen su existencia debido a la falta de síntomas visibles en las etapas iniciales. En este artículo, exploraremos en detalle la clamidiasis, su historia, el agente etiológico, el ciclo de vida y las etapas de la enfermedad, los síntomas, las medidas de prevención, el tratamiento y la epidemiología (Mohseni et al., 2019; Stephens, 1999).
Historia
La clamidiasis, también conocida como infección por Chlamydia, ha sido una enfermedad conocida desde tiempos antiguos. Los síntomas similares a los de esta enfermedad fueron descritos por el médico griego Hipócrates en el siglo V a.C. Sin embargo, la verdadera causa bacteriana y su relación con las enfermedades de transmisión sexual no se descubrieron hasta mediados del siglo XX.
En la década de 1950, los científicos tuvieron un avance significativo en el estudio de la clamidiasis. El equipo liderado por el investigador sueco Harald H. M. Löffler logró cultivar y aislar la bacteria Chlamydia trachomatis, el agente etiológico de la enfermedad. Este hito fue fundamental para comprender mejor la epidemiología y la patogénesis de la infección por clamidia.
En las décadas siguientes, se realizaron numerosas investigaciones para desarrollar métodos de diagnóstico y tratamiento eficaces para la clamidiasis. El científico danés Svend Olaf Sørensen fue uno de los pioneros en el desarrollo de técnicas de cultivo y pruebas serológicas para detectar la presencia de la bacteria en muestras clínicas.
En los últimos años, los científicos han seguido investigando y refinando los métodos de diagnóstico y tratamiento de la clamidiasis. Se han desarrollado pruebas de diagnóstico molecular más sensibles y específicas, como la reacción en cadena de la polimerasa (PCR), que permiten una detección temprana y precisa de la infección.
En cuanto al tratamiento, se ha observado un aumento en la resistencia bacteriana a los antibióticos utilizados tradicionalmente. Esto ha llevado a la investigación y desarrollo de nuevas terapias, como el uso de antibióticos de amplio espectro y la combinación de diferentes medicamentos para aumentar la eficacia.
Además, se ha enfatizado la importancia de la educación y la prevención en la lucha contra la clamidiasis. Se han implementado programas de educación sexual y se promueve el uso de preservativos como una medida eficaz para prevenir la transmisión de la enfermedad (Mohseni et al., 2019; Stephens, 1999).
Agente etiológico
La bacteria responsable de la clamidiasis es Chlamydia trachomatis, una bacteria intracelular obligada que se transmite principalmente a través de contacto sexual desprotegido. La bacteria puede infectar tanto a hombres como a mujeres y afecta principalmente los genitales, el recto y la garganta.
Figura 24.1. Chlamydia trachomatis es una bacteria de forma característica, que se presenta en forma de cuerpos elementales (EB) y cuerpos reticulados (RB). Los cuerpos elementales son la forma infectante, mientras que los cuerpos reticulados son la forma replicativa. Carece de una pared celular rígida y posee una membrana externa y una membrana plasmática interna. En su interior, contiene un genoma de ADN circular. Esta bacteria es intracelular obligada y se replica dentro del citoplasma de las células huésped. A través de su ciclo de vida, altera el metabolismo y la función de las células infectadas para su propia supervivencia y propagación.
A lo largo del ciclo de vida de C. trachomatis, la bacteria adopta dos formas distintas. Los cuerpos elementales tienen un tamaño de 200 a 400 nanómetros y están rodeados por una pared celular rígida que les permite sobrevivir fuera de la célula huésped. Esta forma puede iniciar una nueva infección si entra en contacto con una célula huésped susceptible. Los cuerpos reticulados tienen un tamaño de 600 a 1500 nanómetros y se encuentran solo dentro de las células huésped. Ninguna de las formas es móvil.
El genoma de C. trachomatis es considerablemente más pequeño que el de muchas otras bacterias, con aproximadamente 1.04 megabases y alrededor de 900 genes codificados. Varias funciones metabólicas importantes no están codificadas en el genoma de C. trachomatis y, en cambio, se obtienen probablemente de la célula huésped. Además del cromosoma que contiene la mayoría del genoma, casi todas las cepas de C. trachomatis llevan un plásmido de 7.5 kilobases que contiene 8 genes. El papel de este plásmido es desconocido, aunque se han aislado cepas sin el plásmido, lo que sugiere que no es necesario para la supervivencia de la bacteria (Mohseni et al., 2019; Stephens, 1999).
Ciclo de vida y etapas de la enfermedad
Al igual que otras especies de Chlamydia, C. trachomatis tiene un ciclo de vida compuesto por dos formas morfológicamente distintas. Primero, C. trachomatis se adhiere a una nueva célula huésped en forma de una pequeña estructura similar a una espora llamada cuerpo elemental. El cuerpo elemental entra en la célula huésped, rodeado por una vacuola del huésped, llamada inclusión. Dentro de la inclusión, C. trachomatis se transforma en una forma más grande y metabólicamente activa llamada cuerpo reticulado. El cuerpo reticulado modifica sustancialmente la inclusión, convirtiéndola en un ambiente más propicio para la replicación rápida de las bacterias, lo cual ocurre en las siguientes 30 a 72 horas. La gran cantidad de bacterias intracelulares luego regresan a la forma resistente de cuerpos elementales antes de provocar la ruptura de la célula y ser liberadas al medio ambiente. Estos nuevos cuerpos elementales son luego liberados en el semen o desde las células epiteliales del tracto genital femenino y se adhieren a nuevas células huésped.
Los cuerpos elementales generalmente están presentes en el semen de hombres infectados y en las secreciones vaginales de mujeres infectadas. Cuando entran en contacto con una nueva célula huésped, los cuerpos elementales se unen a la célula mediante la interacción entre adhesinas en su superficie y varias proteínas receptoras del huésped y proteoglicanos de heparán sulfato. Una vez unidos, las bacterias inyectan diversas proteínas efectoras en la célula huésped utilizando un sistema de secreción de tipo tres. Estos efectores estimulan a la célula huésped para que capture los cuerpos elementales y evita que la célula active la apoptosis.
Dentro de las 6 a 8 horas posteriores a la infección, los cuerpos elementales se transforman en cuerpos reticulados y se sintetizan varios nuevos efectores. Estos efectores incluyen proteínas que modifican la membrana de la inclusión, llamadas proteínas Inc, así como proteínas que redirigen las vesículas del huésped hacia la inclusión. De 8 a 16 horas después de la infección, se sintetiza otro conjunto de efectores, lo que facilita la adquisición de nutrientes de la célula huésped. En esta etapa, los cuerpos reticulados comienzan a dividirse, coincidiendo con la expansión de la inclusión. Si varios cuerpos elementales han infectado una sola célula, sus inclusiones se fusionarán en este punto para crear una sola inclusión grande en la célula huésped.
De 24 a 72 horas después de la infección, los cuerpos reticulados se transforman en cuerpos elementales que son liberados mediante lisis de la célula huésped o extrusión de toda la inclusión en el tracto genital del huésped (Mohseni et al., 2019; Stephens, 1999).
Síntomas:
En muchos casos, la clamidiasis no presenta síntomas visibles, lo que hace que sea difícil de detectar. Sin embargo, cuando se presentan síntomas, pueden incluir flujo vaginal o uretral anormal, dolor durante la micción, dolor abdominal bajo, sangrado entre períodos menstruales, dolor durante las relaciones sexuales y, en casos más avanzados, complicaciones como la infertilidad (Mohseni et al., 2019; Stephens, 1999).
Prevención
La prevención de la clamidiasis se basa en medidas simples pero efectivas. El uso adecuado y consistente de preservativos durante las relaciones sexuales, tanto vaginales como anales, puede reducir significativamente el riesgo de transmisión. Además, es esencial realizar pruebas regulares de detección de ETS, especialmente para aquellos que son sexualmente activos o tienen múltiples parejas sexuales (Mohseni et al., 2019; Stephens, 1999).
Tratamiento
La clamidiasis se puede tratar con antibióticos específicos para eliminar la infección bacteriana. Los regímenes de tratamiento varían según la gravedad de la infección y las características del paciente. Es fundamental seguir el tratamiento completo y evitar las relaciones sexuales durante el tratamiento para prevenir la reinfección y la propagación de la enfermedad (Mohseni et al., 2019; Stephens, 1999).
25. Gonorrea
25. Gonorrea
La gonorrea, también conocida como blenorragia, es una infección de transmisión sexual (ITS) que ha afectado a la humanidad durante siglos. En este artículo, exploraremos en detalle la historia de la gonorrea, el agente etiológico, el ciclo de vida y las etapas de la enfermedad, los síntomas, las medidas de prevención, el tratamiento y la epidemiología a nivel mundial, en América y específicamente en Colombia (Christodoulides, 2019; Pérez-Gracia & Suay-García, 2021).
Historia
La gonorrea ha sido reconocida como una enfermedad desde la antigüedad. Los primeros registros escritos de síntomas similares a los de la gonorrea datan de la antigua Grecia y Roma. Durante siglos, la enfermedad se propagó sin control debido a la falta de conocimiento sobre su causa y métodos efectivos de prevención y tratamiento.
Figura 25.1. Albert Ludwig Sigesmund Neisser (1855-1916) fue un médico e investigador alemán reconocido por su importante contribución al campo de la microbiología. Nacido el 22 de enero de 1855 en Silesia, Prusia, Neisser se especializó en dermatología y venereología. En 1879, mientras trabajaba como asistente en la clínica de Robert Koch, Neisser logró un hito importante al descubrir y describir la bacteria responsable de la gonorrea, que ahora se conoce como Neisseria gonorrhoeae en su honor. Este descubrimiento fue fundamental para comprender y tratar la enfermedad de manera más efectiva. Además de su trabajo en gonorrea, Neisser también realizó investigaciones pioneras sobre el lupus vulgaris y otras enfermedades dermatológicas. Fue uno de los primeros en utilizar técnicas de tinción para visualizar bacterias en muestras clínicas, lo que sentó las bases para el posterior desarrollo de la microbiología clínica. A lo largo de su carrera, Neisser publicó numerosos artículos científicos y fue reconocido internacionalmente por sus contribuciones al campo de la medicina. Murió el 30 de julio de 1916 en Breslau, Alemania (actualmente Wroclaw, Polonia), dejando un legado duradero en el campo de la microbiología y la dermatología.
En 1878, Albert Neisser aisló y visualizó diplococos de N. gonorrhoeae en muestras de pus de 35 hombres y mujeres con los síntomas clásicos de infección genitourinaria por gonorrea, dos de los cuales también tenían infecciones en los ojos. En 1882, Leistikow y Loeffler lograron cultivar el organismo en cultivo. Luego, en 1883, Max Bockhart demostró de manera concluyente que la bacteria aislada por Albert Neisser era el agente causante de la enfermedad conocida como gonorrea al inocular el pene de un hombre sano con las bacterias. El hombre desarrolló los síntomas clásicos de la gonorrea días después, cumpliendo con el último de los postulados de Koch. Hasta este punto, los investigadores debatían si la sífilis y la gonorrea eran manifestaciones de la misma enfermedad o dos entidades distintas. Uno de esos investigadores del siglo XVIII, John Hunter, trató de resolver el debate en 1767 al inocular a un hombre con pus tomado de un paciente con gonorrea. Concluyó erróneamente que tanto la sífilis como la gonorrea eran la misma enfermedad cuando el hombre desarrolló la erupción de color cobre que es clásica de la sífilis.
Aunque muchas fuentes repiten que Hunter se inoculó a sí mismo, otros argumentan que en realidad fue otro hombre. Después del experimento de Hunter, otros científicos buscaron refutar sus conclusiones inoculando pus gonocócico en otros médicos varones, estudiantes de medicina y hombres encarcelados, todos los cuales desarrollaron la sensación de ardor y secreción de la gonorrea. Un investigador, Ricord, se tomó la iniciativa de realizar 667 inoculaciones de pus gonocócico en pacientes de un hospital mental, sin registrar ningún caso de sífilis. Es importante destacar que la aparición de la penicilina en la década de 1940 proporcionó tratamientos efectivos para la gonorrea (Christodoulides, 2019; Pérez-Gracia & Suay-García, 2021).
Agente etiológico:
La gonorrea es causada por la bacteria Neisseria gonorrhoeae, también conocida como gonococo. Esta bacteria se transmite principalmente a través de relaciones sexuales vaginales, anales u orales desprotegidas con una persona infectada. La bacteria se adhiere a las células epiteliales de los órganos sexuales y se reproduce en su interior, lo que resulta en la infección.
Figura 25.2. Neisseria gonorrhoeae es una bacteria gramnegativa de forma cocobacilar. Presenta una cápsula externa compuesta por polisacáridos que le confiere resistencia al sistema inmunitario del huésped. Su membrana externa contiene proteínas porinas que le permiten la entrada de nutrientes y la interacción con las células huésped. Posee fimbrias en su superficie que le ayudan a adherirse a las células epiteliales del tracto genital humano. El citoplasma contiene ribosomas, ADN y otros componentes celulares necesarios para su metabolismo y replicación. N. gonorrhoeae no forma esporas y puede presentar pili sexuales que le permiten la transferencia de material genético entre bacterias.
Ciclo de vida y etapas de la enfermedad:
N. gonorrhoeae se transmite a través de relaciones sexuales vaginales, orales o anales; la transmisión no sexual es poco probable en infecciones en adultos. También puede transmitirse al recién nacido durante el paso por el canal de parto si la madre tiene una infección genitourinaria no tratada. Dada la alta tasa de infección asintomática, todas las mujeres embarazadas deben ser evaluadas para detectar la infección por gonorrea. Sin embargo, se ha implicado a baños comunales, toallas o tejidos, termómetros rectales y manos de cuidadores como medios de transmisión en el entorno pediátrico. También se ha teorizado que los besos podrían ser un medio de transmisión en la población masculina homosexual, según un estudio más reciente.
Tradicionalmente, se pensaba que la bacteria se desplazaba adherida a los espermatozoides, pero esta hipótesis no explicaba la transmisión de la enfermedad de mujer a hombre. Un estudio reciente sugiere que en lugar de "surfear" sobre los espermatozoides en movimiento, las bacterias de N. gonorrhoeae utilizan pili para anclarse a proteínas en el esperma y moverse a través del líquido coital.
Para N. gonorrhoeae, el primer paso después de una exitosa transmisión es adherirse a las células epiteliales que se encuentran en el sitio mucoso infectado. La bacteria depende de pili tipo IV que se adhieren y se retraen, atrayendo a N. gonorrhoeae hacia la membrana epitelial donde sus proteínas de superficie, como las proteínas de opacidad, pueden interactuar directamente. Una vez adherida, N. gonorrhoeae se replica y forma microcolonias. Durante la colonización, la bacteria tiene el potencial de transcitosis a través de la barrera epitelial y abrirse paso hacia el torrente sanguíneo. Durante el crecimiento y la colonización, N. gonorrhoeae estimula la liberación de citoquinas y quimiocinas de las células inmunitarias del huésped, las cuales son proinflamatorias. Estas moléculas proinflamatorias reclutan macrófagos y neutrófilos. Estas células fagocíticas generalmente ingieren patógenos extraños y los destruyen, pero N. gonorrhoeae ha desarrollado varios mecanismos que le permiten sobrevivir dentro de estas células inmunitarias y frustrar los intentos de eliminación (Christodoulides, 2019; Pérez-Gracia & Suay-García, 2021).
Síntomas
Los síntomas de la gonorrea pueden variar dependiendo del género y la ubicación de la infección. En los hombres, los síntomas pueden incluir secreción purulenta del pene, dolor al orinar y agrandamiento de los ganglios linfáticos en la ingle. En las mujeres, los síntomas pueden ser más sutiles o incluso inexistentes, pero pueden incluir flujo vaginal anormal, dolor pélvico y sangrado entre períodos menstruales (Christodoulides, 2019; Pérez-Gracia & Suay-García, 2021).
Prevención
La prevención de la gonorrea se basa en prácticas seguras de actividad sexual. El uso correcto y consistente de preservativos durante todas las relaciones sexuales, así como la reducción del número de parejas sexuales y la realización regular de pruebas de detección de ETS, son medidas clave para prevenir la transmisión y propagación de la enfermedad (Christodoulides, 2019; Pérez-Gracia & Suay-García, 2021).
Tratamiento
El tratamiento de la gonorrea implica el uso de antibióticos específicos para eliminar la infección bacteriana. Sin embargo, debido a la creciente resistencia bacteriana, el tratamiento de la gonorrea se ha vuelto más desafiante en los últimos años. Es fundamental seguir el tratamiento completo y evitar las relaciones sexuales hasta que la infección haya sido completamente eliminada para prevenir la reinfección y la propagación de la enfermedad (Christodoulides, 2019; Pérez-Gracia & Suay-García, 2021).
26. Sífilis
26. Sífilis
La sífilis es una enfermedad infecciosa de transmisión sexual que ha afectado a la humanidad a lo largo de la historia. En este artículo, exploraremos en detalle la historia de la sífilis, el agente etiológico, el ciclo de vida y las etapas de la enfermedad, los síntomas, las medidas de prevención y el tratamiento (Radolf & Lukehart, 2006; Sato, 2011; Zbar, 2022).
El pian, el bejel y la sífilis son enfermedades causadas por diferentes subespecies de la bacteria Treponema pallidum. Aunque comparten similitudes en su morfología y serología, presentan diferencias en términos de transmisión, síntomas y distribución geográfica.
El pian, causado por la subespecie T. p. pertenue, es una infección cutánea y ósea que se transmite principalmente por contacto directo con heridas abiertas en la piel de una persona infectada. Se caracteriza por la aparición de úlceras en la piel, lesiones en los huesos y deformidades óseas. Es más común en regiones tropicales y subtropicales, especialmente en áreas rurales con condiciones de higiene deficientes.
El bejel, causado por la subespecie T. p. endemicum, es una forma crónica de sífilis que se encuentra principalmente en áreas rurales y desfavorecidas de África, Medio Oriente y partes de Asia. Se transmite principalmente a través del contacto directo con lesiones mucosas infectadas, como al compartir utensilios o alimentos. El bejel afecta principalmente a niños y se caracteriza por la formación de úlceras en la boca y la piel, inflamación ósea y problemas dentales.
La sífilis, causada por la subespecie T. p. pallidum, es una infección de transmisión sexual que puede transmitirse a través de relaciones sexuales sin protección, contacto directo con lesiones abiertas o de madre a hijo durante el embarazo o el parto. La sífilis puede afectar múltiples órganos y etapas de la enfermedad, presentando síntomas como úlceras genitales, erupciones en la piel, fiebre, inflamación de los ganglios linfáticos y daño neurológico si no se trata adecuadamente (Radolf & Lukehart, 2006; Sato, 2011; Zbar, 2022).
Historia
La sífilis, una enfermedad infecciosa de transmisión sexual, ha sido objeto de estudio e investigación por parte de numerosos científicos a lo largo de la historia. Desde su aparición en Europa en el siglo XV, varios investigadores han contribuido de manera significativa al entendimiento de esta enfermedad y al desarrollo de métodos de tratamiento y diagnóstico.
Uno de los primeros científicos en estudiar la sífilis fue Girolamo Fracastoro, un médico italiano del siglo XVI. En 1530, Fracastoro propuso la teoría de que la sífilis era causada por un "semilla venenosa" que se transmitía de persona a persona. Su trabajo fue fundamental en la comprensión de la transmisión de la enfermedad y sentó las bases para futuras investigaciones.
Figura 26.1. August von Wassermann fue un médico y bacteriólogo alemán nacido el 21 de febrero de 1866 en Bamberg, Baviera. Es reconocido por su desarrollo de la prueba serológica conocida como la prueba de Wassermann, utilizada para detectar la presencia de anticuerpos específicos contra Treponema pallidum, la bacteria causante de la sífilis. Esta prueba revolucionó el diagnóstico de la enfermedad y se convirtió en una herramienta fundamental en el campo de la medicina. Wassermann también hizo importantes contribuciones en el campo de la inmunología y su trabajo sentó las bases para futuras investigaciones en el diagnóstico y tratamiento de enfermedades infecciosas. Falleció el 16 de marzo de 1925 en Berlín, Alemania.
En el siglo XIX, varios científicos realizaron importantes contribuciones al estudio de la sífilis. August von Wassermann, un médico y bacteriólogo alemán, desarrolló en 1906 una prueba serológica conocida como la prueba de Wassermann. Esta prueba permitía detectar la presencia de anticuerpos específicos contra Treponema pallidum, la bacteria causante de la sífilis, en el suero sanguíneo de los pacientes. Su trabajo revolucionó el diagnóstico de la enfermedad y se convirtió en una herramienta fundamental en el campo de la medicina.
En el ámbito del tratamiento, uno de los mayores hitos en la historia de la sífilis fue el descubrimiento de la penicilina como un medicamento eficaz. Alexander Fleming, un científico británico, descubrió las propiedades antibacterianas de la penicilina en 1928. Sin embargo, fue durante la Segunda Guerra Mundial cuando se demostró de manera definitiva la eficacia de la penicilina en el tratamiento de la sífilis. Este avance significó un gran paso hacia la cura de la enfermedad y ha salvado innumerables vidas desde entonces.
Figura 26.2. Alexander Fleming fue un médico y microbiólogo escocés nacido el 6 de agosto de 1881 en Lochfield, Escocia. Es reconocido por su descubrimiento de la penicilina, el primer antibiótico que revolucionó la medicina moderna. En 1928, mientras trabajaba en su laboratorio, Fleming observó que una colonia de bacterias había sido contaminada por un hongo que producía una sustancia que inhibía el crecimiento bacteriano. Este hallazgo condujo al desarrollo de la penicilina, un medicamento eficaz en el tratamiento de infecciones bacterianas. Por su descubrimiento, Fleming fue galardonado con el Premio Nobel de Medicina en 1945. Falleció el 11 de marzo de 1955 en Londres, Inglaterra.
A lo largo de los años, se han desarrollado otros tratamientos para la sífilis, como los antibióticos como la doxiciclina y la azitromicina, que son eficaces en las diferentes etapas de la enfermedad. Además, se han realizado avances en la prevención de la sífilis a través de la educación sexual, el uso de condones y la detección temprana de la enfermedad.
La sífilis ha dejado una huella significativa en la historia de la medicina y la sociedad. Durante siglos, fue una enfermedad altamente estigmatizada y se asoció con el pecado y la promiscuidad. Su impacto en la sociedad fue tal que influenció la cultura, el arte y la literatura de la época. Por ejemplo, el famoso pintor Gustav Klimt retrató la enfermedad y sus consecuencias en su obra "La enfermedad". Además, la sífilis fue motivo de debate y controversia, especialmente en relación con su transmisión y tratamiento (Radolf & Lukehart, 2006; Sato, 2011; Zbar, 2022).
Agente etiológico
La sífilis es causada por la bacteria Treponema pallidum, una bacteria espiroqueta delgada y helicoidal. Esta bacteria se transmite principalmente a través de relaciones sexuales desprotegidas con una persona infectada. También puede transmitirse de madre a hijo durante el embarazo, lo que se conoce como sífilis congénita. Treponema pallidum es altamente sensible a las condiciones ambientales y no puede sobrevivir fuera del cuerpo humano durante mucho tiempo.
Figura 26.3. Treponema pallidum es una bacteria espiral que pertenece al género Treponema. Tiene un tamaño de aproximadamente 0.2 a 0.5 micrómetros de ancho y 5 a 15 micrómetros de longitud. Carece de estructuras móviles como flagelos o pili, lo que limita su capacidad de movimiento. Su cuerpo celular está rodeado por una membrana externa y una membrana interna. Además, posee una capa de peptidoglicano que proporciona soporte estructural. A nivel molecular, Treponema pallidum cuenta con proteínas de membrana y lipoproteínas que le permiten interactuar con las células huésped y evadir la respuesta inmunológica. Su forma es característica de una espiroqueta, lo que le permite penetrar y propagarse a través de los tejidos.
Se conocen tres subespecies de T. pallidum: Treponema pallidum pallidum, que causa la sífilis. T. p. endemicum, que causa el bejel o sífilis endémica. T. p. pertenue, que causa el pian. Las tres subespecies que causan el pian, el bejel y la sífilis son morfológica y serológicamente indistinguibles. Estas bacterias fueron originalmente clasificadas como miembros de especies separadas, pero el análisis de hibridación de ADN indica que son miembros de la misma especie. Treponema carateum, causante de la pinta, sigue siendo una especie separada porque no se dispone de un aislado para análisis de ADN. La transmisión de la enfermedad en las subespecies T. p. endemicum y T. p. pertenue se considera no venérea. T. p. pallidum es la subespecie patógena más invasiva, mientras que T. p. carateum es la menos invasiva de las subespecies. T. p. endemicum y T. p. pertenue son intermedias en su grado de invasividad (Radolf & Lukehart, 2006; Sato, 2011; Zbar, 2022).
Ciclo de vida y etapas de la enfermedad
El ciclo de vida de Treponema pallidum, la bacteria responsable de la sífilis, es complejo y se divide en tres etapas principales: primaria, secundaria y tardía. Cada etapa presenta características distintivas y puede tener diferentes efectos en el organismo.
La etapa primaria de la sífilis se caracteriza por la formación de una úlcera indolora en el lugar de entrada de la bacteria. Esta úlcera, conocida como chancro, suele aparecer en los genitales, el ano o la boca, aunque puede desarrollarse en otras partes del cuerpo. El chancro es altamente contagioso y contiene una gran cantidad de bacterias. A menudo, pasa desapercibido debido a su falta de dolor, lo que puede dificultar su detección temprana. Sin embargo, es durante esta etapa cuando la bacteria se multiplica activamente y se propaga a través del contacto sexual o el contacto directo con la lesión.
Si no se trata, la infección progresa a la etapa secundaria, que generalmente ocurre unas semanas o meses después de la aparición del chancro. Durante esta etapa, el organismo afectado puede experimentar una amplia variedad de síntomas, como erupciones cutáneas en todo el cuerpo, fiebre, fatiga, dolor muscular, inflamación de los ganglios linfáticos, dolor de garganta y pérdida de cabello. Estos síntomas pueden aparecer y desaparecer de forma intermitente durante un período de tiempo prolongado. La sífilis secundaria es altamente contagiosa, ya que las bacterias se encuentran en la sangre y en las lesiones cutáneas. Además, en esta etapa, la bacteria puede invadir órganos internos y sistemas, lo que puede tener consecuencias graves para la salud si no se trata adecuadamente.
Si la infección continúa sin tratamiento, la sífilis progresa a la etapa tardía, también conocida como sífilis terciaria o tardía. Esta etapa puede desarrollarse años después de la infección inicial. Durante la sífilis tardía, la bacteria puede afectar varios órganos y sistemas del cuerpo, incluyendo el corazón, los vasos sanguíneos, el cerebro, los huesos, los ojos y los órganos internos. Los síntomas pueden variar ampliamente dependiendo de los órganos afectados y pueden incluir enfermedades cardiovasculares, trastornos neurológicos, ceguera, trastornos psiquiátricos, lesiones óseas y daño a otros órganos. En esta etapa, la sífilis puede causar daños graves y permanentes en el cuerpo, y en algunos casos, puede ser fatal.
A lo largo de la historia, la sífilis ha sido objeto de intensa investigación y estudio por parte de numerosos científicos destacados. Uno de los hitos más importantes en el tratamiento de la sífilis fue el descubrimiento de la penicilina como un tratamiento eficaz. Alexander Fleming, un científico británico, descubrió las propiedades antibacterianas de la penicilina en 1928, sentando las bases para el desarrollo de este importante medicamento. Sin embargo, fue en la década de 1940 cuando se estableció de manera definitiva la
eficacia de la penicilina en el tratamiento de la sífilis. Durante este período, se llevaron a cabo numerosos estudios clínicos que demostraron su efectividad para combatir la infección causada por la bacteria Treponema pallidum, responsable de la sífilis.
Otros científicos también contribuyeron significativamente al avance en el tratamiento de la sífilis. Paul Ehrlich, un científico alemán, desarrolló el primer tratamiento específico para la sífilis en 1909, conocido como el "606" o Salvarsán. Esta fue la primera terapia química eficaz contra la enfermedad y marcó un hito en su tratamiento (Radolf & Lukehart, 2006; Sato, 2011; Zbar, 2022).
Síntomas
Los síntomas de la sífilis varían según la etapa de la enfermedad. En la etapa primaria, se forma una lesión indolora llamada chancro, que desaparece sin tratamiento en pocas semanas. En la etapa secundaria, pueden aparecer síntomas como erupciones cutáneas, llagas en la boca y los genitales, fiebre, fatiga y dolor muscular. En la etapa tardía, la sífilis puede afectar el corazón, los vasos sanguíneos, el cerebro y otros órganos, lo que puede provocar complicaciones graves (Radolf & Lukehart, 2006; Sato, 2011; Zbar, 2022).
Prevención
La prevención de la sífilis se basa en prácticas seguras de actividad sexual. El uso adecuado y consistente de preservativos durante todas las relaciones sexuales puede reducir significativamente el riesgo de transmisión. Además, es fundamental realizar pruebas regulares de detección de ETS, especialmente para aquellos que son sexualmente activos o tienen múltiples parejas sexuales. Durante el embarazo, es importante realizar pruebas de detección de sífilis para prevenir la transmisión vertical (Radolf & Lukehart, 2006; Sato, 2011; Zbar, 2022).
Tratamiento
El tratamiento para la sífilis generalmente implica el uso de antibióticos, específicamente la penicilina o sus derivados, que son altamente efectivos para combatir la infección. La elección del tratamiento depende de la etapa de la enfermedad y la condición clínica del paciente.
En las primeras etapas de la sífilis, generalmente se administra una única dosis de penicilina benzatina por vía intramuscular. Esta dosis es suficiente para eliminar la bacteria y prevenir la progresión de la enfermedad. Para casos más avanzados o cuando la infección ha estado presente por un tiempo prolongado, puede ser necesario un tratamiento más prolongado con dosis adicionales de antibióticos.
En casos de alergia a la penicilina, se pueden utilizar otros antibióticos, como la doxiciclina o la azitromicina, aunque se necesita un seguimiento más estrecho para asegurar la efectividad del tratamiento.
Es importante destacar que el tratamiento oportuno es crucial para prevenir complicaciones graves. Después del tratamiento, se recomienda realizar pruebas de seguimiento para confirmar la eliminación de la bacteria y garantizar una curación completa. Además, es fundamental practicar relaciones sexuales seguras y notificar a las parejas sexuales para que también se sometan a pruebas y tratamiento si es necesario (Radolf & Lukehart, 2006; Sato, 2011; Zbar, 2022).
27. Los herpes 1 y 2
27. Los herpes 1 y 2
Los herpes 1 y 2 son dos tipos de virus que causan infecciones de transmisión sexual (ITS) comunes en todo el mundo. En este artículo, exploraremos en detalle la historia de estos virus, su agente etiológico, el ciclo de vida y las etapas de la enfermedad, los síntomas, las medidas de prevención y el tratamiento, así como su epidemiología (Diefenbach & Fraefel, 2016; Ruderfer & Krilov, 2015).
Historia
El herpes ha acompañado a la humanidad durante siglos. En la antigüedad, la infección por herpes genital era considerada una enfermedad de transmisión sexual altamente estigmatizada. Sin embargo, no fue hasta mediados del siglo XX que se identificaron y se distinguieron dos tipos de herpes: el herpes simplex tipo 1 (HSV-1) y el herpes simplex tipo 2 (HSV-2).
En la década de 1940, los científicos John F. Enders, Thomas H. Weller y Frederick C. Robbins realizaron investigaciones fundamentales sobre los virus, incluido el herpes. Su trabajo pionero en el cultivo de tejidos y células permitió el aislamiento y estudio del virus del herpes, sentando las bases para el desarrollo de métodos de diagnóstico y tratamientos efectivos.
Figura 27.1. John F. Enders (1897-1985) fue un destacado científico estadounidense y pionero en el campo de la virología. Nacido en Connecticut, Enders se especializó en microbiología y realizó investigaciones fundamentales en el cultivo de tejidos y células en laboratorio. En la década de 1940, junto con Thomas H. Weller, logró aislar y estudiar virus humanos, como el poliovirus y el virus del sarampión, lo que condujo al desarrollo de vacunas efectivas. Por su destacado trabajo, Enders fue galardonado con el Premio Nobel de Fisiología o Medicina en 1954. Sus contribuciones revolucionaron el campo de la virología y sentaron las bases para el estudio y tratamiento de enfermedades virales.
En el ámbito del diagnóstico, se han desarrollado pruebas específicas para detectar la presencia de anticuerpos contra el virus del herpes en la sangre. Estas pruebas, como la prueba de ELISA y la prueba de Western blot, permiten identificar la infección por HSV-1 o HSV-2, lo que ayuda a un diagnóstico más preciso y a una mejor comprensión de la epidemiología de la enfermedad.
Figura 27.2. Frederick C. Robbins (1916-2003) fue un destacado científico estadounidense y ganador del Premio Nobel de Fisiología o Medicina en 1954. Nacido en Alabama, Robbins se especializó en microbiología y realizó investigaciones fundamentales en el campo de las enfermedades infecciosas. En la década de 1940, junto con John F. Enders y Thomas H. Weller, logró cultivar virus en tejidos humanos, lo que permitió desarrollar vacunas efectivas contra enfermedades como la poliomielitis y el sarampión. Sus investigaciones fueron fundamentales para el avance de la virología y la comprensión de los mecanismos de propagación de enfermedades virales. Robbins dejó un legado duradero en el campo de la medicina y la investigación científica.
Además, los avances en la biología molecular y la secuenciación del genoma viral han permitido un mejor entendimiento de la estructura y función de los diferentes genes del herpes. Esto ha llevado al desarrollo de nuevas terapias antivirales más efectivas y específicas (Diefenbach & Fraefel, 2016; Ruderfer & Krilov, 2015).
Agente etiológico
Los herpes 1 y 2 son virus pertenecientes a la familia de los herpesviridae. El HSV-1 se transmite principalmente a través del contacto oral, mientras que el HSV-2 se transmite predominantemente por contacto sexual. Ambos virus son altamente contagiosos y se propagan mediante el contacto directo con las lesiones activas o el fluido infectado de una persona infectada.
Figura 27.3. El virión del herpes simplex virus (HSV) es un virus envuelto y complejo en su estructura. Consiste en un núcleo central compuesto por el genoma viral, que es ADN de doble cadena. El núcleo está rodeado por una cápside icosaédrica formada por proteínas, que le proporciona rigidez y protección. Esta cápside está envuelta en una envoltura lipídica derivada de la célula hospedadora. En la envoltura, se encuentran incrustadas glicoproteínas virales que desempeñan un papel crucial en la entrada del virus a las células huésped. El virión de HSV es altamente contagioso y se transmite de persona a persona a través de contacto directo.
Ciclo de vida y etapas de la enfermedad
Una vez que el virus ingresa al cuerpo humano, se replica y se establece en los nervios sensoriales, donde puede permanecer latente durante largos períodos de tiempo. Durante la fase latente, el virus no causa síntomas y puede reactivarse en momentos de estrés, inmunosupresión o estimulación hormonal. Las etapas de la enfermedad varían según el tipo de herpes y la localización de la infección (Diefenbach & Fraefel, 2016; Ruderfer & Krilov, 2015).
Síntomas
Los síntomas del herpes pueden variar desde leves hasta graves. En la infección por HSV-1, es común la aparición de herpes labial, que se caracteriza por la formación de ampollas en los labios o alrededor de la boca. Por otro lado, la infección por HSV-2 se asocia con herpes genital, manifestándose como llagas o úlceras en los genitales, el área anal o en la boca en casos de sexo oral. Ambos tipos de herpes pueden causar síntomas como picazón, dolor, malestar general y fiebre (Diefenbach & Fraefel, 2016; Ruderfer & Krilov, 2015).
Prevención
La prevención del herpes 1 y 2 se basa en prácticas seguras de actividad sexual y medidas de higiene adecuadas. El uso de condones durante todas las relaciones sexuales puede reducir el riesgo de transmisión, aunque no ofrece una protección total debido a la capacidad de los virus para infectar áreas no cubiertas por el condón. Evitar el contacto directo con las lesiones activas y evitar el sexo oral o genital durante los brotes activos también son medidas preventivas importantes (Diefenbach & Fraefel, 2016; Ruderfer & Krilov, 2015).
Tratamiento
No existe una cura definitiva para el herpes, pero existen opciones de tratamiento para controlar los síntomas y reducir la frecuencia y la duración de los brotes. Los medicamentos antivirales, como el aciclovir, el valaciclovir y el famciclovir, pueden ayudar a acortar la duración de los brotes, aliviar los síntomas y reducir la transmisión. Además, es fundamental llevar un estilo de vida saludable, mantener un sistema inmunológico fuerte y recibir apoyo emocional para lidiar con los aspectos psicológicos de vivir con herpes (Diefenbach & Fraefel, 2016; Ruderfer & Krilov, 2015).
Epidemiología
Los herpes 1 y 2 son infecciones prevalentes en todo el mundo. Se estima que miles de millones de personas están infectadas con HSV-1, mientras que cientos de millones están infectadas con HSV-2. La prevalencia varía según las regiones geográficas y los grupos de edad. En general, la infección por HSV-1 es más común en la infancia, mientras que la infección por HSV-2 se adquiere principalmente a través del contacto sexual en la edad adulta (Diefenbach & Fraefel, 2016; Ruderfer & Krilov, 2015).
28. Papiloma
28. Papiloma
El Papiloma Humano (VPH) es una infección de transmisión sexual que afecta a millones de personas en todo el mundo. En este artículo, exploraremos en detalle la historia del VPH, su agente etiológico, el ciclo de vida y las etapas de la enfermedad, los síntomas, las medidas de prevención y el tratamiento, así como su epidemiología (Davy & Doorbar, 2008; Sendagorta-Cudós, Burgos-Cibrián, & Rodríguez-Iglesias, 2019).
Historia
El virus del papiloma humano (VPH) ha sido objeto de estudio e investigación durante décadas, y muchos científicos han contribuido de manera significativa a nuestra comprensión de este virus y sus implicaciones clínicas.
Figura 28.1. Ludwig Gross fue un destacado científico del siglo XX conocido por sus contribuciones en el campo de la virología y la oncología. Nació el 28 de julio de 1905 en Austria y emigró a los Estados Unidos en 1938. Durante su carrera, realizó investigaciones pioneras sobre la relación entre los virus y el cáncer. En la década de 1950, Gross llevó a cabo estudios fundamentales que demostraron que ciertos virus, incluido el virus del papiloma humano (VPH), podían inducir la formación de tumores en animales. Sus hallazgos sentaron las bases para futuras investigaciones sobre el VPH y su vínculo con el desarrollo de cáncer. Ludwig Gross dejó un legado duradero en el campo de la virología y su impacto en la comprensión de las enfermedades oncológicas es reconocido hasta el día de hoy.
En la década de 1950, el investigador Georgios Papanikolaou realizó un importante descubrimiento relacionado con el VPH. Papanikolaou desarrolló la prueba de Papanicolaou, también conocida como la prueba de citología cervical o prueba de Papanicolaou. Esta prueba se utiliza para detectar células anormales en el cuello uterino, incluyendo células asociadas al VPH y otras anomalías que pueden indicar la presencia de cáncer cervical. Su trabajo fue un avance crucial en el diagnóstico temprano del cáncer de cuello uterino y ha tenido un impacto significativo en la salud de las mujeres en todo el mundo. Ludwig Gross, por otro lado, demostró que el VPH podía inducir la formación de tumores en animales, lo que también contribuyó al entendimiento de este virus y su relación con el cáncer.
Figura 28.2. Georgios Papanikolaou, nacido el 13 de mayo de 1883 en Kymi, Grecia, fue un destacado médico y científico cuyas contribuciones revolucionaron el campo de la medicina. Se le reconoce principalmente por su desarrollo de la prueba de Papanicolaou, también conocida como la prueba de citología cervical. Papanikolaou se graduó en medicina en la Universidad de Atenas y posteriormente emigró a los Estados Unidos en 1913. Allí, trabajó en el Departamento de Patología del Hospital de Nueva York y en el Instituto de Investigación del Cáncer de Nueva York. Durante su tiempo en el hospital, Papanikolaou llevó a cabo una extensa investigación en citología y células cancerosas. En 1928, Papanikolaou y su esposa, Mary Papanikolaou, desarrollaron la prueba de Papanicolaou para detectar células anormales en el cuello uterino. Esta prueba, que se basa en la observación microscópica de células cervicales, se convirtió en un método crucial para el diagnóstico temprano del cáncer cervical y ha salvado innumerables vidas desde entonces. Georgios Papanikolaou recibió numerosos reconocimientos y premios a lo largo de su carrera, incluyendo la Medalla Elliott Cresson en 1954. Su trabajo pionero en citología y su contribución a la medicina le han valido un lugar destacado en la historia de la ciencia médica. Papanikolaou falleció el 19 de febrero de 1962, dejando un legado duradero en la lucha contra el cáncer.
En la década de 1980, Harald zur Hausen identificó la relación entre ciertos tipos de VPH y el desarrollo de cáncer cervical. Su investigación demostró que los tipos de VPH de alto riesgo, como el VPH-16 y el VPH-18, eran responsables de la mayoría de los casos de cáncer cervical.
Desde entonces, se han realizado avances significativos en el tratamiento y la prevención de las infecciones por VPH. En la década de 2000, se introdujeron las vacunas contra el VPH, desarrolladas por los científicos Ian Frazer y Jian Zhou. Estas vacunas, como la vacuna Gardasil y la vacuna Cervarix, ofrecen protección contra los tipos de VPH más comunes que causan cáncer cervical y otras enfermedades asociadas.
Figura 28.3. Harald zur Hausen es un eminente científico alemán nacido el 11 de marzo de 1936. Es reconocido por su destacada contribución en el campo de la virología y la oncología. En la década de 1970, propuso la teoría de que el virus del papiloma humano (VPH) estaba relacionado con el desarrollo del cáncer cervical. A través de años de investigación y experimentación, zur Hausen identificó los subtipos específicos del VPH responsables de este tipo de cáncer. Su descubrimiento sentó las bases para el desarrollo de vacunas preventivas contra el VPH y revolucionó la prevención y el tratamiento de esta enfermedad. Por sus logros científicos, Harald zur Hausen fue galardonado con el Premio Nobel de Fisiología o Medicina en 2008.
En términos de diagnóstico, se han desarrollado pruebas de detección molecular más avanzadas para la detección temprana de infecciones por VPH. La prueba de reacción en cadena de la polimerasa (PCR) y la prueba de hibridación de ácido nucleico (NAT) permiten la detección precisa del material genético del VPH en muestras cervicales y ayudan en la identificación de los tipos de VPH presentes.
Además, la educación y la concienciación sobre la importancia de la prevención y el control de las infecciones por VPH han aumentado significativamente. Se han implementado programas de vacunación en muchos países, dirigidos a adolescentes y jóvenes, con el objetivo de reducir la carga de enfermedades relacionadas con el VPH (Davy & Doorbar, 2008; Sendagorta-Cudós et al., 2019).
Agente etiológico
El VPH es un virus perteneciente a la familia de los Papillomaviridae. Se conocen más de 200 tipos diferentes de VPH, algunos de los cuales tienen el potencial de causar enfermedades, como verrugas genitales y cáncer cervical, así como otros tipos de cáncer, como el cáncer de ano, vagina, vulva, pene y orofaríngeo. Los diferentes tipos de VPH se clasifican en función de su potencial oncogénico, siendo los tipos de alto riesgo los más asociados con el desarrollo de cáncer.
Figura 28.4. El virion de VPH consta de una cápside proteica que encapsula el ADN viral. La cápside contiene proteínas estructurales L1 y L2, y en la superficie hay proyecciones proteicas. Algunos tipos de VPH tienen una envoltura lipídica. Esta estructura es esencial para la infección de células epiteliales y la transmisión del virus.
El virion de VPH está compuesto por una cápside proteica, también conocida como cápside viral, que encapsula el material genético del virus. La cápside está formada por proteínas estructurales llamadas proteínas L1 y L2, que se organizan en una estructura icosaédrica.
En el interior de la cápside, se encuentra el genoma del VPH, que consiste en una doble cadena de ADN circular. El genoma contiene los genes necesarios para la replicación y la producción de proteínas virales.
En la superficie de la cápside, hay proyecciones proteicas llamadas epítopos neutralizantes, que son importantes para la interacción del virus con las células huésped y la respuesta inmunitaria.
El virion de VPH también puede tener una envoltura lipídica que lo rodea, pero no todos los tipos de VPH la poseen. La presencia de la envoltura puede variar según el tipo de VPH y su capacidad de infectar diferentes tejidos (Davy & Doorbar, 2008; Sendagorta-Cudós et al., 2019).
Ciclo de vida y etapas de la enfermedad
El ciclo de vida del VPH es complejo y se lleva a cabo en las células epiteliales de la piel y las mucosas. Después de la infección, el virus ingresa a las células y comienza a multiplicarse. En algunos casos, el sistema inmunológico del huésped puede eliminar la infección por sí solo. Sin embargo, en otros casos, el virus puede persistir y provocar cambios en las células, lo que puede dar lugar a la aparición de verrugas o al desarrollo de lesiones precancerosas y cáncer (Davy & Doorbar, 2008; Sendagorta-Cudós et al., 2019).
Síntomas
En la mayoría de los casos, las infecciones por VPH no causan síntomas evidentes y pueden pasar desapercibidas. Sin embargo, en algunos casos, pueden aparecer verrugas genitales visibles en los genitales o alrededor del ano. Estas verrugas pueden ser pequeñas o grandes, únicas o múltiples, y pueden causar picazón o molestias. En el caso de las infecciones por VPH de alto riesgo que afectan al cuello uterino, no se presentan síntomas evidentes hasta que se desarrolla un cáncer cervical en etapas avanzadas (Davy & Doorbar, 2008; Sendagorta-Cudós et al., 2019).
Prevención
La prevención del VPH se basa en medidas de educación sexual, vacunación y detección temprana. La vacuna contra el VPH está disponible y se recomienda para niños y niñas antes de la exposición al virus. También es importante promover el uso de preservativos durante las relaciones sexuales y mantener una buena higiene personal. Además, las pruebas de detección, como la prueba de Papanicolaou y la prueba de detección del VPH, son fundamentales para detectar lesiones precancerosas o cáncer cervical en etapas tempranas (Davy & Doorbar, 2008; Sendagorta-Cudós et al., 2019).
Tratamiento
No existe un tratamiento específico para eliminar el VPH por completo. Sin embargo, las verrugas genitales pueden ser tratadas mediante la aplicación de medicamentos tópicos, la crioterapia, la electrocauterización u otros procedimientos médicos. En el caso de lesiones precancerosas o cáncer cervical, se pueden realizar diversos tratamientos, como la extirpación quirúrgica, la radioterapia o la quimioterapia, dependiendo del estadio y la gravedad de la enfermedad (Davy & Doorbar, 2008; Sendagorta-Cudós et al., 2019).
Epidemiología
El VPH es una infección común en todo el mundo. Se estima que millones de personas están infectadas con VPH en algún momento de sus vidas. La prevalencia del VPH varía según la región geográfica y los grupos de edad, y se cree que alrededor del 80% de las personas sexualmente activas adquirirán una infección por VPH en algún momento de su vida. Además, se estima que el VPH es responsable de la mayoría de los casos de cáncer cervical en mujeres, así como de otros tipos de cáncer relacionados (Davy & Doorbar, 2008; Sendagorta-Cudós et al., 2019).
29. Hepatitis
29. Hepatitis
Las hepatitis transmitidas sexualmente son infecciones del hígado que se adquieren principalmente a través de prácticas sexuales sin protección. En este artículo, exploraremos en detalle la historia de estas infecciones, los agentes etiológicos responsables, el ciclo de vida y las etapas de la enfermedad, los síntomas característicos, las medidas de prevención y los tratamientos disponibles. Además, examinaremos la epidemiología global de estas infecciones y su impacto en la salud pública (Mauss et al., 2010; Willson, 1997).
Historia
Las hepatitis transmitidas sexualmente han sido objeto de estudio durante décadas, y numerosos científicos han contribuido significativamente en la comprensión y el manejo de estas infecciones.
Uno de los científicos destacados en este campo es Baruch S. Blumberg, quien en 1967 descubrió el antígeno de superficie del virus de la hepatitis B (HBsAg), un hallazgo fundamental que permitió el desarrollo de pruebas de diagnóstico y vacunas contra la hepatitis B. Gracias a su trabajo, se logró reducir drásticamente la transmisión de esta enfermedad.
Figura 29.1. Baruch S. Blumberg fue un científico estadounidense nacido el 28 de julio de 1925 en Nueva York. Se destacó por sus contribuciones en el campo de la medicina y la investigación de enfermedades infecciosas. En 1967, descubrió el antígeno de superficie del virus de la hepatitis B (HBsAg), lo que le valió el Premio Nobel de Fisiología o Medicina en 1976. Su descubrimiento sentó las bases para el desarrollo de pruebas de diagnóstico y vacunas contra la hepatitis B. Además de su trabajo en hepatitis B, Blumberg también hizo importantes contribuciones en el campo de la genética y la inmunología. Falleció el 5 de abril de 2011.
En cuanto a la hepatitis C, el virus fue identificado en 1989 por Michael Houghton y su equipo de investigación. Su descubrimiento fue un hito importante, ya que permitió el desarrollo de pruebas de detección del virus y la comprensión de su epidemiología. Posteriormente, Charles M. Rice y su equipo lograron replicar el virus de la hepatitis C en el laboratorio, lo que sentó las bases para el desarrollo de nuevos tratamientos.
En términos de prevención, el desarrollo de vacunas ha sido un avance crucial en la lucha contra la hepatitis B. La vacuna contra el VHB, basada en la proteína del antígeno de superficie, fue introducida en la década de 1980 y ha demostrado ser altamente efectiva en la prevención de la infección.
Figura 29.2. Michael Houghton es un científico británico nacido el 1949 en Reino Unido. Es reconocido por su destacada contribución en el campo de la medicina y la investigación de enfermedades virales. En 1989, lideró un equipo de científicos que logró identificar y secuenciar el genoma del virus de la hepatitis C (VHC). Este descubrimiento permitió el desarrollo de pruebas de diagnóstico precisas y eficientes, así como el diseño de terapias antivirales efectivas contra la hepatitis C. Por su invaluable aporte, Houghton recibió el Premio Nobel de Fisiología o Medicina en 2020. Actualmente, continúa su investigación en enfermedades virales y su impacto en la salud global.
En el caso de la hepatitis C, los avances en el diagnóstico han sido fundamentales para identificar a las personas infectadas y proporcionarles el tratamiento adecuado. Se han desarrollado pruebas altamente sensibles para detectar la presencia de anticuerpos y ácidos nucleicos del virus, lo que ha permitido un diagnóstico temprano y un seguimiento de la progresión de la enfermedad.
En términos de tratamiento, la hepatitis C ha experimentado un avance significativo con la introducción de los antivirales de acción directa (AAD). Estos medicamentos, como los inhibidores de la proteasa y los inhibidores de la polimerasa, han demostrado una alta tasa de curación en pacientes infectados con hepatitis C crónica. Este avance ha revolucionado el manejo de la enfermedad y ha brindado esperanza a millones de personas en todo el mundo (Mauss et al., 2010; Willson, 1997).
Agentes Etiológicos
El VHB y el VHC son los principales agentes etiológicos de las hepatitis transmitidas sexualmente.
(a) Virus de la Hepatitis B (VHB): Este virus pertenece a la familia Hepadnaviridae y se transmite a través de los fluidos corporales, como la sangre, el semen y los fluidos vaginales. El VHB puede sobrevivir fuera del cuerpo durante períodos prolongados y puede transmitirse a través de prácticas sexuales sin protección, compartir agujas contaminadas, transfusiones de sangre no seguras y de madre a hijo durante el parto.
(b) Virus de la Hepatitis C (VHC): Pertenece a la familia Flaviviridae y se transmite principalmente a través del contacto directo con la sangre infectada. Aunque la transmisión sexual del VHC es menos común que la del VHB, sigue siendo una vía importante de infección, especialmente en personas con múltiples parejas sexuales o prácticas sexuales de alto riesgo (Mauss et al., 2010; Willson, 1997).
Ciclo de Vida y Etapas de la Enfermedad
El ciclo de vida del VHB y el VHC implica la entrada del virus en las células del hígado, su replicación y la liberación de nuevas partículas virales al torrente sanguíneo. Estos virus pueden causar infecciones agudas o crónicas.
(a) Hepatitis B: La infección aguda por VHB puede ser asintomática o manifestarse como una enfermedad similar a la gripe. En algunos casos, la infección aguda puede resolverse espontáneamente, pero en otros puede progresar a una infección crónica, que aumenta el riesgo de complicaciones hepáticas graves, como cirrosis y cáncer de hígado.
Figura 29.3. El virión del virus de la hepatitis B (VHB) es una partícula esférica compuesta por diferentes componentes. Está formado por una cápside central, llamada core, que contiene el material genético del virus, conocido como ADN viral. Esta cápside está rodeada por una envoltura lipídica que contiene proteínas de superficie denominadas antígenos de superficie del virus de la hepatitis B (HBsAg). Estos antígenos son esenciales para la entrada del virus en las células hepáticas. Además, el virión puede contener otras proteínas virales, como la polimerasa del virus de la hepatitis B (HBV DNA polimerasa). La estructura del virión del VHB es crucial para su capacidad de infectar y replicarse en las células hepáticas.
(b) Hepatitis C: La infección aguda por VHC también puede ser asintomática o presentar síntomas leves. Sin embargo, la mayoría de las infecciones por VHC se vuelven crónicas, lo que aumenta el riesgo de cirrosis hepática y cáncer de hígado a lo largo del tiempo.
Figura 29.4. El virión del virus de la hepatitis C (VHC) es una partícula esférica compuesta por diferentes componentes. En su núcleo, contiene un único fragmento de ARN viral que contiene toda la información genética del virus. Alrededor del núcleo, se encuentra una cápside proteica que protege el ARN viral. La cápside está rodeada por una envoltura lipídica que contiene proteínas de superficie llamadas E1 y E2, que son esenciales para la entrada del virus en las células hepáticas. Además, el virión puede contener otras proteínas virales, como NS3, NS4 y NS5A, que desempeñan roles importantes en la replicación y propagación del virus. La estructura del virión del VHC es fundamental para su capacidad de infectar las células hepáticas y causar la infección crónica de la hepatitis C.
Síntomas
Los síntomas de las hepatitis transmitidas sexualmente pueden variar desde leves hasta graves. En las etapas agudas, pueden incluir fatiga, fiebre, dolores musculares, ictericia (coloración amarillenta de la piel y los ojos), pérdida de apetito y malestar general. En las etapas crónicas, los síntomas pueden ser menos evidentes, pero pueden incluir fatiga persistente, dolor abdominal, pérdida de peso inexplicada y síntomas de daño hepático (Mauss et al., 2010; Willson, 1997).
Prevención
La prevención de las hepatitis transmitidas sexualmente se basa en la adopción de medidas de protección durante las relaciones sexuales. Algunas recomendaciones clave incluyen:
(a) Uso de preservativos: El uso correcto y consistente de condones reduce significativamente el riesgo de transmisión de las hepatitis transmitidas sexualmente.
(b) Prácticas sexuales seguras: Evitar el contacto directo con sangre y otros fluidos corporales durante las relaciones sexuales, así como la compartición de agujas y otros equipos de inyección.
(c) Vacunación: La vacuna contra la hepatitis B está ampliamente disponible y se recomienda como parte de los programas de inmunización. Vacunarse puede prevenir la infección por el VHB y sus complicaciones.
(d) Pruebas de detección: Es importante realizarse pruebas de detección regularmente, especialmente si se ha tenido una exposición de riesgo, para detectar y tratar tempranamente las infecciones por VHB y VHC.
Tratamiento
El tratamiento de las hepatitis transmitidas sexualmente se basa en el tipo de infección y su estado (aguda o crónica). Actualmente, existen terapias antivirales efectivas disponibles para el tratamiento de la hepatitis B y la hepatitis C. Estos tratamientos tienen como objetivo suprimir la replicación viral, prevenir la progresión de la enfermedad y reducir el riesgo de complicaciones hepáticas (Mauss et al., 2010; Willson, 1997).
Epidemiología
La carga de las hepatitis transmitidas sexualmente varía en todo el mundo. Se estima que hay millones de personas infectadas con hepatitis B y hepatitis C en todo el mundo. La prevalencia y la incidencia de estas infecciones son más altas en áreas con altas tasas de infecciones de transmisión sexual y prácticas de salud menos seguras. En América y Colombia, las hepatitis transmitidas sexualmente también representan un desafío de salud pública, y es importante implementar estrategias de prevención, educación y acceso a pruebas y tratamientos efectivos (Mauss et al., 2010; Willson, 1997).
30. Tricomonas
30. Tricomonas
La tricomoniasis es una infección de transmisión sexual (ITS) causada por un parásito protozoario llamado Trichomonas vaginalis. En este artículo, exploraremos en detalle la tricomoniasis, incluyendo su historia, el agente etiológico involucrado, el ciclo de vida del parásito, las etapas de la enfermedad, los síntomas, las medidas de prevención y las opciones de tratamiento disponibles (Coudray & Madhivanan, 2020; Riestra, de Miguel, Dessi, Simoes-Barbosa, & Mercer, 2022; Van Gerwen, Camino, Sharma, Kissinger, & Muzny, 2021).
Historia
La tricomoniasis ha sido objeto de estudio por parte de numerosos científicos a lo largo de la historia. Uno de los principales hitos en su investigación fue el descubrimiento y aislamiento del parásito Trichomonas vaginalis, responsable de la infección. Este importante avance se produjo en el siglo XX.
En 1836, el médico francés Alfred Donne realizó la primera descripción de las características microscópicas del parásito, sentando las bases para su estudio y diagnóstico. Sus observaciones permitieron identificar las características distintivas de Trichomonas vaginalis y diferenciarlo de otros organismos similares.
Figura 30.1. Alfred François Donné fue un médico y científico francés nacido en 1801. Es conocido por sus contribuciones en el campo de la microbiología y la parasitología. En 1836, realizó la primera descripción detallada de Trichomonas vaginalis, el parásito responsable de la tricomoniasis. Sus estudios microscópicos permitieron identificar las características distintivas de este organismo y sentaron las bases para su posterior estudio y diagnóstico. Además de sus investigaciones sobre Trichomonas vaginalis, Donné también realizó importantes contribuciones en el campo de la hematología y la histología. Sus trabajos pioneros sentaron las bases para el posterior desarrollo de la microbiología médica.
Posteriormente, se han realizado numerosos estudios para comprender mejor la biología y la patogenia de Trichomonas vaginalis, así como para desarrollar métodos más precisos de diagnóstico. En la década de 1970, se introdujo la técnica de cultivo in vitro del parásito, lo que permitió un mayor estudio de sus propiedades biológicas.
En términos de tratamiento, a lo largo de los años se han investigado diferentes opciones terapéuticas. En la década de 1940, se introdujo el uso de compuestos a base de nitroimidazoles, como el metronidazol, que demostraron ser efectivos contra Trichomonas vaginalis. Estos medicamentos siguen siendo la terapia estándar en la actualidad.
En cuanto al diagnóstico, se han desarrollado diversas técnicas para detectar la presencia del parásito. En la década de 1950, se comenzaron a utilizar técnicas de microscopía de contraste de fase para visualizar los organismos en muestras clínicas. Posteriormente, se introdujeron métodos de cultivo en medios específicos y técnicas de detección molecular, como la reacción en cadena de la polimerasa (PCR), que permiten una mayor sensibilidad y especificidad en el diagnóstico.
Científicos como John Schwebke y Patricia Kissinger han contribuido significativamente al estudio de la tricomoniasis, investigando la epidemiología, el manejo clínico y la prevención de la enfermedad. Sus investigaciones han ayudado a mejorar la comprensión de la tricomoniasis y han proporcionado información crucial para su tratamiento y control (Coudray & Madhivanan, 2020; Riestra et al., 2022; Van Gerwen et al., 2021).
Agente Etiológico
El agente etiológico de la tricomoniasis es el protozoario unicelular Trichomonas vaginalis. Este organismo es de forma ovalada y flagelada, lo que le permite moverse activamente en ambientes húmedos, como el tracto genital femenino y el tracto urinario masculino. Trichomonas vaginalis no tiene capacidad para formar quistes o sobrevivir fuera del cuerpo humano durante mucho tiempo, por lo que la transmisión generalmente ocurre a través de contacto sexual directo.
Figura 30.2. La célula de Trichomonas vaginalis es un parásito flagelado unicelular que presenta una forma ovalada o piriforme. Está rodeada por una membrana plasmática que le brinda protección y permite el intercambio de sustancias. En su interior, se encuentra el núcleo, que contiene el material genético de la célula. Además, cuenta con múltiples flagelos que se extienden desde su superficie y le permiten la movilidad. Carece de una pared celular rígida y posee un aparato de Golgi bien desarrollado, así como vesículas, gránulos de secreción y mitocondrias. Esta estructura le permite adaptarse y sobrevivir en el tracto genital humano.
La célula de Trichomonas vaginalis es un organismo unicelular que pertenece al grupo de los parásitos flagelados. Tiene una forma ovalada o piriforme y está cubierta por una membrana plasmática que le confiere protección y permite el intercambio de sustancias con el entorno. En el interior de la célula, se encuentra el núcleo, que contiene el material genético de la célula y controla sus funciones vitales. El citoplasma ocupa la mayor parte de la célula y está compuesto por un citosol gelatinoso donde se encuentran diversos orgánulos celulares. Uno de los orgánulos más característicos de Trichomonas vaginalis son los flagelos. Esta célula tiene múltiples flagelos que se extienden desde su superficie y le permiten moverse de manera rápida y flexible. Los flagelos son estructuras filamentosas que se mueven mediante ondas de movimiento y permiten la locomoción del parásito. Además, la célula de Trichomonas vaginalis presenta un aparato de Golgi bien desarrollado que desempeña un papel importante en la síntesis y modificación de proteínas. También se pueden observar vesículas, gránulos de secreción y mitocondrias en su interior. Es importante destacar que Trichomonas vaginalis carece de una pared celular rígida, lo que la diferencia de otros organismos. Esto le confiere la capacidad de adaptarse y sobrevivir en diferentes ambientes, incluido el tracto genital humano (Coudray & Madhivanan, 2020; Riestra et al., 2022; Van Gerwen et al., 2021).
Ciclo de Vida
El ciclo de vida de Trichomonas vaginalis consta de dos formas principales: la forma vegetativa y la forma quística. En la forma vegetativa, el parásito se encuentra en el tracto genital de hombres y mujeres, donde se adhiere a las células epiteliales y se alimenta de los nutrientes disponibles. Durante la reproducción, el parásito se divide por fisión binaria, lo que resulta en una mayor carga de parásitos en el huésped.
En ciertas condiciones ambientales desfavorables, Trichomonas vaginalis puede transformarse en su forma quística. Estas quistes son resistentes y pueden sobrevivir fuera del cuerpo durante un tiempo limitado. Sin embargo, para reiniciar el ciclo de vida, los quistes deben ingresar al tracto genital de otro huésped mediante el contacto sexual (Coudray & Madhivanan, 2020; Riestra et al., 2022; Van Gerwen et al., 2021).
Etapas de la Enfermedad
La tricomoniasis se caracteriza por varias etapas de la enfermedad. En la etapa inicial, la infección puede ser asintomática, lo que dificulta su detección temprana. Sin embargo, a medida que la infección progresa, pueden aparecer síntomas específicos. En las mujeres, estos síntomas incluyen flujo vaginal abundante, maloliente y de color verde amarillento, picazón, ardor durante la micción y dolor durante las relaciones sexuales. En los hombres, los síntomas son generalmente menos pronunciados y pueden incluir picazón, ardor durante la micción y secreción uretral.
La tricomoniasis también puede tener complicaciones en ambos sexos. En las mujeres, la infección puede aumentar el riesgo de enfermedad inflamatoria pélvica, embarazo ectópico y parto prematuro. En los hombres, la tricomoniasis puede causar inflamación del tracto urinario y la próstata (Coudray & Madhivanan, 2020; Riestra et al., 2022; Van Gerwen et al., 2021).
Prevención
La prevención de la tricomoniasis se basa en prácticas sexuales seguras. El uso correcto y constante de preservativos puede reducir significativamente el riesgo de transmisión de la enfermedad. Además, limitar el número de parejas sexuales y elegir parejas sexuales que se hayan sometido a pruebas y estén libres de la infección también puede ayudar a prevenir la tricomoniasis.
Es importante destacar que la tricomoniasis puede transmitirse incluso sin la presencia de síntomas visibles. Por lo tanto, es esencial someterse a pruebas regulares de detección de ITS, especialmente si se ha tenido actividad sexual de riesgo o si se sospecha de una posible exposición a la infección (Coudray & Madhivanan, 2020; Riestra et al., 2022; Van Gerwen et al., 2021).
Tratamiento
El tratamiento de la tricomoniasis generalmente implica el uso de medicamentos antiparasitarios, como el metronidazol o el tinidazol. Estos medicamentos se administran por vía oral y son efectivos para eliminar el parásito del cuerpo. Es importante seguir el régimen de tratamiento completo según lo prescrito por un médico, incluso si los síntomas desaparecen antes de finalizar el tratamiento.
Además, se recomienda que las parejas sexuales también sean tratadas simultáneamente para evitar la reinfestación y la transmisión continua de la infección (Coudray & Madhivanan, 2020; Riestra et al., 2022; Van Gerwen et al., 2021).
31. Desordenes reproductivos masculinos
31. Desordenes reproductivos masculinos
Las disfunciones reproductivas masculinas pueden ser causadas por trastornos endocrinos, alteraciones morfológicas en el tracto reproductivo, neuropatología y mutaciones genéticas. Varias pruebas médicas, incluidos los niveles de hormonas séricas, el examen físico de los órganos reproductivos y el conteo de espermatozoides, son importantes para determinar las causas de las disfunciones reproductivas.
Hipogonadismo
El hipogonadismo conduce a una disminución de la actividad funcional de las gónadas y puede deberse a varios defectos. El hipogonadismo masculino puede ser el resultado de defectos en la espermatogénesis, esteroidogénesis o ambos. Puede ser un defecto primario en los testículos o secundario a la disfunción hipotalámica-pituitaria, y determinar si el inicio de la falla gonadal ocurrió antes o después de la pubertad es importante para establecer la causa. Sin embargo, se deben considerar varios factores. Primero, la espermatogénesis normal casi nunca ocurre con esteroidogénesis defectuosa, pero la esteroidogénesis normal puede estar presente con espermatogénesis defectuosa. En segundo lugar, la insuficiencia testicular primaria elimina la inhibición de la retroalimentación del eje hipotalámico-hipofisario, lo que da como resultado un aumento de las gonadotropinas en plasma. Por el contrario, la disminución de los niveles de gonadotropina y esteroides y el tamaño testicular reducido casi siempre acompañan a la falla hipotalámica y / o hipofisaria. La falla gonadal antes de la pubertad da como resultado la ausencia de características sexuales secundarias, creando una presentación clínica distintiva llamada eunucoidismo. Por el contrario, los hombres con insuficiencia testicular pospuberal conservan rasgos masculinos, pero exhiben recuentos bajos de espermatozoides o una capacidad reducida para producir espermatozoides funcionales.
Para establecer la (s) causa (s) de la disfunción reproductiva, se realizan exámenes físicos e historial médico, análisis de semen, determinaciones hormonales, pruebas de estimulación hormonal y análisis genético. El examen físico debe establecer si las características eunucoidales (es decir, la apariencia infantil de los genitales externos y el desarrollo deficiente o ausente de las características sexuales secundarias) están presentes. En los hombres con disfunción reproductiva de inicio en la edad adulta, el examen físico puede descubrir problemas como la criptorquidia (testículos no descendientes), lesión testicular, varicocele (una anormalidad de la vasculatura espermática), tumores testiculares, inflamación prostática o ginecomastia. Los antecedentes médicos y familiares ayudan a determinar la pubertad tardía, la anosmia (incapacidad para oler, a menudo asociada con disfunción de GnRH), fertilidad previa, cambios en el rendimiento sexual, trastornos eyaculatorios o impotencia (incapacidad para lograr o mantener la erección).
Un paso en la evaluación de la fertilidad es el análisis de semen. El semen se analiza en muestras recolectadas después de 3 a 5 días de abstinencia sexual, ya que el número de espermatozoides eyaculados permanece bajo durante un par de días después de la eyaculación. El examen inicial incluye la determinación de la viscosidad, la licuefacción y el volumen de semen. Luego se cuentan los espermatozoides y se puntúa el porcentaje de espermatozoides que muestran motilidad hacia adelante. Los espermatozoides se evalúan morfológicamente, con atención a la configuración anormal de la cabeza y las colas defectuosas. El análisis químico puede proporcionar información sobre la actividad secretora de las glándulas accesorias, que se considera anormal si el volumen de semen es demasiado bajo o la motilidad de los espermatozoides está alterada. Los niveles de fructosa y prostaglandina se determinan para evaluar la función de las vesículas seminales y los niveles de zinc, magnesio y fosfatasa ácida para evaluar la próstata. Los términos utilizados para evaluar la fertilidad incluyen aspermia (sin semen), hipospermia e hiperspermia (volumen de semen demasiado pequeño o demasiado grande), azoospermia (sin espermatozoides) y oligozoospermia (número reducido de espermatozoides).
Los análisis de testosterona sérica, estradiol, LH y FSH se realizan mediante radioinmunoensayos. Se deben medir los niveles de testosterona libre y total; Debido a la naturaleza pulsátil de la liberación de LH, se necesitan varias muestras de sangre consecutivas. Las pruebas de estimulación hormonal dinámica son más valiosas para establecer el sitio de anormalidad. Una falla en el aumento de la liberación de LH en el tratamiento con clomifeno, un antiestrógeno, probablemente indica una anormalidad hipotalámica. El clomifeno bloquea los efectos inhibitorios del estrógeno y la testosterona en la liberación endógena de GnRH. La ausencia o aumento de la testosterona después de la inyección de hCG sugiere un defecto testicular primario. El análisis genético se utiliza cuando se sospechan defectos congénitos. El cariotipo de linfocitos periféricos cultivados o la detección directa de antígenos Y específicos en las superficies celulares pueden revelar la presencia del cromosoma Y.
Desordenes hormonales
La mayoría de los trastornos reproductivos masculinos están relacionados con estados hipogonadotróficos o hipergonadotróficos. Los factores endocrinos son responsables de aproximadamente el 50% de los casos hipogonadales o de infertilidad. Los restantes son de etiología desconocida o el resultado de lesiones, deformidades y factores ambientales. El hipogonadismo relacionado con el endocrino puede clasificarse como defectos hipotalámicos-hipofisarios (hipogonadotróficos debido a la falta de LH y / o FSH), defectos gonadales primarios (hipergonadotróficos porque las gonadotropinas son altas como resultado de la falta de retroalimentación negativa de los testículos), y acción androgénica defectuosa (generalmente el resultado de la ausencia de receptores de andrógenos o 5a-reductasa). Cada uno de estos se subdivide en varias categorías, pero aquí solo se analizan algunos ejemplos.
Hipogonadismo hipogonadotrífico
Puede ser congénito, idiopático o adquirido. La forma congénita más común es el síndrome de Kallmann, que resulta de una secreción disminuida o ausente de GnRH, como se mencionó anteriormente. A menudo se asocia con anosmia o hiposmia y se transmite como un rasgo autosómico dominante. Los pacientes no experimentan desarrollo puberal y tienen características eunuchoidales. Los niveles plasmáticos de LH, FSH y testosterona son bajos, y los testículos son inmaduros y no tienen esperma. No hay respuesta al clomifeno, pero el tratamiento intermitente con GnRH puede producir maduración sexual y espermatogénesis completa.
Falla de la pituitaria
Otra categoría de hipogonadismo hipogonadotrófico, panhipopituitarismo o insuficiencia hipofisaria, puede ocurrir antes o después de la pubertad y generalmente se acompaña de una deficiencia de otras hormonas hipofisarias. La hiperprolactinemia, ya sea por un trastorno hipotalámico o adenoma hipofisario, a menudo produce una disminución de la producción de GnRH, estado hipogonadotrófico que genera impotencia y disminución de la libido. Se puede tratar con agonistas dopaminérgicos (p. Ej., Bromocriptina), que suprimen la liberación de PRL. El exceso de andrógenos también puede provocar la supresión del eje hipotalámico-pituitario, lo que resulta en niveles más bajos de LH y una función testicular deteriorada. Esta condición a menudo resulta de hiperplasia suprarrenal congénita y aumento de la producción de andrógenos suprarrenales por deficiencia de 21-hidroxilasa (CYP21A2).
Hipogonadismo hipergonadotrífico
Suele ser el resultado de una producción de testosterona deteriorada, que puede ser congénita o adquirida. El trastorno más común es el síndrome de Klinefelter, como se discutió anteriormente.
Insensibilidad a los andrógenos
El seudohermafroditismo es una paradoja reproductiva que resulta de la insensibilidad a los andrógenos. El seudohermafroditismo produce gónadas de un sexo y los genitales del otro en la misma persona. El término pseudohermafrodita masculino se usa cuando hay un testículo presente, y el término pseudohermafrodita femenina se usa cuando hay un ovario. El término hermafrodita está reservado para los casos muy raros en los que están presentes los tejidos ováricos y testiculares. Una de las causas más interesantes de las anomalías reproductivas masculinas es la insensibilidad del órgano final a los andrógenos. El síndrome mejor caracterizado es la feminización testicular, un trastorno recesivo ligado al cromosoma X causado por un defecto en el receptor de testosterona.
En la forma clásica, los pacientes son pseudohermafroditas masculinos con un fenotipo femenino y un genotipo masculino XY. Tienen testículos abdominales que secretan testosterona pero no otros genitales internos de ninguno de los sexos. Comúnmente tienen genitales externos femeninos, pero con una vagina corta que termina en una bolsa ciega. El desarrollo de los senos es típico de una mujer (como resultado de la aromatización periférica de testosterona), pero el vello axilar y púbico, que dependen de los andrógenos, son escasos o ausentes. Los niveles de testosterona son normales o elevados, los niveles de estradiol están por encima del rango masculino normal y los niveles de gonadotropina circulante son altos. Los testículos localizados inguinalmente por lo general deben extirparse debido a un mayor riesgo de cáncer. Después de la orquiectomía, los pacientes son tratados con estradiol para mantener un fenotipo femenino.
Infertilidad
La principal causa de infertilidad masculina es la baja calidad del semen. En los hombres que tienen los órganos reproductivos necesarios para procrear, la infertilidad puede ser causada por un recuento bajo de espermatozoides debido a problemas endocrinos, medicamentos, radiación o infección. Puede haber malformaciones testiculares, desequilibrio hormonal o bloqueo del sistema de conductos del hombre. Aunque muchos de estos pueden tratarse mediante cirugía o sustituciones hormonales, algunos pueden ser indefinidos. La infertilidad asociada con espermatozoides viables pero inmóviles puede ser causada por discinesia ciliar primaria. El esperma debe proporcionar al cigoto ADN, centriolos y factor de activación para que se desarrolle el embrión. Un defecto en cualquiera de estas estructuras de esperma puede provocar infertilidad que no se detectará mediante análisis de semen. Los anticuerpos antiespermáticos causan infertilidad inmune. La fibrosis quística puede provocar infertilidad en los hombres.
32. Desordenes reproductivos femeninos
32. Desordenes reproductivos femeninos
La infertilidad afecta a una de las cinco mujeres en los Estados Unidos. Una comprensión profunda de la endocrinología, la anatomía y la fisiología femenina es fundamental para obtener información para resolver este importante problema de salud. Varios factores pueden causar infertilidad. Los factores ambientales, los trastornos del sistema nervioso central, la enfermedad hipotalámica, los trastornos hipofisarios y las anomalías ováricas pueden interferir con el desarrollo folicular y / o la ovulación. Si se produce una ovulación normal, los problemas estructurales, patológicos y / o endocrinos asociados con el oviducto y / o el útero pueden evitar la fertilización, impedir el transporte o la implantación del embrión y, en última instancia, interferir con el establecimiento o mantenimiento del embarazo.
Amenorrhea
La amenorrea puede ser el resultado de una disfunción anatómica u hormonal. Como pauta general, la amenorrea puede definirse como la ausencia de menarquia a los 16 años, o sin menstruación durante más de tres ciclos en una mujer que previamente tuvo menstruación cíclica. La amenorrea se definió clásicamente como primaria (sin menstruaciones previas) o secundaria (interrupción de la menstruación en un individuo que normalmente realiza un ciclo), pero estas distinciones ya no se recomiendan ya que pueden conducir a un error de diagnóstico. Se han desarrollado varios sistemas de clasificación para el diagnóstico de amenorrea en función de si la causa es anatómica u hormonal, hereditaria o adquirida. En los siguientes párrafos se proporcionan ejemplos de amenorrea con diferentes etiologías.
Síndrome de Turner
También llamado disgenesia gonadal, el síndrome de Turner es una anormalidad congénita causada por una no disyunción de uno de los cromosomas X, lo que resulta en un cariotipo cromosómico 45X0. Debido a que los dos cromosomas X son necesarios para el desarrollo normal de los ovarios, las mujeres con esta afección tienen gónadas rudimentarias y no tienen una pubertad normal. Debido a la deficiencia de esteroides ováricos (falta de estrógenos), las características sexuales secundarias permanecen prepúberes, y la LH y FSH en plasma están elevadas. Otras anormalidades incluyen baja estatura, cuello palmeado, coartación de la aorta y trastornos renales.
Hipogonadotrofismo
El hipogonadismo hipogonadotrópico con anosmia es similar al síndrome de Kallmann en los hombres, pero no se han identificado las mutaciones específicas en el gen Kal-1 en las mujeres, lo que sugiere que existen otras mutaciones genéticas. Los pacientes no progresan a través de la pubertad normal y tienen niveles bajos y no pulsátiles de LH y FSH. Sin embargo, pueden tener estatura normal, cariotipo femenino y anosmia. Una falla en el desarrollo del lóbulo olfativo y la deficiencia de GnRH causan el trastorno.
Falla prematura del ovario
La pérdida de ovocitos y las células de soporte circundantes antes de los 40 años de edad define la falla ovárica prematura. Los hallazgos clínicos incluyen amenorrea, niveles bajos de estrógenos y gonadotropina alta (LH y FSH). Los síntomas son similares a los de la menopausia, incluidos los sofocos y un mayor riesgo de osteoporosis. La etiología es variable, incluyendo anormalidades cromosómicas; lesiones resultantes de irradiación, quimioterapia o infecciones virales; y condiciones autoinmunes
Síndrome del ovario poliquistico
Este síndrome tiene una variedad de presentaciones, pero generalmente se caracteriza por anovulación, amenorrea y altos niveles de andrógenos. La relación elevada LH / FSH, los ovarios poliquísticos, el hirsutismo y la obesidad a menudo están presentes. Aunque se desconoce la etiología, la producción excesiva de andrógenos suprarrenales puede iniciar el síndrome durante la pubertad o después del estrés que trastorna la secreción del eje hipotalámico-hipofisario de LH. La insulina elevada debido a la resistencia a la insulina en sujetos obesos también puede causar hiperandrogenismo. Los andrógenos se convierten periféricamente en estrógenos y estimulan la liberación de LH. El exceso de LH, a su vez, aumenta la producción de andrógenos del estroma ovárico y tecal, lo que da como resultado una maduración folicular deteriorada. Los ovarios estimulados por LH están agrandados y contienen muchos folículos pequeños y células teca hiperplásicas y luteinizadas (el sitio de los receptores de LH). Los niveles elevados de andrógenos en plasma causan hirsutismo, aumento de la actividad de las glándulas sebáceas e hipertrofia del clítoris, que son signos de virilización en las mujeres.
Hiperprolactilemia
La secreción elevada de prolactina (PRL) de la hipófisis es una causa común de amenorrea y a menudo se asocia con galactorrea, una secreción persistente similar a la leche del pezón en mujeres no lactantes (que también ocurre en hombres). Los prolactinomas hipofisarios representan aproximadamente el 50% de los casos. Otras causas son los trastornos hipotalámicos, el trauma en el tallo hipofisario y los medicamentos psicotrópicos, todos los cuales están asociados con una reducción en la liberación de dopamina, lo que resulta en una mayor secreción de PRL. El hipotiroidismo, la insuficiencia renal crónica y la cirrosis hepática son causas adicionales de hiperprolactinemia. En algunas formas de hipotiroidismo, se cree que el aumento de la hormona liberadora de tirotropina hipotalámica (TRH) contribuye al exceso de secreción de PRL, ya que los estudios experimentales revelan que la TRH exógena aumenta la secreción de PRL. El mecanismo por el cual los niveles elevados de PRL suprimen la ovulación no está del todo claros, pero parece que la supresión de la liberación de GnRH es un mecanismo primario.
Triada atlética y anorexia nerviosa
El ejercicio excesivo y los factores nutricionales, psicológicos y sociales pueden causar amenorrea. La tríada atlética femenina, caracterizada por trastornos alimentarios, amenorrea y osteoporosis, ocurre en atletas y bailarines competitivos. Se cree que dos factores principales son responsables: un bajo nivel de grasa corporal y el efecto del estrés en sí mismo a través de las endorfinas que se sabe que inhiben la secreción de LH. Se sabe que otros tipos de estrés, como la reubicación, los exámenes universitarios, las enfermedades generales y las presiones relacionadas con el trabajo, inducen amenorrea. La anorexia nerviosa es un trastorno conductual severo asociado con una dieta constante para lograr un hábito de cuerpo delgado. La afección se caracteriza por desnutrición extrema y cambios endocrinos secundarios a trastornos psicológicos y nutricionales. La amenorrea puede no aliviarse inmediatamente con el aumento de peso.
Tratamiento para la infertilidad femenina
El diagnóstico y el tratamiento de la amenorrea presentan un problema desafiante. Después de descartar el embarazo, la lactancia y la menopausia como la causa, el siguiente paso es determinar si el trastorno se origina en el hipotálamo y el sistema nervioso central, la hipófisis anterior, el ovario o el tracto reproductivo.
Varios tratamientos pueden aliviar los problemas de infertilidad. Por ejemplo, se ha logrado cierto éxito en la enfermedad hipotalámica con la administración pulsátil de GnRH. Cuando el hipogonadotropismo es la causa de infertilidad, la administración secuencial de FSH y hCG es un tratamiento común para inducir la ovulación, aunque aumenta el riesgo de hiperestimulación ovárica y ovulaciones múltiples. La hiperprolactinemia puede tratarse quirúrgicamente mediante la eliminación del adenoma hipofisario que contiene numerosos lactotrofos (células secretoras de prolactina). También se puede tratar farmacológicamente con bromocriptina, un agonista dopaminérgico que reduce el tamaño y el número de lactótrofos y la secreción de PRL. El tratamiento con clomifeno, un antiestrógeno que se une y bloquea los receptores de estrógenos, puede inducir la ovulación en mujeres con estrógenos endógenos en el rango normal. El clomifeno reduce los efectos de retroalimentación negativa del estrógeno y, por lo tanto, aumenta la secreción endógena de FSH y LH. Cuando las lesiones del tracto reproductivo son la causa de infertilidad, la cirugía correctiva o la fertilización in vitro es el tratamiento de elección.
33. Métodos anticonceptivos y preventivos de its
33. Métodos anticonceptivos y preventivos de its
Anticoncepción, también conocida como control de natalidad, anticonceptivos y control de la fertilidad, es el uso de métodos o dispositivos para prevenir embarazos no deseados. El control de natalidad ha sido utilizado desde tiempos antiguos, pero métodos efectivos y seguros solo estuvieron disponibles en el siglo XX. La planificación, disponibilidad y uso del control de natalidad humano se denomina planificación familiar. Algunas culturas limitan o desalientan el acceso al control de natalidad porque lo consideran moral, religiosa o políticamente indeseable (A. L. Gilbert & Hoffman, 2021).
La Organización Mundial de la Salud y los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos brindan orientación sobre la seguridad de los métodos anticonceptivos en mujeres con condiciones médicas específicas. Los métodos anticonceptivos más efectivos son la esterilización mediante vasectomía en hombres y ligadura de trompas en mujeres, dispositivos intrauterinos (DIU) y métodos anticonceptivos implantables. Esto es seguido por una serie de métodos basados en hormonas, incluyendo píldoras anticonceptivas orales, parches, anillos vaginales e inyecciones. Los métodos menos efectivos incluyen barreras físicas como condones, diafragmas y esponjas anticonceptivas, así como los métodos de conciencia de fertilidad. Los métodos menos efectivos son los espermicidas y la retirada por parte del hombre antes de la eyaculación. La esterilización, aunque es altamente efectiva, generalmente no es reversible; todos los demás métodos son reversibles, la mayoría de ellos inmediatamente después de suspender su uso. Las prácticas sexuales seguras, como el uso de condones masculinos o femeninos, también pueden ayudar a prevenir infecciones de transmisión sexual. Otros métodos de control de natalidad no protegen contra las enfermedades de transmisión sexual. El control de natalidad de emergencia puede prevenir el embarazo si se toma dentro de las 72 a 120 horas después de tener relaciones sexuales sin protección. Algunos argumentan que no tener relaciones sexuales también es una forma de control de natalidad, pero la educación sexual basada únicamente en la abstinencia puede aumentar los embarazos en adolescentes si se ofrece sin educación sobre el control de natalidad debido a la falta de cumplimiento.
Figura 33.1. Las mujeres que se embarazan a temprana edad enfrentan mayores dificultades económicas debido a la falta de estabilidad financiera y oportunidades educativas y laborales. Suelen depender más de la asistencia pública y tienen menos recursos para cubrir los gastos relacionados con el embarazo y la crianza de los hijos. Por otro lado, las mujeres que se embarazan a mayor edad, generalmente después de los treinta años, tienden a tener una mayor estabilidad financiera y acceso a mejores oportunidades laborales. Esto les permite afrontar de manera más sólida los costos económicos asociados con el embarazo y la maternidad.
En los adolescentes, los embarazos tienen un mayor riesgo de malos resultados. La educación sexual integral y el acceso al control de natalidad disminuyen la tasa de embarazos no deseados en este grupo de edad. Si bien todas las formas de control de natalidad pueden ser utilizadas generalmente por los jóvenes, los métodos anticonceptivos reversibles de acción prolongada como los implantes, los DIU o los anillos vaginales son más exitosos en la reducción de las tasas de embarazo en adolescentes. Después del parto, una mujer que no está amamantando exclusivamente puede quedar embarazada nuevamente en tan solo cuatro a seis semanas. Algunos métodos anticonceptivos pueden comenzar inmediatamente después del parto, mientras que otros requieren un retraso de hasta seis meses. En las mujeres que están amamantando, se prefieren los métodos que contienen solo progestina en lugar de las píldoras anticonceptivas orales combinadas. En las mujeres que han alcanzado la menopausia, se recomienda que el control de natalidad se continúe durante un año después del último período menstrual.
Alrededor de 222 millones de mujeres que desean evitar el embarazo en países en desarrollo no están utilizando un método moderno de control de natalidad. El uso del control de natalidad en países en desarrollo ha disminuido el número de muertes durante o alrededor del embarazo en un 40% (alrededor de 270000 muertes prevenidas en 2008) y podría prevenir el 70% si se satisficiera plenamente la demanda de control de natalidad. Al prolongar el tiempo entre embarazos, el control de natalidad puede mejorar los resultados del parto en mujeres adultas y la supervivencia de sus hijos. En el mundo en desarrollo, los ingresos, los activos y el peso de las mujeres, así como la educación y la salud de sus hijos, mejoran con un mayor acceso al control de natalidad. El control de natalidad aumenta el crecimiento económico debido a la menor cantidad de hijos dependientes, una mayor participación de las mujeres en la fuerza laboral y un menor uso de recursos escasos (A. L. Gilbert & Hoffman, 2021).
Métodos hormonales
La anticoncepción hormonal está disponible en diversas formas, que incluyen píldoras anticonceptivas orales, implantes debajo de la piel, inyecciones, parches, dispositivos intrauterinos (DIU) y anillos vaginales. Actualmente, estos métodos están disponibles solo para mujeres, aunque los anticonceptivos hormonales para hombres han sido y están siendo sometidos a pruebas clínicas. Hay dos tipos de píldoras anticonceptivas orales, las píldoras anticonceptivas orales combinadas (que contienen tanto estrógeno como progestina) y las píldoras solo de progestina (a veces llamadas minipíldoras). Si se toman durante el embarazo, ninguno de los dos aumenta el riesgo de aborto espontáneo ni causa defectos de nacimiento. Ambos tipos de píldoras anticonceptivas previenen principalmente la fertilización al inhibir la ovulación y espesar el moco cervical. También pueden alterar el revestimiento del útero y, por lo tanto, disminuir la implantación. Su efectividad depende de la adherencia del usuario al tomar las píldoras.
Los anticonceptivos hormonales combinados están asociados con un ligero aumento del riesgo de coágulos sanguíneos venosos y arteriales. Los coágulos venosos aumentan en promedio de 2.8 a 9.8 por cada 10,000 mujeres-año, lo cual sigue siendo menor que el riesgo asociado con el embarazo. Debido a este riesgo, no se recomiendan en mujeres mayores de 35 años que continúan fumando. Debido al aumento del riesgo, se incluyen en herramientas de toma de decisiones como la puntuación DASH y la regla PERC utilizadas para predecir el riesgo de coágulos sanguíneos.
El efecto en el deseo sexual es variado, con aumento o disminución en algunos casos, pero sin efecto en la mayoría. Las píldoras anticonceptivas orales combinadas reducen el riesgo de cáncer de ovario y cáncer de endometrio, y no cambian el riesgo de cáncer de mama. A menudo reducen el sangrado menstrual y los calambres menstruales dolorosos. Las dosis más bajas de estrógeno liberadas por el anillo vaginal pueden reducir el riesgo de sensibilidad en los senos, náuseas y dolores de cabeza asociados con productos con dosis más altas de estrógeno.
Figura 33.2. En Colombia, una de las hormonas más utilizadas para el control de la natalidad es la hormona progestina. La progestina es una hormona sintética similar a la progesterona, que se encuentra naturalmente en el cuerpo de la mujer y desempeña un papel importante en el ciclo menstrual y la fertilidad. La progestina se administra comúnmente en forma de píldora anticonceptiva, conocida como "píldora progestínica", que contiene solo progestina y no estrógeno. Esta píldora se toma diariamente a la misma hora para prevenir el embarazo al inhibir la ovulación y alterar el revestimiento del útero. La píldora progestínica puede ser recetada por médicos, ginecólogos y otros profesionales de la salud capacitados. También puede ser suministrada en clínicas de planificación familiar y centros de salud. Es importante destacar que el uso de la píldora progestínica como método anticonceptivo debe ser indicado y supervisado por un profesional de la salud, ya que su eficacia y seguridad pueden variar según cada individuo y sus circunstancias específicas.
Las píldoras solo de progestina, las inyecciones y los dispositivos intrauterinos no están asociados con un mayor riesgo de coágulos sanguíneos y pueden ser utilizados por mujeres con antecedentes de coágulos en las venas. En aquellas con antecedentes de coágulos sanguíneos arteriales, se debe utilizar un método anticonceptivo no hormonal o un método solo de progestina que no sea la versión inyectable. Las píldoras solo de progestina pueden mejorar los síntomas menstruales y pueden ser utilizadas por mujeres lactantes, ya que no afectan la producción de leche. Puede ocurrir sangrado irregular con los métodos solo de progestina, y algunos usuarios pueden reportar ausencia de períodos. Las progestinas drospirenona y desogestrel minimizan los efectos secundarios androgénicos, pero aumentan el riesgo de coágulos sanguíneos y, por lo tanto, no se consideran de primera línea. La tasa de fracaso en el primer año de uso perfecto de la progestina inyectable es del 0.2%, mientras que la tasa de fracaso típico es del 6% (A. L. Gilbert & Hoffman, 2021).
Métodos de barrera
Los anticonceptivos de barrera son dispositivos que intentan prevenir el embarazo al impedir físicamente que los espermatozoides entren en el útero. Incluyen condones masculinos, condones femeninos, capuchones cervicales, diafragmas y esponjas anticonceptivas con espermicida.
A nivel mundial, los condones son el método anticonceptivo más común. Los condones masculinos se colocan en el pene erecto del hombre y bloquean físicamente los espermatozoides eyaculados para que no entren en el cuerpo de la pareja sexual. Los condones modernos están hechos principalmente de látex, pero algunos están hechos de otros materiales como poliuretano o intestino de cordero. También están disponibles condones femeninos, generalmente hechos de nitrilo, látex o poliuretano. Los condones masculinos tienen la ventaja de ser económicos, fáciles de usar y tienen pocos efectos adversos. El hecho de poner condones a disposición de los adolescentes no parece afectar la edad de inicio de la actividad sexual ni su frecuencia. En Japón, aproximadamente el 80% de las parejas que utilizan anticonceptivos utilizan condones, mientras que en Alemania este número es aproximadamente del 25% y en Estados Unidos es del 18%.
Los condones masculinos y el diafragma con espermicida tienen tasas de fracaso típicas en el primer año de uso del 18% y el 12%, respectivamente. Con un uso perfecto, los condones son más efectivos, con una tasa de fracaso del 2% en el primer año, en comparación con una tasa del 6% con el diafragma. Los condones tienen el beneficio adicional de ayudar a prevenir la propagación de algunas infecciones de transmisión sexual como el VIH/SIDA, sin embargo, los condones hechos de intestino animal no ofrecen esta protección.
Figura 33.3. Los métodos de barrera son considerados los únicos eficaces en la prevención de la transmisión de infecciones de transmisión sexual (ITS) debido a su capacidad para crear una barrera física entre los fluidos corporales infectados y las áreas no infectadas del cuerpo de una pareja sexual. Los condones, por ejemplo, cubren el pene durante las relaciones sexuales, evitando así el contacto directo entre los fluidos infecciosos y las membranas mucosas o la piel. A diferencia de otros métodos anticonceptivos, como los anticonceptivos hormonales o los dispositivos intrauterinos, los métodos de barrera ofrecen una protección directa contra las ITS al evitar que los patógenos se transmitan. Pueden ayudar a prevenir la transmisión de virus como el VIH, bacterias como la gonorrea y la sífilis, así como parásitos como los piojos púbicos. Es importante destacar que los métodos de barrera deben utilizarse correctamente y de manera consistente para ser efectivos. También es recomendable combinarlos con otros métodos anticonceptivos para una protección más completa. La educación sexual y la promoción del uso de métodos de barrera son fundamentales para reducir la propagación de las ITS y promover una salud sexual y reproductiva segura.
Las esponjas anticonceptivas combinan una barrera con un espermicida. Al igual que los diafragmas, se insertan vaginalmente antes del coito y deben colocarse sobre el cuello uterino para que sean efectivas. Las tasas de fracaso típicas durante el primer año dependen de si una mujer ha dado a luz previamente, siendo del 24% en aquellas que lo han hecho y del 12% en aquellas que no lo han hecho. La esponja se puede insertar hasta 24 horas antes del coito y debe dejarse en su lugar durante al menos seis horas después. Se han reportado reacciones alérgicas y efectos adversos más graves como el síndrome de shock tóxico (A. L. Gilbert & Hoffman, 2021).
Instrumentos intrauterinos
Los dispositivos intrauterinos (DIU) actuales son pequeños dispositivos, a menudo en forma de 'T', que contienen cobre o levonorgestrel y se insertan en el útero. Son una forma de anticoncepción reversible de larga duración y son los tipos más efectivos de anticonceptivos reversibles. Las tasas de fracaso del DIU de cobre son aproximadamente del 0.8%, mientras que el DIU de levonorgestrel tiene una tasa de fracaso del 0.2% en el primer año de uso. Entre los tipos de anticonceptivos, los DIU, junto con los implantes anticonceptivos, son los que generan mayor satisfacción entre los usuarios. A partir de 2007, los DIU son la forma más ampliamente utilizada de anticoncepción reversible, con más de 180 millones de usuarios en todo el mundo.
Existen evidencias que respaldan la efectividad y seguridad de los DIU en adolescentes y en aquellas personas que han tenido hijos previamente y en aquellas que no. Los DIU no afectan la lactancia materna y pueden ser insertados inmediatamente después del parto. También pueden ser utilizados inmediatamente después de un aborto. Una vez retirados, incluso después de un uso a largo plazo, la fertilidad vuelve a la normalidad de inmediato.
Figura 33.4. Los DIU son dispositivos intrauterinos que pueden ser recetados y colocados por profesionales de la salud, como ginecólogos, obstetras o médicos de atención primaria. En Colombia, los DIU suelen estar disponibles en clínicas y hospitales, así como en algunas farmacias y centros de salud. Las marcas y modelos específicos pueden variar según la disponibilidad y las preferencias de los proveedores de atención médica.
Si bien los DIU de cobre pueden aumentar el sangrado menstrual y provocar cólicos más dolorosos, los DIU hormonales pueden reducir el sangrado menstrual o incluso detener la menstruación por completo. Los cólicos pueden tratarse con analgésicos como los medicamentos antiinflamatorios no esteroides. Otras complicaciones potenciales incluyen la expulsión del DIU (2-5%) y, raramente, la perforación del útero (menos del 0.7%). Un modelo anterior del dispositivo intrauterino (el escudo de Dalkon) se asoció con un mayor riesgo de enfermedad inflamatoria pélvica; sin embargo, el riesgo no se ve afectado con los modelos actuales en aquellas personas sin infecciones de transmisión sexual en el momento de la inserción. Los DIU parecen disminuir el riesgo de cáncer de ovario (A. L. Gilbert & Hoffman, 2021).
Esterilización
La esterilización quirúrgica está disponible en forma de ligadura de trompas para las mujeres y vasectomía para los hombres. La ligadura de trompas disminuye el riesgo de cáncer de ovario. Las complicaciones a corto plazo son veinte veces menos probables después de una vasectomía que después de una ligadura de trompas. Después de una vasectomía, puede haber hinchazón y dolor en el escroto que generalmente se resuelve en una o dos semanas. El dolor crónico en el escroto asociado con un impacto negativo en la calidad de vida ocurre después de una vasectomía en aproximadamente el 1-2% de los hombres. Con la ligadura de trompas, las complicaciones ocurren en el 1-2% de los procedimientos, y las complicaciones graves generalmente se deben a la anestesia. Ninguno de los métodos ofrece protección contra las infecciones de transmisión sexual. A veces, también se utiliza la salpingectomía para la esterilización en las mujeres.
Esterilización no quirúrgica También se han explorado métodos no quirúrgicos. Fahim et al. encontraron que la exposición al calor, especialmente el ultrasonido de alta intensidad, era efectiva tanto para la anticoncepción temporal como permanente, dependiendo de la dosis, por ejemplo, destrucción selectiva de las células germinales y células de Sertoli sin afectar las células de Leydig o los niveles de testosterona. También están disponibles métodos químicos basados en medicamentos, como la administración oral de Lonidamina, para el control temporal o permanente de la fertilidad, dependiendo de la dosis. Boris proporciona un método para inducir químicamente la esterilidad temporal o irreversible, dependiendo de la dosis: "La esterilidad permanente en hombres puede obtenerse mediante una dosis oral única que contenga aproximadamente de 18 mg/kg a 25 mg/kg".
Permanencia Esta decisión puede causar arrepentimiento en algunos hombres y mujeres. De las mujeres que se han sometido a una ligadura de trompas después de los 30 años, aproximadamente el 6% se arrepiente de su decisión, en comparación con el 20-24% de las mujeres que se esterilizaron dentro del primer año después del parto y antes de cumplir los 30 años, y el 6% en mujeres nulíparas esterilizadas antes de los 30 años. En cambio, menos del 5% de los hombres es probable que se arrepientan de la esterilización. Los hombres que tienen más probabilidades de arrepentirse de la esterilización son más jóvenes, tienen hijos pequeños o no tienen hijos, o tienen un matrimonio inestable. En una encuesta a padres biológicos, el 9% afirmó que no habrían tenido hijos si pudieran volver atrás.
Aunque la esterilización se considera un procedimiento permanente, es posible intentar una reversión de la ligadura de trompas para reconectar las trompas de Falopio o una reversión de la vasectomía para reconectar los conductos deferentes. En las mujeres, el deseo de una reversión a menudo está asociado con un cambio de esposo. Las tasas de éxito de embarazo después de una reversión de la ligadura de trompas están entre el 31% y el 88%, con complicaciones que incluyen un mayor riesgo de embarazo ectópico. El número de hombres que solicitan una reversión está entre el 2% y el 6%. Las tasas de éxito para engendrar otro hijo después de la reversión están entre el 38% y el 84%, siendo el éxito menor cuanto más tiempo haya pasado entre la vasectomía y la reversión. La extracción de esperma seguida de fertilización in vitro también puede ser una opción en los hombres (A. L. Gilbert & Hoffman, 2021).
Métodos comportamentales
Los métodos de comportamiento implican regular el momento o el método de las relaciones sexuales para evitar la introducción de espermatozoides en el tracto reproductivo femenino, ya sea por completo o cuando puede haber un óvulo presente. Si se utilizan de manera perfecta, la tasa de fracaso en el primer año puede ser de aproximadamente el 3.4%; sin embargo, si se utilizan de manera deficiente, las tasas de fracaso en el primer año pueden acercarse al 85% (A. L. Gilbert & Hoffman, 2021).
Días fértiles
Los métodos de conciencia de la fertilidad implican determinar los días más fértiles del ciclo menstrual y evitar las relaciones sexuales sin protección. Las técnicas para determinar la fertilidad incluyen monitorear la temperatura basal del cuerpo, las secreciones cervicales o el día del ciclo. Tienen tasas de fracaso típicas en el primer año del 24%; las tasas de fracaso en el primer año con uso perfecto dependen del método utilizado y oscilan entre el 0.4% y el 5%. Sin embargo, la evidencia en la que se basan estas estimaciones es pobre, ya que la mayoría de las personas en los ensayos dejan de usarlos tempranamente. A nivel mundial, son utilizados por aproximadamente el 3.6% de las parejas. Si se basa tanto en la temperatura basal del cuerpo como en otro signo principal, el método se denomina sintotérmico. Se han informado tasas de fracaso en el primer año del 20% en general y del 0.4% para el uso perfecto en estudios clínicos del método sintotérmico. Existen varias aplicaciones de seguimiento de la fertilidad disponibles, a partir de 2016, pero están diseñadas más comúnmente para ayudar a aquellos que intentan quedar embarazadas en lugar de prevenir el embarazo.
Interrupción del coito
El método de retiro (también conocido como coitus interruptus) es la práctica de interrumpir la relación sexual ("retirarse") antes de la eyaculación. El principal riesgo del método de retiro es que el hombre puede no realizar la maniobra correctamente o a tiempo. Las tasas de fracaso en el primer año varían desde el 4% con un uso perfecto hasta el 22% con un uso típico. Algunos profesionales médicos no lo consideran un método anticonceptivo.
Hay pocos datos sobre el contenido de espermatozoides en el fluido preeyaculatorio. Mientras que algunas investigaciones preliminares no encontraron espermatozoides, un estudio encontró espermatozoides presentes en 10 de 27 voluntarios. El método de retiro se utiliza como anticonceptivo por aproximadamente el 3% de las parejas.
Abstinencia
La abstinencia sexual puede ser utilizada como una forma de anticoncepción, lo que significa abstenerse de cualquier tipo de actividad sexual o específicamente abstenerse de tener relaciones sexuales vaginales, mientras se participa en otras formas de sexo no vaginal. La abstinencia sexual completa es 100% efectiva para prevenir el embarazo. Sin embargo, entre aquellos que se comprometen a abstenerse de tener relaciones sexuales antes del matrimonio, hasta el 88% de los que tienen relaciones sexuales lo hacen antes del matrimonio. La elección de abstenerse del sexo no puede proteger contra el embarazo como resultado de una violación, y los esfuerzos de salud pública que enfatizan la abstinencia para reducir el embarazo no deseado pueden tener una efectividad limitada, especialmente en países en desarrollo y entre grupos desfavorecidos.
El sexo deliberado sin penetración sin sexo vaginal o el sexo oral deliberado sin sexo vaginal también se consideran a veces como métodos anticonceptivos. Si bien esto generalmente evita el embarazo, aún puede ocurrir con el sexo intercrural y otras formas de sexo pene-cerca de la vagina (roce genital y la salida del pene de la relación anal), donde los espermatozoides pueden depositarse cerca de la entrada de la vagina y pueden viajar a lo largo de los fluidos lubricantes de la vagina.
La educación sexual basada únicamente en la abstinencia no reduce el embarazo en adolescentes. Las tasas de embarazo en adolescentes y de infecciones de transmisión sexual suelen ser iguales o más altas en los estados donde se imparte educación basada únicamente en la abstinencia en comparación con la educación sexual integral. Algunas autoridades recomiendan que aquellos que utilizan la abstinencia como método principal tengan métodos de respaldo disponibles (como condones o píldoras anticonceptivas de emergencia).
Lactancia
El método de amenorrea lactacional implica el uso de la infertilidad natural de una mujer en el posparto, que ocurre después del parto y puede ser prolongada mediante la lactancia materna. Para que una mujer en el posparto sea infértil (protegida contra el embarazo), por lo general, sus períodos aún no han regresado (no está menstruando), está amamantando exclusivamente al bebé y el bebé tiene menos de seis meses. Si la lactancia materna es la única fuente de nutrición del bebé y el bebé tiene menos de 6 meses, se estima que entre el 93% y el 99% de las mujeres están protegidas contra el embarazo en los primeros seis meses (tasa de fracaso del 0,75% al 7,5%). La tasa de fracaso aumenta al 4-7% al año y al 13% a los dos años. El uso de fórmula, extraer leche en lugar de amamantar, el uso de un chupete y la introducción de alimentos sólidos aumentan las posibilidades de quedar embarazada durante la lactancia. En aquellas que están amamantando exclusivamente, alrededor del 10% comienzan a tener períodos antes de los tres meses y el 20% antes de los seis meses. En aquellas que no están amamantando, la fertilidad puede regresar tan pronto como cuatro semanas después del parto.
Píldora del día después
Los métodos anticonceptivos de emergencia son medicamentos (a veces llamados de manera engañosa "píldoras del día después") o dispositivos utilizados después de tener relaciones sexuales sin protección con la esperanza de prevenir el embarazo. Los anticonceptivos de emergencia se administran con frecuencia a las víctimas de violación. Funcionan principalmente al prevenir la ovulación o la fertilización. Es poco probable que afecten la implantación, aunque esto no se ha excluido por completo. Existen varias opciones, incluyendo píldoras anticonceptivas de alta dosis, levonorgestrel, mifepristona, ulipristal y dispositivos intrauterinos (DIU). Suministrar píldoras anticonceptivas de emergencia a las mujeres de forma anticipada no afecta las tasas de infecciones de transmisión sexual, el uso de condones, las tasas de embarazo ni el comportamiento de riesgo sexual. Todos los métodos tienen efectos secundarios mínimos.
Las píldoras de levonorgestrel, cuando se utilizan dentro de los 3 días, reducen la probabilidad de embarazo después de un único episodio de sexo sin protección o fallo del condón en un 70% (lo que resulta en una tasa de embarazo del 2,2%). El ulipristal, cuando se utiliza dentro de los 5 días, disminuye la probabilidad de embarazo en aproximadamente un 85% (tasa de embarazo del 1,4%) y es más efectivo que el levonorgestrel. La mifepristona también es más efectiva que el levonorgestrel, mientras que los DIU de cobre son el método más efectivo. Los DIU se pueden insertar hasta cinco días después del coito y previenen aproximadamente el 99% de los embarazos después de un episodio de sexo sin protección (tasa de embarazo de 0,1% a 0,2%). Esto los convierte en la forma más efectiva de anticoncepción de emergencia. En personas con sobrepeso u obesidad, el levonorgestrel es menos efectivo y se recomienda un DIU o ulipristal.
R. Referencias bibliográficas
R. Referencias bibliográficas
(CDC, C. for D. C. (1982). A cluster of Kaposi’s sarcoma and Pneumocystis carinii pneumonia among homosexual male residents of Los Angeles and Orange Counties, California. MMWR. Morbidity and Mortality Weekly Report, 31(23), 305.
Abramov, V. (2000). BLOOD SAFETY…FOR TOO FEW. World Health Organization. Retrieved from https://web.archive.org/web/20050117092135/http://www.who.int/inf-pr-2000/en/pr2000-25.html
ABUBAKAR, A. B. (2013). ASSESSMENT OF THE PHARMACOLOGICAL INTERVENTIONS IN PREVENTION OF MOTHER TO CHILD TRANSMISSION (PMTCT) OF HIV/AIDS IN NASARA TREATMENT AND CARE CENTRE, AHMADU BELLO UNIVERSITY TEACHING HOSPITAL, ZARIA-NIGERIA.
Airhihenbuwa, C. O., Ford, C. L., & Iwelunmor, J. I. (2013). Why culture matters in health interventions lessons from HIV/AIDS stigma and NCDs. Health Education & Behavior, 1090198113487199.
Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P. (2015). Molecular biology of the cell (5th ed.). Garland Science.
Alcântara, D., Rodrigues, M. N., Franciolli, A. L. R., Da Fonseca, E. T., Silva, F. M. O., Carvalho, R. C., … Miglino, M. A. (2013). Embryonic development of endoderm in chicken (Gallus gallus domesticus). Microscopy Research and Technique, 76(8), 803.
Alonso, A. L., & Cox, D. (2015). Platelet interactions with viruses and parasites. Platelets, 26(4), 317–323.
Alonzo, A. A., & Reynolds, N. R. (1995). Stigma, HIV and AIDS: An exploration and elaboration of a stigma trajectory. Social Science & Medicine, 41(3), 303–315.
Altfeld, M., Addo, M. M., Rosenberg, E. S., Hecht, F. M., Lee, P. K., Vogel, M., … Strick, D. (2003). Influence of HLA-B57 on clinical presentation and viral control during acute HIV-1 infection. Aids, 17(18), 2581–2591.
Altman, L. (1982). CLUE FOUND ON HOMOSEXUALS’PRECANCER SYNDROME. The New York Times, 18.
Altman, L. K. (1994). AIDS Mystery That Won’t Go Away: Did a Dentist Infect 6 Patients?
Amwata, L. M. (2015). Mathematical modeling of HIV and Malaria co-infection dynamics. University of Nairobi.
Aral, S. O., Fenton, K. A., & Lipshutz, J. A. (2012). The new public health and STD/HIV prevention: personal, public and health systems approaches. Springer Science & Business Media.
Ascher, M. S., Sheppard, H. W., Winkelstein, W., & Vittinghoff, E. (1993). Does drug use cause AIDS? Nature, 362(6416), 103–104.
Asthana, S., & Oostvogels, R. (1996). Community participation in HIV prevention: problems and prospects for community-based strategies among female sex workers in Madras. Social Science & Medicine, 43(2), 133–148.
Baeten, J., & Celum, C. (2013). Systemic and topical drugs for the prevention of HIV infection: antiretroviral pre-exposure prophylaxis. Annual Review of Medicine, 64, 219.
Baggaley, R. F., Boily, M.-C., White, R. G., & Alary, M. (2006). Risk of HIV-1 transmission for parenteral exposure and blood transfusion: a systematic review and meta-analysis. Aids, 20(6), 805–812.
Barre-Sinoussi, F., Chermann, J. C., Rey, F., Nugeyre, M. T., Chamaret, S., Gruest, J., & Dauguet, C. (1983). Isolation of T-lymphotropic retrovirus from a patient at risk for acquired immune defficiency syndrome (AIDS). Science, 220(4599), 868–871.
Belk, C., & Maier, V. B. (2013). Biology Science for Life with physiology. (Pearson, Ed.) (4th ed.).
Berta, A., Sumich, J. L., & Kovacs, K. M. (2015). Marine mammals: evolutionary biology. Academic Press.
Beyrer, C., Baral, S. D., van Griensven, F., Goodreau, S. M., Chariyalertsak, S., Wirtz, A. L., & Brookmeyer, R. (2012). Global epidemiology of HIV infection in men who have sex with men. The Lancet, 380(9839), 367–377.
Blattner, W., Gallo, R. C., & Temin, H. M. (1988). Hiv causes AIDS. Science, 241(4865), 515–516.
Bockarie, M. J., & Paru, R. (1996). Can mosquitoes transmit AIDS? PAPUA NEW GUINEA MEDICAL JOURNAL, 39, 205–207.
Boily, M.-C., Baggaley, R. F., Wang, L., Masse, B., White, R. G., Hayes, R. J., & Alary, M. (2009). Heterosexual risk of HIV-1 infection per sexual act: systematic review and meta-analysis of observational studies. The Lancet Infectious Diseases, 9(2), 118–129.
Breitschwerdt, E. B., Linder, K. L., Day, M. J., Maggi, R. G., Chomel, B. B., & Kempf, V. A. J. (2013). Koch’s postulates and the pathogenesis of comparative infectious disease causation associated with Bartonella species. Journal of Comparative Pathology, 148(2), 115–125.
Broder, S. (2010). The development of antiretroviral therapy and its impact on the HIV-1/AIDS pandemic. Antiviral Research, 85(1), 1–18.
Brown, A. J. L. (1991). Sequence variability in human immunodeficiency viruses: pattern and process in viral evolution. AIDS, 5, 35–42.
Broz, D., Wejnert, C., Pham, H. T., DiNenno, E., Heffelfinger, J. D., Cribbin, M., … Paz-Bailey, G. (2014). HIV infection and risk, prevention, and testing behaviors among injecting drug users—National HIV Behavioral Surveillance System, 20 US cities, 2009. MMWR Surveill Summ, 63(6), 1–51.
Brusca, R., Brusca, G. J., & Haver, N. J. (2003). Invertebrates (2nd ed.). Sinauer Associates.
Byrd, A. L., & Segre, J. A. (2016). Adapting Koch’s postulates. Science, 351(6270), 224–226.
Cainelli, F. (2013). Hepatitis C virus and human immunodeficiency virus transmission routes: Differences and similarities. World Journal of Hepatology, 5(5), 234.
Cameron, D. W., D’Costa, L., Maitha, G., Cheang, M., Piot, P., Simonsen, J. N., … Brunham, R. (1989). Female to male transmission of human immunodeficiency virus type 1: risk factors for seroconversion in men. The Lancet, 334(8660), 403–407.
Campbell, C. (2000). Selling sex in the time of AIDS: the psycho-social context of condom use by sex workers on a Southern African mine. Social Science & Medicine, 50(4), 479–494.
Campbell, M. K., & Farrell, S. O. (2009). Biochemistry (6th ed.). USA: Thomsom Brooks/Cole.
Cardo, D. M., Culver, D. H., Ciesielski, C. A., Srivastava, P. U., Marcus, R., Abiteboul, D., … McKibben, P. S. (1997). A case–control study of HIV seroconversion in health care workers after percutaneous exposure. New England Journal of Medicine, 337(21), 1485–1490.
Casadevall, A., & Pirofski, L. (2000). Host-pathogen interactions: basic concepts of microbial commensalism, colonization, infection, and disease. Infection and Immunity, 68(12), 6511–6518.
Casadevall, A., & Pirofski, L. (2015). What is a host? Incorporating the microbiota into the damage-response framework. Infection and Immunity, 83(1), 2–7.
Casartelli, N., Di Matteo, G., Argentini, C., Cancrini, C., Bernardi, S., Castelli, G., … Doria, M. (2003). Structural defects and variations in the HIV-1 nef gene from rapid, slow and non-progressor children. Aids, 17(9), 1291–1301.
Centers for Disease Control and Prevention. (2006). CDC HIV/AIDS Science Facts: CDC Releases Revised HIV Testing Recommendations in Healthcare Settings. Retrieved from https://web.archive.org/web/20080916032856/http://www.cdc.gov/hiv/topics/testing/resources/factsheets/healthcare.htm
Centers for Disease Control and Prevention. (2015). HIV Among Gay and Bisexual Men. Retrieved July 10, 2016, from http://www.cdc.gov/hiv/group/msm/index.html
Chakrabarti, L., Guyader, M., Alizon, M., Daniel, M. D., Desrosiers, R. C., Tiollais, P., & Sonigo, P. (1987). Sequence of simian immunodeficiency virus from macaque and its relationship to other human and simian retroviruses. Nature, 328(6130), 543–547.
Chao, C., Jacobson, L. P., Tashkin, D., Martínez-Maza, O., Roth, M. D., Margolick, J. B., … Detels, R. (2008). Recreational drug use and T lymphocyte subpopulations in HIV-uninfected and HIV-infected men. Drug and Alcohol Dependence, 94(1), 165–171.
Chigwedere, P., & Essex, M. (2010). AIDS denialism and public health practice. AIDS and Behavior, 14(2), 237–247.
Choopanya, K., Martin, M., Suntharasamai, P., Sangkum, U., Mock, P. A., Leethochawalit, M., … Kittimunkong, S. (2013). Antiretroviral prophylaxis for HIV infection in injecting drug users in Bangkok, Thailand (the Bangkok Tenofovir Study): a randomised, double-blind, placebo-controlled phase 3 trial. The Lancet, 381(9883), 2083–2090.
Christodoulides, M. (2019). Neisseria gonorrhoeae: methods and protocols. Springer.
Cohen, J. (1994). The Duesberg phenomenon. Science, 266(5191), 1642.
Cohen, J., & Enserink, M. (2008). HIV, HPV researchers honored, but one scientist is left out. Science, 322(5899), 174–175.
Conrad, C., Bradley, H. M., Broz, D., Buddha, S., Chapman, E. L., Galang, R. R., … Patel, M. R. (2015). Community outbreak of HIV infection linked to injection drug use of oxymorphone—Indiana, 2015. MMWR Morb Mortal Wkly Rep, 64(16), 443–444.
Cooper, D., Maclean, P., Finlayson, R., Michelmore, H., Gold, J., Donovan, B., … Group, S. A. S. (1985). Acute AIDS retrovirus infection: definition of a clinical illness associated with seroconversion. The Lancet, 325(8428), 537–540.
Coudray, M. S., & Madhivanan, P. (2020). Bacterial vaginosis—A brief synopsis of the literature. European Journal of Obstetrics & Gynecology and Reproductive Biology, 245, 143–148.
Coutsoudis, A., Kwaan, L., & Thomson, M. (2010). Prevention of vertical transmission of HIV-1 in resource-limited settings. Expert Review of Anti-Infective Therapy, 8(10), 1163–1175.
Cox, M. M., Doudna, J. A., & O’Donnell, M. (2012). Molecular biology (1st ed.). Freeman.
Crans, W. J. (1993). Why mosquitoes cannot transmit AIDS. Rutgers Cooperative Extension Leaflet No. FS736.
Daniel, M. D., Letvin, N. L., King, N. W., Kannagi, M., Sehgal, P. K., Hunt, R. D., … Desrosiers, R. C. (1985). Isolation of T-cell tropic HTLV-III-like retrovirus from macaques. Science, 228(4704), 1201–1204.
Davy, C., & Doorbar, J. (2008). Human papillomaviruses: methods and protocols (Vol. 119). Springer Science & Business Media.
De Clercq, E. (2009). The history of antiretrovirals: key discoveries over the past 25 years. Reviews in Medical Virology, 19(5), 287–299.
Demme, J. (1993). Philadelphia. USA: InterCom.
Deviche, P., Hurley, L. L., & Fokidis, H. B. (2011). Avian testicular structure, function, and regulation. In Hormones and reproduction of vertebrates (pp. 27–70). Elsevier.
Diefenbach, R. J., & Fraefel, C. (2016). Herpes simplex virus. Springer.
Dosekun, O., & Fox, J. (2010). An overview of the relative risks of different sexual behaviours on HIV transmission. Current Opinion in HIV and AIDS, 5(4), 291–297.
Drucker, E., Alcabes, P. G., & Marx, P. A. (2001). The injection century: massive unsterile injections and the emergence of human pathogens. The Lancet, 358(9297), 1989–1992.
Duesberg, P. H. (1987). Retroviruses as carcinogens and pathogens: expectations and reality. Cancer Research, 47(5), 1199–1220.
Duesberg, P. H. (1988). HIV is not the cause of AIDS. Science, 241(4865), 514–517.
Faria, N. R., Rambaut, A., Suchard, M. A., Baele, G., Bedford, T., Ward, M. J., … Pépin, J. (2014). The early spread and epidemic ignition of HIV-1 in human populations. Science, 346(6205), 56–61.
Fenstermacher, G. D. (1994). The knower and the known: The nature of knowledge in research on teaching. Review of Research in Education, 20, 3–56.
Flegr, J. (2006). Evolutionary parasitology: the development of invasion, evasion, and survival mechanisms used by bacterial, viral, protozoan, and metazoan parasites. Food Consumption and Disease Risk–Consumer Pathogen Interactions. Woodhead Publication Ltd.: Abington, Cambridge, UK, 251–270.
Fourie, P., & Meyer, M. (2016). The politics of AIDS denialism: South Africa’s failure to respond. Routledge.
Froland, S. S., Jenum, P., Lindboe, C. F., Wefring, K. W., Linnestad, P. J., & Böhmer, T. (1988). HIV-1 infection in Norwegian family before 1970. The Lancet, 331(8598), 1344–1345.
Fuller, L. (2008). African Women’s Unique Vulnerabilities to HIV/AIDS: Communication Perspectives and Promises. Springer.
Furness, P. (2012). Coroners and medical examiners: mutualism, commensalism or parasitism? Medico-Legal Journal, 80(3), 86–101.
Gao, F., Bailes, E., Robertson, D. L., Chen, Y., Rodenburg, C. M., Michael, S. F., … Shaw, G. M. (1999). Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes. Nature, 397(6718), 436–441.
Garry, R. F., Witte, M. H., Gottlieb, A. A., Elvin-Lewis, M., Gottlieb, M. S., Witte, C. L., … Drake, W. L. (1988). Documentation of an AIDS virus infection in the United States in 1968. Jama, 260(14), 2085–2087.
Giami, A., de Colomby, P., & Paterson, F. (1995). Eroticizing condoms: Representations of sex and AIDS among sex workers of the porn industry, and consumers of porn magazines in France. A preliminary study in D. Friedrich, W. Heckmann. Aids in Europe-The Behavioural Aspect. Vol. 2: Risk Behaviour and Its Determinants, 235–246.
Gilbert, A. L., & Hoffman, B. L. (2021). Contraceptive Technology: Present and Future. Obstetrics and Gynecology Clinics, 48(4), 723–735.
Gilbert, S. F. (2000). Early Development in Birds. In Developmental Biology (6th ed.). Sunderland (MA): Sinauer Associates.
Gilder, E. (1987). A Clash of Symbols: An Analysis of Competing Images and Arguments in the AIDS Controversy.
Gonda, M. A. (1992). Bovine immunodeficiency virus. Aids, 6(8), 759–776.
Goodenough, J., & McGuire, B. (2012). Biology of Humans, Concepts, Applications and Issues (4th ed.). San Francisco: Pearson, Benjamin Cummings.
Gottlieb, M. S., Schanker, H. M., Fan, P. T., Saxon, A., Weisman, J. D., & Pozalski, I. (1981). Pneumocystis pneumonia--Los Angeles. MMWR. Morbidity and Mortality Weekly Report, 30(21), 250–252.
Gross, G., & Tyring, S. K. (2011). Sexually transmitted infections and sexually transmitted diseases. Springer Science & Business Media.
Gupta, R. K., Jordan, M. R., Sultan, B. J., Hill, A., Davis, D. H. J., Gregson, J., … Pillay, D. (2012). Global trends in antiretroviral resistance in treatment-naive individuals with HIV after rollout of antiretroviral treatment in resource-limited settings: a global collaborative study and meta-regression analysis. The Lancet, 380(9849), 1250–1258.
Hemelaar, J. (2012). The origin and diversity of the HIV-1 pandemic. Trends in Molecular Medicine, 18(3), 182–192.
Hethcote, H. W., & Van Ark, J. W. (2013). Modeling HIV transmission and AIDS in the United States (Vol. 95). Springer Science & Business Media.
Hoefnagels, M. (2015). Biology: concepts and investigations (3rd ed.). McGraw-Hill New York.
Hoffman, D. J., & Moore, J. M. (1979). Teratogenic effects of external egg applications of methyl mercury in the mallard, Anas platyrhynchos. Teratology, 20(3), 453–461.
Hong, R. (1998). Inherited Immune Deficiency. In Principles of Molecular Medicine (pp. 283–291). Springer.
Hosie, M. J., Addie, D., Belák, S., Boucraut-Baralon, C., Egberink, H., Frymus, T., … Marsilio, F. (2009). Feline immunodeficiency ABCD guidelines on prevention and management. Journal of Feline Medicine and Surgery, 11(7), 575–584.
Johnson, V. A., Calvez, V., Gunthard, H. F., Paredes, R., Pillay, D., Shafer, R. W., … Richman, D. D. (2013). Update of the drug resistance mutations in HIV-1: March 2013. Top Antivir Med, 21(1), 6–14.
Kalichman, S. C. (2014). The Psychology of AIDS Denialism. European Psychologist.
Kalichman, S. C. (2015). Commentary on “Questioning the HIV–AIDS hypothesis: 30 years of dissent.” Frontiers in Public Health, 3, 30.
Kalichman, S. C., Eaton, L., & Cherry, C. (2010). “There is no proof that HIV causes AIDS”: AIDS denialism beliefs among people living with HIV/AIDS. Journal of Behavioral Medicine, 33(6), 432–440.
Kalish, M. L., Wolfe, N. D., Ndongmo, C. B., McNicholl, J., Robbins, K. E., Aidoo, M., … Djoko, C. F. (2005). Central African hunters exposed to simian immunodeficiency virus. Emerg Infect Dis, 11(12), 1928–1930.
Kardong, K. V. (2011). Vertebrates, comparative anatomy, function, evolution (6th ed.). McGraw-Hill New York.
Kardong, K. V. (2014). Vertebrates: Comparative Anatomy, Function, Evolution (7th ed.). McGraw-Hill Education.
Karp, G. C. (2013). Cell and Molecular Biology, Concepts and Experiments (7th ed.). USA: Wiley Online Library.
Kazandjieva, J., & Tsankov, N. (2007). Tattoos: dermatological complications. Clinics in Dermatology, 25(4), 375–382.
Keele, B. F., Van Heuverswyn, F., Li, Y., Bailes, E., Takehisa, J., Santiago, M. L., … Liegeois, F. (2006). Chimpanzee reservoirs of pandemic and nonpandemic HIV-1. Science, 313(5786), 523–526.
Kent, R., & Huber, B. (1999). Obituary: Gertrude Belle Elion (1918-99). Nature, 398(6726), 380.
Kerrigan, D., Wirtz, A., Baral, S., Stanciole, A., Butler, J., Oelrichs, R., & Beyer, C. (2012). The global HIV epidemics among sex workers. World Bank Publications.
Knipe, D. M., & Howley, P. M. (2013). Fields Virology. (J. Goolsby, Ed.) (6th ed.). Philadelphia: Lippincott Williams & Wilkins.
Koblin, B. A., Husnik, M. J., Colfax, G., Huang, Y., Madison, M., Mayer, K., … Buchbinder, S. (2006). Risk factors for HIV infection among men who have sex with men. Aids, 20(5), 731–739.
Koenig, R. (2006). The legacy of great science: the work of nobel laureate Gertrude Elion lives on. The Oncologist, 11(9), 961–965.
Krueger, G. R. F., Friedman, E. K., & Kuta, A. J. (2013). Pathology of Hematopoietic and Lymphatic Tissues. In Atlas of Anatomic Pathology with Imaging (pp. 399–443). Springer.
Kumar, P. (2013). Long term non-progressor (LTNP) HIV infection. The Indian Journal of Medical Research, 138(3), 291.
Lara, V. M., Taniwaki, S. A., & Araújo Júnior, J. P. (2008). Occurrence of feline immunodeficiency virus infection in cats. Ciência Rural, 38(8), 2245–2249.
Lazarus, J. V, Hoekstra, M., Raben, D., Delpech, V., Coenen, T., & Lundgren, J. D. (2013). The case for indicator condition‐guided HIV screening. HIV Medicine, 14(7), 445–448.
Lederberg, J. (1997). Infectious disease as an evolutionary paradigm. Emerging Infectious Diseases, 3(4), 417.
Lederer, B. (2005). Dead Certain? POZ. Retrieved from https://www.poz.com/article/Dead-Certain-2788-6789
Lee, T. S. H. (2012). Penile Bead Implantation in Relation to HIV Infection in Male Heroin Users in Taiwan. J AIDS Clinic Res S1: 018. doi: 10.4172/2155-6113. S1-01 8 Page 2 of 6 ISSN: 2155-6113 JAR an open access journal J AIDS Clinic Res Risk Behaviors: HIV/AIDS a study cond. Southeast Asia, Including Mainland China and Taiwan There Is a Phenomenon of Inserting Self-Made Artificial Nodules beneath the Skin of the Penis Called RuJu, in Which Pearls, Pieces of Jade, or Glass or Metal Beads Are Inserted [23]. Searched MEDLINE And, 35.
Lemey, P., Pybus, O. G., Wang, B., Saksena, N. K., Salemi, M., & Vandamme, A.-M. (2003). Tracing the origin and history of the HIV-2 epidemic. Proceedings of the National Academy of Sciences, 100(11), 6588–6592.
Lerche, N. W., Yee, J. L., & Jennings, M. B. (1994). Establishing specific retrovirus-free breeding colonies of macaques: an approach to primary screening and surveillance. Laboratory Animal Science, 44(3), 217–221.
Leung, B. (2009). House of Numbers: Anatomy of an Epidemic. USA. Retrieved from https://www.youtube.com/watch?v=woFRQPdaSqM
Lovette, I. J., & Fitzpatrick, J. W. (2016). Handbook of bird biology. John Wiley & Sons.
Mackean, D. G., & Hayward, D. (2014). Biology (3rd ed.). IGCSE Cambridge.
Mader, S. S. (2010). Biology (10th ed.). McGraw-Hill Education.
Mader, S. S., & Windelspecht, M. (2015). Biology (12th ed.). McGraw-Hill Education.
Mader, S. S., & Windelspecht, M. (2018). Essentials of biology (5th ed.). McGraw-Hill Education.
Marieb, E. N., Wilhelm, P. B., & Mallatt, J. (2017). Human Anatomy (8th ed.). Pearson.
Marrazzo, J. M., Ramjee, G., Richardson, B. A., Gomez, K., Mgodi, N., Nair, G., … Noguchi, L. (2015). Tenofovir-based preexposure prophylaxis for HIV infection among African women. New England Journal of Medicine, 372(6), 509–518.
Marx, P. A., Alcabes, P. G., & Drucker, E. (2001). Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa. Philosophical Transactions of the Royal Society of London B: Biological Sciences, 356(1410), 911–920.
Mason, K. A., Losos, J. B., Singer, S. R., & Raven, P. H. (2014). Biology (7th ed.). McGraw-Hill New York.
Mathers, B. M., Degenhardt, L., Bucello, C., Lemon, J., Wiessing, L., & Hickman, M. (2013). Mortality among people who inject drugs: a systematic review and meta-analysis. Bulletin of the World Health Organization, 91(2), 102–123.
Mauss, S., Berg, T., Rockstroh, J., Sarrazin, C., Wedemeyer, H., & Kamps, B. S. (2010). Hepatology: a clinical textbook. flying publisher Düsseldorf, Germany.
Méthot, P.-O., & Alizon, S. (2014). What is a pathogen? Toward a process view of host-parasite interactions. Virulence, 5(8), 775–785.
Mohseni, M., Sung, S., & Takov, V. (2019). Chlamydia.
Muckenthaler, M., Gunkel, N., Levantis, P., Broadhurst, K., Goh, B., Colvin, B., … Oxford, J. S. (1992). Sequence analysis of an HIV‐1 isolate which displays unusually high‐level AZT resistance in vitro. Journal of Medical Virology, 36(2), 79–83.
Murray, R. K., Bender, D. A., Botham, K. M., Kennelly, P. J., Rodwell, V., & Weil, A. (2012). Harpers Illustrated Biochemistry (29th ed.). McGraw-Hill Medical.
NHS Blood and Transplant. (2013). Patient information leaflet: will I need a blood transfusion?
Nitheshkumar, K., Kiranmai, B., & Chandrasekhar, A. (2013). A STUDY ON PULMONARY MANIFESTATIONS IN HIV/AIDS PATIENT’S ATTENDING TERTIARY CARE HOSPITAL HYDERABAD. International Journal of Pharma & Bio Sciences, 4.
Nobel, P. (n.d.). AIDS & HIV.
Otter, K., & Ratcliffe, L. (1996). Female initiated divorce in a monogamous songbird: abandoning mates for males of higher quality. Proceedings of the Royal Society of London. Series B: Biological Sciences, 263(1368), 351–355.
Parmentier, E., & Michel, L. (2013). Boundary lines in symbiosis forms. Symbiosis, 60(1), 1–5.
Pattman, R., Sankar, N., Elawad, B., Handy, P., & Price, D. A. (2010). Oxford handbook of genitourinary medicine, HIV, and sexual health. OUP Oxford.
Peeters, M., Courgnaud, V., & Abela, B. (2001). Genetic diversity of lentiviruses in non-human primates. AIDS Reviews, (3), 3–10.
Pérez-Gracia, M.-T., & Suay-García, B. (2021). Neisseria gonorrhoeae Infections. MDPI-Multidisciplinary Digital Publishing Institute.
Pierson, T., McArthur, J., & Siliciano, R. F. (2000). Reservoirs for HIV-1: mechanisms for viral persistence in the presence of antiviral immune responses and antiretroviral therapy. Annual Review of Immunology, 18(1), 665–708.
Plantier, J.-C., Leoz, M., Dickerson, J. E., De Oliveira, F., Cordonnier, F., Lemée, V., … Simon, F. (2009). A new human immunodeficiency virus derived from gorillas. Nature Medicine, 15(8), 871.
Pollard, T. D., Earnshaw, W. C., Lippincott-Schwartz, J., & Johnson, G. T. (2017). Cell Biology (3rd ed.). Elsevier.
Popovic, M., Sarngadharan, M. G., Read, E., & Gallo, R. C. (1984). Detection, isolation, and continuous production of cytopathic retroviruses (HTLV-III) from patients with AIDS and pre-AIDS. Science, 224(4648), 497–500.
Prusiner, S. B. (2002). Discovering the Cause of AIDS. Science, 298(5599), 1726.
Quigley, R. (2013). HIV-infected porn star had sex with actor who days later had sex with Sydney Leathers in her debut movie Weiner And Me. Mailonline.
Radolf, J. D., & Lukehart, S. A. (2006). Pathogenic Treponema: molecular and cellular biology. Caister Academic Press.
Raghwani, J., Bhatt, S., & Pybus, O. G. (2016). Faster Adaptation in Smaller Populations: Counterintuitive Evolution of HIV during Childhood Infection. PLoS Comput Biol, 12(1), e1004694.
Reece, J. B., Urry, L. A., Wasserman, S. A., Cain, M. L., Minorsky, P. V, & Jackson, R. B. (2014). Campbell Biology (10th ed.). Pearson Higher Ed.
Richman, D. D., Morton, S. C., Wrin, T., Hellmann, N., Berry, S., Shapiro, M. F., & Bozzette, S. A. (2004). The prevalence of antiretroviral drug resistance in the United States. Aids, 18(10), 1393–1401.
Riestra, A. M., de Miguel, N., Dessi, D., Simoes-Barbosa, A., & Mercer, F. K. (2022). Trichomonas vaginalis: Lifestyle, Cellular Biology, and Molecular Mechanisms of Pathogenesis. In Lifecycles of Pathogenic Protists in Humans (pp. 541–617). Springer.
Ritchison, G. (2015). Bird biogeography. RITCHISON, G. Avian Biology: Everything You Wanted to Know about Birds… and More. Eastern Kentucky University,[Sd]. Disponível Em:< Http://People. Eku. Edu/Ritchisong/Birdbiogeography1. Htm>. Acesso Em, 9.
Rjabtsev, A. (2016). AIDS denialism. Erepublik. Retrieved from http://www.erepublik.com/en/article/aids-denialism-817945/1/20
Roitt, I. M., & Delves, P. J. (2011). Roitt’s Essential Immunology (12th ed.). Malden: Wiley.
Rom, W. N., & Markowitz, S. B. (2007). Environmental and occupational medicine. Lippincott Williams & Wilkins.
Ruderfer, D., & Krilov, L. R. (2015). Herpes simplex viruses 1 and 2. American Academy of Pediatrics.
Sadava, D., Berenbaum, M., & Hillis, D. (2014). Life the Science of Biology (10th ed.). Sinauer & MacMillian.
Sadler, T. W. (2012). Medical Embryology. (C. Taylor, Ed.) (12th ed.). Baltimore: Lippincott Williams & Wilkins.
Santiago, M. L., Range, F., Keele, B. F., Li, Y., Bailes, E., Bibollet-Ruche, F., … Brookfield, J. F. Y. (2005). Simian immunodeficiency virus infection in free-ranging sooty mangabeys (Cercocebus atys atys) from the Tai Forest, Cote d’Ivoire: implications for the origin of epidemic human immunodeficiency virus type 2. Journal of Virology, 79(19), 12515–12527.
Sato, N. S. (2011). Syphilis: Recognition, Description and Diagnosis. BoD–Books on Demand.
Schechter, M. T., Craib, K. J., Montaner, J. S. G., Le, T. N., O’Shaughnessy, M. V, & Gelmon, K. A. (1993). HIV-1 and the aetiology of AIDS. The Lancet, 341(8846), 658–659.
Schumacher, S. K. (2007). Exposure: A Guide to Sources of Infection. Emerging Infectious Diseases, 13(5), 810.
Schwandt, M., Morris, C., Ferguson, A., Ngugi, E., & Moses, S. (2006). Anal and dry sex in commercial sex work, and relation to risk for sexually transmitted infections and HIV in Meru, Kenya. Sexually Transmitted Infections, 82(5), 392–396.
Sendagorta-Cudós, E., Burgos-Cibrián, J., & Rodríguez-Iglesias, M. (2019). Genital infections due to the human papillomavirus. Enfermedades Infecciosas y Microbiologia Clinica (English Ed.), 37(5), 324–334.
Sethi, S., Kiran, D. N., Popli, G., Malhotra, A., Bansal, A., & Mohan, S. (2016). Risk of Exposure and Preventive Strategies of HIV Infection in Dental Office-A Review. International Journal of Health Sciences and Research (IJHSR), 6(5), 317–323.
Sfard, A. (1998). On two metaphors for learning and the dangers of choosing just one. Educational Researcher, 27(2), 4–13.
Sharp, P. M., Bailes, E., Chaudhuri, R. R., Rodenburg, C. M., Santiago, M. O., & Hahn, B. H. (2001). The origins of acquired immune deficiency syndrome viruses: where and when? Philosophical Transactions of the Royal Society of London B: Biological Sciences, 356(1410), 867–876.
Sheppard, H. W., Lang, W., Ascher, M. S., Vittinghoff, E., & Winkelstein, W. (1993). The characterization of non-progressors: long-term HIV-1 infection with stable CD4+ T-cell levels. Aids, 7(9), 1159–1166.
Shier, D., Butler, J., & Lewis, R. (2015). Hole’s Human Anatomy & Physiology (14th ed.). McGraw-Hill Education.
Simon, E. J., Dickey, J. L., & Reece, J. B. (2013). Essential biology (Pearson).
Simunovic, C., & Shinohara, M. M. (2014). Complications of decorative tattoos: recognition and management. American Journal of Clinical Dermatology, 15(6), 525–536.
Sneader, W. E. (2005). Drug discovery (the history). Wiley Online Library.
Soler, J. K. (2012). Revisiting the concept of ‘chronic disease’from the perspective of the episode of care model. Does the ratio of incidence to prevalence rate help us to define a problem as chronic? Department of General Practice, University of Amsterdam.
Solomon, E., Martin, C., Martin, D. W., & Berg, L. R. (2014). Biology (10th ed.). Cengage Learning.
Songer, N. B., & Linn, M. C. (1991). How do students’ views of science influence knowledge integration? Journal of Research in Science Teaching, 28(9), 761–784.
Starr, C., Evers, C., & Starr, L. (2013). Biology: Today and Tomorrow With Physiology (4th ed.). Brooks/Cole.
Stephens, R. S. (1999). Chlamydia: intracellular biology, pathogenesis, and immunity. Zondervan.
Strebhardt, K., & Ullrich, A. (2008). Paul Ehrlich’s magic bullet concept: 100 years of progress. Nature Reviews Cancer, 8(6), 473–480.
Sutton, M. Y., & Parks, C. P. (2013). HIV/AIDS prevention, faith, and spirituality among black/African American and Latino communities in the United States: strengthening scientific faith-based efforts to shift the course of the epidemic and reduce HIV-related health disparities. Journal of Religion and Health, 52(2), 514–530.
Taylor, M. R., Simon, E. J., Dickey, J. L., Hogan, K., & Reece, J. B. (2018). Biology, Concepts and conections (9th ed.). Boston: Pearson education.
Thompson, J. N., Nuismer, S. L., & Gomulkiewicz, R. (2002). Coevolution and maladaptation. Integrative and Comparative Biology, 42(2), 381–387.
Thorne, C., & Newell, M. L. (2013). Ask the experts: HIV vertical transmission prevention.
Turan, J. M., & Nyblade, L. (2013). HIV-related stigma as a barrier to achievement of global PMTCT and maternal health goals: a review of the evidence. AIDS and Behavior, 17(7), 2528–2539.
Van Gerwen, O. T., Camino, A. F., Sharma, J., Kissinger, P. J., & Muzny, C. A. (2021). Epidemiology, natural history, diagnosis, and treatment of Trichomonas vaginalis in men. Clinical Infectious Diseases, 73(6), 1119–1124.
Van Heuverswyn, F., Li, Y., Neel, C., Bailes, E., Keele, B. F., Liu, W., … Bienvenue, Y. (2006). Human immunodeficiency viruses: SIV infection in wild gorillas. Nature, 444(7116), 164.
Vessière, A., Delaugerre, C., Plantier, J.-C., & Simon, F. (2010). Passages inter-espèces des virus de l’immunodéficience humaine et simienne chez les primates. Revue Francophone Des Laboratoires, 2010(423), 43–53.
Vitt, L. J., & Caldwell, J. P. (2014). Herpetology An Introductory Biology of Amphibians and Reptiles (4th ed.). Oklahoma: Elsevier Inc.
Walker, C. M., Moody, D. J., Stites, D. P., & Levy, J. A. (1986). CD8+ lymphocytes can control HIV infection in vitro by suppressing virus replication. Science, 234(4783), 1563–1566.
Wardley, R. C., & Lowery, D. E. (1998, November 10). Feline immunodeficiency virus vaccine. Google Patents.
Weaver, R. F. (2012). Molecular biology (5th ed.). McGraw-Hill Education.
Weiss, R. A. (2008). On viruses, discovery, and recognition. Cell, 135(6), 983–986.
Weiss, R. A., & Jaffe, H. W. (1990). Duesberg, HIV and AIDS. Nature, 345(6277), 659–660.
Werren, J. H., Baldo, L., & Clark, M. E. (2008). Wolbachia: master manipulators of invertebrate biology. Nature Reviews Microbiology, 6(10), 741–751.
Westergaard, R. P., Hess, T., Astemborski, J., Mehta, S. H., & Kirk, G. D. (2013). Longitudinal changes in engagement in care and viral suppression for HIV-infected injection drug users. AIDS (London, England), 27(16), 2559.
Wilburn, S. Q., & Eijkemans, G. (2013). Preventing needlestick injuries among healthcare workers: a WHO-ICN collaboration. International Journal of Occupational and Environmental Health.
Willson, R. A. (1997). Viral Hepatitis: Diagnosis, Treatment, Prevention. M. Dekker.
Woolley, S. C., & Doupe, A. J. (2008). Social context–induced song variation affects female behavior and gene expression. PLoS Biology, 6(3), e62.
Worobey, M., Gemmel, M., Teuwen, D. E., Haselkorn, T., Kunstman, K., Bunce, M., … Van Marck, E. (2008). Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960. Nature, 455(7213), 661–664.
Worobey, M., Telfer, P., Souquière, S., Hunter, M., Coleman, C. A., Metzger, M. J., … Honarvar, S. (2010). Island biogeography reveals the deep history of SIV. Science, 329(5998), 1487.
Yager, R. E. (1996). Science/technology/society as reform in science education. SUNY Press.
Yu, M., & Vajdy, M. (2010). Mucosal HIV transmission and vaccination strategies through oral compared with vaginal and rectal routes. Expert Opinion on Biological Therapy, 10(8), 1181–1195.
Zbar, A. P. (2022). Syphilis: A Short Biography. Springer Nature.
Zhu, T., Korber, B. T., Nahmias, A. J., Hooper, E., Sharp, P. M., & Ho, D. D. (1998). An African HIV-1 sequence from 1959 and implications for the origin of the epidemic. Nature, 391(6667), 594–597.


































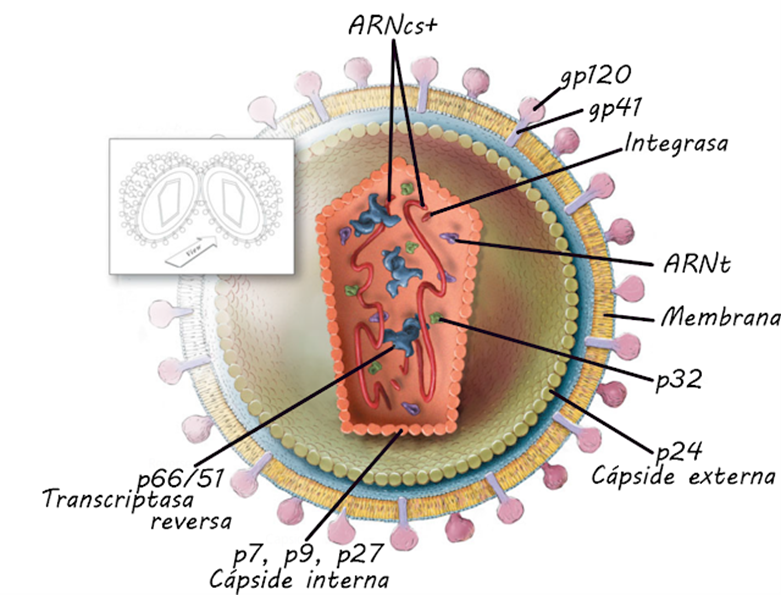






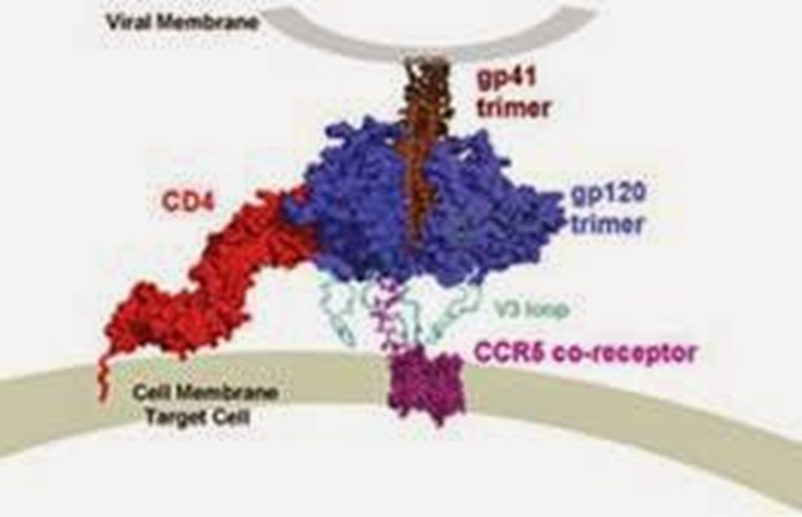


















































Gran información
ResponderEliminar