Índice
Portada
1. Introducción
|| REGRESAR AL INDICE ||
Durante milenios los elementos puros podían contarse con los dedos de la mano, pero a medida que se descubrieron más elementos, se hizo necesario organizarlos en algún tipo de sistema de clasificación. A fines de 1800, los científicos reconocieron que ciertos elementos se parecían y se comportaban de la misma manera. En 1872, un químico ruso, Dmitri Mendeleev, organizó los 60 elementos conocidos en ese momento en grupos con propiedades similares y los colocó en orden de aumentar las masas atómicas relativas, su modelo superó a otros debido a que predecía no solo elementos faltantes, sino sus propiedades físicas y químicas de antemano. Hoy, esta disposición de 118 elementos se conoce como la tabla periódica. El nombre de periódica alude a que las propiedades químicas y físicas se repiten de manera constante con el aumento de la masa molar en ciclos predecibles.
Definiremos como tabla periódica a una tabla, en la cual se encuentran los elementos clasificados de acuerdo a sus propiedades físicas y químicas, y que, por lo tanto, nos permite un acceso fácil y confiable a dichas propiedades para su uso. La tabla periódica es una organización tabular de los elementos químicos conocidos, organizados mediante el número atómico (que en la actualidad se considera igual al número de protones de cualquiera de los isótopos del elemento), como a las configuraciones electrónicas, así como las propiedades químicas y físicas recurrentes.
La tabla recibe su nombre de periódica debido a la existencia de tendencias repetitivas, tales como elementos con un comportamiento químico similar en cada una de las columnas. Adicionalmente existen otros patrones de agrupación como los cuatro grandes bloques con aproximadamente las mismas propiedades químicas. En general en una misma fila (que llamamos periodo) los elementos a la izquierda son metálicos y los elementos a la derecha no son metálicos. Las filas de la columna (hileras horizontales) se denominan periodos; y las columnas se denominan grupos. Seis grupos especiales reciben nombres además de números debido a razones históricas: por ejemplo, el grupo 17 es el de los halógenos; y el grupo 18 es el de los gases nobles. La tabla periódica puede emplearse para derivar relaciones entre las propiedades de los elementos, predecir las propiedades de nuevos elementos aun por aislar o por sintetizar. La tabla periódica provee un marco de referencia útil para el análisis del comportamiento químico, y es ampliamente usada en la química y otras ciencias.
Dmitri Mendeleev publicó en 1869 la primera tabla periódica. El desarrollo su tabla para ilustrar las propiedades repetitivas o periódicas entre los casi 60 elementos conocidos en aquel momento. Mendeleev también predijo la existencia y propiedades de elementos aun no aislados. La mayoría de sus predicciones demostraron ser correctas con niveles de detalle exquisitos, lo cual hizo que casi 15 años después de su modelo inicial, la comunidad científica tuviera que reconocer su éxito. Los elementos desde el elemento 1 (hidrógeno) hasta el 118 (oganesón) han sido sintetizados, con las adiciones más recientes de los elementos 113, 115, 117 y 118 (Oganessian et al., 2010). Los primeros 94 elementos ocurren naturalmente, aunque algunos son tan escasos que fueron sintetizados antes de ser aislados en los laboratorios. Los elementos del 95 al 118 solo han sido sintetizados en laboratorios, aunque en teoría algunos podrían existir efímeramente y/o en trazas no medibles. Sin embargo, con la mejora de los espectrómetros pueden encontrarse trazas de elementos más pesados, después de todo primero se pensaba que el límite natural era el uranio (Emsley, 2011). En la actualidad se siguen buscando métodos para que la estabilidad de los elementos muy pesados aumente y poder determinar sus propiedades, además de poder sintetizar elementos de mayor peso al 118.
1.1 Dmitri Ivanovich Mendeleev (8 de febrero 1834 - 2 de febrero 1907)
Fue un químico e inventor ruso. Es mejor conocido por formular la Ley Periódica y crear una versión de la tabla periódica de elementos. Usó la Ley Periódica no solo para corregir las propiedades entonces aceptadas de algunos elementos conocidos, como la valencia y el peso atómico del uranio, sino también para predecir las propiedades de tres elementos que aún no se habían descubierto.
2. Historia de la tabla periódica
|| REGRESAR AL INDICE ||
La historia de la tabla periódica puede dividirse en tres etapas: (1) las tablas anteriores a la ley periódica, (2) las tablas periódicas por masa elemental relativa, y (3) las tablas periódicas por carga de protones.
2.1 La alquimia
Figura 2.1. Henning Brand y el descubrimiento del fósforo. (1630-1710) fue un comerciante, soplador de vidrio, farmacéutico y alquimista aficionado alemán que vivió y trabajó en Hamburgo, recordado por haber descubierto el fósforo alrededor de 1669. Comunicó su secreto a Daniel Kraft con la condición de no revelarlo a nadie; pero Johann von Löwenstern-Kunckel finalmente descubrió la manera de obtener fósforo (1674). Recibió una pensión de Juan Federico de Brunswick-Luneburgo.
Varios elementos se conocen en su estado puro desde épocas antiguas como: el oro, la plata, el platino el zinc o el cobre; dado que algunos no son oxidables “como el oro”, mientras que otros pueden ser separados del oxígeno calentándolos lo suficiente en una forja (Eliade, & Ledesma, 1974). Los herreros fueron los maestros del control de los elementos hasta que su trabajo capturó la atención de filósofos y sacerdotes, lo cual daría nacimiento a la alquimia. Para el siglo VI antes de Cristo los filósofos griegos Empédocles, Platón y Aristóteles propusieron que toda materia estaba compuesta por cuatro principios: agua, aire, tierra y fuego; y que a su vez cada uno de esos elementos se caracterizaba por un par de cualidades como seco, húmedo, cálido y frío. Los primeros cuatro fueron conocidos como los cuatro elementos, más un quinto elemento llamado éter cuya esencia era divina. Estos fueron empleados por los alquimistas para explicar el mundo material (Eliade et al., 1974). Las ideas de Aristóteles mantendrían ocupados a los alquimistas en sus intentos por crear oro o una pócima para la vida eterna por al menos 2000 años. Eso hasta que empezaron a aparecer cosas raras, por ejemplo, el elemento tierra parecía no ser una entidad homogénea, por lo que para el siglo XVII se hablaba de las tierras en plural, para hacer referencias a varios tipos de óxidos y sales con propiedades diferentes (Wisniak, 2004).
2.2 Descubrimiento de los elementos
Figura 2.2. Robert Boyle (Waterford, 25 de enero de 1627-Londres, 31 de diciembre de 1691) fue un filósofo natural, químico, físico e inventor. También fue un prominente teólogo cristiano. Como científico es conocido principalmente por la formulación de la ley de Boyle, además de que es generalmente considerado hoy como el primer químico moderno y por lo tanto uno de los fundadores de la química moderna. Su obra The Sceptical Chymist (El químico escéptico) es considerada una obra fundamental en la historia de la química.
La historia de la tabla periódica también es la historia del descubrimiento de los elementos químicos. La primera persona individual que tengamos registros en descubrir un elemento químico es Henning Brand, un mercader germano en bancarrota que buscaba obtener la piedra filosofal para crear oro y salir de sus aprietos económicos. En 1649 Brand destiló orina, produciendo una sustancia que brillaba con un tono blanquecino en una botella de base esférica, la sustancia fue llamada fósforo (Weeks, 1932). Brand mantuvo el descubrimiento en secreto hasta 1680 cuando Robert Boyle redescubrió el fósforo y publicó sus descubrimientos. El descubrimiento del fósforo ayudó a reabrir el tema de que era lo que se entendía por elemento, si un principio inmaterial o una sustancia palpable (Prandtl, 1948).
En 1661 Robert Boyle definió un elemento como: una sustancia que no podía ser separada en otra más simple por medio de una reacción química” (Chalmers, 2005). Esta es la definición química de elemento, y sigue siendo igual de útil ahora que en tiempos de Boyle, con una diferencia, en el siglo XX surgió una nueva definición de elemento, pero en todo caso se trata de una definición basada en la física y la cantidad de protones en el núcleo de los átomos de cada elemento.
Figura 2.3. Antoine-Laurent de Lavoisier y Marie-Anne Pierrette Paulze.
En 1789 “mismo año de la revolución francesa” Antoine-Laurent de Lavoisier publicó el Tratado Elemental de la Química, lo cual es un nombre gracioso porque también se puede interpretar como un tratado sobre la química de los elementos, en ese sentido estamos hablando de un libro de enseñanza (libro de texto) que proseguía el modelo de trabajo de Boyle: aislar elementos en términos de sustancias simples no separables por métodos químicos, y organizar dichas sustancias de una forma lógica. Lavoisier enlistó varios elementos conocidos para nosotros como el oxígeno, el nitrógeno, el fosforo o el azufre, así como otros que nosotros no relacionamos con materia másica como la luz y el calor. Adicionalmente fue el primero en separar las dos categorías fundamentales de cualquier tabla periódica: Metales y No Metales. Los químicos de su generación tomaron el texto críticamente, pero las nuevas generaciones se convencieron de la utilidad de la redefinición de elemento químico, lo cual terminaría por dar inicio a la química moderna, con un lenguaje propio, un lenguaje en el cual los nuevos elementos eran el alfabeto (Bensaude-Vincent & Abbri, 1995).
2.3 Las primeras tablas periódicas
En 1829 Dobereiner observó que muchos elementos podían ser agrupados en triadas basados en sus propiedades químicas, por ejemplo: el cloro el bromo y el yodo. Otro ejemplo fue el litio, el sodio y el potasio, los cuales eran metales blandos como la gelatina que reaccionan muy violentamente con el agua. Döbereiner también observó que, cuando organizados bajo el criterio de la masa, el segundo miembro de la triada tenía una masa más o menos igual al promedio de los otros dos miembros. Esto se convirtió en la ley de las triadas (Kauffman, 1999).
Tabla 2.1. Triadas de Dobereiner
|
Cl |
Br |
I |
|
Ca |
Sr |
Ba |
|
S |
Se |
Te |
|
Li |
Na |
K |
El químico alemán Leopold Gmelin trabajó en este sistema y para 1843 había identificado diez triadas, pero también detalles que no concordaban, por ejemplo, cuatro grupos de cuatro elementos y un grupo de cinco elementos. En 1857 Jean-Baptiste Dumas extendió el estudio de las propiedades de varios grupos de metales (Mendeleev, s/f; E. R. Scerri, 2006). El problema con todos estos intentos es que creaban múltiples tablillas desconectadas del todo, grupitos de tres o cinco elementos, sin ningún sentido general que las justificara.
En 1857, uno de los mejores químicos de su generación August Kekulé observó que el carbono generalmente tenía un poder de enlace de cuatro, y en consecuencia podía enlazarse a otros cuatro elementos que tuvieran poder de enlace de uno como el hidrógeno o el cloro. El metano, por ejemplo, posee un carbono y cuatro hidrógenos. El concepto de poder de enlace eventualmente conllevó al desarrollo del concepto de valencia; y cada elemento posee un determinado poder de enlace (Izquierdo-Aymerich & Adúriz-Bravo, 2009).
En 1862, Alexander-Emile Beguyer de Chancourtois, un geólogo francés publicó una temprana forma de la tabla periódica, la cual el llamó como la hélice telúrica.
Figura 2.4. La hélice telúrica de Chancourtois muestra la repetición de algunas propiedades de los elementos, por lo que él debe ser reconocido como padre de la ley periódica.
Chancourtois fue la primera persona en notar la periodicidad de los elementos. Con los elementos organizados en una espiral o cilindro en un orden de masa relativa de elemento creciente, de Chancourtois demostró que los elementos con propiedades semejantes se repetían periódicamente. Esta tabla incluía algunos iones y compuestos en adición de elementos. Debido a que en la época la química y la geología aún no habían convergido, los dos campos empleaban un lenguaje diferente, por lo que su idea fue poco valorada por los demás químicos hasta la llegada de Dmitri Mendeleyev (E. R. Scerri, 1998).
En 1864, Meyer un químico alemán publicó una tabla de 44 elementos organizados de acuerdo a su poder de enlace “valencia”. El resultado era más o menos similar ya que las propiedades químicas y la valencia están relacionadas. La valencia es quien permite que algunas reacciones comunes en cada periodo se repitan. Unos cuantos meses después de que Mendeleev publicara su tabla periódica prediciendo elementos nuevos, Meyer publicó una tabla parecida.
Tabla 2.2. Tabla de Meyer.
Casi al mismo tiempo William Odling, un químico inglés publicó otra tabla de 57 elementos organizados en base a su masa relativa. Con algunas irregularidades y saltos Odling notó una tendencia tenue de periodicidad en las masas relativas elementales y que acorde con eso también se generaban los grupos tradicionales como los metales alcalinos o los halógenos. Aunque Odling aludió a la idea de la ley periódica, no prosiguió con ella y por consiguiente propuso en 1870 una tabla basada en el poder de enlace para clasificar los elementos (Emsley, 1987).
Tabla 2.3. Tabla periódica de Newlands
El químico inglés John Newlands produjo una serie de artículos entre 1863 y 1866 en los que proponía tambien una tabla organizada por masa relativa creciente, las propiedades físicas y químicas parecían repetirse a intervalos de ocho; y empleó una analogía con la repetición de los tonos musicales que también se repiten a intervalos de ocho. Esto terminó por acuñar la ley del octeto, aunque sus contemporáneos no estaban muy convencidos, e incluso la Sociedad Química se reusó a publicar su trabajo. Newlands sin embargo fue capaz de algo por lo cual generalmente acreditamos a Mendeleev, crear una tabla con huecos que permitía la inferencia de la existencia del germanio (E. R. Scerri, 2006, 2011).
En 1867 Gustavus Hinrichs un químico Danés-Americano publicó una tabla periódica en espiral basada en los espectros de los elementos y en sus masas relativas, así como en algunas propiedades químicas, sin embargo muchos opinaron de que su trabajo era ostentoso y difícil de entender (Rouvray & King, 2004; E. R. Scerri, 2011).
2.4 La tabla de Mendeleev
El profesor ruso Dmitri Mendeleev en 1869 y el químico alemán Julius Lothar Meyer en 1870 publicaron de forma independiente una versión nueva de la tabla periódica. La tabla de Mendeleev fue publicada primero en su versión inicial, la cual no se parece en nada a la tabla que poseemos en la actualidad (Baird, Scerri, & McIntyre, 2006; Camacho, Gallego, & Pérez, 2007; Mendeleev, s/f; Rouvray & King, 2004; Samuelson, 2000; E. R. Scerri, 2011).
Mientras que la de Meyer era una versión refinada de su modelo de 1864. Ambos construyeron sus tablas listando los elementos en filas y columnas en orden de la masa relativa creciente. Las filas eran construidas de forma tal que presentaran propiedades químicas semejantes, lo cual si lo comparamos con la tabla moderna es como si giraramos la tabla 90 grados a la izquierda.
Ahora, ¿Por qué nos olvidamos de Meyer? A demás de la ley de prioridades de publicación, la tabla de Mendeleev tenía dos detalles cruciales que le hizo ganar a largo plazo esta carrera por las tablas de los elementos. La primera fue seguir la idea de Newlands, dejar huecos para elementos aun no aislados. La segunda idea fue la de dar diferentes prioridades a las dos ideas organizadoras:
-Organizar los grupos por familias de elementos con propiedades químicas semejantes.
-Organizar los elementos por masa relativa creciente.
Para Mendeleev la primera idea sería más relevante que la segunda en casos anómalos como el yodo y el telurio, pues si se organizan solo por masa relativa creciente, ambos elementos quedarían en familias que no concuerdan con sus propiedades químicas.
Tabla 2.4. Tabla de Mendeleev de 1869
En 1871 Mendeleev publicó una segunda versión de su tabla periódica, sin duda más cercana a la que empleamos actualmente, pero aun así muy distante. En esta nueva versión los elementos con propiedades semejantes se organizaban en columnas y no en filas. A demás apareció un sistema de numeración de los grupos de elementos clásicos que aun hoy es muy empleado. Sobre cada columna se colocó un numero en romano del I al VIII que indicaba el estado de oxidación mayor de un elemento “lo cual también se relaciona con su poder de enlace más alto”, esto debido a que varios elementos podían expresar más de un poder de enlace dependiendo de la situación.
Tabla 2.5. Tabla periódica de Mendeleev de 1871.
En esta versión Mendeleev avanzó más en la idea de Newlands, no solo conformándose en predecir la existencia de un elemento, Mendeleev también predijo las propiedades químicas y físicas del elemento aun por aislar. Mendeleev propuso la existencia de un elemento hasta el momento desconocido, el cual el llamo eka-alumino junto con varias de sus propiedades. Cuando el galio fue descubierto, cuatro años más tarde, sus propiedades coincidieron de manera casi perfecta a las que Mendeleev había predicho para el eka-aluminio.
Figura 2.5. Dmitri Ivánovich Mendeléyev (Tobolsk, 27 de enerojul./ 8 de febrero de 1834greg.-San Petersburgo, 20 de enerojul./ 2 de febrero de 1907greg.) fue un químico ruso, conocido por haber descubierto el patrón subyacente en lo que ahora se conoce como la tabla periódica de los elementos.
A pesar de que Mendeleev argumentó que el criterio de familia era mas importante que el de masa relativa para organizar la tabla, jamás pudo encontrar explicación para paradojas como la del yodo-telurio. Estas y otras discrepancias sugerían que existía alguna propiedad fundamental que daba origen a la periodicidad y que no era la masa relativa, aun que estuviera relacionada con esta. Esta propiedad terminó por estar relacionada con el número atómico, un concepto desconocido para Mendeleev y sus contemporáneos, después de todo ni siquiera creían en la existencia del átomo.
Tabla 2.6. Tabla periódica de Deming.
¿Bueno y si en este punto abandonamos a Mendeleyev, como rayos tenemos una tabla distinta?
2.5 Tablas periódicas del siglo XX
Mendeleev jamás creyó en la existencia del átomo, pero sería ese proyecto de investigación quien arrojaría una propiedad que justificaría la organización periódica sin las paradojas arrojadas por la masa relativa promedio. El concepto original empleado no fueron los protones sino la carga atómica (zI).
Figura 2.6. Henry Gwyn Jeffreys Moseley (23 de noviembre de 1887-10 de agosto de 1915) fue un físico y químico inglés. Su principal contribución a la ciencia fue la justificación cuantitativa del concepto de número atómico mediante la Ley de Moseley. En química avanzada proporcionó un apoyo fundamental al modelo atómico de Bohr definido con detalle por Rutherford y Antonius van den Broek, mencionando que los núcleos atómicos contienen cargas positivas iguales a su número atómico.
En 1914 el físico ingles Henry Moseley encontró una relación entre la longitud de onda de rayos X de un elemento y la carga atómica. Moseley reorganizó la tabla periódica en términos de la carga atómica positiva absoluta. Mediante este proceso Moseley pudo corregir diversas anomalías en la tabla periódica como la posición del telurio y el yodo; o la posición del potasio y el argón. A pesar de ser un método de organización físico, el nuevo sistema concordaba de forma exacta y sin anomalías con las propiedades químicas sin tener que cambiar posiciones a las malas. Moseley también demostró que existían huecos en la tabla periódica para los elementos de carga 43 y 61 conocidos actualmente como el tecnecio y el prometio.
Tabla 2.7. Versión real de la tabla de Deming.
La estructura clásica de la tabla periódica con la que todos hemos crecido, también conocida como como la tabla común o tabla estandarizada se atribuye a alguien menos conocido, un químico Americano llamado Horace Groves Deming. En 1923 Deming Reorganizó la tabla de Moseley de forma tal que tuviera 18 columnas.
Las características de esta tabla ya la acercan a nuestra versión, los lantánidos son sacados de la tabla debido a razones de espacio, de lo contrario se vería así (Tabla 2.7).
Tabla 2.8. Tabla de Seaborg, versión real
Las características principales de la tabla de Deming es la separación en bloques, antes todos los elementos se encontraban en un mismo bloque así tuvieran que compartir casillas, ahora hay un bloque para los metales de transición que Deming llamó metales pesados, otro para las tierras raras radioactivas y dos bloques que intentaban separar los metales ligeros de los no metales. Adicionalmente los gases nobles se colocaban a la izquierda ya que esta tabla se organiza por valencia, y como los gases nobles no tienen poder de enlace en condiciones normales se los considera como de valencia 0. Una diferencia notable es que no se encuentra aún la serie de los actínidos separada y algunos de sus miembros aún son considerados metales pesados o de transición. Industrias Merck preparo una tabla de mano con la versión de Deming en 1928, la cual se popularizó escolarmente en los colegios de enseñanza media y básica secundaria de los Estados Unidos. Para 1930 ya aparecía repetida en los manuales y enciclopedias de química.Tabla 2.9. La tabla de Seaborg nuevamente tiene dos versiones, una en la que los elementos del bloque f salen para que los cuadros puedan ser más grandes y otra que es la verdadera configuración.
En 1945, Glenn Seaborg un Químico Americano realizó la sugerencia de que los elementos actínidos no pertenecían al grupo de los metales de transición, para la época se pensaba que solo los lantánidos llegaban hasta el subnivel f de la tabla periódica. Seaborg a pesar de los consejos en contra afirmó que los actínidos también debían llenar el subnivel f y publicó sus ideas, estas junto con su trabajo en la síntesis de elementos actínidos le permitieron ganar el premio nobel de química en 1951. La estructura final dada por Seaborg es la tabla que recibimos nosotros, aunque es probable que no sea la misma que verán nuestros hijos, la tabla aún sigue siendo un modelo teórico y predictivo en constante desarrollo.
2.6 Llenando las cacillas con interrogantes
Yo mismo he enseñado un mito falso, que los elementos naturales van hasta el uranio (92 y más allá todos son sintéticos), la verdad es que los elementos naturales van hasta el plutonio (94), pero la idea de transuránicos es mucho más fuerte y tiene, como en todos estos mitos o paradojas de la ciencia, una razón histórica (Eisenbud et al., 1984; Peppard et al., 1951). Aunque cantidades minúsculas de plutonio y neptunio existen naturalmente, estos elementos fueron identificados primero mediante la síntesis nuclear (Eisenbud et al., 1984; Hakim, 2007; Peppard et al., 1951).
Figura 2.7. Glenn Theodore Seaborg (Ishpeming, Michigan, 19 de abril de 1912-Lafayette, California, 25 de febrero de 1999) fue un químico atómico y nuclear estadounidense que obtuvo el Premio Nobel de Química en 1951 por sus «descubrimientos en la química de los elementos transuránicos». Es recordado sobre todo por el descubrimiento y aislamiento de diez elementos químicos, por el desarrollo del concepto de elemento actínido y por ser el primero en proponer la serie actínida, que fijó la disposición actual de la tabla periódica de los elementos.
En cualquier caso, fue el neptunio el primer elemento en ser sintetizado en un laboratorio en el año de 1939. Muchos de estos elementos sintéticos son inestables y decaen “es decir se rompen o fisionan produciendo elementos hijos ligeros y más estables” muy rápido, por lo que es muy retador poder detectarlos y caracterizarlos después de ser producidos (Ball, 2004). Han existido controversias con respecto a la aceptación de la síntesis de algunos de estos elementos por laboratorios en competencia, lo cual ha hecho que la asignación de prioridades sea un dolor de cabeza. Lo anterior provocó que el sistema de bautizo de los elementos nuevos fuera complejo (Barber, Karol, Nakahara, Vardaci, & Vogt, 2011).
Los nombres elementales aceptados más recientes son los de Flerovio “elemento 114” (Yakushev et al., 2014) y el Livermorio “elemento 116” (Witze, 2012), los cuales eran anteriormente ununquadium y ununhexium; ambos bautizados en mayo de 2012. En 2010 un equipo conjunto ruso-americano afirmó haber sintetizado seis átomos del ununseptium “elemento 117” (Witze, 2012). En diciembre de 2015, los elementos 113, 115, 117 y 118 fueron formalmente aceptados por la IUPAC completando finalmente el séptimo periodo de la tabla periódica. De esta forma nombres oficiales para la fila de los ununs----- propuestos y acuñados durante el año 2016 (Banks, 2016a, 2016b; Winter, 2015). El 28 de noviembre de 2016, los científicos de la IUPAC reconocieron oficialmente los nombres de cuatro de los elementos químicos más nuevos, con los números atómicos 113, 115, 117 y 118, siendo estos nihonio 113, moscovio 115, tenesio 117 y oganesón 118 (Corish, 2016; Jarlskog, 2016; Mayfield & Sayle, 2017).
2.7 Diferentes formas de representar la tabla periódica
👉 Forma larga y forma estándar
La tabla periódica moderna a veces se expande en su forma larga o de 32 columnas al restablecer los elementos del bloque f ubicado como notas a pie de página en su posición natural entre los bloques s y d. A diferencia de la forma de 18 columnas, esta disposición da como resultado que no existe ninguna interrupción en la secuencia del aumento de números atómicos (Scerri, 2013). La relación del bloque f con los otros bloques de la tabla periódica también se vuelve más fácil de ver. Jensen aboga por una forma de mesa con 32 columnas sobre la base de que los lantánidos y actínidos son relegados en la mente de los estudiantes como elementos aburridos y sin importancia que pueden ser puestos en cuarentena e ignorados (Newell, 1980). A pesar de estas ventajas, los editores generalmente evitan la forma de 32 columnas a causa de su proporción rectangular incómoda, debido a que las celdas de cada elemento serían más pequeñas, y también a la familiaridad de los químicos con la forma moderna introducida por Seaborg.
👉 Versiones alternativas de la tabla periódica
Entre los 100 años de la aparición de la tabla de Mendeleev en 1869, se ha estimado que se publicaron alrededor de 700 versiones diferentes de tablas periódicas (Scerri, 2006). Además de numerosas variaciones rectangulares, otros formatos de tablas periódicas se han configurado, por ejemplo, como un círculo, cubo, cilindro, edificio, espiral, lemniscato, prisma octogonal, pirámide, esfera o triángulo. Tales alternativas a menudo se desarrollan para resaltar o enfatizar las propiedades químicas o físicas de los elementos que no son tan evidentes en las tablas periódicas tradicionales, dado que es difícil expresarlas en una forma plana en la hoja de un libro.
Se puede pensar que las diversas formas de tablas periódicas se encuentran en un continuo cuyos extremos son el punto de vista químico y el punto de vista físico (Scerri, 2006). Hacia el extremo químico del continuo se puede encontrar, por ejemplo, la tabla periódica "ingobernable" de Rayner-Canham, de la Tabla Periódica de Químicos Inorgánicos que enfatiza tendencias, patrones, relaciones y propiedades químicas inusuales. Cerca del extremo de la física la Tabla Periódica del Paso Izquierdo de Janet (1928). Esto tiene una estructura que muestra una conexión más cercana al orden del llenado del último nivel de energía y, por asociación, a la mecánica cuántica ( Scerri, 2008). La razón por la cual la forma estándar es tan, estandarizadamente aceptada es el hecho de que, en el medio de los dos puntos de vista, siendo útil para ambos extremos. Se cree que su popularidad es el resultado de que este diseño tiene un buen equilibrio de características en términos de facilidad de construcción y tamaño, y su descripción del orden atómico y las tendencias periódicas (Francl, 2009).
2.8 El futuro
No está claro si los elementos nuevos continuarán con el patrón de la tabla periódica actual como período 8, o si requieren más adaptaciones o ajustes. Seaborg esperaba que el octavo período siguiera exactamente el patrón establecido previamente, simplemente que adicionando los elementos del bloque g, sin embargo, físicos como Pekka Pyykkö han teorizado que estos elementos adicionales no siguen la regla de Madelung, que predice cómo se llenan los orbitales de electrones y, por lo tanto, afecta la apariencia de la tabla periódica actual. Actualmente existen varios modelos teóricos en competencia para la colocación de los elementos de número atómico 119 a 172. En todos estos, el elemento 172, en lugar del elemento 168, emerge como el siguiente gas noble después de oganesón, aunque esto debe ser considerado especulativo, ya que no se han realizado cálculos completos más allá del elemento 122 (Pyykkö, 2011).
3. Bloques de la tabla periódica
|| REGRESAR AL INDICE ||
La tabla periódica se divide en una serie de regiones de acuerdo a criterios como los patrones de reactividad, la cantidad de electrones en el último nivel de energía, el subnivel energético que alcanza a ocupar en estado fundamental, entre otros criterios. Las principales divisiones son los bloques, las familias y los períodos.
Los grupos más grandes que podemos hacer en una tabla periódica es la de los bloques. Los bloques son regiones específicas de la tabla que se reconocen de acuerdo al punto en que la configuración electrónica de AUFBAU llegó al tope. De este modo los bloques reciben el mismo nombre que los números cuánticos llamados subniveles, siendo estos; s, p, d, f.
Figura 3.1. Bloques de la tabla periódica según el último subnivel de energía.
3.1 Bloque s
Agrupa a los metales alcalinos y alcalinotérreos, con propiedades semejantes. Son metales con alta reactividad. Los únicos no metales en este bloque son el hidrógeno y el helio. A demás el helio tiene una muy pobre reactividad.
3.2 Bloque p
Allí se ubica la mayoría de los elementos representativos, siendo aproximadamente la mitad no metales. Sus propiedades son muy diversas.
3.3 Bloque d
Metales de transición, todos son metales que tienden a ser plateados, difíciles de fundir y bastante duros, aunque existen variaciones individuales como el oro o el mercurio. Muchos de los miembros del periodo 7 no están bien caracterizados debido a que son sintéticos.
3.4 Bloque f
Todos son metales radioactivos e inestables, y casi la mitad son sintéticos.
4. Grupos representativos
|| REGRESAR AL INDICE ||
En química un grupo o familia representa un conjunto vertical de elementos en la tabla periódica de los elementos químicos. En la actualidad se reconocen 18 grupos sin contar a los miembros del bloque f (las dos filas de elementos que aparecen por debajo aparentemente desconectados en las tablas estandarizadas modernas) los cuales no están numerados.
Figura 4.1. Los tres sistemas de nombres aparecen simultáneamente en la mayoría de tablas.
Los elementos de cada grupo poseen propiedades químicas y físicas semejantes, así como características análogas en su capa externa de electrones. Existe en la actualidad tres sistemas para numerar los grupos y al menos dos sistemas para nombrarlos semánticamente, ¡es un caos! Más aún porque los profesores y profesionales no químicos tendemos a emplear la nomenclatura vieja y los de la IUPAC ya van por otro lado, pero regresemos al asunto.
El sistema moderno (Figura 9 IUPAC nuevo) para numerar los grupos es simple, números arábigos del 1 a 18 consecutivos desde la izquierda a la derecha incluyendo a los metales de transición, pero excluyendo a los miembros del bloque f. Este sistema se usa muy poco, así que mencionaremos los dos sistemas previos. El CAS que representa las siglas para Servicio de Resúmenes Químicos y el viejo sistema IUPAC.
Ambos son reconocibles al emplear numerales romanos principalmente, aunque algunas fuentes podían emplear numerales arábigos, aunque es raro, así como los literales A y B. Ambos sistemas concordaban los números romanos, pero tenían un uso y significación completamente diferente para las letras. De hecho, en lo único en que concuerdan es en el nombre del viejo grupo VIII de Mendeleev justo en el centro de los metales de transición. En Colombia históricamente empleamos más el sistema CAS, que emplea los literales A para los elementos representativos, es decir aquellos pertenecientes a los bloques s y p, mientras que emplea el literal B para los metales de transición, los números romanos se interpretan como los electrones s y p de la capa externa que representan comúnmente la valencia más común del elemento; algo muy útil para enseñar la regla del octeto.
Aunque el sistema IUPAC nuevo es más sencillo, aún seguimos empleando el CAS para los elementos representativos debido a que concuerda con la cantidad de electrones de valencia máximo de cada grupo que representa, por ejemplo, los miembros del grupo VII tienen como máximo 7 electrones de valencia, o lo que es lo mismo, la posibilidad de generar 7 enlaces en una molécula en su mayor estado de oxidación. Ahora, los dos sistemas para nombrarlos semánticamente son, el sistema de familia y el sistema de elemento más ligero. El sistema de familia corresponde a los grupos clásicos, por ejemplo: metales alcalinos, alcalinotérreos, anfígenos o halógenos. Por otra parte, el sistema del elemento más ligero para esos mismos grupos es, el grupo del litio, el grupo de calcio, el grupo del oxígeno y el grupo de flúor.
4.1 Grupos representativos y no representativos
En química y física atómica, el grupo principal es el grupo de elementos (a veces llamados elementos representativos) cuyos miembros más ligeros están representados por helio, litio, berilio, boro, carbono, nitrógeno, oxígeno y flúor, según se ordenan en la tabla periódica de los elementos, es decir, elementos de los bloques s y p. Los elementos del bloque s se caracterizan principalmente por un estado de oxidación principal, y los elementos del bloque p, cuando tienen múltiples estados de oxidación, a menudo tienen estados de oxidación comunes separados por dos unidades.
Los elementos del grupo principal (con algunos de los metales de transición más ligeros) son los elementos más abundantes en la Tierra, en el Sistema Solar y en el universo. Los elementos del grupo 12 a menudo se consideran metales de transición; sin embargo, el zinc (Zn), el cadmio (Cd) y el mercurio (Hg) comparten algunas propiedades de ambos grupos y algunos científicos creen que deberían incluirse en el grupo principal. Ocasionalmente, se han incluido incluso los elementos del grupo 3, así como los lantánidos y actínidos, porque especialmente los elementos del grupo 3 y muchos lantánidos son elementos electropositivos con un solo estado de oxidación principal como los elementos del grupo 1 y 2. La posición de los actínidos es más cuestionable, pero los más comunes y estables, el torio (Th) y el uranio (U), son similares a los elementos del grupo principal, ya que el torio es un elemento electropositivo con un solo estado de oxidación principal (+4 ), y el uranio tiene dos principales separados por dos unidades de oxidación (+4 y +6).
En la nomenclatura más antigua, los elementos del grupo principal son los grupos IA y IIA, y los grupos IIIB a 0 (grupos CAS IIIA a VIIIA). El grupo 12 está etiquetado como grupo IIB en ambos sistemas. El grupo 3 está etiquetado como grupo IIIA en la nomenclatura anterior (grupo CAS IIIB).
En este documento definiremos a los elementos representativos como aquellos que pertenecen al grupo 1-2 y 13-18, teniendo la mayoría de estos grupos o familias de elementos nombres cualitativos como metales alcalinos o gases nobles.
4.2 Hidrógeno
No existe un lugar donde podamos ubicar al hidrógeno en la tabla periódica sin que empiece a formar problemas. Tradicionalmente se lo ha ubicado a la cabeza del grupo 1, pero realmente no existe un químico con dos dedos de frente que se atreva a denominarlo como un metal alcalino. Aunque el hidrógeno comparte la misma configuración electrónica en el último nivel de energía con los demás metales alcalinos, su electronegatividad es mucho más grande, por lo que es bien capaz de despojar de los electrones a algunos metales muy poco electronegativos formando el ion hidruro. El hidrógeno sin embargo posee una electronegatividad más débil que la de los elementos ubicados a la derecha de la tabla, como los halógenos y la mayoría de los anfígenos de importancia, por lo que ante ellos pierde su único electrón, formando el ion hidrón. Este ion se comporta similar al que forman los metales alcalinotérreos ante los mismos elementos halógenos y anfígenos.
4.3 Grupo 1: Metales alcalinos
Los metales alcalinos poseen propiedades consistentes. Todos son metales brillantes, blandos y altamente reactivos en condiciones estándar. Son fuertemente metálicos y con baja electronegatividad por lo que tienden a convertirse en iones positivos mediante la pérdida de un electrón en las reacciones iónicas. Se oxidan con rapidez en la atmósfera y deben ser almacenados en aceite para que no estén en contacto con el oxígeno del aire. Reaccionan con violencia con el agua, y a mayor peso con más energía. El hidrógeno se localiza en esa columna aun cuando pose características ambivalentes que lo colocarían también como un elemento del grupo 17. Los nombres del grupo son: IA en el viejo IUPAC; IA en el CAS; 1 en el nuevo IUPAC, metales alcalinos como nombre clásico; y grupo del litio.
Figura 4.2. El sodio es un metal típico de alta reactividad del grupo 1.
4.4 Grupo 2; metales alcalinoterreos
Los elementos alcalinotérreos también son metales que reaccionan violentamente con el agua, pero en menor medida que los alcalinos.
Figura 4.3. El calcio puro también es un metal como todos los elementos del grupo 2.
Estructuralmente hablando pueden dar dos electrones en su último nivel de energía, pero a diferencia del helio, estos los pueden perder con facilidad para formar compuestos iónicos, así como iones con dos cargas positivas. Los nombres de este grupo son: IIA en el IUPAC viejo; IIA en el CAS; 2 en el IUPAC nuevo; metales alcalinotérreos como nombre clásico; y grupo del berilio.
4.5 Grupo 13 icosagenos
Los miembros del grupo 13 poseen un poder de enlace “valencia” de 3 y tienden a tener una electronegatividad baja, por lo que forman iones de carga positiva. Todos tienen carácter metálico menos el primero, el boro. Su reactividad aumenta con forme la masa del elemento se hace mayor. Cas: IIIA; IUPAC viejo: IIIB; IUPAC nuevo: 13; Nombre trivial/clásico: icosagenos o trienos; Nombre de cabeza de grupo: grupo del boro.
Figura 4.4. Los no metales como el carbono tienden a presentar formas físicas diferentes a pesar de ser sustancias puras, para el carbono estas formas llamadas alótropos son el carbón mineral, el grafito y el diamante.
4.6 Grupo 14 tetrenos
El carbono es un no metal, el silicio y el germanio son metaloides, mientras que el plomo y presumiblemente el flevorio son metales. Todos tienen un poder de enlace (valencia) de dos, pero la hibridación puede alterarlo a cuatro que es el más normal. Su electronegatividad intermedia permite la formación de enlaces covalentes. Cas: IVA; IUPAC viejo: IVB; IUPAC nuevo: 14; Nombre trivial/clásico: cristalógenos o tetrenos: Nombre de cabeza de grupo: grupo del carbono.
4.7 Grupo 15 pnictógenos
El nitrógeno y el fósforo no son metales, el arsénico y el antimonio son metaloides, y el bismuto es un metal. Estos elementos poseen valencias variables, pero la más constante es cinco. Al igual que en el grupo anterior, la electronegatividad de este grupo puede denominarse como intermedia, especialmente en los miembros más ligeros, lo que permite la formación de enlaces covalentes. Cas: VA; IUPAC viejo: VB; IUPAC nuevo: 15; Nombre trivial/clásico: pnictógenos; Nombre de cabeza de grupo: grupo del nitrógeno.
4.8 Grupo 16 anfígenos
La mayoría no son metales menos el telurio que es un metaloide y el polonio que es un metal. El poder de enlace base de estos elementos es de dos, pero la hibridación permite otros siempre en pares como el cuatro y el seis. Los miembros sólidos del grupo son buenos aislantes y pobres conductores de electricidad. La electronegatividad disminuye a medida que la masa aumenta lo que altera radicalmente el comportamiento químico, desde un no metal altamente electronegativo como el oxígeno hasta un metal poco electronegativo como el polonio. Cas: VIA; IUPAC viejo: VIB; IUPAC nuevo: 16; Nombre trivial/clásico: calcógenos o anfígenos; Nombre de cabeza de grupo: grupo del oxígeno
4.9 Grupo 17 halógenos
Los halógenos en su mayoría no son metales excepto el astato que es un metaloide.
Figura 4.5. Muchos no metales son gases a temperatura ambiente, como en el caso del cloro.
Poseen altas electronegatividades que les permite formar enlaces iónicos con los metales o enlaces covalentes con elementos de los grupos 15 y 16. Al igual que en el grupo anterior la electronegatividad aumenta a medida que el elemento es más ligero, siendo el flúor el elemento con mayor electronegatividad de todos. La electronegatividad puede llegar a implicar reactividad por lo que el flúor reacciona rápido y no se lo encuentra libre en la naturaleza. La mayoría tiene la tendencia a formar múltiples ácidos fuertes. Cas: VIIA; IUPAC viejo: VIIB; IUPAC nuevo: 17; Nombre trivial/clásico: halógenos; Nombre de cabeza de grupo: grupo del flúor.
4.10 Grupo 18 gases nobles
Todos son no-metales gaseosos con poca o nula reactividad. Cas: VIIIA; IUPAC viejo: 0; IUPAC nuevo: 18; Nombre trivial/clásico: gases nobles, aerógenos; Nombre de cabeza de grupo: grupo del helio o grupo del neón.
5. Grupos de transición y tierras raras
|| REGRESAR AL INDICE ||
5.1 Grupo 3
Aunque el grupo no tiene un nombre trivial se lo puede llamar el grupo de las tierras raras más el escandio y el itrio. No poseen propiedades comunes, aunque la mayoría son radioactivos. Algunos exhiben apariencia metálica cromada cuando hay suficiente cantidad para verlos macroscópicamente. Cas: IIIB; IUPAC viejo: IIIA; IUPAC nuevo 3; Nombre trivial/clásico: ninguno, aunque los lantánidos y actínidos reciben el nombre de tierras raras; Nombre de cabeza de grupo: grupo del escandio.
5.2 Grupo 4
Los primeros tres miembros del grupo son metales con alta resistencia al calor, pero el rutherfordio es un elemento sintético que ha sido fabricado en pocas cantidades. Cas: IVB; IUPAC viejo: IVA; IUPAC nuevo 4; Nombre trivial/clásico: ninguno; Nombre de cabeza de grupo: grupo del titanio.
Figura 5.1. El uranio puro, así como todas las tierras raras son de hecho metales.
Figura 5.2. El oro por su baja reactividad no se oxida en condiciones estándar, por lo que es muy valorado.
5.3 Grupo 5
Igual que el grupo 4, los tres primeros son metales refractarios, mientras que el último es un elemento sintetizado artificialmente cuyas propiedades exactas aún son poco entendías. Cas: VB; IUPAC viejo: VA; IUPAC nuevo 5; Nombre trivial/clásico: ninguno; Nombre de cabeza de grupo: grupo del vanadio.
5.4 Grupo 6
Todos son metales muy poco reactivos con enlace metálico fuerte que genera un punto de fusión bastante alto, es decir son difíciles de fundir. Al igual que los demás miembros de los metales de transición el último miembro sintético del grupo está poco estudiado. Cas: VIB; IUPAC viejo: VIA; IUPAC nuevo 6; Nombre trivial/clásico: ninguno; Nombre de cabeza de grupo: grupo del cromo.
5.5 Grupo 7
Igual que siempre, los tres primeros elementos son metales plateados refractarios con poca reactividad, mientras que el último es un elemento sintético poco estudiado. Cas: VIIB; IUPAC viejo: VIIA; IUPAC nuevo 7; Nombre trivial/clásico: ninguno; Nombre de cabeza de grupo: grupo del manganeso.
5.6 Grupos 8, 9 y 10
Misma tendencia, los primeros tres de cada grupo son metales duros resistentes al calor y los últimos son elementos sintéticos. La pregunta evidente es ¿Por qué los sistemas viejos los agrupamos a todos en el mismo conjunto? Como siempre digo, si hay una cosa ilógica se debe a la herencia histórica. En la segunda tabla de Mendeleev el grupo VIII aún no era el de los gases nobles, entre otras porque aún no habían sido descubiertos, por otra parte, algunos de los metales de estos grupos tienen un potencial de enlace de 8 como el rutenio. En otras palabras, estos eran los miembros del grupo VIII original hasta el descubrimiento de los gases nobles que hizo las cosas un poco más complicadas. Cas: VIIIB; IUPAC viejo: VIII; IUPAC nuevo 8, 9 y 10 Nombre trivial/clásico: ninguno; Nombre de cabeza de grupo: grupo del hierro, grupo del cobalto y grupo de níquel.
Figura 5.3. Todos los metales pueden fundirse a una temperatura suficiente, aunque el mercurio destaca por ser el que más rápido lo hace, siendo líquido a temperatura ambiente.
5.7 Grupo 11 metales de acuñado
Los tres primeros son metales brillantes, aunque su punto de fusión no es tan alto. Son generalmente metales con valor económico e industrial debido a la facilidad para darles forma, así como de valor monetario, algunos los llaman metales de acuñado, especialmente el oro y la plata. La reactividad disminuye con forme se avanza en el grupo siendo el cobre el más oxidable y el oro el menos oxidable. Cas: IB; IUPAC viejo: IB; IUPAC nuevo: 11; Nombre trivial/clásico: metales de acuñado; Nombre de cabeza de grupo: grupo del cobre.
5.8 Grupo 12 metales volátiles
A pesar de ser metales de transición los electrones del subnivel d parecen no jugar en los enlaces, por lo que las propiedades de estos elementos son muy similares a aquellas de los metales alcalinotérreos correspondientes, lo cual los hace algo volátiles con el agua. Los dos primeros miembros son metales cromados, pero el mercurio es célebre al ser el único metal que es líquido bajo condiciones estándar. Cas: IIB; IUPAC viejo: IIB; IUPAC nuevo: 12; Nombre trivial/clásico: metales volátiles; Nombre de cabeza de grupo: grupo del zinc.
6. Periodos de la tabla periódica
|| REGRESAR AL INDICE ||
En la tabla periódica de los elementos de la materia, estos se encuentran organizados en una serie de filas en sentido horizontal denominadas periodos. Los periodos aparecieron originalmente como un intento ad hoc “para un uso concreto sin explicación aparente” de organizar las columnas de los elementos con propiedades semejantes. Con el desarrollo de la teoría atómico y la propuesta de las capas de electrones en una configuración electrónica en la actualidad interpretamos los periodos como los grupos de átomos que tienen un máximo de electrones que llega a la misma capa. Cabe destacar que los elementos en los bloques s y p no comparten muchas similitudes en sentido horizontal, pero los elementos de los metales de transición (bloque d) y de las tierras raras (bloque f) si exhiben propiedades químicas semejantes en sentido horizontal. En la naturaleza los elementos estables solo llegan a llenar parcialmente el séptimo nivel, por lo que se ha requerido de síntesis artificiales para completar este, además aún se sigue investigado la posibilidad de poder sintetizar elementos en el octavo nivel.
Figura 6.1. Los periodos en la tabla periódica son las filas horizontales, las tierras raras o miembros del grupo f hacen parte de los periodos 6 y 7, solo que normalmente se los saca por cuestiones estéticas en las tablas periódicas de mano.
6.1 Primer periodo
Aunque el primer periodo contiene menos elementos que los demás, también es cierto que estos dos elementos son los más comunes en todo nuestro universo actual. Ninguno de los dos sigue la regla del octeto y tampoco son capaces de hibridar “alterar su poder de combinación/enlace/valencia” en condiciones normales. Los dos elementos son rarezas ya que pertenecen simultáneamente a dos grupos. El hidrógeno por ejemplo estructuralmente se asemeja a los demás miembros del grupo 1, pero en términos químicos puede comportarse también como un elemento del grupo 17. Mientras que el helio tiene estructura de un elemento del grupo 2, pero químicamente se comporta como un elemento del grupo 18.
6.2 Segundo periodo
El segundo periodo de la tabla periódica, todos son elementos que encabezan los grupos representativos y les dan nombre, por ejemplo, el primer grupo es el del litio, el segundo el del berilio, el del décimo séptimo es del flúor. También son los siguientes elementos más comunes y a demás son de gran importancia en los seres vivos. El oxígeno es el segundo elemento más común en el universo y el carbono es el cuarto más común.
6.3 Tercer periodo
Todos son elementos con isotopos estables, y algunos son muy importantes para los seres vivos como el sodio.
6.4 Cuarto periodo
Los elementos del cuarto periodo tienen elementos del bloque s, el bloque p y por primera vez del bloque d. Muchos de los metales de este nivel son importantes biológicamente, por ejemplo, el ADN no podría replicarse en ausencia de potasio, ninguno de nosotros podría respirar sin hierro, y muchísimas enzimas son marcos de incremento de reactividad para iones de zinc, cobalto o níquel.
6.5 Quinto periodo
En este periodo tenemos algunos de los últimos metales pesados con roles biológicos como el molibdeno y el yodo, así como el elemento radioactivo más ligero, el tecnecio.
6.6 Sexto periodo
En este nivel se encuentra el elemento más pesado que pueden usar los seres vivos, el tungsteno. A demás aparece el bloque f de elementos, algunos de ellos son de los elementos más pesados estables, pero otros son radioactivos. La mayoría son tóxicos, pero el oro y el platino tienden a reaccionar muy poco.
Figura 6.2. Como se puede ver, la mayoría de los elementos en la naturaleza son metales, y la mayoría de estos tienen un color semejante a la plata, son grises.
6.7 Séptimo periodo
Todos los elementos del grupo 7 son inestables y radioactivos. A mayor masa se hacen más inestables, el uranio fue el primer elemento límite pues los demás fueron descubiertos por síntesis y de allí que reciben el nombre de transuránicos. Posteriormente se ha logrado aislar trazas de plutonio e incluso de californio en la naturaleza, pero tan pobres que solo son registrables con equipo de investigación de vanguardia. Los elementos transuránicos se caracterizan por su poca cantidad, solo el einstenio ha logrado sintetizarse hasta poderlo ver macroscópicamente, todos los demás han sido aisladas en cantidades de laboratorio, por el ejemplo, el elemento 118 Ununoctium se conoce solo por ocho átomos. Las propiedades periódicas de los elementos del grupo 7 parecen diluirse, pues solo el francio y el radio exiben las propiedades de sus respectivos grupos.
7. Otras agrupaciones de la tabla periódica
|| REGRESAR AL INDICE ||
7.1 Metales no metales y metaloides
Intuitivamente un metal es como el hierro y un no metal como una roca o un plástico, pero en química la cosa es más complicada. El metal arquetípico en nuestra mente, el hierro es solo un metal a medias de convertirse en no metal en química, y es que la categoría de metal y no metal obedece a un cambio continuo en la tabla periódica. Los metales más metálicos en química son los metales alcalinos, siendo estos suaves y muy reactivos, entonces ¿qué es un metal? Bueno al menos ya podemos excluir que sean duros y estables. Lo que comparten todos los metales es un brillo liso y suave casi cromado, el brillo metálico. Adicionalmente los metales se caracterizan por conducir la electricidad con facilidad debido al enlace que mantiene unida su estructura cuando se encuentran en el sólido elemental puro.
Para ser francos los metaloides también se ven como metales, es decir poseen el brillo metálico cuando se encuentran en el sólido elemental puro, pero no son buenos conductores de la electricidad o calor. Los no metales se definen en base a no ser un metal, ya sé que es redundante pero es que los no metales son diversos, los hay sólidos, los hay líquidos y los hay gases, por lo que lo único que los unifica es carecer de carecer de los atributos de un metal, es decir sin el brillo y sin la conductividad eléctrica cuando se encuentran en el sólido.
7.2 Sintéticos
Tabla 7.1. Tabla periódica con los elementos señalados según son metales, metaloides o no metales.
Un elemento sintético es uno de los 24 elementos químicos que no ocurren naturalmente en la Tierra: han sido creados por la manipulación humana de partículas fundamentales en un reactor nuclear o acelerador de partículas, o la explosión de una bomba atómica; por lo tanto, se denominan "sintéticos" o "artificiales". Los elementos sintéticos son aquellos con números atómicos 95-118, estos 24 elementos se crearon por primera vez desde 1944. El mecanismo para la creación de un elemento sintético es forzar protones adicionales. en el núcleo de un elemento con un número atómico inferior a 95. Todos los elementos sintéticos son inestables, pero se descomponen a un ritmo muy variable: su vida media oscila entre 15,6 millones de años y unos pocos cientos de microsegundos.
Luego se descubrió que otros siete elementos que fueron creados artificialmente, y por lo tanto inicialmente considerados sintéticos, existían en la naturaleza en pequeñas cantidades. El primero, tecnecio, fue creado en 1937. El plutonio, número atómico 94, sintetizado por primera vez en 1940, es otro de esos elementos. Es el elemento con el mayor número de protones (y un número atómico equivalente) en la naturaleza, pero lo hace en cantidades tan pequeñas que es mucho más práctico sintetizarlo. El plutonio es extremadamente conocido debido a su uso en bombas atómicas y reactores nucleares. Ningún elemento con un número atómico superior a 99 tiene ningún uso fuera de la investigación científica, ya que tienen vidas medias extremadamente cortas y, por lo tanto, nunca se han producido en grandes cantidades.
8. Propiedades periódicas
|| REGRESAR AL INDICE ||
Aprender a leer la tabla periódica es vital para que esta sirva realmente como un instrumento de consulta, ya sea para memorizar o identificar un valor o símbolo requerido para resolver un problema de lápiz y papel. En el mercado existen muchos tipos de tabla periódica, pero en esta lección emplearemos la versión de marca Walter, no tanto porque sea la mejor, sino porque más o menos sé dónde están la mayoría de sus errores, y es que hay que tener en cuenta que la mayoría de las tablas periódicas poseen algún tipo de error.
Figura 8.1. La celda clave nos indica el significado de los diversos valores que aparecen en la tabla periódica, así como las convenciones de color.
Figura 8.2. La tabla periódica Walter.
El cuerpo de esta tabla periódica consta de dos lados, sin embargo, la mayoría de temas de química general se resolverán por la primera cara cura celda clave se muestra en la figura anterior. En esta cara ignoraremos la tabla de funciones orgánicas que no emplearemos sino hasta el próximo curso en química orgánica. Enfoquémonos inicialmente en la celda de la clave (Figura 8.1) que se encuentra en la esquina superior izquierda. La clave de instrucciones muestra lo que significan varios de los valores de magnitudes dimensionales, de estos solo los enfocaremos en: nombre, símbolo, grupo de clasificación, numero atómico, peso atómico, estado de oxidación, electronegatividad, y configuración electrónica; al aprender y ubicar estos valores en la tabla se ahorrará mucho tiempo durante la resolución de los ejercicios de lápiz y papel.
8.1 Símbolo del elemento
Al observar una celda en la tabla periódica lo que más sobresale es el símbolo del elemento que está relacionado al nombre, en este sentido podemos separar las siguientes categorías:
👉 Los símbolos que concuerdan con su nombre en español y que poseen una sola letra mayúscula como el hidrógeno H, nitrógeno N y boro B.
👉 Los que concuerdan con su nombre en español y están compuestos por dos letras, la primera mayúscula y la segunda minúscula como en el litio Li y el aluminio Al.
👉 Aquellos que no concuerdan con el nombre en español porque proceden de otros idiomas como en el fósforo P que proviene del latín phosphorus o el azufre S que proviene del latín sulphur.
👉 Del mismo modo hay símbolos que no concuerdan con el nombre en español compuestos por dos letras, la primera mayúscula y la segunda minúscula como en el sodio Na que proviene del latín natrum y el mercurio Hg que proviene del latín hidrargirium.
👉 En tablas posteriores a 1990 y anteriores a 2017 habían elementos con tres letras, la primera mayúscula y las demás minúsculas como en el ununoptio Uuo, en la actualidad estos ya no se muestran, ya que estos elementos desconocidos se han sintetizado en el laboratorio y sus símbolos provisionales han sido reemplazados por símbolos de dos letras, por ejemplo el ununoptio ahora se llama oganesón Og, es probable que algunos de ustedes, así como nosotros en la tengan la tabla anterior a esta actualización, por suerte estos elementos son poco comunes y nos interesarán poco en química general.
8.2 El número atómico
Otro valor que resalta es el número atómico o número Z, este representa las cargas positivas del núcleo, lo que indica directamente la cantidad de protones, también representa la masa atómica aportada por los protones y de manera más fundamental, la identidad de un átomo a un elemento, así todos los elementos con numero atómico (Z=6) serán carbono sin importar su cantidad de neutrones.
8.3 Peso atómico
Uno de los valores más consultados en una tabla periódica es la masa atómica relativa promedio ponderada para una muestra promedio de la corteza terrestre o simplemente “aunque incorrectamente” peso atómico, su símbolo es (Ar) y puede expresarse adimensionalmente.
La unidad Dalton la convierte en la masa atómica absoluta, pero en unidades relativas, y si convertimos Dalton a lo que vale en masa (valor conocido como constante de masa atómica) obtenemos la masa absoluta (mp) o real en gramos o kilogramos, dicha constante vale 1.661x10-24 g, valor que surge al dividir la constante de los gases ideales entre el número de Avogadro.
Recuerde siempre que, aunque en las tablas se refieren a esto como peso atómico, el nombre correcto es masa atómica relativa promedio, aunque ambos pueden emplearse indistintamente en el contexto químico. La unidad de masa atómica o dalton (u) (anteriormente uma) se define como un doceavo de la masa del carbono-12, esto se debe a que determinar la masa de un elemento más masivo presenta menos desviaciones que medir la masa de un elemento tan ligero como el hidrógeno.
Tenga en cuenta que en la clave de datos el “peso atómico” aparece sin unidades, pero otros valores como la temperatura sí, eso se debe a que existen otras magnitudes dimensionales que poseen el mismo valor, pero unidades diferentes, la más importante es la masa molar (M) expresada en (g/mol) y la masa atómica absoluta (mp) expresada en gramos (g).
8.4 Electronegatividad
La electronegatividad representa la capacidad de un núcleo para atraer electrones, ya sean propios o ajenos, y eso afecta el tamaño de un átomo, de esta manera átomos muy electronegativos mantienen sus electrones muy cerca del núcleo, lo cual hace que sean átomos con radios y volúmenes pequeños, es una de las propiedades más interesantes debido a sus aplicaciones, y sobre la cual señalaremos reglas para poder determinar sus magnitudes relativas sin mirar la tabla periódica, su símbolo es χ pero lo usaremos como valores adimensionales.
8.5 Los estados de oxidación
Los estados de oxidación son el mecanismo con el cual determinamos el poder de enlace de los elementos, lo que anteriormente llamaban valencia, así como la carga durante el enlace para determinar el poder oxidante o reductor de un elemento, el problema es que tal como se expresan en la tabla, están resumidos.
En la tabla podemos ver que el flúor posee un estado de -1, pero en realidad debe leerse como que se puede encontrar en 0 o en -1. En el caso del cloro tenemos la expresión ±1, 3, 5, 7, en esta el símbolo (±) solo afecta al valor inmediatamente a la derecha y a ningún otro, por lo que los posibles estados del cloro deben leerse como -1, 0, 1, 3, 5, 7. Algo parecido sucede con el nitrógeno que aparece en la tabla como 2, ±3, 4, 5, los cuales deben leerse como -3, 0, 2, 3, 4, 5.
Tabla 8.1. A parte de que los estados de oxidación de la tabla están condensados, hay que tener en cuenta que para el H, el Cl y el O están incompletos, es conveniente corregir en la Walter adicionando la expresión ± a estos dos elementos, y el estado de oxidación +4 al cloro.
*Algunos estados de oxidación relativamente comunes no están dados en las tablas, a parte del estado 0 que siempre omiten.
Muchas tablas periódicas, como la Walter, nos presentan incorrectamente al oxígeno y al hidrógeno como de carga simple, sin embargo, los estados de oxidación de ambos deberían portar el símbolo ±, así que el oxígeno debe ser ±2 y leerse como -2, 0, 2, mientras que el hidrógeno debería estar como ±1 y leerse como -1, 0, 1, por tal razón se aconseja que realicen esta corrección en sus tablas de mano inmediatamente.
8.6 Carácter metálico
Otro carácter a tener en cuenta es el carácter metálico, que no solo hace referencia a la apariencia, sino a las reacciones, en esquemas como el que se muestra el carácter metálico se da por la apariencia, un metal es una sustancia lustrosa con brillo característico a demás transfiere fácilmente electricidad y calor, mientras que los no metales cuando están sólidos son opacos que no transfieren luz o calor, mientras que los metaloides poseen propiedades físicas mixtas.
Sin embargo, muchos metales de transición poseen reacciones químicas propias de los no metales, existen muchas excepciones, eso se muestra por el otro lado de la tabla Walter con el código llamado “propiedades ácido base”, esto nos advierte que metales como el cromo o el manganeso se comportaran como no metales, los cuales poseen tendencias ácidas, mientras que los metales poseen tendencias básicas. A estos metales que se comportan como no metales en ciertas circunstancias los llamamos anfóteros.
8.7 Configuración electrónica
Una propiedad que emplearemos especialmente al final de este curso es la configuración electrónica cuántica que nos ayudará a inferir como se organizan los electrones en capas y a predecir la geometría de muchas moléculas. Por cierto, la configuración del carbono en la tabla Walter tiene un 2 de más, pero eso lo corregiremos después cuando sepamos de donde vienen esos números.
Figura 8.3. Comenzando por la primera fila de arriba hacia abajo: Nomenclatura CAS para los grupos representativos de la tabla periódica; modelo del átomo cúbico de Lewis para la configuración de los electrones de valencia; elementos del segundo periodo; y elementos del tercer periodo.
Sin embargo, existe una configuración electrónica más simple, y de mayor utilidad, y es la configuración electrónica de Lewis, que puede predecirse empleando la numeración CAS “código azul en romano sobre cada una de las columnas en la tabla Walter”, el valor del número romano representa la cantidad de electrones en la capa de valencia de un átomo del elemento, por lo que para el litio y toda su columna (IA) implica que solo poseen un electrón de valencia.
A medida que nos movemos a la derecha los electrones aumentan de uno en una. Elementos del grupo IIA tendrán dos electrones de valencia, los del IIIA tendrán 3 electrones de valencia y así sucesivamente, la clave aquí es que esto solo funciona para los elementos del bloque s y p., o lo que es lo mismo, no podemos emplear la numeración CAS para inferior los electrones de valencia de Lewis para los elementos de metales de transición y tierras raras
Existen otras propiedades periódicas, pero varias de ellas como los radios atómicos, volúmenes atómicos y potenciales de ionización se infieren a través de la electronegatividad, además solo serán importantes en la siguiente sección cuando analicemos las tendencias periódicas.
9. Ley periódica
|| REGRESAR AL INDICE ||
La tabla periódica se emplea para predecir fenómenos usando la ley periódica, que básicamente es una tendencia a la repetición de propiedades entre un periodo y otro, lo cual provoca la aparición de familias con propiedades físicas y químicas compartidas, lo cual a su vez nos permite predecir algunos valores relativos de la tabla sin tenerla a la mano, el problema es que debemos tener una imagen mental relativa de los elementos de la tabla en la cabeza, por ejemplo, saber que el sodio se encuentra a la izquierda y el cloro a la derecha.
9.1 Tendencias en las familias
Las tendencias entre grupos y periodos son las más evidentes, los grupos o familias por ejemplo se definen inicialmente al compartir reacciones químicas semejantes, debido a que sus configuraciones electrónicas en la capa de valencia son iguales, pero esto no implica que siempre se vean igual, a medida que nos movemos a la derecha de la tabla, los miembros de una misma familia pueden parecer adoptados, sobre todo los de abajo, para términos prácticos las familias de la tabla serán las ocho familias clásicas que en el sistema CAS se nombran como IA hasta VIIIA sin contar las B, además tenemos dos grandes familias de bloque, los metales de transición o bloque d y las tierras raras o bloque f.
9.2 No son fáciles de predecir
Para ser francos la tabla periódica fue primero, y las tendencias después. Esto se debe a que varias características de las tendencias periódicas son propiedades que se midieron después de que la tabla estuviera establecida en su forma general, ya fuera porque no se habían creado algunas líneas de investigación o a la falta de tecnología. En cualquier caso, una vez que una propiedad elemental fue acuñada y medida, la comparación fue inevitable, lo cual al graficar genera una serie de tendencias. La gráfica general es la de curvas periódicas como el latir de un corazón, es decir, en ciclos periódicos. Antes de empezar a estudiar los grupos individuales, tomemos otro vistazo de las tendencias generales. Hemos dicho que los elementos de un mismo grupo poseen propiedades químicas semejantes debido a que poseen una configuración electrónica similar en sus últimos niveles de energía (por eso reciben el nombre de electrones de valencia, porque son aquellos que valen a la hora de realizar reacciones químicas).
Aunque el postulado anterior es correcto en su aplicación general, debe tomarse con pinzas, como todo en química. Los químicos han sabido desde hace mucho tiempo que el primer miembro de cada grupo se diferencia del resto de los miembros del mismo grupo (el litio no presenta prácticamente las mismas propiedades que los miembros de los metales alcalinos por ejemplo). Del mismo modo, el berilio es bastante atípico con respecto a los demás miembros de los metales alcalinotérreos. Los periodos tenemos repeticiones periódicas de las propiedades de los elementos. Las propiedades periódicas presentan tendencias tanto a lo largo de un grupo como de un periodo, por lo que parecen moverse diagonalmente, muchas de estas tendencias están relacionadas a los electrones y la atracción del núcleo sobre estos, por lo que al final podremos combinarlas todas bajo la electronegatividad.
9.3 Relación diagonal
Otra tendencia general de los elementos representativos es la relación en diagonal. La relación en diagonal es una similitud entre pares de elementos de diferentes grupos y periodos de la tabla periódica.
Figura 9.1. Relación diagonal entre las propiedades de elementos de familias adyacentes.
10. Tendencias en las propiedades periódicas
|| REGRESAR AL INDICE ||
10.1 Relaciones diagonales.
Específicamente, los primeros tres miembros del segundo periodo (Li, Be y B) exhiben muchas similitudes con los elementos localizados diagonalmente debajo de ellos en la tabla periódica estándar. La razón para este fenómeno es la similitud entre la densidad de carga de sus cationes (la densidad de carga es la carga de un ión dividida entre su volumen). Los cationes con densidades de carga similares reaccionan de manera similar con aniones formando el mismo tipo de compuestos. Por lo tanto, la química del litio se parece mucho a la del magnesio en muchas características; lo mismo va para el berilio y el aluminio, o para el boro y el silicio.
Cada una de estas parejas exhibe una relación diagonal. Hay que tener en mente que la generalización de la regularidad en las propiedades químicas aplica más fuertemente a aquellos grupos representativos (del IA al VIIIA también conocidos como 1, 2, 13, 14, 15, 16, 17 y 18) cuyos miembros pertenecen a un solo tipo de sustancia (metal o no metal). Por lo anterior, los grupos con propiedades más similares entre si serán los 1 y 2 ya que en ambos solo tenemos metales; y los grupos 17 y 18 ya que en ellos solo existen no metales. En los grupos 14, 15 y 16 donde los elementos cambian entre metales, no metales y metaloides debemos esperar una variación mucho mayor entre las propiedades químicas de cada grupo. En conclusión, los metales alcalinos y alcalinoterreos se parecen entre sí, y los halógenos y los afígenos se parecen entre sí.
10.2 Tendencias del número atómico
El número atómico representa la cantidad de protones que tiene un elemento, y como tal identifica la identidad del elemento, antes del descubrimiento del protón el número atómico se definía con respecto a la carga del núcleo. Durante la era del núcleo se descubrió que un mismo elemento podía presentar átomos con diferentes masas atómicas, esto conllevó a la definición de los isótopos. Sin embargo, todos los isótopos coinciden con la cantidad de protones en el núcleo y por eso se los identifica como un mismo elemento.
Figura 10.1. Tendencia del número atómico y el peso atómico, en azul el elemento con el menor y el rojo el elemento con el mayor número/peso atómico hasta el momento.
10.3 Carácter metálico
Aunque el carácter metálico disminuye de forma continua de izquierda a derecha y de abajo hacia arriba, clásicamente entablamos límites claros entre las categorías de metal, metaloide y no metal.
Figura 10.2. El carácter metálico aumenta en dirección al francio.
10.4 Volumen atómico
Figura 10.3. El volumen y radio atómico también crecen en dirección al francio.
Figura 10.4. Crecimiento del radio atómico para los primeros 5 periodos e la tabla periódica. Podemos ver claramente que el radio crece como esperaríamos para los primeros niveles, pero que en los niveles más altos existen desviaciones.
El volumen atómico es difícil de definir debido a que la nube de electrones se dispersa de manera indefinida desde el núcleo. Aunque definimos el límite de los orbitales como el volumen que representa al 90% de la probabilidad de encontrar a un electrón, tal límite es arbitrario. Bien, aunque generalmente decimos que el radio atómico crece desde la derecha gasta la izquierda y de arriba para abajo, tal como se muestra en las gráficas de muchos libros básicos. La verdad es que, de hecho, es así, pero con ciertos matices.
10.5 Energía de ionización
Es la energía necesaria para que un electrón sea despedido el átomo formando un ion positivo. En consecuencia, para átomos poli-electrónicos se pueden definir energías para varios electrones. En las tablas periódicas se presenta la energía del primer electrón. La energía de ionización "tiende" a crecer de abajo hacia arriba y de izquierda a derecha, de este modo, el elemento que más fácilmente pierde electrones es el francio, y el que más difícilmente pierde sus electrones es el helio.
Figura 10.5. energía de ionización crece en dirección al helio.
Figura 10.6. La gráfica que muestra las energías de ionización de los primeros 90 átomos de la tabla periódica. Podemos darnos cuenta de que los gases nobles tienen energías de ionización muy altas, lo que tiene sentido, pues esta energía refleja que prácticamente nunca pierden sus electrones. Sin embargo, hay otros detalles, los gases nobles más pesados tienen potenciales de ionización más bajos, lo que tal vez explique por qué ellos si pueden generar enlaces en ciertas situaciones. El elemento más electronegativo que no es un gas noble es el flúor.
Siempre es un proceso endergónico, es decir, requiere energía, pero esta energía cambia dependiendo del tipo de átomo, algunos liberan sus electrones muy fácilmente, y en ese caso decimos que tienen bajas energía de ionización, mientras que otros elementos liberan sus electrones muy difícilmente, y en ese caso diremos que tienen altas energía de ionización.
La energía de ionización será más grande a medida que el ion se hace más pequeño, debido a que la fuerza relativa entre la atracción del núcleo y la repulsión de los electrones favorece la retención de los electrones. En otras palabras, a medida que un electrón pierde electrones, no solo se hace más pequeño, también empieza a retener los electrones e le restan con mayor fuerza. Nuevamente debido a que a mayor atracción del núcleo por electrones la energía de ionización es más alta, podemos emplear la propiedad de electronegatividad para inferir la energía de ionización.
10.6 Radio atómico
Figura 10.7. (a) En el radio de elementos metálicos, podemos notar que los radios de los elementos neutros son casi el doble de grandes que los de sus iones, y eso que solo han perdido uno de sus electrones. (b) Radio atómico de elementos no metálicos, en rojo sus estados neutrales diatómicos, en rojo sus formas iónicas. Los elementos no metálicos tienen la tendencia constante a capturar electrones, y al hacerlo sus radios e incrementan, y lo hacen bastante, con un solo electrón de más estos iones prácticamente duplican su radio.
Es el radio de un catión o un anión. Es una propiedad importante, debido a que afecta las propiedades físicas y químicas de los compuestos iónicos como las sales. Cuando un átomo central se convierte en un ión, esperamos un cambio de tamaño. Sí el átomo forma un anión, es decir, si gana electrones, su tamaño o radio atómico se incrementa, debido a que la carga nuclear de atracción permanece constante, pero la repulsión entre los electrones se incrementa, esto causa que las funciones de onda de los electrones se expandan, debido a que cada electrón hace que los demás se alejen de sí mismo.
Si el átomo forma un catión, es decir, si pierde electrones, esperamos que su radio atómico se contraiga, esto se debe a que la repulsión entre los electrones disminuye, mientras que a carga atractiva del núcleo permanece constante. La nube de electrones se contrae, lo que causa que los cationes sean más pequeños que sus átomos neutros.
Figura 10.8. Los elementos metálicos tienden a generar iones con cargas positivas con radios pequeños, mientras que los elementos no metálicos tienden a generar iones con cargas negativos con mayores radios.
En general, los átomos metálicos tienden a disminuir su radio atómico, mientras que los no metales “exceptuando los gases nobles” tendrán a hacerse más grandes.
10.7 Afinidad electrónica
La afinidad electrónica de un átomo es la cantidad de energía liberada cuando se agrega un electrón a un átomo neutro para formar un ion negativo. Aunque la afinidad electrónica varía mucho, surgen algunos patrones. Generalmente, los no metales tienen valores de afinidad de electrones más positivos que los metales. El cloro atrae con mayor fuerza un electrón extra. Las afinidades electrónicas de los gases nobles no se han medido de manera concluyente, por lo que pueden tener o no valores ligeramente negativos.
La afinidad electrónica generalmente aumenta a lo largo de un período. Esto es causado por el relleno de la capa de valencia del átomo; un átomo del grupo 17 libera más energía que un átomo del grupo 1 al obtener un electrón porque obtiene una capa de valencia llena y, por lo tanto, es más estable.
Se esperaría una tendencia a la disminución de los grupos descendentes de afinidad electrónica. El electrón adicional estará ingresando en un orbital más alejado del núcleo. Como tal, este electrón se sentiría menos atraído por el núcleo y liberaría menos energía cuando se agregará. Al descender un grupo, alrededor de un tercio de los elementos son anómalos, con elementos más pesados que tienen afinidades electrónicas más altas que sus congéneres más ligeros. En gran parte, esto se debe a la escasa protección de los electrones d y f. Una disminución uniforme en la afinidad electrónica solo se aplica a los átomos del grupo 1.
10.8 Electronegatividad
La electronegatividad es quizá la propiedad periódica que más nos servirá en nuestro estudio del enlace químico, ya que ella nos dice cuando un átomo puede formar alguno de los grandes tipos de enlace químico.
Figura 10.9. La afinidad electrónica y la electronegatividad crecen en dirección del flúor.
Podemos definir a la electronegatividad como la propiedad que tiene un núcleo atómico de atraer los electrones a su alrededor. Los electrones atraídos a su alrededor pueden ser tanto los propios como los ajenos. La electronegatividad tiene diferentes escalas, la más comunes la de Pauling aunque formalmente se expresa como un escalar adimensional. La electronegatividad tiende a crecer de izquierda a derecha y de abajo hacia arriba, aunque pueden existir desviaciones en los bloques d y f.
Esto implica que los elementos con grandes electronegatividades tienen en sus estados fundamentales pequeños radios atómicos, debido a que las nubes de electrones están fuertemente atraídas a sus núcleos. También implica que os elementos con grandes electronegatividades pueden atraer electrones muy fácilmente de otras fuentes. La electronegatividad crece de izquierda a derecha y de abajo hacia arriba omitiendo a los gases nobles generalmente. De este modo en sentidos prácticos ele elemento más electronegativo es el flúor y el menos electronegativo es el francio.
10.9 Valencia
Es el potencial para formar enlaces o combinaciones. Un elemento con una valencia de 1 se unirá con un átomo de otro elemento mediante un enlace simple. Si tiene una valencia de dos se puede enlazar con otros dos átomos o formar un enlace doble. Las valencias no son entidades fijas, muchos elementos tienen valencias variables que no siguen la regla del octeto; tales casos se explican mejor mediante la hibridación, y son la mayoría.
10.10 Elementos de vínculo
De izquierda a derecha a través de los cuatro bloques de la tabla larga o de 32 columnas de la tabla periódica hay una serie de grupos de elementos de enlace o puente, ubicados aproximadamente entre cada bloque. Estos grupos, como los metaloides, muestran propiedades en el medio, o que son una mezcla de grupos a cada lado. Químicamente, los elementos del grupo 3, escandio, itrio, lantano y actinio se comportan en gran medida como metales alcalinotérreos o, más generalmente, bloquean metales pero tienen algunas de las propiedades físicas de los metales de transición. El Lutecio y lawrencio, al final del final del bloque f, pueden constituir otro grupo de enlace o puente. El lutecio se comporta químicamente como lantánido, pero muestra una mezcla de propiedades físicas de lantánidos y del metal de transición. El lawrencio, como un análogo del lutecio, podría mostrarse como mezcla de características de tierras raras y metales de transición.
Figura 10.10. Tabla periódica de 32 columnas que muestra, de izquierda a derecha, la ubicación del grupo 3; lutecio y lawrencio; grupos 11-12; y los gases nobles.
Los metales de acuñación en el grupo 11 (cobre, plata y oro) son químicamente capaces de actuar como metales de transición o como metales representativos. El grupo 12 de metales volátiles, zinc, cadmio y mercurio a veces se considera que une el bloque d al bloque p. En teoría, son elementos d bloque, pero tienen pocas propiedades de metal de transición y se parecen más a sus vecinos de bloque p en el grupo 13. Los gases nobles relativamente inertes, en el grupo 18, unen los grupos de elementos más reactivos en la tabla periódica: los halógenos en el grupo 17 y los metales alcalinos en el grupo 1.
11. Los límites de la tabla periódica
|| REGRESAR AL INDICE ||
La tabla periódica de Deming-Seaborg (la que usamos en el colegio) es un modelo científico pensado principalmente para la química y de forma secundaria para la física, de allí que algunos físicos propusieran otras versiones. Sin embargo, como todos los modelos y teorías científicas la tabla periódica posee errores o inconsistencias, que no la hacen menos importante.
11.1 Elementos con propiedades desconocidas
Aunque todos los elementos hasta el ununoctium han sido aislados o sintetizados, solo los elementos 112 copernicio y 114 flerovio han sido caracterizados químicamente. Los demás elementos siguen siendo incógnitas, incluso en su apariencia macroscópica debido a que solo se han producido átomos de ellos, una cantidad insuficiente para determinar sus capacidades reactivas u organolépticas (Samuelson, 2000).
11.2 Extensiones futuras de la tabla
Aun no es claro si los nuevos elementos amas allá del 118 continuarán el patrón de la tabla periódica en el periodo 8, o si se requerirán de ajustes posteriores, incluso no es claro si es posible sintetizarlos. Incluso se ha llegado a especular que estos elementos nuevos seguirán aún menos las reglas de llenado de capas electrónicas, por lo que cualquier cosa podía pasar (Fricke, Greiner, & Waber, 1971).
El número exacto de átomos pesados sintetizables es desconocido. Sin embargo, existe un modelo moderno denominado como isla de estabilidad, la cual predice que la estabilidad teórica máxima se extiende solo hasta el elemento 126. Existen otros estimativos que ponen el límite en el 128, en el 137 y en el 155. Solo el tiempo y la tecnología pondrán a prueba cada uno de estos modelos (Fricke et al., 1971).
11.3 El problema del helio y el hidrógeno
Por medio de las configuraciones electrónicas el hidrógeno y el helio pertenecen al grupo 1 y 2, pero si se ven las propiedades químicas pertenecen a los grupos 17 y 18. El hidrogeno ha sido puesto en su punto estructural, mientras que el helio en su punto químico (Cronyn, 2003). De hecho, el hidrógeno comparte características con el grupo 1 y 17 así que algunas tablas lo repiten en ambas posiciones. Otra alternativa más rara es ponerlo en el grupo 14 con el carbono debido a algunas características fisicoquímicas, aunque en tal taso la química y la valencia concordarían menos (Cronyn, 2003). Tal vez la solución más útil es decir que el hidrogeno hace un grupo de uno, con propiedades únicas a los demás elementos (Cronyn, 2003). Debido a que la naturaleza de la tabla periódica es química antes que física, la decisión más lógica para la tabla es que el hidrógeno forme el grupo de uno, un elemento raro en propiedades, pero extremadamente común y fundamental para nuestro universo.
De hecho, la desición de colocar al hidrógeno con los metales alcalinotérreos recae en una propiedad de metalización, esta fase fue predicha en 1935 en terrenos teóricos por Eugene Wigner y Hillard Bell Huntington (Wigner & Huntington, 1935). A altas presiones y temperaturas, el hidrógeno metálico podría existir como un líquido en lugar de como un sólido, y los investigadores creen que está presente en grandes cantidades en los interiores calientes y gravitacionalmente comprimidos de Júpiter, Saturno y en algunos planetas extrasolares (Johnson et al., 2004).
11.4 Grupos incluidos en los metales de transición
Este es el problema del grupo 12, el grupo del zinc no se comporta como los metales de transición, de hecho, funciona más como un metal alcalinotérreo a pesar de que su configuración electrónica es la de un metal de transición. Este es un caso en el que el criterio físico supera al criterio químico, pero igual esto es una cuestión histórica (House & House, 2015).
Este grupo es una desgracia, son los primeros dos miembros son inconfundiblemente pertenecientes a un grupo el escandio y el itrio, pero los demás miembros son confusos. Algunos proponen, tal como está actualmente que el lantano y el actinio pertenecen también, otros proponen que el grupo 3 solo está compuesto por los primeros dos elementos, otros que el lutecio y el laurencio deberían estar allí en lugar del lantano y el actino, mientras que otros que el grupo 3 está compuesto por todos los lantánidos y actínidos, más el lantano, el actino el itrio y el escandio (Scerri, 2012). La IUPAC ha conformado una comisión en 2015 para dar un veredicto arbitrario al respecto, así que hay que esperar.
Referencias bibliográficas
|| REGRESAR AL INDICE ||
Baird, D., Scerri, E., & McIntyre, L. (2006). Philosophy of Chemistry: synthesis of a new discipline (Vol. 242). Springer.
Ball, P. (2004). The ingredients: a guided tour of the elements. Recording for the Blind & Dyslexic.
Banks, M. (2016a). Discovery announced of four new elements. Physics World, 29(2), 11.
Banks, M. (2016b). Japanese lab spells out collider needs. Physics World, 29(2), 11.
Barber, R. C., Karol, P. J., Nakahara, H., Vardaci, E., & Vogt, E. W. (2011). Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report). Pure and Applied Chemistry, 83(7), 1485–1498.
Bensaude-Vincent, B., & Abbri, F. (1995). Lavoisier in European context: negotiating a new language for chemistry (Vol. 1). Science history publications.
Blei, I., & Odian, G. (2006). General, Organic , and biochemistry (2a ed.). W. H. Freeman and Company.
Brown, W. H., & Poon, T. (2014). Introduction to Organic Chemistry (5a ed.). Wiley & Sons.
Camacho, J. P. G., Gallego, R. B., & Pérez, R. M. (2007). La ley periódica. Un análisis histórico epistemológico y didáctico de algunos textos de enseñanza. Educación química, (da época), 278–288.
Chalmers, A. (2005). Atomism from the 17th to the 20th Century.
Chang, R. (2006). Chang’s “General Chemistry - Essential Concepts” (4a ed.). McGraw-Hill New York.
Chang, R. (2010). Chemistry (10a ed.). McGraw-Hill New York.
Chang, R., & Overby, J. (2011). General Chemistry,Th e Essential Concepts (11a ed.). McGraw-Hill New York.
Corish, J. (2016). Procedures for the Naming of a New Element. Chemistry International, 38(2), 9–11.
Cronyn, M. W. (2003). The proper place for hydrogen in the periodic table. Journal of chemical education, 80(8), 947.
Ebbing, D. D., & Gammon, S. D. (2008). General chemistry. (Houghton Mifflin Company, Ed.) (9a ed.). Bonston.
Eisenbud, M., Krauskopf, K., Franca, E. P., Lei, W., Ballad, R., Linsalata, P., & Fujimori, K. (1984). Natural analogues for the transuranic actinide elements: An investigation in Minas Gerais, Brazil. Environmental Geology and Water Sciences, 6(1), 1–9.
Eliade, M., ET, & Ledesma, M. P. (1974). Herreros y alquimistas. Alianza Madrid.
Emsley, J. (1987). The Development of the Periodic Table of the Chemical Elements. Interdisciplinary Science Reviews, 12(1), 23–32.
Emsley, J. (2011). Nature’s building blocks: an AZ guide to the elements. Oxford University Press.
Francl, M. (2009). Table manners. Nature chemistry, 1(2), 97–98.
Fricke, B., Greiner, W., & Waber, J. T. (1971). The continuation of the periodic table up to Z= 172. The chemistry of superheavy elements. Theoretica chimica acta, 21(3), 235–260.
Gilbert, T. R., Kirss, R. V, Foster, N., & Davies, G. (2012). Chemistry, the science in context (3a ed.). W. W. Norton & Company, Inc.
Gorzynski, J. (2010). General, organic, and biological chemistry (1a ed.). McGraw-Hill Education.
Hakim, J. (2007). The Fission Vision. The Science Teacher, 74(8), S204.
House, J. E., & House, K. A. (2015). Descriptive inorganic chemistry. Academic Press.
Izquierdo-Aymerich, M., & Adúriz-Bravo, A. (2009). Physical construction of the chemical atom: Is it convenient to go all the way back? Science & Education, 18(3–4), 443–455.
Jarlskog, C. (2016). Validation of new superheavy elements and IUPAC-IUPAP joint working group. En EPJ Web of Conferences (Vol. 131, p. 6004). EDP Sciences.
Jespersen, N. D., Brady, J. E., & Hyslop, A. (2012). Chemistry The Molecular Nature of Matter (6a ed.). USA: Wiley.
Johnson, R. E., Carlson, R. W., Cooper, J. F., Paranicas, C., Moore, M. H., Wong, M. C., … McKinnon, W. B. (2004). Jupiter—The Planet, Satellites, and Magnetosphere. Cambridge University Press Cambridge, UK.
Kauffman, G. B. (1999). From triads to catalysis: Johann Wolfgang Döbereiner (1780–1849) on the 150th anniversary of his death. The Chemical Educator, 4(5), 186–197.
Mayfield, J. W., & Sayle, R. A. (2017). Technical implications of new IUPAC elements in cheminformatics. Journal of cheminformatics, 9(1), 10.
McMurry, J. (2012). Organic Chemistry (8a ed.). Belmont, USA: Brooks/Cole.
Mendeleev, D. (s/f). definitions-periodic table report a problem. Group, 1(2), 3.
Newell, S. B. (1980). Chemistry: an introduction. Little Brown and Company.
Oganessian, Y. T., Abdullin, F. S., Bailey, P. D., Benker, D. E., Bennett, M. E., Dmitriev, S. N., … Itkis, M. G. (2010). Synthesis of a new element with atomic number Z= 117. Physical review letters, 104(14), 142502.
Peppard, D. F., Studier, M. H., Gergel, M. V, Mason, G. W., Sullivan, J. C., & Mech, J. F. (1951). Isolation of Microgram Quantities of Naturally-occurring Plutonium and Examination of its Isotopic Composition1. Journal of the American Chemical Society, 73(6), 2529–2531.
Petrucci, R. H., Herring, F. G., Madura, J. D., & Bissonnette, C. (2010). General Chemistry Principles and Modern Applications (10a ed.). Pearson.
Prandtl, W. (1948). Some early publications on phosphorus. Journal of Chemical Education, 25(8), 414.
Pyykkö, P. (2011). A suggested periodic table up to Z≤ 172, based on Dirac–Fock calculations on atoms and ions. Physical Chemistry Chemical Physics, 13(1), 161–168.
Raymond, K. W. (2014). General, Organic, and Biological Chemistry, an Integrated Aproach (4a ed.). Wiley.
Rouvray, D. H., & King, R. B. (2004). The periodic table: Into the 21st century. Research Studies Press Baldock, UK.
Samuelson, A. G. (2000). Fulfilling Mendeleev’s dream. Resonance, 5(5), 64–66.
Scerri, E. (2008). The role of triads in the evolution of the periodic table: past and present. Journal of Chemical Education, 85(4), 585.
Scerri, E. (2013). A tale of seven elements. OUP USA.
Scerri, E. R. (1998). The evolution of the periodic system. Scientific American, 279(3), 56–61.
Scerri, E. R. (2006). The periodic table: its story and its significance. Oxford University Press.
Scerri, E. R. (2011). The periodic table. Philosophy of Chemistry, 6, 329.
Silberberg, M. S. (2009). Chemistry, The Molecular Nature of Matter and Change (5a ed.). McGraw-Hill Education.
Stoker, H. S. (2013). General, Organic, and Biological Chemistry (6a ed.). Brooks/Cole.
Timberlake, K. C. (2015). Chemistry An Introduction to General, Organic, and Biological Chemistry (15a ed.). USA: Pearson.
Weeks, M. E. (1932). The discovery of the elements. II. Elements known to the alchemists. Journal of Chemical Education, 9(1), 11.
Whitten, K. W., Davis, R. E., Peck, M. L., & Stanley, G. G. (2010). Chemistry (9a ed.). Brooks/Cole.
Wigner, E., & Huntington, H. áB. (1935). On the possibility of a metallic modification of hydrogen. The Journal of Chemical Physics, 3(12), 764–770.
Winter, M. J. (2015). D-block Chemistry. Oxford University Press.
Wisniak, J. (2004). Pierre Joseph Macquer. Educación química, 15, 3.
Witze, A. (2012). Matter & energy: Meet flerovium and livermorium: Group confers official names on two superheavy elements. Science News, 181(13), 10.
Yakushev, A., Gates, J. M., Türler, A., Schädel, M., Düllmann, C. E., Ackermann, D., … Dvorak, J. (2014). Superheavy element flerovium (element 114) is a volatile metal. Inorganic chemistry, 53(3), 1624–1629.
Zumdahl, S. S., Zumdahl, S. A., & DeCoste, D. J. (2018). Chemistry (10a ed.). Cengage Learning.
















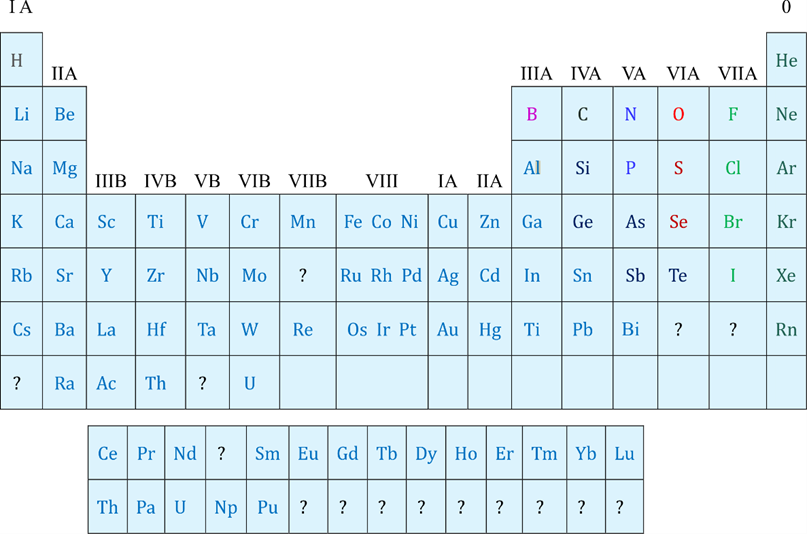













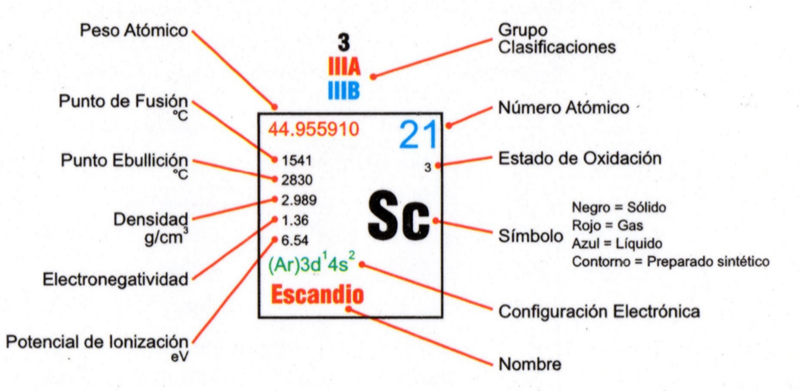


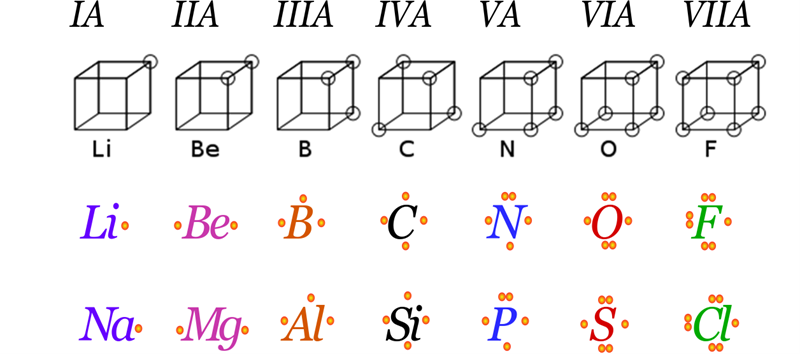










No hay comentarios:
Publicar un comentario