Índice
Índice
1. Introducción
1. Introducción
En física, una ley de conservación establece que una propiedad medible particular de un sistema físico aislado no cambia a medida que el sistema evoluciona con el tiempo. Las leyes de conservación exactas incluyen la conservación de la energía, la conservación del momento lineal, la conservación del momento angular y la conservación de la carga eléctrica. También hay muchas leyes de conservación aproximadas, que se aplican a cantidades tales como masa, paridad, número de leptones, números de bariones, extrañeza, hipercarga, etc. Estas cantidades se conservan en ciertas clases de procesos físicos, pero no en todos.
Una ley de conservación local se suele expresar matemáticamente como una ecuación de continuidad, una ecuación diferencial parcial que da una relación entre la cantidad de la cantidad y el "transporte" de esa cantidad. Establece que la cantidad de la cantidad conservada en un punto o dentro de un volumen solo puede cambiar la cantidad de la cantidad que fluye dentro o fuera del volumen. Del teorema de Noether, cada ley de conservación está asociada con una simetría en la física subyacente.
En nuestro curso de química general deberemos trabajar con dos leyes de conservación exactas y dos leyes aproximadas. Las leyes exactas son las de conservación de la energía y conservación de la carga eléctrica, y las aproximadas son las de la conservación de la masa y la conservación del número de átomos. Es sobre estas cuatro reglas que se fundamenta la estequiometria básica de las reacciones químicas.
1.1 Michael Faraday (1791-1867)
Fue un físico y químico británico que se destacó por su investigación en el campo de la electricidad y el magnetismo. Nacido en una familia humilde en el sur de Londres, Faraday no tuvo una educación formal, pero gracias a su ingenio y curiosidad, llegó a convertirse en uno de los científicos más importantes de su época. Sus descubrimientos en el campo de la electromagnetismo sentaron las bases para la revolución tecnológica del siglo XIX y su legado científico sigue siendo relevante hasta el día de hoy.
Contexto social
Michael Faraday vivió durante una época de importantes cambios políticos, económicos, sociales, religiosos y culturales en Gran Bretaña. En el ámbito político, se encontraba en el período de la Monarquía Constitucional, con Guillermo IV como rey y un sistema parlamentario que había experimentado importantes reformas en la década de 1830.
En el plano económico, Gran Bretaña estaba experimentando una rápida industrialización y transformación de la economía, gracias a la Revolución Industrial, lo que trajo consigo cambios importantes en la estructura social y la forma en que se organizaban las relaciones laborales.
En cuanto a lo social, la sociedad victoriana estaba caracterizada por la estratificación social y la rigidez de las clases sociales, donde la familia y la religión tenían un papel muy importante. La religión cristiana anglicana era la predominante en la época, y los científicos como Faraday debían enfrentar ciertas tensiones entre su fe y sus investigaciones.
Culturalmente, se encontraba en la época victoriana, que fue un período de gran creatividad y logros culturales en literatura, artes y ciencias. En particular, se vivía una época de gran fascinación por la ciencia y la tecnología, que tuvo un gran impacto en la vida de Faraday y su carrera científica.
Infancia
Michael Faraday nació en 1791 en el distrito de Newington Butts, en el sur de Londres. Era el tercero de los cuatro hijos de James y Margaret Faraday, quienes eran de origen humilde y trabajaban como artesanos. La familia luchó económicamente y vivió en la pobreza durante gran parte de la infancia de Michael.
Aunque la familia no podía permitirse una educación formal, Michael tenía una gran curiosidad por el mundo que lo rodeaba y una mente analítica. Aprendió a leer y escribir en la escuela dominical y en su tiempo libre, Michael solía leer libros y revistas científicas que conseguía en la librería a la que iba a trabajar como aprendiz de encuadernador a los 13 años.
A los 14 años, Michael empezó a asistir a las conferencias de la Royal Institution, un centro científico en Londres, y se impresionó tanto por las demostraciones científicas que vio allí que decidió convertirse en un científico. La infancia de Faraday estuvo marcada por la pobreza y la falta de educación formal, pero su curiosidad y perseverancia lo llevaron a convertirse en uno de los científicos más importantes de su tiempo.
Educación y logros
En 1813, Faraday fue contratado como asistente de Humphry Davy en la Royal Institution, lo que le permitió aprender de uno de los más grandes científicos de su tiempo.
Entre los logros científicos de Faraday, se destacan sus descubrimientos en el campo del electromagnetismo. En 1821, descubrió la inducción electromagnética, que estableció una conexión entre la electricidad y el magnetismo, sentando las bases para el desarrollo de la electricidad y la tecnología eléctrica. También descubrió la ley de Faraday de la electrólisis, que explica cómo la corriente eléctrica puede producir reacciones químicas.
Faraday también realizó importantes investigaciones sobre la óptica, el diamagnetismo y la electroquímica. Fue uno de los primeros en investigar los rayos catódicos, que fueron un precursor de los tubos de rayos X, y también desarrolló el primer generador eléctrico práctico.
Además de sus logros científicos, Faraday también fue un gran divulgador científico y un líder en la comunidad científica. Fue elegido miembro de la Royal Society en 1824 y fue presidente de la institución en dos ocasiones. En su carrera, publicó más de 300 artículos científicos y libros, y sus investigaciones siguen siendo relevantes en la actualidad.
Comunidad científica
Michael Faraday fue parte de la comunidad científica británica del siglo XIX, que incluía a algunos de los más grandes científicos de la época, como Humphry Davy, James Clerk Maxwell y Charles Darwin.
Faraday trabajó como asistente de Davy en la Royal Institution, donde aprendió y colaboró con él en numerosas investigaciones. Sin embargo, la relación entre ellos se deterioró debido a desacuerdos y a la competencia entre ellos. Otros colaboradores notables de Faraday incluyen a John Tyndall y William Thomson, quienes trabajaron con él en la Royal Society.
En cuanto a opositores, Faraday no tuvo muchos en el campo de la ciencia, pero su trabajo en electromagnetismo y teoría de campos generó controversia en algunos círculos, incluyendo a físicos y matemáticos como James Clerk Maxwell y William Thomson (Lord Kelvin). Sin embargo, aunque hubo algunas críticas a sus ideas en su momento, en general su trabajo fue altamente valorado por la comunidad científica.
Faraday también fue reconocido y respetado fuera de la comunidad científica, y su trabajo fue valorado por figuras literarias como Charles Dickens y Samuel Taylor Coleridge, quienes asistieron a sus conferencias en la Royal Institution y escribieron sobre su trabajo.
Reconocimientos
Michael Faraday recibió numerosos reconocimientos a lo largo de su vida y después de su muerte.
Durante su carrera, fue elegido miembro de la Royal Society en 1824, y posteriormente recibió numerosos premios y medallas, entre ellos la Medalla Copley de la Royal Society en tres ocasiones, en 1832, 1838 y 1846, convirtiéndose en el primer científico en recibir esta medalla tres veces. También fue galardonado con la Medalla Real en 1853 y la Medalla Rumford en 1846.
En 1858, la reina Victoria le otorgó la Orden del Mérito, convirtiéndolo en uno de los primeros miembros de esta orden. Sin embargo, Faraday rechazó una oferta de títulos nobiliarios por parte de la reina, prefiriendo mantener su humilde origen y enfocarse en su trabajo científico.
Después de su muerte en 1867, Faraday recibió numerosos homenajes póstumos. Fue enterrado en la Abadía de Westminster, cerca de Isaac Newton, y su tumba fue marcada con una placa de mármol en su honor. También se creó una beca en su nombre en la Royal Society, y la Faraday Society, una organización dedicada a promover la química física, lleva su nombre.
Además, su obra y legado han sido celebrados en todo el mundo. En 1931, se inauguró el Faraday Building en el King's College de Londres, y en 1991, se conmemoró el bicentenario de su nacimiento con una serie de eventos en todo el mundo, incluyendo una exposición en la Royal Society de Londres. Faraday sigue siendo uno de los científicos más influyentes de la historia, y su legado ha inspirado a generaciones de científicos en todo el mundo.
¿Por qué debe importarnos?
Michael Faraday ha tenido un gran impacto en nuestra vida cotidiana a través de su trabajo en electromagnetismo y otras áreas de la física y la química.
Una de las aplicaciones más evidentes de su trabajo es el uso generalizado de la electricidad en nuestra vida diaria, desde la iluminación y la calefacción hasta los electrodomésticos y la electrónica. Faraday fue uno de los primeros en demostrar la relación entre electricidad y magnetismo, lo que llevó a la creación de motores eléctricos y generadores de energía, que son esenciales en nuestra sociedad moderna.
Además, Faraday también realizó investigaciones importantes en la química, especialmente en el campo de la electroquímica, que es la base de las baterías modernas. Las baterías son utilizadas en una amplia gama de dispositivos, desde teléfonos móviles hasta vehículos eléctricos, y han revolucionado la forma en que nos comunicamos y nos transportamos.
Otras aplicaciones de sus descubrimientos incluyen la tecnología de resonancia magnética nuclear (MRI), que se utiliza en la medicina para obtener imágenes de alta resolución del interior del cuerpo, y la tecnología de televisión y radio, que utiliza ondas electromagnéticas para transmitir información y entretenimiento.
¿Por qué debe inspirarnos?
La vida de Michael Faraday es una inspiración para todos nosotros, ya que nos muestra cómo es posible superar las limitaciones y obstáculos que la vida nos presenta, y lograr grandes cosas a través del trabajo duro, la perseverancia y el amor por el conocimiento.
Faraday nació en una familia humilde y sin educación, pero a través de su propia determinación y dedicación al aprendizaje, logró superar su situación y convertirse en uno de los científicos más influyentes de la historia.
A lo largo de su vida, Faraday enfrentó muchos obstáculos y limitaciones, incluyendo su falta de formación académica formal y la discriminación que enfrentó como científico autodidacta. Sin embargo, nunca se rindió y continuó persiguiendo su pasión por la ciencia, incluso cuando sus investigaciones no eran valoradas por otros científicos de su época.
A pesar de los obstáculos, Faraday logró hacer importantes descubrimientos en electromagnetismo, electroquímica y otras áreas de la física y la química, y su legado sigue influyendo en nuestras vidas hasta el día de hoy.
La vida de Faraday nos enseña que la perseverancia y la determinación son fundamentales para lograr grandes cosas, y que no debemos dejar que las limitaciones y obstáculos nos detengan. También nos muestra la importancia del amor por el conocimiento y la curiosidad, y cómo estos valores pueden inspirarnos a hacer descubrimientos que cambien el mundo.
2. Las leyes de la conservación
2. Las leyes de la conservación
Las leyes de conservación son un conjunto de principios fundamentales en física que establecen que ciertas cantidades físicas se mantienen constantes en un sistema aislado. Estas leyes tienen una larga historia que se remonta a la antigüedad, aunque no fueron expresadas de manera formal hasta la era moderna.
2.1 Historia
En la antigua Mesopotamia y Egipto, se observó que ciertas cantidades, como la cantidad de grano en un granero o el número de animales en un rebaño, se mantienen constantes a pesar del tiempo y las condiciones ambientales. Esto llevó a la idea de que ciertas cantidades físicas son invariantes y no pueden ser creadas ni destruidas.
En la Grecia antigua, el filósofo Leucipo propuso la idea de que la materia está compuesta por partículas indivisibles llamadas átomos, lo que sugiere que la cantidad de materia es constante. Esto fue desarrollado más tarde por el filósofo Demócrito y el matemático y filósofo Pitágoras, quien también formuló la idea de que la suma de los cuadrados de los lados de un triángulo rectángulo es igual al cuadrado de la hipotenusa (el teorema de Pitágoras), que es una expresión de la conservación de la energía cinética.
2.2 Algunas leyes de la conservación
En la era moderna, las leyes de conservación se expresaron formalmente a través de la física matemática, generalmente adquiriendo formas de sumas indefinidas, o multiplicaciones de algún término constante que genera un modelo de crecimiento lineal entre dos parámetros físicos.
(a) La ley de conservación de la masa fue propuesta por Antoine Lavoisier en el siglo XVIII “o eso dice la leyenda”, y establece que la masa de un sistema cerrado se mantiene constante durante una reacción química.
(b) La ley de conservación de la energía, también conocida como la primera ley de la termodinámica, fue formulada por Julius Robert von Mayer y James Prescott Joule en la década de 1840, y establece que la energía no puede ser creada ni destruida, sino que solo puede ser transformada de una forma a otra.
(c) La Ley de Conservación del Momento Lineal fue descubierta por Isaac Newton en 1687. Esta ley establece que la cantidad total de momento lineal en un sistema aislado permanece constante, es decir, la suma de los momentos lineales de todas las partículas en un sistema no cambia. Esto implica que, si no hay fuerzas externas, el movimiento del sistema se mantendrá constante.
(d) La Ley de Conservación del Momento Angular fue descubierta por Isaac Newton en 1687. Esta ley establece que la cantidad total de momento angular en un sistema aislado permanece constante, es decir, la suma de los momentos angulares de todas las partículas en un sistema no cambia. Esto implica que, si no hay fuerzas externas, el sistema rotará de forma constante.
(e) La Ley de Conservación de la Carga Eléctrica fue descubierta por Charles-Augustin de Coulomb en 1785. Esta ley establece que la carga eléctrica total en un sistema aislado permanece constante durante una interacción eléctrica. Esto significa que la carga eléctrica no puede ser creada ni destruida, solo puede ser transferida de un objeto a otro.
(f) La Ley de Conservación del Número de Partículas fue descubierta por Antoine Lavoisier en el siglo XVIII. Esta ley establece que el número total de partículas en un sistema aislado permanece constante, es decir, la cantidad de átomos, moléculas o partículas subatómicas en un sistema no cambia. Esto implica que la materia no puede ser creada ni destruida, solo puede transformarse de una forma a otra. Independientemente de si se trata de un sistema macroscópico (como un montón de semillas de arveja) o de un sistema microscópico (como una masa de moléculas). Es una ley fundamental de la física y se aplica a cualquier nivel de escala en el que se considere la materia.
(f) La Ley de Conservación del Impulso fue establecida por Isaac Newton en el siglo XVII. Esta ley indica que, en un sistema aislado, la suma de los impulsos antes y después de una colisión o interacción es constante. El impulso se define como la fuerza aplicada sobre un objeto durante un intervalo de tiempo. Por lo tanto, esta ley establece que, en un sistema aislado, la cantidad total de impulso se mantiene constante.
2.3 Contexto
El curso de química general se enfoca en las leyes de conservación más relevantes y aplicables en la química y en la vida cotidiana. La Ley de Conservación de la Masa de Lavoisier es fundamental para entender la estequiometría y las reacciones químicas. La Ley de Conservación del Número de Partículas se relaciona con la estructura de la materia y la termodinámica. La Ley de Conservación de la Energía es importante en la cinética química y la termodinámica. Y la Ley de Conservación de la Carga Eléctrica se aplica en la electroquímica y la física de semiconductores.
Normalmente, en los cursos de ciencias básicas, las leyes de conservación se presentan en el orden en que se describen anteriormente. Como ciudadano científicamente informado, es importante tener una comprensión básica de estas leyes de conservación y su aplicación en la ciencia y la tecnología. Por ejemplo, la Ley de Conservación de la Energía se aplica en la producción de energía eléctrica y la eficiencia energética de los automóviles. La Ley de Conservación del Número de Partículas se utiliza en la fabricación de productos químicos y la radiación. La Ley de Conservación de la Carga Eléctrica es fundamental en la producción de circuitos electrónicos y dispositivos. Y la Ley de Conservación de la Masa se aplica en la producción de alimentos, medicamentos y otros productos químicos.
3. Energía
3. Energía
En física y química, la ley de conservación de la energía establece que la energía total (E o ET) de un sistema aislado permanece constante con el tiempo (Feynman, Leighton, & Sands, 1965), por lo que la energía total inicial es igual a la energía total final (E = Eo). Tenga en cuenta que en algunas fuentes especialmente en termodinámica avanzada la energía termodinámica o energía interna de un sistema se modela con el símbolo ΔU (IUPAC, 2020).
Esta ley, fue propuesta y probada por primera vez por Émilie du Châtelet (Hagengruber, 2012), significa que la energía no se puede crear ni destruir; más bien, solo se puede transformar o transferir de una forma a otra; también implica necesariamente que la energía total de un sistema es igual a la suma de las energías de los subsistemas (i) que lo componen.
Por ejemplo, la energía química se convierte en energía cinética cuando explota una barra de dinamita. Si se suman todas las formas de energía que se liberaron en la explosión, como la energía cinética y la energía potencial de las piezas, así como el calor y el sonido, se obtendrá la disminución exacta de la energía química en la combustión de la dinamita.
3.1 Tipos de energía
La energía puede manifestarse de formas diversas:
(a) Calor, asociada a la cantidad de vibración molecular transferible entre dos sistemas.
(b) Energía cinética que está asociada a su velocidad y su masa.
(c) Energía potencial que está asociada a la energía cinética desencadenable por una atracción gravitacional.
(d) Energía de trabajo mecánico asociada al desplazamiento de una masa ejercida por una fuerza.
(e) Energía de radiación electromagnética, la cual puede dividirse en subcategorías como luz o calor.
(f) Energía química asociada a los enlaces ya sea formación o rompimiento, sean estos débiles o fuertes de las moléculas y/o átomos.
(g) La energía nuclear que mantiene unidos las partículas subatómicas al interior del núcleo atómico.
(h) la materia, que es una forma especial y condensada de energía.
3.2 El sistema
El sistema debe estar aislado (sin flujos de energía o materia con los alrededores del sistema), pues de lo contrario la ley y su modelo matemático se hacen inválidos y deben modificarse.
Figura 3.1. Los modelos matemáticos son muy sensibles a los presupuestos cualitativos de un sistema, si cambia la naturaleza del sistema, las matemáticas cambian.
3.3 Relación masa y energía
La masa y la energía se pueden ver como dos nombres (y dos unidades de medida) para la misma cantidad física subyacente y conservada y relacionada en la ecuación:
Por lo tanto, las leyes de conservación de la energía y conservación de la masa (total) son equivalentes y ambas son verdaderas, cuando una no cuadra es que no se está tomando en cuenta la otra. Einstein explicó en un ensayo de 1946 que "el principio de la conservación de la masa resultó [...] inadecuado frente a la teoría especial de la relatividad. Por lo tanto, se fusionó con el principio de conservación de la energía, tal como, unos 60 años antes, el principio de la conservación de la energía mecánica se había combinado con el principio de la conservación del calor [energía térmica]. Podríamos decir que el principio de la conservación de la energía, habiendo absorbido previamente el de la conservación del calor, ahora procedía a traga eso de la conservación de la masa, y mantiene el campo solo" (Einstein, 1996).
A pesar de esto, los procesos químicos estándar no requieren un balance combinado de materia y energía, dado que para estas reacciones la masa no se convierte en energía de manera significativa (ecuación 2.3.), aunque en verdad si ocurre dicha conversión en los procesos químicos que denominamos no-nucleares, la mayoría de los instrumentos no podrían medir que algo pasa, así que esta ley se divide en la ley de la conservación de la energía y la ley de la conservación de la masa.
3.4 La energía química
En química, la energía puede percibirse como dos cosas diferentes,
(a) como un potencial de cambio químico,
(b) como una condición para el cambio químico;
en cualquiera de los dos, los cambios químicos o reacciones, en las cuales las sustancias alteran sus identidades requieren de un cambio de energía por emisión o por absorción; de allí que dividamos la energía en una reacción química en dos categorías.
Reacciones exergónicas
Una reacción exergónica es una reacción química donde el cambio en la energía libre es negativo (hay una liberación neta de energía libre), que indica una reacción espontánea. En palabras más sencillas, los reactivos son de alta energía potencial, y cuando se altera el sistema levemente, ocurre una reacción espontánea, muchas veces hasta violenta, como una explosión, liberando energía al ambiente, ya sea en forma de calor, luz, sonido, electrones entre otros. Aunque parte de esa energía puede ser absorbida por los productos en sus nuevos enlaces, siempre existe una pérdida de energía que se dispersará en los alrededores del sistema en forma de calor inútil.
Aunque se dice que las reacciones exergónicas ocurren espontáneamente, esto no implica que la reacción se llevará a cabo a una velocidad observable. Por ejemplo, la desprotonación del peróxido de hidrógeno es muy lenta en ausencia de un catalizador adecuado.
Las reacciones exergónicas generalmente se relacionan a la emisión de calor, y por ende tienden a ser denominadas exotérmicas, pero el calor no es la única forma de energía que pueden emitir, pues también pueden generar flujo eléctrico y emisión de luz. En los sistemas vivos, una ruta encadenada de reacciones que destruye una o varias sustancias para obtener la energía que estas contienen se denomina como un proceso catabólico o liberador de energía.
Reacciones endergónicas
Una reacción endergónica es una reacción química donde el cambio en la energía libre es positivo (hay una absorción neta de energía libre), que indica una reacción solo será espontánea si se le proporciona energía. En palabras más sencillas, los reactivos son de baja energía potencial, y para que la reacción se dé, se requiere un pago energético mayor que el de los productos, pues mucha de la energía dada será absorbida por el universo en forma de calor inútil.
Es como si el universo fuera un gobernante corrupto que se queda con la mayoría del dinero en TODO tramite energético en todo el universo conocido hasta ahora. En cualquiera de los dos procesos, el universo siempre se queda con mucha energía, por lo que solo una fracción, llamada energía libre es la que se involucra realmente en el proceso químico.
Aunque se dice que las reacciones exergónicas no son espontáneas, esto no implica que la reacción sea imposible o inviable. Por ejemplo, la síntesis de ADN requiere de la liberación de la energía de los nucleótidos trifosfatados, cuando estos pierden dos fosfatos, se libera la energía requerida para unirlos a la cadena creciente del ADN.
Las reacciones endergónicas generalmente se relacionan a la absorción de calor, y por ende tienden a ser denominadas endotérmicas, pero el calor no es la única forma de energía que pueden absorber, pues también pueden requerir flujo eléctrico y absorber ciertos colores de luz como en la fotosíntesis. En los sistemas vivos, una ruta encadenada de reacciones que construye una o varias sustancias para almacenar energía la energía que estas se denomina como un proceso anabólico o de construcción de estructuras, que de otro modo no deberían existir.
Portadores de energía metabólicos
En las reacciones biológicas, los catabolismos liberadores de energía se conectan indirectamente con los anabolismos constructores a través de sustancias puente que transportan la energía de un lugar a otro, en enlaces de fosfato o en enlaces a protones ácidos, siendo estas sustancias llamadas coenzimas portadoras de energía. Las reacciones anteriores son bidireccionales, por lo que, dependiendo de las necesidades celulares, el portador puede absorber o liberar la energía:
|
3.5 Identificando reacciones endergónicas y exergónicas.
El estudio del balance energético es extenso y será ahondado en el capítulo de termodinámica, por el momento tenga en cuenta que las reacciones endergónicas y exergónicas se identifican mediante un nuevo parámetro en una ecuación química, denominado calor de reacción o cambio de entalpia.
El Calor de Reacción (también conocido como Entalpía de Reacción) es el cambio en la entalpía de una reacción química que ocurre a presión constante. Es una unidad termodinámica de medida útil para calcular la cantidad de energía por mol de reacción (es decir, por avance de reacción) liberada o producida en una reacción química. Dado que la entalpía se deriva de la presión, el volumen y la energía interna, todas las cuales son funciones de estado, la entalpía también es una función de estado.
Las entalpias (H) por mismas no se pueden medir, lo que se miden son entalpias relativas a algún punto arbitrario o de referencia, que para la mayoría de las sustancias es su sustancia elemento. Por ejemplo, el cambio de entalpia para la formación del aluminio metálico es 0 kJ/mol. El cambio de entalpia de la reacción (ΔH) es la medida de energía por mol de reacción que nos servirá de pista para saber si un proceso es alergénico o endergónico.
El cambio de entalpia de la reacción es igual a la diferencia entre los cambios de entalpias de formación de los productos menos los cambios de entalpias de formación de los reactivos. Es simple economía energética.
(a) si los productos son más costosos que los reactivos, debemos pagar con energía extra para formarlos, por lo que el cambio de entalpia de la reacción será positivo, y la reacción tenderá a ser endergónica.
(b) si los productos son menos costosos que los reactivos, estos pagan por sí mismos la formación de productos y el impuesto a la entropía del universo, por lo que el cambio de entalpia de la reacción será negativo, y la reacción tenderá a ser exergónica.
Como se mencionó anteriormente, ahondaremos en estos conceptos de manera más profunda en capítulos futuros.
4. Masa
4. Masa
La ley de conservación de masa o principio de conservación de la materia establece que, para cualquier sistema aislado a todas las transferencias de materia y energía, la masa del sistema debe permanecer constante a lo largo del tiempo, ya que la masa del sistema no puede cambiar, por lo que la cantidad no se puede agregar ni eliminar. Por lo tanto, la cantidad de masa se conserva en el tiempo. Matemáticamente puede expresarse como que la masa total inicial (mo) es igual a la masa total final (m). Y a su vez una masa total será igual a las masas de cada subsistema.
Así por ejemplo si tenemos dos soluciones una de cloruro de bario y otra de sulfato de cobre (Figura 4.1), la suma de las masas de ambas será la masa inicial del sistema. Aunque experimentalmente las sustancias deben ser estimuladas para mezclarse, reaccionar y cambiar, la ecuación en si no modela el cambio, pues la suma de masas final estará dada por las sustancias producidas durante la reacción química, siendo en este caso sulfato de bario y cloruro de sodio. El punto es que experimentalmente sin importar como se combinaron, la masa del sistema completo permanece constante entre los dos momentos analizados.
Figura 4.1. Conservación de la masa experimental. La masa total de los reactivos es igual a la masa total de los productos.
La ley implica que la masa no puede ser creada ni destruida, aunque puede ser reorganizada en el espacio, o las entidades asociadas con ella pueden ser cambiadas de forma. Por ejemplo, en reacciones químicas, la masa de los componentes químicos antes de la reacción es igual a la masa de los componentes después de la reacción. Por lo tanto, durante cualquier reacción química y procesos termodinámicos de baja energía en un sistema aislado, la masa total de los reactivos, o materiales de partida, debe ser igual a la masa de los productos.
Lo anterior implica que, si restamos la masa total de productos (∑mp) y la masa total de reactivos (∑mr), el resultado debe ser una suma cero.
Ley de la conservación de la masa en una reacción química, por conversión en este tipo de despejes, los parámetros de los reactivos van negativos.
Los dos postulados anteriores pueden ser modelados matemáticamente, de varias maneras, en esencia tenemos dos variables que hemos visto en capítulos anteriores que describen a la materia, la variable masa y la variable cantidad de sustancia.
LibreChem
5. Número de entidades
5. Número de entidades
La Ley de la Conservación del Número de Partículas es una de las leyes fundamentales de la física y la química. Esta ley establece que en cualquier reacción química, el número total de átomos o moléculas de los reactivos es igual al número total de átomos o moléculas de los productos. En otras palabras, la cantidad total de partículas en un sistema cerrado permanece constante durante una reacción química. Esta ley es también conocida como la Ley de Lavoisier-Proust, en honor a los químicos Antoine Lavoisier y Joseph Proust, quienes contribuyeron a su formulación.
La Ley de la Conservación del Número de Partículas es una consecuencia directa de la teoría atómica de John Dalton. Según esta teoría, la materia está compuesta de partículas indivisibles llamadas átomos. Los átomos de diferentes elementos tienen diferentes masas y propiedades químicas. En una reacción química, los átomos de los reactivos se combinan o se separan para formar nuevos compuestos. Dalton propuso que la combinación de átomos en una reacción química sigue reglas bien definidas, lo que conduce a la formación de compuestos específicos con propiedades químicas bien definidas.
La Ley de la Conservación del Número de Partículas es esencial en la química, ya que permite la predicción y el cálculo de las cantidades de sustancias que se producen o se consumen durante una reacción química. Esta ley se aplica a cualquier tipo de reacción química, ya sea una reacción de síntesis, una reacción de descomposición, una reacción de sustitución o una reacción de precipitación.
5.1Interpretación atómica de la ecuación química
La interpretación atómica de una ecuación química se refiere a la descripción de la reacción en términos de la interacción entre los átomos y moléculas involucrados en la reacción. Por ejemplo, la síntesis del agua por combustión de hidrógeno se puede representar por la ecuación química:
Figura 5.1. Interpretación análoga de la ecuación química 2H2+O2→2H2O, en dicha ecuación se necesita una molécula de oxígeno “que está compuesta por dos átomos” completar un solo evento de reacción.
Esta ecuación indica que dos moléculas de gas hidrógeno (H2) y una molécula de gas oxígeno (O2) reaccionan para formar dos moléculas de líquido agua (H2O). La interpretación atómica de esta reacción implica que cada molécula de hidrógeno consiste en dos átomos de hidrógeno, representados por el símbolo H.
5.2Controversias
La interpretación atómica de la ecuación química tuvo una larga historia de oposición y discusión entre los científicos. En el siglo XIX, algunos científicos como Johann Dobereiner y John Dalton propusieron la existencia de átomos y la ley de las proporciones múltiples, respectivamente. Sin embargo, la idea de la composición discreta de la materia seguía siendo controvertida.
Uno de los argumentos en contra de la teoría atómica era que no se podían observar directamente los átomos y que se basaba en especulaciones. Otro argumento era que las ecuaciones químicas no podían explicarse simplemente por la combinación de átomos, sino que requerían de la intervención de alguna fuerza vital.
La teoría atómica y la interpretación de la ecuación química recibieron un fuerte impulso en la segunda mitad del siglo XIX gracias a los trabajos de científicos como Amedeo Avogadro, Dmitri Mendeleev y August Kekulé. En particular, la ley de Avogadro, que establece que volúmenes iguales de gases a la misma temperatura y presión contienen el mismo número de moléculas, fue fundamental para la comprensión de la composición molecular de los gases y líquidos.
A pesar de estos avances, algunos científicos continuaron oponiéndose a la teoría atómica. Por ejemplo, William Prout argumentó en 1815 que los átomos de todos los elementos eran múltiplos de los átomos de hidrógeno, lo que se conoce como la hipótesis de Prout. Esta hipótesis fue desacreditada cuando se descubrieron isótopos y se midieron las masas atómicas con mayor precisión.
En general, la oposición a la interpretación atómica de la ecuación química disminuyó a medida que se acumularon más evidencias experimentales y se desarrollaron nuevas técnicas de medición y análisis. En la actualidad, la teoría atómica y la interpretación de la ecuación química son fundamentales en la química y se aceptan ampliamente como explicaciones válidas para los fenómenos químicos.
5.3La interpretación molar
La interpretación molar de una ecuación química es una alternativa a la interpretación atómica. En esta interpretación, los coeficientes estequiométricos se refieren al número de moles estándar (no) o entidades de Avogadro (6.02 x 1023) en lugar de moléculas individuales. Esto se debe a que, en una reacción química, las moléculas se combinan y reordenan para formar nuevas moléculas, por lo que puede ser más útil pensar en términos de moles o entidades de Avogadro para entender las cantidades involucradas en una reacción. La interpretación molar también permite trabajar con diferentes sustancias que tienen diferentes pesos moleculares, lo que facilita los cálculos estequiométricos.
5.4Un modelo unificado
Las dos interpretaciones conviven en el modelo unificado de la ecuación química estándar, la cual entenderemos como aquella cuyos números estequiométricos son iguales al número mínimo necesario para completar un evento de reacción una vez. Esto nos permitirá plantear que, este numero de entidades es constante para una reacción química, y posee su propio símbolo, la letra griega nu (v) (IUPAC, 2019). Pero, ¿de dónde proviene este símbolo y por qué fue elegido?
La historia del símbolo v se remonta a principios del siglo XIX, cuando el químico y matemático francés Joseph Louis Gay-Lussac comenzó a trabajar en la relación entre las proporciones de reactantes y productos en una reacción química. En su trabajo, Gay-Lussac desarrolló la idea de que las sustancias reaccionan en proporciones estequiométricas fijas y predecibles. Para expresar esta relación matemáticamente, Gay-Lussac utilizó el símbolo "v" para representar los coeficientes estequiométricos en sus ecuaciones químicas.
Más tarde, el químico alemán August Kekulé adoptó el símbolo "v" de Gay-Lussac en sus propios trabajos sobre la teoría estructural de la química orgánica. Sin embargo, Kekulé utilizó el símbolo "v" para representar los "valores estequiométricos", es decir, los coeficientes estequiométricos multiplicados por el número de valencias de cada átomo en la molécula.
A medida que la química se desarrollaba, se hizo necesario un símbolo más específico para representar los coeficientes estequiométricos en las ecuaciones químicas. En la década de 1930, la IUPAC propuso el uso del símbolo "v" para este propósito, lo que fue adoptado ampliamente por la comunidad científica.
A lo largo de la historia de la química, se han propuesto otros símbolos para representar los coeficientes estequiométricos, como "m" y "n". Sin embargo, estos símbolos no han ganado tanta aceptación como el símbolo "ν" de la IUPAC.
5.5Ley de la conservación del número de átomos
El enunciado de la ley es sencillo, pero su demostración es un poco más compleja:
Demostración: Como calcular el número de átomos de un elemento en una molécula si se conoce cuantas veces ocurre la reacción y cuantas moléculas de la sustancia se consumen. Deduzca una ecuación para el caso de que el elemento se encuentre en una sola molécula y para el caso de que el elemento se encuentre en más de una molécula.
Si cancelamos a ambos lados el número de eventos de reacción, nos quedamos con:
Ley de la conservación del número de átomos de un elemento (J) entre reactivos (r) y productos (p).
5.6Aplicaciones de la ley de la conservación del número de átomos
Hasta este punto hemos demostrado que la ley de la conservación del número de átomos es una consecuencia necesaria de la ley de la conservación de la masa, así que, por defecto sabemos que debe cumplirse, y cuando aparentemente no lo hace, es que el modelo que lo representa, en este caso la ecuación química, está mal planteada. Existe una variedad de razones para que una ecuación química esté mal planteada a saber:
(a) Faltan sustancias en los reactivos o los productos.
(b) Las sustancias involucradas son incorrectas, lo que también engloba a que los subíndices sean incorrectos, recuerde que la identidad de la molécula depende del subíndice, cambiar el subíndice cambia la sustancia.
(c) Pero la razón más común para los ejercicios de lápiz y papel es que los coeficientes estequiométricos sean incorrectos, recuerde que estos coeficientes indican cantidad de sustancia/moléculas, no identidad, por lo que si pueden cambiar sin que alteremos la identidad de una sustancia.
(d) Otra razón puede ser que el número de electrones no se tuvo en cuenta, pero para esto deberemos comprende la ley de la conservación de la carga,
Una de las labores de los químicos es plantear correctamente una ecuación química, y en ejercicios de lápiz y papel eso implica inferir los productos correctos, y los coeficientes estequiométricos adecuados e incluso el número de cargas involucradas de modo tal que carga y masa se encuentren en perfecto equilibrio, como todo debe estar.
Enunciado: Pruebe que la ecuación química: Zn+2HCl →ZnCl2+H2, cumple con la ley de la conservación de la materia.
6. Carga eléctrica y la carga relativa
6. Carga eléctrica y la carga relativa
La carga eléctrica es la propiedad física de la materia que hace que experimente una fuerza cuando se coloca en un campo electromagnético. Hay dos tipos de carga eléctrica por polaridad: positiva y negativa (comúnmente transportada por protones y electrones respectivamente).
Las cargas iguales se repelen entre sí y las cargas diferentes se atraen entre sí. Un objeto con ausencia de carga neta se denomina neutral. El conocimiento temprano de cómo interactúan las sustancias cargadas ahora se denomina electrodinámica clásica y sigue siendo preciso para problemas que no requieren la consideración de efectos cuánticos.
La unidad de carga eléctrica derivada del SI es el culombio (C) que lleva el nombre del físico francés Charles-Augustin de Coulomb. En ingeniería eléctrica también es común utilizar el amperio-hora (Ah).
La conservación de la carga fue propuesta por primera vez por el científico británico William Watson en 1746 y el estadista y científico estadounidense en 1747, aunque la primera prueba convincente fue dada por Michael Faraday en 1843.
6.1Definición
La ley de la conservación de la carga se debe mantener ya sea en la interpretación de partículas o en la interpretación de cuerpos. Adicionalmente para no caer en la paradoja del Sorites (Vlaardingerbroek, 2012), entenderemos como cuerpo a la agrupación de dos partículas semejantes hasta la agrupación de todas las partículas semejantes en el universo, aunque lo común para un cuerpo sea entenderlo como la cantidad de partículas cercana a un número de Avogadro, o a órdenes de magnitud cercanos al número de Avogadro.
6.2Medidas de carga continua
Definiremos las medidas de carga continua como aquellas que no están condicionadas a una cantidad de sustancia fija en paquetes, por lo que puede expresarse en valores no enteros o decimales. La carga más pequeña que podemos concebir es la carga elemental (qe = 1.602×10−19 C), y una partícula cualquiera tendrá una carga igual a múltiplos enteros de la constante de carga elemental (q=z⋅qe). Cuando describimos la carga de un cuerpo de masa variable lo haremos con el parámetro (Q), también medido en culombios y relacionado a una constante de carga llamada la carga de Faraday (Q=z⋅Qe). Y a su vez, la constante de carga elemental está relacionada con la constante de Faraday por medio del número de Avogadro (Fe = qe⋅NA).
También podemos definir la carga molar de una sustancia, pero aquí la cosa se complica. En la literatura científica se utiliza el símbolo "F" para la constante de Faraday y no para la carga molar. En cuanto al símbolo para la carga molar en C/mol, no existe un símbolo estandarizado, pero si no acuñamos bien los símbolos, después las ecuaciones no nos saldrán bien, por ende:
Arbitrariamente definiremos que la carga molar de F y su constante que es la constante de Faraday será Fe. Ambas estarán medidas en C/mol.
Dado lo anterior, podemos definir la relación entre carga molar y constante de Faraday como (F= Fe⋅n) donde (n) es la cantidad de sustancia en moles o ( F= Fe⋅ξ ) donde ( ξ ) es la cantidad de reacción en moles.
6.3Medidas de carga discreta
Demostración: Pruebe que la constante z es la misma, ya sea para cargas de partículas cuantizadas o para cargas macroscópicas.
Definiremos a (z) como la carga relativa de una partícula, las cuales pueden ser reales en iones o virtuales en números de oxidación. La carga relativa (z) se puede calcular a través de otros parámetros diferentes, es adimensional, asume valores de números enteros pequeños fácilmente memorizables y consignables en la tabla periódica para los elementos y a través de ellos se puede deducir las cargas elementales de iones poliatómicos.
En consecuencia, la carga relativa (z) es el parámetro de carga que normalmente emplearemos en los ejercicios de lápiz y papel en el contexto de química básica o química general.
Hoy la carga relativa es homóloga a la masa relativa de un elemento, en ambos casos tenemos valores de carga o masa que son divididos o ponderados por una constante, ya sea la constante de carga elemental, hola doceava parte de la masa de un mol de carbono 12.
6.4Carga como variable de estado
Podemos emplear las cargas ya sean de partículas o de cuerpos como variables de estado, es decir, donde lo que nos interesa es la relación entre un momento inicial y otro final. En ese orden de ideas establecemos que, la ley de la conservación de la carga para un sistema cerrado establece que:
(a) la carga se conserva en un cambio de estado.
(b) la carga se conserva en una suma de partes del sistema.
6.5Cargas en partículas subatómicas
Durante nuestra discusión sobre los modelos atómicos físicos, llegamos a un punto después de discutir el modelo del núcleo atómico, y fue el hecho de que, para los químicos, existen varios tipos de modelos atómicos relevantes.
Figura 6.1. Modelo de planetario con representación de las partículas del núcleo de berilio.
Para este punto de nuestra discusión el modelo del átomo que requerimos tener en cuenta es el átomo planetario de Rutherford-Bohr más el modelo del núcleo atómico de protones más neutrones de Chadwick (Figura 6.1). En este modelo del átomo tenemos 3 partículas que lo componen, los protones pr, los electrones el, y los neutrones ne:
(a) La carga del protón es igual a la constante de carga elemental (qpr=qe).
(b) La carga del electrón es igual a la constante de carga elemental negativa (qel=-qe).
(b) La carga del neutrón es nula o inexistente (qne= 0)
dado lo anterior podemos establecer la relación entre carga de un protón, carga de un electrón, y la constante de carga elemental de la siguiente forma:
La constante de carga relativa es igual al valor absoluto de la carga relativa de un protón, o al valor absoluto de la carga de un electrón, siendo igual a 1.
7. Carga relativa de los átomos
7. Carga relativa de los átomos
Los números de carga relativa de los átomos y los estados de oxidación son conceptos importantes en la química que nos permiten entender cómo los átomos interactúan entre sí y cómo se producen las reacciones químicas. En este artículo, exploraremos estos conceptos en detalle.
En la sección anterior vimos que el número de carga relativa surge de dividir cada parámetro de carga en tus redes su constante correspondiente:
(a) la carga de una partícula dividida entre la constante de carga elemental
(b) la carga de un sistema dividida entre la carga de Faraday
(c) la carga molar de una sustancia pura o una reacción entre la constante de Faraday.
Sin embargo ahora debemos responder a la pregunta de dónde emerge esos valores constantes y por qué algunos elementos poseen valores positivos mientras que otros poseen valores negativos.
7.1La carga de un átomo neutro o un ion monoatómico
Dado que la ley de la conservación de la carga es una ley al aditiva, esta deberá cumplirse también para sus formas relativas, de allí qué: la carga relativa total de un átomo (zJ) es igual a la suma de cargas relativas de las partículas que lo componen por el número de partículas presente.
Técnicamente también deberíamos colocar el producto de la carga relativa del neutrón por el número de neutrones, pero dado que la carga relativa al neutrón es cero ese término se cancela, por lo que únicamente van a quedar 2 partículas relevantes para la carga de un átomo. La ecuación funcionará un poco diferente dependiendo de si tenemos un átomo neutro o un átomo con una carga es decir un ión.
(a) La carga relativa de un átomo neutro es igual a cero (zJ=0).
(b) La carga relativa de un ion es igual a alguno de sus estados de oxidación positivos o negativos u otros valores (zJ≠0).
Adicionalmente tenga en cuenta que:
(c) La carga relativa de un protón es 1 (zpr=1).
(d) La carga relativa de un electrón es -1 (zpr=-1).
(e) Los elementos inmersos en moléculas poliatómicas de diferentes elementos poseen cargas virtuales llamadas estados de oxidación, cuyos valores son iguales a las cargas relativas de un ion monoatómico.
Ejemplos
¿Cuál es la carga de un ion o elemento que tiene 6 protones y 7 electrones?
Si un ion tiene carga +3 y 10 electrones ¿Cuál es el número de protones que posee?
7.2Carga real contra la carga virtual y sus causas
La carga de un elemento puede ser real o virtual.
La carga real
Si un elemento está cargado realmente entonces estamos hablando de un ion, y por lo tanto dicha carga se modela con la variable de carga relativa (zJ). La carga real es una carga que realmente influye y es medible en un sistema, y ocurre en sustancias que generan iones monoatómicos como los iones de hierro(+3) (Fe → Fe3+ + 3e-), sodio(+1) (Na → Na+ + e-), o calcio(2+) (Ca → Ca2+ + 2e-). En estos casos los iones son entidades reales que se encuentran en mezclas con agua.
La carga virtual
La carga virtual es una carga que no influye realmente y no es medible directamente, pero se encuentra allí para poder explicar que una molécula completa es neutra. Como el sistema completo es neutro no puede medirse. por ejemplo, en el sólido iónico cloruro de sodio (NaCl) el sodio se encontrará en su estado de oxidación +1, y el cloro se encontrará en su estado de oxidación -1, pero la carga total de la molécula será cero. Cuando estamos hablando de cargas virtuales no podemos emplear el número de carga relativa, sino que emplearemos otra magnitud relacionada que el libro de oro de la IUPAC aconseja como estado de oxidación (OSJ).
A pesar de lo anterior, en ese curso de química general emplearemos únicamente el símbolo de cargas relativas, para manejar el menor número de ecuaciones posible.
7.3Causas de la carga relativa diferente de cero de un átomo
La ganancia o pérdida de electrones en un cambio de estado del sistema es la causa para las cargas positivas y negativas.
Si entendemos por el sistema al átomo J cualquiera, si ese pierde electrones, la ecuación Eq 7.1, nos dirá que ese átomo asumirá cargas positivas convirtiéndose en un catión. Por el contrario, si un átomo J cualquiera gana electrones entonces, la ecuación Eq 7.1 nos dirá que el átomo asumirá cargas negativas convirtiéndose en un anión.
La pérdida de electrones se conoce en química como la oxidación, mientras que la ganancia de electrones se conoce como la reducción.
7.4Números de oxidación o estados de oxidación
Los conceptos de número de carga relativa y estado de oxidación son muy semejantes, y en la práctica, a ambos los podemos extraer de la tabla periódica, bajo el concepto de estado de oxidación. Sin embargo, un estado de oxidación es un concepto que está vinculado al elemento, mientras que un número de carga puede extenderse también a partículas y a moléculas.
En cualquier caso, tanto el número de carga relativo, como el estado de oxidación van a representar el número de electrones que se han ganado, se han perdido, o se encuentran en estado fundamental de un elemento particular.
El número de electrones que puede ganar o perder un determinado elemento no es un valor arbitrario, un determinado elemento puede ganar o perder una cantidad fija de electrones dependiendo de las condiciones de la reacción. Aunque no podemos reducirlo a un solo valor constante, la cantidad de electrones que se gana o se pierde si son lo suficientemente pequeños como para caber en la tabla periódica bajo el nombre de los números de oxidación o estados de oxidación.
Tenga en cuenta que el estado de oxidación va a representar la cantidad de electrones y por ende la carga relativa del átomo ionizado más común, pero existirán situaciones raras en las cuales algún elemento asuma números de oxidación no estándar que no se encuentran reportados en la tabla periódica.
Cómo leer los números de oxidación
Por ejemplo, el cloro va a tener valores reportados como ±1, 3, 5, 7., los cuales deberemos leer como los posibles Estados de oxidación -1, 0, +1, +3, +5, +7., lo cual a su vez implica que el átomo de cloro puede ganar un electrón (z = -1), encontrarse en estado fundamental o neutro (z = 0), o perder un electrón (z = 1), tres electrones (z = 3), cinco electrones (z = 5), o siete electrones (z = 7).
Números de oxidación no reportados
El estado de oxidación más común de lejos es el estado fundamental o estado neutral, es decir la carga cero para los elementos. sin embargo, también es el estado de oxidación que más comúnmente omite la tabla periódica. es por eso que es muy importante que usted tenga en cuenta que todos los elementos de la tabla periódica para los cuales se ha reportado estado oxidación también tienen el estado de oxidación cero cuando están formando su elemento puro, por ejemplo, el hidrógeno molecular (H2), el hierro metálico (Fe), o el octaazufre (S8), todos se encuentran en estado de oxidación cero. también los carbonos en moléculas orgánicas como la glucosa (C6H12O6) también se encuentra en estado de oxidación cero, aunque se encuentre enlazado a otros elementos diferentes.
Algunos de los casos más importantes en que la tabla periódica no reporta estado de oxidación que pueden llegar a ser comunes son el oxígeno, el hidrógeno, y el propio cloro.
La tabla periódica únicamente reporta el estado de oxidación del oxígeno como -2, sin embargo, si el oxígeno forma una sustancia con el flúor, a su mirada estado de oxidación 2, lo cual implica que cada oxigeno perderá 2 electrones frente al flúor.
Cuando el hidrógeno forma moléculas con metales menos electronegativos que él, va a robar electrones y por lo tanto asumirá un estado de oxidación de -1.
Finalmente, una de las moléculas más famosas que ha surgido en el contexto de las noticias falsas sobre la pandemia de COVID-19 ha sido el dióxido de cloro, y en esa molécula el cloro asume un estado de oxidación de +4.
7.5Estados de oxidación fácilmente memorizables
La expresión anterior es de hecho el fundamento por el cual inferimos los subíndices al formular moléculas basadas en los números de oxidación, y el conocimiento de que la carga total de una molécula es cero, sin embargo, en este contexto lo que nos interesa es desarrollar la habilidad de inferir los estados de oxidación de elementos que no son fácilmente memorizables, pero antes de eso ¿Cuáles son los estados de oxidación fácilmente memorizables?
Existen números de carga de elementos que se memorizan fácilmente y otros que deben calcularse:
Hidrógeno
(a) Neutro cuando forma el hidrógeno molecular H2, esto es cierto para todos los elementos que forman gases diferentes de los nobles.
(b) Uno positivo, cuando forma moléculas con elementos más electronegativos que él, que son en su mayoría no metales como el cloro o el oxígeno.
(c) Uno negativo, cuando forma moléculas con elementos menos electronegativos que él, en su mayoría metales.
Oxígeno
(a) Neutro cuando forma oxígeno molecular.
(b) Uno negativo, cuando forma peróxidos “raro”.
(c) Dos negativo, cuando forma moléculas con cualquier elemento diferente de sí mismo o del flúor.
(d) Dos positivo, cuando forma el difluoruro de oxígeno.
Halógenos o grupo del flúor
(a) Neutro cuando forman su molécula diatómica pura.
(b) Menos uno cuando forman sales binarias con metales.
(c) En sales ternarias u óxidos debemos inferir usando la conservación de la carga, excepto el flúor que siempre será menos uno a menos que forme su gas diatómico.
Afíjenos o grupo del oxígeno
Sus reglas son semejantes a las del oxígeno, pero serán de dos negativo en sales binarias con metales.
Metales
Cero en sus formas puras. Los metales alcalinos o del grupo 1 tendrán estados de uno positivo, los alcalinotérreos o del grupo dos tendrán estados dos positivo, otros elementos deberán inferirse con la ley de la conservación de la carga.
8. La carga relativa de una molécula
8. La carga relativa de una molécula
Dado que una molécula o ion poliatómico es una partícula que resulta de la unión de átomos individuales podemos expresar la ley de la conservación de la carga relativa para una molécula o ion monoatómico como: la suma ponderada de los productos carga relativa del elemento por el número de átomos del elemento en la molécula.
Sin embargo, el hecho de que aparezca el término su índice de una fórmula química implica necesariamente que podemos predecir los subíndices empleando las relaciones de cargas relativas, que, al estar reportadas en la tabla periódica, nos permitirá predecir fórmulas químicas con los estados de oxidación de los elementos respectivos, lo cual literalmente justifica el proceso de formulación química teórica y nomenclatura química.
A diferencia de lo que ocurre con la misma ley, pero para un átomo, la forma de desplegada de esta ecuación es diferente dependiendo de la molécula involucrada, de allí que necesitemos expresarla como una suma indefinida.
A pesar de lo anterior existen algunos casos altamente estandarizados en los que se justifica desplegar la ecuación, hoy los casos son:
(a) cálculo de subíndices o cargas en una molécula ionica binaria, sea neutra o con carga.
(b) cálculo de la carga o subíndice del elemento central en una molécula ternaria en la cual conozcamos los subíndices y cargas de los otros 2 elementos.
8.1Cálculo de subíndices en moléculas ionicas binarias neutras.
La ecuación Eq 8.2 es útil para calcular los subíndices empiricos de una molécula binaria neutra conociendo los estados de oxidación de la tabla periódica, hoy esta regla es comúnmente conocida como regla de aspa, aunque puede tener otros nombres vulgares como cruzado, samurai, entre muchos otros. Hoy en ese caso debe tener en cuenta que lo que estamos calculando es el cociente de subíndices, no necesariamente los verdaderos subíndices de la fórmula molecular, y aunque muchas fórmulas moleculares tienen subíndices empíricos iguales a los moleculares, NaCl, existen casos donde la cosa no es así de sencilla.
Un ejemplo de un compuesto iónico con una fórmula molecular superior a su fórmula empírica es el cloruro de aluminio. La fórmula empírica del cloruro de aluminio es AlCl3, lo que sugiere que hay un átomo de aluminio y tres átomos de cloro en cada molécula. Sin embargo, la estructura real del cloruro de aluminio es una red cristalina tridimensional de iones de aluminio y cloro en una proporción de 1:3. Por lo tanto, la fórmula molecular del cloruro de aluminio es Al2Cl6, que indica que hay dos átomos de aluminio y seis átomos de cloro en cada unidad de fórmula. En este caso, la fórmula molecular es el doble de la fórmula empírica, lo que se debe a que cada molécula de cloruro de aluminio contiene dos átomos de aluminio y seis átomos de cloro en lugar de uno y tres, respectivamente.
Es relativamente raro que un compuesto iónico tenga una fórmula molecular mayor que su fórmula empírica. En la mayoría de los casos, la fórmula molecular es igual que la fórmula empírica debido a que los iones presentes en el compuesto se combinan en proporciones enteras. Sin embargo, hay algunos casos en los que esto puede suceder debido a la presencia de iones poliatómicos o a la formación de estructuras cristalinas complejas. En general, estos casos son menos comunes que los compuestos con fórmulas moleculares iguales o menores que sus fórmulas empíricas. En consecuencia la ecuación Eq 8.2 debería funcionar para la mayoría de los casos triviales consignados en libros de texto.
Por el contrario si contamos con un dato más es decir un subíndice real de uno de los elementos, podemos calcular a ciencia cierta el subíndice real del otro elemento, por lo que la ecuación Eq 8.3 es más confiable pero requiere de mayor cantidad de datos.
Ejemplos
Enunciado: Determine los subíndices más probables para una molécula binaria entre Ti(+4) y O(-2).
8.2Cálculo de subíndices en moléculas iónicas binarias no neutras
En este caso debemos emplear la ecuación Eq 8.1 original teniendo en cuenta que la carga total es diferente de cero.
Enunciado: Determine los subíndices más probables para una molécula iónica entre NH4(+) y CO3(-2)
8.3Calculando la carga relativa de un elemento central
Las sales oxoácidas están compuestas por más de dos elementos, pero en esencia siguen siendo como si fueran binarias, ya que un grupo de elementos forman un anión o ente negativo y uno o más elementos formaran un catión o ente positivo, por lo que podemos reciclar la ecuación Eq 8.1.
Para calcular la carga de un elemento cualquiera en una molécula constituida por una cantidad indeterminada de elementos, asumiremos que su carga es neutra y modificamos la ley de la conservación de la carga del siguiente modo.
Ejemplos
Enunciado: Determine el estado de oxidación de S en H2SO3 sabiendo que H es (+1) y O (-2).
Enunciado: Determine el estado de oxidación del carbono en la glucosa C6H12O6.
8.4Cargas relativas aparantemente no enteras
Es importante recalcar que, aunque el número de carga (zJ) muchas veces coincide con los estados de oxidación reportados en la tabla periódica, ese no es necesariamente el caso en todas las situaciones posibles. La razón para esta discrepancia es muy simple, en algunas moléculas algunos átomos de un mismo elemento pueden tener un estado de oxidación diferente que otros átomos del mismo elemento. Sin embargo, estas diferencias no son tomadas en cuenta en la ecuación Eq 8.1 y sus derivados, pues ésta asume que todos los átomos en una molécula tienen el mismo número de carga.
De lo anterior se deduce que si nos encontramos ante una de estas moléculas en las cuales algunos átomos tienen diferentes estados de oxidación, entonces obtendremos números de carga promedio, y en algunas ocasiones estos números de carga promedio van a ser valores fraccionarios o decimales.
En consecuencia, si en algunas ocasiones obtiene números de carga que no son iguales a los estados de oxidación reportados en la tabla periódica, y que para colmo son números fraccionarios o decimales, no desespere, pues se encuentra ante una de estas moléculas en las cuales no todos los átomos de un mismo elemento comparten el mismo estado de oxidación, como por ejemplo H2S4O5, en la que si calculamos el número de carga del azufre obtenemos (+2.5).
9. La carga relativa de la reacción
9. La carga relativa de la reacción
Cuando vi por primera vez los conceptos de carga, los libros de texto generalmente se conforman con establecer la conservación de la carga para una molécula. Sin embargo, las reacciones químicas como un todo están sometidas tanto a la ley de la conservación de la carga, la ley de la conservación de la energía, y la ley de la conservación de la masa, en caso de que sean reacciones químicas no nucleares. En esta sección veremos las consecuencias que tiene la conservación de la carga y la conservación de la masa en reacciones químicas no nucleares.
Adicionalmente, como estamos en un contexto químico, sólo emplearemos la magnitud de carga relativa (z) para describir la conservación de la carga “y para modelar cargas relativas y estados de oxidación según se requiera”, pero el lector deberá tener en cuenta, que la ley también aplica para otras magnitudes de carga, como las cargas de los cuerpos (Q), o las cargas molares (F).
9.1Definición
Lo primero que vamos a hacer es definir el sistema, en este caso entendemos ecuación química como un solo evento de reacción, en tal caso, la ley de la conservación de la carga establece que la carga total de la reacción es igual a la suma de las cargas iniciales y finales en productos y reactivos. Para simplificar la cosa asumiremos que al principio la reacción sólo había reactivos, y al final de la reacción solo productos, por lo tanto, la suma de cargas de todos los reactivos debe ser igual a la suma de carga de todos los productos. Para simplificar la ecuación asumiremos implícitamente que reactivo es un sinónimo de inicio de la reacción o de estado inicial de la reacción, con lo cual no tendremos que adicionar el subíndice cero a los reactivos en la fórmula.
Desplegar la ecuación anterior de manera completa para una reacción química e incluso bastante pequeña sería algo muy complejo, por lo que normalmente lo que se hace es aplicarla elemento por elemento, lo cual permite omitir los subíndices. Hoy de esa manera se puede leer la ley de la siguiente manera, la suma ponderada del número estequiométrico el subíndice y la carga de un elemento en el lado de los reactantes, debe ser igual a la suma ponderada del producto de el número estequiométrico el subíndice y el número de carga del mismo en el elemento en el lado de los productos.
Es una expresión bastante compleja, que al aplicarse a ecuaciones químicas reales generalmente nos da un cero, pues la mayoría de los elementos no cambia su estado de oxidación o número de carga relativo entre reactantes y productos. Sin embargo, existe un tipo especial de reacciones químicas denominadas redox. Esas reacciones químicas físicamente operan como 2 reacciones independientes acopladas, y cuando aplicamos la ley de la conservación de la carga a cada semi reacción por separado obtendremos valores diferentes de cero.
Hoy dado lo anterior lo primero que vamos a hacer es a ahondar en la definición e identificación de las reacciones redox.
9.2Tipos de reacciones químicas por flujo de electrones
En este orden de ideas vale la pena separar las reacciones químicas y las ecuaciones que las representan en dos grandes grupos.
Reacciones no-redox
El primer tipo de ecuaciones, son las ecuaciones no-redox, en las cuales los elementos no cambian de estado de oxidación, lo cual sumado al hecho de que la cantidad de átomos se conserva, implica que la suma neta será cero.
Reacciones redox
El segundo tipo de reacciones químicas presenta un elemento que captura electrones, y un elemento que los cede, tenga en cuenta que todos los demás elementos no presentan cambios en su estado de oxidación, por lo que los podemos ignorar a la hora de evaluar la conservación de la carga. Evaluar las cargas totales es inútil o poco relevante ya que obtendremos sumas cero, pero nuevamente el objetivo no es señalar la evidente suma cero, sino reconocer la cantidad de electrones que fluyen en una reacción redox.
¿Cómo se identifica una reacción redox?
Para identificar una reacción redox se necesita ver dos elementos que presentan cambios en sus números de oxidación, si todos los elementos conservan si mismo estado de oxidación entre reactivos y productos, la reacción es no-redox.
9.3Número de electrones transferidos en una reacción redox.
Para poder aislar el número de electrones es importante poder reconocer la existencia de dos semireacciones:
Oxidación
La primera de estas semirreacciones se denomina oxidación, en la cual un agente reductor o cátodo pierde electrones.
Reducción
La segunda de estas semirreacciones se denomina reducción, en la cual un agente oxidante o ánodo gana electrones.
Número de electrones
Dado que los electrones no se crean o se destruyen, la cantidad de electrones cedidos será igual a la cantidad de electrones capturados.
Interpretación
Las semirreacciones pueden plantearse de dos maneras, como de elemento puro o con reactivos asociados. Por el momento veremos cómo funcionan las semirreacciones de elemento puro. Adicionalmente, cada semirreacción aislada cumple conservación de la carga, pero para hacerlo debe emitir o capturar electrones.
10. Balanceo de ecuaciones químicas por tanteo
10. Balanceo de ecuaciones químicas por tanteo
Ahora que somos conscientes de la existencia de los balances de carga y masa, deberemos aprender las técnicas para lograr dichos balances en caso de que la ecuación química esté mal planteada.
El balanceo por tanteo involucra únicamente el balance de masas, sin ninguna aplicación de fórmulas, aunque en el fondo se basa en evaluar intuitivamente la ecuación:
Donde los subíndices (si) son constantes, pero podemos variar a voluntad los números estequiométricos (v) hasta lograr la igualdad. En este método modificamos los coeficientes hasta igualarlos, aunque normalmente se dice que este es un método sin método “algo intuitivo”, podemos plantear algunas reglas, por ejemplo:
👉 es fácil igualar elementos con subíndices múltiplos, pero
👉 los subíndices no-múltiplos se igualan por mínimo común múltiplo (MCM) convirtiendo el subíndice como coeficiente de la molécula recíproca. Por ejemplo, si tengo 3 átomos de J a la derecha y 2 a la izquierda, el MCM de ambos es 6, por lo que debo ajustar para tener 6 átomos de J a ambos lados.
👉 al balancear, primero iguale los no-múltiplos.
Ejemplos
Enunciado: Como balancear KClO3 ⟶ KCl + O2 por inspección simple
Enunciado: Como balancear C2H6 + O2 ⟶ CO2 + H2O por inspección simple
Enunciado: Como balancear KClO3 ⟶ KCl + O2 por inspección simple
Enunciados, química de Chang décima edición:
(Problema-3.59a-b) Balancear por inspección simple o tanteo C + O2 → CO y CO + O2 → CO2
(Problema-3.59c) Balancear por inspección simple o tanteo H2 + Br2 → HBr
(Problema-3.59d) Balancear por inspección simple o tanteo K + H2O → KOH + H2
(Problema-3.59e) Balancear por inspección simple o tanteo Mg + O2 → MgO
(Problema-3.59f-g) Balancear por inspección simple o tanteo O3 → O2 y H2O2 → H2O + O2
(Problema-3.59h) Balancear por inspección simple o tanteo N2 + H2 → NH3
(Problema-3.59i) Balancear por inspección simple o tanteo Zn + AgCl → ZnCl2 + Ag
(Problema-3.59j) Balancear por inspección simple o tanteo S8 + O2 → SO2
(Problema-3.59k) Balancear por inspección simple o tanteo NaOH + H2SO4 → Na2SO4 + H2O
(Problema-3.59l) Balancear por inspección simple o tanteo Cl2 + NaI → NaCl + I2
(Problema-3.59m) Balancear por inspección simple o tanteo KOH + H3PO4 → K3PO4 + H2O
(Problema-3.59n) Balancear por inspección simple o tanteo CH4 + Br2 → CBr4 + HBr
(Problema-3.60a) Balancear por inspección simple o tanteo N2O5 → N2O4 + O2
(Problema-3.60b) Balancear por inspección simple o tanteo KNO3 → KNO2 + O2
(Problema-3.60c) Balancear por inspección simple o tanteo NH4NO3 → N2O + H2O
(Problema-3.60d) Balancear por inspección simple o tanteo NH4NO2 → N2 + H2O
(Problema-3.60e) Balancear por inspección simple o tanteo NaHCO3 → Na2CO3 + H2O + CO2
(Problema-3.60f) Balancear por inspección simple o tanteo P4O10 + H2O → H3PO4
(Problema-3.60g) Balancear por inspección simple o tanteo HCl + CaCO3 → CaCl2 + H2O + CO2
(Problema-3.60h) Balancear por inspección simple o tanteo Al + H2SO4 → Al2(SO4)3 + H2
(Problema-3.60i) Balancear por inspección simple o tanteo CO2 + KOH → K2CO3 + H2O
(Problema-3.60j) Balancear por inspección simple o tanteo CH4 + O2 → CO2 + H2O
(Problema-3.60k) Balancear por inspección simple o tanteo Be2C + H2O → Be(OH)2 + CH4
(Problema-3.60n) Balancear por inspección simple o tanteo NH3 + CuO → Cu + N2 + H2O
11. Método algebraico o coeficientes indeterminados
11. Método algebraico o coeficientes indeterminados
El método algebraico se basa en usar símbolos algebraicos en lugar de valores numéricos, crear un sistema de ecuaciones lineales, y resolverlos. A veces se resuelven inmediatamente, pero es común tener que asignar un valor de 1 arbitrario para poder resolver el sistema de ecuaciones. Tenga en cuenta que la justificación de este método se fundamenta en la ley de conservación del número de átomos para un solo evento de reacción, el cual depende del subíndice del elemento y del número estequiométrico.
Pero representando los coeficientes estequiométricos de cada una de las moléculas como términos de álgebra indeterminados donde cada (v) se reemplaza por letras del abecedario en orden sistemático, Posteriormente se generará un sistema de ecuaciones que deberá resolverse. Es útil para ecuaciones donde la cantidad de coeficientes sea igual o menor a la cantidad de elementos en la misma. Aunque en los libros de texto aconsejan proponer todas las ecuaciones antes de comenzar la solución de cada variable, esto no es necesariamente cierto.
La forma clásica del redondeo por coeficientes indeterminados es algorítmica, es decir, basada en ejemplos:
Ejemplos libres:
Enunciado: Como balancear H2 + O2 ⟶ H2O por método algebraico
Enunciado: Como balancear KClO3 ⟶ KCl + O2 por el método algebraico o de coeficientes indeterminados
Enunciado: Como balancear KClO3 ⟶ KCl + O2 por el método algebraico analítico
Enunciado: Balancear K2Cr2O7 + FeCl2 + HCl → H2O+KCl + CrCl3 + FeCl3 por el método algebraico analítico.
Enunciado: Balancear MnO2 + HCl → MnCl2 + Cl2 + H2O por el método algebraico clásico.
Enunciado: Balancear N2 + H2 → NH3 por algebraico de coeficientes indeterminados
Enunciado: Balancear FeS2+O2→Fe2O3+SO2 por método algebraico o coeficientes indeterminados
Enunciado: Balancear por coeficientes indeterminados o método algebraico Al+NaOH+H2O→NaAlO2+H2.
Enunciado: Balancear por coeficientes indeterminados o método algebraico Si+NaOH+H2O→Na2SiO3+H2.
Enunciado: Balancear por coeficientes indeterminados o método algebraico PbS+H2O2→PbSO4+H2O.
12. Método de matrices
12. Método de matrices
Antes de iniciar es bueno aclarar que este método no lo propongo para convertirlo en un algoritmo de solución estándar, ni siquiera sé si en términos prácticos pueda llegar a ser viable, sin embargo, en términos algebraicos es funcional, por ende, esta entrada es básicamente un ejercicio académico.
Este método también se basa en el hecho del reconocimiento de patrones, en ese caso el patrón es que todas las ecuaciones que generamos fundamentadas en la ley de la conservación del número de átomos terminan siendo un sistema de ecuaciones lineales, y muchos sistemas de ecuaciones lineales se pueden resolver usando matrices. El problema realmente radica en cómo adaptar la solución de una matriz a un problema químico.
Aunque resolver un sistema de matrices manualmente es viable, aplicado a ecuaciones químicas puede convertir incluso el balanceo más simple en una verdadera tortura, por ende las matrices no sirven para resolver ecuaciones químicas en términos prácticos cuando se aplica manualmente.
Sin embargo, en la actualidad, las hojas de cálculo como Excel son capaces de resolver sistemas matriciales automáticamente, y ese es el método que vamos a trabajar en esta sección.
Para Resolver un sistema matricial,
(a) crear una tabla con filas iguales al número de elementos y columnas iguales al número de compuestos más una columna extra para los términos independientes.
(b) los números estequiométricos correspondientes a los productos van todos negativos.
(c) Se llena la matriz con los subíndices de cada elemento en cada compuesto. Si no hay elemento en el compuesto se llena con cero.
(d) en la última columna de coeficientes la transformamos en la columna de términos independientes que queda externa a la matriz, y sus subíndices van a ir con el signo invertido.
(e) Se genera la matriz inversa con la función de Excel =minversa(celdaddelamatrix) (pero no los términos independientes).
(f) Multiplicamos la matriz inversa por la columna de términos independientes con la función =MMult(matrizinversa;columnaterminosindependientes).
(g) si obtenemos coeficientes decimales, dividimos toda la serie entre el decimal más pequeño.
(h) el coeficiente cuya columna se empleó como la de términos independientes deberá balancearse por la inspección simple al finalizar el reemplazo de los coeficientes generados automáticamente.
Ejemplos
Enunciado: Como balancear H2 + O2 ⟶ H2O por método matricial automático
Enunciado: Como balancear C2H8 + O2 ⟶CO2 + H2O por método matriczial automático
Enunciado: Balancear K2Cr2O7 + FeCl2 + HCl → H2O+KCl + CrCl3 + FeCl3 por el método matricial automático.
Enunciado: Balancear MnO2 + HCl → MnCl2 + Cl2 + H2O por el método matricial automático.
Enunciado: Balancear N2 + H2 → NH3 por matrices en Excel
13. Introducción al balanceo redox e ion electrón
13. Introducción al balanceo redox e ion electrón
Ahora tenemos todos los elementos para obtener una ecuación de balance de carga para un evento de reacción.
Partiremos de la idea de que la suma de cargas de un lado de una ecuación química dependerá de la suma relativa de la carga de cada partícula, y del número de partículas. En una ecuación química, el número de partículas está dado por el número estequiométrico (v):
Número de electrones en una oxidación o reducción en función de UN ELEMENTO en una ecuación química, conociendo el número estequiométrico del compuesto i-ésimo que lo contiene, su estado de oxidación (z) y su subíndice en la molécula i-ésima.
13.1En qué elementos aplica
Con lo que hemos generado una ecuación que nos sirve para evaluar el balance de cargas. Aunque no es muy útil para ecuaciones químicas netas dado que las moléculas son neutras por sí mismas, lo mismo que las reacciones químicas completas, por lo que aplica la fórmula a una ecuación química completa nos va a dar un hermoso cero.
Pero si nos sirve para evaluar semireacciones. A parte de estas notaciones físicas, debemos señalar un sentido químico, las únicas cargas móviles en procesos químicos son los electrones de valencia, y como los electrones son materia, estos no se crean o se destruyen, si un átomo pierde electrones, otro átomo debe ganarlos, y la suma total de electrones perdidos por uno o más átomos en la región catódica, será la misma que la suma de electrones capturada por uno o más átomos en la región anódica. De aquí en más, denominaremos a la pérdida de electrones como oxidación, y la ganancia de electrones como reducción.
La ecuación como tal nos sirve para determinar cuál elemento se está oxidando y cuál se está reduciendo por medio del signo del número de electrones:
(a) negativo para electrones que actúan como reactivos, por lo que el elemento se estará reduciendo.
(b) positivos para electrones que actúan como productos, por lo que el elemento se estará oxidando.
Ejemplos
Enunciado: Calcular el número de electrones que reducen a 4 moléculas de oxígeno a 8 iones óxido 2-.
Cabe destacar que la ecuación anterior puede expresarse para la mayoría de los casos como la diferencia entre producto y reactivo en términos de un solo elemento en un solo producto y reactivo:
Número estequiométrico de electrones en una oxidación (positivo) o reducción (negativo) en función de UN ELEMENTO en una semi-reacción almacenado en un solo producto y en un solo reactivo, en términos del estado de oxidación promedio del elemento en ambas moléculas (z), el número estequiométrico de ambas moléculas (v) y el subíndice del elemento en ambas moléculas (si).
Que es una ecuación más practica y que se ajusta bien a la inmensa mayoría de ejercicios de lápiz y papel, pero tenga en cuenta que puede haber casos en los que exista más de un elemento que se oxida y/o más de un elemento que se reduce.
Cómo estamos enfrentándonos a un problema de balanceo redox podemos tener dos casos muy diferente, y tiene que ver con el balance de todos los átomos en una semi reacción, puedes podemos tener que:
(a) balancear únicamente los átomos que cambiaron de estado de oxidación: Si nuestro objetivo es balancear una ecuación química neta completa, entonces no es obligatorio balancear todos los átomos en las semi reacciones, únicamente necesitaremos balancear los átomos que cambiaron de estado de oxidación, ignorando los acompañantes, esto es verdad para las técnicas de balanceo redox o de ion electrón. Por ejemplo, al balancear la semirreacción O2 → OH(-), si solo nos interesa los átomos que cambiaron de estado de oxidación, el proceso quedaría como O2 + 2e(-)→ 2 OH(-), y el hidrógeno lo balancearíamos una vez se unifica la ecuación completa.
(b) balancear obligatoriamente todos los átomos: si nuestro objetivo es modelar una celda galvánica, o si el enunciado explícitamente nos pide balancear la semi reacción de manera aislada.
13.2Medios de reacción
El problema con balancear completamente una semi reacción radica en el hecho de que depende del medio en el cual se está llevando la reacción completa, y aquí aparecen tres conceptos opuestos que nos acompañarán en la técnica de balanceo de ion electrón, medio básico, medio ácido y ecuaciones indiferentes.
El medio en el que se lleva a cabo una reacción química puede ser ácido, básico o neutro. Estos medios se caracterizan por su pH, que es una medida de la concentración de iones hidrógeno (H+) en una solución. Un pH de 7 se considera neutro, mientras que un pH inferior a 7 indica una solución ácida y un pH superior a 7 indica una solución básica.
Ecuaciones indiferentes
Esta semi reacciones logran un balance perfecto y completo sin la necesidad de agregar iones o de producir o agregar aguas de manera arbitraria. Lo anterior provoca que cuando se unifican las semi reacciones la ecuación química completa va a quedar en balance sin tener en cuenta el medio en el cual se lleva a cabo, en otras palabras, la ecuación se llevará a cabo sin mayores problemas ya sea en medio ácido o en medio básico con el mismo tipo de ecuación química.
Medio ácido
Las condiciones ácidas generalmente implican una solución con un exceso de concentración de H+, lo que hace que la solución sea ácida. El equilibrio comienza separando la reacción en semirreacciones. Sin embargo, en lugar de equilibrar inmediatamente los electrones, equilibre todos los elementos en las semirreacciones que no sean hidrógeno y oxígeno. Luego, agregue moléculas de H2O para equilibrar los átomos de oxígeno. Luego, equilibre los átomos de hidrógeno agregando protones (H+). Posteriormente se puede usar la ecuación 7.4 para calcular la cantidad de electrones y determinar si son electrones reactivos (v negativo) y por lo tanto reductores o si son electrones producidos (v positivo) y por lo tanto electrones de oxidación.
En mi experiencia personal me he encontrado que el balanceo en medio ácido es mucho más sencillo que el balanceo en medio básico, puedes agregar protones H+ y determinar el balance es mucho más sencillo que agregar grupos hidróxido OH− y determinar el balance únicamente, por el hecho de que los iones hidróxido poseen dos átomos de dos elementos diferentes y eso complica la racionalización del proceso.
Por lo anterior, si sufre un atasco al balancear en medio básico lo más conveniente es invertir la ecuación la semi reacción y balancearla por medio ácido y después hacer la conversión básico → ácido.
Medio básico
Las bases se disuelven en iones OH− en solución; por lo tanto, equilibrar las reacciones redox en condiciones básicas requiere OH−. O al menos eso es lo que dice la teoría, pero nos podemos encontrar ante el desdichado hecho de que el balanceo en medio ácido puede derivarse a su vez en 2 situaciones diferentes:
(a) cuando el balanceo por medio básico implica sumar hidróxidos qué es lo teórico y lo que usted esperaría en todos los casos.
(b) cuando balancear por medio básico implica sumar aguas en los reactivos y producir iones hidróxido en los productos.
Esta variabilidad en las situaciones de balanceo en medio básico sumado al hecho de que balancear el grupo hidróxido es más difícil que balancear un protón conlleva a que el balance por medio básico sea más complejo. mi Consejo es siempre intentar balancear primero por medio ácido, y posteriormente realizar la conversión básico → ácido.
Si no se puede balancear por medio ácido implica que debemos balancear sumando grupos hidroxilo en los reactivos, pues de lo contrario obtendremos una indefinición en la cantidad de oxígenos, y esa es la manera en la que la propia ecuación química nos dirá que no se puede balancear en medio ácido.
13.3Conversión ácido básico
Para convertir una ecuación química completa o una semi reacción en medio básico lo que debemos hacer es ubicar los protones del medio ácido y sumar la misma cantidad, pero de iones hidróxido a ambos lados de la ecuación, los iones hidróxido que sumamos en los reactivos se fusionan con los protones reactivos para generar aguas. Normalmente algunas de esas aguas reactivas se van a cancelar con las aguas producto que teníamos originalmente en el balance o por medio ácido.
14. Método redox o del número de oxidación
14. Método redox o del número de oxidación
En el método redox aplicamos las técnicas que dedujimos para el balance de carga. pero antes de ello tenga en cuenta que la técnica redox debe aplicarse para aquellas ecuaciones químicas que no haya podido balancear por el método de coeficientes indeterminados, o en aquellos enunciados que lo obliguen explícitamente a utilizar esta técnica. Para balancear por redox lo primero que debe hacer es
(1) adjudicar coeficientes indeterminados como en el método algebraico.
(2) encontrar los elementos que cambian de estado de oxidación.
(3) posteriormente deberá aislar semi reacciones, para la oxidación y la reducción respectivamente.
(4) luego deberá hacer el balance de masas para el elemento que cambia de estado de oxidación sin involucrar a los elementos acompañantes.
(5) posteriormente deberá aplicar la siguiente ecuación para hallar el número de estequiométrico de los electrones que fluyen en cada semirreacción por separado (Eq 13.1).
Donde (v) es el número estequiométrico o coeficiente estequiométrico de cada compuesto, negativo para los reactivos y positivo para los productos; (si) es el su índice del elemento qué cambio de estado de oxidación; y (z) es el número de oxidación o estado de oxidación del elemento.
(6) si el resultado es negativo los electrones van del lado de los reactivos.
(7) si el resultado es positivo los electrones van del lado de los productos.
(8) en caso de que el número de electrones en ambas semi reacciones sean iguales entonces los coeficientes estequiométricos encontrados se reemplazan en la ecuación química total, y se termina el balanceo por tanteo o por método algebraico.
(9) en caso de que el número de electrones sea diferente, igualamos el número de electrones entre las dos semi reacciones empleando el máximo común múltiplo. El número necesario para encontrar el máximo común múltiplo de los electrones va a multiplicar a toda la semi reacción respectiva.
(10) en caso de que el enunciado nos pida que el medio en el cual se realiza la reacción sea opuesto a que el que se obtiene naturalmente con el balanceo, agregamos el ion opuesto al que se obtuvo naturalmente a ambos lados de la ecuación, por ejemplo sí naturalmente obtuvimos 8 H+ en los reactivos, naturalmente es una ecuación en medio ácido, pero si el enunciado nos pide que esté en medio básico, sumamos 8 OH- a ambos lados de la ecuación.
(11) Balanceamos por inspección simple los faltantes y coeficientes que hubieran quedado incompletos.
Ejemplos
Enunciado: Como balancear H2 + O2 ⟶ H2O por método redox
Enunciado: Como balancear KClO3 ⟶ KCl + O2 por el método redox
Enunciado: Balancear N2 + H2 → NH3 por el método redox
Matamala y Gonzalez:
(Ejemplo-8.12a) Balancear MnO2 + HCl → MnCl2 + Cl2 + H2O por el método del número de oxidación, también llamado de oxidación-reducción o redox.
(Ejemplo-8.12b) Balancear Cu + HNO3 → Cu(NO3)2 + NO + H2O por el método del número de oxidación, también llamado de oxidación-reducción o redox
(Ejercicio-14a) Balancear FeS2+O2→Fe2O3+SO2 por tanteo y redox
(Ejercicio-14b) Balancear NaClO→NaCl+NaClO3
(Ejercicio-14c) Balancear Zn+NaOH→Na2ZnO2+H2 por tanteo y redox
(Ejercicio-14d) Balancear por redox, e identificar quien se oxida y quien se reduce Al+NaOH+H2O→NaAlO2+H2.
(Ejercicio-14f1) Balancear por redox, e identificar quien se oxida y quien se reduce PbS+H2O2→PbSO4+H2O.
(Ejercicio-14h) Balancear e identificar quien se oxida y quien se reduce KMnO4+H2SO4+H2O2→MnSO4+O2+K2SO4+H2O.
química de Chang décima edición:
(Problema-3.60m) Balancear por redox S + HNO3 → H2SO4 + NO2 + H2O
15. Método de ion electrón o de sumando aguas
15. Método de ion electrón o de sumando aguas
En los libros de texto modernos las técnicas de balanceo explicadas son únicamente tanteo y la de ion electrón. Lo anterior se debe posiblemente a que toda ecuación sencilla se puede balancear por tanteo mucho más rápidamente que usar una técnica algebraica, mientras que la mayoría de las ecuaciones complejas se pueden balancear por ion electrón, además de que esta técnica es introductoria al gran capítulo de celdas galvánicas y electroquímica.
Sin embargo, debo admitir que yo me formé con un libro de texto un poco más antiguo (Matamála & Gonzalez, 1976), que si diferenciaba algunas características de la técnica de balanceo de redox y de la técnica de balanceo de Ion electrón, que en el contexto inglés son unificadas bajo el nombre o etiqueta del balanceo de semi reacciones.
La principal diferencia radica en que una ecuación qué se balancee por Ion electrón es una ecuación química incompleta, es decir en la cual no nos dan algunos de los reactivos sino nos ofrecen algunos de los productos, la segunda característica de una ecuación que se debe balancear por Ion electrón es que las especies químicas involucradas son iónicas de allí su nombre en español Ion electrón.
Para balancear por Ion electrón podemos elegir 2 rutas básicas, la forma tradicional y la forma abreviada. en la forma tradicional balanceamos la semi reacciones como introducimos en la subsección “Balance de masa y carga en una semirreacción” que puede encontrar en el siguiente enlace (Enlace→). Posteriormente, igual a la cantidad de electrones que es calcularon para las dos mi reacción es empleando la técnica del común múltiplo:
(1) Si la cantidad de electrones es igual, las semi reacciones se fusionan ignorando la cantidad de electrones.
(2) Si tenemos un múltiplo de otro como 6 en oxidación y 3 en reducción, entonces multiplicamos toda la línea de la semi reacción de reducción por 2 para que obtengamos los 2 electrones, luego fusionamos ambas ecuaciones ignorando los electrones.
(3) Si tenemos un par y un impar diferente de 1 que no sean múltiplos entre si, los multiplicamos, por ejemplo 2 en oxidación y 3 en reducción, entonces multiplicamos toda la oxidación por 3 y toda la reducción por 2, con lo que obtendremos 6 electrones en ambas. Luego fusionamos ambas ecuaciones ignorando los electrones.
Esa técnica es la aconsejada por los libros de texto modernos por la simple razón de que ayuda a modelar el diseño experimental de una celda galvánica donde ambas semi reacciones están físicamente separadas unas de otras. Sin embargo, es problemática si lo único que queremos es balancear la ecuación química completa.
Aun así, dado que es la técnica aconsejada por los libros de texto, encontrará que la mayoría de mis primeros ejemplos se fundamentan bajo ese algoritmo, pero no es la única opción posible.
La segunda forma de balancear por ion electrón es balancear ambas semi reacciones ignorando los átomos que no cambiaron de estado de oxidación. Luego calcular la cantidad de electrones en ambas en reacciones e igualar el flujo de electrones. Posteriormente fusionamos ambas reacciones, y finalmente cuando las dos semi reacciones están fusionadas y conocemos los números estequiométricos de varias especies químicas involucradas, si podemos hacer el balanceo de átomos agregando protones y grupos hidroxilo con las mismas reglas que habíamos aplicado para las semi reacciones.
Esa segunda ruta es más rápida, porque al conocer los números estequiométricos a través de El balance de carga, nos permite identificar la cantidad de oxígeno e hidrógeno más fácilmente y sobre todo más rápido.
Para finalizar volveremos a denunciar las reglas del balance de átomos para los medios posibles en los cuales se realiza el balanceo de ion electrón, después de que hemos unificado la ecuación química.
15.1Ecuaciones indiferentes
Esta reacciones logran un balance perfecto y completo sin la necesidad de agregar iones o de producir o agregar aguas de manera arbitraria. Lo anterior provoca que cuando se unifican las semi reacciones la ecuación química completa va a quedar en balance sin tener en cuenta el medio en el cual se lleva a cabo, en otras palabras, la ecuación se llevará a cabo sin mayores problemas ya sea en medio ácido o en medio básico con el mismo tipo de ecuación química.
15.2Medio ácido
Las condiciones ácidas generalmente implican una solución con un exceso de concentración de H+, lo que hace que la solución sea ácida.
En mi experiencia personal me he encontrado que el balanceo en medio ácido es mucho más sencillo que el balanceo en medio básico, puedes agregar protones H+ y determinar el balance es mucho más sencillo que agregar grupos hidróxido OH− y determinar el balance únicamente, por el hecho de que los iones hidróxido poseen dos átomos de dos elementos diferentes y eso complica la racionalización del proceso.
Por lo anterior, si sufre un atasco al balancear en medio básico lo más conveniente es invertir la ecuación la semi reacción y balancearla por medio ácido y después hacer la conversión básico → ácido.
15.3Medio básico
Las bases se disuelven en iones OH− en solución; por lo tanto, equilibrar las reacciones redox en condiciones básicas requiere OH−. O al menos eso es lo que dice la teoría, pero nos podemos encontrar ante el desdichado hecho de que el balanceo en medio ácido puede derivarse a su vez en 2 situaciones diferentes:
(1) cuando el balanceo por medio básico implica sumar hidróxidos qué es lo teórico y lo que usted esperaría en todos los casos.
(2) cuando balancear por medio básico implica sumar aguas en los reactivos y producir iones hidróxido en los productos.
Esta variabilidad en las situaciones de balanceo en medio básico sumado al hecho de que balancear el grupo hidróxido es más difícil que balancear un protón conlleva a que el balance por medio básico sea más complejo. mi Consejo es siempre intentar balancear primero por medio ácido, y posteriormente realizar la conversión básico → ácido.
Si no se puede balancear por medio ácido implica que debemos balancear sumando grupos hidroxilo en los reactivos, pues de lo contrario obtendremos una indefinición en la cantidad de oxígenos, y esa es la manera en la que la propia ecuación química nos dirá que no se puede balancear en medio ácido.
15.4Conversión ácido básico
Para convertir una ecuación química completa o una semi reacción en medio básico lo que debemos hacer es ubicar los protones del medio ácido y sumar la misma cantidad, pero de iones hidróxido a ambos lados de la ecuación, los iones hidróxido que sumamos en los reactivos se fusionan con los protones reactivos para generar aguas. Normalmente algunas de esas aguas reactivas se van a cancelar con las aguas producto que teníamos originalmente en el balance o por medio ácido.
Ten en cuenta que también es posible hacer la conversión básico → ácido haciendo la suma opuesta, es decir ubicando la cantidad de iones hidróxido, y sumando una cantidad igual de protones a ambos lados de la ecuación, esto producirá aguas de un lado de la ecuación y tendremos que cancelar las cantidades respectivas.
15.5Resumen de la finalización de balanceo por ion electrón
Medio ácido
(1) identificar los elementos que cambiaron de Estado de oxidación.
(2) balancear los átomos que cambiaron de Estado de oxidación.
(3) si la semi reacción contiene oxígenos en cualquier lado, sumaremos aguas en los productos.
(4) asumimos a priori medio ácido y sumamos protones del lado de los reactivos.
(5) balanceamos oxígenos e hidrógenos.
(6) aplicamos la ecuación Eq 14.1 para calcular la cantidad de electrones y determinar su posición, recuerde que v(e-) negativo implica electrones del lado de los reactivos y por lo tanto una reducción, mientras que v(e-) positivo implica electrones que van del lado de los productos y por lo tanto una oxidación.
Medio básico
(1) Procedemos igual que en el medio ácido.
(2) si en efecto logramos balancearla en medio ácido entonces hacemos la conversión ácido → básico
(3) si no pudimos realizar el balanceo con la hipótesis ácida, cambiamos los protones por grupos hidróxido y procedemos a balancear.
(4) si se atasca en el balance, gire la ecuación química y balance de por medio ácido, una vez logre la respuesta, vuelve a girar la ecuación química y realice la conversión ácido → básico.
Por experiencia debo destacar que seguir la segunda ruta en la cual el principio era semi reacciones las balanceamos sin tomar en cuenta el balance de átomos que no cambiaron de Estado de oxidación, conlleva a una menor probabilidad de atascamientos.
Miremos unos cuantos ejemplos.
Matamala y Gonzalez:
Enunciado Balancear Cr2O7(-2) + Fe(+2) → Cr(+3) + Fe(+3) por el método de ion electrón
Enunciado Balancear SO4(-2) + S → 2 SO2 por el método de ion electrón
Enunciado Balancear Cr(+3) + ClO3(-) → CrO4(-2) + Cl(-) por el método de ion electrón
Química de Chang décima edición:
(Practica-19.1) Balancee la siguiente ecuación para la reacción en un medio ácido por el método ion-electrón: Fe(2+) + MnO4(-) → Fe(3+) + Mn(2-)
(Problema-19.1a) Balancee la siguiente ecuación redox por el método de ion-electrón: H2O2 + Fe(2+) → Fe(3+) + H2O (en medio ácido)
(Chang10-problema-19.2a) Balancee la siguiente ecuación redox por el método de ion-electrón: Mn(2+) + H2O2 →MnO2 +H2O en 𝐦𝐞𝐝𝐢𝐨 𝐛á𝐬𝐢𝐜𝐨, y determine que elemento se oxida y que elemento de reduce.
(Chang10-problema-19.2b) Balancee la siguiente ecuación redox por el método de ion-electrón: Bi(OH)3 + SnO2(2-) → SnO3(2-) + Bi en 𝐦𝐞𝐝𝐢𝐨 𝐛á𝐬𝐢𝐜𝐨, y determine que elemento se oxida y que elemento de reduce.
(Chang10-problema-19.2c) Balancee la siguiente ecuación redox por el método de ion-electrón: Cr2O7(2-) + C2O4(2-) → Cr(3+) + CO2 en 𝐦𝐞𝐝𝐢𝐨 ácido, y determine que elemento se oxida y que elemento de reduce.
(Chang10-problema-19.2d) Balancee la siguiente ecuación redox por el método de ion-electrón: ClO3(-) + Cl(-) → Cl2 + ClO2 en 𝐦𝐞𝐝𝐢𝐨 ácido, y determine que elemento se oxida y que elemento de reduce.
Referencias bibliográficas
Referencias bibliográficas
Brady, J. E., & Humiston, G. E. (1986). General Chemistry: Principles and Structure. Wiley & Sons.
Brown, T. L., LeMay, H. E. J., Bursten, B. E., Murphy, C. J., & Woodward, P. (2009). Chemistry the central science (11th ed.). Pearson; Prentice Hall.
Brown, T. L., LeMay, H. E. J., Bursten, B. E., Murphy, C. J., Woodward, P. M., & Stoltzfus, M. W. (2017). Chemistry, the central science (13th ed.). Boston: Pearson.
Brown, T. L., LeMay, H. E. J., Bursten, B. E., Murphy, C. J., Woodward, P., & Stoltzfus, M. W. (2015). Chemistry the Central Science.
Chang, R. (2006). Chang’s “General Chemistry - Essential Concepts” (4th ed.). McGraw-Hill New York.
Chang, R. (2010). Chemistry (10th ed.). McGraw-Hill New York.
Chang, R., & Overby, J. (2011). General Chemistry,Th e Essential Concepts (11th ed.). McGraw-Hill New York.
Ebbing, D. D., & Gammon, S. D. (2008). General chemistry. (Houghton Mifflin Company, Ed.) (9th ed.). Bonston.
Feynman, R. P., Leighton, R. B., & Sands, M. (1965). The feynman lectures on physics; vol. i. American Journal of Physics, 33(9), 750–752.
García-García, J. L. (2020). El álgebra de la estequiometría. Educación Química, 31(1), 138–150. Retrieved from http://www.scielo.org.mx/pdf/eq/v31n1/0187-893X-eq-31-01-138.pdf
Gilbert, T. R., Kirss, R. V, Foster, N., & Davies, G. (2012). Chemistry, the science in context (3rd ed.). W. W. Norton & Company, Inc.
Gorzynski, J. (2010). General, organic, and biological chemistry (1st ed.). McGraw-Hill Education.
Hagengruber, R. (2012). Emilie Du Châtelet between Leibniz and Newton: The Transformation of Metaphysics. In Emilie du Châtelet between Leibniz and Newton (pp. 1–59). Springer.
IUPAC. (2019). Compendium of Chemical Terminology the “Gold Book.” (S. J. Chalk, Ed.) (2nd ed.). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford. Retrieved from http://goldbook.iupac.org/
IUPAC. (2020). Compendium of chemical terminology. (International Union of Pure and Applied Chemistry, Ed.) (Version 3.). Blackwell Science Oxford. Retrieved from https://goldbook.iupac.org/
Jespersen, N. D., Brady, J. E., & Hyslop, A. (2012). Chemistry The Molecular Nature of Matter (6th ed.). USA: Wiley.
Matamála, M., & Gonzalez, P. (1976). Química General. Cultural.
Petrucci, R. H., Harwood, W. S., & Herring, F. G. (2003). Química General (8th ed.). Prentice Hall.
Petrucci, R. H., Herring, F. G., Madura, J. D., & Bissonnette, C. (2010). General Chemistry Principles and Modern Applications (10th ed.). Pearson.
Raymond, K. W. (2014). General, Organic, and Biological Chemistry, an Integrated Aproach (4th ed.). Wiley.
Silberberg, M. S. (2009). Chemistry, The Molecular Nature of Matter and Change (5th ed.). McGraw-Hill Education.
Timberlake, K. C. (2015). Chemistry An Introduction to General, Organic, and Biological Chemistry (15th ed.). USA: Pearson.
Vlaardingerbroek, B. (2012). The Sorites Paradox,“Life,” and Abiogenesis. Evolution: Education and Outreach, 1–3.
Whitten, K. W., Davis, R. E., Peck, M. L., & Stanley, G. G. (2010). Chemistry (9th ed.). Brooks/Cole.
Zumdahl, S. S., & Zumdahl, S. A. (2007). Chemistry (7th ed.). Boston: Houghton Mifflin Company.
Zumdahl, S. S., Zumdahl, S. A., & DeCoste, D. J. (2018). Chemistry (10th ed.). Cengage Learning.
Ejercicios resueltos
Ejercicios resueltos
👉 Demostraciones <Ejercicios analíticos para demostrar las respuestas analíticas o algoritmos de solución> (Pulse aquí)
👉 Ejemplos <Ejercicios Propios de la página> (Pulse aquí)
👉 Libre Chem <Chemistry LibreTexts> (Pulse aquí)
👉 Matamala y González <Libro de texto Ediciones Cultural - 1976> (Pulse aquí)
👉 Química general de Chang <Libro de texto de Raymond Chang> (Pulse aquí)
👉 Química la ciencia central <Libro de texto de Theodore E. Brown> (Pulse aquí)
Demostraciones
Ejemplos
¿Cuál es la carga de un ion o elemento que tiene 6 protones y 7 electrones?
Si un ion tiene carga +3 y 10 electrones ¿Cuál es el número de protones que posee?
Determine los subíndices más probables para una molécula binaria entre Ti(+4) y O(-2).
Determine los subíndices más probables para una molécula iónica entre NH4(+) y CO3(-2)
Determine el estado de oxidación de S en H2SO3 sabiendo que H es (+1) y O (-2).
Determine el estado de oxidación del carbono en la glucosa C6H12O6.
Calcular el número de electrones que reducen a 4 moléculas de oxígeno a 8 iones óxido 2-.
Como balancear KClO3 ⟶ KCl + O2 por inspección simple
Como balancear C2H6 + O2 ⟶ CO2 + H2O por inspección simple
Como balancear H2 + O2 ⟶ H2O por método algebraico
Como balancear H2 + O2 ⟶ H2O por método redox
Como balancear H2 + O2 ⟶ H2O por método analítico
Como balancear KClO3 ⟶ KCl + O2 por el método redox
Como balancear KClO3 ⟶ KCl + O2 por el método algebraico o de coeficientes indeterminados
Como balancear KClO3 ⟶ KCl + O2 por el método algebraico analítico
Como balancear H2 + O2 ⟶ H2O por método matricial automático
Como balancear C2H8 + O2 ⟶CO2 + H2O por método matricial automático
Balancear K2Cr2O7 + FeCl2 + HCl → H2O+KCl + CrCl3 + FeCl3 por el método algebraico analítico.
Balancear K2Cr2O7 + FeCl2 + HCl → H2O+KCl + CrCl3 + FeCl3 por el método matricial automático.
Balancear MnO2 + HCl → MnCl2 + Cl2 + H2O por el método algebraico clásico.
Balancear MnO2 + HCl → MnCl2 + Cl2 + H2O por el método matricial automático.
Balancear N2 + H2 → NH3 por el método redox
Balancear N2 + H2 → NH3 por algebraico de coeficientes indeterminados
Balancear N2 + H2 → NH3 por matrices en Excel
Balancear FeS2+O2→Fe2O3+SO2 por método algebraico o coeficientes indeterminados
Balancear por coeficientes indeterminados o método algebraico Al+NaOH+H2O→NaAlO2+H2.
Balancear por coeficientes indeterminados o método algebraico Si+NaOH+H2O→Na2SiO3+H2.
Balancear por coeficientes indeterminados o método algebraico PbS+H2O2→PbSO4+H2O.
LibreChem
Matamala y Gonzalez
(Ejemplo-8.10) Como balancear KClO3 ⟶ KCl + O2 por inspección simple
(Ejemplo-8.11a1) Balancear KClO3 +HCl → KCl + H2O + Cl2 por el método algebraico o de coeficientes indeterminados.
(Ejemplo-8.12a) Balancear MnO2 + HCl → MnCl2 + Cl2 + H2O por el método del número de oxidación, también llamado de oxidación-reducción o redox.
(Ejemplo-8.12b) Balancear Cu + HNO3 → Cu(NO3)2 + NO + H2O por el método del número de oxidación, también llamado de oxidación-reducción o redox
(Ejemplo-8.13a) Balancear una reacción cuyo oxidante es MnO4(-)→Mn(+2) y reductor es Cl(-) →Cl2 por el método de ion electrónz
(Ejemplo-8.13b) Balancear Cr2O7(-2) + Fe(+2) → Cr(+3) + Fe(+3) por el método de ion electrón
(Ejemplo-8.13c) Balancear SO4(-2) + S → 2 SO2 por el método de ion electrón
(Ejemplo-8.13d) Balancear Cr(+3) + ClO3(-) → CrO4(-2) + Cl(-) por el método de ion electrón
(Ejercicio-14a) Balancear FeS2+O2→Fe2O3+SO2 por tanteo y redox
(Ejercicio-14b) Balancear NaClO→NaCl+NaClO3
(Ejercicio-14c) Balancear Zn+NaOH→Na2ZnO2+H2 por tanteo y redox
(Ejercicio-14d) Balancear por redox, e identificar quien se oxida y quien se reduce Al+NaOH+H2O→NaAlO2+H2.
(Ejercicio-14f1) Balancear por redox, e identificar quien se oxida y quien se reduce PbS+H2O2→PbSO4+H2O.
(Ejercicio-14h) Balancear e identificar quien se oxida y quien se reduce KMnO4+H2SO4+H2O2→MnSO4+O2+K2SO4+H2O.
Química General de Chang
(Problema-3.59a-b) Balancear por inspección simple o tanteo C + O2 → CO y CO + O2 → CO2
(Problema-3.59c) Balancear por inspección simple o tanteo H2 + Br2 → HBr
(Problema-3.59d) Balancear por inspección simple o tanteo K + H2O → KOH + H2
(Problema-3.59e) Balancear por inspección simple o tanteo Mg + O2 → MgO
(Problema-3.59f-g) Balancear por inspección simple o tanteo O3 → O2 y H2O2 → H2O + O2
(Problema-3.59h) Balancear por inspección simple o tanteo N2 + H2 → NH3
(Problema-3.59i) Balancear por inspección simple o tanteo Zn + AgCl → ZnCl2 + Ag
(Problema-3.59j) Balancear por inspección simple o tanteo S8 + O2 → SO2
(Problema-3.59k) Balancear por inspección simple o tanteo NaOH + H2SO4 → Na2SO4 + H2O
(Problema-3.59l) Balancear por inspección simple o tanteo Cl2 + NaI → NaCl + I2
(Problema-3.59m) Balancear por inspección simple o tanteo KOH + H3PO4 → K3PO4 + H2O
(Problema-3.59n) Balancear por inspección simple o tanteo CH4 + Br2 → CBr4 + HBr
(Problema-3.60a) Balancear por inspección simple o tanteo N2O5 → N2O4 + O2
(Problema-3.60b) Balancear por inspección simple o tanteo KNO3 → KNO2 + O2
(Problema-3.60c) Balancear por inspección simple o tanteo NH4NO3 → N2O + H2O
(Problema-3.60d) Balancear por inspección simple o tanteo NH4NO2 → N2 + H2O
(Problema-3.60e) Balancear por inspección simple o tanteo NaHCO3 → Na2CO3 + H2O + CO2
(Problema-3.60f) Balancear por inspección simple o tanteo P4O10 + H2O → H3PO4
(Problema-3.60g) Balancear por inspección simple o tanteo HCl + CaCO3 → CaCl2 + H2O + CO2
(Problema-3.60h) Balancear por inspección simple o tanteo Al + H2SO4 → Al2(SO4)3 + H2
(Problema-3.60i) Balancear por inspección simple o tanteo CO2 + KOH → K2CO3 + H2O
(Problema-3.60j) Balancear por inspección simple o tanteo CH4 + O2 → CO2 + H2O
(Problema-3.60k) Balancear por inspección simple o tanteo Be2C + H2O → Be(OH)2 + CH4
(Problema-3.60l) Balancear Cu + HNO3 → Cu(NO3)2 + NO + H2O por el método del número de oxidación, también llamado de oxidación-reducción o redox
(Problema-3.60m) Balancear por redox S + HNO3 → H2SO4 + NO2 + H2O
(Problema-3.60n) Balancear por inspección simple o tanteo NH3 + CuO → Cu + N2 + H2O
(Practica-19.1) Balancee la siguiente ecuación para la reacción en un medio ácido por el método ion-electrón: Fe(2+) + MnO4(-) → Fe(3+) + Mn(2-)
(Problema-19.1a) Balancee la siguiente ecuación redox por el método de ion-electrón: H2O2 + Fe(2+) → Fe(3+) + H2O (en medio ácido)
(Chang10-problema-19.1c) Balancee la siguiente ecuación redox por el método de ion-electrón: CN(-) + MnO4(2-) → CON(-) + MnO2 en 𝐦𝐞𝐝𝐢𝐨 básico, y determine que elemento se oxida y que elemento de reduce.
(Chang10-problema-19.1d) Balancee la siguiente ecuación redox por el método de ion-electrón: Br2 → BrO3(-) + Br(-) en 𝐦𝐞𝐝𝐢𝐨 básico, y determine que elemento se oxida y que elemento de reduce.
(Chang10-problema-19.1e) Balancee la siguiente ecuación redox por el método de ion-electrón: S2O3(2-) + I2 → I(-) + S4O6(2-) en 𝐦𝐞𝐝𝐢𝐨 ácido, y determine que elemento se oxida y que elemento de reduce.
(Chang10-problema-19.2a) Balancee la siguiente ecuación redox por el método de ion-electrón: Mn(2+) + H2O2 →MnO2 +H2O en 𝐦𝐞𝐝𝐢𝐨 𝐛á𝐬𝐢𝐜𝐨, y determine que elemento se oxida y que elemento de reduce.
(Chang10-problema-19.2b) Balancee la siguiente ecuación redox por el método de ion-electrón: Bi(OH)3 + SnO2(2-) → SnO3(2-) + Bi en 𝐦𝐞𝐝𝐢𝐨 𝐛á𝐬𝐢𝐜𝐨, y determine que elemento se oxida y que elemento de reduce.
(Chang10-problema-19.2c) Balancee la siguiente ecuación redox por el método de ion-electrón: Cr2O7(2-) + C2O4(2-) → Cr(3+) + CO2 en 𝐦𝐞𝐝𝐢𝐨 ácido, y determine que elemento se oxida y que elemento de reduce.
(Chang10-problema-19.2d) Balancee la siguiente ecuación redox por el método de ion-electrón: ClO3(-) + Cl(-) → Cl2 + ClO2 en 𝐦𝐞𝐝𝐢𝐨 ácido, y determine que elemento se oxida y que elemento de reduce.
Química la Ciencia Central
(Muestra-3.2) Balancear la ecuación Na + H2O → NaOH + H2 por inspección simple o tanteo.
(Práctica-3.2.1) Balancear la ecuación CH4 + Br2 → CBr4 + HBr por inspección simple o tanteo.
(Práctica-3.2.2a) Balancear la ecuación Fe + O2 → Fe2O3 por inspección simple o tanteo.
(Práctica-3.2.2b) Balancear la ecuación Al + HCl → AlCl3 + H2 por inspección simple o tanteo.
(Práctica-3.2.2c) Balancear la ecuación CaCO3 + HCl → CaCl2 + CO2 + H2O por inspección simple o tanteo.
(Problema-3.11a) Balancee la siguiente ecuación química CO + O2 → CO2.
(Problema-3.11b) Balancee la siguiente ecuación química N2O5 + H2O → HNO3
(Problema-3.11c) Balancee la siguiente ecuación química CH4 + Cl2 → CCl4 + HCl
(Problema-3.11d) Balancee la siguiente ecuación química Zn(OH)2 + HNO3 → Zn(NO3)2 + H2O
(Problema-3.12a) Balancee la siguiente ecuación química Li + N2 → Li3N
(Problema-3.12b) Balancee la siguiente ecuación química TiCl4 + H2O → TiO2 + HCl
(Problema-3.12c) Balancee la siguiente ecuación química NH4NO3 → N2 +O2 + H2O
(Problema-3.12d) Balancee la siguiente ecuación química AlCl3 + Ca3N2 → AlN + CaCl2
(Problema-3.13a) Balancee la siguiente ecuación química Al4C3 + H2O → Al(OH)3 + CH4
(Problema-3.13b) Balancee la siguiente ecuación química C5H10O2 + O2 → CO2 + H2O
(Problema-3.13c) Balancee la siguiente ecuación química Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
(Problema-3.13d) Balancee la siguiente ecuación química Mg3N2 + H2SO4 → MgSO4 + (NH4)2SO4
(Problema-3.14a) Balancee la siguiente ecuación química Ca3P2 + H2O → Ca(OH)2 + PH3
(Problema-3.14b) Balancee la siguiente ecuación química Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
(Problema-3.14c) Balancee la siguiente ecuación química AgNO3 + Na2CO3 → Ag2CO3 + NaNO3
(Problema-3.14d) Balancee la siguiente ecuación química C2H5NH2 + O2 → CO2 + H2O + N2
(Práctica-20.1.1) ¿Cuál es el agente reductor en la siguiente reacción? 2 Br(-) + H2O2 + 2 H+ → Br2 + 2 H2O
(Práctica-20.1.2) Identificar los agentes oxidantes y reductores en la reacción 2 H2O + Al + MnO4(-) → Al(OH)4(-) + MnO2
(Ecuación-20.6) Balancee la siguiente ecuación química por el método de ion electrón MnO4(-) + C2O4(2-) → Mn(2+) + CO2 en medio ácido
(Muestra-20.2) Balancee la siguiente ecuación química por el método de ion electrón Cr2O7(2-) + Cl(-) → Cr(3+) + Cl2 en medio ácido
(Práctica-20.2.2) Complete y balancee la siguiente ecuación en solución ácida usando el método de semirreacciones. Cu + NO3(-) → Cu(2+) + NO2
(Muestra-20.3) Balancee la siguiente ecuación química por el método de ion electrón CN(-) + MnO4(-) → CNO(-) + MnO2 en medio básico
(Práctica-20.3.2) Complete y balancee la siguiente reacción de oxidación-reducción en solución básica: Cr(OH) + ClO(-) → CrO4(2-) + Cl2
(Problema-20.17a) Identificar los estados de oxidación de los elementos que se oxidan y reducen I2O5 + CO → I2 + 5 CO2
(Problema-20.17b) Identificar los estados de oxidación de los elementos que se oxidan y reducen 2 Hg(2+) + N2H4 → 2 Hg + N2 + 4H(+)
(Problema-20.17c) Identificar los estados de oxidación de los elementos que se oxidan y reducen 3 H2S + 2H(+) + 2 NO3(-) → 3 S + 2 NO + 4 H2O
(Problema-20.18a) Identificar los estados de oxidación de los elementos que se oxidan y reducen 2 MnO4(-) + 3 S(2-) + 4 H2O → 3 S + 2 MnO2 + 8 OH(-)
(Problema-20.18b) Identificar los estados de oxidación de los elementos que se oxidan y reducen 4 H2O2 + Cl2O7 + 2 OH(-) → 2 ClO2(-) + 5 H2O + 4 O2
(Problema-20.18c) Identificar los estados de oxidación de los elementos que se oxidan y reducen Ba(2+) + 2 OH(-) + H2O2 + 2 ClO2 → Ba(ClO2)2 + 2 H2O + O2
(Problema-20.19a) Indique si PBr3 + 3 H2O → H3PO3 + 3 HBr involucra oxidación-reducción. Si es así, identifique los elementos que sufren cambios en el número de oxidación.
(Problema-20.19b) Indique si NaI + 3 HOCl → NaIO3 + 3 HCl involucra oxidación-reducción. Si es así, identifique los elementos que sufren cambios en el número de oxidación.
(Problema-20.19c) Indique si 3 SO2 + 2 HNO3 + 2 H2O → 3 H2SO4 + 2 NO involucra oxidación-reducción. Si es así, identifique los elementos que sufren cambios en el número de oxidación.
(Problema-20.20a) Indique si 2 AgNO3 + CoCl2 → 2 AgCl+ Co(NO3)2 involucra oxidación-reducción. Si es así, identifique los elementos que sufren cambios en el número de oxidación.
(Problema-20.20b) Indique si 2 PbO2 → 2 PbO + O2 involucra oxidación-reducción. Si es así, identifique los elementos que sufren cambios en el número de oxidación.
(Problema-20.20c) Indique si 2 H2SO4 + 2 NaBr → Br2 + SO2 + Na2SO4 + 2 H2O involucra oxidación-reducción. Si es así, identifique los elementos que sufren cambios en el número de oxidación.
(Problema-20.23b) complete y balancee la siguiente semireacción y determine si se trata de una semireacción de oxidación o de una semireacción de oxidación: TiO2 → Ti(2+) en medio ácido.
(Problema-20.23c) complete y balancee la siguiente semireacción y determine si se trata de una semireacción de oxidación o de una semireacción de oxidación: ClO3(-) → Cl(-) en medio ácido.
(Problema-20.23d) complete y balancee la siguiente semireacción y determine si se trata de una semireacción de oxidación o de una semireacción de oxidación: N2 → NH4(+) en medio ácido.
(Problema-20.23e) complete y balancee la siguiente semireacción y determine si se trata de una semireacción de oxidación o de una semireacción de oxidación: OH- → O2 en medio básico.
(Problema-20.24a) complete y balancee la siguiente semireacción y determine si se trata de una semireacción de oxidación o de una semireacción de oxidación: Mo(3+) → Mo en medio ácido.
(Problema-20.24b) complete y balancee la siguiente semireacción y determine si se trata de una semireacción de oxidación o de una semireacción de oxidación: H2SO3 → SO4(2-) en medio ácido.
(Problema-20.24c) complete y balancee la siguiente semireacción y determine si se trata de una semireacción de oxidación o de una semireacción de oxidación: NO3(-) → NO en medio ácido.
(Problema-20.24d) complete y balancee la siguiente semireacción y determine si se trata de una semireacción de oxidación o de una semireacción de oxidación: O2 → H2O en medio ácido.
(Problema-20.24e) complete y balancee la siguiente semireacción y determine si se trata de una semireacción de oxidación o de una semireacción de oxidación: O2 → H2O en medio básico.
(Problema-20.24f) complete y balancee la siguiente semireacción y determine si se trata de una semireacción de oxidación o de una semireacción de oxidación: Mn(2+) → MnO2 en medio básico.
(Problema-20.25a) Complete y balancee la siguiente ecuación en solución ácida usando el método de semirreacciones: Cr2O7(2-) + I (-) → Cr(3+) + IO3(-)
(Problema-20.26b Redox) Complete y balancee la siguiente ecuación en solución ácida usando el método de semirreacciones e identifique que elemento se está oxidando y que elemento se está reduciendo: S + HNO3 → H2SO3 + N2O




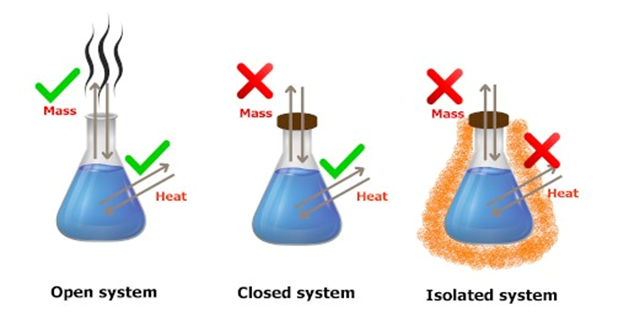





















No hay comentarios:
Publicar un comentario