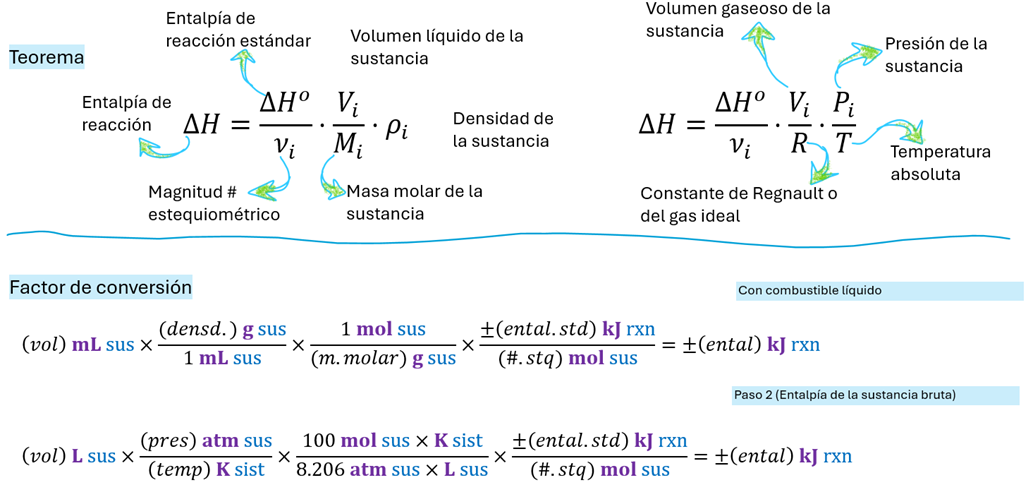
[Demostración] En el lado izquierdo, conceptualizamos la entalpía de una reacción cuando el combustible es un líquido puro, como la gasolina. En este escenario, la energía liberada o absorbida puede relacionarse directamente con las propiedades físicas del líquido. Esto implica que la cantidad de sustancia (y por ende, la energía) puede determinarse a partir de su volumen y densidad iniciales. Para combustibles líquidos, es crucial considerar que su estado físico influye en la entalpía de formación o combustión, especialmente si los productos incluyen agua en fase líquida o gaseosa, lo que impacta el calor neto disponible.
Por otro lado, en el lado derecho, abordamos la entalpía de la reacción cuando el combustible es un gas ideal. Aquí, los parámetros que describen su comportamiento termodinámico son la presión, la temperatura y el volumen. Para un gas ideal, estas variables están interconectadas por la ecuación de estado de los gases ideales, permitiendo calcular la cantidad de sustancia y, consecuentemente, la energía asociada a la reacción. A diferencia de los líquidos, la conversión de unidades y la consideración de la fase gaseosa del agua producida son inherentes a los cálculos para combustibles gaseosos, simplificando algunas consideraciones de fase. Otros teoremas relacionados [Entalpía de reacción para cantidad y masa]

No hay comentarios:
Publicar un comentario