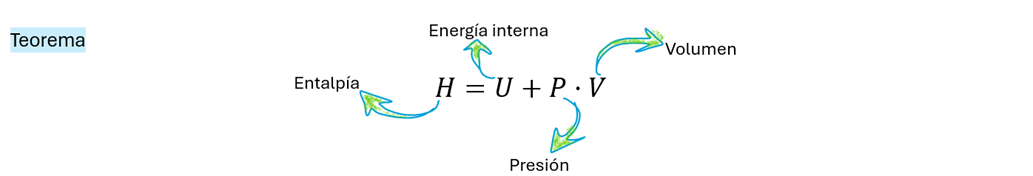
La fórmula H = U + PV define la entalpía de un sistema termodinámico, donde H es la entalpía, U la energía interna, P la presión y V el volumen. Esta expresión fue introducida por el físico holandés Heike Kamerlingh Onnes a finales del siglo XIX como una herramienta conceptual útil para describir sistemas termodinámicos a presión constante, especialmente durante procesos de intercambio de calor. Aunque no es una ley física fundamental, su utilidad radica en su capacidad para simplificar el análisis energético de muchos procesos reales, como los que ocurren en laboratorios y sistemas biológicos, donde la presión del entorno suele mantenerse constante.
La deducción de esta fórmula parte de la primera ley de la termodinámica, que establece que el cambio en la energía interna de un sistema es igual al calor intercambiado más el trabajo realizado: ΔU = Q + W. En muchos sistemas donde el trabajo es puramente de expansión o compresión, este se expresa como W = -PΔV. A presión constante, si combinamos esta relación con la primera ley, se llega a que el calor absorbido o liberado por el sistema equivale a ΔH = ΔU + PΔV. Así, la entalpía surge como una función de estado que facilita el cálculo del calor involucrado en procesos a presión constante, evitando el seguimiento explícito del trabajo mecánico.
En términos clásicos, H = U + PV puede interpretarse como la suma de la energía almacenada dentro del sistema (U), más la energía necesaria para crear espacio para ese sistema dentro de un entorno que ejerce presión (PV). Mientras U considera todas las formas de energía interna —como la cinética y potencial molecular—, el término PV refleja el “costo energético” de ocupar volumen frente a una presión externa. La entalpía, entonces, es una medida escalar del contenido energético total útil bajo condiciones isobáricas.

No hay comentarios:
Publicar un comentario