[Regresar
a más ejercicios de calor específico y capacidad calorífica]
¿Cuánta energía (calor) se necesita para calentar una
cacerola de aluminio (0.20 kg) que contiene 1.0 L de agua desde la temperatura
ambiente (20 °C) hasta la ebullición? Supón equilibrio térmico entre el
recipiente y el agua en todo momento (el calor específico del Al es 0.90 J/g·K
y el del H₂O es 4.18 J/g·K. Supón que la densidad del agua es 1 g/mL)
Etapa analítica
Usaremos el teorema de Calor
en función del calor específico. Considerando un material compuesto,
en lugar de la forma base del teorema, aplicaremos la ley de conservación de
la energía. Esto implica que el calor total es la suma de los
calores parciales. Por lo tanto, podemos expresar el teorema modificado
como la suma de sus componentes elementales. No obstante, es posible
generalizar esta expresión extrayendo la diferencia de temperatura como
factor común, de la siguiente manera:
Etapa numérica por teoremas.
Nota de análisis
dimensional, recordemos que el agua puede convertirse de plumazo L = kg debido
a su densidad normal de 1 kg/L bajo la mayoría de las temperaturas del líquido
de referencia.
Etapa numérica por factor de conversión.
Paso 1. Calor absorbido por el aluminio
Paso 2. Calor absorbido por el agua
Paso 3. El calor del sistema es igual a
la suma de los calores de los componentes despojados de sus identidades
individuales, esta es una interpretación de la ley de la conservación de la masa.
Referencias
Brown, T. L., LeMay, H. E., Bursten, B. E., Murphy, C. J., Woodward, P. M., Stoltzfus, M. W., & Lufaso, M. W. (2022). Chemistry: The central science (15th ed.). Pearson.



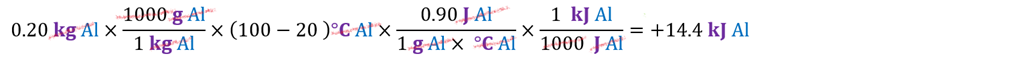


No hay comentarios:
Publicar un comentario