Una propiedad periódica es una característica de
los elementos químicos que varía de manera regular y predecible a lo
largo de la tabla periódica, siguiendo patrones definidos por su posición.
Estas propiedades cambian de forma sistemática cuando se avanza de izquierda a
derecha en un período o de arriba hacia abajo en un grupo. Ejemplos comunes
incluyen el radio atómico, la energía de ionización, la electronegatividad
y la afinidad electrónica. Se llaman “periódicas” porque estas
variaciones se repiten de forma cíclica, reflejando la estructura interna de
los átomos y la manera en que se organizan sus electrones.
Peso atómico y número atómico
El número atómico representa la cantidad de protones
que posee un átomo en su núcleo, y es el criterio que define de forma única a
cada elemento químico. Este número también determina la cantidad de electrones
en un átomo neutro, lo que influye directamente en su comportamiento químico.
Por otro lado, el peso atómico (o masa atómica relativa) es un promedio
ponderado de las masas de todos los isótopos naturales de un elemento,
teniendo en cuenta su abundancia relativa. Aunque en general ambos valores
aumentan progresivamente a lo largo de la tabla periódica, existen excepciones.
Por ejemplo, el cobalto (Z = 27) tiene un peso atómico mayor que el del níquel
(Z = 28), a pesar de tener un número atómico menor. Estas irregularidades
se deben a la composición isotópica y no afectan la organización
fundamental de los elementos, pero son una muestra clara de que masa y número
atómico no siempre crecen al unísono.
En este curso de química general usaremos el símbolo del
parámetro masa molar M para referirnos también a la masa atómica
o masa molecular, entendiendo que se trata de una cuestión de proporciones.
Cuando hablamos de masa molar, nos referimos a la masa de 1 mol
de sustancia, pero si en lugar de usar el mol como unidad abstracta, lo
reemplazamos por su definición —el número de Avogadro 6.022 × 1023—
y resolvemos el cociente, obtenemos directamente el peso atómico o peso
molecular promedio. Esta equivalencia nos permite evitar introducir más
ecuaciones o nuevos símbolos, y así manejar definiciones sinónimas con
mayor elegancia y coherencia formal, sin perder precisión
conceptual. Este enfoque unificado facilita la comprensión y aplicación de los
conceptos fundamentales en los cálculos químicos, manteniendo una notación
consistente a lo largo del curso.
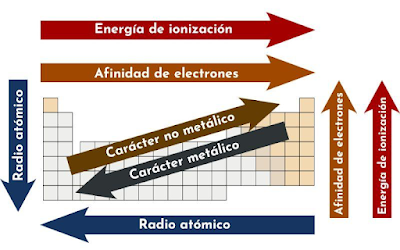
Radio atómico
El radio atómico es la distancia media entre
el núcleo de un átomo y la capa más externa de electrones. Este valor tiende a aumentar
a medida que nos movemos hacia abajo en un grupo de la tabla periódica, ya que
se agregan más capas de electrones, pero tiende a disminuir al avanzar
de izquierda a derecha en un período, debido a que los electrones se atraen más
fuertemente por un mayor número de protones en el núcleo. El volumen atómico
se refiere al espacio total que ocupa un átomo en una sustancia, y está
relacionado con el radio atómico; cuanto mayor es el radio, mayor es el volumen
atómico, ya que el átomo ocupa más espacio.
Energía de ionización, afinidad electrónica y carácter metálico
La energía de ionización es la cantidad de energía
necesaria para remover un electrón de un átomo o ion en su estado
gaseoso. Generalmente, esta energía aumenta de izquierda a derecha en un
período, debido a que los átomos tienen más protones y atraen con mayor fuerza
a los electrones, y disminuye al descender en un grupo, ya que los
electrones externos están más alejados del núcleo y son más fáciles de
eliminar. La afinidad electrónica es la energía liberada cuando
un átomo captura un electrón, formando un ion negativo. Esta propiedad tiende a
ser más negativa (libera más energía) al avanzar de izquierda a derecha
en un período, ya que los átomos tienen una mayor tendencia a ganar electrones.
Por otro lado, el carácter metálico se refiere a las propiedades típicas
de los metales, como la conductividad eléctrica, maleabilidad
y brillo metálico. El carácter metálico disminuye al moverse de
izquierda a derecha en un período (los elementos se vuelven más no metálicos) y
aumenta al bajar en un grupo, ya que los metales tienen más facilidad
para perder electrones.
Electronegatividad
La electronegatividad es la medida de la capacidad de
un átomo para atraer electrones hacia sí mismo cuando forma un enlace
químico. Se simboliza con la letra griega χ (chi). Esta propiedad
aumenta de izquierda a derecha en un período y disminuye de arriba
hacia abajo en un grupo de la tabla periódica. En términos
prácticos, la electronegatividad es una de las propiedades periódicas más
útiles para anticipar la conducta molecular de las sustancias. Exhibe un
patrón creciente de izquierda a derecha y de abajo hacia arriba,
excluyendo a los gases nobles. El flúor ocupa el extremo superior
de esta escala, siendo el elemento más electronegativo, lo que significa
que tiene la mayor propensión a capturar electrones, a pesar de su baja
abundancia. Curiosamente, su nombre no se utiliza en el contexto del proceso de
captura de electrones.
El oxígeno sigue al flúor como el siguiente elemento
más electronegativo y, a diferencia del flúor, es abundante. De hecho,
el término "reducción" se acuñó debido a su capacidad
significativa para ganar electrones, reduciendo el número de electrones
de otros átomos. En contraste, el proceso opuesto, la pérdida de electrones,
se denomina oxidación, ya que el oxígeno, debido a su capacidad para
capturar electrones, induce la pérdida de electrones en la mayoría de
los metales y no metales. A pesar de su potente capacidad como agente oxidante,
el oxígeno no es el más fuerte; el flúor posee una electronegatividad
aún más intensa. Así, en la formación de fluoruro de oxígeno, cuando el
oxígeno se enfrenta al flúor, es el oxígeno quien experimenta la oxidación,
perdiendo electrones frente al flúor.
Número de oxidación o estado de oxidación
La propiedad periódica conocida como número de oxidación
o estado de oxidación indica la carga eléctrica relativa posible
o probable de un elemento →z, expresada como el cociente entre
la carga eléctrica de una mol de sustancia y la constante de Faraday.
Este concepto es aplicable tanto a una mol completa, que contiene
aproximadamente 602 214 mil trillones de partículas (el número de Avogadro),
como a una sola partícula. En un contexto atómico, el estado de oxidación
representa el número de cargas que un átomo único ha cedido o adquirido
al interactuar con átomos de electronegatividades diferentes.
Los números de oxidación →z suelen estar
codificados en las tablas periódicas para resumir la información. Por ejemplo,
el estado de carga relativa basal cero existe en todos los elementos,
aunque no se menciona explícitamente, ya que se asume que el lector está al
tanto de esta condición. Los símbolos ± afectan solo al elemento
inmediatamente a la derecha. Por ejemplo, si se muestra ±3,5, esto
indica que el elemento puede asumir cargas de -3, 0, +3, +5. La ganancia
de electrones se interpreta como un aumento en los valores negativos,
mientras que la pérdida de electrones se asocia con un aumento en los
valores positivos. Es importante destacar que los protones no participan en
reacciones químicas tradicionales, reservándose para reacciones nucleares con
reglas más complejas. Nos concentramos en los movimientos electrónicos en este
contexto.
Simbolizaremos cualquier tipo de carga relativa con la letra
latina zeta minúscula →z utilizando la notación →, aunque no se trate
de un vector en sentido físico estricto. Usaremos esta convención porque el
número de carga tiene dirección, ya sea positiva o negativa,
lo cual justifica su representación con una flecha como notación simbólica.
Referencias
Brown, T. L., LeMay, H. E. J., Bursten, B. E., Murphy, C. J., Woodward,
P., & Stoltzfus, M. W. (2015). Chemistry the Central Science.
Brown, T. L., LeMay, H. E. J., Bursten, B. E., Murphy,
C. J., Woodward, P., Stoltzfus, M. W., & Lufaso, M. W. (2022). Chemistry,
the central science (15th ed.). Pearson.
Chang, R. (2010). Chemistry (10th ed.).
McGraw-Hill New York.
Chang, R., & Overby, J. (2021). Chemistry
(14th ed.). McGraw-Hill.
Seager, S. L., Slabaugh, M. M., & Hansen, M. M.
(2022). Chemistry for Today (10th ed.). Cengage Learning.
Zumdahl, S. S., Zumdahl, S. A., DeCoste, D. J., & Adams, G. (2018). Chemistry (10th ed.). Cengage Learning.

No hay comentarios:
Publicar un comentario