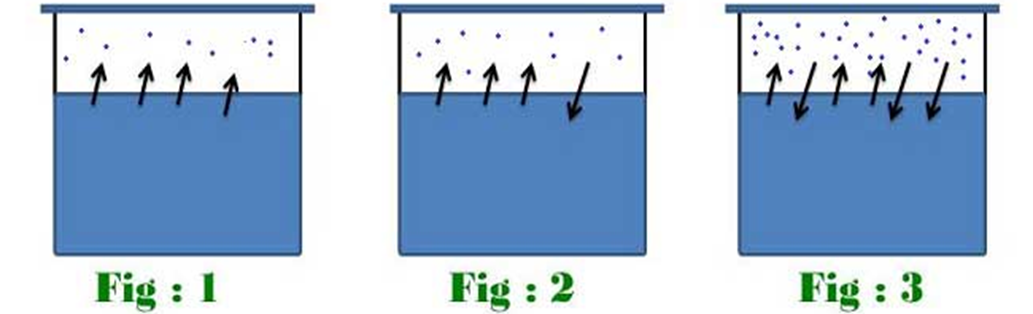
En la imagen 1 se observa un líquido volátil recién cerrado dentro de un recipiente. En esta etapa inicial, la mayor parte de la sustancia se encuentra en estado líquido y la cantidad de vapor en el espacio superior es mínima o casi inexistente. Sin embargo, debido a las propiedades volátiles del líquido, algunas moléculas adquieren suficiente energía cinética para escapar de la superficie y pasar a la fase gaseosa. Este proceso de evaporación es el inicio del cambio de estado y empieza a generar vapor en la atmósfera interna del recipiente.
En la imagen 2, el vapor comienza a acumularse en la parte superior del recipiente, aumentando la presión de vapor dentro del sistema cerrado. A medida que más moléculas del líquido se evaporan, la concentración de vapor se incrementa y la presión interna del gas también. Este aumento de presión genera que algunas moléculas de vapor vuelvan a condensarse, es decir, pasen de la fase gaseosa de nuevo a la fase líquida. Este fenómeno ocurre de manera simultánea, creando un equilibrio dinámico donde la tasa de evaporación es igual a la tasa de condensación, aunque las moléculas sigan cambiando de fase constantemente.
Finalmente, en la imagen 3 se representa el momento en que se alcanza el equilibrio dinámico. En este punto, el espacio superior contiene la máxima cantidad de vapor posible a esa temperatura específica. La presión de vapor del sistema se mantiene constante, y aunque las moléculas continúan evaporándose y condensándose, la cantidad total de líquido y vapor permanece estable. Es importante resaltar que esta estabilidad es dependiente de la temperatura: a mayor temperatura, las moléculas tienen más energía, lo que incrementa la presión de vapor y la cantidad de vapor en equilibrio, favoreciendo una mayor volatilidad del líquido.

No hay comentarios:
Publicar un comentario